INDUKSI EMBRIO SOMATIK DARI KALUS EMBRIOGENIK DAN PERKECAMBAHAN PLANLET JERUK SOE
FITRIA NANDA UTAMI
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul ”Induksi Embrio Somatik dari Kalus Embriogenik dan Perkecambahan Planlet Jeruk SoE” adalah benar karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
ABSTRAK
FITRIA NANDA UTAMI. Induksi Embrio Somatik dari Kalus Embriogenik dan Perkecambahan Planlet Jeruk Varietas SoE. Dibimbing oleh AGUS PURWITO.
Embrio somatik dapat diregenerasikan dari kalus embriogenik. Setelah melalui tahap perkembangan dari globular, jantung, torpedo dan kotiledon, planlet harus cukup besar untuk dapat menyesuaikan diri ketika aklimatisasi. Penelitian ini bertujuan untuk mempelajari pengaruh konsentrasi zat pengatur tumbuh ABA dalam induksi embrio somatik dari kalus embriogenik jeruk SoE, mempelajari pengaruh GA3 dalam perkembangan planlet dari embrio somatik, serta pengaruh konsentrasi media MW dalam perkecambahan planlet. Penelitian ini dilakukan di Laboratorium Kultur Jaringan, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor dari bulan November 2014 sampai Mei 2015. Penelitian tersusun atas tiga percobaan yaitu 1) Induksi embriosomatik dari kalus embriogenik. 2) Perkecambahan embrio somatic dan 3) Pertumbuhan planlet. Induksi embrio somatik menggunakan kalus embriogenik yang ditanam di media MS ditambah dengan ABA (0, 0.5, 1.5, 2.5, 3.5) mg L-1. Regenerasi planlet menggunakan embrio somatik fase kotiledon yang ditanam pada media MS dengan penambahan GA3 (0, 0.5, 1.5, 2.5, 3.5) mg L-1 dan perkecambahan planlet menggunakan konsentrasi media MS (0.25, 0.5 dan 1.0 kali konsentrasi medium). Hasil penelitian menunjukkan bahwa perlakuan kontrol adalah yang terbaik dalam induksi embrio somatik. Pada percobaan kedua media terbaik adalah media MW yang ditambahkan 2.5 GA3 mgL-1 dan pada percobaan ketiga untuk Media pertumbuhan terbaik adalah menggunakan 0.5 kali konsentrasi.
iii
ABSTRACT
FITRIA NANDA UTAMI. Somatic Embryo Induction from Embryogenic Callus and Plantlets germination of Citrus CV SoE. Under immediate supervision of
AGUS PURWITO.
Somatic embryos can be regenerated from embriogenic callus. After the folowing stage of grobular, heart, torpedo and cotyledonary stage, the planlet should be large enough to be acclimatized. This research aims was to study the effect of ABA concentration in the induction of somatic embryos from embryogenic callus, studied the effect of GA3 in the development of plantlets from somatic embryos, and the effect of media concentration in an germination of plantlets. This research was conducted in Tissue Culture Laboratory, Department of Agronomy and Horticulture, Faculty of Agriculture, Bogor Agricultural University of months November 2014 to May 2015. The study was composed of three trials namely: 1) Induction of somatic embryos from embryogenic callus. 2) Regeneration of plantlets and 3) Germination embrio somatic plantlets. Induction of embryo somatic was using embriogenic callus as planted in the media MS supplemented with ABA (0. 0.5, 1.5, 2.5, 3.5) mg L-1. Induction of embrio somatic to produce plantlet used embriosomatic cotyledonary stage plantled to the media MS suplemented with GA3 (0, 0.5, 1.5, 2.5, 3.5) mg L-1, and maturation of plantlet done by using the different concentration of MS media (0.25, 0.5 dan 1.0 concentration). The results showed that the control is the best results in the induction of somatic embryos. In the second experiment for induction embriosomatic, best medium was medium MW added with 2.5 GA3 mg L-1 and in a third experiment, best germination media was media MW with (0.5 x concentration).
iv
©
Hak Cipta milik IPB, tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
v
INDUKSI EMBRIO SOMATIK DARI KALUS EMBRIOGENIK DAN PERKECAMBAHAN PLANLET JERUK SOE
FITRIA NANDA UTAMI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Agronomi dan Hortikultura
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
vii
PRAKATA
Puji syukur senantiasa penulis haturkan atas kehadirat Allah SWT yang telah memberikan hidayah dan kekuataan-Nya, sehingga penelitian ini dapat diselesaikan dengan baik. Adapun judul penelitian adalah Induksi Embrio Somatik dari Kalus Embriogenik dan Perkecambahan Planlet Jeruk SoE yang dilaksanakan sejak bulan November 2014 sampai Mei 2015.
Ucapan terima kasih dan penghargaan setinggi-tingginya penulis sampaikan kepada yang terhormat Dr Ir Agus Purwito, MSc. Agr selaku dosen pembimbing, atas curahan waktu, arahan dan saran dalam pelaksanaan penelitian, menyusun dan menulis Skripsi ini. Penulis juga menyampaikan terima kasih kepada kedua orang tua, Bapak M. Darsih S.Sos dan Ibu Hj. Siti Asnah S.Sos serta kakak-kakak tersayang, keluarga besar, sahabat dan teman-teman yang senantiasa memberikan doa, semangat dan dukungan kepada penulis selama ini. Semoga Skripsi ini bermanfaat.
Bogor, Januari 2016
viii
Teknik Kultur Jaringan ... 4
Media Kultur Jaringan Jeruk ... 4
Embriogenesis Somatik Tanaman Jeruk ... 5
BAHAN DAN METODE ... 6
Tempat dan Waktu ... 6
Bahan dan Alat ... 6
Metode Percobaan ... 6
1) Pengaruh ABA dalam induksi kalus embriogenik menjadi embrio somatik ... 7
2) Pengaruh GA3 dalam induksi perkecambahan menjadi planlet. ... 7
3) Pengaruh konsentrasi media MS dalam pertumbuhan planlet. ... 7
Metode Statistik ... 8
HASIL DAN PEMBAHASAN ... 9
Keadaan Umum ... 9
Pengaruh ABA dalam induksi kalus embriogenik menjadi embriosomatik ... 10
KESIMPULAN DAN SARAN ... 17 kotiledon sampai minggu ke-8 pada kalus tanaman jeruk SoE 11 3 Rata-rata jumlah planlet jeruk SoE yang membentuk jumlah kotiledon,
jumlah daun dan jumlah akar, sampai minggu ke-8 14
4 Rata-rata tinggi planlet (cm), jumlah planlet normal dan jumlah planlet
abnormal sampai minggu ke-pada planlet jeruk SoE 16
5 Rata-rata jumlah planlet pada media perkecambahan yang membentuk jumlah daun, tinggi tanaman (cm) dan jumlah akar sampai minggu ke-8
ix
DAFTAR GAMBAR
1 Tanaman jeruk keprok SoE Nusa Tenggara Timur 1
2 Perbanyakan kalus jeruk SoE dengan media MW + ABA di ruang
kultur Laboratorium Kultur Jaringan 9
3 Pengaruh ABA terhadap diameter kalus embriogenik jeruk SoE dari
minggu ke-4 sampai ke-8. 12
4 Eksplan jeruk SoE pada minggu ke-8 13
5 Embriogenesis somatik dari kalus embriogenik jeruk SoE pada minggu
ke-6 pada perlakuan media MW+ABA 0.5 mg L-1 13
6 Perkecaambahan embrio somatik fase kotiledon 15
7 Pertumbuhan planlet jeruk SoE pada berbagai media 2 MST 17
DAFTAR LAMPIRAN
1
PENDAHULUAN Latar Belakang
Indonesia memiliki banyak varietas jeruk komersial yang sudah dikenal konsumen dalam negeri diantaranya jeruk Siam Pontianak, Keprok SoE, dan Batu 55. Pertanaman di Indonesia didominasi 85% oleh jeruk Siam karena produktivitasnya yang tinggi (Ashari dan Supriyanto 2013).
Saat ini sentra produksi jeruk keprok atau siam terletak di Jawa Timur dan salah satu daerah penghasil terbesarnya adalah di Banyuwangi. Bulan Mei 2013 luas panen jeruk di Banyuwangi mencapai 3,695.34 hektar, produksi jeruk mencapai 65,145.16 ton, dengan rata-rata produktivitas 172,93 kwintal hektar-1. Pencapaian produktivitas jeruk di Banyuwangi cukup menjanjikan bagi para petani (Pemda Banyuwangi 2013).
Jeruk cocok dibudidayakan di berbagai wilayah di Indonesia karena kondisi alamnya yang sesuai dengan lingkungan tumbuhnya. Jeruk keprok SoE ditanam di daerah sentra produksi yang bertempat di Desa Bosen dan Desa Tiobu, Kecamatan Mollo Utara, Kabupaten Timur Tengah Selatan-Nusa Tenggara Timur. Jeruk keprok SoE ditanam pada ketinggian 800-1200 m dpl dengan tanah yang bertekstur kapur/Mediterania. Buah berbentuk bulat pendek dan kulit licin dengan warna kuning kemerah-merahan bila sudah matang. Daging buah berwarna orange dengan rasa manis segar, aroma lembut dan berserat. Produksi buah antara 50-250 kg per pohon per musim dan setiap buah memiliki rata-rata antara 100-125 gram (Astuti 2014).
Gambar 1. Tanaman jeruk keprok SoE Nusa Tenggara Timur (Sumber: Bebeja 2013)
2
Kultur jaringan berguna untuk mempercepat perbanyakan tanaman secara aseksual, menghasilkan tanaman bebas penyakit, juga dapat digunakan untuk tujuan perbaikan tanaman (Zulkarnain 2009). Perbanyakan tanaman dengan kultur jaringan memungkinkan menghasilkan benih dalam jumlah besar yang sifat genetiknya identik, keseragaman yang tinggi, diperbanyak dalam waktu yang relatif cepat, dan dapat diproduksi sepanjang tahun (Santoso dan Nursandi 2003).
Pemuliaan non konvensional pada dasarnya bertumpu pada kemampuan sel dan jaringan tanaman yang dapat tumbuh dan berkembang menjadi tanaman lengkap, baik melalui regenerasi langsung dari eksplan, maupun regenerasi tidak langsung melalui kalus. Kalus yang diinduksi dari sel dan jaringan tanaman dapat langsung beregenerasi menjadi tanaman atau dapat berkembang menjadi kalus embriogenik yang selanjutnya dapat diinduksi menjadi embrio yang disebut sebagai embrio somatik. Kalus embriogenik sangat tepat dijadikan sumber eksplan untuk berbagai metode pemuliaan non-konvensional seperti transfer gen, fusi protoplas, dan mutagenesis invitro. Embrio somatik yang dihasilkan dari kalus embriogenik merupakan embrio vegetatif dan berasal dari individual sel. Kelebihan dari penggunaan jalur embrio somatik dalam pemuliaan non konvensional antara lain dapat menghindari terbentuknya khimera dan regeneran yang dihasilkan sangat banyak, sehingga memudahkan seleksi (Kihhundu et al. 2012). Menurut Kosmiatin (2013) jaringan yang dapat ditumbuhkan menjadi kalus embriogenik dan embrio somatik umumnya adalah jaringan yang bersifat meristimatik.
Pembentukan planlet melalui embriogenesis somatik mempunyai banyak keuntungan antara lain (1) waktu perbanyakan dapat lebih cepat, (2) pencapaian hasil dalam mendukung program pemuliaan juga lebih cepat, dan (3) jumlah tanaman yang dihasilkan lebih banyak (Lestari 2008). Pertumbuhan dan perkembangan embrio yang terbentuk dari embriosomatik akan berlangsung secara bertahap melalui proses yang mirip dengan proses embriogenesis zigotik. Proses perkembangan kalus embriogenik menjadi embrio somatik diawali dari terbentuknya struktur bulat (globular), jantung (heart), torpedo, kotiledon dan akhirnya akan berkecambah menjadi planlet (Yuliarti 2010).
Induksi kalus embriogenik menjadi embrio somatik umumnya sangat dipengaruhi oleh komposisi media tumbuh yang digunakan. Media tumbuh tersebut umumnya mempengaruhi efektivitas dan efisiensi pembentukan embrio somatik dari kalus embriogenik dan efisiensi pembentukan embrio somatik yang normal. Kosmiatin (2013) menyatakan bahwa zat pengatur tumbuh ABA sangat baik ditambahkan dalam media untuk meningkatkan efisiensi pembentukan embrio somatik dari kalus embriogenik. Asam absisik (ABA) juga berpengaruh dalam mengontrol perkecambahan, sedangkan Asam giberelin (GA3) sering ditambahkan untuk meningkatkan jumlah embrio somatik fase kotiledon. Embrio somatik yang dihasilkan harus dapat tumbuh menjadi planlet dan planlet yang dihasilkan harus dapat dibesarkan agar dapat diaklimatisasi menjadi tanaman di lapang. Menurut Basu et al. (2010) planlet harus mempunyai perakaran yang baik dan kuat sehingga dapat mencapai persentase tumbuh yang tinggi saat diaklimatisasi.
3
keprok SoE yang kemungkinan juga ada perbedaan respon terhadap zat pengatur tumbuh yang ditambahkan pada media.
Tujuan
Tujuan penelitian ini mempelajari pengaruh konsentrasi zat pengatur tumbuh ABA dalam induksi embrio somatik dari kalus embriogenik, mempelajari pengaruh GA3 dalam perkecambahan embrio somatik menjadi planlet, serta pengaruh konsentrasi media MW dalam pertumbuhan planlet.
Hipotesis
1. Terdapat konsentrasi ABA yang tepat untuk menginduksi embriosomatik dari kalus embriogenik
2. Terdapat konsentrasi GA3 yang tepat untuk perkecambahan embrio somatik menjadi planlet.
3. Terdapat konsentrasi media MW yang dapat pertumbuhan planlet agar dapat diaklimatisasi.
TINJAUAN PUSTAKA Tanaman Jeruk
Tanaman jeruk (Citrus sp.) adalah tanaman buah tahunan yang berasal dari Asia. Cina dipercaya sebagai tempat pertama kali jeruk tumbuh. Sejak ratusan tahun yang lalu, jeruk sudah tumbuh di Indonesia baik secara alami atau dibudidayakan. Tanaman jeruk yang ada di Indonesia adalah peninggalan orang Belanda yang mendatangkan jeruk dari Amerika dan Italia (Ridjal 2008). Suhu optimal untuk jeruk adalah 25-30°C, namun ada yang masih dapat tumbuh normal pada suhu 38°C. Semua jenis jeruk tidak menyukai tempat terlindung dari sinar matahari, sedangkan kelembaban optimum untuk pertumbuhan tanaman ini sekitar 70-80% (Husni et al. 2010).
Bibit jeruk biasanya berasal dari perbanyakan vegetatif berupa penyambungan antara batang bawah dan batang atas. Bibit yang baik adalah yang bebas penyakit, berdiameter batang 2-3 cm, permukaan batang halus, akar sekunder banyak, akar tunggang berukuran sedang dan memiliki sertifikasi penangkaran bibit (Prihatman 2000). Penyediaan bibit batang bawah jeruk hingga saat ini masih dilakukan melalui perbanyakan biji. Metode yang digunakan masih memiliki kelemahan yaitu adanya keragaman bibit karena sifatnya poliembrioni, sehingga kekhawatiran batang bawah tidak true to type selalu ada (Friyanti dan Yulianti 2010).
Jeruk Keprok SoE
4
meter, usia berbuah 2-3 tahun. Jeruk SoE dapat bertahan hidup dan berbuah selama kemarau panjang dengan suhu 28-31°C (Alawi 2015).
Jeruk keprok SoE pada mulanya ditanam di Desa Tobu, Kecamatan Mollo Utara, kabupaten Timor Tengah Selatan, yang dikenal oleh masyarakat setempat “lemon cina”. Ciri khusus buah jeruk keprok SoE adalah: buah bulat, pendek dengan diameter rata-rata 5-7 cm, ukuran buah hampir seragam, kulit agak tebal, berongga, bewarna oranye dan mudah dikupas. Warna daging buah kemerahan, beraroma lembut, kulit tampak mengkilat ketika masak, licin dan agak bergelombang. Pangkal buah agak menonjol ke atas dan berat buah jeruk SoE berkisar 100-125 g. Tanaman jeruk keprok SoE tumbuh baik pada ketinggian 500-1 200 mdpl (Martosupo et al. 2007).
Jeruk keprok SoE karena memiliki warna yang lebih menarik dan harga yang lebih tinggi dibandingkan jeruk lain termasuk jeruk impor. Jeruk keprok SoE dalam nama latin di kenal dengan Citrus reticulata adalah salah satu jeruk unggul Indonesia yang ditetapkan sebagai varietas unggul nasional melalui SK Menteri Pertanian No.863/Kpts/TP.240/11/98 (Marques dan Sumarji 2014).
Teknik Kultur Jaringan
Kultur jaringan berlandaskan pada teori totipotensi sel (total genetic potential) bahwa sel tanaman mengandung material genetik lengkap, sehingga apabila ditumbuhkan pada lingkungan tumbuh yang sesuai, sel tersebut dapat tumbuh dan berdiferensiasi menjadi tanaman lengkap. Sel atau jaringan tanaman tersebut dapat berorganogenesis menjadi tunas dan akar, atau dapat tumbuh menjadi kumpulan sel meristematik yang belum terdiferensiasi yang disebut kalus. Kalus tersebut dapat diarahkan untuk tumbuh dan beregenerasi menjadi tunas dan akar tanaman atau menjadi embrio somatik tergantung dari komposisi media dan lingkungan tumbuhnya (Lestari 2008).
Kultur jaringan berguna untuk mempercepat perbanyakan tanaman secara aseksual, menghasilkan tanaman bebas penyakit, juga dapat digunakan untuk memperbaiki tanaman secara genetik. Setiap bagian tanaman dapat dijadikan eksplan, namun pada umumnya, bagian tanaman yang bersifat meristimatik dapat ditumbuhkan dengan lebih mudah, seperti biji atau kotiledon, tunas pucuk, potongan batang muda, potongan akar, potongan daun, potongan umbi batang, umbi lapis dengan sebagian batang dan bagian bunga (Zulkarnain 2009).
Media Kultur Jaringan Jeruk
Keberhasilan teknik kultur jaringan sebagai sarana perbanyakan tanaman sangat ditentukan oleh medium yang digunakan. Nutrisi sangat penting untuk mendorong pertumbuhan dan perkembangan tanaman baik secara in vitro maupun in vivo. Komposisi media terdiri dari makro, mikro, vitamin dan gula. Hara makro terdiri dari N, P, K, Ca, Mg dan S, sedangkan hara mikro meliputi Fe, Cu, Mn, B, Mo dan Co. Komposisi media kultur telah banyak diformulasikan, dimana selain hara makro dan mikro juga meliputi, sumber karbon, vitamin dan bahan organik serta bahan pemadat media (Lestari 2008).
5
semi padat dan cair. Pertumbuhan eksplan sangat dipengaruhi oleh media tanam (Hendaryono dan Wijayani 1994). Media tanam tidak hanya mengandung hara makro dan mikro tetapi juga mengandung sukrosa sebagai sumber karbon dan zat pengatur tumbuh (Budiyastuti 2013).
Beberapa bahan organik yang bisa ditambahkan dalam media tanam adalah air kelapa, pisang, tomat, kentang, ekstrak ragi, alpukat, pepaya dan jeruk (Hendaryono dan Wijayani 1994). Sukrosa atau glukosa 2-4%merupakan sumber karbon yang cocok sehingga penggunaan gula pasir dapat digunakan sebagai sumber energi dalam media kultur. Asam amino seperti prolin, glisin, aspargin dan glutamin terkadang diperlukan. Myoinositol merupakan heksitol atau gula alkohol berkarbon yang sering digunakan karena dapat merangsang pertumbuhan jaringan yang dikulturkan (Lestari 2008).
Zat pengatur tumbuh yang digunakan disesuaikan dengan tujuan, untuk menjadi kalus, organogenesis atau embriogenesis. Penentuan jenis dan konsentrasi ZPT pada kultur tertentu sangat penting untuk menghasilkan respons optimum dari ZPT tersebut. (Santoso dan Nursandi 2003). ZPT merupakan senyawa organik yang umum digunakan pada konsentrasinya rendah bersifat mendorong, menghambat atau mengubah pertumbuhan dan perkembangan suatu tanaman. ZPT digolongkan dalam enam golongan yaitu auksin sitokinin, asam absisik (ABA), giberelin, etilen dan retardan (Wattimena et al. 1992).
ABA tergolong suatu zat yang mengatur tumbuh tanaman yang terlibat dalam induksi embrio somatik. Asam absisik tergolong dalam inhibitor tanaman karena perannya berlawanan dengan hormon pendorong auksin, sitokinin dan giberelin (Suganthi et al. 2012). ABA dapat merangsang embrio menjadi dewasa sehingga berhenti mengalami proliferasi dan akan membesar mengakumulasi cadangan nutrisi (Budiyastuti 2013). Kosmiatin (2013) melaporkan media terbaik yang digunakan untuk regenerasi kalus embriogenik jeruk siam Simadu adalah media MS dengan penambahan vitamin MW.
Pendewasaan embrio somatik yang diinduksi dari kalus embriogenik jeruk siam menggunakan ABA (Husni et al. 2010) dapat mendorong proses pendewasaan embrio somatik secara serempak. Perkembangan embrio somatik jeruk siam simadu yang diinduksi pada fase globular mulai terlihat setelah minggu ke-4 pengulturan media pendewasaan. Husni (2010) melaporkan berhasil mendewasakan embriosomatik hasil fusi jeruk siam Simadu dengan Mandarin Satsuma dengan menambahkan konsentrasi ABA sebanyak 0.5 mg L-1.
Embriogenesis Somatik Tanaman Jeruk
Setelah melalui prosedur sterilisasi, eksplan ditanam pada medium induksi kalus untuk menghasilkan kalus embriogenik. Kalus embriogenik yang dihasilkan diperbanyak dan diregenerasikan menjadi embrio somatik dan selanjutnya menjadi planlet. Proses embriogenesis somatik diawali dengan terbentuknya grobular, heart, torpedo dan kotiledon hingga planlet. Embriogenesis somatik pada jeruk, dapat dimulai dengan menanam eksplan dari jaringan nuselus yang terdapat pada biji muda (12-14 minggu setelah antesis).
6
melaporkan keberhasilannya dalam membentuk tunas triploid jeruk siam Simadu menggunakan endosperm melalui embriogenesis somatik.
Pendewasaan embrio somatik sering memerlukan tambahan Zat pengatur tumbuh. Zat pengatur tumbuh yang digunakan adalah ABA. Merigo (2011) menyatakan konsentrasi ABA terbaik untuk pendewasaan embrio somatik jeruk keprok Batu 55 adalah 2.5 mg L-1 ABA. Karyanti et al. (2012) melaporkan bahwa dengan konsentrasi 2.5 mg L-1 ABA memberikan keberhasilan pendewasaan embrio somatik tanaman jeruk keprok Garut hasil induksi mutasi sinar Gamma. Hal itu sesuai dengan Wattimena et al. (2011) yang melaporkan konsentrasi ABA yang tinggi, yaitu 5-50 mg L-1 dapat berperan menghambat pertumbuhan kalus dan pada beberapa jenis tanaman seperti jeruk dengan konsentrasi 0.05 – 5.00 mg L-1 dapat mempercepat pertumbuhan kalus atau mendorong pertumbuhan tunas dari kalus.
Pendewasaan embrio somatik formulasi media sangat menentukan karena apabila tidak sesuai maka sel-sel yang sudah terdiferensiasi untuk membentuk embrio akan kembali membentuk sel-sel yang tidak terdiferensiasi atau membentuk ES sekunder (Kosmiatin 2013).
BAHAN DAN METODE Tempat dan Waktu
Penelitian ini dilakukan di Laboratorium Kultur Jaringan, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor. Waktu pelaksanaan dari bulan November 2014 sampai Mei tahun 2015.
Bahan dan Alat
Eksplan yang digunakan pada penelitian ini adalah kalus embriogenik dari eksplan nuselus jeruk keprok SoE yang berasal dari Nusa Tenggara Timur (NTT) yang tersedia di Laboratorium Kultur Jaringan 1. Kalus tersebut telah berumur satu tahun dan terus dipelihara di Laboratorium Kultur Jaringan, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor. Media dasar yang digunakan untuk media tumbuh adalah media MS (Murashige and Skoog), dan komposisi vitamin MW (Morel and Wetmore) dapat dilihat pada (Tabel Lampiran 1), gula, agar, ABA dan GA3.
Alat yang digunakan untuk sterilisasi alat maupun bahan adalah autoklaf dan oven. Alat untuk membuat media MS terdiri dari labu takar, pipet volumetrik, magnetic stirer, pengaduk kaca, botol kultur, petri dish, gelas ukur, laminar air flow cabinet (LAFC), gunting, pH meter, magnetic stirrer, kompor, mikroskop, pinset, pipet, scalpel, hand sprayer, cutter, lampu UV, rak kultur, botol kultur, timbangan analitik dan kamera digital.
Metode Percobaan
7
embrio somatik menjadi planlet, dan 3) Pengaruh konsentrasi media MW dalam perkecambahan planlet.
1) Pengaruh ABA dalam induksi kalus embriogenik menjadi embrio somatik Percobaan ini bertujuan untuk mendapatkan embrio somatik (fase kotiledon) dari eksplan kalus embriogenik. Percobaan ini merupakan percobaan faktor tunggal yang disusun menggunakan Rancangan Acak Lengkap (RAL). Faktor yang diteliti adalah konsentrasi ABA yang terdiri dari 5 taraf konsentrasi yaitu: 0, 0.5, 1.5, 2.5, dan 3.5 mg L-1 yang ditambahkan pada media MS dengan vitamin MW. Setiap perlakuan diulang 10 kali sehingga terdapat 50 satuan percobaan. Setiap satuan percobaan adalah satu botol kultur yang ditanam satu clump kalus yang berukuran sekitar 0.5 cm. Semua botol disusun pada rak kultur dan diinkubasi dengan suhu 18-21°C dan intensitas cahaya sekitar 1000 luks.
Pengamatan dilakukan setiap satu minggu hingga 8 minggu setelah tanam (MST) terhadap beberapa peubah yaitu: diameter kalus, jumlah embrio somatik fase globular, jantung, torpedo dan kotiledon.
2) Pengaruh GA3 dalam induksi perkecambahan menjadi planlet.
Percobaan ini bertujuan untuk mendapatkan planlet dari eksplan embrio somatik fase kotiledon (dari percobaan 1). Percobaan ini merupakan percobaan faktor tunggal yang disusun menggunakan Rancangan Acak Lengkap (RAL). Faktor yang diteliti adalah konsentrasi GA3 yang terdiri dari 5 taraf konsentrasi yaitu: 0, 0.5, 1.5, 2.5, dan 3.5 mg L-1 yang ditambahkan pada media MS dengan vitamin MW. Setiap perlakuan diulang 10 kali sehingga terdapat 50 satuan percobaan. Setiap satuan percobaan adalah satu botol kultur yang ditanam 2 embrio somatik fase kotiledon, sehingga terdapat 100 satuan pengamatan. Semua botol disusun pada rak kultur dan diinkubasi dengan suhu 18-21°C dan intensitas cahaya sekitar 1000 luks.
Pengamatan dilakukan setiap satu minggu hingga 8 minggu setelah tanam (MST) terhadap beberapa peubah yaitu jumlah kotiledon yang tumbuh, jumlah planlet normal, jumlah planlet yang abnormal, tinggi planlet, jumlah daun dan jumlah akar. Planlet normal adalah planlet yang terbentuknya tahapan fase embrio somatic (fase globular, hati, torpedo dan kotiledon), planlet tampak sehat, tidak berjamur, ukuran planlet seragam, berdaun hijau segar dan tidak menguning, selain itu planlet tumbuh normal tidak kerdil. Ciri-ciri planlet abnormal adalah tampilan fisik planlet tidak sehat, terdapat jamur, ukuran planlet tidak seragam, bentuk batang dan akar abnormal (tidak seragam), ukuran planlet kerdil.
3) Pengaruh konsentrasi media MS dalam pertumbuhan planlet.
8
yang ditanam 3 planlet, sehingga terdapat 90 satuan pengamatan. Semua botol kultur disusun pada rak kultur dan diinkubasi dengan suhu 18-21°C dan intensitas cahaya sekitar 1000 luks.
Pengamatan dilakukan setiap satu minggu hingga 8 minggu setelah tanam (MST) terhadap beberapa peubah, yaitu: tinggi tanaman, jumlah daun, jumlah akar.
Metode Statistik
Ketiga percobaan yang akan dilakukan pada percoban 1, 2 dan 3 mengunakan model aditif linier yaitu :
Yij = μ + τi + Σij Keterangan:
Yij = Respon pengamatan pada berbagai perlakuan taraf yang berbeda ke-i, dan ulangan ke-j.
Μ = Nilai tengah umum
τi = Pengaruh perlakuan dengan taraf yang berbeda ke -i
Σij = Pengaruh galat percobaan perlakuan dengan taraf yang berbeda ke-i dan ulangan ke-j
Data diolah dengan menggunakan software Microsoft Excel 2013 dan dilakukan analisis ragam dengan uji F pada taraf nyata 5% menggunakan Program statistik STAR (Statistical Tool For Agriculture Research).
Pelaksanaan Percobaan Sterilisasi Alat dan Bahan
Peralatan yang digunakan dicuci terlebih dahulu dan disterilkan menggunakan autoklaf pada tekanan 17.5 psi dengan suhu 121° selama 60 menit, kemudian dimasukkan ke dalam oven. Media dan semua peralatan harus disterilkan sebelum digunakan. Sterilisasi media menggunakan autoklaf pada suhu dan tekanan yang sama dengan waktu sekitar 25-30 menit.
Pembuatan Larutan dan Media Stok
9
Persiapan Bahan Tanam
Bahan tanam atau eksplan yang digunakan adalah kalus kalus embriogenik kultur in vitro jeruk keprok varietas SoE Nusa Tenggara Timur (NTT) yang sudah berumur 1 tahun. Kalus tersebut disubkultur pada media yang sama, yaitu media MS dengan modifikasi komposisi vitamin MW. Setelah kalus embriogenik mencukupi, kemudian dipakai sebagai eksplan pada percobaan 1, yaitu induksi embrio somatik, kalus embriogenik ditanam pada media MW dengan penambahan ABA sesuai dengan perlakuan. Kalus embriogenik yang ditanam berdiameter ±0.5 cm. Pada percobaan 2, yaitu induksi embrio somatik menjadi planlet, embrio somatik fase kotiledon yang dihasilkan pada percobaan 1 ditanam pada pada media MS + komposisi vitamin MW dengan penambahan GA3 sesuai perlakuan. Selanjutnya planlet yang dihasilkan pada percobaan 2 ditanam pada percobaan 3 yaitu pertumbuhan planlet.
Penanaman
Penanaman eksplan dilakukan di dalam Laminar Air Flow Cabinet (LAFC) yang disterilkan dengan menyalakan lampu UV (ultra Violet) selama satu jam dan menyemprot dinding LAFC menggunakan alkohol 70 % sebelum digunakan. Semua alat yang digunakan dalam penanaman disemprot dengan alkohol 70% terlebih dulu sebelum masuk ke dalam LAFC.
HASIL DAN PEMBAHASAN Keadaan Umum
Penelitian ini dilaksanakan selama 6 bulan mulai dari bulan November 2014 sampai dengan bulan Mei 2015. Kalus yang digunakan berasal dari nuselus jeruk keprok SoE berumur satu tahun. Kalus embriogenik didapatkan dengan subkultur pada media MS + komposisi vitamin MW tanpa penambahan zat pengatur tumbuh.
10
Media yang digunakan untuk pendewasaan embrio somatik sama dengan media perbanyakan kalus dan ditambah dengan ABA. Terdapat beberapa tahapan diferensiasi jaringan embrio somatik menjadi planlet tanaman dalam perkembangannya, yaitu fase globular, jantung, torpedo dan kotiledon.
Pengaruh ABA dalam induksi kalus embriogenik menjadi embriosomatik Perkembangan embrio somatik dewasa adalah perkembangan yang dimulai dari fase globular ke tahap pendewasaan sampai dengan fase kotiledon (Zulkarnain 2009). Sejalan dengan hal tersebut penelitian ini terdiri dari tahapan diferensiasi menjadi embrio somatik, yaitu embrio somatik fase globular, jantung, torpedo dan fase kotiledon. Preeti et al. (2004) melaporkan bahwa pendewasaan ES melibatkan perubahan akumulasi ABA dan perkembangan pada kalus mulai terlihat pada minggu ke-4 setelah disubkultur. Pada penelitian ini tahapan embrio somatik mulai terlihat setelah memasuki minggu ke-3 dan 4.
Tabel 1 menunjukkan rekapitulasi pertumbuhan induksi embrio somatik pada pengamatan fase globular dipengaruhi oleh konsentrasi ABA. Jumlah globular minggu ke-4 perlakuan yaitu media MS + komposisi vitamin MW yang selanjutnya dinamakan media MW memperoleh hasil lebih tinggi dibandingkan dengan penambahan ABA. Jumlah embriosomatik pada fase globular minggu ke-6 untuk perlakuan kontrol lebih tinggi dibandingkan dengan media lainnya. Jumlah embriosomatik pada fase jantung pada minggu ke- 4 sampai ke-8 memperoleh hasil yang tidak nyata untuk masing-masing perlakuannya. Pembentukan embrio somatik fase jantung baru terlihat pada minggu ke-4, hal ini dikarenakan perubahan fase diikuti dengan perkembangan embrio somatik yang terbentuk (globular, jantung, torpedo dan kotiledon).
Tabel 1 Pengaruh konsentrasi ABA terhadap rata-rata jumlah embriosomatik yang membentuk fase globular, fase jantung yang dihasilkan dari kalus embriogenik tanaman jeruk SoE. yang sama diikuti huruf yang sama tidak berbeda nyata menurut uji DMRT pada taraf 5 % dan untuk transformasi menggunakan data log (X+10)
11
paling baik untuk menghasilkan embrio somatik fase kotiledon. Semakin tinggi konsentrasi ABA yang terkandung dalam media kultur maka semakin banyak embrio somatik fase kotiledon.
Pertumbuhan embrio somatik pada Tabel 2 menunjukkan bahwa fase torpedo pada minggu ke-6 dan ke-8 perlakuan media (kontrol)memperoleh hasil nyata lebih tinggi dibandingkan perlakuan lainnya (MW+ABA 0.5 mg L-1, MW+ABA 1.5 mg L-1, MW+ABA 2.5 mg L-1 dan MW+ABA 3.5 mg L-1). Hasil rekapitulasi menunjukkan jumlah embriosomatik fase kotiledon pada media (kontrol)minggu ke-6 dan ke-8 memperoleh hasil nyata lebih tinggi dibandingkan dengan perlakuan lainnya (MW+ABA 0.5 mg L-1, MW+ABA 1.5 mg L-1, MW+ABA 2.5 mg L-1 dan MW+ABA 3.5 mg L-1), dapat dilihat pada Tabel 2.
Tabel 2 Pengaruh konsentrasi ABA terhadap rata-rata jumlah embrio somatik yang membentuk fase torpedo dan fase kotiledon sampai minggu ke-8 pada kalus embriogenik tanaman jeruk SoE.
Konsentrasi ABA yang sama diikuti huruf yang sama tidak berbeda nyata menurut uji DMRT pada taraf 5 % dan untuk transformasi menggunakan data log (X+10)
Perlakuan media MW kontrol memperoleh hasil nyata lebih tinggi. Sejalan dengan penelitian Kosmiatin (2013) melaporkan bahwa adanya penambahan ABA dapat membentuk embrio somatik yang morfologinya normal. ABA berperan sebagai komponen dalam mempertahankan perkecambahan dini, meningkatkan akumulasi protein, lemak serta cadangan pati. Meningkatkan toleransi desikasi sehingga konversi terhadap perkecambahan tinggi (Robichaud et al. 2004).
12 jumlah pertumbuhan diameter kalus embriogenik. Penambahan diameter kalus diduga adanya peran dari auksin endogen dalam sel suatu varietas, auksin pada tanaman berperan dalam hal perbanyakan dan perkecambahan sel, menghambat terbentuknya klorofil dan juga induksi kalus (Wattimena 1998). Prayogi (2014) melaporkan bahwa faktor media dasar sangat mempengaruhi pertumbuhan dan perkembangan kalus. Faktor lain yang mempengaruhi pertambahan diameter kalus juga terdapatnya embrio sekunder. Semakin lama waktu kultur dapat menyebabkan embrio globular sekunder bermunculan pada permukaan embrio primer (Budiyastuti 2013).
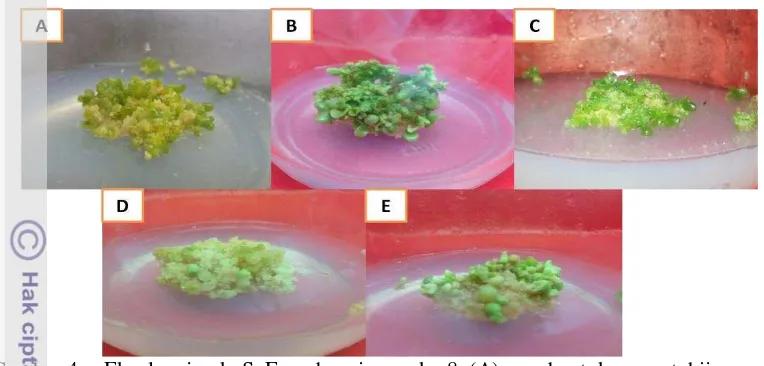
Kalus embriogenik jeruk SoE yang terbentuk pada minggu ke 8 pada media MW kontrol menghasilkan jumlah spot hijau lebih banyak, berbeda dengan pembentukan kalus menggunakan penambahan ABA rata-rata pada media kontrol membentuk embrio somatik sekunder (Gambar 4A). Zulkarnain (2009) embrio zigotik berkembang dari penyatuan gamet jantan dan betina, embrio somatik tumbuh dan berkembang melewati tahapan-tahapan yang sama. Tahapan tersebut adalah globular, jantung, torpedo dan kotiledon.
Perlakuan menggunakan ABA kalus embriogenik jeruk keprok SoE dapat menginduksi terbentuknya embrio somatik primer (fase globular – fase kotiledon) pada minggu ke-8 (Gambar 4 B,C,D,E). Semakin tinggi dosis ABA yang digunakan hasil pembentukan embrio somatik primer semakin baik. Terlihat dari hasil penelitian bahwa dengan menggunakan penambahan ABA dapat menyeragamkan fase pendewasaan sehingga mendapatkan kotiledon yang siap
13
dikecambahkan dan dengan pemberian ABA dapat menekan terjadi pertumbuhan embrio yang prematur dan abnormal (Gambar 4E).
Gambar 4 Eksplan jeruk SoE pada minggu ke-8 (A) pembentukan spot hijau pada perlakuan MW (kontrol), (B) perlakuan MW+ABA 0.5 mg L-1, (C) perlakuan MW+ABA 1.5 mg L-1, (D) perlakuan MW+ABA 2.5 mg L-1 (E) perlakuan MW+ABA 3.5 mg L-1.
Kalus yang diinduksi merupakan kalus embriogenik yang ditunjukkan terbentuknya embrio somatik globular (Gambar 5A). Pembentukan embrio somatik kalus embriogenik jeruk keprok SoE (fase globular-fase kotiledon) terlihat untuk setiap tahapannya pada perlakuan media MW+ABA 0.5 mg L-1 (Gambar 5). Hasil pendewasaan embrio somatik tertinggi dicapai pada eksplan yang dikulturkan dengan menggunakan media MS dengan penambahan vitamin MW, tetapi embrio somatik yang dihasilkan morfologinya tidak normal yang ditandai dengan embrio somatik berbentuk raksasa, kotiledon menebal, pertumbuhan tidak seragam (Gambar 5G). Perlakuan dengan menggunakan media MW + GA3 menghasilkan pendewasaan embrio somatik (planlet) normal yang ditandai dengan terbentuknya akar, kotiledon, daun yang morfologinya normal (Gambar 5F,H).
14
Pengaruh GA3 dalam Perkecambahan Embrio Somatik Menjadi Planlet Percobaan kedua merupakan kelanjutan dari percobaan 1. Pada percobaan ini digunakan media dengan zat pengatur tumbuh terbaik untuk menginduksi embriosomatik dengan menanam embrio somatik fase kotiledon pada media dengan menggunakan konsentrasi GA3. Tujuan dari percobaan ini adalah mendapatkan planlet dari eksplan embrio somatik fase kotiledon.
Pertumbuhan planlet dari kotiledon menunjukkan hasil yang tidak berbeda nyata dari perlakuan GA3 yang diberikan pada minggu ke-4, 6 dan 8 dapat dilihat pada (Tabel 3). Planlet membentuk akar pada media MW (kontrol) pada minggu ke-4 nyata lebih rendah dibandingkan media lainnya. Pada minggu ke-6 dan ke-8 jumlah planlet yang membentuk akar tidak berbeda nyata antar perlakuan.
Tabel 3 Pengaruh konsentrasi GA3 terhadap planlet jeruk SoE terhadap jumlah kotiledon, jumlah daun dan jumlah akar sampai minggu ke-8.
Konsentrasi yang sama diikuti huruf yang sama tidak berbeda nyata menurut uji DMRT pada taraf 5 % dan untuk transformasi menggunakan data log (X+10)
Menurut Marlin et al. (2013) adanya komposisi hara makro, hara mikro dan vitamin yang tepat dalam media MS sangat diperlukan oleh tanaman untuk meningkatkan pembentukan akar. Pada penelitian ini rata-rata pembentukan akar untuk semua perlakuan terlihat pada minggu ke-2 sampai minggu seterusnya. Hal ini merupakan perkembangan dari embrio somatik fase kotiledon yang tumbuh mulai membentuk menjadi planlet. Hasil penelitian ini sejalan dengan Neliyati (2013) bahwa dengan penambahan GA3 lebih berperan dalam pembelahan dan pemanjangan sel pada organ akar sehingga pembentukan dan pemanjangan akar lebih cepat.
15
Gambar 6 Perkecambahan embrio somatik fase kotiledon (A) Perkecambahan embrio somatik fase kotiledon jeruk SoE pada perlakuan kontrol 2 MST, (B) Perkecambahan embrio somatik fase kotiledon jeruk SoE pada perlakuan MW kontrol pada umur 3 MST, (C) Planlet jeruk SoE pada perlakuan MW+0.5 mg L-1 GA3 (6 MST), (D) Planlet jeruk SoE pada perlakuan
MW+1.5 mg L-1 GA3 (7 MST), (E) Planlet jeruk SoE pada perlakuan MW+3.5
mg L-1 GA3 (8 MST).
Pertumbuhan planlet pada (tabel 4) minggu ke-4 media MW+GA3 3.5 mg L-1 nyata lebih tinggi dibandingkan MW+GA3 0.5 mg L-1, MW+GA3 1.5 mg L-1 dan MW (kontrol)tetapi tidak berbeda nyata dengan MW+GA3 2.5 mg L-1. Pada minggu ke-6 dan ke-8 pertumbuhan tinggi tanaman menunjukkan tidak berbeda nyata antar perlakuan. Menurut Oktavia et al. (2003) GA3 berfungsi dalam pemanjangan batang dengan memacu sel-sel penyusun batang serta memacu terbentuknya tunas melalui peran dalam memecah pati oleh enzim amilase serta mengaktifkan auksin pada ujung batang. Pertumbuhan jumlah planlet normal pada minggu ke-4, 6 dan 8 media MW+GA3 2.5 mg L-1, nyata lebih tinggi di bandingkan MW+GA3 0.5 mg L-1, MW+GA3 1.5 mg L-1 dan MW (kontrol), tetapi tidak berbeda nyata dengan MW+GA3 3.5 mg L-1. Menurut Oktavia et al. (2003) perkembangan planlet ditandai dengan tumbuhnya akar, daun primer dan terbentuk daun-daun baru. Pada embrio somatik kopi dapat dihasilkan planlet normal dengan konsentrasi GA3 tertentu dengan hasil yang tinggi.
16
Tabel 4 Pengaruh GA3 terhadap tinggi planlet (cm), jumlah planlet normal dan jumlah planlet abnormal pada planlet jeruk SoE.
Konsentrasi yang sama diikuti huruf yang sama tidak berbeda nyata menurut uji DMRT pada taraf 5 % dan untuk transformasi menggunakan data log (X+10)
Pengaruh konsentrasi media MW dalam pertumbuhan planlet
Pertumbuhan jumlah daun minggu ke-4 tidak berbeda nyata antar perlakuan. Media MW (½ Konsentrasi) pada minggu ke-6 menghasilkan jumlah daun lebih banyak daripada MW (¾ Konsentrasi) tetapi tidak berbeda nyata dengan media MW (Kontrol). Jumlah daun pada media MW (½ Konsentrasi) minggu ke-8 nyata lebih tinggi dibandingkan media lainnya. Penyerapan oleh planlet lebih cepat terhadap dosis yang lebih rendah yaitu 25% hingga konsentrasi 50%. Sejalan dengan penelitian Marlin et al. (2013) sel-sel tanaman akan terpacu berdiferensiasi membentuk akar pada kondisi konsentrasi nutrisi dalam media rendah.
Tabel 5 Pengaruh konsentrasi media MW terhadap jumlah daun, tinggi tanaman (cm) dan jumlah akar pada planlet jeruk SoE.
Media yang sama diikuti huruf yang sama tidak berbeda nyata menurut uji DMRT pada taraf 5 % dan untuk transformasi menggunakan data log (X+10)
17
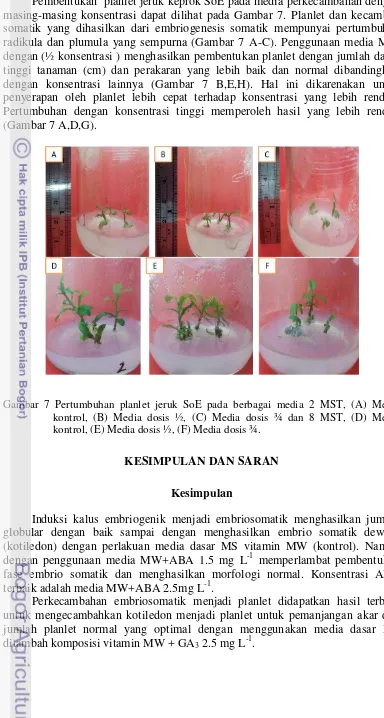
Pembentukan planlet jeruk keprok SoE pada media perkecambahan dengan masing-masing konsentrasi dapat dilihat pada Gambar 7. Planlet dan kecambah somatik yang dihasilkan dari embriogenesis somatik mempunyai pertumbuhan radikula dan plumula yang sempurna (Gambar 7 A-C). Penggunaan media MW dengan (½ konsentrasi ) menghasilkan pembentukan planlet dengan jumlah daun, tinggi tanaman (cm) dan perakaran yang lebih baik dan normal dibandingkan dengan konsentrasi lainnya (Gambar 7 B,E,H). Hal ini dikarenakan untuk penyerapan oleh planlet lebih cepat terhadap konsentrasi yang lebih rendah. Pertumbuhan dengan konsentrasi tinggi memperoleh hasil yang lebih rendah (Gambar 7 A,D,G).
Gambar 7 Pertumbuhan planlet jeruk SoE pada berbagai media 2 MST, (A) Media kontrol, (B) Media dosis ½, (C) Media dosis ¾ dan 8 MST, (D) Media kontrol, (E) Media dosis ½, (F) Media dosis ¾.
KESIMPULAN DAN SARAN Kesimpulan
Induksi kalus embriogenik menjadi embriosomatik menghasilkan jumlah globular dengan baik sampai dengan menghasilkan embrio somatik dewasa (kotiledon) dengan perlakuan media dasar MS vitamin MW (kontrol). Namun dengan penggunaan media MW+ABA 1.5 mg L-1 memperlambat pembentukan fase embrio somatik dan menghasilkan morfologi normal. Konsentrasi ABA terbaik adalah media MW+ABA 2.5mg L-1.
18
Percobaan ketiga untuk media Pertumbuhan terbaik yang digunakan dalam perkecambahan planlet sebelum diaklimatisasi adalah media dengan ½ dosis (0.5 x konsentrasi).
Saran
Perlu dilakukan penelitian lanjutan untuk mendapatkan tanaman jeruk keprok SoE yang diregenerasikan melalui induksi embrio somatik hingga tahap aklimatisasi dan pemeliharaan di lapang.
DAFTAR PUSTAKA
Alawi M. 2015. Jeruk keprok SoE NTT, jeruk istana yang segar dan manis. [Internet]. Kupang (ID): [diunduh pada; 2015 November 01]. Tersedia pada : (http://kupang.tribunnews.com).
Alfoso A, Desamoro NV. 2014. Agricultural Biotechnology (A Lot More than Just GM Crops). ISAAA SE-Asia Center IRRI. Los Banos, Laguna Philippines. Biotech Information Series:1.
Ashari H, Supriyanto A. 2013. Teknologi Budidaya Mempercepat Pembungaan Jeruk Hasil Persilangan Keprok SoE. Balai Penelitian Jeruk Tropika. Badan Litbang Pertanian. Malang (ID): [diunduh pada: 2014 Maret 8]. Tersedia
Basu A, Mohommad A, Paul A, Purkayastha J, Mazumdar P, Solleti SK, Sugla T, Ahmed J. 2010. Efficient in vitro plant regeneration from shoot apices and gene transfer by particle bombardment in Jatropha curcas. Biologia Plantarum.54(1):13-20.
Bebeja. 2013. Jeruk Keprok SoE Nusa Tenggara Timur. Kupang (ID): [diunduh pada 2015 November 10]. Tersedia pada : (http://www.bebeja.com)
Budiyastuti. 2013. Pengaruh ABA dalam pendewasaan embriosomatik jeruk keprok batu 55 dan garut. Bogor (ID): Skripsi. Institut Pertanian Bogor. 23 hal.
Friyanti D. Yulianti F. 2010. Teknologi somatik embriogenesis: Terobosan Perbanyakan Masal Batang Bawah Jeruk. Jurnal Iptek Hortikultura [Internet]. [diunduh 2014 Maret 17]. Balai Penelitian Tanaman Jeruk dan Buah Subtropika. Tlekung (ID).
George EF, Sherrington TD. 1984. Plant propagatin by tissue culture. Handbook and Directionary of commersial laboratories. Exegetic Ltd. England.
19
Husni A. 2010. Fusi Interspesies antar Jeruk Siam Simadu (Citrus nobilis L.) dengan Mandarin Satsuma (Citrus unshiu Marc.) [Disertasi]. Bogor (ID): Sekolah Pascasarjana, Institut Pertanian Bogor.
Husni A, Purwito A, Mariska I, Sudarsono. 2010. Regenerasi jeruk Siam melalui embriogenesis somatik. Bogor (ID): J AgroBiogen [Internet]. [diunduh 2014 Maret 17]; Volume 6(2):75-83.
Karyanti, Purwito A, Husni A. 2012. Pengaruh Induksi Mutasi Sinar Gamma pada Regenerasi Kalus Embriogenik Keprok Garut (Citrus reticulata L.) Prosiding Simposium dan Seminar Bersama PERAGI-PERHORTI-PERIPI-HIGI Mendukung Kedaulatan Pangan dan Energi yang Berkelanjutan. Kihhundu A, Sefasi A, Ghislain M, Kreuze J, Mukasa SB, Semakula G, Manrique
S. 2012. Induction of somatic embryogenesis in recalcitrant sweet potato (Ipomoea batatas L.) cultivars. African Journal of Biotechnology. 11(94). Kosmiatin M. 2013. Pembentukan Tanaman Triploid Jeruk Siam Simadu (Citrus
nobilis Lour) Melalui Kultur Endosperma. Disertasi. Sekolah Pasca Sarjana Institut Pertanian Bogor.
Lestari EG. 2008. Kultur Jaringan. Bogor (ID): Akademia.
Marlin, Roemaida A, Hartal, Gonggo B. 2013. Pengembangan teknologi mikropropagasi tanaman jahe gajah bebas penyakit layu bakteri. Bengkulu (ID): Fakultas Pertanian Universitas Bengkulu.
Martosupo M, Semangun H, Sunbarru B. 2007. Budidaya jeruk keprok SoE di Kabupaten Timor Tengah Selatan [Internet]. Salatiga (ID): [diunduh pada 2015 November 1] Tersedia pada: (http://repository.uksw.edu/). AGRIC Vol. 19. (1-2): 76-90.
Marques S, Sumarji. 2014. Strategi pengembangan sentra agribisnis jeruk keprok SoE (citrus reticulata) di kabupaten Timor Tengah Selatan, Nusa Tenggara Timur. NTT (ID): J Manajemen Agribisnis vol 14(1).
Merigo JA. 2011. Studi Regenerasi Tanaman Jeruk Keprok Batu 55 (Citrus reticulata L) Melalui Jalur Embriogenesis Somatik. Tesis. Sekolah Pasca Sarjana Institut Pertanian Bogor.
Neliyati. 2013. Regenerasi embriosomatik tengkawang (Shorean Stenoptera burck) pada beberapa konsentrasi zat pengatur tumbuh GA3 dan BAP. Jambi (ID): J. ISSN 2302-6472, Vol 2(2).
Oktavia F, Siswanto, Budiani A, Sudarsono. 2003. Embriogenesis somatik dan regenerasi planlet kopi arabika (coffea arabica) dari berbagai eksplan. Bogor (ID): J Menara Perkebunan 71(2), 44-55.
Pemerintah Banyuwangi. 2013. Jeruk Siam andalan Banyuwangi. [Internet]. Banyuwangi (ID): [diunduh pada 2014 Maret 8]. Tersedia pada : (http//www.banyuwangikab.go.id).
Prayogi M. 2014. Embriogenesis somatik tidak langsung jeruk keprok batu 55 (Citrus reticulata L.) hasil perlakuan kolkisin. Bogor (ID): Skripsi. Institut Pertanian Bogor.
Preeti S, S Pandey, A Bhattacharya, PK Nagar, PS Ahuja. 2004. ABA assosiated biochemical changes during somatic embryo development in Camelia sinensis (L.) Kuntze ). Plant Physiol. 161:1269-1276.
20
Ridjal AJ. 2008. Analisis Faktor Determinan Keikutsertaan Petani Berkelompok, Pendapatan Dan Pemasaran Jeruk Siam Di Kabupaten Jember. Jember (ID): Jurnal.unej.ac.id [Internet]. [diunduh pada : 2014 Maret 17]; Vol 2.
Robichaud RL, Lessard VC, Merkle SA. 2004. Treatments affecting maturation and germination of American chestnut somatic embryos. Plant Physiol. 161: 957-969.
Santoso U, Nursandi F. 2003. Kultur Jaringan Tanaman. Malang (ID): Universitas Muhammadiyah Malang (UMM Press).
Suganthi M, Arvinth S, Raj KR. 2012. Impact of osmotica and abscisic acid on direct somatic embryogenesis in tea. Internasional Journal of Plant Research. 2(2):22-27.
Wattimena GA. 1998. Zat Pengatur Tumbuh Tanaman. Bogor (ID): Pusat antar universitas. Institut Pertanian Bogor.
Wattimena GA, Mattjik NA, Wiendi NMA, Purwito A, Efendi D, Purwoko BS, Khumaida N. 2011. Bioteknologi dalam Pemuliaan Tanaman. Bogor (ID): Institut Pertanian Bogor.
Wattimena GA, Gunawan LW, Mattjik NA, Syamsudin E, Wiendi NMA, Ernawati A. 1992. Bioteknologi Tanaman. Bogor (ID): Institut Pertanian Bogor.
Yuliarti N. 2010. Kultur Jaringan Tanaman Skala Rumah Tangga. Yogyakarta (ID): ANDI.
21
22
Lampiran 1 Formulasi media MS dan komposisi vitamin MW
23
RIWAYAT HIDUP
Penulis dilahirkan di Banjarmasin pada tanggal 6 April 1992 sebagai anak ke empat dari empat bersaudara dari pasangan M. Darsi S.Sos dan Hj. Siti Asnah S.Sos.
Penulis memulai pendidikan di SDN Karang Mekar 2 Banjarmasin pada tahun 1998, kemudian melanjutkan ke SMP Islam Sabilal Muhtadin Banjarmasin pada tahun 2004. Pada tahun 2010 penulis lulus dari SPP Negeri Pelaihari dan pada tahun yang sama penulis lulus seleksi masuk Program Diploma III Institut Pertanian Bogor melalui jalur USMI IPB dan di terima di program keahlian Teknologi Industi Benih. Pada tahun 2013, penulis memperoleh gelar Ahli Madya (A.Md) Program Diploma III IPB dan pada tahun yang sama penulis melanjutkan program sarjana pendidikan pada jurusan Agronomi dan Hortikultura IPB, Fakultas Pertanian Institut Pertanian Bogor (IPB).