KAJIAN PEMBERIAN SINBIOTIK DENGAN FREKUENSI
BERBEDA UNTUK PENCEGAHAN KO-INFEKSI
INFECTIOUS MYONECROSIS VIRUS
DAN
VIBRIO HARVEYI
PADA UDANG VANAME (
LITOPENAEUS VANNAMEI
)
ADNI OKTAVIANA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Kajian Pemberian Sinbiotik dengan Frekuensi Berbeda Untuk Pencegahan Ko-Infeksi Infectious Myonecrosis Virus dan Vibrio harveyi pada Udang Vaname (Litopenaeus vannamei) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2014
Adni Oktaviana NRP C151110061
RINGKASAN
ADNI OKTAVIANA. Kajian pemberian sinbiotik dengan frekuensi berbeda untuk pencegahan ko-infeksi Infectious Myonecrosis Virus dan Vibrio harveyi pada udang vaname Litopenaeus vannamei. Dibimbing oleh WIDANARNI dan MUNTI YUHANA.
Salah satu kendala budidaya udang secara intensif adalah serangan penyakit. Serangan penyakit yang sering menyerang adalah penyakit bakterial, viral dan infeksi bersama bakteri dan virus (ko-infeksi). Ko-infeksi dapat mempercepat dan meningkatkan mortalitas. Aplikasi sinbiotik dapat menjadi salah satu alternatif yang dapat digunakan untuk menekan serangan penyakit, karena mampu meningkatkan respon imun dan resistensi udang terhadap serangan penyakit. Penelitian ini bertujuan untuk mengkaji pemberian sinbiotik dengan frekuensi berbeda untuk pencegahan ko-infeksi IMNV dan V. harveyi. Frekuensi yang digunakan yaitu pemberian sinbiotik setiap hari, tiga hari sekali dan tujuh hari sekali. Sinbiotik yang digunakan pada penelitian ini adalah gabungan dari probiotik SKT-b dan prebiotik oligosakarida yang diekstraksi dari tepung ubi jalar varietas sukuh (Ipomoea batatas L). Penelitian ini terdiri dari beberapa tahap yaitu persiapan prebiotik (pembuatan tepung ubi jalar, ekstraksi oligosakarida dengan etanol 70%, penghitungan total padatan terlarut serta analisa kandungan oligosakarida dengan HPLC), persiapan probiotik, persiapan stok virus IMNV dan persiapan V. harveyi, pengujian sinbiotik 1 dosis (1% probiotik dengan 2% prebiotik) secara in vivo selama 30 hari dan uji tantang. Pengujian performa pertumbuhan pada akhir perlakuan sinbiotik dilakukan dengan mengukur laju pertumbuhan harian dan rasio konversi pakan. Jumlah bakteri pada usus udang meliputi total bakteri, jumlah bakteri Vibrio dan total bakteri SKT-bR dihitung pada akhir perlakuan sinbiotik. Pengukuran respon imun dilakukan sebelum dan setelah uji tantang meliputi pengukuran total hemosit, diferensial hemosit (total sel hialin dan sel granular), aktivitas phenoloxidase serta aktivitas respiratory burst. Pengujian resistensi udang terhadap ko-infeksi dilakukan dengan penyuntikan IMNV dan V. harveyi dengan mengamati sintasan yang dilakukan selama tujuh hari. Konfirmasi udang yang terinfeksi untuk memastikan virus dan bakteri yang menginfeksi, dilakukan dengan uji PCR (IMNV) dan metode gores kuadran pada media TCBS-Rif (V. harveyi).
serta respon imun terutama pada parameter jumlah hemosit (THC) sebesar 6,40x106±0,85 sel/ml dan aktivitas phenoloxidase (PO) sebesar 1,07±0,15. Selain itu, penambahan sinbiotik setiap hari juga menghasilkan resistensi terbaik terhadap ko-infeksi IMNV dan V. harveyi, dengan nilai sintasan sebesar 93,33±5,77% dibandingkan kontrol positif sebesar 46,67±11,57%.
SUMMARY
ADNI OKTAVIANA. The frequency effect of synbiotic supplementation diet to control the co-infection disease of Infectious Myonecrosis Virus and Vibrio harveyi. Supervised by WIDANARNI and MUNTI YUHANA.
One of the obstacles in intensive shrimp culture is the high frequency of disease. The diseases that most often attack are bacterial, viral and infection by bacterial and viral at the same time (co-infection). Co-infection disease can accelerate and increase mortality. One of the alternative to prevent the diseases is synbiotics, because synbiotics could increase the shrimp immune response and resistance to diseases. This study aimed to evaluated the frequency effect of synbiotic supplementation diet to control the co-infection disease of IMNV and V. harveyi. The frequencies applied in this study were daily, once in three days and once a week supplementation. The synbiotics used in this study is the combination between the probiotics SKT-b and prebiotic is the derivate of oligosaccharide from sweet potato starch (Ipomoea batatas L). Several stages of this study consisted of prebiotic preparation (making the sweet potato starch, oligosaccharide extraction with ethanol 70%, the determination of total dissolved solid and oligosaccharide test with HPLC), probiotic preparation, IMNV stock preparation and V. harveyi preparation, 1 dosage synbiotics (1% probiotic with 2 % prebiotic) in vivo test during 30 days and challenged test. The growth performance were the daily growth rate and feed conversion ratio. The number of bacteria in shrimp intestine observed at the end of synbiotics treatment consisted of the total viable bacterial count, presumptive vibrio counts and the presumptive SKT-bR counts. Immune responses observed before and after challenge test were total hemocyte count, the numbers of hemocytes (hyaline cells and granular cells), phenoloxidase activity and respiratory burst activity. Shrimp resistance observed was the shrimp survival against co-infection by IMNV and V. harveyi for seven days. PCR test using Nugen IMNV diagnostic kits for IMNV confirmation and streak plate method on TCBS containing rif media for V. harveyi confirmation.
The result of oligosaccharide extraction with 5% TPT used in this study consist of 1,115% inulin; 1,015% FOS and 1,488% GOS. Supplementation of synbiotics diet during 30 days were increase the number of bacteria in shrimp intestine and improve growth performance (LPH and FCR) and shrimp resistance against co-infestion IMNV and V. harveyi. Synbiotics treatment significantly increase THC value and PO activity than controls (before challenge test). Generally, daily supplementation of synbiotics showed better resistance against co-infection IMNV and V. harveyi and better growth performance than control. Daily supplementation of synbiotics given the best result in LPH was 8,12±0,12% and FCR was 1,11±0,08. Total hemocyte count value was 6,40x106±0,85 cell/ml and phenoloxidase was 1,07±0,15. Moreover, daily supplementation of synbiotics given the best shrimp resistance against co-infection by IMNV and V. harveyi with the survival value was 93,33±5,77% compared with positive control was 46,67±11,57%.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
KAJIAN PEMBERIAN SINBIOTIK DENGAN FREKUENSI
BERBEDA UNTUK PENCEGAHAN KO-INFEKSI
INFECTIOUS MYONECROSIS VIRUS
DAN
VIBRIO HARVEYI
PADA UDANG VANAME (
LITOPENAEUS VANNAMEI
)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Kajian Pemberian Sinbiotik dengan Frekuensi Berbeda untuk Pencegahan Ko-infeksi Infectious Myonecrosis Virus dan Vibrio harveyi pada Udang Vaname (Litopenaeus vannamei)
Nama : Adni Oktaviana NIM : C151110061
Disetujui oleh Komisi Pembimbing
Dr Ir Widanarni, MSi Ketua
Dr Munti Yuhana, SPi MSi Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala
karunia-Nya sehingga karya ilmiah yang berjudul “Kajian Pemberian Sinbiotik dengan
Frekuensi Berbeda untuk Pencegahan Ko-infeksi Infectious Myonecrosis Virus dan Vibrio harveyi pada Udang Vaname (Litopenaeus vannamei)” berhasil diselesaikan. Penelitian ini dilakukan dari bulan April sampai Agustus 2013 bertempat di Laboratorium Kesehatan Ikan Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor dan Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Ibu Dr Ir Widanarni, MSi dan Ibu Dr Munti Yuhana, SPi, MSi selaku pembimbing yang telah banyak memberi saran. Dr Dinamella Wahjuningrum, SSi, MSi selaku penguji atas bimbingan dan saran yang diberikan. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya. Penulis sampaikan pula terima kasih dan penghargaan kepada teknisi laboratorium, teman-teman mahasiswa Program Studi Ilmu Akuakultur IPB khususnya angkatan 2011, serta semua pihak yang telah membantu secara langsung maupun tidak langsung.
Akhir kata, penulis berharap semoga karya ilmiah ini dapat bermanfaat. Penulis menyadari hasil penelitian dalam karya ilmiah ini bukanlah sebuah kebenaran mutlak karena sangat mungkin berubah seiring berkembangnya ilmu pengetahuan.
Bogor, Februari 2014
DAFTAR ISI
Pengujian Sinbiotik secaraIn Vivo 10
Uji Tantang 11
Penghitungan Populasi Bakteri di Usus 12
Parameter Pertumbuhan 12
Parameter Respon Imun 13
Sintasan 14
Pengujian Udang Terinfeksi IMNV danV. harveyi 14
Analisis Data 15
4 HASIL DAN PEMBAHASAN 15
Oligosakarida Ubi Jalar Varietas Sukuh 15
Penghitungan Populasi Bakteri di Usus Udang 16
Kinerja Pertumbuhan 17
Respon Imun 19
Sintasan 23
SIMPULAN DAN SARAN 26
Simpulan 26
Saran 26
DAFTAR PUSTAKA 26
LAMPIRAN 31
DAFTAR TABEL
1 Jenis dan Konsentrasi Gula Tepung Ubi Jalar Varietas Sukuh yang Diidentifikasi dengan HPLC (High Performance Liquid
Chromatograph) 4
2 Perlakuan Pemberian Sinbiotik dengan Frekuensi Berbeda dan Uji
Tantang dengan Ko-infeksi IMNV danV. harveyi 11
3 Hasil Analisis Oligosakarida Ubi Jalar Varietas Sukuh dengan
HPLC 15
4 Jumlah Bakteri di Usus Udang Uji (L. vannamei) 16
DAFTAR GAMBAR
1 IMNV. Virion IMNV (a); Subadult Udang Vaname yang Terinfeksi IMNV (b); dan Organ Limfoid yang Terinfeksi IMNV
(d) (Pouloset al. 2006) 5
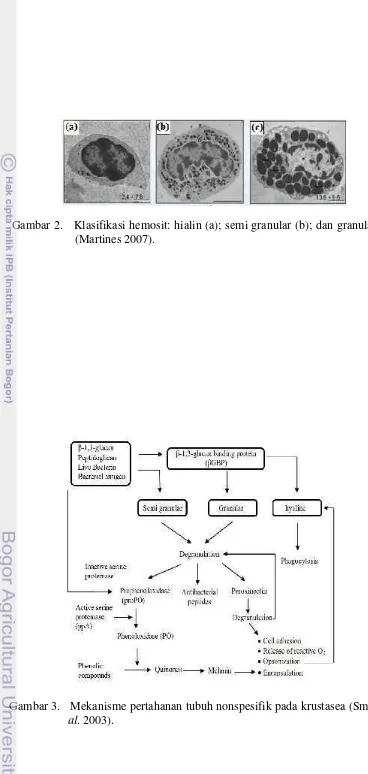
2 Klasifikasi Hemosit: Hialin (a); Semi Granular (b); dan Granular
(c) (Martines 2007) 7
3 Mekanisme Pertahanan Tubuh Nonspesifik pada Krustasea (Smith
et al. 2003) 7
4 Tahapan Pembuatan Ubi Jalar 8
5 Laju pertumbuhan harian udang selama 30 hari pemberian sinbiotik. Data (mean±SE) dengan huruf berbeda menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari sekali; P3:
pemberian sinbiotik tujuh hari sekali 17
6 Rasio konversi pakan (FCR) selama 30 hari pemberian sinbiotik. Data (mean±SE) dengan huruf berbeda menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari sekali; P3: pemberian sinbiotik
tujuh hari sekali 18
7 Hemosit total (THC) udang (L. vannamei) sebelum uji tantang (akhir perlakuan sinbiotik) dan setelah uji tantang. Data (mean±SE) dengan huruf berbeda pada pola yang sama menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari
8 Sel hialin total udang (L. vannamei) sebelum uji tantang (akhir perlakuan sinbiotik) dan setelah uji tantang. Data (mean±SE) dengan huruf berbeda pada pola yang sama menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari sekali; P3: pemberian sinbiotik
tujuh hari sekali 20
9 Sel granular total udang (L. vannamei) sebelum uji tantang (akhir perlakuan sinbiotik) dan setelah uji tantang. Data (mean±SE) dengan huruf berbeda pada pola yang sama menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari sekali; P3: pemberian sinbiotik
tujuh hari sekali 21
10 Aktivitas phenoloxidase (PO) udang (L. vannamei) sebelum uji tantang (akhir perlakuan sinbiotik) dan setelah uji tantang. Data (mean±SE) dengan huruf berbeda pada pola yang sama menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari
sekali; P3: pemberian sinbiotik tujuh hari sekali 22 11 Aktivitasrespiratory burst(RB) udang (L. vannamei) sebelum uji
tantang (akhir perlakuan sinbiotik) dan setelah uji tantang. Data (mean±SE) dengan huruf berbeda pada pola yang sama menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari
sekali; P3: pemberian sinbiotik tujuh hari sekali 23 12 Sintasan udang (L. vannamei) sebelum uji tantang (akhir
perlakuan sinbiotik) dan setelah uji tantang. Data (mean±SE) dengan huruf berbeda pada pola yang sama menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari sekali; P3: pemberian sinbiotik
tujuh hari sekali 24
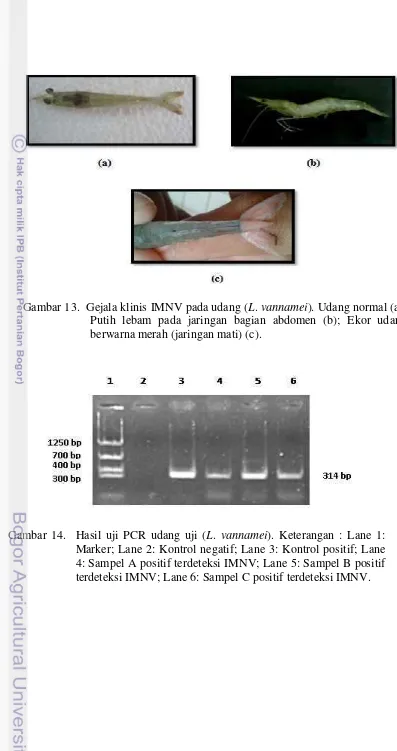
13 Gejala klinis IMNV pada udang (L. vannamei). Udang normal (a); Putih lebam pada jaringan bagian abdomen (b); Ekor udang
berwarna merah (jaringan mati) (c) 25
14 Hasil uji PCR udang uji (L. vannamei). Keterangan : Lane 1: Marker; Lane 2: Kontrol negatif; Lane 3: Kontrol positif; Lane 4: Sampel A positif terdeteksi IMNV; Lane 5: Sampel B positif
DAFTAR LAMPIRAN
1 Pembuatan Media Bakteri 31
2 Udang Terinfeksi IMNV yang Digunakan untuk Stok Virus 31
3 MetodeTotal Plate Count 32
4 Metode Gores Kuadran 32
5 Hasil Uji Statistik dengan SPSS terhadap Rasio Konversi Pakan
(FCR) Udang Uji 33
6 Hasil Uji Statistik dengan SPSS terhadap Laju Pertumbuhan
Harian Udang Uji 34
7 Hasil Uji Statistik dengan SPSS terhadap Sintasan Udang Uji
Setelah Uji Tantang 35
8 Hasil Uji Statistik dengan SPSS terhadap Total Hemosit Udang
Uji Sebelum Uji Tantang 36
9 Hasil Uji Statistik dengan SPSS terhadap Sel Hialin Udang Uji
Sebelum Uji Tantang 37
10 Hasil Uji Statistik dengan SPSS terhadap Sel Granular Udang Uji
Sebelum Uji Tantang 38
11 Hasil Uji Statistik dengan SPSS terhadap AktivitasPhenoloxidase
Udang Uji Sebelum Uji Tantang 39
12 Hasil Uji Statistik dengan SPSS terhadap Aktivitas Respiratory
BurstUdang Uji Sebelum Uji Tantang 40 13 Hasil Uji Statistik dengan SPSS terhadap Total Hemosit Udang
Uji Setelah Uji Tantang 41
14 Hasil Uji Statistik dengan SPSS terhadap Sel Hialin Udang Uji
Setelah Uji Tantang 42
15 Hasil Uji Statistik dengan SPSS terhadap Sel Granular Udang Uji
Setelah Uji Tantang 43
16 Hasil Uji Statistik dengan SPSS terhadap AktivitasPhenoloxidase
Udang Uji Setelah Uji Tantang 44
17 Hasil Uji Statistik dengan SPSS terhadap Aktivitas Respiratory
1
1.
PENDAHULUAN
Latar Belakang
Serangan penyakit merupakan salah satu masalah serius dalam budidaya udang secara intensif (Chang et al. 2012). Penyakit yang sering menyerang budidaya udang intensif adalah penyakit bakterial, viral dan infeksi bersama bakteri dan virus (ko-infeksi) (Teixeira-Lopes 2011). Menurut Poulos et al. (2006), salah satu penyakit viral yang mematikan dan menjadi masalah utama pada budidaya udang vaname adalah IMNV (Infectious Myonecrosis Virus). Penyakit ini menyebar ke Indonesia pada tahun 2006 (Senapin 2007) dan dapat menyebabkan kematian massal pada udang hingga 70% (Hasan 2011). Selain infeksi oleh virus, di alam juga sering ditemukan infeksi oleh bakteri dan Vibrio sp ditemukan paling sering sebagai penyebab infeksi sekunder pada udang (Liu dan Chen 2004). Phuoc et al. (2009), melaporkan infeksi antara Vibrio spp denganWhite Spot Syndrome Virus(WSSV). Selanjutnya, Teixeira-Lopes (2011), melaporkan udang vaname dapat terinfeksi oleh dua jenis virus berbeda yaitu Infectious Hypodermal and Hematopoietic Virus (IHHNV) dan IMNV secara alami.
Infeksi dari beberapa patogen secara bersamaan (ko-infeksi) dapat mempercepat awal mortalitas dan meningkatkan mortalitas (Hasan 2011). Oleh karena itu, perlu adanya cara untuk mencegah serangan penyakit ko-infeksi ini. Dalam beberapa tahun terakhir, antibiotik digunakan untuk mengendalikan penyakit dalam industri budidaya udang, namun antibiotik dapat menyebabkan patogen resisten antibiotik, kerusakan lingkungan dan masalah keamanan pangan (Chang et al. 2012; Ai et al. 2011). Menurut Zhang et al. (2012), perlu dicari alternatif untuk meningkatkan kekebalan tubuh dan mencegah wabah penyakit pada hewan akuatik. Hasil penelitian Li et al. (2009), menunjukkan sinbiotik dapat menjadi salah satu alternatif yang dapat digunakan untuk menekan serangan penyakit, karena sinbiotik terbukti mampu meningkatkan respon imun dan resistensi udang terhadap serangan WSSV. Sinbiotik merupakan kombinasi seimbang dari probiotik dan prebiotik dalam mendukung kelangsungan hidup dan pertumbuhan bakteri yang menguntungkan dalam saluran pencernaan makhluk hidup (Schrenzenmeir dan Vrese 2001).
Probiotik merupakan mikroba tambahan yang memberikan pengaruh menguntungkan bagi kesehatan inang (Nayak 2010). Sedangkan, prebiotik adalah bahan pangan yang tidak dapat dicerna oleh inang tetapi memberikan efek menguntungkan bagi inang dengan cara merangsang pertumbuhan mikroflora normal di dalam saluran pencernaan inang (Schrenzenmeir dan Vrese 2001). Beberapa penelitian menunjukkan keuntungan dari penggunaan probiotik (Panigrahiet al. 2005; Watsonet al. 2008; dan Nayak 2010) dan prebiotik secara terpisah (Delgadoet al. 2011; Hoseinifaret al. 2013). Namun, menurut Merrifield et al. (2010), aplikasi sinbiotik lebih baik daripada aplikasi probiotik dan prebiotik secara terpisah.
2
udang vaname. Frekuensi pemberian sinbiotik merupakan salah satu faktor penting yang dapat mempengaruhi pembentukan, kestabilan dan induksi respon imun pada inang (Nayak 2010). Oleh karena itu, penelitian mengenai frekuensi pemberian sinbiotik yang optimal untuk pencegahan ko-infeksi IMNV dan V. harveyi pada udang vaname penting dilakukan. Selain itu, frekuensi pemberian sinbiotik yang tepat akan berpengaruh terhadap efisiensi produksi mengingat aplikasi sinbiotik akan membutuhkan biaya tambahan.
Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mengkaji pemberian sinbiotik dengan frekuensi berbeda untuk pencegahan ko-infeksi IMNV dan V. harveyi pada udang vaname.
Manfaat Penelitian
Manfaat dari penelitian ini adalah untuk memberikan informasi tentang pemberian sinbiotik dengan frekuensi yang tepat untuk menekan munculnya serangan penyakit Infectious Myonecrosis (IMN) dan vibriosis (V. harveyi) pada budidaya udang vaname.
Hipotesis
Hipotesis penelitian ini adalah pemberian sinbiotik dosis 1 (1% probiotik + 2% prebiotik) dengan frekuensi tertentu dapat berpengaruh dalam pencegahan ko-infeksi IMNV danV.harveyipada udang vaname.
2.
TINJAUAN PUSTAKA
Sinbiotik
Probiotik adalah mikroba tambahan yang memberikan pengaruh menguntungkan bagi inang melalui peningkatan nilai nutrisi dan memperbaiki respon inang terhadap penyakit (Verschuere et al. 2000). Konsep awal aktivitas probiotik yaitu mendukung aktif saluran pencernaan dan memberikan sifat antagonisme terhadap patogen, membantu sistem kekebalan tubuh, memberikan manfaat gizi, dan membantu sebagai penghalang mukosa usus (Chiuet al. 2010; Merrifieldet al. 2010; Nayak 2010).
3
meningkatkan respon imun, perbaikan kualitas air dan interaksi dengan fitoplankton.
Bakteri probiotik yang telah banyak dilaporkan efektif dalam penghambatan patogen dan meningkatkan pertumbuhan dan sintasan pada budidaya udang meliputi Lactobacillus sp, Bacillus sp, ragi dan beberapa bakteri Gram negatif (Kongnum dan Hongpattarakere 2012). Bakteri probiotik yang digunakan pada penelitian ini adalah bakteri Vibrio SKT-b. SKT-b merupakan bakteri dari genus Vibrio, membentuk koloni berwarna kuning pada media TCBS dan menyebar pada media SWC-agar, memproduksi protease dan amilase, namun tidak memproduksi khitinase. Probiotik ini dapat memanfaatkan glukosa dan sukrosa, tetapi tidak dapat memanfaatkan laktosa. Hasil karakteristik fisiologi dan biokimia serta analisis sekuen sebagian gen 16S-rRNA menunjukkan bahwa isolat probiotik SKT-b ini termasuk spesies Vibrio alginolyticus dengan indeks kemiripan 88% (Widanarniet al. 2003). SKT-b telah teruji kemampuannya dalam menghambat pertumbuhan bakteri V. harveyi dan meningkatkan kelangsungan hidup larva udang windu pada berbagai stadia (Widanarniet al. 2010).
Probiotik sering didefinisikan sebagai aplikasi mikroorganisme atau komponen dari mikroorganisme yang bermanfaat untuk kesehatan inangnya (Cerezuela et al. 2011). Namun, probiotik memiliki beberapa kelemahan yaitu kemampuan bertahan, kolonisasi dan kompetisi untuk mendapatkan nutrisi dengan bakteri lain yang terdapat dalam satu lingkungan ekosistem. Bakteri probiotik juga dipengaruhi oleh kondisi lingkungan, jika terjadi perubahan lingkungan yang ekstrim maka bakteri dalam saluran pencernaan akan mengalami wash out (Lisal 2005). Penambahan prebiotik dapat mengatasi kelemahan probiotik.
Prebiotik didefinisikan sebagai bahan makanan yang tidak dapat dicerna yang menguntungkan dan mempengaruhi inang, secara selektif merangsang pertumbuhan dan/atau aktivitas spesifik bakteri yang dapat meningkatkan kesehatan inang (Cerezuela et al. 2011). Prebiotik merupakan komponen bahan pangan yang tidak dapat dicerna oleh inang, memiliki pengaruh menguntungkan terhadap inang dan berhubungan dengan mendukung keberadaan mikrobiota (FAO 2007).
FAO (2007), menyatakan bahwa komponen yang dapat diklaim sebagai prebiotik harus terlebih dahulu dikarakterisasi meliputi sumber asalnya, kemurnian, komposisi dan struktur kimia, konsentrasi dan jumlah yang dibawa ke inang. Manfaat minimum prebiotik adalah mempengaruhi fisiologi dan mendukung keberadaan mikrobiota pada bagian tertentu terutama saluran pencernaan. Kualifikasi prebiotik adalah bahwa prebiotik tidak hanya untuk meningkatkan bifidobakteria saja namun juga ditunjukkan dengan pengaruh meningkatkan kesehatan fisiologi inangnya (Watson et al. 2008). Prebiotik yang digunakan pada penelitian ini adalah oligosakarida yang diekstrak dari tepung ubi jalar.
4
Ubi jalar mengandung karbohidrat yang tinggi dan protein serta lemak yang rendah. Rendemen ubi jalar varietas sukuh adalah 29,71 % dan kadar air tepung adalah 4,98 %. Gula yang terdapat pada ubi ini adalah rafinosa, maltosa, sukrosa dan maltotriosa (Tabel 1). Konsentrasi gula ubi jalar yang dikukus meningkat dibandingkan dengan ubi jalar mentah (Marlis 2008).
Tabel 1. Jenis dan konsentrasi gula tepung ubi jalar varietas sukuh yang diidentifikasi dengan HPLC (High Performance Liquid Chromatograph).
Jenis gula Konsentrasi gula tepung ubi jalat (% berat kering) Segar Panggang Kukus Sangrai Drum dried
Fruktosa 0,33 0,29 0,19 0,32 0,43
Glukosa 0,23 0,24 0,28 0,21 0,26
Sukrosa 2,06 1,33 1,60 2,52 2,84
Maltosa 0,26 2,04 3,52 0,29 0,71
Total gula
Rafinosa 0,03 0,10 0,20 0,01 0,19
Total oligosakarida
(B)
0,14 0,13 0,34 0,01 0,23
Total A+B 2,92 4,03 5,93 3,35 4,47
Sumber: Marlis 2008
Sinbiotik merupakan aplikasi gabungan dari probiotik dan prebiotik yang memberikan keunggulan kompetitif bagi probiotik terhadap sumber energi fermentasi yang tinggi dibandingkan dengan kompetisi populasi endogenous, sehingga secara efektif dapat meningkatkan kelangsungan hidup dan pelekatan (implantasi) dari suplemen makanan mikroba hidup dalam saluran pencernaan dari inang(Danielset al. 2010; Ai et al. 2011; Cerezuela et al. 2011; Delgado et al. 2011). Li et al. (2009), melaporkan bahwa aplikasi sinbiotik dari prebiotik isomaltooligosakarida dan probiotik Bacillus OJ pada udang telah terbukti secara signifikan meningkatkan kelangsungan hidup udang yang diuji tantang dengan WSSV, mendukung keberadaan mikrobiota gastro-intestinal dan merangsang respon imun.
Infectious Myonecrosis Virus(IMNV)
5
6
tertiup angin. Tanda-tanda udang yang terinfeksi V. harveyi gerakan lemah dan menyentak-nyentak, jaringan mengalami nekrosis, pertumbuhan lambat, metamorfosis lambat, udang menyala dalam gelap, otot dan dagingnya berwarna gelap, dan usus kosong (Cano-Gomezet al. 2009).
Ko-Infeksi
Ko-infeksi disebabkan oleh dua atau lebih patogen yang menyerang pada saat bersamaan. Beberapa penelitian telah melaporkan adanya ko-infeksi. Ko-infeksi oleh bakteri-bakteri telah dilaporkan oleh Phuoc et al. (2009), dimana udang windu yang diuji tantang oleh V. parahaemolyticus dan V. harveyi yang diisolasi dari udang sakit dapat menyebabkan sindrom merah pada udang windu. Ko-infeksi oleh beberapa virus juga dilaporkan telah menyerang budidaya udang vaname di Brazil, dimana udang tersebut terinfeksi oleh IMNV dan WSSV (Feijo et al. 2013).
Ko-infeksi oleh IHHNV dan WSSV pada budidaya udang vaname telah dilaporkan oleh Teixeira-Lopes (2011). Flegelet al. (2004), dengan menggunakan histopatologi dan PCR menemukan infeksi oleh dua, tiga sampai empat infeksi virus bersamaan yaitu virus HPV, WSSV, IHHNV dan MBV pada tambak udang komersial di Thailand. Selvin dan Lipton (2003), menemukan kehadiran V. alginolyticus yang mematikan pada tambak udang yang terinfeksi WSSV. Walaupun tidak semua sampel terinfeksi kedua jenis patogen tersebut. Namun, hal ini membuktikan bahwa udang yang melemah karena terinfeksi WSSV akan mudah mengalami infeksi sekunder olehVibrio.
Sistem Imun pada Udang
Sistem imun pada udang kurang berkembang dibandingkan dengan vertebrata lain. Udang maupun krustasea tidak memiliki sistem imun spesifik atau adaptif dan hanya memiliki sistem imun non-spesifik atau bawaan (innate). Sel efektor dari sistem kekebalan tubuh pada krustasea adalah sel-sel darah atau hemosit sementara hepatopankreas bertanggung jawab untuk biosintesis beberapa faktor humoral (Rowley dan Pope 2012).
7
Gambar 2. Klasifikasi hemosit: hialin (a); semi granular (b); dan granular (c) (Martines 2007).
8
Gambar 4. Tahapan pembuatan ubi jalar Persiapan ubi jalar varietas sukuh
Pengupasan
Pengirisan
Pengeringan pada suhu 55oC
Penggilingan dengan willey mill
Pengayakan 60 mesh
9
Tahapan selanjutnya adalah ekstraksi oligosakarida/prebiotik dengan etanol. Prosedur kerja yang dilakukan adalah sebagai berikut: sebanyak 10 gram tepung ubi jalar disuspensikan ke dalam 100 ml etanol 70% dan diaduk selama 15 jam menggunakan magnetic stirer pada suhu ruang. Setelah itu dilakukan penyaringan menggunakan kertas saring dan residu dicuci dengan etanol 70%. Filtrat yang diperoleh dipekatkan menggunakan evaporator vakum pada suhu 40oC. Hasil pemekatan disentrifus pada 2000 rpm selama 10 menit untuk mengendapkan kotoran dan padatan sehingga ekstrak mudah disterilisasi dengan membran steril 0,2 µm (Muchtadi 1989).
Hasil ekstraksi oligosakarida tersebut dilakukan penghitungan total padatan terlarut (Apriyantono 1989). Prosedur penghitungan total padatan terlarut adalah sebagai berikut: cawan porselen dikeringkan selama dua jam dalam oven bersuhu 100oC, kemudian didinginkan dalam desikator hingga diperoleh berat tetap. Cawan tersebut kemudian ditimbang (a gram). Sebanyak 1 ml ekstrak kasar oligosakarida ditempatkan ke dalam cawan porselen tersebut dan ditimbang berat larutan ekstrak kasar oligosakarida (b gram). Cawan yang telah berisi ekstrak kasar oligosakarida kemudian ditempatkan dalam oven selama sehari semalam. Setelah kering, cawan berisi sampel ekstrak kasar oligosakarida didinginkan dalam desikator selama 10 menit atau hingga berat cawan stabil. Berat cawan yang berisi ekstrak kering kemudian diukur (c gram). Total padatan terlarut dihitung dari hasil perbandingan berat ekstrak setelah dikeringkan dengan berat ekstrak sebelum dikeringkan dan dikalikan 100%.
TPT = x 100%
Analisis Kandungan Oligosakarida
10
Persiapan Probiotik
Bakteri probiotik yang digunakan adalahVibrio alginolitycus SKT-b yang telah diberi penanda resisten antibiotik rifampicin (Widanarniet al. 2003) sebagai penanda molekuler untuk membedakan bakteri yang diinokulasikan dengan bakteri yang telah ada pada media pemeliharaan serta tubuh udang. Isolat SKT-b resisten rifampicin (SKT-bR) tersebut kemudian dikultur ulang dan dimurnikan lalu dilakukan re-karakterisasi dan total plate count (TPC). Sebelum digunakan isolat SKT-bR dikultur dalam 25 ml media SWC (Sea Water Complete) cair (Lampiran 1) selama 18 jam dalamwater shakerpada suhu 29oC.
Persiapan Stok Virus IMNV
Jenis virus yang digunakan pada penelitian ini adalah IMNV yang diperoleh dari udang vaname yang telah terinfeksi virus IMNV yang berasal dari Balai Pengembangan Budidaya Air Payau (BPBAP) Situbondo dan telah dikonfirmasi dengan PCR positif IMNV dengan ciri-ciri gejala klinis ekor udang berwarna merah muda (Lampiran 2). Udang tersebut lalu dibersihkan dan diambil bagian dagingnya. Kemudian daging udang dicacah hingga halus lalu ditambahkan larutan PBS dengan perbandingan 1:10 (w/v) kemudian dihomogenkan. Setelah itu disentrifuse dengan kecepatan 6500 rpm pada suhu 4oC selama 20 menit. Selanjutnya supernatan disaring denganfilter mess size0,45 µm. Ekstrak virus hasil filtrasi kemudian disimpan pada freezer suhu -70oC (Rodriguezet al. 2007).
PersiapanVibrio harveyi
Jenis bakteri yang digunakan adalah Vibrio harveyi MR 5339 yang telah diberi penanda resisten terhadap antibiotik rifampicin sebagai penanda molekuler untuk membedakan bakteri yang diinokulasikan dengan bakteri yang telah ada pada media pemeliharaan serta tubuh udang. IsolatV. harveyididapat dari koleksi Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Institut Pertanian Bogor. Isolat bakteri tersebut dikultur ulang dan dimurnikan kemudian dilakukan re-karakterisasi dan total plate count (TPC). Isolat V. harveyi yang digunakan dikultur dalam 25 ml media SWC cair selama 18 jam dalam water shaker pada suhu 29oC.
Pengujian Sinbiotik secaraIn Vivo
Persiapan Hewan Uji dan Media Pemeliharaan
11
benur dipelihara terlebih dahulu selama 14 hari hingga ukuran rata-rata 0,3±0,03 g. Wadah yang digunakan berupa akuarium sebanyak 15 buah yang telah didesinfeksi dengan menggunakan klorin sebanyak 30 ppm kemudian setelah 24 jam diberikan Na-thiosulfat sebanyak 15 ppm dan diaerasi. Akuarium yang digunakan berukuran 60x30x40cm3 dengan volume air 30 liter dan kepadatan udang 15 ekor/akuarium. Kualitas air dalam akuarium selama perlakuan dipertahankan stabil dengan penyiponan dan pergantian air setiap hari sebanyak 10%. Kualitas air selama penelitian adalah temperatur 28-29oC, salinitas 29-32 ppt, oksigen terlarut 4,5-6,5 mg/l; pH 7,4-7,5; dan ammonia-nitrogen 0,005-0,016 mg/l.
Persiapan Pakan Uji
Pakan yang digunakan pada penelitian ini berupa pelet komersil dengan kandungan protein sebesar 40%. Pakan uji dibuat dengan menambahkan sinbiotik pada pakan udang dengan mencampurkan sinbiotik 1 dosis (1% probiotik + 2% prebiotik) dan putih telur sebanyak 2% sebagai bahan perekat, pakan kontrol ditambahkan dengan 2% putih telur tanpa penambahan sinbiotik (Nurhayati et al. 2014).
Aplikasi Sinbiotik pada Udang Vaname
Aplikasi sinbiotik melalui pakan dilakukan selama 30 hari menggunakan rancangan acak lengkap (RAL) yang terdiri dari lima perlakuan dengan tiga ulangan (Tabel 2). Udang diberi pakan sebanyak 4 kali dalam sehari (pukul 08.00, 12.00, 16.00 dan 20.00 WIB) denganfeeding ratesebesar 10-12% berat biomassa. Tabel 2. Perlakuan pemberian sinbiotik dengan frekuensi berbeda dan uji tantang
dengan ko-infeksi IMNV danV. harveyi
Perlakuan Keterangan
Kontrol - Pemberian pakan tanpa sinbiotik dan tanpa ko-infeksi oleh IMNV danV. harveyi
Kontrol + Pemberian pakan tanpa sinbiotik dengan ko-infeksi IMNV dan V. harveyi
P1 Pemberian pakan dengan sinbiotik setiap hari serta ko-infeksi IMNV danV. harveyi
P2 Pemberian pakan dengan sinbiotik tiga hari sekali serta ko-infeksi IMNV danV. harveyi
P3 Pemberian pakan dengan sinbiotik tujuh hari sekali serta ko-infeksi IMNV danV. harveyi
Uji Tantang
Uji tantang dilakukan pada akhir perlakuan sinbiotik, dimaksudkan untuk menguji kinerja sinbiotik terhadap resistensi udang vaname yang diinfeksi oleh IMNV danV. harveyi. Pengamatan uji tantang dilakukan selama tujuh hari setelah infeksi IMNV.
12
V. harveyi (kecuali kontrol negatif). Infeksi dilakukan dengan cara injeksi secara intramuskular pada bagian punggung antara segmen kedua dan ketiga sebanyak masing-masing 100 µl (Selvin dan Lipton 2003). Sebelum digunakan ekstraksi IMNV dicampur dengan PBS sebanyak 1:1. Kepadatan bakteri V. harveyi yang digunakan adalah 103CFU/ml (LD50).
Penghitungan Populasi Bakteri di Usus
Penghitungan jumlah bakteri di usus dilakukan pada akhir perlakuan sinbiotik (hari ke-30). Penghitungan jumlah bakteri dalam usus udang terdiri dari total viable bacterial count(TBC),total presumptive vibrio count(TVC) dantotal SKT-bR count. Usus diambil sebanyak 0,1 g yang dikumpulkan dari 3-5 ekor udang kemudian dihomogenkan dalam larutan phosphat buffer saline (PBS) sebanyak 0,9 ml. Penghitungan bakteri menggunakan metode hitung cawan sebar, dengan menggunakan media SWC (Sea Water Complete) agar untuk perhitungan TBC, media spesifik TCBS (Thiosulfate Citrate Bilesalt Sucrose) agar untuk perhitungan TVC dan media spesifik TCBS-rif agar (50 µg/ml) untuk perhitungan SKT-bR.
Parameter Pertumbuhan
Laju Pertumbuhan Harian
Laju pertumbuhan harian (LPH) diukur pada akhir perlakuan sinbiotik selama 30 hari. Menurut Huissman (1987), laju pertumbuhan harian dapat dihitung dengan menggunakan rumus berikut:
α = 1 x 100%
Keterangan:
α = Laju pertumbuhan harian (%)
Wt = Bobot rata-rata udang pada akhir penelitian (gram) Wo = Bobot rata-rata udang pada awal penelitian (gram) t = Periode pemeliharaan
Rasio Konversi Pakan
Rasio konversi pakan (FCR) diukur pada akhir perlakuan sinbiotik selama 30 hari. Menurut Zonneveld et al. (1991), rasio konversi pakan selama penelitian dapat dihitung dengan menggunakan rumus sebagai berikut:
FCR =( + ) Keterangan:
FCR = Rasio konversi pakan F = Jumlah pakan (gram)
13
Bm = Biomassa udang yang mati (gram)
Bo = Biomassa udang pada awal penelitian (gram)
Parameter Respon Imun
Hemosit Total
Hemosit total diukur pada akhir perlakuan sinbiotik (sebelum uji tantang) dan setelah uji tantang. Hemosit total diamati dengan langkah-langkah berikut hemolim udang diambil sebanyak 0,1 ml dari pangkal kaki renang pertama dengan menggunakan jarum suntik yang sudah berisi 0,3 ml antikoagulan Na-sitrat 3,8%, Campuran yang diperoleh kemudian dihomogenkan dan diteteskan ke haemositometer setelah tetesan pertama dibuang, selanjutnya jumlah sel per ml diamati di bawah mikroskop dengan pembesaran 400 kali (Sang et al. 2009). Hemosit total dihitung dengan menggunakan rumus:
THC = rata-rata jumlah sel terhitung x 1 x FP
Keterangan: FP = faktor pengencer Diferensial Hemosit
Diferensial hemosit diukur pada akhir perlakuan sinbiotik (sebelum uji tantang) dan setelah uji tantang. Hemolim udang yang telah diambil diteteskan pada gelas objek dan dibuat preparat ulas, kemudian dikering udarakan lalu difiksasi dengan metanol 100% selama 5 menit. Setelah itu dikering udarakan kembali lalu diwarnai dengan larutan Giemsa 10% selama 10 menit (Sang et al. 2009). Preparat diamati dengan menggunakan mikroskop dan dibedakan jumlah sel hialin dan granular. Persentase hemosit dihitung dengan menggunakan rumus:
Jenis sel hemosit (%) = x 100%
AktivitasPhenoloxidase
14
yang terdiri dari 100 µl larutan sel, 50 µl cacodylate buffer (untuk mengganti trypsin), dan 50 µl L-DOPA, digunakan untuk kontrol aktivitas phenoloxidase semua larutan yang diuji. Optical density aktivitas phenoloxidase udang yang diuji diekpresikan oleh bentuk dopachrome 100 µl hemolim (Hsiehet al. 2008). AktivitasRespiratory Burst
Pengukuran aktivitas respiratory burst dilakukan pada akhir perlakuan sinbiotik (sebelum uji tantang) dan setelah uji tantang. Aktivitasrespiratory burst hemosit dihitung dengan menggunakan reduksi Nitroblue Tetrazolium (NBT) menjadi formazan dalam kadar negatif superoxide (Chenget al. 2004). Sebanyak 100 µl hemolim yang telah diberikan antikoagulan dimasukan kedalam tube, kemudian diinkubasi selama 30 menit pada suhu ruang. Tube kemudian disentrifuge 3000 rpm selama 20 menit. Plasma dibuang dan 100 µl zymosan (0,3% dalam modifikasi larutan Hank’s Balanced Salt lengkap 10 mM calcium
chloride; 3 mM magnesium chloride dan 5 mM magnesium sulfate) ditambahkan dan dibiarkan bereaksi selama 2 jam pada suhu ruang. Setelah itu, disentrifus 3000 rpm selama 10 menit dan supernatan dibuang, lalu hemosit dicuci dua kali dengan menggunakan 100 µl methanol 70% lalu dikering udarakan. Pellet yang terbentuk dilarutkan kedalam 120 µl, 2 M KOH dan 140 µl dimethyl sulfoxide (DMSO). Optical density diatur pada 630 nm menggunakan microplate reader. Respiratory burstdiekspresikan sebagai NBT-reduction dalam 10 µl hemolim.
Sintasan
Sintasan udang vaname diamati pada akhir perlakuan sinbiotik selama 30 hari (sebelum uji tantang) dan setelah uji tantang, dengan menggunakan rumus (Soleimaniet al. 2012) sebagai berikut:
Survival= x 100% Keterangan:
Nf = Jumlah udang pada akhir penelitian (ekor) No = Jumlah udang pada awal penelitian (ekor)
Pengujian Udang Terinfeksi IMNV danV. harveyi
15
Analisis Data
Data performa pertumbuhan (laju pertumbuhan spesifik harian dan rasio konversi pakan) dan respon imun (hemosit total, diferensial hemosit, aktivitas phenoloxidase dan aktivitas respiratory burst) dan sintasan yang diperoleh diuji secara statistik (α=0,05) dengan menggunakan software statistik SPSS 16 dan apabila berbeda nyata dilanjutkan dengan uji beda nyata Duncan. Data kandungan oligosakarida dan populasi bakteri di usus diuji secara deskriptif.
4.
HASIL DAN PEMBAHASAN
Oligosakarida Ubi Jalar Varietas Sukuh
Hasil uji kandungan oligosakarida tepung kukus ubi jalar varietas sukuh dengan HPLC menunjukkan bahwa ubi jalar varietas sukuh mengandung FOS, GOS dan inulin (Tabel 3). Ubi jalar diketahui mengandung oligosakarida yang tidak dapat dicerna (Non Digestible Oligosaccharides) yang dapat berfungsi sebagai prebiotik (Marlis 2008).
Tabel 3. Hasil analisis oligosakarida ubi jalar varietas sukuh dengan HPLC
No. Parameter Unit Hasil
1. FOS g/100 g 1.015
2. GOS g/100 g 1.488
3. Inulin g/100 g 1.115
FOS, GOS dan inulin merupakan prebiotik yang biasa digunakan pada akuakultur. FOS dapat difermentasikan oleh bakteri tertentu yang dapat menghasilkan enzim pemecah FOS seperti lactobacillus dan bifidobacter (Delgado et al. 2011). Pakan yang ditambah dengan FOS dapat mendukung pertumbuhan dan kelangsungan hidup bakteri dalam saluran GI inang. Selanjutnya penambahan FOS dan inulin dalam pakan telah menunjukkan peningkatan pertumbuhan dan/atau kelangsungan hidup hewan air.
16
Inulin adalah oligosakarida yang biasa digunakan sebagai prebiotik pada manusia atau pakan hewan. Inulin memiliki banyak manfaat dalam akuakultur diantaranya dapat menstimulasi mikroba baik dalam usus, menekan patogen dan meningkatkan sistem imun, walaupun dalam dosis tinggi mungkin berdampak negatif pada morfologi usus (Ringoet al. 2010).
Penghitungan Populasi Bakteri di Usus Udang
Jumlah bakteri total (TBC), bakteri Vibrio total (TVC) dan bakteri probiotik SKT-bR total di usus udang setelah pemberian pakan perlakuan selama 30 hari disajikan pada Tabel 4.
Tabel 4. Penghitungan populasi bakteri di usus udang (L.vannamei) Perlakuan Bakteri Total
Keterangan: P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari sekali; P3: pemberian sinbiotik tujuh hari sekali.
Pemberian sinbiotik selama 30 hari meningkatkan jumlah bakteri di dalam usus udang. Peningkatan jumlah bakteri tidak hanya terjadi pada jumlah bakteri total pada usus udang namun juga jumlah bakteri Vibrio dan probiotik SKT-bR. Hal ini ditunjukkan oleh jumlah bakteri pada perlakuan sinbiotik lebih tinggi dibandingkan dengan kontrol.
Menurut Ai et al. (2011), bakteri pada saluran pencernaan mengambil bagian dalam dekomposisi nutrisi, memberikan makroorganisme dengan bahan aktif secara fisiologis seperti enzim, asam amino dan vitamin, dengan demikian memfasilitasi pemanfaatan pakan dan pencernaan. Pemberian sinbiotik meningkatkan fungsi dan jumlah dari bakteri menguntungkan dalam usus (Delgado et al. 2011). Menurut Daniels et al. (2010) pemberian MOS pada lobster menyebabkan bakteri pada gastrointestinal lebih stabil dibandingkan dengan perlakuan yang tidak diberikan MOS. Pemberian probiotik secara live-sprayed dan freeze-dried pada ikan meningkatkan bakteri asam laktat total pada usus ikan (Panigrahiet al. 2005). Liet al. (2009), melaporkan bahwa peningkatan dosis pemberian probiotikBacillus dan isomaltooligosakarida (IMO) pada udang vaname menurunkan jumlah bakteri Vibrio pada usus udang, namun hal ini meningkatkan imunomudulatory udang tersebut. Aplikasi sinbiotik dapat memaksimalkan pakan yang tertelan diubah lebih efektif menjadi protein struktural yang kemudian dapat meningkatkan pertumbuhan (Cerezuela et al. 2011).
17
Gambar 5. Laju pertumbuhan harian udang (LPH) selama 30 hari pemberian sinbiotik. Data (mean±SE) dengan huruf berbeda menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari sekali; P3: pemberian sinbiotik tujuh hari sekali.
b b a ab ab
0.00 1.00 2.00 3.00 4.00 5.00 6.00 7.00 8.00
K (-) K (+) P1 P2 P3
L
P
H
(%
)
18
Gambar 6. Rasio konversi pakan (FCR) selama 30 hari pemberian sinbiotik. Data (mean±SE) dengan huruf berbeda menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari sekali; P3: pemberian sinbiotik tujuh hari sekali.
a
a
b ab ab
0.00 0.50 1.00 1.50 2.00 2.50
K (-) K (+) P1 P2 P3
F
C
R
19
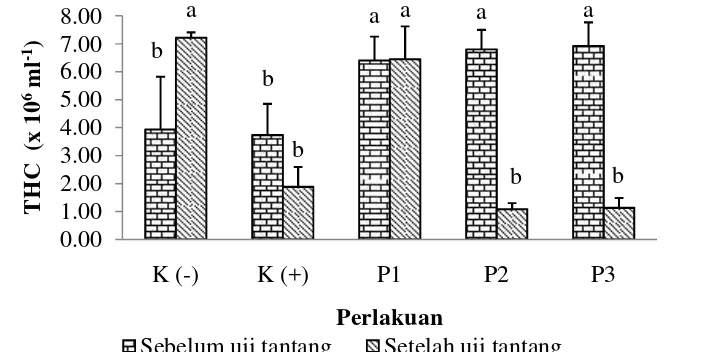
Gambar 7. Hemosit total (THC) udang (L. vannamei) sebelum uji tantang (akhir perlakuan sinbiotik) dan setelah uji tantang. Data (mean±SE) dengan huruf berbeda pada warna yang sama menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari sekali; P3: pemberian sinbiotik tujuh hari sekali.
b
20
Gambar 8. Sel hialin total udang (L. vannamei) sebelum uji tantang (akhir perlakuan sinbiotik) dan setelah uji tantang. Data (mean±SE) dengan huruf berbeda pada warna yang sama menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari sekali; P3: pemberian sinbiotik tujuh hari sekali.
a a a ab a a a
b b ab
0.0 10.0 20.0 30.0 40.0 50.0 60.0 70.0 80.0
K (-) K (+) P1 P2 P3
S
el
h
ial
in
(
x
10
6m
l
-1)
Perlakuan
21
Gambar 9. Sel granular total udang (L. vannamei) sebelum uji tantang (akhir perlakuan sinbiotik) dan setelah uji tantang. Data (mean±SE) dengan huruf berbeda pada warna yang sama menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari sekali; P3: pemberian sinbiotik tujuh hari sekali.
a a
a a a
b
ab a a ab
0.0 10.0 20.0 30.0 40.0 50.0 60.0
K (-) K (+) P1 P2 P3
S
el
gr
an
u
lar
(
x 10
6m
l
-1)
Perlakuan
22
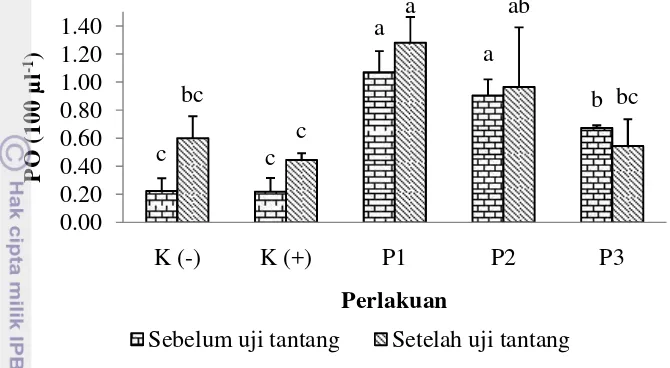
Gambar 10. Aktivitas phenoloxidase (PO) udang (L. vannamei) sebelum uji tantang (akhir perlakuan sinbiotik) dan setelah uji tantang. Data (mean±SE) dengan huruf berbeda pada warna yang sama menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari sekali; P3: pemberian sinbiotik tujuh hari sekali.
c c
a
a
b bc
c
a ab
bc
0.00 0.20 0.40 0.60 0.80 1.00 1.20 1.40
K (-) K (+) P1 P2 P3
P
O
(
100 µ
l
-1)
Perlakuan
23
Gambar 11. Aktivitas respiratory burst (RB) udang (L. vannamei) sebelum uji tantang (akhir perlakuan sinbiotik) dan setelah uji tantang. Data (mean±SE) dengan huruf berbeda pada warna yang sama menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari sekali; P3: pemberian sinbiotik tujuh hari sekali.
ab c ab a ab b
b
a
b b
0.00 0.10 0.20 0.30 0.40
K (-) K (+) P1 P2 P3
R
B
(
10 µ
l
-1)
Perlakuan
24
Gambar 12. Sintasan udang (L. vannamei) sebelum uji tantang (akhir perlakuan sinbiotik) dan setelah uji tantang. Data (mean±SE) dengan huruf berbeda pada warna yang sama menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari sekali; P3: pemberian sinbiotik tujuh hari sekali.
a a a a a a
c
ab ab b
0.0 20.0 40.0 60.0 80.0 100.0
K (-) K (+) P1 P2 P3
S
in
tas
an
(
%
)
Perlakuan
25
Gambar 13. Gejala klinis IMNV pada udang (L.vannamei). Udang normal (a); Putih lebam pada jaringan bagian abdomen (b); Ekor udang berwarna merah (jaringan mati) (c).
26
5.
SIMPULAN DAN SARAN
Simpulan
Pemberian pakan dengan penambahan sinbiotik setiap hari memberikan hasil terbaik pada performa pertumbuhan dan respon imun terutama pada parameter jumlah hemosit (THC) dan aktivitas phenoloxidase (PO). Selain itu, penambahan sinbiotik setiap hari juga menghasilkan resistensi terbaik terhadap ko-infeksi IMNV danV. harveyidibandingkan dengan kontrol positif.
Saran
Perlu dilakukan penelitian lanjutan untuk penerapan aplikasi sinbiotik melalui pakan pada skala lapangan.
DAFTAR PUSTAKA
Ai Q, Xu H, Mai K, Xu W, Wang J, Zhang W. 2011. Effects of dietary supplementation of Bacillus subtilis and fructooligosaccharide on growth performance, survival, non-specific immune response and disease resistance of juvenile large yellow croaker, Larimichthys crocea. Aquaculture 317: 155-161.
Apriyantono A, Fardiaz D, Puspitasari NL, Sedarnawati, Budiyanto S. 1989. Petunjuk Laboratorium Analisis Pangan. Bogor: IPB Press
Arisa II. 2011. Pemberian probiotik, prebiotik dan sinbiotik untuk meningkatkan respon imun udang vaname (Litopenaeus vannamei) terhadap infeksiVibrio Harveyi. [Tesis]. Bogor: Sekolah Pascasarjana Institut Pertanian Bogor. Cano-Gomez A, Bourne DG, Hall MR, Owens L, Hoj L. 2009. Molecular
identification, typing and tracking ofVibrio harveyi in aquaculture systems: current methods and future prospects.Aquaculture287:1-10.
Cerezuela R, Meseguer J, Esteban MA. 2011. Current knowledge in synbiotic use for fish aquaculture: a review. Journal Aquatic Research Development. doi.org/10.4172/2155-9546.S1-008.
Chang, YP, Liu CH, Wu CC, Chiang CM, Lian JL, Hsieh SH. 2012. Dietary administration of zingeronento enhance growth, non-specific immune response, and resistance to Vibrio alginolyticus in Pasific white shrimp (Litopenaeus vannamei) juveniles. Fish and Shellfish Immunology 32:284-290.
27
Chiu CH, Cheng CH, Gua WR, Guu YK, Cheng W. 2010. Dietary administration of the probiotic, Saccharomyces cerevisiae P13, enhanced the growth, innate immune responses, and disease resistance of the grouperEpinephelus coioides.Fish and Shellfish Immunology29: 1053-1059.
Costa AM, Buglione CC, Bezerra FL, Martins PCC, Barraco MA. 2009. Immune assessment of farm-reared penaeus vannamei shrimp naturally infected by IMNV in NE Brazil.Aquaculture291: 141-146.
Daniels CL, Merrifield DL, Boothroyd DP, Davies SJ, Factor JR, Arnold KE. 2010. Effect of dietary bacillus spp. and mannan oligosaccharides (MOS) on European Lobster (Homarus gammarus L) larvae growth performance, gut morphology and gut microbiota.Aquaculture304: 49-57.
Delgado GTC, Tamashiro WMSC, Junior MRM, Moreno YMF, Pastore GM. 2011. The putative effects of prebiotics as immunomodulatory agents.Food Research International44: 3167-3173.
Diaz-Rosales P, Arijo S, Chabrillon M, Alarcon FJ, Tapia-Paniaqua ST, Martinez-Manzanares E, Balebona MC, Morinigo MA. 2009. Effect of two closely related probiotics on respiratory burst activity of Senegalese sole (Solea senegalensis, Kaup) phagocytes and protection against Photobacterium damselaesubsp.Piscicida.Aquaculture293: 16-21.
FAO. 2007. FAO Technical meeting on prebiotics.
www.fao.org/ag/agn/agns/index.en.stm.
Feijo RG, Kamimura MT, Oliveira-Neto JM, Vila-Nova CMVM, Gomes ACS, Coelho MGL, Vasconcelos RF, Gesteira TCV, Marins LF, Maggioni R. 2013. Infectious myonecrosis virus and white spot syndrome virus co-infection in Pacific white shrimp (Litopenaeus vannamei) farmed in Brazil. Aquaculture380-383:1-5.
Flegel TW, Nielsen L, Thamavit V, Kongtim S, Pasharawipas T. 2004. Presence of multiple viruses in non-diseased, cultivated shrimp at harvest. Aquaculture240: 55-68.
Garrity GM, Bell JA. Lilburn TG. 2004. Taxonomic outline of the prokaryotes bergey’s manual® of systematic bacteriology, Second Edition. Michigan State University. doi:10.1007/bergeysoutline200405.
Grisdale-Helland B, Helland SJ, Gatlin III DM. 2008. The effect of dietary supplementation with mannanoligosaccharide, fructooligosaccharide or galactooligosaccharide on the growth and feed utilization of Atlantic salmon (Salmon salar).Aquaculture283:161-167.
Hasan A. 2011. Ko-infeksi Infectious Myonecrosis Virus (IMNV) dan Vibrio harveyi pada udang vaname (Litopenaeus vannamei). [Thesis]. Bogor: Sekolah Pascasarjana Institut Pertanian Bogor.
Hauton C. 2012. The scope of the crustacean immune system for disease control. Journal of Invertebrate Pathology110; 251-260.
Hoseinifar SH, Khalili M, Rostami HK, Esteban MA. 2013. Dietary galactooligosaccharides affects intestinal microbiota, stress resistance, and performance of Caspian roach (Rutilus rutilus) fry. Fish and Shellfish Immunology35:1416-1420.
28
Huisman EA. 1987.Principles of fish production. Netherland: Department of Fish Culture and Fisheries. Waganingen Agriculture University.
Johansson MW, Keyser P, Sritunyalucksana K, Soderhall K. 2000. Crustacean haemocytes and haematopoiesis.Aquaculture191: 45-52.
KKP. 2013. Produksi udang ditargetkan 200000 ton. Tersedia pada:
http://www.kkp.go.id/index.php/arsip/c/9120/.
Produksi-Udang-Ditargetkan-200.000-Ton/. [Internet] [diunduh 2013 Juni 4]. Jakarta.
Kongnum K, Hongpattarakere T. 2012. Effect ofLactobacillus plantarumisolated from digestive tract of wild shrimp on growth and survival of white shrimp (Litopenaeus vannamei) challenged with Vibrio harveyi. Fish and Shellfish Immunology32:170-177.
Lesmanawati W. 2013. Aplikasi sinbiotik pada udang vaname Litopenaeus vannamei: resistensi terhadap Infectious Myonecrosis Virus dan performa pertumbuhan. [Thesis]. Bogor: Sekolah Pascasarjana Institut Pertanian Bogor.
Li J, Tan B, Mai K. 2009. Dietary probiotic Bacillus OJ and isomaltooligosaccharides influence the intestine microbial populations, immune responses and resistance to white spot syndrome virus in shrimp (Litopenaeus vannamei). Aquaculture291: 35-40.
Lightner DV, Redman RM, Pantoja CR, Tang KJF, Noble BL, Schofield P, Mohney LL, Nunan LM, Navarro SA. 2012. Historic emergence, impact and current status of shrimp pathogens in the Americas. Articles in Press. Journal of Invertebrate Pathology.doi.org/10.1016/j.jip.2012.03.006. Lisal JS. 2005. Konsep probiotik dan prebiotik untuk modulasi mikrobiota usus
besar.Jurnal Medical Nusantara26:256-262.
Liu CH, Chen CJ. 2004. Effect of ammonia on the immune response of white shrimp Litopenaeus vannamei and its susceptibility to Vibrio alginolyticus. Fish and Shellfish Immunology16: 321-334.
Marlis A. 2008. Isolasi oligosakarida Ubi Jalar (Ipomoea batatas L.) dan pengaruh pengelolaan terhadap potensi prebiotiknya. [Thesis]. Bogor: Sekolah Pascasarjana Institut Pertanian Bogor.
Martines FS. 2007. The immune system of shrimp. Boletines Nicovita Alimentando tu Confianza. www.nicovita.com.pe.
Merrifield DL, Dimitroglou A, Foey A, Davis SJ, Baker RTM, Bøgwald J, Castex M, Ringø, E. 2010. The current status and future focus of probiotic and prebiotics applications for salmonids. Review.Aquaculture302: 1-8.
Muchtadi D. 1989. Evaluasi nilai gizi pangan. Bogor: Depdikbud. Ditjen Dikti-PAU IPB.
Nayak SK. 2010. Probiotics and immunity: a fish perspective. review. Fish and Shellfish Immunologi29: 2-14.
Nurhayati D, Widanarni, Yuhana M. 2014. Effect of dietary probiotic SKT-b and oligosaccharide from sweet potato (Ipomoea batatas L) on growth performance, immune responses and resistance to co-infection with IMNV and Vibrio harveyi in white shrimp Litopenaeus vannamei. Biotropia, forthcoming.
29
Phuoc LH, Corteel M, Thanh NC, Nauwynck H, Pensaert M, Alday-Sanz V, den Broeck WY, Sorgeloos P, Bossier P. 2009. Effect of dose and challenge routes of Vibrio spp. on co-infection with white spot syndrome virus in penaeus vannamei.Aquaculture290: 61-68.
Poulos BT, Tang KFJ, Pantoja CR, Bonami JR, Lightner DV. 2006. Purification and characterization of infectious myonecrosis virus of penaeid shrimp. Journal of General Virology87: 987-996.
Pyng Yeh S, Nan Chen Y, Hsieh SL, Cheng W, Liu CH. 2009. immune response of white shrimp Litopenaeus vannamei after a concurrent infection with white spot syndrome virus and infectious hypodermal and hematopoietic necrosis virus.Fish and Shellfish Immunology26: 582-588.
Ringo E, Olsen RE, Gifstad TO, Dalmo RA, Amlund H, Hemre G-I, Bakke AM. 2010. Prebiotic in aquaculture: a review.Aquaculture Nutrition16:117-136. Rodriguez J, Espinosa Y, Echeverria F, Cardenas G, Roman R, Stern S. 2007.
Exposure to probiotics and β-1,3/1,6-glucans in larviculture modifies the
immune responses of Penaeus vannamei juveniles and both the survival to white spot syndrome virus challenge and pond culture. Aquaculture 273: 405-415
Rowley A, Pope EC. 2012. Vaccines and crustacean aquaculture-a mechanistic exploration.Aquaculture334-337: 1-11.
Sahoo PK, Pillai BR, Mohanty J, Kumari J, Mohanty S, Mishra BK. 2007.In vivo humoral and cellular reaction, and fate of injected bacteria Aeromonas hydrophila in freshwater prawn Macrobrachium rosenbergii. Fish and Shellfish Immunology23:327-340.
Sang HM, Ky LT, Fotedar R. 2009. Dietary supplementation of mannan oligosaccharide improves the immune responses and survival of marron, Cherax tenuimanus(Smith, 1912) when challenged with different stressors. Fish and Shellfish Immunology27:341-348.
Schrezenmeir J, Vrese M. 2001. Probiotics, prebiotics, and synbiotics—
approaching a definition. The American Journal of Clinical Nutrition 73: 361S-364S.
Selvin J, Lipton AP. 2003.Vibrioalginolyticusassociated with white spot disease ofPenaeus monodon.Disease of Aquatic Organisms57: 147-150.
Senapin S, Phewsaiya K, Briggs M, Flegel TW. 2007. Outbreaks of infectious myonecrosis virus (IMNV) in Indonesia confirmed by genome sequencing and use of an alternative RT-PCR detection method. Aquaculture 266: 32-38.
Septiani GR. 2011. Pemberian sinbiotik dengan frekuensi berbeda pada pakan udang vaname Litopenaeus vannamei untuk pencegahan IMNV (Infectious Myonecrosis Virus). [Skripsi]. Bogor: Departemen Budidaya Perairan. FPIK Institut Pertanian Bogor.
Smith VJ, Brown JH, Hauton C. 2003. Immunostimulation in crustacean: does it really protect against infection?.Fish and Shellfish Immunology15: 71-90. Soleimani N, Hoseinifar SH, Merrifield DL, Barati M, Abadi ZH. 2012. Dietary
30
Teixeira-Lopes MA, Vieira-Girão PRN, da Cruz Freire JE, Rocha ÍRCB, Costa FHF, Rádis-Baptista G. 2011. Natural co-infection with Infectious Hypodermal and Hematopoietic Necrosis Virus andInfectious Myonecrosis VirusinLitopenaeus vannameiin Brazil.Aquaculture312: 212-216.
Van De Braak CBT, Botterblom MHA, Liu W, Taverne N, Van Der Knaap, Rombout JHWM. 2002. The role of the haematopoietic tissue in haemocyte production and maturation in the black tiger shrimp (Penaeus monodon). Fish and Shellfish Immunology12:253-272.
Verschuere L, Rombaut G, Sorgeloos P, Verstraete W. 2000. Probiotic bacteria as biological control agents in aquaculture. Microbiology and Molecular Biology Reviews64(4): 655-671.
Wang YB. 2007. Effect of Probiotics on growth performance and digestive enzyme activity of the shrimp Penaeus vannamei. Aquaculture 269: 259-264.
Watson AK, Kaspar H, Lategan MJ, Gibson L. 2008. Probiotics in aquaculture: The need, principles and mechanisms of action and screening processes. Aquaculture274: 1-14.
Widanarni, Suwanto A, Sukenda, Lay BW. 2003. Potency of Vibrio isolates for biocontrol of vibriosis in tiger shrimp (Penaeus monodon) Larvae.Biotropia 20: 11-23.
Widanarni, Sukenda, Setiawati M. 2008. Bakteri probiotik dalam budidaya udang: seleksi, mekanisme aksi, karakterisasi dan aplikasinya sebagai agen biokontrol.Jurnal Ilmu Pertanian Indonesia13 (2): 80-89.
Widanarni, Lidaenni MA, Wahjuningrum D. 2010. Pengaruh pemberian bakteri probiotik Vibrio SKT-b dengan dosis yang berbeda terhadap kelangsungan hidup dan pertumbuhan larva udang windu (Penaeus monodonFab.).Jurnal Akuakultur Indonesia9(1): 21-29.
Zhang J, Liu Y, Tian L, Yang H, Liang G, Xu D. 2012. Effects of dietary mannan oligosaccharide on growth performance, gut morphology and stress tolerance of juvenile pacific white shrimp Litopenaeus vannamei. Short
Communication. Fish and Shellfish Immunology
doi;10.1016/j.fsi.2012.05.001.
32
Lampiran 3. Metodetotal p
Lampiran 4. Metode Gores K Koloni Bakteri
Total
Keterangan: fp = Faktor
l plate count
es Kuadran
sampel ml
x fp x
ni 1 1
ktor pengenceran
33
Lampiran 5. Hasil uji statistik dengan SPSS terhadap rasio konversi pakan (FCR) udang uji
FCR
Perlakuan Mean N Std. Deviation
1 1.7600 3 .54617
2 1.7300 3 .24556
3 1.1067 3 .08505
4 1.2233 3 .16773
5 1.3800 3 .15133
Total 1.4400 15 .36627
ANOVA
FCR
Sum of Squares df Mean Square F Sig.
Between Groups 1.044 4 .261 3.132 .065
Within Groups .834 10 .083
Total 1.878 14
FCR
Perlakuan N Subset for alpha = 0.05
1 2
Duncana 3 3 1.1067
4 3 1.2233 1.2233
5 3 1.3800 1.3800
2 3 1.7300
1 3 1.7600
34
Lampiran 6. Hasil uji statistik dengan SPSS terhadap laju pertumbuhan harian udang uji
LPH
Perlakuan Mean N Std. Deviation
1 7.2100 3 .26458
2 7.1833 3 .25106
3 8.1167 3 .11846
4 7.7833 3 .45611
5 7.6567 3 .46004
Total 7.5900 15 .46448
ANOVA
LPH
Sum of Squares df Mean Square F Sig.
Between Groups 1.887 4 .472 4.162 .031
Within Groups 1.133 10 .113
Total 3.020 14
LPH
Perlakuan N Subset for alpha = 0.05
1 2
Duncana 2 3 7.1833
1 3 7.2100
5 3 7.6567 7.6567
4 3 7.7833 7.7833
3 3 8.1167
35
Lampiran 7. Hasil uji statistik dengan SPSS terhadap sintasan udang uji setelah uji tantang
SR
Perlakuan Mean N Std. Deviation
1 1.0000E2 3 .00000
2 46.6667 3 11.54701
3 93.3333 3 5.77350
4 80.0000 3 17.32051
5 73.3333 3 15.27525
Total 78.6667 15 21.66850
ANOVA
SR
Sum of Squares df Mean Square F Sig.
Between Groups 5173.333 4 1293.333 9.238 .002
Within Groups 1400.000 10 140.000
Total 6573.333 14
SR
Perlakuan N Subset for alpha = 0.05
1 2 3
Duncana 2 3 46.6667
5 3 73.3333
4 3 80.0000 80.0000
3 3 93.3333 93.3333
1 3 1.0000E2
36
Lampiran 8. Hasil uji statistik dengan SPSS terhadap total hemosit udang uji sebelum uji tantang
THC
Perlakuan Mean N Std. Deviation
1 3.9333 3 1.88768
2 3.7333 3 1.11505
3 6.4000 3 .85440
4 6.8000 3 .70000
5 6.9233 3 .84506
Total 5.5580 15 1.76747
ANOVA
THC
Sum of Squares df Mean Square F Sig.
Between Groups 30.254 4 7.563 5.610 .012
Within Groups 13.482 10 1.348
Total 43.735 14
THC
Perlakuan N Subset for alpha = 0.05
1 2
Duncana 2 3 3.7333
1 3 3.9333
3 3 6.4000
4 3 6.8000
5 3 6.9233
37
Lampiran 9. Hasil uji statistik dengan SPSS terhadap sel hialin udang uji sebelum uji tantang
Hialin
Perlakuan Mean N Std. Deviation
1 77.5367 3 1.66182
2 75.1400 3 7.16346
3 69.4200 3 12.63207
4 65.9167 3 6.77129
5 64.7333 3 16.13733
Total 70.5493 15 10.06833
ANOVA
Hialin
Sum of Squares df Mean Square F Sig.
Between Groups 379.380 4 94.845 .912 .493
Within Groups 1039.819 10 103.982
Total 1419.199 14
Hialin
Perlakuan N Subset for alpha = 0.05 1
Duncana 5 3 64.7333
4 3 65.9167
3 3 69.4200
2 3 75.1400
1 3 77.5367
38
Lampiran 10. Hasil uji statistik dengan SPSS terhadap sel granular udang uji sebelum uji tantang
Granular
Perlakuan Mean N Std. Deviation
1 22.4633 3 1.66182
2 24.8600 3 7.16346
3 30.5800 3 12.63207
4 34.0833 3 6.77129
5 35.2667 3 16.13733
Total 29.4507 15 10.06833
ANOVA
Granular
Sum of Squares df Mean Square F Sig.
Between Groups 379.380 4 94.845 .912 .493
Within Groups 1039.819 10 103.982
Total 1419.199 14
Granular
Perlakuan N Subset for alpha = 0.05 1
Duncana 1 3 22.4633
2 3 24.8600
3 3 30.5800
4 3 34.0833
5 3 35.2667
39
Lampiran 11. Hasil uji statistik dengan SPSS terhadap aktivitas phenoloxidase udang uji sebelum uji tantang
PO
Perlakuan Mean N Std. Deviation
1 .2250 3 .09000
2 .2200 3 .09644
3 1.0700 3 .15025
4 .9050 3 .11358
5 .6733 3 .01877
Total .6187 15 .36977
ANOVA
PO
Sum of Squares df Mean Square F Sig.
Between Groups 1.808 4 .452 42.454 .000
Within Groups .106 10 .011
Total 1.914 14
PO
Perlakuan N Subset for alpha = 0.05
1 2 3
Duncana 2 3 .2200
1 3 .2250
5 3 .6733
4 3 .9050
3 3 1.0700