APLIKASI SINBIOTIK PADA UDANG VANAME
Litopenaeus
vannamei
: RESISTENSI TERHADAP
INFECTIOUS
MYONECROSIS VIRUS DAN PERFORMA PERTUMBUHAN
WIDA LESMANAWATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Aplikasi Sinbiotik pada Udang Vaname Litopenaeus vanammei: Resistensi terhadap Infectious Myonecrosis Virus dan Performa Pertumbuhan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Maret 2013
Wida Lesmanawati NIM C151100141
RINGKASAN
WIDA LESMANAWATI. Aplikasi Sinbiotik pada Udang Vaname Litopenaeus vanammei: Resistensi terhadap Infectious Myonecrosis Virus dan Performa Pertumbuhan. Dibimbing oleh WIDANARNI dan SUKENDA.
Wabah Infectious Myonecrosis (IMN) telah menyerang budidaya udang vaname di Indonesia dan menyebabkan kematian sampai dengan 70%. Banyak penelitian membuktikan keberhasilan probiotik dalam meningkatkan resistensi udang atau ikan terhadap penyakit dengan cara menekan patogen, meningkatkan imunitas atau memperbaiki kualitas air. Aplikasi prebiotik pada hewan akuatik juga telah menunjukkan berbagai keuntungan. Akan tetapi, kombinasi probiotik dengan prebiotik (sinbiotik) memberikan hasil yang lebih baik dibandingkan bila diaplikasikan secara terpisah. Penelitian ini bertujuan untuk mengevaluasi potensi sinbiotik dari bakteri SKT-b dan oligosakarida hasil ekstraksi dari ubi jalar, untuk meningkatkan resistensi terhadap infeksi penyakit IMN serta performa pertumbuhan udang vaname. Penelitian dilaksanakan pada bulan Mei-September 2012, bertempat di Laboratorium Kesehatan Ikan, Fakultas Perikanan dan Ilmu Kelautan (FPIK) dan Program Diploma, Institut Pertanian Bogor. Penelitian ini meliputi kegiatan persiapan prebiotik (preparasi ubi jalar, ekstraksi dan análisis oligosakarida), persiapan bakteri probiotik (pertumbuhan bakteri SKT-b), uji in vitro dan uji in vivo. Pada uji in vitro dilakukan pengujian kombinasi prebiotik (0, 1, 2 dan 3%) dengan probiotik (107, 108, 109, 1010 cfu ml-1) yang menghasilkan
pertumbuhan bakteri probiotik paling baik. Pada uji in vivo, udang vaname diberi pakan yang telah ditambah probiotik (1010 cfu g pakan-1) dengan berbagai dosis
prebiotik (0, 1, 2, dan 3%) melalui pakan selama 30 hari. Pengukuran parameter untuk pengujian performa pertumbuhan dilakukan pada akhir perlakuan, meliputi laju pertumbuhan spesifik, efisiensi pakan, retensi nutrien (protein dan lemak) dan aktivitas enzim pencernaan (protease dan amilase). Sedangkan pada pengujian resistensi terhadap IMN, udang perlakuan diinfeksi dengan virus IMN (IMNV) melalui injeksi dan pengamatan dilakukan selama 10 hari. Parameter yang diamati meliputi sintasan, gejala klinis, serta parameter imun berupa total hemosit (THC) dan aktivitas phenoloxidase (PO).
Ekstrak etanol ubi jalar yang digunakan dalam penelitian ini mengandung tiga jenis oligosakarida yaitu maltoheptaosa, sukrosa dan rafinosa, dengan konsentrasi total oligosakarida mencapai 64,86%. Bakteri SKT-b berada di puncak pertumbuhannya pada jam ke 16 sebesar 5,9x1010 cfu ml-1. Hasil uji in vitro
menunjukkan bahwa penambahan prebiotik ke media kultur dapat meningkatkan pertumbuhan bakteri SKT-b yang berkorelasi positif dengan peningkatan dosis prebiotik dan peningkatan konsentrasi inokulan. Kombinasi prebiotik dan probiotik yang optimal didapatkan dari penambahan prebiotik 3% dan inokulan bakteri SKT-b konsentrasi 1010 cfu ml-1. Pada uji in vivo, pemberian pakan perlakuan sinbiotik
Perlakuan Pro+Pre 2% dan Pro+Pre 3% mampu meningkatkan nilai total hemosit udang vaname sampai dengan 2 kali total hemosit udang Kontrol pada awal pengamatan. Penurunan jumlah THC setelah infeksi IMNV pada kedua perlakuan tersebut mengindikasikan reaksi cepat terhadap infeksi yang diberikan. Infeksi IMNV menyebabkan peningkatan aktivitas PO pada semua perlakuan sampai akhir pengamatan. Peningkatan aktivitas PO tertinggi terjadi pada perlakuan Pro+Pre 3%. Pemberian pakan sinbotik tidak mempengaruhi laju pertumbuhan, akan tetapi mampu meningkatkan efisiensi pakan udang yang diberi perlakuan Pro+Pre 2% dan Pro+Pre 3%. Hal ini dikarenakan meningkatnya nilai aktivitas enzim protease dan amilase dibandingkan Kontrol, sehingga diduga meningkatkan kecernaan pakan. Nilai retensi protein dan lemak udang pada perlakuan Pro+Pre 2% dan Pro+Pre 3% juga lebih tinggi dibandingkan Kontrol, mengindikasikan penyerapan nutrien yang lebih baik. Secara umum, perlakuan Pro+Pre 2% dan Pro+Pre 3% menunjukkan respon yang lebih baik terhadap peningkatan resistensi pada infeksi IMNV dan performa pertumbuhan udang vaname.
SUMMARY
WIDA LESMANAWATI. Synbiotic Application for Pacific White Shrimp Litopenaeus vannamei: Resistance to Infectious Myonecrosis Virus and Growth Performance. Supervised by WIDANARNI and SUKENDA.
Outbreaks of Infectious Myonecrosis (IMN) attack white shrimp farming in Indonesia and caused death up to 70%. Many studies have shown efficacy of probiotics in improving the resistance of shrimp or fish against disease by suppressing pathogens, while enhancing immunity and or improving water quality. Application prebiotics also has shown a variety of benefits to the aquatic animal. However, the combination of probiotics with prebiotics (synbiotics) showed better results than when it is applied separately. This study aimed to evaluate the potential of synbiotics from SKT-b bacteria and oligosaccharides-extracted from sweet potatoes, in increasing both white shrimp resistance to IMN and their growth performance. The experiment was conducted in Mei-September 2012, held at the Fish Health Laboratory, Faculty of Fisheries and Marine Sciences and the Diploma Programme, Bogor Agricultural University. This study includes the preparation of a prebiotic (sweet potato-extrac preparation and analyzes of oligosaccharides), preparation of probiotic bacteria (SKT-b bacteria growth), in vitro and in vivo tests. In vitro study tested the combination of prebiotics dose 0, 1, 2 and 3% and probiotics 107, 108, 109, 1010 cfu ml-1, that result the best growth of probiotic
bacteria. In in vivo test, the white shrimp was given a feed in which probiotics (1010
cfu g feed-1) with various doses of prebiotics (0, 1, 2, and 3%) added, for 30 days.
Measurement parameters to test the growth performance is conducted at the end of treatment, including specific growth rate, feed efficiency, retention of nutrients (protein and lipid) and the activity of digestive enzymes (protease and amylase). On challenge their resistance to IMN, shrimp was infected with IMN virus (IMNV) through injection and was observed for 10 days. Parameters observation includes survival, clinical symptoms, and immune parameters (total hemocyte [THC] and phenoloxidase [PO] activities).
The ethanol extract of sweet potato used in this study contains three types of oligosaccharide-which are maltoheptaosa, sucrose, and raffinose-with the total concentration of oligosaccharides that reached 64,86%. SKT-b bacteria reached its optimal growth after 16 hours which was 5,9 x1010 cfu ml-1. The results of in vitro
assays showed that the addition of prebiotic in culture medium can increase the growth of SKT-b bacteria which was positively correlated with the escalation of the dose of prebiotics and the concentrations of inoculants. The most optimal combination of prebiotics and probiotics was obtained from the addition of 3% of prebiotics and 1010 cfu ml-1 of SKT-b bacteria inoculant. In in vivo tests, the
synbiotic feeding treatment (Pro+Pre) for 30 days increased shrimp survival and lowered its infection rates to IMNV, along with the increasing doses of prebiotics.
This is because the increased of shrimp’s immunity after the synbiotics treatment
observation. The highest PO activity itself occurred in Pro+Pre 3% treatment. The giving of synbiotic feed does not affect the growth rate. However, it can improve the food efficiency of shrimp with Pro+Pre 2% and Pro+Pre 3% treatment. This is caused by the increase of protease and amylase enzyme activities compared to the controls, which is believed can increase the digestibility of the feed. The retention value of protein and lipid in the shrimp with Pro+Pre 2% and Pro+Pre 3% treatment is also higher than the control, which indicates the better nutrient absorption. In general, Pro+Pre 2% and Pro+Pre 3% treatment showed a better response to both the increase of the resistance to IMNV infection and the growth performance of white shrimp.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
APLIKASI SINBIOTIK PADA UDANG VANAME
Litopenaeus
vannamei
: RESISTENSI TERHADAP INFECTIOUS
MYONECROSIS VIRUS DAN PERFORMA PERTUMBUHAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
Judul Tesis : Aplikasi Sinbiotik pada Udang Vaname Litopenaeus vanammei: Resistensi terhadap Infectious Myonecrosis Virus dan Performa Pertumbuhan
Nama : Wida Lesmanawati NIM : C151100141
Disetujui oleh Komisi Pembimbing
Dr Ir Widanarni, MSi
Ketua Dr Ir Sukenda, MSc Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Prof Dr Enang Harris, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini dapat diselesaikan dengan baik. Karya ilmiah ini berjudul Aplikasi Sinbiotik pada Udang Vaname Litopenaeus vanammei: Resistensi terhadap Infectious Myonecrosis Virus dan Performa Pertumbuhan.
Terima kasih penulis ucapkan kepada Ibu Dr Widanarni dan Bapak Dr Sukenda selaku pembimbing, Ibu Dr Mia Setiawati selaku penguji, Bapak Dr Kukuh Nirmala dan Bapak Prof Dr Enang Harris, atas bimbingan dan saran yang diberikan. Penghargaan turut penulis sampaikan kepada Bapak Prof Dr Zairin Junior dan Bapak Ir Irzal Effendi, MSi selaku Pimpinan Program Diploma Institut Pertanian Bogor. Ungkapan terima kasih juga penulis sampaikan kepada suami, anak-anak, bapak, ibu, adik-kakak tercinta serta seluruh keluarga, atas segala doa dan kasih sayangnya. Penulis sampaikan pula terima kasih dan penghargaan kepada teknisi laboratorium, teman-teman mahasiswa Program Studi Ilmu Akuakultur IPB khususnya angkatan 2010, teman-teman di Program Diploma IPB khususnya PK. IKN, serta semua pihak yang telah membantu secara langsung maupun tidak langsung.
Akhir kata, penulis berharap semoga karya ilmiah ini dapat bermanfaat. Penulis menyadari hasil penelitian dalam karya ilmiah ini bukanlah sebuah kebenaran mutlak karena sangat mungkin berubah seiring berkembangnya ilmu pengetahuan.
Bogor, Maret 2013
DAFTAR ISI
DAFTAR TABEL xiii
DAFTAR GAMBAR xv
DAFTAR LAMPIRAN xvii
1 PENDAHULUAN
1.1 Latar Belakang 1
1.2 Perumusan Masalah 3
1.3 Tujuan Penelitian 3
1.4 Manfaat Penelitian 3
1.5 Hipotesis 3
2 TINJAUAN PUSTAKA
2.1 Probiotik, Prebiotik dan Sinbiotik 4
2.2 Sistem Imunitas Krustasea 5
2.3 Infectious Myonecrosis (IMN) 7
2.4 Ubi Jalar (Ipomoea batatas) 9
3 METODE PENELITIAN
3.1 Waktu dan Tempat 11
3.2 Metode 11
3.2.1 Preparasi, Ekstraksi, dan Analisis Oligosakarida 11 3.2.2 Pertumbuhan Bakteri Probiotik SKT-b 12
3.2.3 Uji Kombinasi Sinbiotik Optimal 13
3.2.4 Uji In Vivo 13
3.3 Prosedur Analisis Data 19
4 HASIL DAN PEMBAHASAN
4.1 Kandungan Oligosakarida dalam Ubi Jalar dan Pakan Komersil 20
4.2 Pertumbuhan Bakteri Probiotik SKT-b 20
4.3 Kombinasi Sinbiotik Optimal 21
4.4 Uji In Vivo 22
4.4.1 Populasi Bakteri Usus Udang 22
4.4.2 Resistensi Udang Vaname terhadap Infeksi IMNV 24
4.4.3 Performa Pertumbuhan 29
4.4.4 Kualitas Air Media Pemeliharaan 32
5 SIMPULAN 33
DAFTAR PUSTAKA 34
LAMPIRAN 39
DAFTAR TABEL
1 Klasifikasi karbohidrat 5
2 Fungsi berbagai tipe sel hemosit pada sistem imunitas krustasea 7 3 Karakteristik sifat biokimia dan fisiologis bakteri probiotik SKT-b 13 4 Pengelompokan tingkat infeksi IMNV terhadap udang vaname
berdasarkan gejala klinis yang muncul 16
5 Perhitungan parameter pengujian performa pertumbuhan: penambahan bobot tubuh (∆ Biomasa), jumlah konsumsi pakan (JKP),
laju pertumbuhan (SGR), efisiensi pakan (EP), retensi nutrien (protein
dan lemak), aktivitas enzim (AE) (protease dan amilase) 18 6 Jenis dan konsentrasi oligosakarida hasil ekstraksi dari tepung kukus
ubi jalar dan pakan udang komersil dengan metode HPLC 20 7 Penambahan bobot tubuh (∆ biomasa), jumlah konsumsi pakan (JKP),
laju pertumbuhan (SGR), efisiensi pakan (EP), retensi nutrien dan sintasan udang vaname yang diberi empat jenis pakan perlakuan
(rerata±simpangan baku, n=40) selama 30 hari 31 8 Kisaran kualitas air media pemeliharaan udang vaname selama 30 hari
DAFTAR GAMBAR
1 Mekanisme pertahanan tubuh nonspesifik pada krustasea 6 2 Klasifikasi sel hemosit: a) hialin, b) semigranular, c) granular 6 3 Mekanisme pertahanan seluler: a) fagositosis, b) enkapsulasi, c)
pembentukan nodul 7
4 Gejala klinis udang vaname yang terinfeksi IMNV 8 5 Bentuk ikosahedral dari IMNV: a) transmisi elektron mikrograf,
fraksi gradien calsium chloride, diwarnai dengan phosphotungstic acid 2%, garis menunjukkan 100 nm, b) Rekonstruksi 3-dimensi
virion IMNV dengan resolusi 8.0-Å 9
6 Varietas ubi jalar yang banyak diminati di North Carolina Sweet
Potato Commission 10
7 Ubi jalar (Ipomoea batatas) berumbi putih yang digunakan sebagai sumber oligosakarida: a) mentah, b) setelah dikukus, diiris tipis dan
dikeringkan, c) tepung, d) larutan stok ekstrak ubi jalar 11 8 Koloni bakteri probiotik SKT-b yang dikultur di media TCBS agar 12 9 Gejala klinis udang yang terinfeksi IMNV. Angka menunjukkan
tingkat infeksi ringan (1), sedang (2), berat (3), dan sangat berat (4) 16 10 Kurva pertumbuhan bakteri SKT-b yang dikultur di media SWC cair
dan dihitung dengan metode total plate count 21 `11 Nilai absorbansi biakan perlakuan kombinasi bakteri SKT-b
konsentrasi 107, 108, 109 dan 1010 cfu ml-1 dengan prebiotik dosis 0%
(kontrol) ( ), 1% ( ), 2% ( ) dan 3% ( ) 22
12 Populasi bakteri dalam usus udang vaname (x107 cfu g usus-1) pada
sebelum (awal) dan setelah 30 hari pemberian pakan perlakuan (n=5) 23 13 Sintasan udang vaname berbagai perlakuan pakan pada hari ke 10
setelah infeksi IMNV (n=15) 25
14 Tingkat infeksi udang vaname berbagai perlakuan sinbiotik pada hari ke 10 setelah infeksi IMNV (n=15). Simbol menunjukkan tingkat infeksi: mati ( ), sangat berat ( ), berat ( ), sedang ( ), ringan
( ) 26
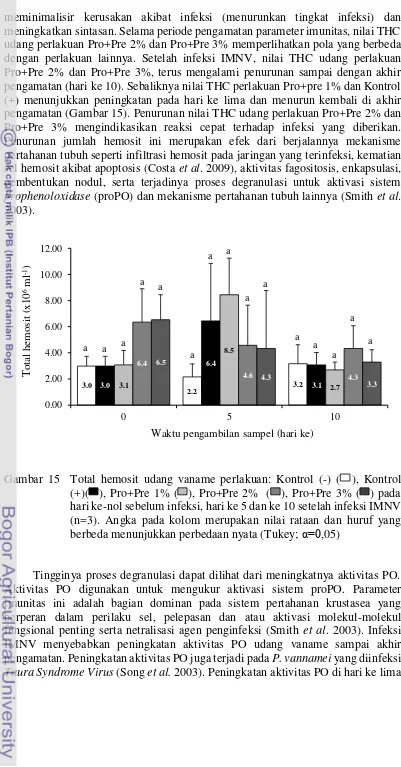
15 Total hemosit udang vaname perlakuan: Kontrol (-) ( ), Kontrol (+) ( ), Pro+Pre 1% ( ), Pro+Pre 2% ( ), Pro+Pre 3% ( ) pada hari
ke 0 sebelum infeksi, hari ke 5 dan ke 10 setelah infeksi IMNV (n=3) 27 16 Aktivitas PO udang vaname perlakuan: Kontrol (-) ( ), Kontrol (+)
( ), Pro+Pre 1% ( ), Pro+Pre 2% ( ), Pro+Pre 3% ( ) pada hari
ke 0 sebelum infeksi, hari ke 5 dan ke 10 setelah infeksi IMNV (n=3) 28 17 Aktifitas enzim pencernaan (protease dan amilase) udang vaname
(n=5) setelah 30 hari pemberian pakan perlakuan: Kontrol ( ),
DAFTAR LAMPIRAN
1 Metode total plate count 40
2 Pembuatan media bakteri 41
3 Sistem resirkulasi pada wadah perlakuan 42
4 Ekstraksi IMNV dari tubuh udang yang terinfeksi 43 5 Tahapan dan waktu kegiatan penelitian pada uji in vivo 43 6 Perhitungan total hemosit dengan menggunakan hemasitometer 44
7 Prosedur analisis proksimat 44
8 Prosedur analisis enzim 47
9 Hasil analisis proksimat udang vaname dan pakan perlakuan 48 10 Hasil analisis oligosakarida ekstrak ubi jalar dan pakan udang dengan
HPLC 48
1 PENDAHULUAN
1.1 Latar Belakang
Udang vaname (Litopenaeus vannamei) mulai diintroduksi ke Indonesia tahun 1999 hasil impor dari Taiwan dan Hawai. Budidaya udang ini menyebar cepat ke berbagai daerah di Indonesia. Sampai akhir tahun 2007, udang vaname telah dibudidayakan sekurangnya di 17 provinsi di Indonesia (Taukhid dan Nur’aini 2008). Komoditas ini telah menggantikan udang windu yang mengalami kegagalan akibat penyakit White Spot Syndrom (WSS). Teknik pengembangbiakan udang vaname lebih mudah daripada udang windu. Selama kegiatan pembesaran, udang ini dikenal sebagai hewan yang kuat, memiliki laju pertumbuhan yang seragam dan kebutuhan protein pakan lebih rendah (25-35%) dibandingkan udang windu (Weidner dan Rosenberry 1992).
Dalam perkembangannya, budidaya udang vaname di Indonesia juga tidak lepas dari berbagai wabah penyakit yang menyerang, terutama oleh infeksi virus. Penyakit viral penting yang telah dilaporkan pada budidaya udang vaname yaitu WSS, Taura Syndrom (TS), Infectious Hypodermal and Hematopoietic Necrosis (IHHN), dan Infectious Myonecrosis (IMN). Wabah IMN pertama kali menyerang budidaya udang vaname di Situbondo pada pertengahan tahun 2006 (Taukhid dan
Nura’ini β008). Wabah tersebut kemudian menyebar cepat ke berbagai daerah di Indonesia dan telah menyebabkan kematian kumulatif udang vaname hingga 70%.
Sampai saat ini belum ditemukan pengobatan yang efektif untuk penyakit viral. Penggunaan kemoteurapeutik termasuk antibiotik telah menimbulkan berbagai dampak negatif terutama munculnya bakteri resisten yang beresiko terhadap kesehatan manusia. Keluarnya pembatasan penggunaan antibiotik pada kegiatan akuakultur di banyak negara dan tingginya kesadaran konsumen akan keamanan pangan telah mendorong meningkatnya penelitian untuk mencari bahan alternatif yang alami dan aman. Selain vaksin, suplemen pakan termasuk probiotik dan prebiotik, mendapat perhatian yang tinggi (Genc et al. 2007).
Penelitian mengenai penanggulangan penyakit IMN belum banyak dilakukan. Beberapa penelitian mengenai IMN terbatas pada purifikasi dan karaktrisasi agen penyakit (Poulos et al. 2006); metode deteksi dan status penyebaran penyakit (Poulos dan Lightner 2006; Andrade et al. 2007; Senapin et al. 2007; Taukhid dan
Nur’aini β008), immune assessment (Costa et al. 2009), serta gejala klinis dan mortalitas (Lightner et al. 2004; Tang et al. 2005). Selama ini upaya penanggulangan wabah IMN dilakukan dengan cara menghindari masuknya agen penyakit melalui biosekuriti, penggunaan benih specific pathogen free (SPF), mengurangi kepadatan, monitoring penyakit dan manajemen budidaya yang baik.
2
kegiatan akuakultur. Strategi tersebut memberikan manfaat dalam mengatasi efek samping penggunaan antibiotik dan obat-obatan kimia lainnya serta meningkatkan produksi melalui perbaikan pertumbuhan dan resistensi terhadap penyakit. Selain itu, probiotik tertentu dapat berperan sebagai water additive yang memegang peran penting dalam dekomposisi bahan organik, menurunkan kadar amonia, nitrit dan H2S. Dalam akuakultur, jenis probiotik yang dievaluasi untuk digunakan jauh lebih
luas dibandingkan dengan hewan darat. Beberapa probiotik baik sebagai monospesies maupun multispesies telah tersedia secara komersial untuk kegiatan akuakultur (Nayak 2010).
Keberhasilan probiotik telah menjadi dasar bagi konsep lain seperti prebiotik dan sinbiotik (Nayak 2010). Berbagai penelitian telah menunjukkan keuntungan aplikasi probiotik dan prebiotik pada hewan akuatik (Merrifield et al. 2010; Nayak 2010; Ringo et al. 2010). Namun pada umumnya, aplikasi penggunaan probiotik dan prebiotik ini diteliti secara terpisah, sebaliknya sinbiotik belum banyak dipelajari. Berdasarkan beberapa penelitian, pemberian sinbiotik pada hewan akuatik menunjukkan hasil yang lebih baik dibandingkan bila diaplikasikan secara terpisah (Li et al. 2009; Rodriguez-Estrada et al. 2009; Zhang et al. 2010).
Penelitian ini mengevaluasi efek sinergis dari bakteri probiotik SKT-b dan oligosakarida hasil ekstraksi dari ubi jalar, dalam meningkatkan resistensi terhadap penyakit IMN dan performa pertumbuhan udang vaname. Bakteri SKT-b yang berhasil diisolasi dari pakan udang Skeletonema, secara in vitro maupun in vivo, telah terbukti berperan sebagai probiotik. Hasil analisis sekuen sebagian gen 16S-rRNA menunjukkan bahwa bakteri tersebut termasuk spesies Vibrio alginolyticus dengan indek kemiripan 88% (Widanarni et al. 2003). Bakteri SKT-b mampu menekan populasi bakteri V. harveyi, meningkatkan sintasan larva udang windu yang terinfeksi vibriosis, dan mampu menstimulasi sistem imunitas udang vaname (Widanarni et al. 2003; Widanarni et al. 2008; Syahailatua 2009).
3
1.2 Perumusan Masalah
Penyakit IMN telah menyebabkan kematian udang vaname sampai dengan 70%. Probiotik dapat menjadi alternatif untuk pencegahan penyakit IMN karena dianggap mampu meningkatkan sintasan dan imunitas inangnya, disamping memperbaiki pertumbuhannya. Aplikasi probiotik yang ditunjang dengan prebiotik (sinbiotik) memberikan hasil yang lebih baik dibandingkan bila diaplikasikan secara terpisah. Pemberian sinbiotik dari bakteri SKT-b dan oligosakarida diharapkan dapat meningkatkan resistensi terhadap infeksi penyakit IMN serta performa pertumbuhan udang vaname.
1.3 Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi potensi sinbiotik dari bakteri SKT-b dan oligosakarida untuk meningkatkan resistensi terhadap infeksi penyakit IMNserta performa pertumbuhan udang vaname.
1.4 Manfaat Penelitian
Hasil penelitian dapat dijadikan salah satu alternatif pemecahan masalah dalam penanggulangan penyakit IMN serta peningkatan produktifitas udang vaname.
1.5 Hipotesis
4
2 TINJAUAN PUSTAKA
2.1 Probiotik, Prebiotik dan Sinbiotik
Probiotik merupakan mikroorganisme hidup yang ketika diberikan dalam jumlah cukup dapat memberikan manfaat kesehatan pada inang (FAO/WHO 2001). Menurut Lisal (2005), kriteria dalam pemilihan probiotik yaitu sebaiknya merupakan mikroflora normal usus, bersifat nonpatogenik dan nontoksik bagi inang, toleran terhadap asam lambung dan garam empedu, mampu menempel dan berkoloniasi dalam usus, bersifat antagonistik terhadap patogen, memiliki pengaruh yang menguntungkan bagi inang, dan memiliki jumlah serta viabilitas yang tinggi. Dalam akuakultur, jenis probiotik yang dievaluasi dan digunakan lebih luas dibandingkan hewan terestrial, baik dalam bentuk monospesies maupun multispesies. Jenis-jenis probiotik tersebut memiliki mekanisme aksi yang berbeda diantaranya mampu meningkatkan efisiensi pakan dan bobot tubuh, memberi proteksi dalam melawan patogen melalui kompetisi ruang, produksi asam organik (asam formik, asam asetat dan asam laktat), produksi hidrogen peroksida dan beberapa bahan lainnya seperti antibiotik, bakteriosin, siderophores, lisozim serta memodulasi respons fisiologis dan imunologis ikan. Beberapa genus bakteri yang telah diteliti sebagai probiotik yaitu Bacillus, Lactobacillus, Lactococcus, Aeromonas, Shewanella, Vibrio, Carnobacterium, dan Clostridium (Nayak 2010).
Prebiotik adalah bahan makanan yang tidak dapat dicerna yang bermanfaat untuk menstimulasi pertumbuhan dan aktivitas bakteri tertentu (bakteri menguntungkan) di dalam usus. Studi mengenai prebiotik pada hewan akuatik berkaitan dengan efek terhadap pertumbuhan, konversi pakan, mikrobiota usus, resistensi terhadap patogen dan parameter imunitas. Prebiotik umumnya merupakan karbohidrat yang tidak dapat dicerna dalam saluran pencernaan inang. Karbohidrat dikelompokkan berdasarkan berat molekul atau tingkat polimerasinya (jumlah unit monosakarida), menjadi monosakarida, oligosakarida dan polisakarida (Tabel 1). Oligosakarida tidak dapat dicerna (non-digestible oligosaccharide) memiliki konfigurasi atom C dalam unit monosakarida yang membuat ikatan glikosidiknya tidak dapat dicerna oleh aktivitas hidrolisis dari enzim pencernaan manusia atau hewan. Prebiotik yang umum digunakan di akuakutur sampai sekarang meliputi inulin, fructooligosaccarides (FOS), short-cain fructooligosaccharides (scFOS), mannanoligosaccharides (MOS), galactooligosaccharides (GOS), xylooligosaccharides (XOS), arabinoxylooligosaccharides (AXOS), isomaltooligosaccharides (IMO) dan GroBiotic –A (Ringo et al. 2010).
5
Tabel 1 Klasifikasi karbohidrat (Subandiyono dan Hastuti 2009)
No. Kelompok Jenis Contoh
1 Monosakarida a. Triosa (C3H6O3) Gliseraldehida; Dihidroksiaseton
(1 unit b. Tetrosa (C4H8O4) Eritrosa
glukosa) c. Pentosa (C5H10O5) Rribosa; Arabinosa; Xilosa; Xilulosa
d. Heksosa (C6H12O6) Glukosa; Galaktosa; Mannosa; Fruktosa
2 Oligosakarida a. Disakarida (C12H22O11) Sukrosa; Laktosa; Maltosa; Selobiosa
(2-10 unit b. Trisakarida (C18H32O16) Rafinosa
glukosa) c. Tetrasakarida (C24H42O16) Stasilosa
d. Pentasakarida (C30H52O26) Verbaskosa
3 Polisakarida a. Homo-polisakarida 1. Pentosan (Araban; Xilan) ( >10 unit
glukosa) (glukosa dengan jenis yang sama) 2. Heksosan (Glukan [Starch, Dekstrin, Glikogen, Selulosa]; Fruktan [Inulin, Levan]; Galaktan; Manan)
b. Hetero-polisakarida
(glukosa dengan jenis Pektin; Hemiselulosa; Gum; Mukopolisakarida Mucilage; yang berbeda)
4 Persenyawaan a. Khitin khusus b. Lignin
2.2 Sistem Imunitas Krustasea
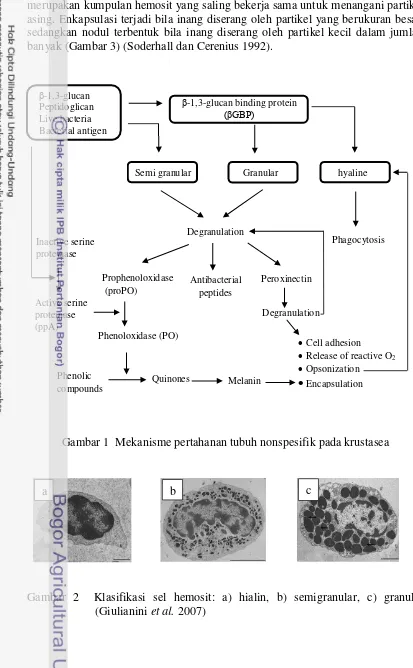
Mekanisme pertahanan tubuh krustasea kurang berkembang dibandingkan ikan bersirip (finfish) dan vertebrata lainnya. Krustasea tidak memiliki memori adaptif dan hanya bergantung pada sistem pertahanan nonspesifik (Roch 1999). Sistem pertahanan tersebut meliputi pertahanan seluler berupa aktivitas sel-sel hemosit (fagositosis, enkapsulasi, dan pembentukkan nodul), serta pertahanan humoral berupa aktivasi dan pelepasan molekul-molekul penting yang tersimpan dalam hemosit (protein antikoagulan, aglutinin, enzim phenoloxidase [PO], peptida antimikrobial, protease inhibitor, dan sebagainya) (Jiravanichpaisal et al. 2006; Holmblad dan Soderhall 1999). Mekanisme pertahanan tubuh krustasea dijelaskan pada Gambar 1 (Smith et al. 2003).
Berdasarkan keberadaan granular pada sitoplasma, terdapat tiga tipe hemosit pada krustasea yaitu sel hialin (nongranular), semi granular dan sel granular (Gambar 2). Fungsi dari masing-masing hemosit seperti pada Tabel 2 (Soderhall dan Cerenius 1992). Fagositosis merupakan mekanisme pertahanan sel yang paling umum dengan cara menelan dan menghancurkan patogen dan partikel asing yang masuk ke dalam tubuh. Penghancuran material yang difagosit melibatkan produksi intraseluler berupa radikal bebas. Selama proses kontak dan pengenalan dengan patogen, enzim inang seperti NADPH-oksidase menjadi aktif yang ditandai dengan meningkatnya konsumsi oksigen dan menghasilkan radikal bebas diantaranya anion superoksida (O2-) dan hidrogen peroksida (H2O2) (Munoz et al. 2000; Rodriguez
6
merupakan kumpulan hemosit yang saling bekerja sama untuk menangani partikel asing. Enkapsulasi terjadi bila inang diserang oleh partikel yang berukuran besar, sedangkan nodul terbentuk bila inang diserang oleh partikel kecil dalam jumlah banyak (Gambar 3) (Soderhall dan Cerenius 1992).
Gambar 1 Mekanisme pertahanan tubuh nonspesifik pada krustasea
Gambar 2 Klasifikasi sel hemosit: a) hialin, b) semigranular, c) granular (Giulianini et al. 2007)
-1,3-glucan Peptidoglican Live bacteria Bacterial antigen
Phenolic
compounds Quinones Melanin
Cell adhesion Release of reactive O2
Opsonization Encapsulation Phenoloxidase (PO)
Prophenoloxidase (proPO)
Active serine proteinase (ppA)
Antibacterial
peptides
Peroxinectin
Phagocytosis Inactive serine
proteinase (proppA)
Granular
Semi granular hyaline
-1,3-glucan binding protein
( GBP)
Degranulation
Degranulation
7
Tabel 2 Fungsi berbagai tipe sel hemosit pada sistem imunitas krustasea
Tipe hemosit Fagositosis Enkapsulasi Fungsi Sitotoksisitas Sistem aktivasi ProPO
Sistem prophenoloxidase (proPO) merupakan bagian yang dominan dari mekanisme pertahanan tubuh krustasea, disimpan dan diproduksi oleh sel semigranular dan granular yang diaktifkan oleh kehadiran sejumlah kecil mikroba. Komponen awal dari sistem proPO adalah PO yang ketika aktif akan mengoksidasi senyawa fenol menjadi kuinolon dan secara spontan membentuk melanin sebagai produk akhir. Melanin beserta produk antaranya merupakan senyawa yang sangat reaktif yang berperan diantaranya dalam inaktivasi dan mencegah penyebaran partikel asing dalam tubuh melalui penghambatan produk ekstraseluler mikroorganisme (proteinase dan khitinase). Sistem proPO berpengaruh terhadap tingkah laku sel, perbanyakan dan atau aktivasi molekul-molekul penting yang fungsional serta netralisasi agen penginfeksi (Smith et al. 2003).
2.3 Infectious Myonecrosis (IMN)
Wabah IMN pertama kali teridentifikasi pada budidaya udang vaname (Litopenaeus vanammei) di timur laut Brazil pada tahun 2004 dan ditemukan di Indonesia pada awal tahun 2006. Hasil analisis subsekuen membuktikan bahwa virus IMN (IMNV) yang menginfeksi udang vaname di Indonesia memiliki kemiripan sekuen asam nukleat 99,6% dengan IMNV yang menginfeksi di Brazil (Senapin et al. 2007). IMNV menginfeksi postlarva, juvenil dan subadult pada pembesaran udang vaname. Mewabahnya penyakit ini diduga berkaitan dengan stress fisik dan lingkungan seperti salinitas dan suhu ekstrim, penanganan udang,
8
serta penggunaan pakan kualitas rendah. Infeksi IMNV memperlihatkan gejala nekrosis dari mulai ringan sampai berat terutama di bagian abdomen dan ekor yang dapat berkembang menjadi kemerahan (Gambar 4) (Lightner et al. 2004).
Gambar 4 Gejala klinis udang vaname yang terinfeksi IMNV: a) Lightner et al. 2004, b) Poulos et al. 2006
Hasil histopatologi, udang yang terinfeksi IMNV memperlihatkan lesi di otot skeletal meliputi multifocal necrosis, kongesi hemosit, inflamasi fibrosis, fagositosis dan munculnya badan inklusi sitoplasmik. Hasil in situ hybridisation (ISH) pada L. vannamei menunjukkan bahwa otot skeletal merupakan organ target utama dari infeksi IMNV. Hal ini yang menyebabkan penyakit IMN bersifat kronis dan kematian terjadi secara perlahan. Selain otot skeletal, IMNV juga ditemukan di organ limfoid, usus bagian belakang, insang serta sel fagositik dalam hepatopankreas dan hati. L vanammei merupakan inang utama dari IMNV, meskipun mampu menginfeksi L. stylirostris dan Penaeus monodon, namun tidak menyebabkan kematian sampai dengan empat minggu pengamatan setelah infeksi (Tang et al. 2005).
Berdasarkan analisis imunologi, perubahan parameter imunologis yang signifikan hanya terjadi pada udang di tahap akhir infeksi IMNV, ketika pemulihan diri tidak dimungkinkan lagi. Infeksi IMNV menyebabkan peningkatan apoptosis pada hemosit (8 kali), titer aglutinasi (16 kali), produksi anion superoksida dari hemosit (50%), dan aktivitas antimikrobial dari hemolimph (21 kali melawan Micrococcus luteus). Infeksi IMNV juga menyebabkan penurunan total hemosit (30%) dan persentase granulosit sirkular (7%) (Costa et al. 2009).
Agen penyebab penyakit IMN adalah virus berbentuk ikosahedral dengan diameter 40 nm, memiliki genom tunggal, double-stranded (dsRNA) dengan panjang molekul 7560 bp (Gambar 5). Hasil analisis filogenetik IMNV berdasarkan RDA-dependent dari gen RNA polimerase (RdRp), IMNV memiliki kemiripan dengan virus Giardia lamblia, yang merupakan anggota dari family Totiviridae. Berdasarkan hal ini, IMNV mungkin merupakan anggota unik dari Totiviridae atau mungkin merepresentasikan family virus dsRNA baru yang menginfeksi inang invertebrata (Poulos et al. 2006).
9
Gambar 5 Bentuk ikosahedral dari IMNV: a) transmisi elektron mikrograf, fraksi gradien calsium chloride, diwarnai dengan phosphotungstic acid 2%, garis menunjukkan 100 nm (Poulos et al. 2006), b) Rekonstruksi 3-dimensi virion IMNV dengan resolusi 8.0-Å (Tang et al. 2008)
2.4 Ubi Jalar (Ipomoea batatas)
Ubi jalar merupakan tanaman asli dari Amerika Tengah dan Amerika Selatan. Tanaman ini mulai menyebar ke seluruh dunia, terutama negara-negara beriklim tropis, pada abad ke 16. Orang-orang Spanyol menyebarkan ubi jalar ke kawasan Asia terutama Filipina, Jepang dan Indonesia. Data tahun 2009 menunjukkan produksi ubi jalar Indonesia menempati urutan ke 4 setelah China, Uganda dan Nigeria. Ubi jalar termasuk dalam ordo Solanaceae, family Convolvulaceae, genus Ipomoea dan spesies Ipomoea batatas serta memiliki nama binomial Ipomoea batatas (L) Lam. Tanaman ini memiliki warna kulit yang bervariasi antara kuning, oranye, merah, coklat, ungu dan abu-abu kecoklatan. Warna daging juga bervariasi mulai dari abu-abu kecoklatan, putih, merah, merah muda, ungu, kuning, sampai oranye, tergantung jenis dan banyaknya pigmen yang terdapat di dalamnya. Varietas umbi warna putih dan kuning pucat memiliki rasa manis dan kadar air lebih rendah dibandingkan dengan varietas berwarna merah, merah muda dan oranye (Wikipedia 2012). Menurut North Carolina Sweet Potato Commission (2013), terdapat ratusan varietas ubi jalar (Gambar 6), kebanyakan di produksi dalam jumlah kecil serta hanya dijual oleh petani lokal. Secara umum, ubi jalar mengandung karbohidrat yang tinggi (20,1%), terdiri dari pati (12,7%), gula (4,2%), dan serat (3,0%). Ubi jalar juga mengandung protein (1,6%) dan lemak (0,1%) yang rendah (Wikipedia 2012).
Komposisi kimia ubi jalar bervariasi tergantung pada waktu panen, varietas dan proses pengolahan. Kandungan gula yang terdapat pada ubi jalar varietas sukuh terdiri dari fruktosa, glukosa, sukrosa, maltose dan maltotriosa (Marlis 2008). Roxas et al. (1985) menyebutkan bahwa ubi jalar varietas Kinabakab, Tinipay, BNAS 51 dan G113-2b hanya tediri dari monosakarida dan sukrosa. Pengukusan dapat meningkatkan konsentrasi gula dalam ubi jalar dibandingkan dengan kondisi mentahnya. Hal ini disebabkan oleh pemecahan struktur pati karena pengaruh panas dan air, menjadi molekul glukosa yang lebih sederhana (Marlis 2008).
10
11
3 METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian dilaksanakan selama 16 minggu, pada bulan Mei–September 2012. Bertempat di Laboratorium Kesehatan Ikan, Fakultas Perikanan dan Ilmu Kelautan (FPIK) dan Program Diploma, Institut Pertanian Bogor (IPB).
3.2 Metode
3.2.1 Preparasi, Ekstraksi, dan Analisis Oligosakarida
Ubi jalar (Ipomoea batatas) berumbi putih didapatkan dari penjual ubi di pasar Ciampea. Proses preparasi dan ekstraksi dimulai dengan mengukus ubi selama 30 menit, kemudian diiris tipis-tipis, dikeringkan dalam oven suhu 50 oC
selama dua hari (sampai kering), dan selanjutnya ditepungkan menggunakan blender. Tepung kukus ubi jalar diekstraksi dalam etanol 70% dengan perbandingan 1:10 dan digoyang dalam shaker (kecepatan 120 rpm suhu 30 oC) selama 15 jam (Muchtadi 1989). Setelah disaring, filtrat yang diperoleh dipekatkan menggunakan evaporator vakum pada suhu 40 oC, kemudian dikeringkan dengan freeze dryer
untuk memisahkan filtrat dari pelarutnya. Sebanyak 50 gram ekstrak diencerkan dengan 100 ml akuades hingga didapatkan larutan stok 50% (Gambar 7).
Gambar 7 Ubi jalar (Ipomoea batatas) berumbi putih yang digunakan sebagai sumber oligosakarida: a) mentah, b) setelah dikukus, diiris tipis dan dikeringkan, c) tepung, d) larutan stok ekstrak ubi jalar
a b
12
Ekstrak oligosakarida hasil freeze dry kemudian dianalisis menggunakan High Performance Liquid Chromatography (HPLC), untuk mengetahui jenis dan konsentrasi oligosakarida yang terkandung dalam ekstrak. Analisis oligosakarida dengan HPLC menggunakan kolom Aminex HPX-87H pada suhu 35 oC dengan
refractive indeks detector, laju alir 1 ml menit-1, fase gerak H2SO4 0,008N dan
volume injeksi 20 µl. Analisis HPLC dilakukan di Balai Bioteknologi, Badan Pengkajian dan Penerapan Teknologi (BPPT), Serpong.
3.2.2 Pertumbuhan Bakteri Probiotik SKT-b
Bakteri SKT-b yang digunakan pada penelitian ini diperoleh dari Laboratorium Kesehatan Ikan, Fakultas Perikanan dan Ilmu Kelautan (FPIK) IPB. Bakteri SKT-b memiliki ciri koloni berbentuk bulat, elevasi cembung, tepian rata, berwarna kuning pada media Thiosulfate Citrate Bilesalt Sucrose (TCBS) agar dan agak berlendir (Gambar 8). Karakteristik fisiologis dan biokimia bakteri SKT-b disajikan pada Tabel 3 (Widanarni et al. 2003). Bakteri SKT-b dikultur pada media Seawater Complete (SWC) cair dan diinkubasi dalam waterbath shaker (kecepatan 140 rpm, suhu 29 oC) selama 22 jam. Setiap dua jam, kultur bakteri diambil
sebanyak 1 ml dan kemudian dihitung konsentrasinya dengan metode total plate count (TPC) pada media TCBS agar (Cappuccino dan Sherman 2008) (Lampiran 1). Selanjutnya dibuat kurva pertumbuhan bakteri SKT-b terhadap waktu. Pembuatan media bakteri dijelaskan pada Lampiran 2.
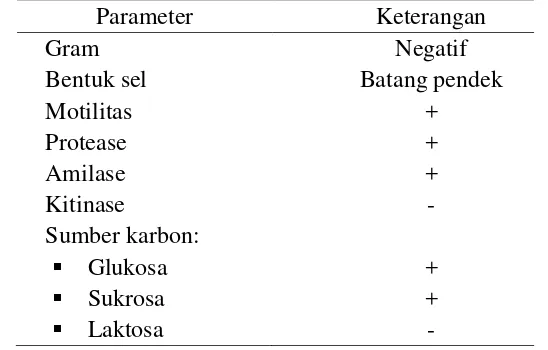
13 Tabel 3 Karakteristik sifat biokimia dan fisiologis bakteri probiotik SKT-b
Parameter Keterangan
Gram Negatif
Bentuk sel Batang pendek
Motilitas +
Protease +
Amilase +
Kitinase -
Sumber karbon:
Glukosa +
Sukrosa +
Laktosa -
3.2.3 Uji Kombinasi Sinbiotik Optimal
Pengujian kombinasi prebiotik-probiotik (sinbiotik) yang optimal dilakukan secara in vitro. Pengujian ini mencari kombinasi prebiotik-probiotik yang memperlihatkan kecepatan pertumbuhan bakteri probiotik paling baik. Biakan cair bakteri SKT-b konsentrasi 107, 108, 109, dan 1010 cfu ml-1, masing-masing sebanyak
1 ml ditumbuhkan dalam 9 ml air laut steril yang telah dicampur dengan prebiotik konsentrasi 0, 1, 2 dan 3% v/v. Sterilisasi prebiotik dilakukan dengan filtrasi mess size 0,20 µm. Biakan bakteri selanjutnya diinkubasi dalam waterbath shaker (kecepatan 140 rpm, suhu 29 oC) selama 12 jam. Pertumbuhan bakteri SKT-b
diketahui dengan mengukur nilai absorbansi biakan setiap perlakuan menggunakan spektrofotometer pada panjang gelombang 600 nm.
3.2.4 Uji In Vivo
3.2.4.1 Preparasi Probiotik
Bakteri probiotik yang akan diberikan ke udang, sehari sebelumnya dikultur di media SWC cair dan diinkubasi dalam waterbath shaker (kecepatan 140 rpm, suhu 29 oC) selama 16 jam. Pelet bakteri dipisahkan dengan supernatan
menggunakan sentrifus kecepatan 10.000 rpm selama lima menit. Pelet bakteri dicampurkan ke pakan sebanyak 1010 cfu g pakan-1.
3.2.4.2 Preparasi Pakan
14
3.2.4.3 Persiapan Wadah dan Media
Wadah perlakuan berupa akuarium kaca berukuran 60x30x40 cm3. Sebelum
digunakan, wadah didesinfeksi dengan klorin 100 ppm selama satu jam. Wadah dibilas air sampai bersih dan dijemur di bawah sinar matahari untuk menghilangkan residu klorin. Akuarium kemudian ditutup dengan plastik hitam untuk mengurangi intensitas cahaya yang masuk. Masing-masing akuarium dilengkapi dengan shelter (pipa paralon ½ inci) dan “anco” (tutup toples plastik diameter 18 cm). Air yang digunakan dalam penelitian ini berasal dari Pantai Ancol. Air laut ditampung dalam tandon dan didesinfeksi dengan klorin 30 ppm. Residu klorin dihilangkan dengan menambahkan Na-Thiosulfat 15 ppm (setengah dosis klorin). Setiap akuarium perlakuan diisi air laut setinggi 30 cm (54 liter). Akuarium dengan perlakuan yang sama digabung dalam satu sistem resirkulasi untuk mempertahankan kualitas air media pemeliharaan udang (Lampiran 3).
3.2.4.4 Kondisi Hewan Uji
Udang vaname diperoleh dari PT. Global Gen Indonesia, Labuan, Banten. Sebelum digunakan, udang vaname (PL 41; bobot rataan 0,6 g) diadaptasikan selama dua minggu dalam wadah fiber volume 1 ton. Udang diberi pakan sekenyangnya sebanyak lima kali sehari pada pukul 06.00, 10.00, 14.00, 18.00 dan 22.00 WIB. Setelah proses adaptasi, udang uji (PL 55; bobot rataan 1,9 g) kemudian dipindahkan ke dalam akuarium perlakuan sebanyak 40 ekor per akuarium. Udang diberi pakan perlakuan selama 30 hari dengan metode dan frekuensi pemberian pakan yang sama seperti saat adaptasi. Selain dengan menggunakan sistem resirkulasi, kualitas air media dipertahankan dengan aerasi terus menerus dan penyifonan setiap dua kali sehari pada pagi dan sore hari. Penyifonan juga dilakukan untuk mengambil sisa pakan untuk pengukuran parameter jumlah konsumsi pakan.
15
3.2.4.5 Pengujian Resistensi Udang Vaname terhadap Infeksi IMNV
Uji ini dilakukan untuk mengevaluasi kinerja sinbiotik dalam meningkatkan resistensi udang vaname yang diinfeksi IMNV. Pengujian terdiri dari lima perlakuan dengan tiga ulangan, sebagai berikut:
Kontrol (-) : Udang vaname diberi pakan komersil dan diinjeksi PBS. Kontrol (+) : Udang vaname diberi pakan komersil dan diinfeksi IMNV.
Pro+Pre 1% : Udang vaname diberi pakan komersil dengan penambahan probiotik dan prebiotik 1% serta diinfeksi IMNV.
Pro+Pre 2% : Udang vaname diberi pakan komersil dengan penambahan probiotik dan prebiotik 2% serta diinfeksi IMNV.
Pro+Pre 3% : Udang vaname diberi pakan komersil dengan penambahan probiotik dan prebiotik 3% serta diinfeksi IMNV.
Udang diberi pakan perlakuan setiap hari selama 30 hari. Infeksi IMNV dilakukan melalui injeksi sebanyak 0,1 ml per ekor udang. Pengamatan dilakukan selama 10 hari setelah infeksi. Parameter yang diamati meliputi sintasan (SR) dan gejala klinis yang diukur pada akhir pengamatan, serta parameter imunitas (total hemosit dan aktivitas phenoloxidase) pada awal (hari ke 0 sebelum infeksi), tengah dan akhir pengamatan (hari ke 5 dan ke 10 setelah infeksi). Tahapan dan waktu kegiatan uji resistensi udang vaname terhadap IMNV dijelaskan pada Lampiran 5.
a. Pengambilan Sampel Hemolimph
Hemolimph diambil dari ventral sinus pada pangkal kaki renang pertama dengan menggunakan syringe 1 ml yang telah dibilas dan diisi antikoagulan sebanyak 200 µl. Hemolimph yang terkumpul kemudian dimasukkan ke dalam eppendorf 2 ml dan dicatat volumenya sebagai faktor pengencer pada perhitungan nilai total hemosit dan aktivitas phenoloxidase. Untuk mengawetkan sampel hemolimph selama pengukuran parameter imunitas, sampel disimpan di dalam cool box yang telah diisi dengan batu es.
b. Sintasan (SR)
Sintasan udang dihitung dengan menggunakan rumus berikut: SR = (Nt / No) x 100 %
Keterangan :
Nt : Jumlah udang yang hidup pada akhir pengamatan (ekor) No : Jumlah udang pada awal pengamatan (ekor)
c. Gejala Klinis
16
Pengelompokan gejala klinis ditentukan berdasarkan Hasan (2011) dengan sedikit modifikasi (Tabel 4 dan Gambar 9)
Tabel 4 Pengelompokan tingkat infeksi IMNV terhadap udang vaname berdasarkan gejala klinis yang muncul
Level Gejala Klinis Tingkat
Infeksi
1 Terinfeksi tanpa gejala klinis Ringan
2 Sedikit warna putih lebam di dalam jaringan di beberapa segmen abdomen
Sedang 3 Sebagian besar jaringan abdomen berwarna
putih lebam Berat
4 Bagian abdomen dari arah ekor berwarna merah (jaringan mati)
Sangat berat
Gambar 9 Gejala klinis udang yang terinfeksi IMNV. Angka menunjukkan tingkat infeksi ringan (1), sedang (2), berat (3), dan sangat berat (4)
d. Total Hemosit
Pengukuran total hemosit (THC) dilakukan berdasarkan metode Blaxhall dan Daishley (1973). Hemolimph sebanyak 0,1 ml yang sudah ditambahkan antikoagulan, dihitung dengan menggunakan hemasitometer pada mikroskop perbesaran 400 kali. Perhitungan nilai THC dijelaskan di Lampiran 6.
4 3
17 e. Aktivitas Phenoloxidase (PO)
Pengukuran PO dilakukan berdasarkan Liu dan Chen (2004). Aktivitas PO diukur berdasarkan formasi dopachrome yang dihasilkan oleh L-DOPA. Hemolimph yang sudah dicampur dengan antikoagulan sebanyak 1 ml disentrifus (1.500 rpm; suhu 4 oC) selama 10 menit. Supernatan dibuang dan
pelet disuspensikan kembali secara perlahan ke dalam 1 ml larutan cacodylate-citrate buffer, selanjutnya disentrifus kembali. Pelet diambil dan disuspensikan
dalam β00 μl cacodylate-citrate buffer. Suspensi sel sebanyak 100 μl diinkubasi
dengan 50 μl trypsin (1 mg ml-1cacodylate-citrate buffer) selama 10 menit pada
suhu 25-26 oC. Selanjutnya ditambahkan 50 μl L-DOPA (3 mg ml-1
cacodylate-citrate buffer) setelah 5 menit, dan ditambahkan 800 μl cacodylate-citrate buffer. Densitas optikal (optical density) diukur dengan menggunakan spektrofotometer pada panjang gelombang 490 nm. Larutan standar
mengandung 100 μl suspensi hemosit, 50 μl cacodylate-citrate buffer
3.2.4.6 Pengujian Performa Pertumbuhan
Penelitian ini dilakukan untuk menguji kinerja sinbiotik dengan berbagai dosis oligosakarida terhadap performa pertumbuhan udang vaname. Pengujian terdiri dari empat perlakuan dengan tiga ulangan sebagai berikut:
Kontrol : Udang vaname diberi pakan komersil.
Pro+Pre 1% : Udang vaname diberi pakan komersil dengan penambahan probiotik dan prebiotik 1%.
Pro+Pre 2% : Udang vaname diberi pakan komersil dengan penambahan probiotik dan prebiotik 2%.
Pro+Pre 3% : Udang vaname diberi pakan komersil dengan penambahan probiotik dan prebiotik 3%.
18
Tabel 5 Perhitungan parameter pengujian performa pertumbuhan: penambahan
bobot tubuh (∆ Biomasa), jumlah konsumsi pakan (JKP), laju
pertumbuhan (SGR), efisiensi pakan (EP), retensi nutrien (protein dan lemak), aktivitas enzim (AE) (protease dan amilase)
Parameter Rumus perhitungan Pustaka
∆ Biomasa (g) � ℎ� − � - t = Periode pemeliharaan
F = Jumlah nutrien tubuh pada akhir pemeliharaan (g) I = Jumlah nutrien tubuh pada awal pemeliharaan (g) P = Jumlah nutrien pakan yang dikonsumsi (g) OD = Persen absorbansi
P = Pengenceran T = Waktu (menit)
3.2.4.7 Populasi Bakteri Usus Udang
19 dihitung konsentrasi total bakterinya dengan metode total plate count pada media SWC agar.
3.2.4.8 Kualitas Air Media Pemeliharaan
Pengukuran kualitas air media pemeliharaan udang dilakukan tiga kali selama masa pemberian pakan perlakuan yaitu pada awal, tengah dan akhir perlakuan. Parameter kualitas air yang diukur meliputi suhu (oC), salinitas (o/
oo), oksigen
terlarut (DO) (mg l-1), TAN (mg l-1), dan pH. Pengukuran suhu, salinitas, DO dan
pH dilakukan dengan menggunakan alat berupa termometer, refraktometer, DOmeter dan pHmeter. Pengukuran nilai TAN dilakukan di Laboratorium Pengujian Departemen Teknologi Industri Pertanian (TIN) IPB.
3.3 Prosedur Analisis Data
20
4 HASIL DAN PEMBAHASAN
4.1 Kandungan Oligosakarida dalam Ubi Jalar dan Pakan Komersil
Ubi jalar memiliki kandungan karbohidrat tinggi (± 20%), termasuk tanaman yang mudah dibudidayakan, produksi melimpah dan harganya yang relatif murah sehingga sangat potensial untuk dikembangkan. Ubi jalar diketahui memberikan manfaat bagi kesehatan karena mengandung oligosakarida tidak dapat dicerna ( non-digestible oligosaccharides [NDOs]) yang berfungsi sebagai prebiotik, diantaranya rafinosa dan sukrosa (Marlis 2008; Putra 2010; Haryati dan Supriyati 2010). Hasil penelitian menunjukkan konsentrasi oligosakarida dalam ekstrak etanol dari tepung kukus ubi jalar sebesar 64,86%. Sukrosa merupakan jenis oligosakarida dengan persentase konsentrasi tertinggi (52,86%) diikuti rafinosa dan maltoheptaosa masing-masing 8,14% dan 3,86%. Kontras dengan komposisi oligosakarida pada ubi jalar, pakan udang komersial didominasi oleh maltoheptaosa sebesar 3,07% (Tabel 6 dan Lampiran 10). Kandungan sukrosa dalam pakan udang sangat kecil serta tidak terdeteksi adanya rafinosa, sehingga perlu ditambahkan oligosakarida dari sumber lain sebagai prebiotik. Pengkayaan pakan dengan NDOs terbukti memperbaiki mikroekologi usus termasuk meningkatkan populasi bakeri, profil biokimia dan efek fisiologis (Mussatto dan Mancilha 2007).
Tabel 6 Jenis dan konsentrasi oligosakarida hasil ekstraksi dari tepung kukus ubi jalar dan pakan udang komersil dengan metode HPLC
Jenis oligosakarida Konsentrasi oligosakarida hasil ekstraksi (%) Ubi jalar Pakan udang komersil
Maltoheptaosa 3,86 3,07
Rafinosa 8,14 -*
Sukrosa 52,86 0,91
Total oligosakarida 64,86 3,98
* tidak terdeteksi
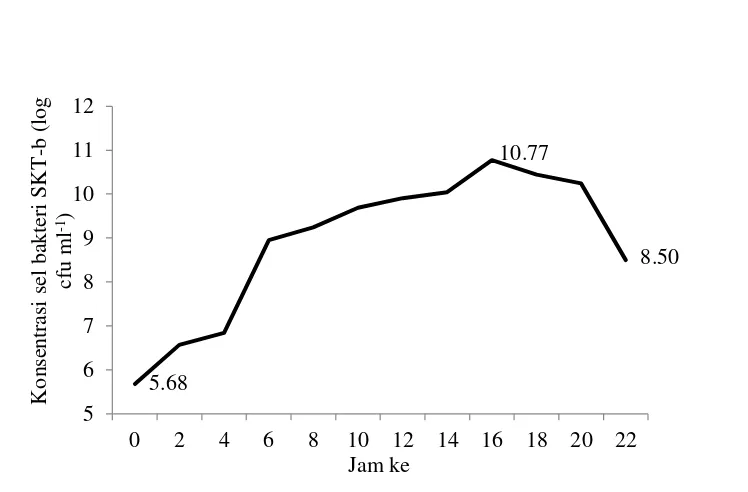
4.2 Pertumbuhan Bakteri Probiotik SKT-b
Bakteri yang ditumbuhkan di media akan mengalami empat fase pertumbuhan yaitu fase lamban, eksponensial, stasioner dan fase kematian. Biakan dengan inokulan berasal dari biakan bakteri segar umumnya tidak mengalami fase lamban, sehingga fase eksponensial terjadi mulai jam ke 0. Puncak pertumbuhan bakteri SKT-b terjadi pada jam ke 16 dan masuk fase kematian pada jam ke 18. Fase stasioner bakteri SKT-b diduga berada pada selang jam ke 16-18 (Gambar 10). Konsentasi bakteri SKT-b pada puncak pertumbuhannya mencapai 5,9x1010 cfu
21
Gambar 10 Kurva pertumbuhan bakteri SKT-b yang dikultur di media SWC cair dan dihitung dengan metode total plate count
4.3 Kombinasi Sinbiotik Optimal
Oligosakarida yang berasal dari ubi jalar dapat dimanfaatkan sebagai sumber makanan oleh bakteri probiotik SKT-b untuk menunjang pertumbuhan bakteri tersebut secara in vitro. Penambahan oligosakarida ke media kultur meningkatkan pertumbuhan bakteri SKT-b, yang berkorelasi positif terhadap peningkatan dosis prebiotik tersebut, pada semua perlakuan konsentrasi bakteri. Jumlah inokulan yang ditambahkan ke media kultur juga menentukan konsentrasi akhir dari biakan bakteri yang dikultur. Pengurangan jumlah inokulan bakteri SKT-b menyebabkan penurunan konsentrasi akhir biakan pada semua perlakuan dosis prebiotik. Kombinasi prebiotik dan probiotik yang optimal didapatkan pada penambahan prebiotik 3% dan inokulan bakteri SKT-b konsentrasi 1010 cfu ml-1 (Gambar 11).
Li et al. (2009) menyebutkan bahwa ada hubungan yang erat antara efek dosis probiotik dan prebiotik terhadap efisiensinya. Oligosakarida dalam jumlah tertentu bersifat antinutrisi. Pemberian karbohidrat yang berasal dari bungkil kedelai (kandungan total karbohidrat terlarut 12-15%), dengan kandungan oligosakarida utama yaitu sukrosa (6-7%), rafinosa (1-2%) dan stakiosa (5-6%), menurunkan konsumsi pakan pada hybrid striped bass dan rainbow trout, serta menurunkan kecernaan pakan pada trout (Francis et al. 2001). Selain itu, dosis prebiotik yang diaplikasikan dalam kegiatan budidaya berkolerasi positif dengan biaya produksi. Oleh karena itu perlu dievaluasi efek dosis prebiotik tersebut secara in vivo. Diharapkan diperoleh dosis prebiotik terkecil yang memberikan dampak tidak berbeda dengan dosis yang lebih tinggi terhadap penanggulangan infeksi IMNV maupun performa pertumbuhan udang vaname.
22
Gambar 11 Nilai absorbansi biakan perlakuan kombinasi bakteri SKT-b konsentrasi 107, 108, 109 dan 1010 cfu ml-1 dengan prebiotik dosis
0% (kontrol) ( ), 1% ( ), 2% ( ) dan 3% ( )
4.4 Uji In Vivo
4.4.1 Populasi Bakteri Usus Udang
Secara in vivo, pemberian oligosakarida selama 30 hari terbukti meningkatkan populasi bakteri di dalam usus udang vaname. Peningkatan yang signifikan ditunjukkan oleh udang yang diberi perlakuan Pro+Pre 2% dan Pro+Pre 3% masing-masing sebesar 2,03 x 108 dan 1,25 x 108 cfu g usus-1 atau mencapai
10,9 dan 6,7 kali lebih tinggi dibandingkan Kontrol (Gambar 12). Rafinosa diketahui mampu meningkatkan jumlah mikroflora spesifik dalam usus (Mathious et al. 2006; Haryati dan Supriyati 2010). Namun efek dari peningkatan populasi mikroflora terhadap inang karena pemberian ekstrak oligosakarida dari ubi jalar, perlu dipelajari lebih lanjut. Mekanisme kerja dari berbagai jenis prebiotik tidak selalu sama. Beberapa prebiotik menyebabkan peningkatan mikroflora spesifik asli usus pencernaan yang menyebabkan menurunnya bakteri patogen di usus melalui kompetisi langsung terhadap nutrien atau binding site dengan memproduksi blocking factors. Beberapa prebiotik bekerja dengan cara menurunkan pH usus karena dihasilkannya short-cain fatty acid (SCFA), yang mengakibatkan persentase bakteri menguntungkan meningkat dan menurunkan persentase bakteri merugikan. Mannanoligosaccharides (MOS) sebagai prebiotik mempunyai mekanisme berbeda yang secara selektif tidak menyebabkan peningkatan populasi bakteri
0
23 menguntungkan, tetapi melalui kemampuannya yang dapat melekat pada lektin spesifik manosa dari patogen Gram negatif tipe 1 fimbriae seperti Salmonella dan E. coli yang kemudian akan dikeluarkan dari saluran pencernaan. Mekanisme MOS sebagai antiinfeksi pada fimbriae E. coli dan Salmonella dilakukan dengan berperan sebagai reseptor analog untuk fimbriae tipe 1 guna mencegah proses kolonisasi bakteri (Haryati 2011).
Gambar 12 Populasi bakteri dalam usus udang vaname (x107 cfu g usus-1) pada
sebelum (awal) dan setelah 30 hari pemberian pakan perlakuan (n=5)
Pada penelitian ini tidak diberikan penanda pada bakteri probiotik yang diberikan, sehingga tidak diketahui dominansi bakteri SKT-b di dalam usus udang vaname. Perhitungan populasi total bakteri di usus dilakukan sebagai pendekatan. Selain itu juga tidak dilakukan perhitungan keragaman bakteri di usus, sehingga tidak diketahui bagaimana pengaruh perbedaan dosis prebiotik, hasil ekstraksi dari ubi jalar, terhadap keragaman bakteri dalam usus udang. Keragaman bakteri dalam usus hewan akuatik sangat tergantung pada habitat dan sistem pencernannya. Bakteri yang masuk melalui air dan makanan akan mempengaruhi mikroflora dalam usus, sehingga kompleksitas bakteri dalam usus hewan akuatik dapat berubah-ubah selama hidupnya (Austin 2006). Kolonisasi bakteri patogen, yang umumnya banyak terdapat di perairan budidaya intensif maupun semiintensif, dalam usus sangat tidak diharapkan sehingga penggunaan prebiotik dan probiotik sangat dianjurkan untuk memanipulasi mikroflora usus yang menguntungkan terhadap inang.
Keragaman mikroflora dalam usus udang vaname telah diamati oleh Li et al. (2007), U-taynapun et al. (2007) dan Pangastuti et al. (2010) dengan metode yang berbeda. Li et al. (2007) mengamati keragaman bakteri usus L. vannamei yang dipelihara di laboratorium menggunakan 16S rDNA clone library. Populasi usus udang didominasi oleh kelompok Firmicutes (75,4%) dan sisanya dari kelompok
3.36
Awal Kontrol Pro+Pre 1% Pro+Pre 2% Pro+Pre 1%
24
Gamma-proteobacteria (24,6%) yang teridentifikasi sebagai Shewanella sp., Pantoea sp., Aranicola sp., Pseudomonas sp. and Vibrio sp. Hasil tersebut menunjukkan bahwa sebagian besar bakteri yang berasosiasi dengan usus udang adalah bakteri yang tidak dapat dikultur dan merupakan spesies baru. U-taynapun et al. (2007) menggunakan teknik Fluorescent in situ hybridization (FISH) untuk menganalisis keragaman udang vaname yang dikultur di tambak tanah. Eubacteria merupakan kelompok yang paling dominan mencapai 80%, terdiri dari low G+C gram positive bacteria (LGC) group, CFB group, High G+C gram positive bacteria (HGC) group, serta α, , -Proteobacteria group. Kelompok bakteri dengan persentase paling besar adalah -Proteobacteria (Vibrio spp., Pseudomonas spp., dan kelompok lainnya) serta LGC (Bacillales, lactic acid bacteria, Streptococcaceae, Enterococcus spp., dan kelompok lainnya). Sedangkan Pangastuti et al. (2010) menggunakan Terminal Restriction Fragment Length Polymorphism (T-RFLP) untuk menganalisis larva udang vaname dan menemukan 9 phylotypes yang mempunyai kelimpahan tinggi yaitu Bacteroidetes (36 bp dan 529 bp), Pseudomonas (37 bp), Vibrio (149 bp dan 152 bp), α-protobacteria ( 213 bp dan 215 bp), serta 2 phylotypes (58 bp dan 357 bp) yang belum ada di Ribosomal Database Project.
Hood dan Meyers (1974) mengisolasi bakteri dari saluran usus udang putih (P. setiferus) dan air yang berasal dari perairan payau di Barataria Bay, Louisiana. Hasil isolasi di media menunjukkan bahwa bakeri dalam saluran pencernaan terdiri dari genus yang lebih terbatas namun dalam jumlah yang lebih tinggi dibandingkan bakteri di lingkungan airnya. Terbatasnya tipe genus ini menggambarkan kemampuan bakteri tertentu untuk bertahan melewati saluran pencernaan udang dan hidup dalam lingkungan mikro usus udang. Spesies bakteri yang berhasil diisolasi dari usus meliputi Pseudomonas, Vibrio dan Beneckea. Berbeda dengan genus bakteri hasil isolasi dari air yang terdiri dari Bacillus, Pseudomonas, Flavobacterium, Chromobacterium, Micrococcus, Aeromonas, Alginomonas, Vibrio dan genus lainnya. Biomasa mikroba dalam saluran pencernaan lebih tinggi mencapai 2,9 x 107 cfu g-1 dibandingkan dengan di perairan sebesar 1,5 x 105 cfu
ml-1. Bakteri hasil isolasi dari usus tersebut memiliki karakteristik aktif
memperoduksi enzim protease, amilase, lipase, dan khitinase; tumbuh pada pH rendah (5); dan waktu generasi pendek (30 menit) pada suhu relatif rendah (22 oC).
4.4.2 Resistensi Udang Vaname terhadap Infeksi IMNV
4.4.2.1 Sintasan dan Gejala Klinis
25 bakteri SKT-b mampu meningkatkan sintasan hidup udang vaname yang diinfeksi V. harveyi sebesar 91,1% dibandingkan kontrol 46,7%. Peningkatan sintasan ini dimungkinkan karena terjadinya peningkatan beberapa parameter respons imunitas berupa nilai total hemosit, aktivitas fagositosis dan aktivitas phenoloxidase (PO) (Syahailatua 2009).
Gambar 13 Sintasan udang vaname berbagai perlakuan pakan pada hari ke 10 setelah infeksi IMNV (n=15). Angka pada kolom merupakan nilai rataan dan huruf yang berbeda menunjukkan perbedaan nyata (Tukey; α=0,05)
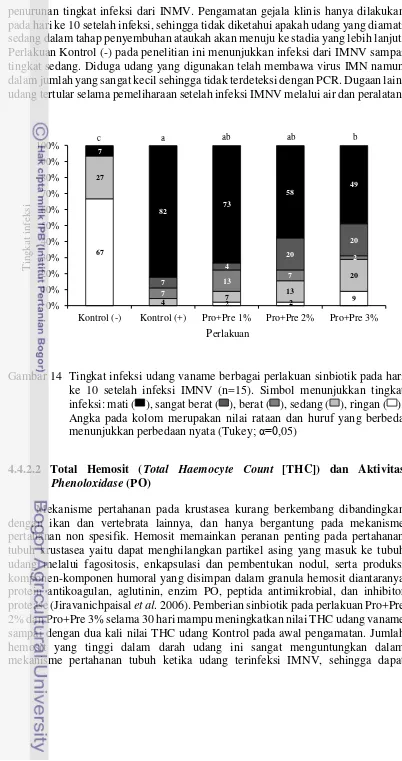
Udang vaname yang masih hidup hari ke 10 setelah infeksi pada perlakuan yang sama memperlihatkan gejala klinis yang berbeda-beda. Gejala klinis yang muncul menunjukkan tingkat infeksi IMNV terhadap udang uji. Infeksi IMNV dimulai dengan munculnya gejala klinis berupa lesi (nekrosis) keputih-putihan di otot bagian belakang. Nekrosis di otot pada stadia awal infeksi dapat sembuh yang ditandai dengan perubahan nekrosis dari coagulative ke liquefactive dan disertai dengan infiltrasi hemosit serta fibrosis. Pada tahap lanjut dari infeksi IMNV, nekrosis kemudian meluas ke seluruh bagian otot abdomen, yang menyebabkan warna otot menjadi putih (tidak transparan) dan kemudian berlanjut ke perubahan warna otot menjadi kemerahan. Pada tahap ini, udang tidak dapat pulih dan berujung pada kematian (Lightner et al. 2004; Tang et al. 2005; Costa et al. 2009). Berdasarkan hasil pengamatan gejala klinis pada hari ke 10 setelah infeksi, Kontrol (+) memperlihatkan tingkat infeksi paling berat yang diiringi dengan tingkat kematian yang tinggi. Pada perlakuan Sinbiotik masih ditemukan udang dengan tingkat infeksi ringan. Persentase udang dengan tingkat infeksi ringan dan sedang semakin tinggi seiring peningkatan dosis prebiotik. Udang perlakuan Pro+Pre 2% dan Pro+Pre 3% menunjukkan tingkat infeksi lebih ringan dan berbeda nyata dengan kontrol (+) (Gambar 14 dan Lampiran 12). Hal ini menandakan peningkatan imunitas pada udang yang diberi perlakuan sinbiotik, yang menyebabkan
93.33
Kontrol (-) Kontrol (+) Pro+Pre 1% Pro+Pre 2% Pro+Pre 3%
26
penurunan tingkat infeksi dari INMV. Pengamatan gejala klinis hanya dilakukan pada hari ke 10 setelah infeksi, sehingga tidak diketahui apakah udang yang diamati sedang dalam tahap penyembuhan ataukah akan menuju ke stadia yang lebih lanjut. Perlakuan Kontrol (-) pada penelitian ini menunjukkan infeksi dari IMNV sampai tingkat sedang. Diduga udang yang digunakan telah membawa virus IMN namun dalam jumlah yang sangat kecil sehingga tidak terdeteksi dengan PCR. Dugaan lain, udang tertular selama pemeliharaan setelah infeksi IMNV melalui air dan peralatan.
Gambar 14 Tingkat infeksi udang vaname berbagai perlakuan sinbiotik pada hari ke 10 setelah infeksi IMNV (n=15). Simbol menunjukkan tingkat infeksi: mati ( ), sangat berat ( ), berat ( ), sedang ( ), ringan ( ). Angka pada kolom merupakan nilai rataan dan huruf yang berbeda menunjukkan perbedaan nyata (Tukey; α=0,05)
4.4.2.2 Total Hemosit (Total Haemocyte Count [THC]) dan Aktivitas
Phenoloxidase (PO)
Mekanisme pertahanan pada krustasea kurang berkembang dibandingkan dengan ikan dan vertebrata lainnya, dan hanya bergantung pada mekanisme pertahanan non spesifik. Hemosit memainkan peranan penting pada pertahanan tubuh krustasea yaitu dapat menghilangkan partikel asing yang masuk ke tubuh udang melalui fagositosis, enkapsulasi dan pembentukan nodul, serta produksi komponen-komponen humoral yang disimpan dalam granula hemosit diantaranya protein antikoagulan, aglutinin, enzim PO, peptida antimikrobial, dan inhibitor protease (Jiravanichpaisal et al. 2006). Pemberian sinbiotik pada perlakuan Pro+Pre 2% dan Pro+Pre 3% selama 30 hari mampu meningkatkan nilai THC udang vaname sampai dengan dua kali nilai THC udang Kontrol pada awal pengamatan. Jumlah hemosit yang tinggi dalam darah udang ini sangat menguntungkan dalam mekanisme pertahanan tubuh ketika udang terinfeksi IMNV, sehingga dapat
67
Kontrol (-) Kontrol (+) Pro+Pre 1% Pro+Pre 2% Pro+Pre 3%
27 meminimalisir kerusakan akibat infeksi (menurunkan tingkat infeksi) dan meningkatkan sintasan. Selama periode pengamatan parameter imunitas, nilai THC udang perlakuan Pro+Pre 2% dan Pro+Pre 3% memperlihatkan pola yang berbeda dengan perlakuan lainnya. Setelah infeksi IMNV, nilai THC udang perlakuan Pro+Pre 2% dan Pro+Pre 3%, terus mengalami penurunan sampai dengan akhir pengamatan (hari ke 10). Sebaliknya nilai THC perlakuan Pro+pre 1% dan Kontrol (+) menunjukkan peningkatan pada hari ke lima dan menurun kembali di akhir pengamatan (Gambar 15). Penurunan nilai THC udang perlakuan Pro+Pre 2% dan Pro+Pre 3% mengindikasikan reaksi cepat terhadap infeksi yang diberikan. Penurunan jumlah hemosit ini merupakan efek dari berjalannya mekanisme pertahanan tubuh seperti infiltrasi hemosit pada jaringan yang terinfeksi, kematian sel hemosit akibat apoptosis (Costa et al. 2009), aktivitas fagositosis, enkapsulasi, pembentukan nodul, serta terjadinya proses degranulasi untuk aktivasi sistem prophenoloxidase (proPO) dan mekanisme pertahanan tubuh lainnya (Smith et al. 2003).
Gambar 15 Total hemosit udang vaname perlakuan: Kontrol (-) ( ), Kontrol (+)( ), Pro+Pre 1% ( ), Pro+Pre 2% ( ), Pro+Pre 3% ( ) pada hari ke-nol sebelum infeksi, hari ke 5 dan ke 10 setelah infeksi IMNV (n=3). Angka pada kolom merupakan nilai rataan dan huruf yang berbeda menunjukkan perbedaan nyata (Tukey; α=0,05)
Tingginya proses degranulasi dapat dilihat dari meningkatnya aktivitas PO. Aktivitas PO digunakan untuk mengukur aktivasi sistem proPO. Parameter imunitas ini adalah bagian dominan pada sistem pertahanan krustasea yang berperan dalam perilaku sel, pelepasan dan atau aktivasi molekul-molekul fungsional penting serta netralisasi agen penginfeksi (Smith et al. 2003). Infeksi IMNV menyebabkan peningkatan aktivitas PO udang vaname sampai akhir pengamatan. Peningkatan aktivitas PO juga terjadi pada P. vannamei yang diinfeksi Taura Syndrome Virus (Song et al. 2003). Peningkatan aktivitas PO di hari ke lima
28
setelah infeksi pada udang yang diberi perlakuan sinbiotik lebih tinggi dibandingkan dengan Kontrol (+) (Gambar 16). Aktivitas PO tertinggi terjadi pada perlakuan Pro+Pre 3% sebesar 0,61 PO 100µl-1 (hari ke 10 pengamatan). Pola
peningkatan aktivitas PO yang tajam pada udang perlakuan sinbiotik, sudah terjadi pada hari ke 5 dan semakin meningkat pada pengamatan hari ke 10. Sebaliknya pada udang perlakuan Kontrol (+) pola peningkatan tajam baru mulai terjadi setelah hari ke lima, menandakan respons imunitas yang lebih lambat. Respons imunitas yang lambat akan merugikan karena dapat memberikan kesempatan pada virus untuk memperbanyak diri dan menimbulkan kerusakan parah pada udang sehingga tidak memungkinkan lagi untuk memulihkan diri, yang akan berujung pada kematian udang.
Gambar 16 Aktivitas PO udang vaname perlakuan: Kontrol (-) ( ), Kontrol (+)( ), Pro+Pre 1% ( ), Pro+Pre 2% ( ), Pro+Pre 3% ( ) pada hari ke 0 sebelum infeksi, hari ke 5 dan ke 10 setelah infeksi IMNV (n=3). Angka pada kolom merupakan nilai rataan dan huruf yang berbeda menunjukkan perbedaan nyata (Tukey; α=0,05)
Hasil pengukuran parameter imunitas menunjukkan bahwa nilai THC dan aktivitas PO udang uji sangat bervariasi, bahkan pada udang dengan perlakuan dan ulangan yang sama. Hal ini dikarenakan setiap individu udang berada pada tingkat infeksi yang berbeda-beda (ditunjukkan dengan beragamnya gejala klinis yang muncul), sehingga menyebabkan perbedaan nilai parameter imunitasnya. Nilai dari parameter imunitas sangat tergantung pada kondisi fisiologis individu (Maggioni et al. 2004; Le Moullac et al. 1997) atau perubahan lingkungan (Le Moullac dan Haffner 2000). Keragaman nilai THC dan aktivitas PO individu udang ini menyebabkan standar deviasi antar perlakuan sangat tinggi sehingga hasil analisis statistik menunjukkan tidak berbeda nyata walaupun secara nominal memperlihatkan perbedaan yang sangat signifikan. Nilai parameter imunitas yang