PENGARUH BERAT MOLEKUL KITOSAN TERHADAP KADAR
PLUMBUM (Pb) DARAH DAN AKTIVITAS ENZIM
δ
-ALAD
(
Delta
Aminolevulinic
Acid
Dehydratase
) MENCIT ALBINO
(
Mus musculus
L.)
TESIS
Oleh
EMNI PURWONINGSIH
057008002/BM
SEKOLAH PASCASARJANA
UNIVERSITAS SUMATERA UTARA
PENGARUH BERAT MOLEKUL KITOSAN TERHADAP KADAR
PLUMBUM (Pb) DARAH DAN AKTIVITAS ENZIM
δ
-ALAD
(
Delta
Aminolevulinic
Acid
Dehydratase
) MENCIT ALBINO
(
Mus musculus
L.)
TESIS
Untuk Memperoleh Gelar Magister Kesehatan
dalam Program Studi Biomedik
pada Sekolah Pascasarjana Universitas Sumatera Utara
Oleh
EMNI PURWONINGSIH
057008002/BM
SEKOLAH PASCASARJANA
UNIVERSITAS SUMATERA UTARA
Judul Tesis
:
PENGARUH BERAT MOLEKUL KITOSANTERHADAP KADAR PLUMBUM (Pb) DARAH DAN AKTIVITAS ENZIM δ-ALAD (Delta Aminolevulinic AcidDehydratase) MENCIT ALBINO
(Mus musculus L.) Nama Mahasiswa : Emni Purwoningsih Nomor Pokok : 057008002
Program Studi : Biomedik
Menyetujui, Komisi Pembimbing
(Dr. Ramlan Silaban, M.Si.) (Dr. Harry. Agusnar, M.Sc., M.Phil.) Ketua Anggota
Ketua Program studi, Direktur,
(dr. Yahwardiah Siregar, Ph.D.) (Prof. Dr. Ir. T. Chairun Nisa B., MSc.)
Telah diuji pada
Tanggal: 12 Agustus 2008
PANITIA PENGUJI TESIS
Ketua : Dr. Ramlan Silaban, M.Si.
Anggota : 1. Dr. Harry Agusnar, M.Sc., M.Phil. 2. Dr. Dwi Suryanto, M.Sc.
ABSTRAK
Industrialisasi berdampak negatif terhadap lingkungan. Buangan asap kendaraan bermotor dan pabrik menghasilkan logam berat plumbum yang berbahaya bagi kesehatan manusia. Plumbum masuk ke tubuh manusia melalui air, udara, dan makanan. Keracunan plumbum dapat merusak hampir semua sistem tubuh. Daya racunnya menghambat kerja enzim pada proses fisiologis dan metabolisme tubuh. Plumbum juga mengganggu sistem sintesa hemoglobin dan aktivitas δ-ALAD.
Kitosan merupakan biopolimer alami yang mampu mengikat logam berat. Kemampuannya tersebut telah diuji pada banyak penelitian. Namun penggunaan kitosan sebagai pengikat logam berat secara invivo belum pernah diteliti. Kemampuan kitosan mengikat logam berat dipengaruhi oleh berat molekul dan derajat deasetilasi yang dimilikinya.
Penelitian ini bertujuan untuk mengetahui apakah ada pengaruh berat molekul kitosan terhadap kadar plumbum darah, kadar hemoglobin dan aktivitas δ-ALAD pada mencit yang telah dipapar plumbum.
Penelitian menggunakan 30 ekor mencit jantan strain BALBC, dengan berat badan 30-45g. Sampel dibagi 10 kelompok, perlakuan dengan volum 0,1mL/KgBB setiap hari selama 14 hari. Sepuluh kelompok terdiri dari; kontrol aqua (K0), kontrol kitosan (K1), kontrol Pb (K2), kontrol as. Asetat (K3), kelompok Pb + kitosan LM 1% (P1), Pb + kitosan LM 2% (P2), Pb + kitosan MM 1% (P3), Pb + kitosan MM 2% (P4), Pb + kitosan HM 1% (P5), Pb + kitosan HM 2% (P6). Darah sampel diambil untuk menentukan kadar plumbum, hemoglobin dan aktivitas δ-ALAD.
Data penelitian diolah dengan program SPSS 13 menggunakan uji ANOVA dan uji lanjutan dengan uji BNT. Hasil analisis diperoleh; (1) Pemberian kitosan pada berat molekul rendah, sedang dan tinggi pada konsentrasi 1% dan 2% lebih tinggi dan berbeda signifikan terhadap kadar hemoglobin darah kelompok K1 dan K3, (2) kadar hemoglobin pada kelompok perlakuan kitosan pada berat molekul rendah, sedang, dan tinggi pada konsentrasi 1% dan 2% tidak berbeda signifikan terhadap kelompoknya, (3) pemberian kitosan pada berat molekul rendah, sedang dan tinggi pada konsentrasi 1% dan 2% tidak berbeda signifikan terhadap kadar plumbum darah mencit kelompok kontrol, (4) pemberian kitosan pada berat molekul rendah dan sedang pada konsentrasi 1% dan 2%, aktivitas enzim δ-ALAD lebih rendah dan berbeda signifikan terhadap kelompok kontrol kecuali terhadap K2, (5) pemberian kitosan pada berat molekul tinggi pada konsentrasi 1% dan 2% aktivitas δ-ALAD lebih tinggi dan berbeda signifikan terhadap kelompok P1, P2, P3, dan P4.
ABSTRACT
Industrialiatio has show a negative impact ton the environment. Heavy metal such as lead, produced from motor vehicle exhaust and industries, are dangerous for human health. Lead enter to the bodey through water, air and food. Lead poisoning can destroy body systems, it blocks the activity of any enzymes important in physiological processes and metabolism. Lead also discrubs the synthesis of hemoglobin and the activity δ-ALAD (delta aminolevulinic acid dehydratase).
Chitosan is a natural biopolymer that binds to heavy metal. The ability of chitosan to absorb heavy metal in factory waste has beeb shown preonously. But use of chitosan as a chelating agent in vivo has not been tested. The afficacy of chitosan is influenced by weight of the chitosa and the extern deacetylation in the molecule.
The present research aimed to test the influence of the moleculer weight of chitosan on the concentration of lead in the blood, the concentration of hemoglobin and activity of δ-ALAD in mice which have been adminintered lead.
This study used 30 Balbc male mice, with a weight of 30-45 g. the animals were divided into 10 groups, all animals received treatment 0,1 Ml/Kg body weight perday for 14 days. The ten groups were the aqua control (K0), the chitosan control (K1), the Pb control (K2), the asetat acid control (K3), and group of treatment Pb + chiitosan LM 1% (P1), Pb + chitosan LM 2% (P2), Pb + chitosan MM 1% (P3), Pb + chitosan MM 2% (P4), Pb + chitosan HM 1% (P5), and Pb + chitosan HM 2% (P6). Blood sampels were to determine hemoglobin concentration, lead concentration and activity of δ-ALAD.
The data was processed by SPSS 13 program using theANOVA test followed by the LSD test. The results of analysis are: (1) the adminitration of chitosan of low, medium or high molecular weight and concentration of 1% or 2% results in significanly different hemoglobin concentration as compared to group of K1 and K2, (2) the hemoglobin concentration in the group in the treated with chitosan of any molecule weight or concentration not significanly different, (3) group given of chitosan of any molecular weight or concentration did not differ significanly in lead concentration as compared to the control groups (4) group given of low chitosan an medium molecular weight chitosan of any concentration significanly δ-ALAD activity, (5) group administered moleculer or weigght chitosan showed significanly δ -ALAD activitty as compared to groups P1, P2, P3 and P4.
Based on the results above, we conclud that chitosan can reduce the concentration of lead in the blood, and increas improve hemoglobin concentration. Mechanism by wich chitosan effect the activity of δ-ALADmust be determined by the research.
KATA PENGANTAR
Puji syukur ke hadirat Allah SWT atas rahimnya dapat menyelesaikan tesis dengan judul ”Pengaruh Berat Molekul Kitosan Terhadap Kadar Pb Darah dan Aktivitas Enzim DALAD Mencit Albino (Mus musculus)”.
Tulisan ini merupakan laporan penelitian yang dilaksanakan di laboratorium terpadu USU. Untuk memenuhi persyaratan meraih gelar Magister pada Sekolah Pasca Sarjana Universitas Sumatera Utara.
Terwujudnya tulisan ini tak lepas dari bantuan berbagai pihak, oleh sebab itu penulis ingin sampaikan terimakasih yang sedalam-dalamnya dan penghargaan yang setinggi-tingginya terutama kepada:
Rektor Universitas Sumatera Utara, Prof. Dr. H. Chairuddin P. Lubis, SpA (K), dan seluruh jajarannya yang telah memberikan kesempatan pada penulis untuk mengikuti pendidikan di sekolah Pascasarjana USU Medan.
Direktur PPs Universitas Sumatera Utara Prof. Ir. T. Chairunnisa B.MSc, dan Ketua Program Studi Biomedik dr. Yahwardiah Siregar, Ph.D., yang telah memberi kesempatan dan fasilitas serta membimbing dan memberi motivasi kepada penulis dalam menyelesaikan pendidikan.
Ketua komisi pembimbing Dr. Ramlan Silaban, M.Si., dan Dr. Harry Agusnar, M.Sc., M.Phil sebagai anggota komisi pembimbing yang telah banyak mengorbankan waktunya untuk memberikan bimbingan, arahan, masukan dan motivasi kepada penulis mulai dari persiapan penelitian sampai pada penyelesain tesis ini.
Komisi penguji, Dr. Dwi Suryanto, M.Sc.dan Dr. Rumondang Bulan, M.Si. yang telah bersedia menguji dan menilai tesis ini.
Persembahan terimakasih yang tulus kedua orang tuaku dan adik-adik tersayang, yang senantiasa mencurahkan perhatian, bantuan moril dan materil, serta do’a kepada penulis. Suamiku tercinta, Abd. Ghofur, S.Pd., M.Pd. yang selalu memberikan motivasi, perhatian dan pengertian pada penulis untuk segera menyelesaikan tulisan ini.
Penulis menyadari akan ketidak sempurnaan tulisan ini. Dengan sepenuh hati penulis bersedia menerima kritik dan saran yang konstruktif. Semoga tulisan ini bermanfaat.
Medan, September 2008
Penulis,
(Emni Purwoningsih)
RIWAYAT HIDUP
1. Nama : Emni Purwoningsih
2. Tempat/Tanggal Lahir : Medan, 05 April 1981
3. Agama : Islam
4. Status : Menikah
5. Alamat : Jl. Jala Permai 1 Blok 8 No. 37 Medan 6. Telp/HP : 061-6853365/ 081264879153
7. Pendidikan
SD Muhammadiyah 04 Belawan : 1987-1993 MTS Muhammadiyah Kwala Madu : 1993-1996
SMA Dharmawangsa Medan : 1996-1999
Sarjana (S1) FMIPA Unimed : 1999-2004 Sekolah Pascasarjana, Program Biomedik, USU : 2005-2008 8. Riwayat Pekerjaan
DAFTAR ISI
Halaman
ABSTRAK ... iv
ABSTRACT... v
KATA PENGANTAR ... vi
RIWAYAT HIDUP... viii
DAFTAR ISI... ix
DAFTAR TABEL... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN... xiv
BAB I PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Perumusan Masalah ... 5
1.3. Kerangka Teori... 6
1.4. Hipotesis ... 7
1.5. Tujuan Penelitian ... 8
1.6. Manfaat Penelitian ... 8
BAB II TINJAUAN PUSTAKA... 9
2.1. Plumbum ... 9
2.1.1. Sifat Fisika dan Kimia Plumbum ... 9
2.1.3. Pengaruh Plumbum pada Sistem Peredaran Darah... 12
2.1.4. Monitoring Plumbum dalam Tubuh Manusia ... 16
2.2. Bahan Pengkhelat (Chelating agent)... 16
2.3. Kitosan ... 17
2.3.1. Sifat-Sifat Kitosan... 18
2.3.2. Berat Molekul (molecular weight (MW)) ... 19
2.3.3. Pengkelat Kitosan dengan Ion-ion Logam... 19
2.3.4. Penggunaan dan Bentuk-bentuk Kitosan ... 20
BAB III METODOLOGI PENELITIAN ... 22
3.1. Desain Penelitian... 22
3.2. Tempat dan Waktu Penelitian ... 22
3.3. Sampel Penelitian ... 22
3.4. Variabel Penelitian ... 22
3.4.1. Variabel Independent ... 22
3.4.2. Variabel Dependent ... 23
3.5. Rancangan Penelitian ... 23
3.6. Pelaksanaan Penelitian ... 24
3.6.1. Prosedur Pemeriksaan ... 25
3.6.1.1. Pengambilan Sampel Darah ... 25
3.6.2. Pembuatan Larutan Pereaksi untuk Analisis
Enzim δ-ALAD... 25
3.6.3. Prosedur Penentuan Aktivitas δ-ALAD... 27
3.6.4. Penentuan Kadar Pb dalam Darah... 28
3.6.5. Penentuan Hematokrit... 28
3.6.6. Penentuan Kadar Hemoglobin ... 29
3.7. Variabel yang Diamati ... 30
3.7.1. Keaktivan Enzim δ-ALAD ... 30
3.7.2. Kadar Pb dalam Darah ... 30
3.7.3. Kadar Hb dalam Darah ... 30
3.8. Analisis Data ... 31
BAB IV HASIL DAN PEMBAHASAN ... 32
4.1. Hasil Penelitian ... 32
4.1.1. Kadar hemoglobin ... 32
4.1.2. Kadar Plumbum Darah Mencit ... 34
4.1.3. Aktivitas Enzim δ-ALAD ... 35
4.2. Pembahasan... 38
BAB V KESIMPULAN DAN SARAN... 43
5.1. Kesimpulan ... 43
5.2. Saran ... 44
DAFTAR TABEL
Nomor Judul Halaman
1. Tingkat kadar Pb di Darah dan Efeknya Pada Anak-anak... 10
2. Pemanfaatan Kitosan Pada Beberapa Industri ... 20
3. Bentuk dan Sifat Kitosan ... 21
4. Data Kadar Hemoglobin Rata-rata Berbagai Kelompok Perlakuan ... 33
5. Hasil Uji BNT Rerata Kadar Hemoglobin Antar Kelompok Perlakuan . 34 6. Data Kadar Plumbum dalam Darah Mencit dari Kelompok Kontrol dan Kelompok Perlakuan... 35
7. Data Aktivitas Enzim δ-ALAD Dalam Darah Mencit dari Kelompok Kontrol dan Perlakuan ... 36
DAFTAR GAMBAR
Nomor Judul Halaman
1. Bagan Kerangka Teori Pengaruh Kitosan terhadap Kadar Pb darah dan Aktivitas Enzym δ-ALAD ... 6 2. Diagram Alir Gangguan Timah Hitam Terhadap Biosintesis
Hemoglobin... 14 3. Struktur Selulosa, Kitin, Kitosan ... 17 4. Grafik Nilai Hb Dari Kelompok Kontrol dan Kelompok Perlakuan ... 33 5. Grafik Aktivitas Enzim δ-ALAD dari Kelompok Kontrol dan
DAFTARLAMPIRAN
Nomor Judul Halaman
1. Data Nilai Rata-rata Hasil Pengukuran Penelitian pada Mencit ... 50
2. Bagan Alir Penentuan Aktivitas Enzim δ-ALAD dalam Darah ... 51
3. Bagan Alir Penentuan Kadar Pb Darah ... 52
4. Bagan Alir Penentuan Hematokrit ... 53
5. Bagan Alir Pemeriksaan Hemoglobin ... 54
BAB I
PENDAHULUAN
1.1. Latar Belakang
Industrialisasi di Indonesia menimbulkan dampak negatif terhadap lingkungan dan kesehatan masyarakat, yaitu pencemaran lingkungan. Logam berat plumbum (Pb) merupakan salah satu pencemar lingkungan yang dihasilkan dari kegiatan industri. Plumbum masuk ke tubuh manusia melalui saluran pernafasan, pencernaan, dan permukaan kulit. Plumbum di udara yang terhirup oleh manusia berasal dari penggunaan bahan bakar bertimbal yang dalam pembakarannya melepaskan timbal oksida yang berbentuk partikulat. Berdasarkan Pedoman Penetapan Baku Mutu Lingkungan (KEP 02/MENKLH/1988) dikatakan bahwa Baku Mutu Udara untuk plumbum adalah 0,06 μg/m3 (Saraswati, 1998). Plumbum dalam makanan berasal dari kontaminasi kaleng makanan dan minuman dan solder yang bertimbal. Plumbum dalam air minum dapat berasal dari kontaminasi pipa, solder dan kran air. Kandungan plumbum dalam air sebesar 15 mg/l dianggap sebgai konsentrasi yang aman untuk dikonsumsi (Hariono, 2005).
Plumbum mengganggu sistem sintesis Hb dengan menghambat konversi delta aminolevulinic acid (delta-ALA) menjadi forfobilinogen dan juga menghambat
korporasi dari Fe ke dalam protoforfirin IX untuk membentuk Hb dengan menghambat enzim delta eminolevulinic acid dehidratase (δ-ALAD) dan feroketalase. Hal ini mengakibatkan meningkatnya ekskresi koproporfin dalam urin dan delta–ALA (ATSDR, 1993; Jeffe, 1991; Akagi et al, 2000).
Pada kasus keracunan logam berat, pengobatan dilakukan dengan terapi bahan pengkhelat. Bahan pengkhelat dapat mengikat logam-logam transisi dengan cara mengikat logam plumbum dan membentuk ikatan kompleks yang membuatnya bersifat polar (hydrophilik), dan dikeluarkan bersama urin. Plumbum dikeluarkan dalam bentuk garam dari uric acid, hipuric acid, dan creatinin. Plumbum yang masuk melalui saluran cerna dan tidak terabsorbsi di saluran cerna akan diekskresikan bersama feses (Luckey dan Venugopel, 1977). Pada tahun 1952 dilakukan terapi bahan pengkhelat pada kasus keracunan arsenic dengan menggunakan EDTA (Ketty, 1942). Golongan aminopolikarboksil termasuk EDTA, N-hidroxy ethylene diamine triacetic acid (HEDTA), diethylen triamin pentaacetic acid (DTPA), dan nitrilo triacetic acid (NTA) merupakan bahan pengkhelat komersil yang umum digunakan. Asam amino sintetik yang pertama kali digunakan untuk treatment pada keracunan logam berat adalah EDTA. Polimer pengkhelat juga dapat diperoleh dari bahan alami, yang berpotensi salah satunya adalah kitosan (Sanghi, 2000).
Kitosan memiliki kemampuan untuk mengikat logam dan membentuk kompleks logam-kitosan. Kitosan merupakan bahan pengkhelat ion yang sangat baik (Wan Ngah et al, 1998). Elektron dari nitrogen yang terdapat pada gugus amina dapat
rantai polimer (Onsoyen & Skaugrud, 1990). Alimuniar (1992), melaporkan bahwa penggunaan larutan kitosan untuk menyerap logam berat harus terlebih dahulu disesuaikan pH larutannya, begitu pula dilaporkan bahwa kitosan yang dilarutkan asam asetat dapat digunakan sebagai absorben yang baik pada beberapa logam berat, seperti: Hg, Zn, Pt, Ni, Ag, Co, Cd, Cu dan Cr dengan tujuan untuk pengolahan air limbah.
Kitosan merupakan turunan biopolymer karbohidarat alami yang diperoleh dari deasetylasi kitin. Kitin dapat diperoleh dari invertebrata laut, serangga, jamur, dan ragi (Guibal, 2004). Jenis crustacean mengandung 20-30% kitin pada bagian eksoskletonnya.
Fernandez-Kim, (2004) melaporkan, bahwa kitosan aman untuk kesehatan manusia karena bersifat tidak beracun (non-toxic), dapat diuraikan secara alami (biodegradabel), penyerap logam (biosorbents). Menurut Knorr, (1984) kitosan
dimanfaatkan pada beberapa industri, seperti di industri pharmasi dan industri biomedik (immobilisasi enzym dan pemurnian (purification)), di industri kimia (pengolah limbah), dan di industri makanan (pengawet makanan, bahan pengental, dan gel). Dosis harian kitosan yang dianjurkan untuk pengobatan adalah 1-3gram (Ultranutrition, 1999)
derajat deasetilasi 84,3% , berat molekul 6,5x105 pada suhu 370C selama 8 jam (Zhou et al, 2003).
Jenis bahan pengkhelat alami lainnya yang pernah diteliti adalah ekstrak Du-zhong. Lee Kyung et al (2005) melaporkan bahwa pemberian plumbum dengan dosis 25 mg/KgBB terhadap tikus jantan menurunkan aktivitas enzim δ-ALAD dan pemberian Pb dan ekstrak Du-zhong (Eucomnia ulmoides Oliv) dengan dosis 0,139 g/kg bb (Pb + DzCw) meningkatkan kadar hematokrit dan Hb darah.
Berdasarkan data-data penelitian yang dikemukakan tersebut diatas, maka akan dilakukan penelitian tentang pengaruh berat molekul kitosan terhadap kadar plumbum darah dan terhadap aktivitas enzim δ-ALAD serta karakteristik darah mencit jantan. 1.2. Perumusan Masalah
Telah dilakukan penelitian tentang pengaruh pemberian plumbum terhadap aktivitas enzim δ-ALAD dan gambaran darah pada hewan percobaan. Kemampuan kitosan sebagai khelator bagi logam berat seperti plumbum juga telah banyak diteliti. Meskipun demikian, sejauh ini belum ada penelitian tentang bagaimana pengaruh pemberian plumbum dan kitosan dengan berbagai tingkat berat molekul sebagai bahan khelasi terhadap kadar plumbum darah karakteristik darah dan aktivitas enzim δ-ALAD secara in vivo.
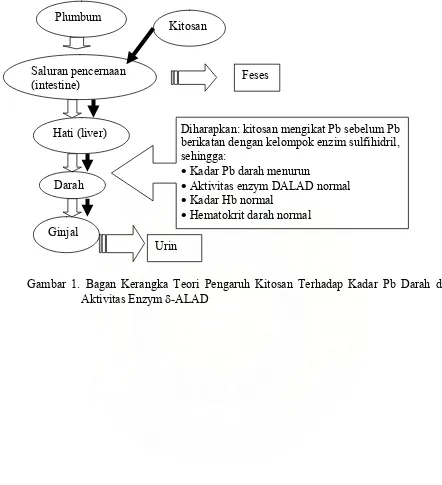
Gambar 1. Bagan Kerangka Teori Pengaruh Kitosan Terhadap Kadar Pb Darah dan Aktivitas Enzym δ-ALAD
Plumbum
Kitosan
Saluran pencernaan
(intestine) Feses
Hati (liver) Diharapkan: kitosan mengikat Pb sebelum Pb berikatan dengan kelompok enzim sulfihidril, sehingga:
• Kadar Pb darah menurun
• Aktivitas enzym DALAD normal
• Kadar Hb normal
• Hematokrit darah normal Darah
Ginjal
1.4. Hipotesis
Yang menjadi hipotesis pada penelitian ini adalah:
1. Ho1: tidak ada pengaruh berat molekul kitosan terhadap kadar plumbum darah mencit jantan
Ha1: ada pengaruh berat molekul kitosan terhadap kadar plumbum darah mencit
2. Ho2: tidak ada pengaruh berat molekul kitosan terhadap aktivitas enzim δ- ALAD
Ha2: ada pengaruh berat molekul kitosan terhadap aktivitas enzim δ -ALAD 3. Ho3: tidak ada pengaruh konsentrasi kitosan terhadap kadar lumbum darah
mencit jantan
Ha3: ada pengaruh konsentrasi kitosan terhadap kadar plumbum darah mencit jantan
4. Ho4: tidak ada pengaruh konsentrasi kitosan terhadap aktivitas enzim δ -ALAD
1.5. Tujuan Penelitian
Tujuan umum :
Penelitian ini adalah untuk mengetahui pengaruh kitosan terhadap keracunan plumbum pada mencit jantan.
Tujuan khusus penelitian ini adalah:
a. Untuk mengetahui pengaruh pemberian kitosan dengan berat molekul yang berbeda terhadap kadar plumbum darah mencit jantan.
b. Untuk mengetahui pengaruh pemberian kitosan dengan berat molekul yang berbeda terhadap aktivitas enzim δ-ALAD mencit jantan.
1.6. Manfaat Penelitian
Hasil penelitian diharapkan bermanfaat untuk :
a. Bahan informasi tentang efek industri terhadap lingkungan dan kesehatan. b. Bahan informasi tentang bahaya plumbum yang berasal dari limbah industri
dan asap kendaraan.
BABII
TINJAUAN PUSTAKA
2.1. Plumbum
2.1.1. Sifat fisika dan kimia Plumbum
Plumbum adalah logam berat dengan nomor atom 82, berat atom 207,19 dan berat jenis 11,34. Bersifat lunak dan bewarna biru keabu-abuan dengan kilau logam yang khas sesaat setelah dipotong. Kilaunya akan segera hilang sejalan dengan pembentukan lapisan oksida pada permukaannya, mempunya titik leleh 327,50C dan titik didih 1740 0
C (MSDS, 2005).
Lebih dari 95% plumbum bersifat anorganik dan umumnya dalam bentuk garam plumbum anorganik, kurang larut dalam air, selebihnya berbentuk plumbum organik. Plumbum organik ditemukan dalam bentuk senyawa tetraethylled (TEL) dan tetramethyllead (TML). Jenis senyawa ini hampir tidak larut dalam air, namun dapat dengan larut dalam pelarut organi, misalnya dalam lipid (WHO, 1977)
2.1.2. Keracunan Plumbum
Anak lebih rantan keracunan plumbum karena sistem syaraf dan pencernaan anak masih dalam tahap perkembangan. Anak dapat menyerap hingga 50% plumbum yang masuk ke dalam tubuh, sedang dewasa hanya menyerap 10-15%. Anak dapat menyerap 3 kali dosis lebih besar dibanding orang dewasa karena memiliki perbandingan permukaan penyerapan dan volume yang lebih besar (WHO, 1977). Dalam jumlah kecil, plumbum dapat menyebabkan gangguan pada fase awal pertumbuhan fisik dan mental yang kemudian berakibat pada fungsi kecerdasan dan kemampuan akademik. Kadar plumbum di darah anak-anak sebesar 10-15 μg/dL akan mengakibatkan gangguan kognitif dan perkembangan kemampuan dasar (CDC, 2000).
Efek yang disebabkan oleh keracunan plumbum pada anak-anak adalah: Tabel 1. Tingkat Kadar Pb di Darah dan Efeknya Pada Anak-anak Kelompok Tingkat kadar Pb di darah Efek pada anak-anak
1 1-9 μg/dL Gangguan belajar
10-14 μg /dL 2
15-19 μg/dL
Gangguan pendengaran, pertumbuha lamban, masalah belajar
3 20-44 μg /dL Sakit kepala, Berat badan menurun gangguan nevous system
4 45-69 μg /dL Anemia, nyeri perut yang hebat
5 > 69 μg /dL Kerusakan otak mengakibatkan kematian Sumber: Center for Disease Control and Prevention, 2000
jumlah sperma yang abnormal. Jumlah yang sangat tinggi pada wanita akan mengakibatkan keguguran. Tingginya level plumbum didarah juga meningkatkan tekanan darah (Shannon, 1998)
Plumbum memiliki 3 sifat biokimia yang penting, yang dapat menimbulkan efek toxik pada manusia:
a. Plumbum merupakan logam yang bersifat elektropositif dengan afinitas yang tinggi untuk kelompok enzyme sulfhydryl dan menghambat enzym sulfhydryl seperti 5-aminolivolinic acid (ALAD, EC 4.2.1.24) dan ferrochetalase (EC 4.99.1.2) yang sangat penting pada sintesa haem.
b. Aktivitas divalensinya menyerupai kalsium dan aksinya sebagai competitive inhibitor di dalam daerah yang sangat penting seperti phosporilasi oksidativ
mitokondria. Plumbum merusak system messenger yang diatur oleh kalsium dengan demikian akan mempengaruhi fungsi endokrin dan neural.
c. Plumbum juga dapat mempengaruhi transkripsi DNA, yang berinteraksi dengan ikatan protein asam nukleat yang memiliki kemampuan mengatur gen. (Goering, 1993).
2.1.3. Pengaruh Plumbum pada Sistem Peredaran Darah
Plumbum mempengaruhi sistem peredaran darah dengan berbagai cara :
2. Mempengaruhi kelangsungan hidup sel darah merah. Sel darah merah yang diberi perlakuan dengan plumbum, memperlihatkan peningkatan tekanan osmosis dan kelemahan pergerakan. Selain itu juga memperlihatkan penghambatan Na-K-ATP ase yang meningkatkan kehilangan kalium intraseluler. Pengaruh ini menjelaskan bahwa kejadian anemia pada peristiwa keracunan plumbum disertai oleh singkatnya waktu hidup sel darah merah. 3. Menghambat biosintesis hemoglobin dengan cara menghambat aktivitas
enzim δ ALAD dan enzim ferroketalase (WHO, 1977). a. Aktivitas Enzim
Enzim didefinisikan oleh Dixon dan Webb sebagai suatu protein yang
bersifatkatalis, karena kemampuannya untuk mengaktifkan senyawa lain secara spesifik (dalam Sadikin, 2002).
Dalam menjalankan tugasnya, enzim membutuhkan logam atau vitamin atau gabungan dari keduanya sebagai ko-faktor dan aktivator (Heryando, 1994). Logam mempunyai peran yang sangat menentukan dalam aktivitas enzimatik. Logam berat juga mempunyai kemampuan untuk berikatan dengan enzim. Ikatan itu dapat terjadi karena logam berat mempunyai kemampuan untuk menggantikan gugus logam yang berfungsi sebagai ko-faktor enzim.
oleh enzim menjadi sangat berkurang atau sama sekali tidak bekerja (Palar, 1994).
Plumbum adalah logam berat yang merupakan inhibitor (penghambat kerja) enzim. Kerjanya berdasarkan reaksi dengan gugus sulfihidril yang diperlukan oleh enzim agar berfungsi normal (Ariens, 1993). Akibat terbentuknya ikatan antara subtrat-enzim dengan logam berat adalah tidak berfungsinya subtrat-enzim sebagaimana mestinya (Palar, 1994). Enzim δ-ALAD merupakan enzim yang peka terhadap penghambat plumbum (Mayes, et al,1985).
- METABOLITES AND ABNORMAL PRODUCTS ACCUMULATED IN HUMAN LEAD POISONING ENZYMATIC STEPS
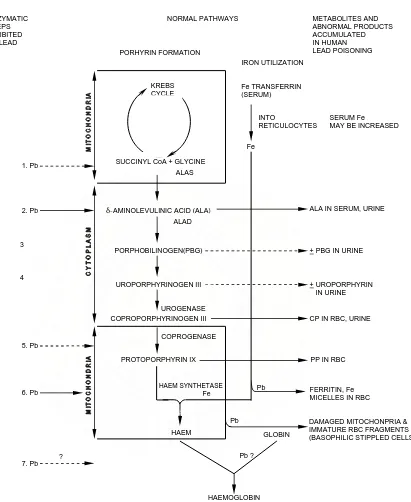
Gambar 2. Diagram Alir Gangguan Timah Hitam Terhadap Biosintesis Hemoglobin (WHO, 1977).
INHIBITED BY LEAD
PORHYRIN FORMATION
SUCCINYL CoA + GLYCINE ALAS
-AMINOLEVULINIC ACID (ALA) ALAD PORPHOBILINOGEN(PBG) UROPORPHYRINOGEN III COPROPORPHYRINOGEN III UROGENASE COPROGENASE PROTOPORPHYRIN IX HAEM SYNTHETASE Fe HAEM Fe TRANSFERRIN (SERUM) IRON UTILIZATION INTO RETICULOCYTES Fe
ALA IN SERUM, URINE
+ PBG IN URINE
+ UROPORPHYRIN IN URINE
CP IN RBC, URINE
PP IN RBC
FERRITIN, Fe MICELLES IN RBC
DAMAGED MITOCHONPRIA & IMMATURE RBC FRAGMENTS (BASOPHILIC STIPPLED CELLS)
HAEMOGLOBIN NORMAL PATHWAYS GLOBIN KREBS CYCLE Pb Pb 1. Pb 2. Pb 3 4 5. Pb SERUM Fe
MAY BE INCREASED
Pb ? 6. Pb
b. Biosintesis Hemoglobin
Hemoglobin merupakan protein konjugasi globulin dan heme yaitu suatu kompleks protoporfirin dengan besi. Biosintesis porfirin berasal dari derivate Ko-enzim A dari asam suksinat pada Siklus Krebs dalam mitokondria dan asam amino glisin. Hasil reaksi kondensasi antara suksinil Ko-enzim A dan glisin adalah asam alfa amino beta ketoadipat yang dengan cepat dikarboksilasi menjadi asam delta aminolevulenat. Sintesis asam delta-aminolevulenat terjadi di mitokondria.
Dalam sitoplasma 2 molekul aminolevulenat dikatalisis oleh enzim delta-aminolevulinic acid dehydratase membentuk 2 molekul air dan 1 molekul porfobilinogen. Masih dalam sitoplasma, 4 unit porfobilinogen mengalami kondensasi membentuk polimer siklik yaitu uroporfobilinogen. Ada 2 isomer uroporfobilinogen, yaitu isomer tipe I dan isomer tipe III. Heme berasal dari isomer tipe III. Uroporfobilinogen III diubah menjadi koproporfirinogen III. Reaksi ini dikatalisis oleh uroporfirinogen dekarboksilase.
2.1.4. Monitoring Plumbum dalam Tubuh Manusia
Untuk mengetahui seberapa besar kandungan plumbum yang diabsorbsi, dapat dilakukan dengan beberapa cara. Tiga cara yang umum dilakukan adalah:
a. Pengujian kadar koproporfirin dalam urin b. Pengujian kadar ALA dalam urin
c. Pengujian kadar ALA dan kativitas enzim -ALAD dalam darah
Pengujian kadar ALA dan aktivitas enzim -ALAD dalam darah biasanya dipakai untuk mengetahui kandungan plumbum pada orang yang terpapar plumbum. Pengukuran yang paling sensitif adalah pengukuran yang dilakukan terhadap penurunan aktivitas enzim -ALAD (WHO, 1977).
2.2. Bahan Pengkhelat (Chelatingagent)
Istilah chelate pertamakali digunakan oleh Morgan pada tahun 1920, diperoleh dari cangkang lobster atau jenis crustacean (Wikipedia, 2006). Bahan pengkhelat dapat mengikat logam-logam transisi. Bahan khelat yang sering digunakan adalah pengkhelat buatan yaitu EDTA. Bahan pengkhelat mengikat logam timbal dan membentuk ikatan kompleks yang membuatnya bersifat hydrophilik, dan mengluarkan bersama urin. Perlakuan ini telah dilakukan pada kasus keracunan arsenik di tahun 1952 (Ketty, 1942).
Karakteristik yang penting dan ideal yang harus dimiliki bahan pengkhelat logam adalah:
a. Dapat mengurangi efek racun logam pada sel target. b. Dapat meperkecil atau mencegah malfungsi pada sel.
d. Menghilangkan atau meminimalisir toxisitas intrinsik (Goyer, at. al, 1995) 2.3. Kitosan
Kitosan merupakan biopolimer alami turunan dari kitin, homopolymer dari (1-4)-amino-2-deoksi- -D-glukosa. Kitin merupakan biopolimer alami tebesar kedua yang dapat ditemukan di alam setelah selulose. Kitin dapat diperoleh dari invertebrata laut, serangga, jamur, dan ragi (Fernandez-Kim, 2004). Chitin dapat diisolasi dari cangkang kepiting dengan 2 tahap dasar, (1) pemisahan protein (deproteinisasi) dan pemisahan kalsium karbonat dan kalsium phospat (demineralisasi) (Kim & Park, 2001).
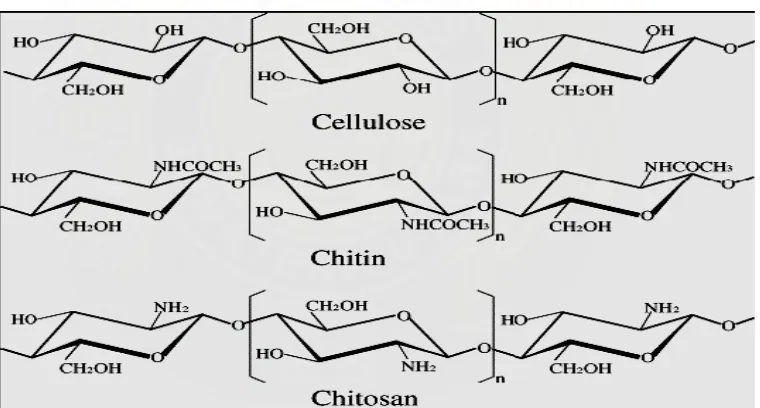
[image:32.612.141.521.339.543.2]Kitin memiliki struktur kimia yang sangat mirip dengan sellulosa. Berikut adalah struktur sellulosa, kitin dan kitosan:
Gambar 3. Struktur Sellulose, Kitin, Kitosan (Fernandez-Kim, 2004)
pengikat dari logam, larutan inorganik anionik, bahan pencelup, dan pestisida (Guibal, 2004). Menurut Rorrer (1993), gugusan amina pada rantai kitosan merupakan tempat pengkhelat untuk logam transisi dan β-1,4 glikosida bergabung dengan unit glukosamina yang tahan terhadap degradasi kimia dan biologi.
Menurut Berger, J et. all (2003) bahwa Parameter utama yang mempengaruhi karakteristik kitosan adalah bobot molekular nya (MW) dan tingkat derajat deacetylation (DD). Berat molekul kitosan adalah sekitar 1,2 X 105Da, bergantung pada degradasi yang terjadi selama proses deasetilasi.
2.3.1. Sifat-sifat kitosan
Kitosan mudah mengalami degradasi secara biologis dan tidak beracun, flokulan dan koagulan yang baik, mudah membentuk membran atau film serta membentuk gel dengan anion bervalensi ganda, juga sebagai polyelektrolit kationik kuat yang berpotensi tinggi untuk menyerap logam-logam, dalam hal ini berperan sebagai agent pengkhelat dan selanjutnya membentuk kompleks kitosan dengan logam (Wikipedia, 2006).
meningkat dengan meningkatnya derajat deasetilasi. Gel kitosan terdegradasi secara berangsur-angsur, sebagaimana halnya kitosan melarut (Muzzarelli et al.,1988).
2.3.2. Berat molekul (molecularweight (MW))
Kitosan memiliki berat molekul yang tinggi. Berat molekul dari kitosan bervariasi berdasarkan sumber materialnya dan metode preparasinya. Kitin memiliki berat molekul biasanya lebih besar dari satu juta Dalton sementara berat molekul pada kitosan antara 100KDa-1200KDa, bergantung pada proses dan kwalitas produk (Kim et al, 2004). Berat molekul dapat ditentukan dengan beberapa metode seperti chromatography, viscometry dan light scattering (Muzzarelli, 1977).
2.3.3. Pengkelat kitosan dengan ion-ion logam
Kitosan memiliki reaktivitas yang tinggi untuk penyerapan ion dengan beberapa mekanisme:
a. Kandungan yang tinggi pada gugus –OH membuatnya menjadi polymer yang hidrophilic dan memberikan efek khelasi.
b. Kandungan gugus amina primer dengan aktivitas tinggi.
c. Kelompok amina dapat mengikat logam kationik sehingga membuatnya menjadi sepasang elektron (Guibal, et. al. 2005; Inoue et. al., 1993)
Elektron dari nitrogen yang terdapat pada gugus amina dapat mengakibatkan ikatan kovalen dative dengan ion-ion logam transisi. Dimana kitosan sebagai donor eletron pada ion-ion logam transisi. Kitosan memiliki memiliki kemampuan untuk mengikat logam dan membentuk kompleks logam-kitosan (Guibal, 2004).
Kitosan sudah dimanfaatkan dibeberapa bidang industri, seperti yang ditunjukkan pada tabel berikut:
Tabel 2. Pemanfaatan Kitosan Pada Beberapa Industri
Industri Manfaat
Industri pengolahan limbah Penyerap ion logam, koagulan, protein, asam amino dan bahan pencelup
Industri makanan Pengawet, penstabil makanan, penstabil warna bahan pengental, dll.
Industri kesehatan Penyembuh luka dan tulang, pengontrol kholestero darah, kontak lensa, penghambat plag gigi, dll. Industri pertanian Pupuk, pelindung biji, dll.
Kosmetik Pelembab (moisturizer), krem wajah, tangan da bada, dll.
Bioteknologi Dapat immobolisasi enzim, chromatography penyembuh sel, dll.
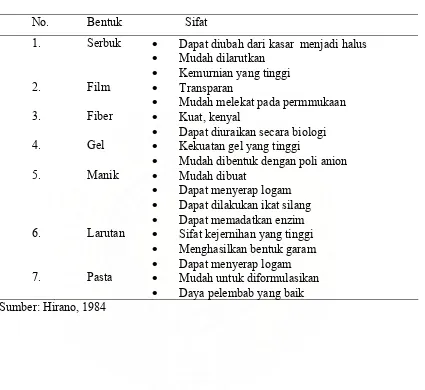
Kitosan terdiri dari berbagai bentuk dan sifatnya seperti yang ditunjukkan pada tabel 3, di bawah ini:
Table 3. Bentuk dan Sifat Kitosan
No. Bentuk Sifat
1. Serbuk • Dapat diubah dari kasar menjadi halus
• Mudah dilarutkan
• Kemurnian yang tinggi
2. Film • Transparan
• Mudah melekat pada permmukaan
3. Fiber • Kuat, kenyal
• Dapat diuraikan secara biologi 4. Gel • Kekuatan gel yang tinggi
• Mudah dibentuk dengan poli anion
5. Manik • Mudah dibuat
• Dapat menyerap logam
• Dapat dilakukan ikat silang
• Dapat memadatkan enzim 6. Larutan • Sifat kejernihan yang tinggi
• Menghasilkan bentuk garam
• Dapat menyerap logam 7. Pasta • Mudah untuk diformulasikan
BAB III
METODOLOGI PENELITIAN
3.1. Desain Penelitian
Desain yang digunakan pada penelitian ini adalah studi experimental pada mencit jantan.
3.2. Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di laboratorium terpadu USU, selama 12 minggu. 3.3. Sampel Penelitian
Hewan uji yang digunakan dalam penelitian ini adalah mencit jantan Mus musculus L. strain BALBC, umur 6-7 minggu, dengan kisaran berat badan 30-45gr yang
diperoleh dari Balai Penyidikan dan pengujian veteriner (BPPV) Medan. Sebelum perlakuan mencit terlebih dahulu diaklimatisasi selama seminggu. Mencit dipelihara dalam kandang yang diberi alas sekam dan anyaman kawat sebagai penutup. Pemberian pakan dan minum dilakukan setiap hari secara ad libitum. Pakan yang diberikan berupa pellet produksi PT. Charoen Pokphan Medan dan diberi minum aquadest. Selanjutnya secara acak mencit dimasukkan ke dalam tiap kandang terpisah. Setiap kandang diberi tanda sesuai dengan perlakuan.
3.4. Variabel penelitian
3.4.1. Variabel Independent
1. Pb asetat
3.4.2. Variabel Dependent
1. Aktivitas enzim DALAD 2. Kadar Pb darah
3. Kadar Hb 3.5. Rancangan penelitian
Pada penelitian ini sampel terdiri dari 30 ekor mencit yang dibagi secara acak dalam 10 kelompok masing-masing 3 ekor tiap kelompok dengan kode sebagai berikut:
K0 = 0,01L/KgBB aqudest (kontrol)
K1 = 25mg/KgBB Pb asetat +0,01 L/KgBB aqudest (kontrol larutanPb) K2 = 0,01 L/KgBB aqudest LM 1% (kontrol kitosan)
K3 = 0,01 L/KgBB asetat (kontrol asetat) P1 = larutan Pb+ larutan kitosan LM1% P2 = larutan Pb+ larutan kitosan LM2% P3 = larutan Pb+ larutan kitosan MM1% P4 = larutan Pb+ larutan kitosan MM2% P5 = larutan Pb+ larutan kitosan HM1% P6 = larutan Pb+ larutan kitosan HM2%
Jumlah ulangan tiap kelompok
Penentuan jumlah ulangan untuk tiap kelompok berdasarkan rumus dari Federer (1963), yaitu :
( t- 1 ) ( n-) ≥ 15 t = jumlah perlakuan n = jumlah ulangan
3.6.Pelaksanaan Penelitian
Perlakuan dimulai dengan menimbang berat badan masing-masing mencit dan diberi perlakuan sesuai dengan kelompok perlakuan. Bahan uji diberikan secara oral dengan menggunakan sonde yaitu alat suntik dengan jarum yang berujung tumpul sedikit membendol pada ujungnya. Jarum tumpul tersebut dimasukkan dengan hati-hati kira-kira sampai di lambung, setelah itu bahan uji dipompakan keluar. Volume pemberian bahan adalah 0,01L/Kg BB setiap hari selama 14 hari.
Kitosan yang diberikan ke mencit dalam bentuk larutan dengan pelarut asam asetat 1% dengan berat molekul rendah bersumber dari udang, molekul sedang bersumber dari kepiting dan molekul tinggi bersumber dari blankas. Konsentrasi larutan kitosan 1% dan 2%, untuk menjaga kesetabilan viskositas larutan maka larutan kitosan dibuat setiap pemberian perlakuan.
Satu hari setelah selesai perlakuan berat badan mencit ditimbang dan dimatikan secara dislokasi leher dan dibedah untuk diambil darahnya sebanyak 5 mL selanjutnya dianalisa kadar Pb dalam darah, aktivitas enzim -ALAD, dan kadar Hemoglobin.
3.6.1. Prosedur Pemeriksaan
Adapun prosedur pemeriksaan akan dilakukan penahapan sebagai berikut : Alat dan Bahan
Darah diambil sebanyak 5 ml dengan menggunakan spuit, dimasukkan ke dalam tabung yang telah berisi heparine dan disimpan pada suhu 40C (Wigfield & Farant, 1981).
3.6.2. Pembuatan larutan pereaksi untuk analisis enzim δ-ALAD
Alat dan bahan
Alat yang digunakan dalam pembuatan larutan pereaksi yaitu: timbangan analitik; labu ukur 100 ml, , pH meter, gelas piala 250 ml, batang pengaduk, gelas ukur 50 ml dan 100 ml.
Bahan kimia yang digunakan adalah: Na2HPO4.12H2O; NaH2PO4.2H2O, -ALA; trikloro asetat (TCA), HgCl2, Triton X-100, p-dimethylaminobenzaldehyd, asam asetat glacial, asam perklorat, aquades.
Cara kerja
a. Larutan triton x-100
Sebanyak0,5 mL triton x-100 dicampur dengan 500 mL aquades. b. Larutan buffer natrium fosfat 0,2 mol/L pH 6,4
Sebanyak 53,72 g Na2HPO4.12H2O ditimbang dilarutkan dalam mL 500 mL aquades hingga 100 mL (Larutan A). NaH2PO4.2H2O 23,4 g dilarutkan dalam 500 mL aquades (Larutan B).Selanjutnya 100 mL Larutan A dicampur dengan 168 mL Larutan B, dilakukan pengukuran pH dengan menggunakan pH meter. Jika pH menunjukkan lebih besar dari 6,4, maka larutan ditambahkan asam fosfat sedikit demi sedikit hingga pH 6,4. sedang jika pH lebih rendah dari 6,4, maka larutan ditambah dengan larutan Na2PO4.
Sebanyak 209,5 mg -ALA dimasukkan ke dalam labu ukur 100 ml., dilarutkan dengan aquades hingga 100 mL, dikocok hingga homogen, dan disimpan pada suhu 40C.
d. Larutan trikloro asetat (TCA) 60 g/L yang mengandung HgCl2 60 mmol/L
Sebanyak 15 g TCA dan 4 g HgCl2 dimasukkan ke dalam gelas piala dan ditambah dengan aquades sampai volumenya 250 mL.
e. Larutan pereaksi ehrlich
3.6.3. Prosedur penentuan aktivitas enzim -ALAD dalam darah
Alat dan Bahan
Alat yang digunakan dalam penentuan aktivitas enzim -ALAD adalah: tabung mikro, mikro pipet, inkubator, sentrifugator dan spektrofotometer .
Bahan-bahan yang digunakan adalah: sampel darah, aquades, triton x-100, larutan buffer natrium fosfat 0,2 mol/l pH 6,4, larutan -ALA 125 mmol/L, larutan trikloro asetat (TCA) 60 g/L yang mengandung HgCl2 60 mmol/L ,larutan pereaksi ehrlich. Cara kerja
Pipet 20 μL sample darah dengan mikropipet, dimasukkan dalam tabung mikro tambahkan 100 μL larutan Triton X-100 campur selama 15 detik dan tempatkan campuran dalam ice-bath selama 3 menit untuk menyempurnakan lisis. Ke dalam hemolisat ditambahkan 100 μL buffer natrium fosfat pH 6,4 dan 100 μL larutan δ -Aminolevulinic acid kemudian diinkubasi selama 30 menit pada suhu 37 0C. Untuk blanko tambahkan 200 μL campuran larutan TCA merkuri klorida. Inkubasi semua sample selama 60 menit pada suhu 37 0C. Untuk mengakhiri inkubasi hentikan reaksi dengan menambahkan 200 μL campuran larutan TCA merkuri klorida. Sentrifugasi pada kecepatan 11500 rpm selama 5 menit pada eppendorf microcentrifuge. Setelah disentrifugasi pindahkan 400 μL larutan supernatan ke tabung lain dan tambahkan 400
μL pereaksi Ehrlich. Selanjutnya untuk blanko ditambahkan 400 μL pereaksi Ehrlich
dan 400 μL aquadest. Setelah 5 menit, absorbansi diukur pada panjang gelombang 555 nm (Wigfield & Farant, 1981).
Alat dan Bahan
Alat yang digunakan: tabung reaksi; hote plate, pipet ukur 1,0 ml; spektrofotometer serapan atom (Shimaddzu 650).
Bahan yang digunakan: sampel darah; larutan asam nitrat pekat; larutan asam nitrat 13%.
Cara Kerja
Sebanyak 0,5 ml darah dimasukkan ke dalam tabung reaksi, kemudian ditambahkan asam nitrat pekat kurang lebih 1 ml. Selanjutnya dipanaskan secara perlahan-lahan ke atas hote plate sampai tidak terjadi busa dan larutan bewarna kuning. Pemanasan dilanjutkan sampai kering dengan baik di atas hote plate. Kemudian tambahkan asam nitrat 13%. Kemudian larutan diukur dengan spektrofotometer serapan atom (AAS Simadzu AA 6200) pada panjang gelombang 283,3nm.
3.6.5. Penentuan Hematokrit
Digunakan untuk menentukan aktivitas enzim -ALAD. Alat dan Bahan
Cara Kerja
Sample darah dimasukkan ke dalam pipet hematokrit hingga hampir penuh, kedua ujung pipet ditutup dengan lilin dan kemudian disentrifuge pada kecepatan 16.000 rpm, selama 5 menit. Persentase hematokrit dibaca pada skala khusus.
3.6.6. Penentuan Kadar Hemoglobin
Kadar hemoglobin diukur dengan metode cyanmethemoglobin. Alat dan Bahan
Alat yang digunakan: mikropipet, spektofotometer. Bahan yang digunakan: sampel darah, reagents untuk menentukan konsentrasi hemoglobin (Biosistem reagent & intrumen).
Cara kerja
Preparasi reagents: satu mL reagents ditambah 49 mL air suling, diaduk dan dimasukkan ke dalam botol cokelat, di simpan pada suhu 15-300C dapat stabil dalam 6 hari.
3.7. Variabel yang diamati
3.7.1. Keaktivan enzim -ALAD
Keaktivan enzim dinyatakan dalam mikromolekul porfobilinogen (PBG) per jam per liter eritrosit yang dihitung dengan rumus:
Absorbansi X 109,4 X1,00 µmol PBG /jam/1 eritrosit Hematokrit
3.7.2. Kadar Pb dalam Darah
Kadar Pb dalam darah dinyatakan dalam µg /100 mL darah. Pada alat AAS Langkah-langkah Pengoperasian AAS Simadzu AA 6200, angka yang dibaca pada recorder menunjukkan harga konsentrasi. Sampel darah yang dianalisis kadar Pbnya sebanyak 0,5 ml. Pada waktu pengukuran, volume ditepatkan menjadi 1,0 ml, maka kadar Pb dalam darah adalah:
1 X konsentrasi yang dibaca 0,5
3.7.3. Kadar Hb dalam darah
Untuk mendapatkan konsentrasi Hb maka dihitung dengan rumus: A sampel x 37,5 = C sampel
Keterangan:
3.8. Analisis Data
BAB IV
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
Pada bagian ini dipaparkan hasil penelitian yang diperoleh dari hasil pengukuran terhadap variabel bebas dan terikat. Tujuannya adalah untuk mengetahui pengaruh kitosan terhadap kadar plumbum darah dan aktivitas enzim δ-ALAD. Berdasarkan hasil pengukuran diperoleh data sebagai berikut.
4.1.1. Kadar Hemoglobin
Kadar hemoglobin diukur untuk mengetahui apakah ada pengaruh pemberian kitosan dari beberapa berat molekul,yaitu molekul rendah(LM=<400Kda) yang bersumber dari kulit udang, molekul sedang (MM=400-800Kda) bersumber dari kepiting, dan molekul tinggi (HM=≥900KDa) bersumber dari blangkas, terhadap kadar hemoglobin darah mencit yang diberi Pb asetat secara oral selama 14 hari.
Dari perhitungan didapat kadar hemoglobin darah mencit pada kelompok kontrol berbeda nyata (p<0,05) jika dibandingkan dengan kelompok perlakuan. Pada kelompok kontrol kadar hemoglobin rata-rata pada K1 (kontrol Pb) berbeda signifikan jika dibandingkan dengan K0 (kontrol aqua), K2 (kontrol kitosan) dan K3 (kontrol asetat) serta berbeda nyata jika dibandingkan dengan kelompok perlakuan.
Kadar hemoglobin rata-rata K3 juga berbeda nyata dengan seluruh kelompok kontrol dan kelompok perlakuan.
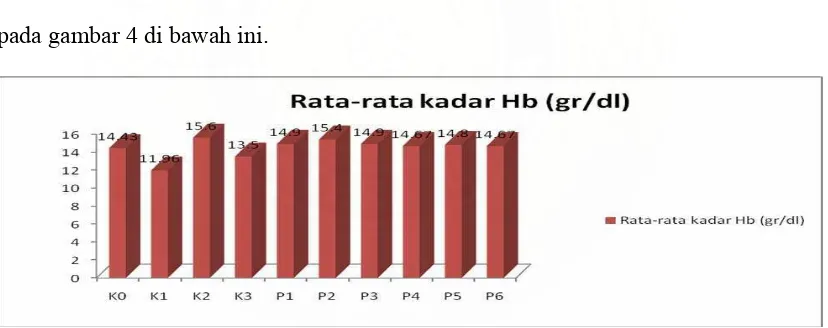
Tabel 4. Data Kadar Hemoglobin Rata-Rata Berbagai Kelompok Perlakuan
Perlakuan Data
Ulangan
K0 K1 K2 K3 P1 P2 P3 P4 P5 P6
1 14,3 12,6 14,8 13 15 15 15 15 15 14,8
2 14 11,3 16 13,5 14,8 15,2 15 15 15,4 15,2
3 15 12 16 14 15 16 14,7 14 14 14
Kadar Hb (gr/dl)
Rerata 14,43 ±0,51 11,96 ±0,65 15,6 ±0,69 13,5 ±0,5 14,9 ±0,17 15,4 ±0,52 14,9 ±0,17 14,67 ±0,57 14,8 ±0,72 14,67 ±0,61
Kadar hemoglobin rata-rata K1 merupakan yang terendah jika dibandingkan dengan kelompok kontrol yang lain maupun kelompok perlakuan. Sedangkan K3 memiliki kadar hemoglobin terendah jika dibandingkan dengan kelompok K0, K2, K2 dan kelomopok perlakuan. Pada gambar 4 terlihat kadar hemoglobin kelompok perlakuan mengaladari peningkatan dari K1 dan K3.
[image:48.612.115.529.375.539.2]Perbedaan nilai Hemoglobin antar kelompok perlakuan dapat dilihat dari grafik pada gambar 4 di bawah ini.
Gambar 4. Grafik Nilai Hb dari Kelompok Kontrol dan Kelompok Perlakuan Setelah dilakukan uji anova kemudian dilanjutkan dengan uji Beda Nyata Terkecil (BNT), untuk mengetahui perbedaan kadar hemoglobin rata-rata antar kelompok seperti yang tercantum dalam tabel 5 berikut ini.
Tabel 5. Hasil Uji BNT Rerata Kadar Hemoglobin antar Kelompok Perlakuan
K0 * * * NS * NS NS NS NS
K1 * * * * * * * * *
K2 * * * NS NS NS * NS *
K3 * * * * * * * * *
P1 NS * NS * NS NS NS NS NS
P2 * * NS * NS NS NS NS NS
P3 NS * NS * NS NS NS NS NS
P4 NS * * * NS NS NS NS NS
P5 NS * NS * NS NS NS NS NS
P6 NS * * * NS NS NS NS NS
Dari hasil uji BNT pada tabel 5 perbedaan yang bermakna (p<0,05) antara sesama kelompok kontrol. Pada K1 dan K3 kadar hemoglobin darah mencit berbeda nyata terhadap kelompok perlakuan P1, P2, P3, P4, P5, dan P6.
Namun hasil uji BNT kadar hemoglobin rata-rata antar kelompok perlakuan P1, P2, P3, P4, P5, dan P6 tidak ada perbedaan yang nyata. Dengan demikian perbedaan berat molekul antara LM, MM dan HM tidak berpengaruh secara signifikan terhadap kadar hemoglobin darah mencit. Perbedaan konsentrasi (1% dan 2%) juga tidak berpengaruh secara nyata terhadap kadar hemoglobin darah mencit.
4.1.2. Kadar Plumbum Darah Mencit
Pengukuran kadar plumbum darah mencit dari tiap kelompok perlakuan untuk mengetahui pengaruh berat molekul kitosan pada konsentrasi 1% dan 2% terhadap kadar timbal darah mencit. Data diuji menggunakan uji anova dan diperoleh p>0,05 artinya kadar plumbum darah antara kelompok kontrol dan kelompok perlakuan tidak berbeda nyata.
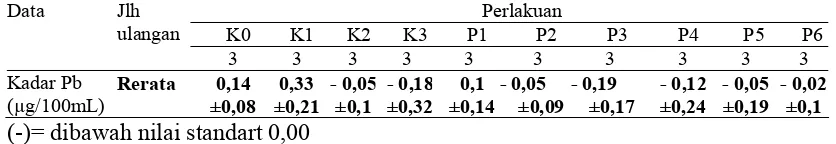
[image:49.612.118.527.81.205.2]Perbedaan kadar plumbum darah rata-rata dari kelompok kontrol dan kelompok perlakuan dapat dilihat pada tabel 6.
Perlakuan
K0 K1 K2 K3 P1 P2 P3 P4 P5 P6
Data Jlh
ulangan
3 3 3 3 3 3 3 3 3 3
Kadar Pb (µg/100mL)
Rerata 0,14 ±0,08 0,33 ±0,21 - 0,05 ±0,1 - 0,18 ±0,32 0,1 ±0,14 - 0,05 ±0,09 - 0,19 ±0,17 - 0,12 ±0,24 - 0,05 ±0,19 - 0,02 ±0,1 (-)= dibawah nilai standart 0,00
Dari tabel 6 dapat dilihat rata-rata kadar Pb darah mencit pada kelompok kontrol K1 (kontrol Pb) memiliki kadar yang tinggi yaitu 0,33 µg/100mL jika dibandingkan dengan kelompok kontrol K0, K2, K3 dan kelompok perlakuan.
4.1.3. Aktivitas Enzim δ-ALAD
Enzim δ-ALAD merupakan enzim yang terlibat dalam sintesa hemoglobin dan aktivitasnya dipengaruhi oleh keberadaan plumbum di dalam darah. Untuk mengetahui apakah pemberian kitosan dengan berat molekul yang berbeda pada konsentrasi 1% dan 2% terhadap aktivitas enzim δ-ALAD mencit yang diberi larutan plumbum selama 14 hari.
[image:50.612.110.528.97.169.2]Data penelitian diuji dengan uji anova, dan diperoleh p<0,05 artinya aktivitas enzim δ-ALAD antara kelompok kontrol dengan kelompok perlakuan berbeda signifikan. Data aktivitas enzim δ-ALAD rata-rata dari kelompok kontrol dan perlakuan ditampilkan pada tabel 7.
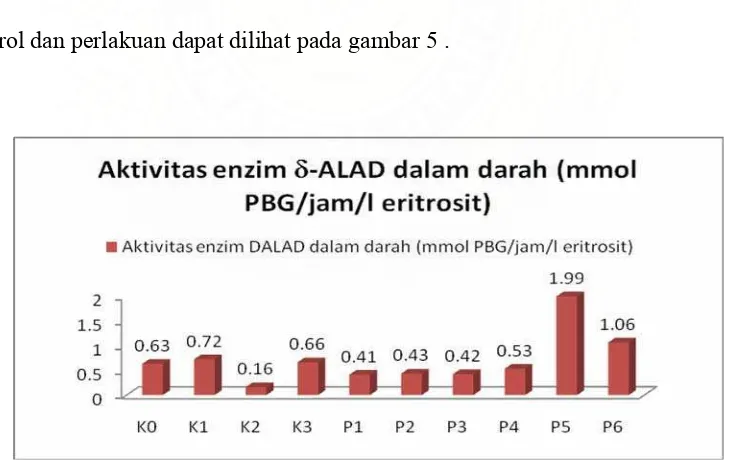
Tabel 7. Data Aktivitas Enzim δ-ALAD Dalam Darah Mencit dari Kelompok Kontrol dan Perlakuan
Perlakuan
Data Ulangan
K0 K1 K2 K3 P1 P2 P3 P4 P5 P6
1 0,68 0,66 0,15 0,61 0,49 0,44 0,45 0,49 1,88 0,77
2 0,63 0,80 0,19 0,78 0,42 0,53 0,45 0,54 2,31 1,21
3 0,58 0,70 0,14 0,58 0,33 0,32 0,37 0,55 1,79 0,66
Aktivitas enzim
DALAD dalam
darah (μmol
eritrosit) ±0,05±0,07 ±0,03 ±0,11 ±0,08 ±0,1 ±0,04 ±0,03 ±0,27 ±0,14
Berdasarkan data tabel 7, aktivitas enzim δ-ALAD pada kelompok K1 mengalami peningkatan jika dibandingkan dengan kelompok K0. Kelompok K2 memiliki aktivitas enzim δ-ALAD yang paling rendah jika dibandingkan dengan kelompok perlakuan yang lain.
[image:51.612.136.503.400.630.2]Dari gambar 5 menunjukkan aktivitas enzim δ-ALAD pada kelompok perlakuan P1, P2, P3, dan P4 mengalami penurunan jika dibandingkan dengan K0, K1, dan K3. Sedangkan aktivitas enzim δ-ALAD pada kelompok perlakuan P5 memiliki nilai yang tertinggi jika dibandingkan dengan kelompok kontrol dan kelompok perlakuan lainnya. Pada kelompok P6 juga mengalami peningkatan aktivitas enzim dari kelompok kontrol dan kelompok P1, P2, P3, dan P4. Perbedaan aktivitas enzim δ-ALAD pada kelompok kontrol dan perlakuan dapat dilihat pada gambar 5 .
Untuk melihat perbedaan antar kelompok uji, kemudian dilanjutkan dengan uji Beda Nyata Terkecil (BNT), maka didapatkan perbedaan antar kelompok perlakuan seperti yang tercantum dalam tabel 8.
Tabel 8. Hasil Uji BNT Antar Rerata Aktivitas Enzim δ-ALAD Berbagai Kelompok Penelitian
Perlakuan K0 K1 K2 K3 P1 P2 P3 P4 P5 P6
K0 NS * NS * * * NS * *
K1 NS * NS * * * NS * *
K2 * * * * * * * * *
K3 NS NS * * * * NS * *
P1 * * * * NS NS NS * *
P2 * * * * NS NS NS * *
P3 * * * * NS NS NS * *
P4 NS NS * NS NS NS NS * *
P5 * * * * * * * * *
P6 * * * * * * * * *
Dari hasil uji BNT pada tabel 8 perbedaan yang bermakna (p<0,05) antara kelompok K2 terhadap K0, K1, dan K3, juga terhadap kelompok perlakuan. Aktivitas enzim δ-ALAD pada kelompok K0, K1, dan K3 berbeda nyata terhadap kelompok P1, P2, P3, P5, dan P6.
Aktivitas enzim δ-ALAD pada kelompok perlakuan P5 (HM1%), dan P6 (HM2%) berbeda nyata dengan kelompok perlakuan lainnya.
4.2. Pembahasan
hemoglobin darah. Keadaan ini sesuai dengan penelitian Sugiharto (2004), dan Hariono (2005) yang menunjukkan pemberian larutan plumbum dapat mengakibatkan penurunan kadar haemoglobin darah tikus. Pada manusia dewasa kadar timah hitam dalam darah mencapai 0,5µg/100mL dapat menurunkan sintesis hemoglobin (WHO, 1987)
Pemberian plumbum dapat menyebabkan tingginya kadar plumbum dalam darah, karena plumbum merupakan kelompok logam toksik yang dapat membentuk ligan kompleks dalam tubuh yang dapat mengganggu aktivitas enzim dan dapat menyebabkan kerusakan organ tubuh. Salah satu jalur metabolisme yang sangat dipengaruhi adalah sistem hemopoitik. Toksisitas timbal disebabkan adanya interaksi atara Pb dengan senyawa ligand yaitu gugus enzim –SH dari δ-ALAD dan enzim hemesintase. Sehingga terjadi hambatan sintesis hemoglobin. Plumbum juga dapat menghambat enzim feroketalase yang menyebabkan ion Fe tidak dapat berikatan dengan cincin protoporpirin, oleh karena terjadi kompetisi antara timbal dengan Fe. Proses ini menyebabkan penurunan kadar hemoglobin (Sugiharto, 2004). Pemberian kitosan dengan berat molekul rendah, sedang dan tinggi dengan konsentrasi 1% dan 2% tidak berpengaruh secara signifikan terhadap kadar Pb darah. Menurut Guibal, 2005; Inoue et.al, 1993., bahwa kemampuan kitosan sebagai pengkhelat karena kandungan yang
belum terlihat perbedaan yang signifikan antar berat molekul kitosan terhadap kadar plumbum darah, walaupun dari grafik pada kelompok perlakuan P3 memiliki kadar plumbum darah yang paling rendah.
Kadar plumbum di darah mempengaruhi kadar hemoglobin. Kecenderungan menurunnya kadar plumbum darah pada kelompok perlakuan yang diberi kitosan, memberi efek terhadap kadar hemoglobin mencit. Pada data tabel 4 terlihat adanya peningkatan kadar hemoglobin yang signifikan antara kelompok kontrol dan kelompok perlakuan, walaupun antar kelompok perlakuan tidak ada perbedaan kadar hemoglobin yang signifikan.
Berdasarkan kemampuan kitosan berikatan dengan logam berat maka pemberian kitosan dapat mengurangi kompetisi antara plumbum dan Fe. Meningkatnya kadar hemoglobin pada kelompok perlakuan pada tabel 4 menunjukkan bahwa proses pembentukan hemoglobin tidak terganggu.
Banyak peneliti melaporkan bahwa aktivitas enzim δ-ALAD dihambat oleh plumbum (WHO,1977; Hasan dan Seth, 1981; Idris, 2004). Dari penelitian yang telah dilakukan menunjukkan bahwa pada pemberian plumbum terjadi peningkatan aktivitas enzim δ-ALAD. Peningkatan aktivitas enzim δ-ALAD juga dilaporkan oleh beberapa peneliti (Maes dan Gerber, 1978; Kajimoto et al, 1982; Hariono 2006). Mekanisme biokomiawi terhadap kenaikan aktivitas enzim δ-ALAD ini belum diketahui.
maka terlihat adanya penurunan aktivitas enzim. Berbeda halnya dengan aktivitas enzim
δ-ALAD pada kelompok perlakuan P5 jika dibandingkan dengan kelompok K1 maka adanya peningkatan aktivitas enzim yang berbeda nyata. Mekanisme biokimiawi pada kenaikan aktivitas δ-ALAD belum diketahui.
Kitosan memiliki 2 karakter yang mempengaruhi kemampuan kerjanya, satu diantaranya adalah tingkat berat molekul yang dimiliki kitosan. Kitosan memiliki berat berat molekul yang besar, dan dibagi menjadi 3 tingkatan berat molekul. Tingkat molekul rendah (low molecul) memiliki berat molekul <400 KDa, molekul sedang (median molecul) memiliki berat molekul 400-800 KDa, dan molekul tinggi (hight molecul) memiliki berat molekul ≥ 900 KDa. Pada penelitian ini sumber kitosan dengan low molekul berasal dari kulit udang, medium molekul dari kulit kepiting dan high molekul dari kulit blangkas.
Kitosan LM, MM dan HM jika dilarutkan dengan asam asetat pada konsentrasi yang sama memiliki viskositas yang berbeda. Semakin tingggi berat molekul dan konsentrasi kitosan maka viskositas (kekentalan) juga semakin tinggi.
Pada penelitian ini pengaruh antar berat molekul LM, MM dan HM pada konsentrasi 1% dan 2% terhadap kadar hemoglobin mencit belum memperlihatkan ada perbedaan yang nyata.
mengalami penurunan aktivitas enzim δ-ALAD jika dibandingkan dengan K0, K1, dan K3.
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Dari hasil penelitian yang dilakukan maka dapat disimpulkan:
a. Pemberian kitosan dengan berat molekul rendah, sedang dan tinggi dengan konsentrasi 1% dan 2% berbeda signifikan terhadap kadar hemoglobin darah mencit terhadap kelompok K1 dan K2.
b. Kadar hemoglobin pada kelompok perlakuan kitosan dengan berat molekul rendah, sedang dan tinggi pada konsentrasi 1% dan 2% tidak berbeda signifikan terhadap kelompoknya.
c. Pemberian kitosan dengan berat molekul rendah, sedang dan tinggi dengan konsentrasi 1% dan 2% tidak berbeda signifikan terhadap kadar plumbum darah mencit kelompok kontrol, tetapi cenderung kadar plumbum darah rata-rata kelompok perlakuan cenderung menurun.
d. Pemberian kitosan dengan berat molekul rendah, sedang dengan konsentrasi 1% dan 2% aktivitas enzim δ-ALAD berbeda signifikan terhadap kelompok kontrol. Aktivitas enzim pada kelompok P1, P2, P3, dan P4 mengalami penurunan jika dibandingkan dengan kelompok K0, K1, dan K3
5.2.Saran
1. Perlu dilakukan penelitian yang sama dengan dengan jumlah sampel yang lebih banyak, untuk melihat pengaruh kitosan pada sampel yang lebih besar.
2. Perlu dilakukan penelitian lanjutan dengan pemberian kitosan secara intra vena, untuk mengetahui pengaruhnya terhadap kadar hemoglobin, plumbum darah dan aktivitas enzim darah, dan dibandingkan dengan pemberian kitosan secara oral. 3. Dilakukan penelitian lanjutan untuk mengetahui pengaruh pemberian kitosan secara
oral terhadap absorbsi mineral yang dibutuhkan oleh tubuh.
4. Penggunaan kitosan dalam penelitian harus memperhatikan viskositasnya, karena pada larutan kitosan akan terjadi pemutusan rantai molekul sehingga viskositas larutan kitosan akan berubah.
5. Pada pengukuran kadar Plumbum darah sebaiknya menggunakan metode yang lebih spesifik untuk dapat membaca kadar plumbum yang sangat kecil.
DAFTAR PUSTAKA
Akagi, R., Nishitani, C., Harigae, H., Horie, Y., Garbaczewski, L., Hassoun, A., Marcelis, R., Versrtraeten, L. and Sassa, S. 2000. Molecular Analysis of Delta Aminolevulinate Dehydratase Deficiency in a Patient with an Unusual Late-Onset Porphyria. Blood. 96: 3618
Alimuniar, A., Zainuddin, R. 1998. An Economical Technique for Producing, Advantage integration chitin and chitosan, London, Elvesier.
A.T.S.D.R. (Agency for Toxic Substances and Disease Registry). 1993. Toxicological profile for lead, Update. Prepared by Clement International Corporation under contact no. 205-88-060 for ATSDR, U.S. Public Health Services, Atlanta, GA.
Berger
a,J., Reist
a,M., Mayera, J. M., O. Felt
b, N.A. Peppas, R. Gurny. 2004.
Strrukture And Interaction In Covalently and Ionocally Crosslinked
Chitosan Hydrgels For Biomedical Applications. European Journal of
Pharm. And BioPharm 57: 19-34
Centers for Disease Control and Prevention (CDC), 2000. Recommendation for Blood Lead Screening of Young Children Enrolled in Medicaid: Targeting a Group at High Risk. MMWR, 49: 1-13.
Ellenhorn, M.J. and Barceloux, D.G. 1988. Medical Toxicology: Diagnosis and Treatment of Human Poisoning. Elsevier Science Publishing Company, Inc. New York.
Fernandez-Kim. 2004. Thesis: Phisicochemichal and Fungtional Properties of Crawfish Chitosan as Effected by Different Processing Protocols. The Departement of Food Science. Soul National University. Available at: etd.esu.edu/docs/available/etd_11102004-134343/unrestricted/kim_03
Federer,W.Y. 1963. Experimental Design Theory and Application. New York, Mac Millan.p: 544.
Goering, P. L. 1993. Lead-Protein Interactions as a Basis for Lead Toxicity. Neurolotoxicology, 14: 45-60.
Guibal, E. 2004. Metal Ion Interaction with Chitosan A Review. Separation and Purification Technology, 3: 43-74.
Guibal, E., Touraud, E., and Roussy, J. 2005. Chitosan Interaction with Metal Ions And Dyes: Dissolved-State Versus Solid-State Application. World J. Microbiol. Biotechnol., 21: 913-20.
http://www.wikipedia.org/chelat. Chelating Agent, up date 2006.
Hariono, 2005. Efek Pemberian Plumbum (Timah Hitam) Anorganik pada Tikus Putih (Rattus norvegicus). J Sain Vet. 23:107-18.
_______, 2006. Efek Pemberian Plumbum (Timah Hitam) organik pada Tikus Putih (Rattus norvegicus). J Sain Vet, 24 : 125-134.
Hirano, Senda, H. dan Watanabe, 1984. Several Novel Attemps for The Use of The Potential Function of Chitin and Chitosan. J. Carbohydrate Polymer 3.
Hasan, M.Z., Seth, T. D. 1981. Effect Of Lead and Zinc Administration on Liver, Kidney and Brain Levels Of Copper, Lead, Manganes And Zinc On Erythrocytes Ala-D Activity In Rats. Toxicol let. p: 353-58.
Idris. 2004. Aktivitas DALAD dan Konsentrasi Hemoglobin pada Ikan Nila (Oreocromis niloticus) yang Didedahkan pada Air Yang Mengandung Timbal. Abstrak Thesis.
Inoue, K., Baba, Y., and Yoshiuzuka, K. 1993. Absorbtion of Metal Ions on Chitosan and Crosslinked Cooper (II) Complexed Chitosan Bulletin Chemistry Science. Japan . Vol. 60: 2915-19.
Jeffe, E. K., Bagla, S. and Machini, P. A. 1991. Reevaluation of Sensitive Indicator of Early Lead Exposure, Measurement of Porphobilinogen Synthese in Blood. Biol-Trace-Elem-Res; 28(3): 223-31.
Kajimoto, M., Kondo, M., Niwa, M., Suzuki, T., Kimura, H., Sasaki, A., and Urata, G. 1983. Increase of δ-aminolevulinic acid dehydratase (ALAD) in rat erytrocytes in lead poisoning. J. Arch Toxicol. p: 52.
Kety, S. S. 1942. The Lead Citrate Complex Ion and Its Role In Physiology and Therapy of Lead Poisoning. J. Biol Chem. p: 181-192.
King, M. W. and Marchesini, S. 2004. Heme and Porphyrin Metabolism. University of Brescia.
Knorr, D. 1984. Use of Chitinous Polymers in Food-A Challenge for Food Research and Development. Food Technol, 38: 85-97
Landes, D. R. & Bough, W. A. 1976. Effect of Kitosan- a Coagulating Agent for
Processing Waste in Diets of Rats-on Growth and Liver and Blood Composition. Bull. Environt. Contam. Toxicol., 15: 555-563
Lee, K. M., Cho, Y.S., Kim, J. D., Jan, Y. J., Shin, H. K., Park, A. S. 2005. Du-Zhong (Eucomnia ulmoides Oliv.) Cortex Water Extract Alters Heme Biosynthesis and Erythrocyte Antioxidant Defense System in Lead-Administered Rats. Journal of Medicine Food, 8: 86-92.
Maes, J. and Geber, G. 1978. increase ALA dehydratase activity and spleen weight in lead-intoxicated rats. A concequence of increase blood cell destruction. Journal celllular and molecular life science,p: 34.
Mi-Kyung Lee et. al. 2005. Du-zhon (Eucommia ulmoides oliv.) cortex extrach alters heme biosynthesis and arythrocyte antioxidant defense system in lead-administered rats. J. Of medicinal food. 8: 86-92.
Murray, K., et. al. 2003. Biokimia Harper. Penerbit Buku Kedokteran EGC, Jakarta, hlm: 343.
Muzzarelli, R., Baldassare. V, Conti, F., Ferrara, P. and Biagini, G. 1988. Biological Activity of Chitosan : Ultrastructural study. Biomaterial. 9: 247-252.
Muzarelli, R. A. A. 1977. Chitin; Pergamon: Oxford
MSDS (Material Safety Data Sheet), 2005. Lead. Health, Safety and Environmental. Departement. Canada Metal.
NIOSH Manual of Analytical Methods (NMAM). 1994. Lead in Blood and Urine. NMAM, fourth Edition.
Orkason, A. and Fowler, B. A. 1985. Effects of Lead on The Heme Biosynthetic Pathway in Rat Kidney. Exp. Mol. Pathol. 43: 409-417.
Palar H. 1994. Pencemaran dan Toksikologi Logam Berat. Penerbit Rineka Cipta. hlm: 23-56.
Purwaningsih , 1994. Teknologi Pembekuan Udang. PT Penebar swadaya. Bogor.
Rorrer, G. L. and Way, J. D. 1999. Chitosan Beads to Remove Heavy Metals from Wastewater. Oregon State University. Available at:
http://www.memberstripod.com/dalwoo/rorrer.html.
Sadikin, M. 2002. Biokimia Enzim. Penerbit Widya Medika. Jakarta. hlm :129. Saraswati. T.R. 1998. Analisis Kadar Timah Hitam Dalam Darah Dan Pengaruhnya Terhadap Aktivitas Enzim Delta Aminolevulinic Acid Dehydratase Dan
Kadar Haemoglobin Dalam Darah Karyawan, Di Industry Peleburan Timah Hitam. Tesis.
Sanghi, R. 2000. What’s Up With Chelates. Current science, p: 78.
Soetopo. 2005. Toksisitas Subkronis Limbah Padat Industri Pulp dan Kertas terhadap Aktivitas Delta-Aminolevulinic Acid Dehydratase (Delta-ALAD) dan Karakteristik Darah Tikus (Rattus norvegicus) Wistar Jantan. Tesis. Sekolah Ilmu dan Teknologi Hayati-ITB, Bandung.
Shannon, M. W. 1998. Lead. In: Haddat, L. M. and Winchester, J. F., eds., Clinical Management of Poisooning and Drug Overdose. Philadelphia: W. B. Saundersm. p: 767-784.
Sugiharto. 2004. Pengaruh Infus Rimpang Temulawak (Curcuma xanthorrhiza) terhadap kadar haemoglobin dan jumlah eritrosit tikus Putih yang diberi larutan timbale nitrat [(PbNO3)2]. Berk. Penel. Hayati. 10: 53-57.
Ultranutrition. 1999. Mega Chitosan PlusTM. Available at:
Http://www.ultranutrition.com/mega_chitosan_plus.htm.
Wan-Ngah, W. S., and Isa, I. M. 1998. Comparison Study of Copper Ion Adsorbtion on Chitosan, Dowex A-Land Zenith 225. J. Apllied Polymer Science. 67 :1067-70 Wigfield, D.C and Farant, J.P. 1981. Assay of δ-Aminolaevulinate Dehydratase in 10
μL of Blood. Clin.Chem. 27: 100-103.
Lampiran 1. Data Nilai Rata-rata Hasil Pengukuran Penelitian pada Mencit
Sampel Ulangan PCV Hb DALADkonsen P Blangk A555 kadar Pb Ueaktif
aqua 14.3 0.28 0.068 0.025 0.255 0.136 0.6807111
aqua 14 0.271 0.112 0.025 0.246 0.224 0.6307957
aqua 15 0.238 0.026 0.028 0.21 0.052 0.5786044
Pb 12.6 0.223 0.256 0.02 0.203 0.512 0.6593568
Pb 11.3 0.294 0.184 0.068 0.226 0.368 0.80409
Pb 12 0.238 0.05 0.02 0.218 0.1 0.7037081
kitosan 14.8 0.055 0.0007 0.041 0.014 0.0014 0.1467561
kitosan 16 0.084 -0.0872 0.024 0.06 -0.1744 0.1997739
kitosan 16 0.062 0.0057 0.028 0.034 0.0114 0.1413083
Asetat 13 0.24 0.072 0.028 0.212 0.144 0.6106047
Asetat 13.5 0.251 -0.087 0.041 0.21 -0.174 0.7845543
Asetat 14 0.214 -0.257 0.041 0.173 -0.514 0.58529
Pb+LM1% 15 0.211 0.0041 0.022 0.189 0.0082 0.4911362
14.8 0.138 0.0155 0.022 0.116 0.031 0.4193667
15 0.123 0.1316 0.041 0.082 0.2632 0.3282
Pb+LM2% 15 0.136 0.021 0.022 0.114 0.042 0.4376
15.2 0.221 -0.034 0.022 0.199 -0.068 0.5255957
16 0.118 -0.069 0.024 0.094 -0.138 0.32273
Pb+MM1% 15 0.184 -0.196 0.028 0.156 -0.392 0.4473244
15 0.167 -0.078 0.02 0.147 -0.156 0.4456049
14.7 0.14 -0.025 0.024 0.116 -0.05 0.373561
Pb+MM2% 15 0.21 -0.198 0.028 0.182 -0.396 0.4994348
15 0.249 -0.032 0.02 0.229 -0.064 0.544812
14 0.206 0.037 0.02 0.186 0.074 0.5496683
Pb+HM1% 15 0.742 -0.072 0.068 0.674 -0.144 1.887786
15.4 0.739 -0.087 0.068 0.671 -0.174 2.3099029
14 0.64 0.086 0.02 0.62 0.172 1.7952821
Pb+HM2% 14.8 0.37 -0.059 0.022 0.348 -0.118 1.0652105
15.2 0.355 -0.022 0.022 0.333 -0.044 1.2136563
Lampiran 2. Bagan Alir Penentuan Aktivitas Enzim δ-ALAD dalam Darah
Wigfield & Farant, 1981
(+) 100 μL Triton-X 100, 15 detik
ice bath 3 menit
20 μL Sample darah
Hemolisat Hemolisat
(+) 100 μL larutan buffer natrium fosfat pH 6,4 (+) 100 μL larutan δ-aminolevulinic acid diinkubasi 37 0C, 90 menit
(+) 200 μL larutan TCA merkuri klorida sentifugasi 1500 rpm, 5 menit
Supernatan
(+) 400 μL pereaksi Ehrlich
setelah 5 menit, diukur absorbansi pada λ 555 nm (400 μL)
Lampiran 3. Bagan Alir Penentuan Kadar Pb dalam Darah
0,5 mL sampel darah
(+) 1 ml asam nitrat pekat, dipanaskan
Pemanasan sampai kering
(+) 10 ml asam nitrat 13%
injeksi ke alat AAS (Shimaddzu 6200)
Lampiran 4. Bagan Alir Penentuan Hematokrit
Sampel darah
dimasukkan ke dalam pipet hematokrit
ujung pipet ditutup lilin
disentrifuse pada 16.000 rpm, 5 menit dibaca persentase pada skala khusus
Lampiran 5. BaganAlir Pemeriksaan Hemoglobin
10 μL sample darah
+ 25 mL reagents Hb
Vortex dan tunggu 3 menit
Diukur absorbansi pada λ 540 nm