ABSTRACT
ANDI ETE, Study on Physiology and Identification of Photosynthetic Protein of Shade Tolerant Upland Rice. Under direction of DIDY SOPANDIE, SARSIDI SASTROSUMARJO, MUHAMMAD AHMAD CHOZIN, AHMAD SURKATI, and MARIA BINTANG.
The research was aimed to study the upland rice response of shading, which was conducted in two stage studies, as followed: firstly, the analysis of agronomical and morpho-physiological characteristics using a split plot design, shading as main plot and genotype/variety as sub plot, and arranged in a block randomized design in three replications. Secondly, study was aimed to find out the specific protein characterization of upland rice as affected by shading using a completely randomized design with two factors in three replications. First factor was shading and second factor was variety.
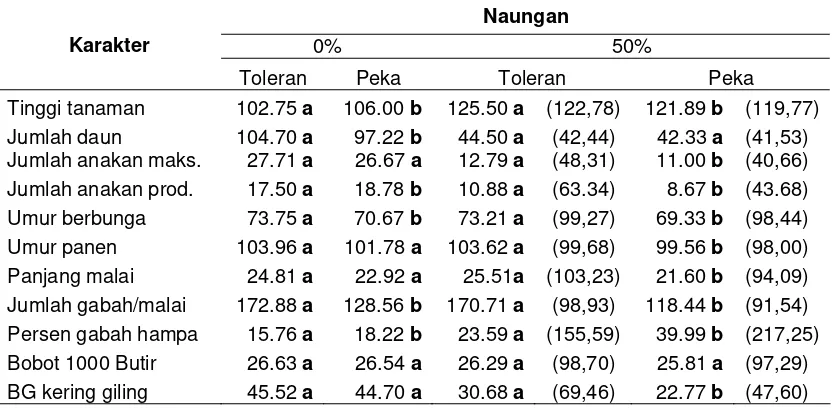
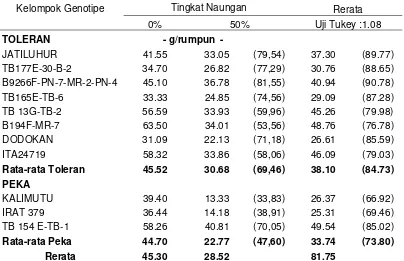
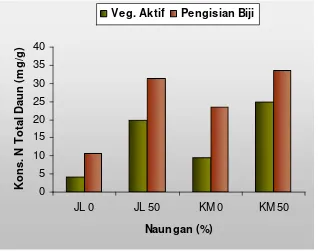
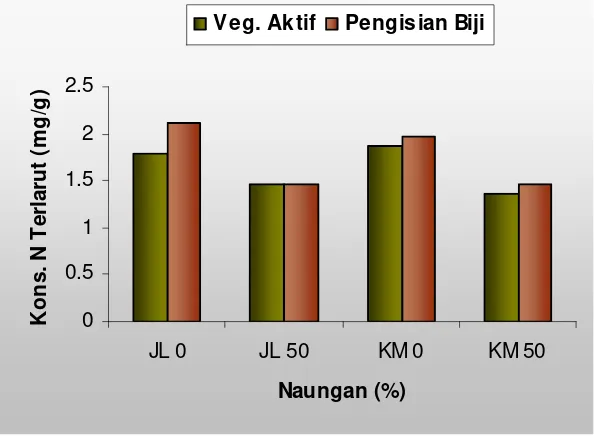
The first study results showed that the both genotypes observed had changed in case of characteristics of agronomy and morpho-physiology. The tolerant upland rice had more increase in plant height and panicle length than intolerances. In contrary, the sensitive upland rice varieties had more decrease in leave total, maximum seedlings, productive seedlings, grain per panicle, 1000 seeds weight, unfilled grain percentage and dry ground grain weight, compared with the tolerance. According to the change of agronomical and morpho-physiological characteristics of tolerant (TB 177 E-28-B-3) and sensitive (TB 154 E-TB-1) upland rice might be categorized as inconsistence. Furthermore, the 50% of shading might increased leave nitrogen total concentration, but decreased the soluble N, protein soluble N and TCA soluble N. Whiles, the path analysis in 9 and 18 days of shading showed a decrease in leave nitrogen total and soluble nitrogen in both genotypes, tolerance and intolerance.
The second study results showed the tolerant upland rice (Jatiluhur) under 50% of shading had a higher decrease of total protein and chloroplast protein leaf compared with the intolerance (Kalimutu) in active vegetative and grain filled phases, although the consentration mean of the tolerant genotype was still higher than the sensitive genotype. Whereas, there was lower increase in leaf membrane thylakoid protein of the tolerant genotype than the sensitive genotype either in active vegetative or grain filled phases. According to path analysis on 50% shading for 3,9 and 19 days, the tolerant genotype had more decrease in thylakoid membrane protein consentrantion than the intolerance. The specific protein analysis on tolerant upland rice under shading showed gradation in chloroplast protein band tickness at molecule weight of 64 kDa, as known as polyphenol oxidization, the 55 kDa protein was coded by rbc L gene as known as a large sub-unit Rubisco enzyme (Rubisco-L), the 33 kDa protein was coded by psb O gene as a protein complex OEC1 (Oxygen-Evolving Complex), and the 18 kDa protein coded by psb Q gene. In addition, there were also gradations in thylakoid membrane protein at molecule weight of 31, coded by psb A, 23 kDa protein was coded by psb Q and 20 kDa protein produced by Lhcb6 gene as known as CP 24 protein, that is pigment-protein light harvesting complex in photosystem II (LHC-II).
ABSTRAK
ANDI ETE. Studi Fisiologi dan Identifikasi Protein Fotosintetik Padi Gogo Toleran Naungan. Dibimbing oleh DIDY SOPANDIE, MUHAMMAD AHMAD CHOZIN, SARSIDI SASTROSUMARJO, AHMAD SURKATI dan MARIA BINTANG.
Penelitian ini bertujuan untuk mengkaji respon padi gogo terhadap naungan yang dilakukan pada dua tahap yaitu: pertama analisis karakter agronomi, morfo-siologi dengan menggunakan rancanagan petak terpisah, sebagai petak utama adalah naungan dan genotipe/varietas sebagai anak petak dengan rancangan acak kelompok sebagai rancangan lingkungan yang diulang tiga kali. Tahap kedua adalah untuk mengetahui karakteristik protein spesifik padi gogo akibat naungan dengan menggunakan rancangan acak lengkap pola faktorial yang diulang tiga kali. Faktor pertama adalah naungan dan faktor kedua adalah varietas.
Hasil penelitian pada tahap pertama menunjukkan: kedua genotipe yang diuji mengalami perubahan karakter agronomi dan morfo-fisiologi akibat naungan. Padi gogo genotipe toleran mengalami peningkatan tinggi tanaman dan panjang malai lebih banyak dari pada genotipe peka. Sebaliknya genotipe peka mengalami penurunan lebih banyak dari genotipe toleran pada jumlah daun, jumlah anakan maksimum dan jumlah anakan produktif, jumlah gabah per malai, bobot 1000 butir, persentase gabah hampa dan bobot gabah kering giling. Sesuai perubahan karakter agronomi, maka galur TB 177 E-28-B-3 (nomor galur 2) kelompok genotipe toleran dan TB 154 E-TB-1 (nomor galur 13) kelompok galur peka keduanya tergolong tidak konsisten. Naungan 50% meningkatkan konsentrasi total nitrogen daun, sebaliknya N terlarut, protein N terlarut dan N terlarut TCA. Demikian pula pada Uji Cepat 9 dan 18 hari menyebabkan penurunan konsentrasi total nitrogen daun dan nitrogen terlarut pada kedua genotipe toleran dan peka.
FOTOSINTETIK PADI GOGO TOLERAN NAUNGAN
ANDI ETE
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi Studi Fisiologi dan Identifikasi Protein Fotosintetik Padi Gogo Toleran Naungan adalah karya saya sendiri dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir disertasi ini.
Bogor, Agustus 2007
ABSTRACT
ANDI ETE, Study on Physiology and Identification of Photosynthetic Protein of Shade Tolerant Upland Rice. Under direction of DIDY SOPANDIE, SARSIDI SASTROSUMARJO, MUHAMMAD AHMAD CHOZIN, AHMAD SURKATI, and MARIA BINTANG.
The research was aimed to study the upland rice response of shading, which was conducted in two stage studies, as followed: firstly, the analysis of agronomical and morpho-physiological characteristics using a split plot design, shading as main plot and genotype/variety as sub plot, and arranged in a block randomized design in three replications. Secondly, study was aimed to find out the specific protein characterization of upland rice as affected by shading using a completely randomized design with two factors in three replications. First factor was shading and second factor was variety.
The first study results showed that the both genotypes observed had changed in case of characteristics of agronomy and morpho-physiology. The tolerant upland rice had more increase in plant height and panicle length than intolerances. In contrary, the sensitive upland rice varieties had more decrease in leave total, maximum seedlings, productive seedlings, grain per panicle, 1000 seeds weight, unfilled grain percentage and dry ground grain weight, compared with the tolerance. According to the change of agronomical and morpho-physiological characteristics of tolerant (TB 177 E-28-B-3) and sensitive (TB 154 E-TB-1) upland rice might be categorized as inconsistence. Furthermore, the 50% of shading might increased leave nitrogen total concentration, but decreased the soluble N, protein soluble N and TCA soluble N. Whiles, the path analysis in 9 and 18 days of shading showed a decrease in leave nitrogen total and soluble nitrogen in both genotypes, tolerance and intolerance.
The second study results showed the tolerant upland rice (Jatiluhur) under 50% of shading had a higher decrease of total protein and chloroplast protein leaf compared with the intolerance (Kalimutu) in active vegetative and grain filled phases, although the consentration mean of the tolerant genotype was still higher than the sensitive genotype. Whereas, there was lower increase in leaf membrane thylakoid protein of the tolerant genotype than the sensitive genotype either in active vegetative or grain filled phases. According to path analysis on 50% shading for 3,9 and 19 days, the tolerant genotype had more decrease in thylakoid membrane protein consentrantion than the intolerance. The specific protein analysis on tolerant upland rice under shading showed gradation in chloroplast protein band tickness at molecule weight of 64 kDa, as known as polyphenol oxidization, the 55 kDa protein was coded by rbc L gene as known as a large sub-unit Rubisco enzyme (Rubisco-L), the 33 kDa protein was coded by psb O gene as a protein complex OEC1 (Oxygen-Evolving Complex), and the 18 kDa protein coded by psb Q gene. In addition, there were also gradations in thylakoid membrane protein at molecule weight of 31, coded by psb A, 23 kDa protein was coded by psb Q and 20 kDa protein produced by Lhcb6 gene as known as CP 24 protein, that is pigment-protein light harvesting complex in photosystem II (LHC-II).
ABSTRAK
ANDI ETE. Studi Fisiologi dan Identifikasi Protein Fotosintetik Padi Gogo Toleran Naungan. Dibimbing oleh DIDY SOPANDIE, MUHAMMAD AHMAD CHOZIN, SARSIDI SASTROSUMARJO, AHMAD SURKATI dan MARIA BINTANG.
Penelitian ini bertujuan untuk mengkaji respon padi gogo terhadap naungan yang dilakukan pada dua tahap yaitu: pertama analisis karakter agronomi, morfo-siologi dengan menggunakan rancanagan petak terpisah, sebagai petak utama adalah naungan dan genotipe/varietas sebagai anak petak dengan rancangan acak kelompok sebagai rancangan lingkungan yang diulang tiga kali. Tahap kedua adalah untuk mengetahui karakteristik protein spesifik padi gogo akibat naungan dengan menggunakan rancangan acak lengkap pola faktorial yang diulang tiga kali. Faktor pertama adalah naungan dan faktor kedua adalah varietas.
Hasil penelitian pada tahap pertama menunjukkan: kedua genotipe yang diuji mengalami perubahan karakter agronomi dan morfo-fisiologi akibat naungan. Padi gogo genotipe toleran mengalami peningkatan tinggi tanaman dan panjang malai lebih banyak dari pada genotipe peka. Sebaliknya genotipe peka mengalami penurunan lebih banyak dari genotipe toleran pada jumlah daun, jumlah anakan maksimum dan jumlah anakan produktif, jumlah gabah per malai, bobot 1000 butir, persentase gabah hampa dan bobot gabah kering giling. Sesuai perubahan karakter agronomi, maka galur TB 177 E-28-B-3 (nomor galur 2) kelompok genotipe toleran dan TB 154 E-TB-1 (nomor galur 13) kelompok galur peka keduanya tergolong tidak konsisten. Naungan 50% meningkatkan konsentrasi total nitrogen daun, sebaliknya N terlarut, protein N terlarut dan N terlarut TCA. Demikian pula pada Uji Cepat 9 dan 18 hari menyebabkan penurunan konsentrasi total nitrogen daun dan nitrogen terlarut pada kedua genotipe toleran dan peka.
@ Hak Cipta milik IPB, tahun 2007 Hak cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
STUDI FISIOLOGI DAN IDENTIFIKASI PROTEIN
FOTOSINTETIK PADI GOGO TOLERAN NAUNGAN
ANDI ETE
Disertasi
sebagai salah satu syarat untuk memperoleh gelar
Doktor pada
Departemen Agronomi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Disertasi : Studi Fisiologi dan Identifikasi Protein Fotosintetik Padi Gogo Toleran Naungan
Nama : Andi Ete NIM : Agr 965023
Disetujui Komisi Pembimbing
Prof. Dr. Ir. Didy Sopandie, M.Agr. Ketua
Prof. Dr. Ir. Sarsidi Sastrosumarjo Prof. Dr. Ir. H.M.A. Chozin, M.Agr. Anggota Anggota
Prof.Dr.Ir. H. Ahmad Surkati Abidin Prof. Dr. drh. Maria Bintang, MS. Anggota Anggota
Diketahui
Ketua Program Studi Agronomi Dekan Sekolah Pascasarjana
Dr. Ir. Sartriyas Ilyas, MS. Prof. Dr.Ir. H. Khairil Anwar Notodiputro, MS.
PRAKATA
Tidak ada kata yang paling pantas diucapkan kecuali rasa syukur pada Allah SWT atas segala karunia dan kemudahan serta izin-Nya yang diberikan ditengah kesukaran yang dihadapi sehingga penulisan disertasi yang berjudul “Studi Fisiologi Dan Identifikasi Protein Fotosintetik Padi Gogo Toleran Naungan” dapat diselesaikan.
Berbagai pengalaman dan ide yang penulis peroleh sejak menulis proposal, pelaksanaan penelitian, hingga penulisan disertasi ini. Oleh karena itu penulis menyampaikan rasa terimakasih yang mendalam serta penghargaan yang setinggi-tingginya kepada:
Bapak Prof. Dr. Ir. Didy Sopandie, M.Agr, sebagai ketua komisi pembimbing yang banyak memberikan perhatian, saran dan koreksi yang sangat berarti, meskipun ditengah kesibukan sebagai pejabat di Fakultas, selalu meluangkan waktu untuk membimbing dan mengarahkan penulis agar berfikir secara dinamis, sistimatis dalam menghadapi berbagai masalah selama pengajuan proposal, penelitian hingga penulisan disertasi ini.
Bapak Prof. Dr. Ir. H.M.A. Chozin, M.Agr, selaku anggota komisi pembimbing yang banyak memberi arahan dalam penulisan, saran dan koreksi yang sangat menolong dalam perbaikan tulisan ini, meskipun ditengah-tengah kesibukannya sebagai pejabat di Rektorat, selalu bersedia dan ramah menerima penulis untuk berkonsultasi.
Bapak Prof. Dr. Ir. Sarsidi Sastrosumarjo, MSc, selaku anggota komisi pembimbing dengan penuh perhatian dan kesabaran memberi arahan dan saran demi perbaikan tulisan ini.
Bapak Prof.Dr. Ir. H. Ahmad Sukarti Abidin, MSc, selaku anggota komisi pembimbing banyak memberi perhatian dan nasihat kepada penulis demi perbaikan tulisan ini.
Ibu Prof. Dr. drh. Maria Bintang, MS, sebagai anggota komisi pembimbing yang telah banyak meluangkan waktu untuk diskusi, membimbing, memberikan semangat, saran dan koreksi yang sangat berarti kepada penulis. Peran semua komisi pembimbing sungguh sangat berarti sehingga penelitian dan penulisan disertasi ini dapat dirampungkan.
Ir. Trikoesoemaningtyas, MSc. yang berkenan menjadi penguji luar komisi pada ujian tertutup dan memberikan masukan yang amat berharga sehingga memberi bobot tersendiri dalam disertasi ini.
Ucapan terima kasih dan penghargaan yang tulus penulis sampaikan kepada:
1. Rektor Institut Pertanian Bogor, Rektor Universitas Tadulako dan Dekan Fakultas Pertanian Universitas Tadulako, Dekan Sekolah Pascasarjana dan Ketua Program Studi Agronomi atas kesempatan yang diberikan kepada penulis dalam penyelesaian pendidikan Program Doktor (S3).
2. Pemerintah Propinsi Sulawesi Tengah atas bantuan berupa fasilitas tempat tinggal yang telah disediakan.
3. Kepala Kebun Percobaan PSPT Cikabayan Darmaga dan staf serta Balai Penelitian Padi Muara, yang telah memberikan dukungan moril dan fasilitas pelaksanaan percobaan di lapangan.
4. Staf Laboratorium Biokimia-IPB, Laboratorium PSPT, Laboratorium Balitvet dan Laboratorium HPT yang telah memfasilitasi dalam analisis laboratorium. 5. Rekan-rekan sesama mahasiswa, khususnya program studi Agronomi IPB,
serta rekan-rekan yang tergabung dalam wadah HIMPAST, atas dorongan moril dan bantuan yang diberikan kepada penulis.
Ucapan terima kasih yang tak terhingga buat kedua orang tua (Alm) atas jasa mereka yang telah mendidik dan membesarkan penulis, serta kakak-kakak dan adik-adik atas kasih sayang dan doa yang dipanjatkan untuk penulis, kepada suami dan anakku Annisa Nur Rahma dan Andika Nur Hikmah yang penuh pengertian dengan kondisi penulis yang pergi menuntut ilmu.
Akhirnya, kepada semua pihak yang turut membantu dalam penelitian hingga penulisan disertasi ini, penulis sampaikan terima kasih, dan semoga tulisan ini bermanfaat bagi pengembangan ilmu pertanian khususnya bidang fisiologi tanaman.
Bogor, Agustus 2007
RIWAYAT HIDUP
Penulis dilahirkan di Mamboro Palu Sulawesi Tengah, tanggal 4 Juli 1962, sebagai anak ke lima dari delapan bersaudara dari ayah Yunus H. Mahmud (Alm) dan ibu Indocani Djuraedjo (Almarhumah).
Penulis menyelesaikan pendidikan Sekolah Menengah Atas Negeri I Palu pada tahun 1981. Pendidikan sarjana ditempuh di Fakultas Pertanian Universitas Tadulako Palu, lulus pada tahun 1986. Pada tahun 1990 penulis memperoleh beasiswa dari BPPS DIKTI untuk mengikuti pendidikan Program Magister Sains pada Progran Studi Agronomi KPK IPB – UNSRAT dan lulus tahun 1993. Kesempatan untuk melanjutkan ke Program Doktor pada Program Studi Agronomi Institut Pertanian Bogor pada tahun 1996 dengan beasiswa ADB-LOAN.
DAFTAR ISI
Halaman DAFTAR TABEL ...
DAFTAR GAMBAR ... DAFTAR LAMPIRAN ...
xii xiii xiv
PENDAHULUAN 1
Latar Belakang ... Tujuan ... Hipotesis... Manfaat Penelitian... Ruang Lingkup Penelitian...
1 3 3 3 4
TINJAUAN PUSTAKA 6
Pengaruh Naungan terhadap Pertumbuhan dan Hasil Tanaman ... Pengaruh Naungan terhadap Metabolisme Tanaman... Struktur Kloroplas, Membran Tilakoid dan Fotosistem II... Mekanisme Adaptasi Padi terhadap Naungan... Sintesis Protein Spesifik pada Kondisi Cekaman... Sintesis Protein Fotosintetik...
6 8 10 17 20 22 STUDI KARAKTER AGRONOMI DAN MORFOFISIOLOGI PADI GOGO
TERHADAP NAUNGAN 27
Abstract... Abstrak... Pendahuluan... Latar Belakang ... Tujuan... Bahan dan Metode ... Hasil dan Pembahasan... Simpulan... 27 28 29 29 30 30 32 52 STUDI KARAKTERISASI PROTEIN SPESIFIK PADA PADI GOGO
TOLERAN DAN PEKA NAUNGAN 53
Abstract... Abstrak... Pendahuluan... Latar Belakang ... Tujuan... Bahan dan Metode ... Hasil dan Pembahasan... Simpulan... 53 54 55 55 57 57 59 73 PEMBAHASAN UMUM... SIMPULAN DAN SARAN ... DAFTAR PUSTAKA ...
DAFTAR TABEL
Halaman
1. Uji nilai rata-rata antar kelompok genotipe padi gogo untuk karakter morfologi dan agronomi pada naungan 0% dan 50 % ... 33 2. Perubahan bobot gabah kering giling galur/varietas toleran dan peka
pada naungan paranet 50 % ... 40 3. Hasil analisis komponen utama terhadap 13 galur/varietas padi gogo
pada kondisi naungan paranet 50 % ... 42 4. Konsistensi toleransi genotipe padi gogo pada naungan 50 % ... 45 5. Konsentrasi total protein daun pada genotipe toleran dan peka pada fase
vegetatif aktif dan pengisian biji pada naungan 0% dan 50 %... 60 6. Konsentrasi protein kloroplas pada genotipe toleran dan peka pada fase
vegetatif aktif dan pengisian biji pada naungan 0% dan 50 % ... 61 7. Konsentrasi protein membran tilakoid pada genotipe toleran dan peka
pada fase vegetatif dan pengisian biji pada naungan 0% dan 50 %... 62 8. Estimasi bobot molekul protein kloroplas pada varietas toleran dan peka
pada naungan 0% dan 50% pada fase vegetatif aktif dan pengisian biji .... 67 9. Estimasi bobot molekul protein tilakoid pada varietas toleran dan peka
pada naungan 0% sdan 50% pada fase vegetatif aktif dan pengisian biji.... 70 10. Estimasi bobot molekul protein tilakoid pada uji cepat varietas toleran dan
DAFTAR GAMBAR
Halaman
1. Alur kegiatan penelitian ... 5
2. Struktur kloroplas dan perangkat-perangkatnya ... 10
3. Skema mekanisme penghindaran (avoidance) terhadap cahaya rendah 18
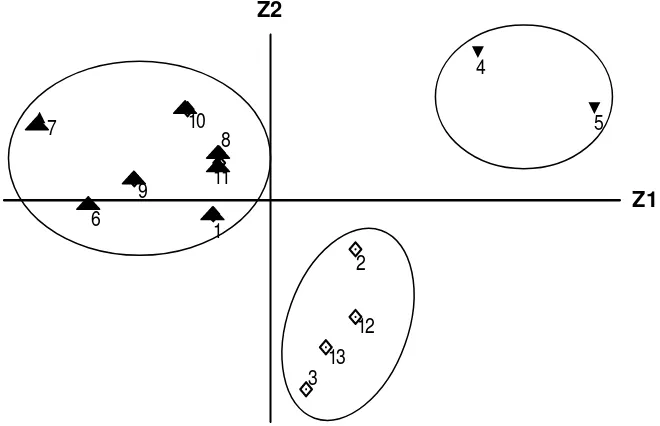
4. Diagram skor komponen genotipe toleran, moderat dan peka pada naungan 50 % ... 43
5. Dendogram 13 galur/varietas padi gogo pada naungan 50 % ... 44
6. Konsentrasi total nitrogen daun pada naungan 0% dan 50 % ... 46
7. Konsentrasi nitrogen terlarut pada naungan 0% dan 50 % ... 48
8. Konsentrasi protein-nitrogen terlarut pada naungan 0% dan 50 % ... 49
9. Konsentrasi total nitrogen daun pada uji cepat ... 50
10. Konsentrasi nitrogen terlarut pada uji cepat ... 51
11. Konsentrasi protein membran tilakoid padi genotipe toleran Jatiluhur dan peka Kalimutu pada uji cepat ... 63
12. Profil kloroplas dan membran tilakoid daun padi pada gradien sukrosa berbeda... 65
13. Komposisi protein kloroplas dua genotipe padi gogo pada dua perlakuan naungan dan dua fase pertumbuhan melalui SDS-PAGE ... 66
14. Komposisi protein membran tilakoid dua genotipe padi gogo pada naungan 0% dan 50% melalui SDS-PAGE ... 69
15. Komposisi protein membran tilakoid uji cepat dua genotipe padi gogo pada 3, 9 dan 18 hari naungan melalui SDS-PAGE... 71
16 Diagram lintas karakter morfologi padi gogo pada naungan 50 %... 76
DAFTAR LAMPIRAN
Halaman
1. Analisis ragam respon genotipe padi gogo terhadap naungan paranet pada
karakter agronomi dan fisiologi ... 104
2. Tinggi tanaman genotipe padi gogo pada naungan paranet ... 106
3. Jumlah daun genotipe padi gogo pada naungan paranet ... 106
4. Umur berbunga genotipe padi gogo pada naungan paranet ... 107
5. Umur panen genotipe padi gogo pada naungan paranet ... 107
6. Jumlah anakan maksimum genotipe padi gogo pada naungan paranet .... 108
7. Panjang malai genotipe padi gogo pada naungan paranet ... 108
8. Jumlah anakan produktif genotipe padi gogo pada naungan paranet... 109
9. Jumlah gabah per malai genotipe padi gogo pada naungan paranet ... 109
10. Persentase gabah hampa genotipe padi gogo pada naungan paranet ... 110
11. Bobot 1000 butir genotipe padi gogo pada naungan paranet ... 110
12. Perubahan konsentrasi nitrogen (mg/g) varietas toleran dan peka terhadap naungan pada fase vegetatif ... 111
13. Perubahan konsentrasi nitrogen (mg/g) varietas toleran dan peka terhadap naungan pada fase pengisian biji... 111
14. Perubahan konsentrasi nitrogen (mg/g) varietas toleran terhadap naungan pada fase vegetatif dengan uji cepat (short term)... 112
15. Perubahan konsentrasi nitrogen (mg/g) varietas peka terhadap naungan pada fase vegetatif dengan uji cepat (short term)... 112
16. Perubahan konsentrasi protein total (μg/ml) varietas toleran, peka terhadap naungan pada fase vegetatif dan pengisian biji ... 113
17. Perubahan konsentrasi protein kloroplas (μg/ml) varietas toleran, peka terhadap naungan pada fase vegetatif dan pengisian biji ... 113
18. Perubahan konsentrasi protein tilakoid (mg/g) varietas toleran, peka terhadap naungan pada fase vegetatif dan pengisian biji ... 114
19. Perubahan konsentrasi protein tilakoid (mg/g) varietas toleran, peka terhadap naungan pada fase vegetatif dengan uji cepat (short term)... 114
21. Migrasi, Rf dan estimasi BM protein kloroplas padi gogo fase pengisian biji ... 116 22. Migrasi, Rf dan estimasi BM protein membran tilakoid padi gogo fase
vegetatif ... 117 23. Migrasi, Rf dan estimasi BM protein membran tilakoid padi gogo fase
pengisian biji ... 117 24. Migrasi, Rf dan estimasi BM protein membran tilakoid padi gogo pada uji
cepat ... 118 25. Migrasi dan Rf protein standar untuk protein kloroplas ... 118 26. Migrasi dan Rf protein standar untuk protein membran tilakoid ... 119 27. Migrasi dan Rf protein standar untuk protein membran tilakoid uji cepat ....
120 28. Prosedur analisis karakterisasi protein fotosintetik ...
Penguji Luar Komisi Pada Ujian Tertutup
Dr. Ir. Trikoesoemaningtyas, MSc.
Penguji Luar Komisi Pada Ujian Terbuka
Dr. Ir. Suwarno, MS.
Latar Belakang
Peningkatan produksi yang dicapai tahun 2006 sebesar 0.46 % belum mampu mengimbangi peningkatan kebutuhan pangan sehingga terus dilakukan impor beras sebanyak 2 juta ton (BPS 2007). Kondisi ini menjadi semakin serius bila dikaitkan neraca pangan 2000 – 2010 dimana pada tahun 2010 Indonesia masih mengalami defisit sebanyak 1 juta ton (Sopandie 2006). Menyikapi kondisi ini diperlukan usaha yang konkrit untuk meningkatkan produksi baik melalui intensifikasi, extensifiksi maupun diversifikasi sekaligus mengurangi ketergantungan impor beras.
Pendayagunaan lahan kering sebagai salah satu sasaran extensifikasi untuk peningkatan produksi dapat dinilai potensial. Ini dikarenakan luas lahan kering yang dimiliki mencapai kurang lebih 76,3 juta ha. Sesuai data tahun 2005, pemanfaatan lahan kering untuk bidang pertanian baru mencapai 13,36 juta ha termasuk didalamnya penanaman padi gogo seluas 1.105.610 ha. Produksi yang dicapai pada luasan tersebut adalah sabanyak 2.832.556 ton atau setara dengan 2,5 ton per ha (BPS 2005). Kedua informasi ini memberikan penguatan akan peningkatan produksi beras melalui pengembangan tanaman padi gogo.
Fakta lapangan menunjukkan pemanfatan lahan kering yang masih didominasi oleh pengembangan tanaman tahunan dan setahun. Kondisi ini mengharuskan adanya pengembangan teknologi pemanfaatan areal disela tanaman utama khususnya pada tanaman tahunan seperti karet, kelapa dan lainnya. Secara agronomis ketersediaan cahaya menjadi kendala utama yang sering muncul pada penanaman tanaman sela khususnya kelompok sun crops
seperti halnya padi. Defisit cahaya pada tanaman padi gogo menyebabkan terganggunya proses metabolisme yang berimplikasi kepada menurunnya laju fotosintesis dan sintesis karbohidrat (Chaturvedi dan Ingram 1989, Vijayalaksmi
et al. 1991, Murty et al. 1992, Watanabe et al. 1993, Jiao et al. 1993, Yeo et al. 1994). Kondisi demikian akan menyebabkan penurunan produktivitas tanaman.
pertanian di masa mendatang semakin kompleks, teknologi konvensional saja menjadi kurang efektif untuk menjawab persoalan pembangunan pertanian. Oleh karena itu pemanfaatan teknologi terbaru sebagai komplemen teknologi konvensional diharapkan mampu menjadi katalisator pencapaian hasil menjadi lebih singkat dan efisien, salah satu diantaranya adalah teknologi biologi molekuler. Teknologi ini mampu mengidentifikasi protein fotosintetik spesifik pada tingkat molekuler yang sangat dibutuhkan untuk mengenali sifat tanaman.
Peningkatan kapasitas fotosintesis pada kondisi cahaya terbatas umumnya didukung oleh penyesuaian protein membran tilakoid dan ultrastruktur kloroplas. Anderson (1999) dan Schiethaler et al. (1999) melaporkan bahwa kloroplas pada tanaman toleran naungan menunjukkan peningkatan perluasan grana dan lebih banyak grana per kloroplas dan relatif banyak tumpukan pada tilakoid. Demikian pula Khumaida (2002) melaporkan struktur kloroplas tanaman kedelai genotipe toleran pada kondisi naungan 50 % memiliki perkembangan pembentukan kloroplas yang baik pada grana, pati dan membran tilakoid dalam tiap grana, memiliki persentase yang tinggi pada tumpukan grana, jumlah stroma sedikit dan ukuran kloroplas lebih kecil.
Tujuan
1. Mengevaluasi konsistensi toleransi galur/varietas padi gogo terhadap naungan alami di bawah tegakan karet dan naungan paranet (50 %).
2. Mengidentifikasi kandungan total nitrogen daun, total protein daun, kandungan dan bobot molekul protein kloroplas, protein membran tilakoid pada padi gogo yang toleran dan peka terhadap naungan.
3. Mengidentifikasi protein spesifik dari protein kloroplas serta protein membran tilakoid pada galur/varietas yang toleran terhadap naungan.
4. Mengetahui mekanisme adaptasi tanaman padi gogo terhadap naungan.
Hipotesis
1. Terdapat galur/varietas padi gogo yang konsisten toleran maupun konsisten peka dari beberapa galur/varietas yang di uji pada naungan yang berbeda. 2. Terdapat perbedaan konsentrasi total nitrogen daun, total protein daun,
protein kloroplas dan protein membran tilakoid pada padi gogo yang toleran dan peka terhadap naungan.
3. Terdapat perbedaan bobot molekul dan komposisi protein fotosintetik pada galur/varietas yang toleran dan peka terhadap naungan dan galur/varietas yang toleran naungan mengekpresikan pola protein spesifik yang berbeda dengan galur yang peka naungan.
Manfaat Penelitian
Ruang Lingkup Penelitian
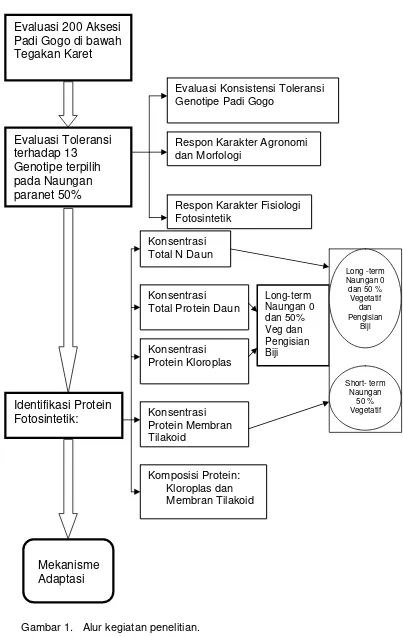
Penelitian ini menjelaskan mekanisme adaptasi antara genotipe padi gogo toleran naungan dan peka naungan, dari aspek morfofisiologi dan aspek biokimia. Kedua aspek tersebut dirumuskan ke dalam subjudul penelitian : (1) studi karakter agronomi dan morfofisiologi padi gogo terhadap naungan, (2) studi identifikasi karakter protein padi gogo toleran dan peka naungan. Pada subjudul penelitian 1 menyangkut : respon karakter agronomi dan morfologi, evaluasi konsistensi toleransi genotipe padi gogo dan respon karakter fisiologi fotosintetik padi gogo terhadap naungan, dan subjudul penelitian 2 mengenai : pengukuran konsentrasi total protein daun, protein kloroplas dan protein membran tilakoid serta melihat komposisi protein fotosintetik yang dipengaruhi oleh naungan .
Evaluasi 200 Aksesi
Padi Gogo di bawah
Tegakan Karet
Evaluasi Toleransi
terhadap 13
Genotipe terpilih
pada Naungan
paranet 50%
Identifikasi Protein
Fotosintetik:
Evaluasi Konsistensi Toleransi Genotipe Padi Gogo
Respon Karakter Agronomi dan Morfologi
Respon Karakter Fisiologi Fotosintetik
Konsentrasi Total N Daun
Konsentrasi Total Protein Daun
Konsentrasi Protein Kloroplas
Konsentrasi Protein Membran Tilakoid
Komposisi Protein: Kloroplas dan Membran Tilakoid
Long-term Naungan 0 dan 50% Veg dan Pengisian Biji
Mekanisme
Adaptasi
Gambar 1. Alur kegiatan penelitian.
Long -term Naungan 0 dan 50 %
Vegetatif dan Pengisian
Biji
Short- term Naungan
Pengaruh Naungan terhadap Pertumbuhan dan Hasil Tanaman
Cahaya sangat mempengaruhi pertumbuhan dan produksi tanaman padi. Bila faktor-faktor lain tidak merupakan kendala, maka cahaya merupakan faktor utama yang mempengaruhi pertumbuhan dan hasil tanaman (Fischer 1975) dan terdapat hubungan yang erat antara radiasi dengan fotosintesis bersih (Webster dan Wilson 1980) produksi gabah kering berkorelasi positif dengan intensitas radiasi (De Datta 1981). Menurut Gupta dan O’Toole (1986) intensitas radiasi yang relatif rendah merupakan salah satu sebab rendahnya produksi padi di daerah tropik.
Naungan secara langsung berpengaruh terhadap intensitas cahaya yang sampai di permukaan tajuk tanaman, sehingga dapat menciptakan iklim mikro tersendiri terhadap tanaman (Man et al. 1980). Unsur-unsur iklim mikro disekitar tanaman ternaungi akan berbeda sebagai akibat perbedaan intensitas dan keseimbangan radiasi (Gupta dan O,Toole 1986).
Beberapa hasil penelitian menunjukkan bahwa naungan mempengaruhi pertumbuhan dan produksi tanaman. Baharsjah (1980) membuktikan bahwa tanggap tanaman kedelai terhadap naungan berbeda menurut tingkat perkembangan tanaman dan mengakibatkan menurunnya hasil biji kedelai. Naungan berpengaruh nyata terhadap pertumbuhan padi gogo yang ditunjukkan dengan meningkatnya proporsi naungan, tinggi tanaman bertambah, jumlah tunas semakin berkurang, semakin kecil luas daun dan semakin berkurang bahan kering (Irsal 1982, 1983; Irsal dan Muladi 1986). Selanjutnya dikemukakan dengan berkurangnya proporsi naungan, jumlah gabah meningkat, tetapi persentase gabah hampa cenderung meningkat pula, diduga bukan disebabkan oleh peningkatan intensitas radiasi secara langsung, tetapi hal ini diperkirakan erat kaitannya dengan meningkatnya jumlah gabah tiap rumpun sebagai penumpukan asimilat (sink) yang tidak terimbangi masukan senyawa organik hasil fotosintesis sebagai sumber (source). Selain itu dengan meningkatnya intensitas radiasi, suhu udara juga meningkat sehingga laju respirasi makin besar. Kedua faktor tersebut menyebabkan kurang sempurnanya proses pengisian sebagian gabah.
lapis) menjadi 78 % (1 lapis) dan 35 % (3 lapis) naungan kawat kasa, dapat menurunkan kapasitas sink rata-rata dari 62.4 g per rumpun menjadi 52.9 g per rumpun dan 46.0 g per rumpun. Penurunan tersebut berkaitan erat dengan penurunan jumlah malai, jumlah gabah serta sejalan dengan penurunan komponen pertumbuhan lainnya. Bharali et al. (1995) mengemukakan bobot 1000 biji gabah tidak nyata dipengaruhi oleh naungan akan tetapi lebih ditentukan oleh varietas/galur padi gogo.
Saodah, Yuyun dan Qamariah (1992) pada percobaan padi gogo di bawah naungan kayu Africa (Maesopsis eminii Engl) menunjukkan bahwa pada naungan 75 %, 50 % dan 25 % terjadi perbedaan tinggi tanaman dan jumlah anakan sampai umur 10 minggu. Wibawa (1994) pada percobaan padi gogo diantara tanaman karet yang berumur 3 tahun dengan naungan sekitar 60-80 % dapat menghasilkan gabah kering giling berkisar 1-2 ton ha-1, sedang padi gogo di antara tanaman karet berumur kurang dari setahun, menghasilkan 3.8 ton ha-1 gabah kering giling.
Hasil penelitian yang dilakukan Kim et al. (1991) pada varietas Soebaegbyeo (genjah) menunjukkan bahwa produksi biji dan berat 1000 biji pada kondisi cahaya penuh, 50 % dan 75 % berturut-turut adalah 5.17, 3.14 dan 2.84 ton ha-1 dan 23.0, 20.5 dan 20.0 gram, sedang pada varietas berumur medium Dodongbyeo hasilnya adalah 5.57, 3.45 dan 3.18 ton ha-1 dan 23.0, 23.0 dan 22.5 gram. Hal ini menunjukkan varietas yang berumur genjah lebih peka terhadap kondisi cahaya rendah dibandingkan varietas berumur medium.
Hasil penelitian Cabuslay et al. (1995) menunjukkan naungan sebesar 50% mengurangi berat kering tanaman rata-rata 34.13%. Penelitian yang dilakukan oleh Murty dan Dey (1992) dengan naungan 50% menurunkan berat kering tanaman rata-rata sebesar 47%. Selanjutnya dikemukakan bahwa naungan 50% menurunkan berat kering tanaman rata-rata 63%, pengurangan ini berkisar antara 25 - 76%. Pada semua galur atau varietas yang diuji dengan naungan 50%, penurunan berat kering yang besar dijumpai pada varietas yang peka terhadap naungan.
ketegakan daun, jumlah gabah per malai dan persentase gabah hampa lebih kecil. Demikian pula hasil penelitian Khumaida (2002) menunjukkan pada kondisi naungan 50%, genotipe toleran Jatiluhur dan C22 mempunyai jumlah malai per tanaman lebih tinggi .
Pengaruh Naungan terhadap Metabolisme Tanaman
Tanggap berbagai tanaman terhadap macam kualitas dan tingkat intensitas cahaya yang tersedia tidak sama. Hal tersebut ditentukan oleh macam fitokrom yang dikandung, lintasan fotosintesis atau ada tidaknya fotorespirasi dan keadaan lingkungan fisik lainnya serta tingkat pertumbuhan dari tanaman itu sendiri (Noggle dan Fritz 1977).
Proses-proses di dalam tanaman yang dapat dipengaruhi oleh naungan adalah fotosintesis, transpirasi, respirasi, reduksi nitrat, sintesis protein, produksi hormon, translokasi, umur tanaman (Struik dan Deinum 1982) pertumbuhan akar (Wong dan Wilson 1980; Stoskopf 1981), dan penyerapan mineral (Larcher 1975; Marschner 1995). Naungan juga dapat mengurangi hilangnya kelengasan tanah, mempertahankan unsur hara, menekan gulma, menurunkan suhu tanah dan tanaman pada waktu siang, menaikan suhu udara malam, perlindungan dari limpasan air hujan, pemindahan uap air dan CO2
(Strigter 1984).
Tanaman di bawah naungan memperlihatkan sifat-sifat tumbuh yang berbeda dengan tanaman di luar naungan. Tanaman yang tumbuh di bawah naungan lebih tinggi dan tegak dari tanaman yang tumbuh pada cahaya penuh (Wong dan Wilson 1980). Selanjutnya dikemukakan naungan dapat menaikan proporsi daun dan menyebabkan luas daun lebih tersebar ke seluruh kanopi. Gejala tersebut menurut Smith (1982) merupakan usaha dari tanaman untuk menghindar dari naungan. Hal itu sejalan dengan yang dikemukakan oleh Hidema et al. (1992) bahwa tanaman akan mengubah morfologi daun dan komposisi kloroplas sebagai respon adaptasi terhadap perubahan penyinaran. Daun-daun lebih tipis namun mempunyai luas permukaan yang lebih besar (Salisbury dan Ross 1995).
organik dari karbon dioksida dan air. Fotosintesis dapat terjadi pada bagian hijau tanaman terutama daun dengan bagian permukaan yang luas serta kloroplas melimpah yang merupakan pusat utama proses tersebut.
Kloroplas merupakan plastid yang mengandung pigmen klorofil dan berasal dari proplastid. Proplastid ini membelah diri saat embrio biji berkembang, pada saat daun atau batang terbentuk maka proplastid berkembang menjadi kloroplas. Kloroplas muda (yang baru terbentuk) juga aktif membelah diri terutama bila mendapat cukup cahaya. Membran ganda kloroplas berperan mengatur keluar masuknya ion atau senyawa ke kloroplas dan dari kloroplas.
Pada membran internal kloroplas terdapat pigmen fotosintesis dan pigmen ini banyak terdapat pada permukaan luar membran internal yang disebut tilakoid yang berbentuk bulat pipih seperti kantong. Pada posisi tertentu tilakoid akan menumpuk rapih membentuk struktur yang disebut granum. Tilakoid yang memanjang yang menghubungkan granum yang satu dengan yang lain di dalam matriks kloroplas yang disebut stroma. Pada bagian dalam grana maupun stroma terdapat rongga yang berisi air dan garam-garam yang terlarut dalam air. Pigmen utama terdapat dalam membran tilakoid adalah klorofil a, klorofil b dan karatenoid (karotin dan xantofil). Semua klorofil dan karotenoid ini terbenam/melekat pada molekul protein oleh ikatan non kovalen. Kompleks protein yang ada dalam membran tilakoid yaitu semua kompleks protein yang terlibat dalam proses transpor elektron, antara lain LHC I, LHC II, plastoquinon, sitokrom b6, sitokrom f, plastosianin, feredoksin dan lainnya
(Becker dan Deamer 1991).
Menurut Murty dan Sahu (1987) varietas yang adaptif terhadap cahaya rendah memiliki kandungan klorofil b yang tinggi. Lebih lanjut dikemukakan, walaupun klorofil meningkat tetapi laju fotosintesis turun akibat terganggunya aktivitas RuBP karboksilase. Naungan akan mengurangi respirasi gelap, titik jenuh dan kompensasi cahaya serta kerapatan stomata (Marler 1994) mengurangi sintesis rubisco enzim yang berfungsi sebagai katalisator dalam fiksasi CO2 (Mae et al. 1993).
Struktur Kloroplas, Membran Tilakoid dan Fotosistem II.
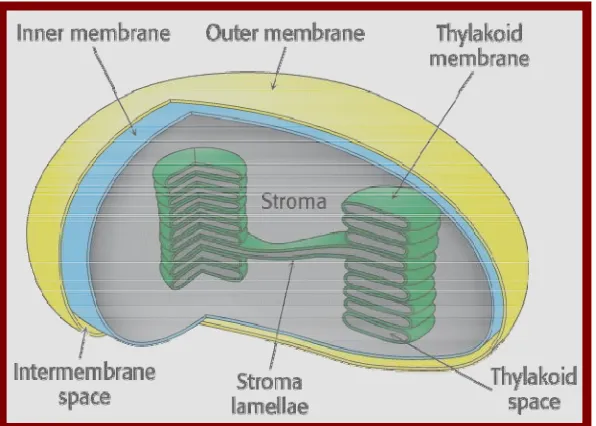
Kloroplas. Proses fotosintesis berada dalam organel semi-autonom yakni kloroplas yang memiliki genom sirkular dengan ukuran 120-127 kb merupakan komponen yang terlibat dalam kedua kompartemen, larutan (stroma) dan membran (tilakoid) (Mullet 1990). Struktur kloroplas dan perangkat-perangkatnya di sajikan pada Gambar 2.
Gambar 2. Pembesaran struktur tiga dimensi dari kloroplas. Sumber : Becker et al. (2000).
ganda yang secara relatif sama genom kecil dan tertutupi oleh envlope terdiri atas dua membran konsentrik.
Semua tanaman berkembang dari proplastida yang secara relatif organel kecil ada dalam sel belum matang pada meristem tanaman. Proplastida berkembang menurut keperluan tiap diferensiasi sel, dan tipe ini ditentukan sebagian besar oleh genom inti. Bila daun tumbuh pada cahaya gelap, proplastida ini memperluas dan berkembang menjadi etioplas, yang mempunyai susunan kristalin pada membran internal yang mengandung klorofil kuning merupakan prekursor dari klorofil. Bila terekspos cahaya etioplas dengan cepat berkembang menjadi kloroplas melalui perubahan prekursor ini ke klorofil dan mensintesis membran baru, pigmen, enzim fotosintetik dan komponen-komponen pada rantai transpor-elektron.
Fakta biokimia menunjukkan bahwa kloroplas merupakan turunan dari bakteri fotosintetik produksi-oksigen yang merupakan endositos dan hidup dalam simbiosis dengan sel eucaryot primitif. Kloroplas melakukan pengubahan antar energinya memalui mekanisme kemiosmotik, dan mereka diorganisir pada prinsip yang sama. Analisis mikroskop elektron menunjukkan bahwa kloroplas pada tanaman tingkat tinggi mempunyai lingkaran envlope 10-20 nm pada dua membran (membran luar dan dalam), yang dipisahkan oleh ruang intermembran yang sempit. Membran luar yang sangat permeabel untuk bobot molekul rendah dan membran dalam yang sedikit permeabel melewatkan protein pembawa khususnya ion-ion atau molekul menggunakan translokator seperti fosfat, C3-translokator.
Membran dalam dikelilingi ruang yang besar disebut stroma, yang mengandung berbagai enzim-enzim, ribosom, RNA dan DNA. Membran envlope penting untuk meregulasi transport metabolit, juga sebagai sistim translokasi untuk mensintesis prekursor polypeptida komplemen sitoplasmik disertai transit sekuen atau transit sekuen sebelumnya. Diameter kloroplas bervariasi antara 3-4 µm dan ketebalannya kira-kira 1-3 µm. Jumlah kloroplas per sel dan distribusinya juga bervariasi dan sangat tergantung pada pertumbuhan dan kondisi lingkungan seperti pencahayaan. Sel mesofil pada tanaman C3 (bayam, gandum dan padi) ditemukan kira-kira 20-100 kloroplas per sel (Irrgang 1999).
membran appres memberikan interkoneksi pada PS II untuk menangkap energi cahaya lebih efisien. Kloroplas pada tanaman naungan dan tanaman cahaya rendah mempunyai beberapa tumpukan grana yang lebih banyak dan lebih besar dan sedikit tilakoid non appressed dibandingkan tanaman cahaya dan cahaya tinggi. Sebagai contoh rata-rata panjang rasio membran appressed hingga nonappressed dengan ranges dari 4-5 untuk kloroplas tanaman naungan dan 1-1.5 untuk kloroplas tanaman matahari (Anderson et al. 1988). Disamping itu daun-daunnya mempunyai gradien tumpukan tilakoid kloroplas dibagian atas permukaan yang tidak ternaung mempunyai sedikit tumpukan grana dibandingkan dengan sel-sel yang berada pada permukaan ternaungi (Terashima 1989).
Kloroplas tanaman matahari dan cahaya tinggi mempunyai kompleks PS II yang lebih banyak, masing-masing dengan antena pemanen-cahaya yang relatif lebih kecil dari PS I, sedangkan kloroplas tanaman naungan dan cahaya rendah mampunyai kompleks PS II lebih sedikit masing-masing dengan antena pemanen cahaya lebih besar (Anderson et al. 1988).
Membran Tilakoid. Elektron mikrografi menunjukkan ketiga sistim membran vesikel di dalam kloroplas, yang memiliki struktur seperti kantong yang disebut membran tilakoid, membran ini melekat ke dalam matriks yang disebut stroma yang mengandung plastid DNA sirkular, ribosom, plastoglobuli osmifilik, pati dan enzim untuk fiksasi CO2 (siklus reduksi pentosa, siklus Calvin).
Keberadaan membran tilakoid yang tersusun dari wilayah appressed (grana) dan non-appressed (stroma lamela) wilayah ruang ini saling berhubungan yang menunjukkan asimetris polypeptida, lipid dan komposisi pigmen mereka (Booij et al. 1999).
sintase, semua berada dalam membran tilakoid. Fase cair pada vesikel (lumen) yang lebarnya 5-10 nm. Lumen pada tiap tilakoid merupakan saluran yang menghubungkan dengan lumen pada tilakoid lainnya, dengan demikian terdapat kompartemen internal yang ketiga disebut ruang tilakoid yang terpisah dari stroma oleh membran tilakoid.
Secara umum, tumpukan grana adalah perluasan kompartemen seluler yang terjadi selama evolusi sebagai strategi umum untuk meregulasi peningkatan lintasan metabolik yang rumit (Anderson dan Anderson 1988). Dugaan bahwa tumpukan grana pada tanaman tingkat tinggi untuk meregulasi laju degradasi protein D1 dan karenanya penggantian protein D1 cepat. Dugaan lainnya bahwa membran appressed meningkatkan fosforilasi non-siklik (Chow 1984).
Hall dan Rao (1994) mengemukakan empat kompleks protein integral supra molekul yang melekat di dalam membran tilakoid; PS II, kompleks Cyt b6/f, PS I dan ATPase serta beberapa polypeptida periferal yang melekat, mengikat pigmen dan sistem redoks. Protein periferal hidrofilik merupakan protein yang melekat pada membran atau larutan dalam ruang matriks (feredoksin) atau protein yang melekat pada lumen (plastoquinon). Tiga kompleks protein pertama (PS II, kompleks Cyt b6/f dan PS I) yang berpartisipasi pada transpor elektron dari H2O ke NADP+. Kompleks protein ke
4 (ATPase) yang digunakan gradien elektrokimia melintasi tilakoid, merupakan kopel dari rantai elektron, untuk sintesis ATP. Enzim (ATPase) yang memediasi reduksi CO2 menjadi gula fosfat yang berada dalam matriks stroma
menggunakan ATP dan NADPH. ATPase ditemukan dilamela stroma, sementara kompleks Cyt b6/f didistribusi merata di grana dan di stroma tilakoid. Tiap kompleks membran utuh mempunyai ukuran rata-rata kira-kira 350 kDa mengandung beberapa subunit polypeptida dengan berat molekul dari sangat rendah (4 kDa hingga 64 kDa).
pigmen yang menangkap energi cahaya dan menyalurkan ke pusat reaksi. Kompleks antena penting untuk menangkap energi cahaya . Dalam kloroplas kompleks antena terdiri atas beberapa ribu molekul klorofil yang saling berkaitan dengan protein, terikat kuat pada membran tilakoid (Trebst 1995).
Fotosistem II merupakan kompleks protein-pigmen di dalam kloroplas yang mengkatalisis transfer elektron yang diinduksi cahaya dari air ke plastoquinon, terdiri atas antena pigmen klorofil, komplek pusat reaksi serta molekul P680 mengikat struktur protein dan menghubungkan
komponen-komponen P680 ke enzim kompleks water-spliting dan ke aseptor elektron pada
P680 (Booij et al. 1999). PS II mengoksidasi air menjadi molekul oksigen dan
menyediakan elektron dan proton, mengandung kira-kira 30 klorofil antena pusat (hanya klorofil a) yang menyalurkan energi eksitasi ke klorofil pusat reaksi. Disamping sistem pemanen cahaya (LHCP) kira-kira 300 klorofil (a dan b) dan disertai pigmen pelengkap yang secara fungsional dan secara struktural melekat ke polypeptida antena pusat. Komposisi polypeptida fungsional evolusi oksigen kompleks PS II terdiri atas 7 protein integral hidrofobik (BM 47 dan 43, protein D1 dan D2, dua polypeptida subunit dari cytokrom b559 dan produk dari
gen psb I ) dan 3 polypeptida periferal hidrofobik (Barber 1992; Satoh 1992). Sebagian besar komponen PS II berada dalam tumpukan grana pada membran tilakoid kloroplas dan digambarkan dengan baik sebagai holokompleks sebab tersusun dari beberapa organisasi khusus sub-set dari protein pigmen (Gantt, 1996; Whitmarsh dan Govindjee 1995). Fungsi enzimatik PS II pada perangkat fotosintesis yaitu untuk mengkatalisis proses yang dikendalikan-cahaya pada water splitting untuk menghasilkan molekul oksigen dan proton dan mentransfer fungsi reduksi yang sama (elektron) diekstraksi dari air ke plastoquinon (PQ); karena itu PS II dapat dinyatakan sebagai water-redok PQ.
yang merespon untuk reaksi pemisahan-muatan (charge–separation) (Vermaas et al. 1993; Bassi et al. 1993; Lee dan Thornber 1995; Xiong et al. 1996 ).
Antena periferal PS II sebagian besar disusun kompleks trimerik dari LHC IIb, disingkat sebagai IIb. Subset LHC IIb merupakan fungsi mobil antara grana PS II– diperkaya membran dan stroma, PS I–diperkaya membran tilakoid (Allen 1992; Bennett 1991). Proses mobilisasi dari LHC IIb dikontrol oleh fosforilasi spesifik stroma. Hal ini diduga meregulasi distribusi spektral energi cahaya dan redistribusi antara 2 fotosistem untuk mengoptimasi transpor elektron non-siklik. Kompleks LHC IIb dari antena periferal mengandung sampai 50 % (110-120 Chl a+b) dari total Chl (Npig = 240-300) dari unit PS II dengan molekul minimum 7 Chl a dan 5 Chl b per LHC IIb monomer ( Bassi et al. 1993; Kuhlbrandt et al. 1994).
CPs minor (CP24, CP26 dan CP29) pada antena dalam relatif immobil ke pusat PS II dan kemungkinan bertindak sebagai jembatan dalam mentrasfer energi eksitasi dari antena periferal ke pusat PS IIb. CPs minor diduga untuk menyusun bagian integral dari mekanisme fotoprotektif yang penting, juga berpengaruh terhadap struktur dan konformasi integritas/stabilitas dari pusat PS II (Gilmore 1997). Pusat reaksi PS II tersusun atas protein D1, D2, 2 sub unit Cyt b559 dan beberapa polypeptida berat molekul kecil (Nanba dan Satoh,
1987; Matto et al. 1989). Pada pusat PS II dan protein D1/D2 heterodimer mengikat redoks merupakan faktor penting untuk transfer elektron melintasi membran dan protein Cyt b.559, kemudian protein klorofil a bagian dalam (CP47 dan CP43), beberapa protein minor Chl a/b juga berhubungan dengan protein D1/D2 heterodimer pada kompleks pemanen-cahaya pada PS II, LHC II ( Anderson dan Styring 1991).
PS II mengandung kira-kira 25 polypeptida diorganisir ke dalam sistim water-splitting disebut OEC (Oksigen Evolving Compleks), kompleks protein klorofil pemanen cahaya (LHC II) dan pusat reaksi. OEC ini berada pada sisi lumen tilakoid dan terdiri atas kluster 4 atom Mn dan 3 protein ekstrinsik hidrofilik 33, 23 dan 18 kDa (OEC33, OEC23 dan OEC 18) dan membutuhkan keberadaan ion Clorida dan Calsium (Booij et al. 1999; Matto et al. 1999).
Protein 33 kDa merupakan komponen yang sangat penting pada kompleks evolusi-oksigen pada organisasi struktural, dikode oleh gen psb O, ditemukan pada semua organisme oksigenik. Pemindahan protein 33 kDa dari preparasi PS II menyebabkan kehilangan stabilitas pada kluster Mn pada kondisi Cl rendah (<100mM). Pada konsentrasi Cl tinggi (>100mM) kluster Mn stabil dan evolusi-oksigen terjadi pada laju yang rendah. Pada membran PS II yang telah menipis, protein 33 kDa membutuhkan dua kali lipat konsentrasi Ca yang tinggi untuk mengoptimalkan aktivitas evolusi-oksigen. Hasil tersebut mengindikasikan bahwa protein 33 kDa berperan di dalam konsentrasi dan mengikat Ca pada PS II.
Protein 33 kDa mengandung 2 atom Mn terikat kuat sangat responsif terhadap evolusi O2, terikat kuat pada komponen PS II dan berhubungan erat
dengan jumlah kompleks instrinsik PS II, berhubungan dengan loop extrinsik CP 47, berasosiasi dengan protein D1, D2, CP 43, Cyt b559 dan protein psb I.
Gangguan pada kluster Mn berpengaruh pada kehilangan kemampuan dari PS II untuk mengoksidasi molekul air, oleh karena itu protein 33 kDa dipertimbangkan sebagai protein penstabilisasi Mn, kehilangan Mn diikuti kehilangan protein 33 kDa, dengan demikian Mn menstabilisasi protein extrinsic pada PS II (Critchley 1999).
Protein 24 kDa kemungkinan secara elektrostatis terikat ke 33 kDa dan18 kDa. Juga berhubungan erat dengan PS II dan kompleks M yaitu : Cyt b559, protein 10 kDa dengan 2 polypeptida setiap heme, mempunyai peran meregulasi dan esensial untuk evolusi O2. Protein 18 kDa, juga berfungsi
meregulasi evolusi O2. Protein 24 kDa membutuhkan protein ekstrinsik 33 kDa
evolusi-oksigen sebesar 80%. Keberadaan protein ekstrinsik 24 kDa berasosiasi dengan penurunan kebutuhan Ca, sedangkan keberadaan protein ekstrinsik 18 kDa berasosiasi dengan penurunan kebutuhan Cl. Keberadaan protein 24 kDa untuk memproteksi kluster Mn dari pengaruh reduktan-reduktan seperti hidroquinon sementara hubungan kedua protein (24 kDa dan 18 kDa) dengan PS II stabil melalui keberadaan kluster Mn (Ghanotakis et al. 1999).
Mekanisme Adaptasi Tanaman Terhadap Naungan
Naungan merupakan salah satu bentuk stress (cekaman) cahaya rendah. Tanaman yang secara kontinu terekspos cekaman lingkungan akan mempengaruhi perkembangan, pertumbuhan dan produktivitasnya. Cekaman cahaya rendah membatasi permukaan terbesar absorbsi cahaya yang dapat dimanfaatkan dalam proses fotosintesis. Laju fotosintesis dan transpirasi kebanyakan berkurang pada bagian tanaman yang ternaungi. Laju fotosintesis berkurang ini sebagai akibat langsung dari berkurangnya absorpsi foton dalam kloroplas (Pons dan Bergkotte 1996). Keadaan seperti ini sering dihadapi oleh tanaman-tanaman yang ternaungi. Namun demikian, tanaman mengembangkan berbagai strategi agar dapat melindungi diri dari kondisi cekaman (Bjorkman dan Demming-Adams 1994). Lawlor (2002) melaporkan bahwa terjadi pengurangan fotosintesis netto (Pn) karena kondisi cahaya rendah. Umumnya untuk tanaman-tanaman yang telah teraklimatisasi pengurangan intensitas cahaya atau naungan mengurangi fotosintesis netto pada tanaman. Pengurangan fotosintesis akan mengurangi produksi bobot kering yang akhirnya akan berpengaruh pada produktivitas tanaman. Murty dan Sahu (1987) menyatakan pengurangan cahaya sampai 30 % tidak mengganggu translokasi fotosintat, tetapi pengurangan di atas 50 % akan menyebabkan gangguan translokasi fotosintat.
luas daun sebagai cara mengurangi penggunaan metabolit, dan (b) mengurangi jumlah cahaya yang ditransmisikan dan direfleksikan. Levitt (1980) membuat hipotesis bahwa adaptasi terhadap naungan dicapai melalui : (a) mekanisme penghindaran (avoidance) berkaitan dengan respon perubahan anatomi dan morfologi daun untuk fotosintesis yang efisien (Gambar 3) serta (b) mekanisme toleran (tolerance) yang berkaitan dengan penurunan titik kompensasi cahaya serta respirasi yang efisien.
.
Efisiensi penangkapan cahaya (Avoidance)
Peningkatan kandungan pigmen per kloroplas
Meningkatkan penangkapan cahaya per unit area fotosintetik
Hilangnya kutikula, lilin dan rambut pada permukaan daun
Hilangnya pigmen non-kloroplas (ex. Antosianin)
Peningkatan kandungan kloroplas
Peningkatan kandungan per sel mesofil
Peningkatan kloroplas dalam sel epidemis
Penghindaran absorbsi yang tak
berguna Penghindaran
Transmisi Penghindaran
Refleksi Meningkatkan area penangkapan
cahaya
Meningkatkan proporsi area Fotosintetik
Gambar 3. Mekanisme penghindaran (avoidance) terhadap cahaya rendah
spesifikasi pada struktur daun dan komposisi kloroplas. Daun pada tanaman naungan biasanya lebih tipis dibanding daun matahari dan memiliki lebih besar dan lebih banyak kloroplas, tersusun paralel dipermukaan daun agar supaya memaksimalkan absorbsi cahaya (Bjorkman 1981; Anderson 1986; Anderson et al. 1988, 1998).
Tanaman memiliki sensitifitas dalam merespon terhadap cekaman maupun merespon perubahan kondisi lingkungan yang sub optimal terutama intensitas cahaya. Dari fakta yang ada, tanaman memiliki kemampuan untuk mengelaborasi strategi protektif untuk menstabilisasi perangkat fotosintesis kloroplas terutama pada fotosistim II (PS II) akibat cekaman lingkungan yang ekstrim. Critchley (1999) menyatakan bahwa strategi tanaman dalam menstabilisasi dan mencegah kerusakan perangkat fotosintesis mereka, tanaman akan melakukan proses aklimatisasi spesifik.
Tanaman yang mengalami cekaman cahaya dapat mentoleransi cekaman tersebut sebagaimana yang dikemukakan oleh Anderson (1986) dan Burkey et al. (1997) daun yang ternaung secara potensial terlibat dalam merespon aklimatisasi cahaya, termasuk perubahan dalam kapasitas fotosintesis dan komposisi kloroplas.
Menurut Holmberg dan Bulow (1998) bila terjadi cekaman pada tanaman, maka tanaman tersebut memberi respon dan dapat beradaptasi pada kondisi yang tidak sesuai. Adaptasi ini sering melalui perubahan-perubahan metabolik. Menurut Morgan (1984) berbagai adaptasi penting tanaman yang mengalami cekaman dengan cara penimbunan bahan organik tertentu misalnya sukrosa, asam amino (prolin), dan beberapa zat lainnya yang dapat menurunkan potensial osmotik, sehingga potensial air menurun dalam sel tanpa membatasi fungsi enzim. Akibat menurunnya potensial osmotik ini maka tanaman melakukan pengaturan osmotik atau osmoregulasi.
itu tanaman berusaha meningkatkan absorpsi cahaya dengan cara meningkatkan jumlah klorofil perunit luas daun.
Maxwell et al. (1999) menunjukkan bahwa aklimatisasi tanaman Gusmania monostachia pada intensitas cahaya rendah mengakibatkan peningkatan sangat nyata pada ukuran kloroplas, dan perluasan grana. Demikian pula jumlah tilakoid per kloroplas lebih banyak, mempunyai volume tilakoid besar dan jumlah tumpukan lebih besar per granum. Volume tilakoid kira-kira 38 % dari kloroplas pada intensitas cahaya rendah, sedangkan volume tilakoid pada intensitas cahaya tinggi hanya 15 %. Rata-rata jumlah tumpukan per granum adalah 14 pada intensitas cahaya rendah dan rata-rata tumpukan per granum lebih rendah hanya 5 pada intensitas cahaya tinggi.
Sintesis Protein Spesifik pada Kondisi Cekaman
Salah satu fungsi utama protein adalah sebagai katalis. Protein yang termasuk dalam katagori ini sering disebut sebagai enzim yang mengkatalisis semua reaksi metabolit di dalam sel termasuk reaksi sintesis dan reaksi degradatif. Mengingat pentingnya protein, maka sintesis protein yang terjadi akan sangat berpengaruh di dalam kehidupan suatu organisme. Untuk membentuk protein yang mempunyai fungsi biologis spesifik maka diperlukan pola (template) yang spesifik. Pola (template) tersebut adalah m-RNA yang dibentuk melalui proses transkripsi (Becker et al. 2000). Selanjutnya dijelaskan bahwa pola yang ada pada m-RNA sesungguhnya adalah urutan basa N yang mencerminkan sebuah informasi genetik yang diperoleh pada proses transkripsi dengan DNA sebagai pola untuk diteruskan pada protein yang dibentuk. Informasi genetik mengalir dari DNA dan melalui RNA, informasi diekspresikan menjadi protein dengan fungsi enzimatik tertentu. Beberapa protein bekerja pada suatu lintasan metabolik untuk menentukan sifat suatu tanaman.
garam pada kultur tembakau menunjukkan terbentuknya beberapa protein baru, khususnya protein berbobot molekul rendah yang disebut osmotin. osmotin ini banyak tertimbun pada sel yang mengalami cekaman osmotik dan diduga membantu melindungi diri dari keadaan cekaman tersebut. Akumulasi osmotin ditunjukkan tanaman karena perubahan tekanan turgor dalam sel (Singh et al. 1987; Thomas et al. 1993).
Pola protein (pola pita) yang berubah juga sebagai respon terhadap cekaman garam (Singh et al. 1987; Hasegawa et al. 1987; Iraki et al. 1989; Schnapp et al. 1990). Hasil penelitian Hurkman et al.(1988) tentang pengaruh cekaman garam pada membran akar barley menunjukkan adanya polipeptida (protein) baru yang muncul akibat cekaman.
Burke dan Orzech (1988) melaporkan terdapat beberapa Heat Shock Protein (HSP) yang mempunyai bobot molekul tinggi (HSP 70 kDa) banyak terdapat pada berbagai organisme termasuk tumbuhan dan kelompok HSP dengan bobot molekul rendah sebesar 20-30 (15-27 kDa) terdapat pada tumbuhan. HSP ini muncul dengan cepat dan sering menjadi bagian terbesar dari protein total dalam waktu 30 menit setelah terjadi perubahan mendadak misalnya dari 28 0C menjadi 41 0C. Sintesis protein itu berlangsung terus selama 3-4 jam berikutnya, tetapi setelah 8 jam pola sintesis akan sama dengan pada suhu rendah awal. HSP juga muncul bila peningkatan suhu lebih bertahap, 3 atau 4 jam setelah kembali ke suhu normal, HSP tidak diproduksi lagi tapi HSP tetap ada, ini menunjukkan bahwa protein tersebut sangat stabil. Semakin jelas bahwa HSP berperan dalam toleransi terhadap heat (bahang), mungkin dengan melindungi enzim dan asam amino esensial dari denaturasi akibat bahang juga HSP berperan sebagai protektif fotoinhibition. Bibit kedelai yang diberi perlakuan 50-75μM arsenit selama beberapa jam mengembangkan toleransi terhadap perlakuan bahang sebelumnya dan menghasilkan pola protein yang mirip dengan HSP kedelai (Key et al. 1985).
Bhagwat dan Apte (1989) melaporkan protein yang dihasilkan pada Cyanobakteri (Anabaena sp) penambat-N oleh heat shock, salinitas dan cekaman osmotik, mereka menemukan 15 polipeptida baru, 4 diantaranya khusus akibat heat shock, 4 lainnya diinduksi oleh 3 cekaman. Bray (1988); Bensen et al. (1988); Ramagopal (1987a, 1987b) dan Ranieri et al. (1989), melaporkan bahwa cekaman air menyebabkan perubahan pola protein.
pola peptida baru (empat 47 k Da, serta satu 160 kDa) yang dijumpai pada tumbuhan Arabidopsis thaliana, teraklimasi pada suhu dingin. Protein tersebut beberapa kali lebih efisien daripada sukrosa dalam melindungi membran tilakoid dari kerusakan akibat suhu dingin (Hincha et al. 1989).
Pada penelitian mengenai perubahan komposisi protein di ribosom sitoplasmik pada fase vegetatif daun barley teretiolasi, ditemukan 89 protein dari fraksi ribosomal, 8 diantaranya mengubah jumlah copy yang tergantung pada stadia vegetatif. Protein ribosomal yang muncul setelah iluminasi didapatkan pada fraksi daun teretiolasi. Diduga protein tersebut disintesis setelah teriluminasi (Koyama et al. 1996).
Critchley (1999) mencatat bahwa penurunan tingkat denaturasi asam lemak berkaitan dengan fenomena aklimatisasi dan berhubungan dengan fotosintesis. Telah dilaporkan munculnya toleransi bahang (heat) dapat dicapai dalam beberapa jam melalui sintesis polypeptida Heat-Shock Protein (HSP), untuk mencegah kerusakan kloroplas (Sachs dan Ho 1986; Yandanov et al. 1989). Pada cahaya rendah (100 μmol foton m-2 det-1) disintesis 4 apoprotein LHC-II bermigrasi pada 32,31, 30 dan 28.5 kDa yang dikenal sebagai LHC-II-1, LHC-II-2, LHC-II-3 dan LHC-II-4 (Tanaka dan Melis 1997).
Sintesis Protein Fotosintetik
Protein berfungsi selain sebagai unsur pembentuk struktur sel juga sebagai protein yang aktif, seperti enzim, yang berperan sebagai katalis segala proses biokimia dalam sel (Becker et al. 2000).
Suatu protein terdiri atas satu atau lebih polipeptida (polimer asam amino) yang terlipat dan terbelit membentuk suatu kesesuaian yang spesifik. Semua molekul protein merupakan polimer yang dibangun dari kumpulan 20 asam amino (Campbell et al. 2000). Pembentukan asam amino berawal dari reduksi NO3- menjadi NH3. Tumbuhan mempunyai kemampuan untuk mengubah
senyawa anorganik, seperti nitrat (NO3-) dan Amonia (NH3+) menjadi asam
amino yang merupakan kerangka dasar protein. Tumbuhan memperoleh N dengan jalan menyerap NO3- atau ion amonia (NH3+) dalam larutan tanah.
Amonia (NH3+) merupakan senyawa N utama dibebaskan oleh pembusukan
asam organik. Pada tanah NH3+ langsung dioksidasi menjadi NO3- sehingga
diserap, ion NO3- direduksi kembali menjadi amonia sebelum komponen N-nya
dapat bergabung ke dalam asam amino dan senyawa organik N lain. Reaksi NO3- ke NH3+ melalui 3 tahap (Loveless 1991):
NO3- nitrat NO2 nitrit NH2OH hidrosilamin NH3
(nitrat) reduktase (nitrit) reduktase (hidroksil amin) reduktase (amonia) Sintesis asam amino di dalam tanaman terjadi dari penggabungan N ke dalam NH3+ menjadi molekul asam amino dimulai dengan pembentukan asam
glutamat dengan aminasi reduksi asam α ketoglutarat :
Asam α ketoglutarat + NH3+ + 2(H) Asam glutamat + H2O
Pada reduksi nitrat donor H yaitu NADH atau NADPH diperoleh dari respirasi dan fotosintesis. Karena asam glutamat merupakan asam amino yang dapat terbentuk langsung dari amonia, maka asam glutamat menduduki posisi kunci pada metabolisme N. Setelah asam glutamat terbentuk, asam glutamat ini dapat berfungsi sebagai prekursor untuk sintesis asam amino lain melalui proses transaminasi. Sintesis asam amino tersebut dapat dilihat pada reaksi seperti yang dikemukakan oleh Loveless (1991) sebagai berikut :
Setiap polipeptida mempunyai amino terminal dan karboksi terminal. Sintesis potein dimulai pada amino terminal. Untuk protein yang mempunyai sekuens seperti H2N - Met - Trp - Asp ....…Pro - Val - COOH, menandakan
Metionin adalah asam amino inisiasi dan Valin adalah asam amino terminasi pada rantai.
pengikatan mRNA pada ribosom, seleksi dari kodon inisiasi dan pengikatan pada tRNA, asam amino pertama. Pada tahap elongasi ada 2 tahap yaitu gabungan asam amino melalui bentuk ikatan peptida dan perpindahan mRNA, ribosom serta molekul lain bahwa kodon ditranslasi dengan baik. Pada tahap terminasi, protein lengkap berdisosiasi dari ribosom, yang dilepas untuk memulai siklus sintesis lain.
Sintesis protein di dalam tanaman terjadi dari asam amino bebas yang diaktifkan dengan cara bereaksi dengan ATP dan enzim pengaktifan khas (aminoasil-tRNA sintase) menghasilkan aminoasiladenilat yang terikat pada enzim. Dalam kompleks ini asam amino disambungkan dengan 5-fosfat AMP melalui gugus karboksilnya sebagai anhidrida.
ATP + asam amino + enzim enzim (AMP-asam amino) + PP
Asam amino yang diaktifkan kemudian dialihkan ke molekul asam ribonukleat alih (t-RNA) yang khas dan terikat pada t-RNA dengan ikatan ester yang berimbang antara posisi 2’ dan 3’ pada satuan AMP ujung dalam t-RNA.
Enzim-(AMP-asam amino) + t-RNA t-RNA-asam amino + enzim Dengan membentuk pasangan basa secara triplet (kodon), molekul t-RNA yang berbeda masing-masing dengan asam aminonya, membentuk barisan sepanjang molekul mRNA dan dengan menggunakan sistem enzim ribosom ikatan peptida dibentuk secara berturut-turut antara asam amino yang bersebelahan, mulai dari asam amino yang akan menjadi ujung terminal-N protein. Akhirnya protein dilepas dari ribosom (Robinson 1991).
Di daun sekitar setengah dari jumlah protein berada pada kloroplas, dan kloroplas mengandung enzim untuk sintesis kebanyakan asam amino. Produk utama pada reaksi glutamin sintase dan glutamat sintase dalam stroma adalah glutamin dan glutamat dan gugus amino ini menyediakan untuk pembentukan asam amino lainnya (Millard 1988).
melalui salah satu dari DNA kloroplas atau DNA inti. Protein yang dikode oleh DNA kloroplas, disintesis pada ribosom kloroplas, sedangkan protein yang dikode oleh DNA inti disintesis pada ribosom sitoplasmik dan kemudian ditranspor ke kloroplas. Protein transpor kloroplas yang disintesis di sitoplasmik, merupakan protein yang bersifat pengatur (regulator) yang baik, sebagai contoh enzim Rubisco yang berfungsi dalam fiksasi CO2 mempunyai
dua tipe, sub unit besar dikode-DNA kloroplas dan sub unit kecil dikode-DNA inti. Sub unit kecil Rubisco disintesis di sitoplasma dan ditranspor ke kloroplas, tempat perakitan berlangsung (Taiz dan Zeiger 1991).
Umumnya protein yang dipersiapkan untuk kloroplas disintesis sebagai protein prekursor serta presekuen N-terminal sebagai jalur ke dalam kloroplas. Protein prekursor ini di arahkan (target) ke permukaan membran organel yang cocok setelah dilepas dari ribosom dan selanjutnya dipertahankan sesuai dengan bentuk untuk ditranslokasi melalui kedua membran envelope (Lubeck, Heins dan Soll 1997). Selanjutnya di translokasi ke dalam organel, protein kloroplas disortir ke sub organel tempat tujuan misalnya membran envelope dalam, membran tilakoid dan lumen tilakoid. Kompleks kloroplas direfleksi melalui berbagai jalur mekanisme hingga protein mencapai lokasi terakhir di dalam kloroplas.
ABSTRACT
The experiment was aimed to assess the agronomical and morpho-physiological characteristics of upland rice under shading. It was arranged in split plot design, and block randomized design as environmental design in three replication. There were two factors, the first factor was shading (S) as main plot that consisted of three levels (S0 = no shading, S1= 25% of shading, S2 = 50% of shading). The second factor was variety (V) as sub plot that consisted of 13 selected genotypes/varieties (8 tolerant, 2 moderate and 3 intolerant varieties). The result of study showed agronomy and morpho-physiology characteristics of tolerant upland rice had more increase in plant height and panicle length than intolerances. In contrary, the intolerant upland rice varieties had more decrease in leave total, maximum seedlings, productive seedlings, grain per panicle, 1000 seeds weight, unfilled grain percentage and dry ground grain weight, compared with the tolerance. Furthermore, the 50% of shading might increased leave nitrogen total concentration, but decreased the soluble N, protein soluble N and TCA soluble N. Whiles, the path analysis in 9 and 18 days of shading showed a decrease in leave nitrogen total and soluble nitrogen in genotypes, tolerance and intolerance. According to the change of agronomical and morpho-physiological characteristics of tolerant (TB 177 E-28-B-3) and intolerant (TB 154 E-TB-1) upland rice might be categorized as inconsistence.
STUDI KARAKTER AGRONOMI DAN MORFOFISIOLOGI PADI GOGO TERHADAP NAUNGAN
ABSTRAK
Percobaan ini bertujuan untuk mengetahui karakter agronomi, morfo-fisiologi tanaman padi gogo yang diberi naungan. Percobaan ini menggunakan rancangan perlakuan Petak Terpisah (Split Plot), dengan rancangan Acak Kelompok (RAK) sebagai rancangan lingkungan yang diulangi tiga kali. Petak utama adalah naungan (S) terdiri tiga taraf yaitu S0 = tanpa naungan, S1 = naungan 25 %, S2 = naungan 50 %. Sebagai anak petak adalah varietas (V) terdiri atas 13 genotipe/varietas yang terpilih (8 toleran, 2 moderat dan 3 peka). Hasil penelitian menunjukkan: karakter agronomi dan morfofisiologi tanaman padi gogo genotipe toleran mengalami pertambahan lebih banyak dari genotipe peka pada tinggi tanaman dan panjang malai. Sebaliknya genotipe peka mengalami penurunan lebih banyak dari genotipe toleran pada jumlah daun, jumlah anakan maksimum dan jumlah anakan produktif, jumlah gabah per malai, bobot 1000 butir, persentase gabah hampa dan bobot gabah kering giling. Naungan 50% meningkatkan konsentrasi total nitrogen daun, sebaliknya N terlarut, protein N terlarut dan N terlarut TCA. Demikian pula pada Uji Cepat 9 dan 18 hari menyebabkan penurunan konsentrasi total nitrogen daun dan nitrogen terlarut pada kedua genotipe toleran dan peka. Sesuai perubahan karakter agronomi dan morfofisiologi tanaman padi gogo, galur TB 177 E-28-B-3 (nomor galur 2) kelompok genotipe toleran dan TB 154 E-TB-1 (nomor galur 13) kelompok galur peka keduanya tergolong tidak konsisten.
PENDAHULUAN
Latar Belakang
Tanaman yang tumbuh pada kondisi intensitas cahaya rendah (ternaungi) memberi respon adaptif sebagai upaya untuk meningkatkan kemampuan tanaman untuk tumbuh dan bersaing dengan kondisi lingkungannya (Logan et al.
1999). Respon adaptif tanaman dapat dikaji dari karakter agronomi dan morfofisiologi tanaman. Kedua karakter ini saling berpengaruh sehingga untuk menjelaskan mekanisme adaptif yang terjadi pada tanaman perlu mengkaji kedua karakter tersebut.
Tanaman yang yang tumbuh pada kondisi ternaungi umunya memiliki laju fotosintesis maksimum lebih rendah dibandingkan tanaman tanpa naungan (Bjorkman, 1981) karena itu cenderung untuk mengalokasi sumber (source) ke jaringan fotosintesis sehingga secara relatif memiliki nisbah biomasa akar/daun rendah (Givnish 1988). Karakter-karakter tanaman yang dipengaruhi oleh intensitas cahaya rendah meliputi karakter morfologi terutama menyangkut arsitektur daun, peningkatan nisbah luas daun terhadap berat daun (luas daun spesifik) yang menyebabkan daun lebih lebar untuk mengumpulkan energi eksitasi lebih banyak pada daerah diagonal (Logan et al. 1999). Sedangkan karakter fisiologi meliputi pergerakan kloroplas, respon perangkat fotosintesis: kompleks pemanen cahaya, transpor elektron, rubisco, kandungan N dan kompleks protein fotosintetik (Lawlor 1987; Evans 1988; Anderson et al. 1995; Logan et al. 1999; Chozin et al. 2000; Khumaida 2002; Sopandie et al. 2003a).
Cabuslay et al. (1995) menyatakan tanaman padi yang toleran naungan daunnya cenderung memanjang serta meningkatkan tinggi tanaman, jumlah daun dan luas daun. Terjadi penurunan berat kering tanaman padi rata-rata 47% (Murty dan Dey 1992) penurunan sekitar 68 % (Cabuslay et al. 1995). Makino et al. (1997) melaporkan bahwa berat kering total tanaman padi pada saat panen sangat nyata lebih kecil pada cahaya rendah dibandingkan dengan cahaya tinggi. Perubahan karakter morfologi pada padi gogo akibat naungan telah pula dilaporkan Sopandie et al. 1999; Chozin et al. (2000).
Kandungan N per unit biomassa (% dalam berat kering) sering digunakan sebagai indikasi bagaimana kemampuan N untuk pertumbuhan tanaman (Lawlor
lingkungan terutama ketersediaan N dalam jaringan. Kira-kira 75% N dalam jaringan daun tanaman C3 dialokasikan ke dalam kloroplas (Chapin et al. 1987), konsentrasi nitrogen yang lebih rendah pada jaringan tanaman dialokasikan keperangkat fotosintesis (tilakoid) (Osmond 1987; Evans 1990).
Hasil analisis Fichtner et al. (1995) pada 2 genotipe yang ditumbuhkan pada cahaya tinggi (1400 µ mol m-2s-1) dan cahaya rendah (400 µ mol m-2s-1) dan pada amonium nitrat tinggi (5.0 mmol) dan amonium nitrat rendah (0.5 mmol) mengindikasikan hubungan yang kuat dan langsung antara ketersediaan sumber dan pertumbuhan. Khususnya pada cahaya terbatas konsentrasi N di dalam tanaman adalah secara positif berhubungan dengan jumlah N tersedia dan sebaliknya pada cahaya tersedia.
Pada kondisi intensitas cahaya rendah ketersediaan N dalam jaringan dan akumulasi N terham