KOMPONEN SITOTOKSIK DARI DAUN BINAHONG
(
Anredera cordifolia
) BERBASIS ANALISIS LARVA UDANG
DEWI LARASATI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Komponen Sitotoksik dari Daun Binahong (Anredera cordifolia) Berbasis Analisis Larva Udang adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
DEWI LARASATI. Komponen Sitotoksik dari Daun Binahong (Anredera cordifolia) Berbasis Analisis Larva Udang. Dibimbing oleh GUSTINI SYAHBIRIN dan PURWANTININGSIH SUGITA.
Telah dilakukan fraksionasi dan identifikasi komponen sitotoksik dari daun binahong (Anredera cordifolia) berbasis analisis larva udang. Serbuk kering-udara daun binahong dimaserasi dengan pelarut etanol. Selanjutnya, ekstrak kasar etanol dipartisi dengan n-heksana, diklorometana, dan n-butanol. Uji toksisitas dengan larva udang menunjukkan bahwa ekstrak n-butanol paling toksik dengan nilai konsentrasi mematikan 50% (LC50)= 494 μg/mL. Pemisahan ekstrak n-butanol dengan menggunakan kromatografi kolom memakai eluen n-heksana-kloroform-metanol secara gradien menghasilkan 5 fraksi. Fraksi 4 paling toksik dengan nilai LC50= 23.4 μg/mL, dan memberikan noda tunggal dalam kromatografi lapis tipis dengan eluen kloroform-metanol (7:3). Hasil uji fitokimia dan analisis spektrum inframerah transformasi Fourier menunjukkan bahwa fraksi aktif mengandung gugus karboksil, cincin aromatik, dan ester. Analisis kromatografi gas-spektrometri massa mendapatkan komponen dominan adalah bis-2-etilheksil-1,2-benzenadikarboksilat (79.29%), bersama dengan asam oleat (5.30%) dan asam palmitat (4.78%).
.
Kata kunci: Anredera cordifolia, binahong, larva udang, sitotoksik
ABSTRACT
DEWI LARASATI. Cytotoxic Components from Binahong Leaves (Anredera cordifolia) Based on Artemia salina Leach Analysis. Supervised by GUSTINI SYAHBIRIN and PURWANTININGSIH SUGITA.
Fractionation and identification of cytotoxic components from binahong (Anredera cordifolia) leaves based on Artemia salina Leach analysis have been carried out. Air-dried binahong leaves were macerated in ethanol as solvent. The ethanol crude extract was further partitioned with n-hexane, dichloromethane, and n-butanol. Toxicity test with A. salina showed that the n-butanol extract was the most toxic with 50% lethal concentration (LC50) of 494μg/mL. Fractionation of the n-butanol extract by using column chromatography and gradient elution with n-hexane-chloroform-methanol resulted 5 fractions. Fraction 4 was the most toxic with LC50= 23.4μg/mL, and gave single spot in thin layer chromatography with chloroform-methanol (7:3) as eluent. Phytochemistry test results and analysis of Fourier transform infrared spectrum showed that the active components of the fraction had carboxyl, aromatic ring, and ester groups. Gas chromatography-mass spectrometry analysis obtained bis-2-ethylhexyl-1,2-benzenedicarboxylate as the main component (79.29%), along with oleic acid (5.30%) and palmitic acid (4.78%).
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
KOMPONEN SITOTOKSIK DARI DAUN BINAHONG
(
Anredera cordifolia
) BERBASIS ANALISIS LARVA UDANG
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2013
Judul Skripsi :Komponen Sitotoksik dari Daun Binahong (Anredera. cordifolia) lBerbasis Analisis Larva Udang
Nama :Dewi Larasati
NIM :G44104005
Disetujui oleh
Dr Gustini Syahbirin, MS Pembimbing I
Prof Dr Purwantiningsih Sugita, MS Pembimbing II
Diketahui oleh
ProfDr Ir Tun Tedja Irawadi, MS Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa karena dengan rahmat dan hidayah-Nya, penulisan karya ilmiah yang berjudul
“Komponen Sitotoksik dari Daun Binahong (Anredera cordifolia) Berbasis Analisis Larva Udang” dapat diselesaikan dengan baik.
Selama penyusunan karya ilmiah ini penulis banyak mendapat bantuan, dorongan, dan arahan dari berbagai pihak. Oleh karena itu, penulis ingin mengucapkan terimakasih kepada Dr Gustini Syahbirin, MS selaku pembimbing I dan Prof Dr Purwantiningsih Sugita, MS selaku pembimbing II atas bimbingan dan pengarahan dalam penyusunan karya ilmiah ini, Bapak Sabur selaku penanggung jawab Laboratorium Penelitian Kimia Organik serta seluruh keluarga besar laboratorium atas bantuan dan kerjasamanya, keluarga tercinta yang telah member dukungan moral dan materi.
Penulis sangat mengharapkan saran dan kritik yang bersifat membangun dari pembaca. Penulis berharap semoga karya ilmiah ini bermanfaat bagi penulis pada khususnya dan pembaca pada umumnya.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
BAHAN DAN METODE 1
Bahan dan Alat 1
Penentuan Kadar Air 2
Ekstraksi Daun Binahong 2
Uji Toksisitas Terhadap Larva Udang 2
Uji Fitokimia 3
Penentuan Eluen 4
Pemisahan Komponen Sitotoksik dengan Kromatografi Kolom 4 Pencirian Fraksi Teraktif dengan FTIR dan GC-MS 4
HASIL DAN PEMBAHASAN 5
Rendemen Ekstrak 5
Toksisitas Ekstrak 5
Fitokimia Ekstrak n-Butanol 6
Fraksi Ekstrak n-Butanol 6
Spektrum FTIR Fraksi 4 8
Komponen Sitotoksik Fraksi 4 Berdasarkan Analisis GC-MS 9
SIMPULAN DAN SARAN 11
DAFTAR PUSTAKA 12
LAMPIRAN 13
DAFTAR TABEL
1 Fitokimia ekstrak n-butanol 6
2 Rendemen fraksi binahong dari kromatografi kolom 8 3 Senyawa dominan dalam fraksi 4 ekstrak n-butanol berdasarkan GC-MS 9
DAFTAR GAMBAR
1 Profil kromatogram ekstrak n-butanol daun binahong 7 2 Profil kromatogram noda tunggal fraksi-fraksi hasil kromatografi kolom 7 3 Nilai LC50 fraksi-fraksi hasil kromatografi kolom 8
4 Spektrum FTIR fraksi 4 daun binahong 9
5 Struktur bis-2-etilheksil-1,2-benzenadikarboksilat (a), asam oleat (b), dan
asam palmitat (c) 10
7 Spektrum massa bis-2-etilheksil-1,2-benzenadikarboksilat 10 8 Fragmentasi bis-2-etilheksil-1,2-benzenadikarboksilat 10
DAFTAR LAMPIRAN
1 Hasil identifikasi Anredera cordifolia 13
2 Bagan alir penelitain 14
3 Kadar air daun binahong kering dan table probit 15 4 Rendemen ekstrak dan fraksi ekstrak n-butanol daun binahong 16 5 Hasil uji toksisitas BSLT ekstrak n-heksana daun binahong 17 6 Hasil uji toksisitas BSLT ekstrak diklorometana daun binahong 18 7 Hasil uji toksisitas BSLT ekstrak n-butanol daun binahong 19 8 Kromatogram lapis tipis pada berbagai eluen (deteksi denganl ampu UV 254
nm) 20
9 Hasil uji toksisitas BSLT fraksi 1 hasil kromatografi kolom 21 10 Hasil uji toksisitas BSLT fraksi 2 hasil kromatografi kolom 22 11 Hasil uji toksisitas BSLT fraksi 3 hasil kromatografi kolom 23 12 Hasil uji toksisitas BSLT fraksi 4 hasil kromatografi kolom 24 13 Hasil uji toksisitas BSLT fraksi 5 hasil kromatografi kolom 25 14 Kromatogram GC-MS dan dugaan senyawa dalam fraksi 4 berdasarkan
PENDAHULUAN
Anredera merupakan salah satu genus dalam famili Basselaceae. Genus ini
memiliki beberapa spesies yang berkhasiat mengobati berbagai penyakit. Anredera diffusa dipakai sebagai penyembuh luka di Peru, A. baselloides dan A.
leptostachys memiliki khasiat sebagai antiradang dan analgesik di Amerika (Duke et al. 2009). Spesies A. cordifolia yang diteliti di Afrika oleh Tshikalange et al. (2005) bersifat antibakteri pada dosis 60 μg/mL. Bahkan pada penelitian lanjutan, tanaman ini positif sebagai anti-HIV pada dosis 50 mg/mL (Tshikalange et al. 2008). Spesies A. cordifolia terkenal dan tumbuh menyebar di Asia, dikenal di Cina dengan nama San Chi atau Teng San Chi dan di Indonesia dengan nama binahong.
Ekstrak metanol daun binahong memiliki sifat antioksidan dengan nilai konsentrasi penghambatan 50% (IC50) 53.11 μg/mL terhadap radikal 1,1 -difenil-2-pikrilhidrazil (DPPH) (Djamil et al. 2012). Ekstrak etanol dengan konsentrasi 2% dapat menyembuhkan luka pada kulit marmut lebih baik daripada povidon iodin 10% (Miladiyah dan Prabowo 2012). Puryanto (2009) juga menyatakan bahwa ekstrak etanol daun binahong dalam bentuk gel bersifat antiradang dan dapat menyembuhkan luka bakar pada punggung kelinci. Masyarakat Bogor lazim menggunakan tanaman ini untuk menyembuhkan diabetes, muntah darah, rematik, obat luka, radang usus, seriawan, asam urat, dan jerawat (Manoi 2009).
Khasiat tanaman binahong disebabkan oleh aktivitas senyawa minor metabolit sekunder sitotoksik pada tanaman tersebut. Namun, komponen sitotoksik tersebut belum banyak diteliti. Hasil penelitian pendahuluan Rachmawati (2007) menyatakan bahwa tanaman binahong mengandung alkaloid, triterpenoid, dan saponin. Astuti (2011) melaporkan kandungan saponin sebesar 28.14% di dalam ekstrak n-butanol daun binahong kering.
Salah satu metode penapisan awal yang sering digunakan untuk menguji potensi sitotoksik adalah uji letalitas larva udang (BSLT). Parameter yang digunakan pada metode BSLT adalah kematian larva Artemia salina Leach. Pengujian BSLT dilakukan pada ekstrak daun binahong hasil partisi dan fraksionasi dengan kromatografi kolom. Fraksi teraktif diidentifikasi dengan menggunakan spektrofotometer inframerah transformasi Fourier (FTIR) untuk menentukan gugus fungsi dalam senyawa aktif dan kromatografi gas-spektrometri massa (GC-MS) untuk menentukan komponen sitotoksik tersebut.
BAHAN DAN METODE
Bahan dan Alat
untuk uji fitokimia, silika gel 60 Merck, larva udang A. salina Leach, dan pelat kromatografi lapis tipis (KLT) silika gel G60F254.
Alat-alat yang digunakan adalah kromatografi kolom, multiwell, corong pisah, lampu ultraviolet (UV), oven, bejana kromatografi, spektrofotometer FTIR Perkin Elmer di Universitas Islam Negeri Syarif Hidayatullah Jakarta, dan GC-MS (Shimadzu-QP-505A) di Laboratorium Forensik Mabes POLRI Jakarta.
Penentuan Kadar Air
Cawan porselen dikeringkan di dalam oven 105 oC selama 30 menit, selanjutnya didinginkan dalam eksikator dan ditimbang. Sebanyak 2 g sampel dimasukkan ke dalam cawan tersebut dan dikeringkan dalam oven 105 oC selama 5 jam sampai diperoleh bobot konstan. Kemudian cawan didinginkan dalam eksikator selama 15 menit dan ditimbang. Penetapan kadar air dilakukan berdasarkan bobot kering sampel sebanyak 5 kali ulangan.
Ekstraksi Daun Binahong
Daun binahong diekstraksi dengan cara maserasi dalam pelarut etanol 80% berair dengan nisbah 1:1.5. Ekstrak dipekatkan dengan penguap putar, kemudian dipartisi berturut-turut antara etil asetat dan akuades, n-heksana dan metanol 90% berair, diklorometana dan metanol 50% berair, dan terakhir lapisan air dipartisi dengan n-butanol (Lampiran 2). Ekstrak dipekatkan, dihitung rendemen masing-masing dengan persamaan sebagai berikut:
Uji Toksisitas terhadap Larva Udang
Penetasan Telur Artemia salina
Telur A. salina yang sudah siap ditetaskan ditimbang sebanyak 0.5 g, kemudian dimasukkan ke dalam gelas piala berisi 250 mL air laut yang sudah disaring dan diaerasi. Telur dibiarkan dalam air laut yang diaerasi selama 48 jam di bawah pencahayaan lampu hingga menetas sempurna. Telur yang telah menetas menjadi larva digunakan untuk uji toksisitas.
Uji Toksisitas
dimasukkan 500 μL air laut, 10 ekor larva udang, dan 500 μL ekstrak sampai volume total 1 mL. Ulangan dilakukan 4 kali. Multiwell ditutup dengan kertas aluminium dan diinkubasi selama 24 jam. Nilai konsentrasi mematikan 50% (LC50) ditentukan dengan menggunakan kurva hubungan konsentrasi ekstrak (sumbu x) dengan % probit (sumbu y). Tabel probit dapat dilihat pada Lampiran 3. Ekstrak yang paling sitotoksik (memiliki LC50 paling rendah) diuji fitokimia dan difraksionasi lebih lanjut.
Uji Fitokimia (Harborne 1987)
Uji Alkaloid
Ekstrak ditimbang 0.01 g, dilarutkan dengan 10 mL kloroform dan beberapa tetes NH4OH, kemudian disaring kedalam tabung reaksi tertutup. Ekstrak kloroform dalam tabung dikocok dengan 10 tetes H2SO4 2 M dan lapisan asamnya dipisahkan ke dalam tabung reaksi lain. Lapisan asam ini diteteskan pada lempeng tetes dan ditambahkan pereaksi Mayer, Wagner, dan Dragendrof yang berturut-turut akan menimbulkan endapan putih, cokelat, dan merah jingga jika terkandung alkaloid.
Uji Saponin dan Flavonoid
Ekstrak sebanyak 0.01 g dimasukkan ke dalam gelas piala 50 mL, kemudian ditambahkan 50 mL air panas dan dididihkan selama 5 menit. Setelah itu, larutan disaring dan filtratnya digunakan untuk pengujian. Uji saponin dilakukan dengan mengocok 10 mL filtrat di dalam tabung reaksi tertutup selama 10 detik, lalu dibiarkan selama 10 menit. Adanya saponin ditunjukkan dengan terbentuknya buih yang stabil. Sebanyak 10 mL filtrat yang lain ditambahkan 0.5 g serbuk magnesium, 2 mL alkohol klorhidrat (campuran HCl 37% dan etanol 95% dengan volume yang sama), dan 20 mL amil alkohol, lalu dikocok kuat-kuat. Terbentuknya warna merah, kuning, dan jingga pada lapisan amil alkohol menunjukkan adanya flavonoid
Uji Steroid dan Terpenoid
Ekstrak dilarutkan sebanyak 0.01 g dalam 25 mL etanol panas (50 oC). Larutan kemudian disaring ke dalam pinggan porselen dan diuapkan. Residu ditambahkan dengan eter, dipindahkan ke dalam tabung reaksi, lalu diuji dengan 3 tetes anhidrida asam asetat dan 1 tetes H2SO4 pekat (uji Liebermann-Buchard). Warna merah atau ungu menunjukkan kandungan triterpenoid, sedangkan warna hijau dan biru menunjukkan adanya steroid.
Uji Polifenol
Ekstrak sebanyak 0.01 g dimasukkan ke dalam gelas piala 100 mL, kemudian ditambahkan 100 mL air panas dan dididihkan selama 5 menit. Campuran disaring, lalu ke dalam sebagian filtrat ditambahkan larutan FeCl3 1%. Warna hitam kehijauan menunjukkan adanya polifenol.
Penentuan Eluen
Ekstrak teraktif daun binahong ditotolkan pada pelat KLT silika gel G60F254 dari Merck. Setelah kering, segera dielusi dalam bejana kromatografi yang telah dijenuhkan oleh uap eluen pengembang. Eluen yang digunakan ialah n-heksana, diklorometana, kloroform, etil asetat, etanol, dan metanol. Noda yang dihasilkan dari setiap proses elusi diamati di bawah lampu UV pada panjang gelombang 254 nm. Eluen yang baik ialah yang menghasilkan noda terbanyak dengan keterpisahan yang baik.
Pemisahan Komponen Sitotoksik dengan Kromatografi Kolom
Bubur fase diam dibuat dengan mencampurkan silika gel 60 Merck dengan eluen n-heksana dengan nisbah 1:10. Bubur silika sebanyak 60 g dimasukkan ke dalam kolom hingga mencapai ¾ tinggi kolom. Elusi dilakukan dengan menggunakan eluen yang semakin meningkat kepolarannya, mulai dari n-heksana, n-heksana-kloroform (8:2, 6:4, 4:6, dan 2:8), kloroform, kloroform-metanol (9:1, 8:2, 7:3, 6:4, 5:5, 4:6, 3:7, 2:8, 1:9), dan metanol.
Eluen dibiarkan turun dengan laju alir eluat 2 mL/menit. Sampel sebanyak 1 g dimasukkan setelah laju alir konstan yang menunjukkan bahwa fase diam sudah terkemas dengan baik. Eluat ditampung dalam vial kecil setiap 5 menit. Noda yang teramati dihitung nilai Rf-nya sebagai berikut:
Eluat yang memiliki nilai Rf yang sama digabung menjadi 1 fraksi. Fraksi-fraksi yang diperoleh diuji kembali toksisitasnya untuk menentukan Fraksi-fraksi teraktif, yaitu yang memiliki LC50 terkecil. Fraksi ini diidentifikasi dengan menggunakan spektrofotometer FTIR dan GC-MS. Prosedur uji toksisitas fraksi seperti dijelaskan sebelumnya, tetapi larutan stok dibuat dengan konsentrasi 2000 g/mL dan diencerkan menjadi 0, 50, 100, 200, 500, dan 1000 g/mL.
Pencirian Fraksi Teraktif dengan FTIR dan GC-MS
Fraksi teraktif diukur dengan spektrofotometer FTIR (Spectrum One Perkin Elmer) untuk menentukan gugus fungsi yang terkandung. Fraksi teraktif juga dianalisis dengan GC-MS (Shimadzu-QP-505A) dengan menggunakan kolom DB-5 MS (0.25 mm × 30 m) dan gas pembawa helium dengan laju alir 42 mL/menit. Suhu injektor 80 oC dan suhu detektor 250 oC, sedangkan suhu kolom terprogram, diawali dengan 80 oC ditahan selama 5 menit kemudian diubah perlahan-lahan dengan laju kenaikan suhu 5 oC/menit hingga mencapai 250 oC (konstan hingga menit ke-45). Kondisi spektrometer massanya adalah energi ionisasi 70 eV, modus ionisasi serangan elektron (EI), split ratio 25.0, dan area deteksi 40–500 m/z. Setiap puncak yang muncul dalam kromatogram ion total diidentifikasi bobot molekul dan pola fragmentasinya dan dibandingkan dengan spektrum massa dalam library index WiNley MS 2008.
HASIL DAN PEMBAHASAN
Rendemen Ekstrak
Rendemen ekstrak dihitung berdasarkan bobot kering sampel. Kadar air daun binahong sebesar 9.01% (Lampiran 3), merupakan air yang terikat secara fisis dan dapat dihilangkan dengan pemanasan pada suhu 100–105 oC (Harjadi 1986).
Metode maserasi digunakan karena kandungan senyawa pada daun binahong belum diketahui ketahanannya terhadap panas. Pelarut etanol dipilih karena dapat mengekstraksi senyawa polar dan nonpolar dengan baik (Harborne 1987). Selain itu, etanol aman digunakan untuk mengekstraksi bahan alam karena tidak memiliki sifat toksik. Ekstrak etanol dipartisi cair-cair dengan akuades dan etil asetat. Ekstrak etil asetat dipekatkan dan dipartisi cair-cair berturut-turut dengan n-heksana, diklorometana, dan n-butanol berdasarkan tingkat kepolaran.
Komponen yang terekstraksi adalah yang berpolaritas sesuai dengan pelarutnya (Markham 1988). Pelarut nonpolar (n-heksana) dapat mengekstraksi senyawa hidrokarbon, terpena, dan lemak. Pelarut semipolar seperti diklorometana mampu mengekstraksi senyawa fenol dan terpenoid, sedangkan pelarut polar (n-butanol) mampu mengekstraksi senyawa alkaloid kuaterner, ester asam lemak, komponen fenolik, dan tanin (Harborne 1987). Lampiran 4 menunjukkan rendemen ekstrak tanaman binahong. Rendemen paling tinggi diperoleh dari ekstrak n-butanol (27.40%), sedangkan rendemen ekstrak n-heksana paling rendah, sebesar 16.59%. Berdasarkan hasil ekstraksi pendahuluan, dapat disimpulkan bahwa daun binahong memiliki lebih banyak senyawa polar dibandingkan dengan senyawa nonpolar.
Toksisitas Ekstrak
Toksisitas ekstrak daun binahong diuji dengan menggunakan larva udang A. salina Leach. Kematian larva udang disebabkan oleh senyawa toksik pada media hidup larva. Larva udang yang ditetaskan selama 48 jam memiliki dinding yang lunak sehingga senyawa asing dalam air laut dengan mudah diserap dan langsung memengaruhi kehidupan larva.
Ekstrak n-heksana, diklorometana, dan n-butanol memberikan nilai LC50
kurang dari 1000 μg/mL (Lampiran 5−7). Menurut Musa (2012), ekstrak bahan alam dapat dikatakan toksik dan dapat dikembangkan sebagai pengobatan jika memiliki nilai LC50kurang dari 1000 μg/mL. Oleh karena itu, ketiga ekstrak daun binahong bersifat toksik. Ekstrak diklorometana memiliki nilai LC50 paling besar
(993 μg/mL), kemudian berturut-turut ekstrak n-heksana (583 μg/mL), dan ekstrak n-butanol (494 μg/mL). Berdasarkan hasil ini, ekstrak n-butanol daun binahong memiliki daya sitotoksik yang diprediksi lebih tinggi daripada kedua ekstrak lainnya.
Keterangan: (-) tidak terdeteksi, (+) terdeteksi, semakin banyak (+), intensitas hasil meningkat.
albicans sebesar 250–1000 μg/mL (Sarjana 2012). Efek toksik terhadap larva udang merupakan indikasi awal dari efek farmakologi bahan tersebut terhadap mikrob, bakteri, atau sel kanker.
Fitokimia Ekstrak n-Butanol
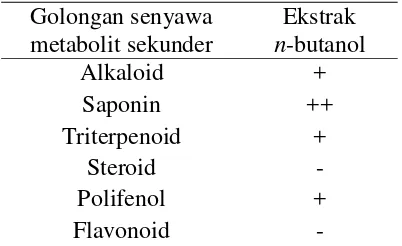
Penapisan fitokimia lazim digunakan untuk mensurvei tumbuhan agar mendapatkan kandungan bioaktif yang berguna untuk pengobatan. Tabel 1 menunjukkan bahwa ekstrak n-butanol mengandung golongan senyawa alkaloid, saponin, triterpenoid, dan polifenol. Senyawa yang paling banyak terkandung adalah saponin karena menunjukkan busa yang banyak dan stabil selama 10 menit. Hal ini didukung oleh penelitian Astuti (2011) yang melaporkan bahwa daun binahong yang diekstraksi menggunakan n-butanol mengandung saponin sebesar 28.14%. Sarjana (2012) juga membuktikan bahwa ekstrak n-butanol daun binahong memiliki kandungan triterpenoid dan saponin. Hasil uji negatif ditunjukkan pada uji steroid dan flavonoid, mengindikasikan bahwa ekstrak n-butanol tidak mengandung golongan senyawa tersebut atau kandungannya dalam ekstrak n-butanol sangat kecil sehingga tidak terdeteksi.
Tabel 1 Fitokimia ekstrak n-butanol Golongan senyawa
Fraksi Ekstrak n-Butanol
Deteksi pendahuluan dengan KLT menunjukkan bahwa eluen tunggal metanol dan etanol memiliki keterpisahan yang lebih baik daripada pelarut lainnya. Namun, noda pada eluen etanol berekor dan memanjang karena tidak adanya interaksi yang seimbang antara bahan uji, fase diam, dan fase gerak (Lampiran 8). Keterpisahan komponen yang baik menurut Sarjana (2012) dan Astuti (2011) diperoleh dengan menggunakan campuran kloroform, metanol, dan air. Elusi ekstrak dengan air tidak memisahkan noda, berekor, dan memerlukan waktu elusi yang lama, maka penelitian ini menggunakan campuran kloroform dan metanol. Pola keterpisahan yang baik didapatkan dengan eluen kloroform-metanol (7:3), dan menghasilkan 5 noda (Gambar 1).
→
Gambar 1 Profil kromatogram ekstrak n-butanol daun binahong
Silika gel lebih polar dibandingkan dengan eluen kloroform-metanol (7:3), maka noda yang lebih bersifat polar akan memiliki nilai Rf yang lebih kecil. Noda 5 memiliki nilai Rf yang sangat kecil dan diperkirakan adalah tanin. Noda 1 dan 2 memiliki nilai Rf yang besar dan diperkirakan bersifat semipolar.
Pemisahan dengan kromatografi kolom menggunakan elusi gradien dengan kepolaran eluen n-heksana-kloroform-metanol yang semakin meningkat (Lampiran 8). Eluat dengan noda tunggal pada nilai Rf yang sama dalam eluen terbaik digabungkan dan menghasilkan 5 fraksi dengan kepolaran yang berbeda (Gambar 2). Noda terdeteksi dengan lampu UV 254 nm yang menunjukkan bahwa senyawa-senyawa yang terkandung memiliki sedikitnya 2 ikatan rangkap terkonjugasi atau hidrokarbon aromatik.
Gambar 2 Profil kromatogram noda tunggal fraksi-fraksi hasil kromatografi kolom
Rendemen terbesar dimiliki oleh fraksi 5 (Tabel 2). Fraksi 5, yaitu noda 5 pada uji pemisahan pendahuluan dengan KLT adalah senyawa yang bersifat polar berdasarkan nilai Rf-nya yang paling kecil dalam eluen nonpolar kloroform-metanol (7:3). Diduga senyawa ini adalah tanin karena fraksi 5 berwarna kuning kecokelatan. Kelima fraksi hasil kromatografi kolom diuji toksisitasnya terhadap larva udang A. salina Leach.
Tabel 2 Rendemen fraksi binahong dari kromatografi kolom Fraksi Rendemen (%b/b)
1 17.58
2 4.73
3 7.47
4 5.82
5 21.98
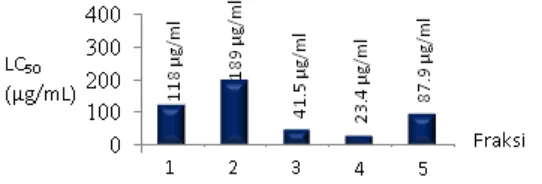
Data mortalitas larva udang hasil uji BSLT diolah menggunakan metode analisis probit pada tingkat 50% kematian (LC50) dengan asumsi selang kepercayaan 95% yang dirumuskan oleh Finney (1971). Koefisien korelasi (r2) kelima fraksi n-butanol lebih besar dari 0.99 (Lampiran 9–13), maka ketelitiannya tergolong sangat baik. Fraksi 4 memiliki LC50 paling kecil, yaitu 23.4 μg/mL (Gambar 3) dan termasuk dalam kategori toksik. Moshi et al. (2010) menyatakan bahwa suatu fraksi pemisahan lanjutan bersifat toksik apabila memberikan nilai LC50 10–30 μg/mL.
Gambar 3 Nilai LC50 fraksi-fraksi hasil kromatografi kolom
Sifat toksik fraksi dalam uji dengan larva udang A. salina berpotensi dikembangkan sebagai antibakteri, antijamur, dan bahan obat (Ogugu et al. 2012). Fraksi 4 memiliki nilai Rf 0.19, dan Gambar 3 secara umum memperlihatkan bahwa senyawa yang lebih polar bersifat lebih sitotoksik.
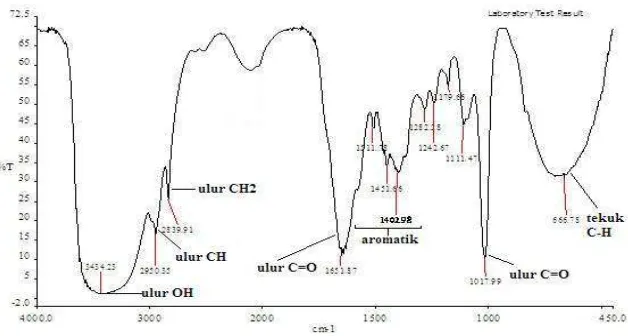
Spektrum FTIR Fraksi 4
Spektrum FTIR (Gambar 4) memberikan informasi jenis dan gugus fungsi yang terdapat dalam fraksi 4. Serapan kuat pada bilangan gelombang 3434.23 cm-1 berasal dari vibrasi ulur OH. Ulur C-H aromatik memberikan serapan kuat pada 2950.35 cm-1. Serapan sedang di 2839.91 cm-1 ditimbulkan oleh ulur –CH2 dan
serapan kuat di 1651.87 cm-1 merupakan hasil vibrasi ulur C=O dari asam karboksilat atau ester. Pita serapan lemah di 2106.99 cm-1 berasal dari vibrasi ulur C=C takterkonjugasi yang didukung oleh serapan lemah pada bilangan gelombang 666.78 cm-1 yang merupakan ciri cincin aromatik. Ulur C-O ester memberikan serapan kuat di 1017.99 cm-1. Analisis spektrum FTIR fraksi 4 mengindikasikan bahwa senyawa di dalamnya mengandung gugus karboksil, cincin aromatik, dan ester.
Gambar 4 Spektrum FTIR fraksi 4 daun binahong
Komponen Sitotoksik Fraksi 4 Berdasarkan Analisis GC-MS
Kromatogram GC-MS fraksi 4 diberikan pada Lampiran 14. Puncak yang paling luas diperoleh pada waktu retensi 23.73 menit dengan bobot molekul 390 g/mol dan area 79.29%. Kemiripan mencapai 91% dengan spektrum massa senyawa bis-2-etilheksil-1,2-benzenadikarboksilat. Puncak dominan kedua dan ketiga (area berturut-turut 5.30% dan 4.78%) diidentifikasi sebagai asam oleat dan asam palmitat (Tabel 3).
Tabel 3 Senyawa dominan dalam fraksi 4 ekstrak n-butanol berdasarkan GC-MS
Komponen sitotoksik memiliki sifat toksik terhadap sel, dan berkorelasi positif dengan toksisitas terhadap bakteri, mikrob, atau jamur, bahkan terhadap sel kanker. Sudhasrikesavan dan Selvam (2012) mengidentifikasi bis-2-etilheksil-1,2-benzenadikarboksilat sebagai komponen aktif dalam tumbuhan laut yang bersifat sitotoksik menghambat proliferasi sel kanker HEP-2 sebesar 16.5 μg/mL. Torane et al. (2012) mengisolasi senyawa yang sama dari ekstrak metanol Sargassum wightii dan memberikan hasil positif sebagai antimikrob dan antiradang. Sastri dan Rao (1995) juga menyatakan bahwa senyawa ini memiliki sifat antibakteri. Pertumbuhan bakteri Escherichia coli dapat dihambat oleh senyawa ini (Swantara 2011).
Asam oleat juga memiliki sifat sitotoksik. Kajian terhadap aktivitas antikanker dari turunan asam oleat telah dilakukan oleh Ho et al. (2009). Sementara Moura (2006) menunjukkan bahwa asam palmitat memiliki aktivitas sebagai inhibitor mutasi pada sel Saccharomyces cerevisae. Asam palmitat juga toksik terhadap mikrob (Swantara 2011). Struktur ketiga komponen sitotoksik dalam fraksi 4 daun binahong tersebut dapat dilihat pada Gambar 5.
Gambar 5 Struktur bis-2-etilheksil-1,2-benzenadikarboksilat (a), asam oleat (b), dan asam palmitat (c).
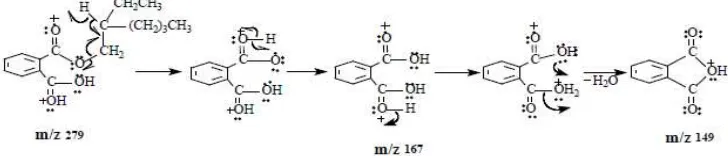
Spektrum massa bis-2-etilheksil-1,2-benzenadikarboksilat (Gambar 6) tidak menunjukkan puncak ion molekul dengan m/z 390. Senyawa diester aromatik tidak stabil sehingga yang muncul ialah fragmen monoester karboksilat dan dikarboksilat berturut-turut pada m/z 279 dan 167. Fragmen dengan m/z 149 menjadi puncak dasar. Fragmen ini khas pada semua ester asam ftalat (Sani dan Pateh 2009). Gambar 7 menunjukkan pola fragmentasi bis-2-etilheksil-1,2-benzenadikarboksilat selengkapnya.
Gambar 6 Spektrum massa bis-2-etilheksil-1,2-benzenadikarboksilat
Gambar 7 Fragmentasi bis-etilheksil-1,2-benzenadikarboksilat
SIMPULAN DAN SARAN
Simpulan
Fraksi teraktif daun binahong ialah fraksi n-butanol dari ekstrak etanol. Fraksionasi lebih lanjut menghasilkan 5 fraksi dengan fraksi 4 memiliki LC50 paling kecil, yaitu 23.4 μg/mL dengan nilai Rf 0.19 pada eluen kloroform-metanol 7:3. Analisis spektrum FTIR menunjukkan bahwa fraksi teraktif mengandung gugus karboksil, cincin aromatik, dan ester. Analisis kromatogram gas-spektrum massa menunjukkan bahwa komponen dominan dalam fraksi tersebut adalah bis-2-etilheksil-1,2-benzenadikarboksilat (79.29%), bersama dengan asam oleat (5.30%), dan asam palmitat (4.78%).
Saran
Fraksi teraktif perlu diuji lebih lanjut pada sel kanker yang lebih spesifik dan dicirikan strukturnya dengan resonans magnetik inti.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemists. 2007. Official Methods of AOAC International. Rev ke-2. Vol ke-1. Maryland (US): AOAC International.
Astuti SM. 2011. Determination of saponin compound from Anredera cordifolia (Ten) Steenis plant (Binahong) to potential treatment for several disease. J Agric Sci. 3(4):224-232.
Djamil R, Wahyudi PS, Wahono S, Hanafi M. 2012. Antioxidant activity of flavonoid from Anredera cordifolia (Ten) Steenis leaves. Int J Pharm. 3(9):241-243.
Duke JA, Godwin MJB, Ottesen AR. 2009. Duke’s Handbook of Medicinal Plants of Latin America. New York (US): CRC Pr.
Finney DJ. 1971. Probit Analysis. Ed ke-2. Cambridge (US): Cambridge University Pr.
Harborne JB. 1987. Metode Fitokimia. Padmawinata K, penerjemah. Bandung (ID): ITB Pr. Terjemahan dari: Phytochemical Method.
Harjadi W. 1986. Ilmu Kimia Analitik Dasar. Jakarta (ID): Gramedia.
Ho CL, Wang EIC, Su YC. 2009. Essential oil compositions and bioactive of the various parts of Cinnamomun camphora Sieb. Yar.Linalool Litera quarterly Fujuta. J Forest Res. 31(2):77-96.
Manoi F. 2009. Binahong (Anredera cordifolia) sebagai obat. Warta Litbang Tanaman Industri. 15(1): 3-5.
Markham KR. 1988. Cara Mengidentifikasi Flavonoid. Bandung (ID): ITB Pr. Miladiyah I, Prabowo BR. 2012. Ethanolic extract of Anredera cordifolia (Ten.)
Moura V. 2006. In vivo wound healing activity of oleanolic acid derived from the acid hydrolysis of Anredera diffusa. J Nat Prod. 69:978-979.
Moshi MJ, Innocent E, Magadula JJ, Otieno DF, Wersheit A, Mbabazi PK, Nondo RSD. 2010. Brine shrimp toxicity of some plants used as traditional medicines in Kugera Region, north western Tanzania. Environ Sci. 2(3):150-156.
Musa AA. 2012. Cytotoxicity activity and phytochemical screening of Cochlspermum tinctonium Perr Ex A. rich rhizome using Artemia salina test. J Pharm Sci. 2(7):155-159.
Ogugu SE, Kehinde AJ, James BI, Paul DK. 2012. Assessment of cytotoxic effects of methanol extract of Calliandra portoricensis using brine shrimp (Artemia salina) lethalitiy bioassay. J Biosyst Biotechnol. 1(2):257-260. Puryanto K. 2009. Uji aktivitas gel ekstrak etanol daun binahong (Anredera
cordifolia) sebagai penyembuh luka bakar pada kulit punggung kelinci [skripsi]. Surakarta (ID): Universitas Muhamadiyah Surakarta.
Rachmawati S. 2007. Studi makroskopi, mikroskopi, dan skrining fitokimia daun binahong (Anredera cordifolia (Ten.) Steenis) [skripsi]. Surabaya (ID): Universitas Airlangga.
Sani UM, Pateh UU. 2009. Isolation of 1,2-benzenedicarboxylic acid bis (2-ethylhexyl) ester from methanol extract of the variety minor seeds of Ricinnus communis Linn. (Euphorbiaceae). J Pharm Sci. 8(2):107-114. Sarjana M. 2012. Isolasi dan identifikasi senyawa triterpenoid aktif sebagai
antimikroba dari ekstrak metanol daun binahong (Anredera cordifolia (Ten.)Steenis) [skripsi]. Surabaya (ID): Universitas Airlangga.
Sastri V, Rao GRK. 1995. Dioctyl phthalate and antibacterial compound from the marine brown alga Sargassum wightii. J Phys. 7:185-186.
Sudhasrikesavan S, Selvam MM. 2012. Actinomycetes from marine sediment: screening for cytotoxicity, identification, and analysis of bioactive constituents by gas chromatography-mass spectrometry. Int J Biosci. 68-71. Swantara IMD. 2011. Kajian senyawa antioksidan pada rumput laut dari pantai
sekitar Bali [skripsi]. Bukit Jimbaran (ID): Universitas Udayana.
Torane RC, Kamble GS, Devare S, Phalgune U, Deshpande N. 2012. Isolation and characterization of 1,2-benzenedicarboxylic acid, bis-2-ethylhexyl ester-dioctyl pthalate, a bioactive compound from Ehreda Laevis. J Pharm Res. 5(6):3251-3252.
Tshikalange TE, Meyer JJM, Hussein AA. 2005. Antimicrobial activity, toxicity, and the isolation of a bioactive compound from plants used to treat sexually transmitted diseases. J Ethnopharmacol. 96:515-519.
Tshikalange, TE. 2007. In vitro anti-HIV-1 properties of ethnobotanically selected South African plants used in the treatment of sexually transmitted diseases. J Ethnopharmacol. 96:515-519.
Uji toksisitas BSLT
Penentuan fraksi (KLT), mencari eluen terbaik Pemisahan dengan kromatografi kolom
Perbandingan daya sitotoksik 5 fraksi
Uji fitokimia, analisis komponen dengan FTIR dan GC-MS Dipekatkan
Lampiran 2 Bagan alir penelitian
v
Ekstrak teraktif
Lapisan metanol 50%
Disaring dan dipekatkan
Diekstraksi dengan 150 mL etanol
Dipartisi dengan etil asetat dan akuades
Dipartisi dengan n-butanol Daun binahong kering
Ekstrak kasar (7.62 g)
Lapisan etil asetat Lapisan akuades
Lampiran 3 Kadar air daun binahong kering dan tabel probit A) Kadar air daun binahong
Ulangan Bobot Bobot Bobot setelah
di oven (g)
Kadar air (%) kosong (g) daun binahong (g)
1 44.67 2.12 46.60 8.96
2 63.40 2.16 65.36 9.26
3 45.51 2.02 47.35 8.91
4 62.51 2.01 64.34 8.96
5 62.08 2.01 63.91 8.96
Rerata 9.01 Contoh perhitungan:
= 8.96%
B) Tabel Probit
% Probit
0 1 2 3 4 5 6 7 8 9
Lampiran 4 Rendemen ekstrak dan fraksi ekstrak n-butanol a) Rendemen ekstrak daun binahong
Ekstrak
Lampiran 5 Hasil uji toksisitas BSLT ekstrak n-heksana daun binahong Konsentrasi
(μg/mL) larva awal Jumlah
Jumlah
larva mati Rerata %Kematian
0 10 0 0 0
log konsentrasi Lampiran 6 Hasil uji toksisitas BSLT ekstrak diklorometana daun binahong
Konsentrasi
Lampiran 7 Hasil uji toksisitas BSLT ekstrak n-butanol daun binahong
Lampiran 8 Kromatogram lapis tipis pada berbagai eluen (deteksi dengan lampu UV 254 nm)
a) Eluen etanol (a) dan metanol (b)
b) Eluen metanol (c), n-heksana (d), etil asetat (e), dan kloroform (f)
c) Eluen kloroform-metanol berbagai nisbah (a) (b)
20
(c) (d) (e) (f)
K:m (4:6)
K:m (5:5)
K:m (6:4)
K:m (7:3)
K:m (8:2)
Lampiran 9 Hasil uji toksisitas BSLT fraksi 1 hasil kromatografi kolom
Lampiran 10 Hasil uji toksisitas BSLT fraksi 2 hasil kromatografi kolom
Lampiran 11 Hasil uji toksisitas BSLT fraksi 3 hasil kromatografi kolom Konsentrasi
(μg/mL) larva awal Jumlah
Jumlah
Lampiran 12 Hasil uji toksisitas BSLT fraksi 4 hasil kromatografi kolom Konsentrasi
(μg/mL) larva awal Jumlah
Jumlah
Lampiran 13 Hasil uji toksisitas BSLT fraksi 5 hasil kromatografi kolom Konsentrasi
(μg/mL) larva awal Jumlah
Jumlah
Lampiran 14 Kromatogram GC-MS dan dugaan senyawa dalam fraksi 4 berdasarkan library index MS
Puncak Waktu retensi (menit)
Kemungkinan senyawa Kemiripan dengan library index MS (%)
1 3.48 Siklobutanol 59
2 6.51 Asam pentanoat 43
3 15.99 Asam heksadekanoat 97
4 16.45 Asam palmitat 96
5 18.84 Asam oleat 95
6 23.73
Bis-2-etilheksil-1,2-benzenadikarboksilat
91
7 29.31 Benzenamina 41
8 30.88 Asam propanadioat 38
9 34.65 3,3-Etilenadioksi-1,2,3-trihidro-2-okso-1-benzil
alkohol
43
10 37.37 Disilana 27
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 19 Maret 1989 sebagai anak pertama dari 6 bersaudara dari pasangan Ir Marsono dan Tasilah Maesitoh.
Tahun 2007 penulis lulus dari SMA Negeri 1 Cilegon dan pada tahun yang sama diterima di Program Keahlian D3 Analisis Kimia, Direktorat Program Diploma, Institut Pertanian Bogor (IPB) dan lulus pada tahun 2010. Pada tahun yang sama penulis melanjutkan ke jenjang S1 Ahli Jenis Kimia di IPB.
Selama menjadi mahasiswi, penulis aktif mengikuti program sosial mengajar anak-anak kurang mampu di bawah naungan “Die Burke Germany” pada tahun 2009–2011. Penulis juga pernah menjadi asisten praktikum Kromatografi II dan Spektroskopi II (D3 Analisis Kimia) pada tahun ajaran 2011/2012 serta Kimia Farmasi, Analisis Komponen dan Uji Aktivitas, Keselamatan Kerja Laboratorium dan Pengetahuan Bahan pada tahun ajaran 2012/2013. Di tahun 2010, penulis melakukan praktik lapangan kerja di Laboratoriun Quality Control, Balai Besar Kimia dan Kemasan. Tahun 2010– 2011, penulis pernah bekerja sebagai Quality Control di PT Boehringer Ingelheim Indonesia, dan tahun 2009 magang kerja di PT Krakatau Steel.