Diuji makroskopik Lampiran 2. Bagan kerja penelitian
Disortasi Basah
Dihaluskan
Rumput laut coklat segar
Simplisia
Serbuk simplisia
Senyawa fukoidan
Identifikasi senyawa fukoidan
Uji sitotoksik
Spektrofotometer UV
Susut pengeringan Spektrofotometer FTIR
Dicuci
Dikeringkan di lemari pengering suhu ±40ºC
Disortasi kering Ditimbang
Dikeringkan dalam oven suhu 50ºC Lampiran 3. Bagan kerja isolasi senyawa fukoidan
Dimasukkan ke gelas beker 1000 ml Ditambah 500 ml HCl 0,1 N
Diesktraksi selama 100ºC selama 4 jam sambil sesekali diaduk
Disaring dan diperas dengan kain flannel
Disentrifugasi dengan kecepatan 3000 rpm selama 10 menit
Ditambah etanol 96 % sama banyak dengan filtrat
Disentrifugasi dengan kecepatan 3000 rpm selama 10 menit 50 g serbuk simplisia
Ampas Filtrat
Endapan Filtrat
Residu Filtrat
Isolat fukoidan 2,27 g
Digerus
Dimasukkan 10 ekor larva
Artemia salina Leach
Ditambah air laut buatan sampai 5 ml Lampiran 4. Bagan kerja uji sitotoksik
Dilarutkan dengan pelarut yang sesuai sampai 5 ml
Dipipet 0,5 ml Dipipet 0,5 ml Dipipet 0,5 ml Dicukupkan Dicukupkan Dicukupkan sampai 5 ml sampai 5 ml sampai 5 ml
Dipipet 0,5 ml Dipipet 0,5 ml Dicukupkan Dicukupkan sampai 5 ml sampai 5 ml
Dipipet 0,5 ml Dicukupkan sampai 5 ml
Dibiarkan dibawah sinar lampu 14 watt selama 24 jam
Dihitung jumlah larva Artemia salina Leach yang mati
50 g fukoidan
Larutan konsentrasi 103 µg/ml
Larutan konsentrasi 103 µg/ml Larutan konsentrasi
103 µg/ml
Larutan konsentrasi 102 µg/ml
Larutan konsentrasi 102 µg/ml
Larutan konsentrasi 10 µg/ml
Lampiran 11. Perhitungan karakteristik isolat fukoidan rumput laut coklat
1. Perhitungan persen rendemen senyawa fukoidan
W0 W
= Berat sampel sebelum diisolasi 1 = Berat hasil isolasi
W0 W
= 550 g 1 % 61 , 3 % 100 x g 550 g 8592 , 19 = =
= 19,8592 g
2. Perhitungan susut pengeringan
W1 W
= botol timbang dan sampel sebelum pengeringan dikurang botol timbang 2 = botol timbang dan sampel setelah pengeringan dikurang botol timbang
1. W1 W
= 25,7959 - 24,7788 = 1,0171 2
= 25,6023 - 24,7788 = 0,8235
% 32 , 19 % 100 x 0171 , 1 8235 , 0 0171 , 1 % 100 x W1 W2 -W1 % = = − =
2. W1 W
= 24,6878 - 23,6667 = 1,0211 2
= 24,4877 - 23,6667 = 0,8210
% , % , , ,
% x100 1959
0211 1 8210 0 0211 1 100 x W1 W2 -W1 %= = − =
% rendemen fukoidan =
Lampiran 11. (Lanjutan)
3.) W1 = 25,242 - 24,2229 = 1,0191 W2
% =
= 25, 0451 - 24,2229 = 0,8222
% 100 x W1
W2 -W1
= x100%
1,0191 0,8222
-1,0191
= 19,32%
% Rata-rata susut pengeringan = 19,32%
3
19,32% 19,59%
19,03%
= +
+
Lampiran 12. Tabel probit Finney
% 0 1 2 3 4 5 6 7 8 9
Lampiran 13. Perhitungan persentase kematian larva
Isolat fukoidan Mortalitas larva Artemia salina Leach Konsentrasi (µg/ml) P1 P2 P3 % Kematian
10 1 1 2 13,33
100 3 2 3 26,67
1000 3 2 5 33,33
Kontrol negatif (air laut) 0 0 0 0
Perhitungan persentase kematian larva yang diberi senyawa isolat fukoidan rumput laut coklat Sargassum ilicifolium (Turner) C. Agard
1. Konsentrasi 10 µg/ml
% 10 % 100 x 10 0 -1
P1= =
% 10 % 100 x 10 0 -1
P2= =
% 20 % 100 x 10 0 -2
P3= =
% 33 , 13 3 20% 10% 10% rata -rata kematian % = + + =
2. Konsentrasi 100 µg/ml
% 30 % 100 x 10 0 -3
P1= =
% 20 % 100 x 10 0 -2
P2= =
% 30 % 100 x 10 0 -3
P3= =
% 67 , 26 3 30% 20% 30% rata -rata kematian % = + + =
Lampiran 13. (Lanjutan) 3. Konsentrasi 1000 µg/ml
% 30 % 100 x 10 0 -3
P1= =
x100% 20% 10
0 -2
P2= =
x100% 50% 10
0 -5
P3= =
Lampiran 14. Perhitungan LC Konsentrasi (µg/ml) 50 Log konsentrasi (x) % kematian Nilai probit (y)
x2 y2 xy
10 1 13,33 3,87 1 14,9769 3,87
100 2 26,67 4,36 4 19,0096 8,72
1000 3 33,33 4,56 9 20,7936 13,68
Jumlah 6 12,79 14 54,7801 26,27
Keterangan :
y = Nilai probit x = log konsentrasi
a = Intercept (garis potong)
b = Slope (kemiringan dari garis regresi linier)
( )
( )
( )
( )
[
∑
]
∑
( )
∑
∑
∑
− − ×= 2 2
x n x xy n y x b
(
) (
[
)
]
( )
14 3 6 27 , 26 3 12,79 6 2− − × =36-42
78,81 -76,74 = -6 2,07 -= = 0,345
( ) ( )
[
]
[
( )
( )
]
( )
[ ]
∑
∑ ∑
∑
( )
∑ ∑
− −= 2 2
2 x n x y x xy x a
(
) (
)
( )
6 3( )
14 79 , 12 14 26,27 6 2 − × − × = 42 -36 179,06 -157,62 =0,3450 1,426 x =
Lampiran 14. (Lanjutan)
6 -21,44
-=
= 3,5733
y = a + bx
5 = 3,5733 + 0,3450x 0,3450x = 5 – 3,5733
x = 4,1354
DAFTAR PUSTAKA
Anggadiredja, J.T., Achmad Z., Heri P., dan Sri I. (2011). Rumput Laut. Jakarta: Penebar Swadaya. Halaman 13-14, 29-39.
Atashrazm, F., Ray. M.L., Gregory. M.W., dan Adele.F.H. (2015). Fucoidan and Cancer: A Multifunctional Molecule with Anti-Tumor Potencial. Marine
Drugs Journal. 13, 2327-2346.
Ati, K., dan Irma, B.P. (2009). Pengambilan Polisakarida Acemannan dari Aloe
vera Menggunakan Etanol Sebagai Pengendap.Skripsi. Semarang: Fakultas
Teknik Universitas Diponegoro.
Atmaja, W.S., Kadi, A., Sulistijo., dan Satari, R. (1996).Pengenalan Jenis-Jenis
Rumput Laut Indonesia. Jakarta: Puslitbang Osenologi LIPI. Halaman
5657.
Basmal, J., Utomo, B.S.B., dan Tazwir, Murdinah. (2014). Membuat Alginat dari
Rumput Laut Sargassum. Yogyakarta: Penebar Swadaya. Halaman 6-8,
10-11.
Ditjen PEN. (2013). Rumput Laut Indonesia. Jakarta: Departemen Perdagangan Republik Indonesia.
Ditjen POM RI. (1995). Farmakope Indonesia. Jilid IV. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 7.
Ditjen POM RI. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta: Kesehatan Republik Indonesia. Halaman 1, 9-10.
Duarte, M., dan Noseda, M. (2001).Structural Studies on Fucoidans from the Brown Seaweed Sargassum stenophyllum.Cabohydr. Res. Halaman 281-293.
Dzul, D.C., Puc, R.M., dan Robledo, D. (2014).Hepatoprotective Effect of the Fucoidan from Brown Seaweed Turbinaria tricostata.Journal of Apllied
Pycology.14, 0429-9.
Gandjar, I.B., dan Rohman, A. (2012). Analisis Obat secara Spektrofotometri dan
Kromatografi. Yogyakarta: Pustaka Pelajar. Halaman 180, 194.
Hamidi, M.R., Jovanova, B., dan Panovska., T.K. (2014). Toxicological Evaluation of the Plant Products Using Brine Shrimp (Artemia salina L.)Model.Macedonian Pharmaceutical Bulletin. Macedonia. 60 (1) 9-18. Handayani, T., Sutarno, dan Ahmad, D.W. (2004).Analisis Komposisi Nutrisi
Harefa, F. (1997).Pembudidayaan Artemia untuk Pakan Udang dan Ikan. Jakarta: Penebar Swadaya. Halaman 14-15, 16-18, 22-25.
Indiastuti, D.N., Purwaningsih, S., Setiawati, Y., dan Cholies, N. (2008).Skrining Pendahuluan Toksisitas Beberapa Tumbuhan Benalu terhadap Larva Udang Artemia salina Leach.Jurnal Ilmu Kefarmasian Indonesia. Universitas Airlangga. Halaman 81-85.
Indriani, H., dan Sumiarsih, E. (1999). Budidaya, Pengolahan dan Pemasaran
Rumput Laut. Jakarta: Penebar Swadaya. Halaman 4-6, 13.
Junaidi, L., Subagja., Hendarti., Asep, S., dan Jamaes,, S. (2009). Identifikasi dan
Ekstraksi Fukoidan dari Alga Coklat.Bogor : Balai Besar Industri Agro.
Halaman 8-10, 18.27.
Juniarti, O.D., dan Yuhemita. (2009). Kandungan Senyawa Kimia, Uji Toksisitas (Brine Shrimp Lethality Test) dan Antioksidan
(1,1-diphenyl-2-pikrilhydrazyl) dari Ekstrak Daun Saga (Abrus precatorius L.). Jurnal Sains. Jakarta: Universitas YARSI. 13(1): 50-54.
Kim, S. K. (2012). Marine Neutraceuticals: Prospect and Perspective. New York: CRC Press. 400-404.
Krishnakumar, P.K., Dineshbabu, A.P., dan Sasikumar, G. (2007). Toxicity Evaluation of Treated Refinery Effluent Using Brine Shrimp (Artemia
salina) Egg and Larval Bioassay.Fishery Technology.Karnataka. 44(1)
85-92.
Li, Bo., Rui, X.Z., dan Xin, J.W. (2008). Anticoagulant Activity of Fucoidan from
Hizikia fusiforme. Agro Food Ind, Hi-tech. 19, 22-24.
McHugh, D.J. (2003).A Guide to the Seaweed Industry. Rome: Food and Agriculture of the United Nations. Halaman 1.
McLaughlin, J.L., dan Lingling. L.R. (1998).The Use of Biological Assays to Evaluate Botanicals.Drug Information Journal. 32. 513-524.
Merdekawati, W., dan Susanto, A.B. (2009).Kandungan dan Komposisi Pigmen Rumput Laut Serta Potensinya Untuk Kesehatan.Squalen. 4(2): 41-42. Meyer, B.N., Ferrigni, N.R., Putnam, J.E., Jacobsen, L.B., Nichols, D.E., dan
McLaughlin, J.L. (1982). Brine Shrimp, A Convenient General Bioassay for Active Plant Constituents. Journal of Plant Medical
Research.45(5).31-34.
Owen, T. (2000).Fundamentals of Modern UV-Visible Spectroscopy.Germany: Agilent Technologies. Halaman 13.
Pavia, D.L. (2001). Introduction To Spectroscopy. Bellingham: Brooks/Cole Thomson Learning. Halaman 28.
Rahmawati, N., Rahmah, M., dan Suminiati.(2014). Aktivitas Sitotoksik dari Ekstrak dan Fraksi Daun Gambir Liar (Uncaria sp).Sekolah Tinggi Ilmu
Farmasi Riau. 2085-0050.
Rizqillah, N. (2013). Uji Toksisitas Akut Ekstrak n-Heksan Daun Garcinia
benthani Pierre Terhadap Larva Artemia salina Leach dengan Metode Brine Shrimp Lethality Test (BSLT).Skripsi. Jakarta: Fakultas Kedokteran
dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah.
Rohman, A. (2007). KimiaFarmasi Analisis.Yogyakarta: Pustaka Pelajar. Halaman 220-262.
Rohman, A., dan Gandjar, I.G. (2012).Analisis Obat. Yogyakarta: Pustaka Pelajar. Halaman 194.
Sahgal G., Ramanathan, S., Sasidharan S., Mordi M.N., Ismail S., dan Mansor S.M. (2010).Brine Shrimp Lethality and Acute Oral Toxicity Studies on
Swietenia mahagoni (Linn.)Jacq. Seed Methanolic Extract. An International Quarterly Published Online Research Journal. 2(4): 3.
Sastrohamidjojo, H. (1985). Spektroskopi. Yogyakarta: Liberty Yogyakarta. Halaman 47.
Septiana, A.T., dan Ari, A. (2012). Kajian Sifat Fisikokimia Ekstrak Rumput Laut Coklat Sargassum duplicatum Menggunakan Berbagai Pelarut dan Metode Ekstraksi.Agrointek. 6(1): 22-23.
Shanti, N., Eluvakkal, T., dan Arunkumar, K. (2014). Caracterization of Galactose Rich Fucoidan with Anticoagulation Potential Isolated from Turbinaria
decurrens Bory de Saint-Vincent Occuring Along the Coast of Gulf of
Mannar (Pamban), India. Journal of Pharmacognosy and Phytochemistry. 3(2): 132-137.
Sinurat, E. (2011). Isolasi dan Karakterisasi Serta Uji Aktivitas Fukoidan sebagai Koagulasi dari Rumput Laut Coklat (Sargassum crassifolium).Tesis. Depok: Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Indonesia.
Synytsya, A., Kim, W.J., dan Kim, S.M. (2010).Structure and Antitumour Activity of Fucoidan Isolated Sporophyll of Korean Brown Seaweed
Tiwari , B. K., dan Troy, D. (2015). Seaweed Sustainability: Food and Non-Food
Applications. New York: Academic Press. 210-220.
Windy, W. (2016).Isolasi Natrium Alginat dari Talus Rumput Laut Coklat
Sargassum illicifolium (Turner) C. Agard.Skripsi. Medan: Fakultas Farmasi
Universitas Sumatera Utara. Halaman 41.
BAB III
METODE PENELITIAN
Metode penelitian ini dilakukan secara deskriptif meliputi pengambilan dan pengolahan sampel,pembuatan simplisia, isolasi senyawa fukoidan, identifikasi senyawa fukoidan hasil isolasi dengan menggunakan spektrofotometer UV dan FTIR serta pengujian sitotoksik terhadap larva Artemia salina Leach.dengan menggunakan metode Brine Shrimp Lethality Test (BSLT) dan dianalisis dengan model analisis probit.
3.1 Alat dan Bahan 3.1.1 Alat
Alat-alat yang digunakan pada penelitian ini adalah alat-alat gelas laboratorium, desikator, lemari pengering, lemari pendingin (Toshiba), oven listrik (Stork), penangas air, kain flannel,termometer, blender (Panasonic MX-101SG1), spatula, kaca arloji, botol timbang dangkal bertutup, neraca kasar (Salter\And EW3000B), neraca analitis (Vibra AJ), sentrifugasi (Hitachi CF16RXII), spektrofotometer UV dan FTIR (Shimadzu), pipet tetes, aluminium foil, vial, bejana penetasan telur Artemia salina Leach, lampu 14 watt (Hannochs). 3.1.2 Bahan
Bahan yang digunakan adalah talus rumput laut coklat Sargassum
ilicifolium (Turner) C.Agard, telur Artemia salina Leach, garam laut.Bahan kimia
3.2 Pengumpulan dan Pengolahan Bahan Tumbuhan 3.2.1 Pengumpulan bahan tumbuhan
Pengumpulan bahan tumbuhan dilakukan secara purposif, yaitu tanpa membandingkan dengan daerah lain. Umur tumbuhan yang diambil tidak diperhitungkan.Tumbuhan yang digunakan adalah talus rumput laut coklat
Sargassum ilicifolium (Turner) C.Agard yang diperoleh dari pantai Poncan,
Kotamadya Sibolga, Provinsi Sumatera Utara. 3.2.2 Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan di Lembaga Ilmu Pengetahuan Pusat Penelitian Oseanografi, Jakarta, Indonesia oleh Windy (2016).Hasil identifikasi tumbuhan dapat dilihat pada Lampiran 1, halaman41.
3.2.3 Pengolahan bahan tumbuhan
3.3 Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan April hingga November di Laboratorium Farmakognosi dan Laboratorium Penelitian Fakultas Farmasi Universitas Sumatera Utara, Medan.
3.4 Pemeriksaan Makroskopik
Pemeriksaan makroskopik dilakukan dengan pemeriksaan bentuk, ukuran, warna, bau dan rasapada rumput laut coklat Sargassum ilicifolium (Turner) C.Agard.
3.5 Pembuatan Pereaksi
Proses pembuatan pereaksi meliputi pereaksi asam klorida 1 N dan perekasi asam klorida 0,1 N.
3.5.1 Pereaksi asam klorida 1 N
Sebanyak 85 ml asam klorida pekat cukupkan dengan air hingga 1000 ml (Ditjen POM RI., 1995).
3.5.2 Pereaksi asam klorida 0,1 N
Diencerkan 8,5 ml asam klorida pro analis dicampurkan dengan akuades dan dicukupkan hingga 1000 ml (Ditjen POM RI., 1995).
3.6 Isolasi Senyawa Fukoidan
suhu 100 oC selama 4 jam sambil dilakukan pengadukan setiap 10 menit. Disaring dengan menggunakan kain flanel lalu diperas, diperoleh filtrat.Filtrat yang diperoleh disentrifugasi dengan kecepatan 3000 rpm selama 10 menit. Endapan dipisahkan dari filtrat dengan cara enap tuang. Selanjutnya filtrat ditambah etanol 96% dengan perbandingan (1:1) hingga terbentuk endapan, dan disentrifugasi kembali dengan kecepatan 3000 rpm selama 10 menit. Endapan dikumpulkan di atas kaca arloji dan dikeringkan di dalam oven pada suhu 50oC (Junaidi, et al., 2009).Bagan kerja prosedur isolasi senyawa fukoidan dapat dilihat pada Lampiran 3, halaman 43.
3.7 Penetapan Susut Pengeringan
Sebanyak 1 g serbuk isolatfukoidan ditimbang dan dimasukkan ke dalam botol timbang dangkal bertutup yang telah dipanaskan pada suhu 105oC selama 30 menit dan telah ditara.Serbuk diratakan dalam botol timbang dengan menggoyangkan botol hingga merupakan lapisan setebal 5-10 mm. Kemudian dimasukkan ke dalam oven, tutupnya dibuka dan dikeringkan pada suhu 105oC hingga bobot tetap.Sebelum setiap pengeringan, dibiarkan botol dalam keadaantertutup dingin dalam desikator hingga suhu kamar. Susut pengeringan dihitungterhadap bahan awal (Ditjen POM RI, 1995).
3.8 Identifikasi Senyawa Fukoidan
3.8.1 Analisis secara spektrofotometri UV
Senyawa fukoidan hasil isolasi diidentifikasi secara spektrofotometri UV. Prosedur kerja dilakukan dengan menimbang 20 mg senyawa isolat fukoidan, dilarutkan dengan asam klorida 0,1 N dimasukkan kedalam labu tentukur 25 ml, lalu dicukupkan hingga garis tanda. Diukur serapannya pada bilangan gelombang 200-400 nm. Kemudian dibandingkan dengan senyawa baku fukoidan.
3.8.2 Analisis secara spektrofotometri FTIR
Isolat fukoidan diidentifikasi secara spektrofotometri FTIR. Prosedur kerja dilakukan dengan cara mencampurkan 1 mg serbuk isolat fukoidan dengan 10 mg KBr digerus di dalam mortar, ditekan hingga diperoleh pelet kemudian dimasukkan ke dalam alat spektrofotometer FTIR,diukur serapannya pada bilangan gelombang 4000-400 cm-1.Kemudian dibandingkan dengan senyawa baku fukoidan.
3.9 Pengujian Sitotoksik
Pengujian dilakukan terhadap fukoidan hasil isolasi dari talus rumput laut coklat Sargassum ilicifolium (Turner) C.Agard menggunakan larva Artemia salina Leach dengan metode Brine Shrimp Lethality Test.
3.9.1 Pembuatan air laut buatan
3.9.2 Penetasan telur Artemia salina Leach
Disiapkan bejana penetasan yang mempunyai dua bagian bersekat.Sekat dalam wadah tersebut di lubangi agar larva dapat berpindah dari tempat yang gelap ke tempat yang terang.Masukkan air laut buatan kedalam bejana.Telur
Artemia salinaLeach ditaburkan secara berhati-hati (Indiastuti, et al., 2008).
Bagian wadah yang berisi telur tersebut ditutup dengan aluminium foilsedangkan bagian wadah yang tidak ditempati telur diterangi dengan sinar lampu 14 watt untuk menghangatkan suhu dalam penetasan. Setelah 48 jam, diambil larva udang yang akan diuji dengan pipet tetes (Juniarti dan Yuhemita, 2009).
3.9.3 Pengujian brine shrimp lethality test
Disiapkan larutan uji yang terdiri dari isolat senyawa fukoidan dengan konsentrasi: 1000, 100, dan 10 µg/ml, disiapkan 3 vial untuk masing-masing konsentrasi larutan uji sehingga semuanya menjadi 9 vial dan 1 vial untuk kontrol. Larutan induk I dibuat dengan menimbang 50 mg isolat lalu dilarutkan dengan air suling sampai 5 ml sehingga diperoleh konsentrasi 10.000 µg/ml. Dipipet 0,5 ml larutan induk I lalu diencerkan sampai 5 ml sehingga diperoleh larutan induk II dengan konsentrasi 1000 µg/ml. Dipipet 0,5 ml larutan induk IIlalu diencerkan sampai 5 ml sehingga diperoleh konsentrasi 100 µg/ml. Dipipet 0,5 ml dari larutan konsentrasi 100 µg/ml lalu diencerkan sampai 5 ml sehigga diperoleh konsentrasi 10 µg/ml. Dimasukkan larutan uji ke masing-masing vial. Dimasukkan sedikit air laut buatan ke dalam masing-masing vial.Dimasukkan 10 ekor larva Artemia
salina Leach, lalu ditambahkan air laut buatan sampai 5 ml. Kemudian semua vial
y = a + bx
100% x uji larva jumlah
mati larva Jumlah kematian
% =
juga telah dilakukan. Dimasukkan 10 ekor larva Artemia salina Leach ke dalam vial dan dicukupkan sampai 5 ml air laut buatan tanpa penambahan isolat. Data dianalisis dengan metode analisis probit untuk menentukan LC50.Bagan uji sitotoksik dapat dilihat pada Lampiran 4, halaman 44.
3.10 PerhitunganLC
Uji sitotoksik dilakukan dengan metode Brine Shrimp Lethality Test menggunakan larva Artemia salina Leach terhadap larutan isolat fukoidan sehingga diperoleh suatu data yang kemudian diolah dengan menggunakan model analisis probit untuk menentukan nilai LC
50
Pengukuran dilakukan dengan menghitung jumlah Artemia salina Leach yang mati sebanyak 50 % dari total larva uji (10 ekor pada vial). Kemudian nilai LC
50.
50
a. Rumus persen kematian
dihitung dengan memasukkan angka probit (50 % kematian larva uji).Efek sitotoksik dihitung dari persen kematian larva Artemia salina Leach dan persamaan regresi linear (Rahma, et al., 2013).
b. Persamaan regresi linier.
Keterangan: y = Nilai probit x = log konsentrasi
a = Intercept (garis potong)
x100% 10
K -T kematian
% =
LC50 adalah nilai antilog x yang saat y = 50%. Apabila pada kontrol ada larva yang mati, maka persen kematian ditentukan dengan rumus Abbot:
Keterangan :
T = jumlah larva uji yang mati K = jumlah larva kontrol yang mati 10 = jumlah larva uji
Perhitungan LC50 fukoidan hasil isolasi dari talus rumputSargassum
ilicifolium (Turner) C. Agard dapat dilihat pada lampiran 11, halaman 56.
3.11Analisis Data Sitotoksik
Ada banyak cara untuk menentukan nilai LC50. Salah satu cara yaitu dengan metode probit. Untuk menghitung LC50 berdasarkan metode probit, berikut merupakan langkah pembuatan perhitungan LC50
1. Mempunyai tabel probit
, yaitu :
2. Menentukan nilai probit dari % kematian tiap kelompok hewan uji 3. Menentukan log dosis tiap-tiap kelompok
4. Menentukan persamaan garis lurus hubungan antara nilai probit dengan log dosis, y = a+bx
5. Masukkan nilai 5 (probit 50% kematian hewan coba) pada persamaan garis lurus, pada nilai y. Nilai LC50
Ekstrak dikatakan bersifat toksis jika harga LC
BAB IV
HASIL DAN PEMBAHASAN
4.1Hasil Identifikasi Tumbuhan
Hasil identifikasi tumbuhan dilakukan di Pusat Penelitian Oseanografi Lembaga Ilmu Pengetahuan Indonesia (LIPI), Jakarta, Indonesia adalah rumput laut coklat Sargassum ilicifolium (Turner) C.Agard, suku Sargassaceae. Hasil identifikasi tumbuhan dapat dilihat pada Lampiran 1, halaman 41.
4.2 Hasil Pemeriksaan Makroskopik
Pemeriksaan karakterisasi rumput laut Sargassum ilicifolium (Turner) C. Agard secara makroskopik dilakukan untuk memperoleh identitas simplisia.Hasil pemeriksaan makroskopik rumput laut coklatyaitu rumput laut coklat memiliki warna coklat, mempunyai bau khas, daun berbentuk lonjong kecil dengan tepibergerigi, dan batang kecil berwarna coklat.Hasil pemeriksaan makroskopik yang dilakukan terhadap simplisia rumput laut coklat yaitu simplisia berwarna coklat tua.Hasil pemeriksaan makroskopik rumput laut coklat dapat dilihat padaLampiran 5, halaman 45.
4.3Hasil Isolasi Senyawa Fukoidan
Isolasi senyawa fukoidan dari 550 g simplisia rumput laut coklat
Sargassum ilicifolium (Turner) C.Agardmemperoleh isolat sebanyak 19,86 g
4.4. Hasil Penetapan Susut Pengeringan
Penetapan susut pengeringan dilakukan untuk menunjukkan jumlah air yang terkandung dalam senyawa fukoidan.Penetapan susut pengeringan dilakukan untuk memberikan batasan kandungan air yang masih dapat ditolerir untuk menjaga stabilitasnya. Hasil rata-rata penetapan susut pengeringan senyawa fukoidan adalah 19,32%. Perhitungan susut pengeringan isolat senyawa fukoidan dari rumput laut coklat dapat dilihat pada Lampiran 8, halaman 51.
4.5Hasil Identifikasi Senyawa Fukoidan 4.5.1 Identifikasi secara spektrofotometri UV
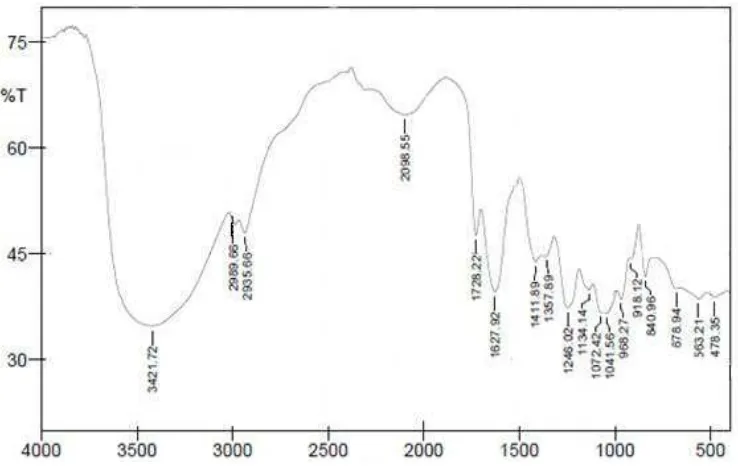
[image:31.595.168.464.550.745.2]Identifikasi senyawa isolat fukoidan dan bakufukoidan dilakukan secara Spektrofotometri UV. Spektrum ultraviolet fukoidan hasil isolasi dari rumput laut coklat Sargassum ilicifolium (Turner) C.Agard memberikan panjang gelombang maksimum 203,81 nm. Kurva serapan dan panjang gelombang maksimum senyawa fukoidan hasil isolasi identik dengan senyawa baku fukoidan. Spektrum ultraviolet dari senyawa isolat dan baku fukoidan dapat dilihat pada Gambar 4.1 dan Gambar 4.2
Gambar 4.2 Spektrum ultraviolet bakufukoidan
4.5.2 Identifikasi secara spektrofotometri FTIR
Spektrum inframerah senyawa isolat fukoidan dari rumput laut coklat
[image:32.595.121.501.470.735.2]Sargassum ilicifolium (Turner) C.Agard dan bakufukoidan dapat dilihat pada
Gambar 4.3 dan Gambar 4.4
Gambar 4.4. Spektrum inframerah baku fukoidan
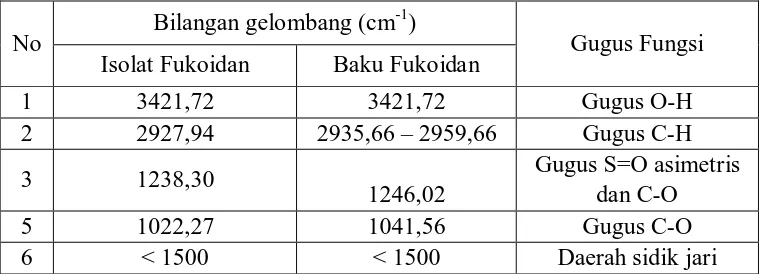
2014). Bilangan gelombang 1072,42 cm-1 pada baku fukoidan menunjukkan vibrasi regang gugus S=O simetris. Pada fukoidan isolat, bilangan gelombang 1022,27 cm-1 menunjukkan adanya gugus C-O, sedangkan pada baku fukoidan terletak pada bilangan gelombang 1041,56 cm-1. Bilangan gelombang dibawah 1500 cm-1
Berdasarkan puncak serapan yang diperoleh dibandingkan dengan baku pembanding menunjukkan bahwa bahan yang diisolasi dari talus rumput laut coklat Sargassum ilicifolium (Turner) C.Agard adalah senyawa fukoidan. Pergeseran spektrum disebabkan karena fukoidan isolat dan baku diperoleh dari spesies rumput laut coklat yang berbeda Puncak serapan senyawa isolat fukoidan dan baku fukoidan dapat dilihat pada Tabel 4.1.
[image:34.595.122.503.506.643.2]merupakan daerah sidik jari (finger print). Kegunaan terpenting dari daerah sidik jari (finger print) setiap senyawa memberikan pola yang berbeda pada daerah ini (Yadav, 2005).
Tabel 4.1 Hasil spektrofotometri FTIR senyawa isolat dan baku fukoidan
Sargassum ilicifolium (Turner) C. Agard
No Bilangan gelombang (cm -1
Gugus Fungsi )
Isolat Fukoidan Baku Fukoidan
1 3421,72 3421,72 Gugus O-H
2 2927,94 2935,66 – 2959,66 Gugus C-H
3 1238,30
1246,02
Gugus S=O asimetris dan C-O
5 1022,27 1041,56 Gugus C-O
6 < 1500 < 1500 Daerah sidik jari
3.6 Hasil Uji Sitotoksik
Hasil uji sitotoksik dapat diketahui dari jumlah kematian larva Artemia
rumput laut coklat Sargassum ilicifolium (Turner) C.Agard pada konsentrasi 10, 100, dan 1000 µg/ml. Selain itu, dibuat kontrol negatif berupa air laut dan larva tanpa penambahan isolat. Hal ini dilakukan untuk mengetahui pengaruh air laut maupun faktor lain terhadap kematian larva. Sehingga dapat dipastikan bahwa kematian larva hanya karena penambahan isolat. Percobaan ini dilakukan dengan 3 kali pengulangan dengan tujuan agar mendapat data yang lebih baik dan lebih akurat.
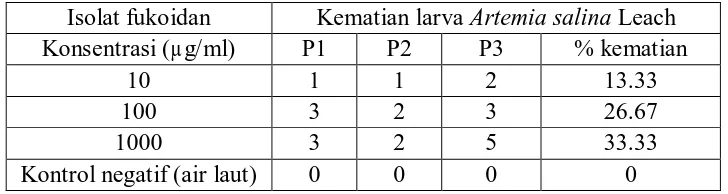
[image:35.595.130.494.418.515.2]Berikut adalah data persen kematian larva Artemia salina Leach dengan pemberian isolat fukoidan rumput laut coklat Sargassum ilicifolium (Turner) C.Agard.
Tabel 4.2 Persen kematian larva Artemia salina Leach dengan pemberian isolat fukoidan
Isolat fukoidan Kematian larva Artemia salina Leach Konsentrasi (µg/ml) P1 P2 P3 % kematian
10 1 1 2 13.33
100 3 2 3 26.67
1000 3 2 5 33.33
Kontrol negatif (air laut) 0 0 0 0
Hasil Artemia salina Leach yang mati karena penambahan isolat fukoidan yang telah dilakukan dengan 3 kali pengulangan. Konsentrasi 10 µg/ml menunjukkan persen kematian larva Artemia salina Leach 13,33%, pada konsentrasi 100 µg/ml persen kematian larva 26,67%, pada konsentrasi 1000 µg/ml persen kematian larva 33,33% dan kontrol negatif persen kematian larva adalah 0%.
larva yang digunakan tiap konsentrasi. Persentase kematian didapat dengan mengalikan rata-rata kematian dengan 100.
Tabel 4.2 menunjukkan bahwa adanya hubungan antara konsentrasi penambahan isolat fukoidan dengan total kematian larva. Semakin tinggi konsentrasi yang diberikan akan meningkatkan kematian larva. Artemia salina Leach yang digunakan pada percobaan yaitu larva yang berusia 48 jam atau berada pada fase instar II-III karena pada usia ini Artemia salina paling sensitif terhadap bahan uji (Hamidi, et al., 2014).
Kematian larva diamati setelah 24 jam pemberian isolat. Berdasarkan kriteria standar larva dikatakan mati apabila larva tidak bergerak selama 10 detik observasi (Krishnakumar, et al., 2007).
Harga LC50 yang diperoleh dari uji sitotoksik senyawa fukoidan hasil isolasi rumput laut coklat Sargassum ilicifolium (Turner) C.Agard adalah 13658,4 µg/ml. Ekstrak dikatakan bersifat toksik atau memiliki aktivitas biologi terhadap
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian yang dilakukan dapat diperoleh kesimpulan sebagai berikut:
a. Senyawa fukoidan dari isolasirumput laut coklat Sargassum ilicifolium (Turner) C.Agard mempunyai persen rendemen 3,61%.
b. Senyawa fukoidan hasil isolasi dari rumput laut coklat Sargassum ilicifolium (Turner) C.Agard pada konsentrasi 10 µg/ml, 100 µg/ml, dan 1000 µg/ml memiliki LC50 sebesar 13658,4 µg/ml, sehingga tidak memiliki sifat sitotoksik terhadap Artemia salina Leach dengan metode Brine Shrimp
Lethality Test.
5.2 Saran
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
2.1.1 Habitat tumbuhan rumput laut
Pertumbuhan dan penyebaran rumput laut seperti halnya biota perairan lainnya sangat dipengaruhi oleh toleransi fisiologi dari biota tersebut untuk beradaptasi terhadap faktor-faktor lingkungan, seperti substrat, salinitas, temperatur, intensitas cahaya, tekanan dan nutrisi. Secara umum rumput laut dijumpai tumbuh di perairan yang dangkal dengan kondisi dasar perairan berpasir, sedikit berlumpur, atau campuran keduanya. Rumput laut memiliki sifat benthic (melekat) dan disebut juga benthic algae, dengan cara melekatkan talus pada substrat pasir, lumpur, karang, kulit kerang, batu atau kayu (Anggadiredja, et al., 2011). Tempat tumbuh rumput laut berfungsi untuk tempat menempel agar tahan terhadap terpaan ombak. Kebanyakan tempat menempel rumput laut berupa karang atau cangkang moluska walaupun dapat juga berupa pasir atau lumpur (Indriani dan Suminarsih, 1999).
berkisar 6.500-7500 lux. Sargassum banyak dijumpai di beberapa perairan pantai termasuk pantai selatan Pulau Jawa, Selat Sunda, sebagian pulau di perairan Batam dan Bangka Belitung (Basmal, et al., 2014).
2.1.2 Morfologi tumbuhan
Rumput laut merupakan makro alga yang termasuk dalam divisi Thallophyta, yaitu tumbuhan yang mempunyai struktur kerangka dari talus, tidak memiliki batang, daun, serta akar sejati (Ditjen PEN, 2013). Talus berbentuk silindris, “akar” (holdfast) membentuk cakram kecil yang berfungsi untuk menempel pada karang, cangkang moluska, pasir atau lumpur. “Batang” (stipe) dengan percabangan utama tumbuh rimbun dibagian ujungnya.“Daun” (blade) kecil, lonjong, ujungnya runcing, tepi daun bergerigi, gelembung udara (pneumatocysts) berbentuk bulat telur berisi gas berfungsi untuk mengangkat
blades terapung kearah permukaan air untuk mendapatkan cahaya matahari.
(Atmaja, 1996; Basmal, et al., 2014). 2.1.3 Sistematika tumbuhan
Menurut Pusat Penelitian Oseanografi LIPI, rumput laut coklat Sargassum
ilicifolium (Turner) C. Agard diklasifikasikan sebagai berikut:
Kingdom : Plantae Divisi : Ochrophyta Kelas : Phaeophyceae Bangsa : Fucales Suku : Sargassaceae Marga : Sargassum
2.1.4 Nama lain tumbuhan
Nama lain dari tumbuhan ini adalah Oseng (Kepulauan seribu). 2.1.5 Kandungan rumput laut coklat
Rumput laut coklat mengandung pigmen klorofil a dan c, beta karoten, violasantin dan fukosantin. Sebagai sumber gizi, rumput laut memiliki kandungan karbohidrat (selulosa, alginat, laminaran, fukoidan), protein, vitamin (A, B1, B2, B6, B12, dan C), mineral makro (kalium, kalsium, fosfor, natrium dan magnesium), serta mineral mikro (besi, iodium) (Anggadiredja, et al., 2011; Indriani dan Suminarsih, 1999).
2.2 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia suatu bahan yang dapat larut sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair (Ditjen POM RI, 2000).
Ekstrak adalah sediaan yang diperoleh dengan mengekstraksi zat aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan masa atau serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang telah ditetapkan (Ditjen POM RI, 2000).
Menurut Ditjen POM RI (2000), beberapa metode ekstraksi yang sering digunakan dalam penelitian antara lain yaitu:
A. Cara dingin 1. Maserasi
Maserasi yang dilakukan pengadukan secara terus menerus disebut maserasi kinetik sedangkan yang dilakukan pengulangan penambahan pelarut setelah dilakukan penyaringan terhadap maserat pertama dan seterusnya disebut remaserasi. Maserasi digunakan untuk penyarian simplisia yang mengandung zat aktif yang mudah larut dalam cairan penyari dan tidak mengandung zat yang mudah mengembang dalam cairan penyari.
2. Perkolasi
Perkolasi adalah proses penyarian simplisia dengan pelarut yang selalu baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada temperatur kamar. Proses perkolasi terdiri dari tahap yaitu pengembangan bahan, tahap perendaman antara, tahap perkolasi sebenarnya (penampungan ekstrak) terus-menerus sampai diperoleh ekstrak (perkolat) yang jumlahnya 1-5 kali bahan. B. Cara panas
1. Refluks
Refluks adalah proses penyarian simplisia dengan menggunakan alat pada temperatur titik didihnya selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik. Umumnya dilakukan pengulangan proses pada residu pertama sampai 3-5 kali sehingga bahan dapat terekstraksi sempurna.
2. Digesti
3. Sokletasi
Sokletasi adalah proses penyarian menggunakan pelarut yang selalu baru, dilakukan dengan menggunakan alat khusus (soklet) dimana pelarut akan terkondensasi dari labu menuju pendingin, kemudian jatuh membasahi sampel. 4. Infundasi
Infundasi adalah proses penyarian dengan menggunakan pelarut air pada temperatur 90ºC selama 15 menit. Infundasi adalah proses penyarian yang umumnya digunakan untuk menyari kandungan zat aktif yang larut dalam air dari bahan-bahan nabati. Penyarian dengan cara ini menghasilkan sari yang tidak stabil dan mudah tercemar oleh kuman dan kapang. Oleh karena itu sari yang diperoleh dengan cara ini tidak boleh disimpan lebih dari 24 jam.
5. Dekoktasi
Dekoktasi adalah proses penyarian dengan menggunakan pelarut air pada temperatur 90ºC selama 30 menit.
2.3 Senyawa Fukoidan
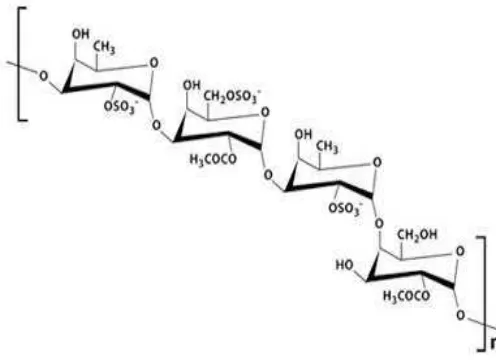
Fukoidan yang diisolasi dari berbagai spesies dipelajari secara mendalam karena aktivitas biologisnya yang bervariasi, termasuk antikoagulan dan antitrombosis, antivirus, antitumor, imunomodulator, antiinflamasi, antioksidan, antiulser (Li Bo, et al., 2008; Atashrazm, et al., 2015). Struktur fukoidan dapat dilihat pada Gambar 2.1.
Gambar 2.1 Struktur senyawa fukoidan 2.3.1 Ekstraksi senyawa fukoidan
Teknik ekstraksi fukoidan telah banyak dipelajari. Metode ekstraksi tidak hanya berpengaruh terhadap rendemen fukoidan tetapi juga berpengaruh terhadap komposisi dan bioaktivitasnya. Beberapa metode ekstraksi senyawa fukoidan antara lain:
1. Ekstraksi umum
atau larutan asam selama beberapa jam. Proton atau ion hidroksida pada pelarut akan mengganggu ikatan hidrogen pada polisakarida sehingga polisakarida tersebut larut dalam pelarut. Salah satu keuntungan ekstraksi senyawa fukoidan dengan menggunakan asam adalah asam alginat akan mengendap sehingga terpisah dari senyawa fukoidan. Tahap ekstraksi dapat dilakukan berulang untuk mendapatkan rendemen fukoidan yang tinggi. Selanjutnya, ekstrak diendapkan dengan menggunakan senyawa organik. Tahap ini akan memisahkan garam dan molekul yang berukuran kecil dengan senyawa fukoidan (Tiwari dan Troy, 2015). 2. Ekstraksi dengan microwave
Ekstraksi senyawa fukoidan yang umum membutuhkan waktu yang lama. Untuk mempersingkat waktu ekstraksi, diperkenalkan metode yang baru yaitu ekstraksi dengan bantuan microwave. Energi microwave dapat mencapai struktur molekul dari rumput laut, sehingga dapat mempercepat pengeluaran senyawa fukoidan dari dalam sel. Ekstraksi menggunakan metode ini memiliki beberapa keuntungan yaitu menghasilkan senyawa yang lebih selektif, waktu ekstraksi yang singkat, tidak menggunakan pelarut yang korosif sehingga lebih ekonomis dan ramah lingkungan. Kondisi terbaik untuk ekstraksi senyawa fukoidan menggunakan microwave adalah tekanan 120 psi selama 1 menit menggunakan 1 g alga dalam 25 mL akuades. Metode ekstraksi ini menghasilkan rendemen fukoidan yang tinggi, tetapi belum dilakukan penelitian mengenai bioaktivitasnya (Tiwari dan Troy, 2015).
ekstraksi menggunakan air panas selama 5 jam. Total waktu yang dibutuhkan pada metode ini kurang lebih 9 jam. Senyawa fukoidan yang diekstraksi dengan metode ini mempunyai bioaktivitas yang sama dengan metode umum (Tiwari dan Troy, 2015).
3. Ekstraksi dengan enzim
Enzim yang digunakan untuk ekstraksi senyawa fukoidan adalah 4-α -D-glukosidase, karbohidrase, alginat liase, dan papain. Enzim akan memecah ikatan 1,4 dan 1,6-α pada polisakarida dinding sel tumbuhan dan dapat mengubah polimer tidak larut air menjadi materi yang larut dalam air sehingga polisakarida sulfat akan berpindah ke media ekstraksi (Tiwari dan Troy, 2015). Ekstraksi menggunakan enzim menghasilkan senyawa fukoidan dengan bioaktivitas yang lebih tinggi jika dibandingkan dengan senyawa fukoidan yang diekstraksi dengan menggunakan metode umum. Metode ekstraksi ini dilakukan pada kondisi yang lemah dan tanpa menggunakan senyawa kimia beracun sehingga dapat langsung digunakan untuk produk makanan atau industri farmasi (Kim, 2012).
4. Ekstraksi autohidrolisis
Autohidrolisis adalah teknik ekstraksi baru yang tidak menggunakan asam atau pelarut sehingga ramah lingkungan. Selama autohidrolisis, materi terhidrolisis karena adanya ion hidronium pada temperatur yang tinggi. Kondisi ekstraksi pada 180ºC selama 20 menit menghasilkan rendemen fukoidan yang tinggi ( ˃ 16%) (Tiwari dan Troy, 2015).
2.3.2 Pemurnian senyawa fukoidan
Ekstraksi menggunakan enzim menghasilkan senyawa fukoidan dengan berat molekul yang tinggi. Ekstraksi menggunakan asam menghasilkan fukoidan dengan berat molekul yang rendah karena asam dapat menginduksi depolimerisasi. Fraksi ini dapat dipisahkan berdasarkan muatan atau ukuran. Metode pemurnian yang umum adalah kromatografi penukar ion dan kromatografi permeasi gel (Tiwari dan Troy, 2015).
1. Kromatografi penukar ion
Senyawa fukoidan mempunyai muatan negatif karena gugus ester sulfat pada struktur polisakarida sehingga kromatografi penukar ion adalah alat yang sering digunakan untuk isolasi dan fraksinasi senyawa fukoidan. Senyawa fukoidan bermuatan negatif akan dipisahkan berdasarkan interaksinya denga fase diam yang bermuatan positif. Resin yang umum digunakan untuk fraksinasi senyawa fukoidan adalah DEAE-Selulosa dan Q-Sephadex. Fukoidan dielusi dengan NaCl dengan konsentrasi bertingkat. Metode ini dapat digunakan untuk menghasilkan fraksi fukoidan yang mempunyai struktur dan sifat kimia yang berbeda (Tiwari dan Troy, 2015).
2. Kromatografi permeasi gel
untuk pemurnian fukoidan adalah Sephadex G-100. Kromatografi penukar ion dan permeasi gel mempunyai pengaruh yang kecil terhadap gugus ester sulfat pada polisakarida sehingga tidak berpengaruh terhadap bioaktivitasnya (Tiwari dan Troy, 2015).
2.4 Artemia salina Leach
Artemia atau brine shrimp adalah jenis udang-udangan primitif. Oleh
Linnaeus pada tahun 1778, Artemia diberi nama Cancer salinus. Kemudian pada tahun 1819 diubah menjadi Artemia salina oleh Leach (Mudjiman, 1999).
Artemia salina hidup secara planktonik di perairan laut dengan salinitas
berkisar antara 15-300 per mil dan suhu antara 25º-30ºC serta nilai pH antara 7,3-8,4. Keistimewaan Artemia salina sebagai plankton adalah memiliki toleransi (kemampuan beradaptasi dan mempertahankan diri) pada kisaran kadar garam yang sangat luas. Pada kadar garam yang sangat tinggi dimana tidak ada satu pun organisme lain mampu bertahan hidup (Mudjiman, 1989).
2.4.1 Klasifikasi Artemia salina
Klasifikasi Artemia salina Leach menurut Harefa (1997), adalah sebagai berikut:
Kingdom : Animalia Filum : Arthropoda Kelas : Branchiopoda Bangsa : Anostraca Suku : Artemiidae Marga : Artemia
2.4.2 Morfologi
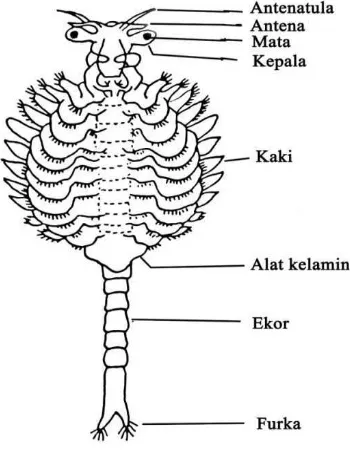
Bentuk Artemia dewasa menyerupai udang kecil. Ukurannya hanya 10-20 mm. Bagian kepala berukuran lebih besar dan kemudian mengecil hingga ke bagian ekor. Panjang ekor kurang lebih sepertiga dari total panjang tubuh. Di bagian kepala terdapat sepasang mata dan sepasang antenula (sungut). Pada bagian tubuh terdapat sebelas pasang kaki atau secara khusus disebut torakopoda. Jumlah kaki inilah yang membedakan Artemia dengan spesies dari Crustacea lain yang umumnya hanya memiliki sepuluh pasang kaki. Antara ekor dan pasangan kaki paling belakang terdapat sepasang alat kelamin, yaitu penis pada jantan dan ovarium pada betina. Ovarium akan menghasilkan telur dan apabila telah masak, telur tersebut kemudian akan menjadi oosit (Harefa, 1997). Morfologi Artemia
[image:48.595.224.399.417.642.2]salina dapat dilihat pada Gambar 2.2.
Gambar 2.2 Morfologi Artemia salina Leach (Harefa, 1997) 2.4.3 Siklus hidup
berkembang biak secara partenogenesis, demikian pula sebalikya. Perkembangan pada jenis biseksual harus melalui proses perkawinan antara induk betina dengan induk jantan. Sedangkan pada jenis partenogenetik tidak ada perkawinan. Jadi betinanya akan beranak dengan sendirinya tanpa kawin (Harefa, 1997).
Perkembangbiakan dapat terjadi secara ovovivipar maupun ovipar. Pada ovovivipar, yang keluar dari induknya sudah berupa Artemia muda yang dinamakan nauplius. Sedangkan pada cara ovipar, yang keluar dari induknya berupa telur yang bercangkang tebal, yang dinamakan siste. Untuk menjadi nauplius harus melalui proses penetasan lebih dahulu. Ovoviviparitas terjadi apabila keadaan lingkungannya cukup baik, kadar garam kurang dari 150 permil dan kandungan oksigennya cukup. Sedangkan oviparitas terjadi jika keadaan lingkungannya memburuk, kadar garam lebih dari 150 permil dan kandungan oksigennya rendah (Harefa, 1997).
Telur Artemia salina yang kering direndam dalam air laut, akan menetas dalam waktu 24-36 jam, dari dalam cangkang keluar larva yang disebut nauplius. Selanjutnya, nauplius akan mengalami 15 kali perubahan bentuk. Setiap kali mengalami perubahan bentuk merupakan satu tingkatan. Tahapan perkembangan pertama disebut instar I, bentuk lonjong dengan panjang sekitar 0,4 mm dan beratnya 15 mikrogram. Warnanya kemerahan karena masih banyak mengandung cadangan makanan. (Mudjiman, 1989).
jalan menyaring makanannya atau filter feeder. Selama perubahan bentuk terjadi, nauplius akan mengalami perubahan mata majemuk, antena dan kaki. Setelah menjadi instar XV, kakinya sudah lengkap 11 pasang maka nauplius telah berubah menjadi Artemia salina dewasa. Proses ini berlangsung antara 1-3 minggu.
Artemia salina dewasa mempunyai panjang sekitar 1 cm dan beratnya 10 mg.
Artemia salina dewasa dapat hidup sampai 6 bulan dan bertelur 4-5 kali. Setiap
kali bertelur dapat menghasilkan 50-300 butir telur (Mudjiman, 1989).
2.5 Uji Sitotoksisitas
Dasar dari uji sitotoksik adalah kemampuan sel untuk bertahan hidup karena adanya senyawa toksik. Beberapa uji pendahuluan untuk pencarian obat kanker antara lain, Metode Potato Disk, Brine Shrimp Lethality Test, dan Uji terhadap Lemna minor L. (McLaughlin dan Lingling, 1998).
2.5.1 Brine shrimp lethality test
Senyawa bioaktif hampir selalu toksik pada dosis tinggi. Oleh karena itu, kematian hewan percobaan pada pengujian suatu ekstrak dapat digunakan sebagai skrining awal terhadap ekstrak tumbuhan yang mempunyai bioaktivitas dan juga untuk mengetahui komponen zat aktifnya.
2.5.2 Metode potato disk (penghambatan tumor crown gall)
Crown gall adalah penyakit tumor pada tumbuhan yang ditimbulkan oleh
strain spesifik dari bakteri gram negatif, Agrobacterium tumefaciens. Bakteri ini mengandung plasmid yang menginduksi tumor yang membawa DNA pengubah sel tanaman yang normal menjadi sel kanker. Penghambatan tumor crown gall pada potato disk (Solanum tuberosum L.) menunjukkan bahwa bahan tersebut mempunyai aktivitas biologi. Terdapat kesamaan antara mekanisme terjadinya tumor pada tumbuhan dan pada hewan, senyawa yang dapat menghambat pertumbuhan tumor pada tumbuhan juga dapat berfungsi sebagai antitumor pada hewan (McLaughlin dan Lingling, 1998).
2.5.3 Uji terhadap Lemna minor L.
Lemna minor L. adalah tumbuhan monokotil yang hidup di daerah
perairan. Pada kondisi normal, tanaman ini menghasilkan anak daun. Ekstrak tumbuhan dan bahan kimia dapat dikatakan berkhasiat sebagai antitumor jika dapat menghambat pertumbuhan anak daun tumbuhan Lemna minor L. (McLaughlin dan Lingling, 1998).
2.6 Spektofotometri Ultraviolet
Spektrofotometer yang sesuai untuk pengukuran di daerah spektrum ultraviolet dan sinar tampak terdiri atas suatu sitem optik dengan kemampuan menghasilkan sinar monokromatik dalam jangkauan panjang gelombang 200-800nm. Komponen spektrofotometer UV-Visibel terdiri atas sumber-sumber sinar, monokromator dan sistem optik (Rohman, 2007).
Data spektrofotometri UV secara tersendiri tidak dapat digunakan untuk identifikasi kualitatif suatu obat atau metabolitnya, tetapi jika digabung dengan cara lain seperti spektrofotometri inframerah, resonansi magnet inti, dan spektroskopi massa dapat digunakan untuk identifikasi kualitatif senyawa tersebut. Data yangdiperoleh dari spektrofotometri UV adalah panjang gelombang maksimal, intensitas, efek pH dan pelarut, yang kesemuanya itu dapat diperbandingkan dengan data yang sudah dipublikasikan (Published data) (Rohman, 2007).
2.7 Spektrofotometri Inframerah
Spektrofotometri inframerah merupakan teknik analisis yang sangat popular untuk analisis berbagai jenis sampel, baik sampel produk farmasetik, makanan, cairan biologis, maupun sampel lingkungan. Penggunaan spektrofotometri inframerah pada bidang kimia organik menggunakan daerah dari 650 – 4000 cm-1. Daerah dengan frekuensi lebih rendah 650 cm-1 disebut
inframerah jauh, dan daerah dengan frekuensi lebih tinggi dari 4000 cm-1 disebut
inframerah dekat (Sastrohamidjojo, 1985). Daerah yang paling penting untuk
Spektrofotometer FTIR didasarkan pada ide adanya interferensi radiasi antara 2 berkas sinar untuk menghasilkan suatu interferogram. Interferogram merupakan sinyal yang dihasilkan sebagai fungsi perubahan pathlenght antara 2 berkas sinar. Radiasi yang berasal dari sumber sinar dilewatkan melalui interferometer ke sampel sebelum mencapai detektor. Selama penguatan (amplifikasi) sinyal, yang mana kontribusi-kontribusi frekuensi tinggi telah dihilangkan dengan filter, maka data diubah ke bentuk digital dengan suatu
analog-to-digital converter dan dipindahkan ke komputer untuk menjalani
transformasi Fourier (Gandjar dan Rohman, 2012).
BAB I PENDAHULUAN
1.1 Latar Belakang
Indonesia dikenal luas sebagai negara kepulauan yang 2/3 wilayahnya adalah lautan dan mempunyai garis pantai terpanjang di dunia, 80.7991,42 km (Septiana dan Ari, 2012). Hal ini menunjukkan bahwa Indonesia mempunyai potensi yang baik untuk mengembangkan dan memanfaatkan kekayaan lautnya, salah satunya adalah rumput laut. Berdasarkan catatan Van Boose (melalui Ekspedisi Sibolga pada tahun 1899-1900), di Indonesia terdapat kurang lebih 555 jenis dari 8642 spesies rumput laut yang terdapat di dunia (Merdekawati dan Susanto, 2009).
Rumput laut, disebut sebagai makro alga, dapat diklasifikasikan berdasarkan pigmen menjadi tiga grup utama yaitu rumput laut coklat (Phaeophyceae), rumput laut merah (Rhodophyceae), dan rumput laut hijau (Chlorophyceae). Rumput laut coklat Sargassum sp. tumbuh menempati hampir disepanjang pantai pulau-pulau di Indonesia (Septiana dan Ari, 2012). Rumput laut ini mempunyai kelimpahan dan sebaran yang sangat tinggi, terdapat hampir di seluruh wilayah laut Indonesia. Secara umum, rumput laut Sargassum sp. Belum banyak dikenal dan dimanfaatkan (Handayani, et al., 2004). Rumput laut coklat biasanya berukuran besar, tebal dan tingginya bisa mencapai 20 m (McHugh, 2003).
Senyawa fukoidan ditemukan terutama pada spesies rumput laut coklat, namun ditemukan juga pada binatang laut seperti timun laut. Fukoidan pertama kali ditemukan oleh Kylin pada tahun 1913 dari rumput laut coklat yang sekarang dikenal dengan fukan sulfat atau fukosan. Secara umum fukoidan terdiri dari fukosa, galaktosa, dan sejumlah polisakarida lain seperti manosa, xilosa, asam glukoronat. Komponen utama fukoidan adalah fukosa dan sulfat (Sinurat, 2011). Dari hasil penelitian terdahulu, senyawa fukoidan yang diisolasi dari rumput laut coklat marga Sargassum mempunyai rendemen 7%.
Menurut Li Bo, et al., (2008), fukoidan diisolasi dari berbagai spesies mempunyai berbagai aktifitas biologis, seperti antikoagulan, antitrombosis, antitumor, antivirus, immunomodulator, antiinflamasi, antioksidan dan antikanker (Atashrazm, et al., 2015). Aktivitas antikanker senyawa fukoidan telah diteliti secara invivo dan invitro pada beberapa jenis kanker. Senyawa fukoidan mempunyai aktivitas antikanker dengan berbagai mekanisme. Sumber rumput laut coklat yang berbeda menghasilkan senyawa fukoidan dengan aktivitas antikanker yang berbeda pula (Atazhrazm, et al., 2015). Namun, aktivitas antikanker fukoidan yang berasal dari rumput laut coklat Sargassum ilicifolium (Turner) C. Agard belum diteliti secara mendalam.
aktif suatu bahan alam terhadap ekstrak, fraksi maupun isolat (McLaughlin dan Lingling, 1998).
Berdasarkan hal tersebut di atas, maka peneliti melakukan isolasi fukoidan dari rumput laut coklat Sargassum ilicifolium (Turner) C. Agard menggunakan HCl 0,1 N serta uji sitotoksik senyawa fukoidan menggunakan metode Brine
Shrimp Lethality Test.
1.2 Perumusan Masalah
Berdasarkan latar belakang di atas, maka permasalahan dalam penelitian ini dapat dirumuskan sebagai berikut :
a. Berapakah persen rendemen senyawa fukoidan yang diisolasi dari rumput laut coklat Sargassum ilicifolium (Turner) C. Agard ?
b. Apakah senyawa fukoidan hasil isolasi dari rumput laut coklat Sargassum
ilicifolium (Turner) C. Agard memiliki potensi sitotoksik terhadap larva
Artemia salina Leach dengan metode Brine Shrimp Lethality Test ?
1.3 Hipotesis
Berdasarkan masalah yang dirumuskan diatas, maka hipotesis dalam penelitian ini adalah sebagai berikut:
a. Persen rendemen senyawa fukoidan hasil isolasi dari talus rumput laut coklat
Sargassum ilicifolium (Turner) C. Agard sesuai dengan penelitian terdahulu
yang menggunakan marga yang sama yaitu Sargassum.
b. Senyawa fukoidan hasil isolasi dari talus rumput laut coklat Sargassum
ilicifolium(Turner) C. Agard memiliki potensi sitotoksik terhadap larva
1.4 Tujuan Penelitian
Adapun tujuan penelitian ini adalah:
a. Untuk mengetahui persen rendemen senyawa fukoidan hasil isolasi dari talus rumput laut coklat Sargassum ilicifolium (Turner) C. Agard.
b. Untuk mengetahui potensi sitotoksik senyawa fukoidan hasil isolasi dari talus rumput laut coklat Sargassum ilicifolium (Turner) C. Agard terhadap larva
Artemia salina Leach dengan metode Brine Shrimp Lethality Test.
1.5 Manfaat Penelitian
Manfaat dari penelitian ini adalah untuk memberikan informasi dan pengetahuan tentang isolasi senyawa fukoidan, identifikasi, serta potensi sitotoksik senyawa isolat fukoidan dari talus rumput laut coklat Sargassum
ilicifolium (Turner) C. Agard.
1.6 Kerangka Pikir Penelitian
Variabel Bebas Variabel Terikat Parameter isolat senyawa fukoidan
talus rumput laut coklat
Karakteristik senyawa
1. Data Spektrofotometri UV
2. Data Spektrofotometri FTIR
Larutan senyawa
fukoidan konsentrasi
10, 100, 1000 µg/ml Kematian larva Artemia
salina Leach Larva Artemia salina
Leach
ISOLASI SENYAWA FUKOIDAN DARI TALUS RUMPUT LAUT COKLAT (Sargassum ilicifolium (Turner) C.Agard) SERTA UJI SITOTOKSIK DENGAN METODE BRINE SHRIMP LETHALITY TEST
ABSTRAK
Rumput laut coklat Sargassum ilicifolium (Turner) C. Agard tumbuh hampir diseluruh wilayah laut Indonesia, tetapi belum banyak dimanfaatkan. Salah satu komponen utama yang terdapat di dalam rumput laut coklat adalah fukoidan. Beberapa sumber menyatakan bahwa fukoidan memiliki aktivitas biologis seperti antikoagulan, antitrombosis, antitumor, antivirus, immunomodulator, antiinflamasi, antioksidan, dan antikanker. Penelitian ini bertujuan untuk mengisolasi senyawa fukoidan dan memantau senyawa aktif yang bersifat toksik.
Penelitian ini meliputi penyiapan bahan tumbuhan, pemeriksaan karakteristik simplisia, proses isolasi fukoidan menggunakan HCl 0,1 N, identifikasi senyawa fukoidan secara spektrofotometri UV dan FTIR, serta uji sitotoksik terhadap larva Artemia salina Leach yang ditunjukkan oleh nilai LC50
Hasil isolasi diperoleh fukoidan sebesar 19,86 g. Hasil karakteristik senyawa fukoidan diperoleh susut pengeringan 19,32%, identifikasi senyawa fukoidan hasil isolasi secara spektrofotometri UV diperoleh panjang gelombang yang sama dengan baku pembanding yaitu pada 203,81 nm, sedangkan secara sprektrofotometri FTIR menunjukkan adanya gugus O-H, C-H alifatik, gugus S=O dan C-O. Pengujian sitotoksik diperoleh LC
dengan menggunakan metode Brine Shrimp Lethality Test. Pengujian ini menggunakan 3 konsentrasi isolat yaitu 10 µg/ml, 100 µg/ml, dan 1000 µg/ml serta kontrol negatif dengan menggunakan air laut buatan. Tiap konsentrasi berisi 10 ekor larva dengan 3 kali pengulangan. Kematian larva diamati setelah 24 jam pemberian isolat. Data hasil pengujian dianalisis dengan model analisis Probit.
50 sebesar 13658,4 µg/ml, menunjukkan bahwa isolat fukoidan tidak bersifat sitotoksik.
Kata kunci: Brine Shrimp Lethality Test, fukoidan, isolasi, Sargassum
ISOLATION OF FUCOIDAN FROM BROWN SEAWEED THALLUS (Sargassum ilicifolium (Turner) C.Agard) AND CITOTOXICITY TEST
USING BRINE SHRIMP LETHALITY TEST METHOD
ABSTRACT
Brown seaweed Sargassum ilicifolium (Turner) C. Agard grows in most of Indonesia’s coast, unfortunately it is not widely used yet. One of major components in brown seaweed is fucoidan. According to some source, fucoidan has many biological activities such as anticoagulant, antitrombotic, antitumor, antivirus, immunomodulator, antiinflammatory, antioxidants, and anticancer. This study aims to isolate fucoidan compound and to monitor the toxic effect of bioactive compound.
This study included the preparation of plant materials, determination the characteristics of simplex, isolation of fucoidan compound with 0.1 N HCl, identification of fucoidan compound, and cititoxicity test on Artemia salina Leach shown by LC50
The result of fucoidan isolation is 19.85 g, drying shrinkage is 19.32 %, identification isolates of fucoidan with UV spectrophotometric obtained similar wavelength to standart at 203.81 nm. FTIR spectrophotometric showed O-H, CH-aliphatic, group of S=O and C-O. Citotoxicity test obtained LC
using Brine Shrimp Lethality Test method. This test used 3 concentrations of isolate, 10 µg/ml, 100 µg/ml, and 1000 µg/ml, and negative control using sea water. Each concentration contain ten larvas and performed 3 replications. Death of larvas observed 24 hours after giving the isolate. Data were analyzed by Analytic Probit Model.
50 is on 13658.4 µg/ml, showed that isolates of fucoidan compound did not have citotoxic effect.
BAHAN SEMINAR
SKRIPSI
OLEH:
FIORRIETA VEGLYANI MASHITHA
NIM 121501014
PENGESAHAN SKRIPSI
ISOLASI SENYAWA FUKOIDAN DARI TALUS RUMPUT
LAUT COKLAT (Sargassum ilicifolium (Turner) C. Agard)
SERTA UJI SITOTOKSIK DENGAN METODE BRINE
SHRIMP LETHALITY TEST
SKRIPSI
OLEH:
FIORRIETA VEGLYANI MASHITHA
NIM 121501014
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
BAHAN SEMINAR
SKRIPSI
OLEH:
FIORRIETA VEGLYANI MASHITHA
NIM 121501014
PENGESAHAN SKRIPSI
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
2017
ISOLASI SENYAWA FUKOIDAN DARI TALUS RUMPUT
LAUT COKLAT (Sargassum ilicifolium (Turner) C. Agard)
SERTA UJI SITOTOKSIK DENGAN METODE BRINE
SHRIMP LETHALITY TEST
Diajukan sebagai salah satu syarat untuk memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
PENGESAHAN SKRIPSI
ISOLASI SENYAWA FUKOIDAN DARI TALUS RUMPUT LAUT COKLAT (Sargassum ilicifolium (Turner) C. Agard) SERTA UJI SITOTOKSIK DENGAN METODE BRINE SHRIMP LETHALITY
TEST
OLEH:
FIORRIETA VEGLYANI MASHITHA NIM 121501014
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 29 Maret 2017 Disetujui Oleh:
Dosen Pembimbing I Panitia Penguji, . PENGESAHAN SKRIPSI
Dr. Poppy Anjelisa Z. Hsb., M.Si., Apt. NIP 197506102005012003
Drs. Fathur Rahman Harun, M.Si., Apt. NIP 195201041980031002
Dra. Suwarti Aris, M.Si., Apt. NIP 195107231982032001
Drs. Fathur Rahman Harun, M.Si., Apt. NIP 195201041980031002
Dr. Panal Sitorus, M.Si., Apt. NIP 195310301980031002
Medan, April 2017 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
Prof. Dr. Masfria, M.S., Apt. NIP 195707231986012001 Dra. Suwarti Aris, M.Si., Apt.
NIP 195107231982032001
KATA PENGANTAR
Bismillaahirrahmaanirrahiim,
Puji dan syukur penulis ucapkan kepada Allah SWT yang telah memberikan karunia yang berlimpah sehingga penulis dapat menyelesaikan skripsi yang berjudul “Isolasi Senyawa Fukoidan dari Talus Rumput Laut Coklat (Sargassum
ilicifolium (Turner) C. Agard) serta Uji Sitotoksik dengan Metode Brine Shrimp
Lethality Test”. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh
gelar Sarjana Farmasi dari Fakultas Farmasi Universitas Sumatera Utara.
kepada Bapak dan Ibu koordinator laboratorium yang telah memberikan izin dan fasilitas untuk penulis sehingga dapat mengerjakan dan menyelesaikan penelitian. Penulis mengucapkan terima kasih kepada pemerintah yang telah memberikan beasiswa kepada penulis selama masa perkuliahan. Penulis juga ingin menyampaikan rasa terima kasih serta penghargaan yang tulus dan tak terhingga kepada orangtua tercinta H. Ir. Muhammad Ruslan, Ibunda Hj. Hoilisah, S.Kep., Ners., dan kepada adik-adik tercinta Razy Naubach Haritsa Albatriq dan Abbsumarmanali Firyabi Sakhtiani atas doa dan dukungan baik moril maupun materiil kepada penulis. Penulis juga mengucapkan terima kasih kepada teman-teman semua khususnya DEFISA (Della Rispita, Elvi Tri Yunita, Nurhotimah Siregar, Novita Sari), Fadlina Aulia dan Arief Hidayat Zulkifli, serta seluruh teman-teman kelas B 2012, STF 2012, dan ISMAFARSI yang selalu memberikan dorongan dan motivasi selama penulis melakukan penelitian.
Penulis menyadari bahwa masih banyak kekurangan yang terdapat dalam skripsi ini. Untuk itu, penulis mengharapkan kritik dan saran yang membangun dari semua pihak guna perbaikan skripsi ini. Akhir kata penulis berharap semoga skripsi ini dapat bermanfaat bagi ilmu pengetahuan khususnya dalam bidang farmasi.
Medan, April 2017 Penulis,
Fiorrieta Veglyani Mashitha
SURAT PERNYATAAN
Saya yang bertanda tangan di bawah ini,
Nama : Fiorrieta Veglyani Mashitha Nomor Induk Mahasiswa : 121501014
Program Studi : S-1 Reguler Farmasi
Judul Skripsi : Isolasi Senyawa Fukoidan dari Talus Rumput Laut Coklat (Sargassum ilicifolium (Turner) C. Agard) serta Uji Sitotoksik dengan Metode Brine Shrimp
Lethality Test
Dengan ini menyatakan bahwa skripsi ini ditulis berdasarkan data dari hasil pekerjaan yang saya lakukan sendiri dan belum pernah diajukan oleh orang lain untuk memperoleh gelar kesarjanaan di Perguruan Tinggi dan bukan plagiat karena kutipan yang ditulis telah disebutkan sumbernya di dalam daftar pustaka. Apabila dikemudian hari ada pengaduan dari pihak lain karena di dalam skripsi ini ditemukan plagiat karena kesalahan saya sendiri, maka saya bersedia menerima sanksi apapun oleh Program Studi Farmasi Fakultas Farmasi Universitas Utara dan bukan menjadi tanggung jawab pembimbing.
Demikianlah surat pernyataan ini saya perbuat dengan sebenarnya untuk dapat digunakan jika diperlukan sebagaimana mestinya.
Medan, April 2017 Yang membuat pernyataan,
Fiorrieta Veglyani Mashitha
ISOLASI SENYAWA FUKOIDAN DARI TALUS RUMPUT LAUT COKLAT (Sargassum ilicifolium (Turner) C.Agard) SERTA UJI SITOTOKSIK DENGAN METODE BRINE SHRIMP LETHALITY TEST
ABSTRAK
Rumput laut coklat Sargassum ilicifolium (Turner) C. Agard tumbuh hampir diseluruh wilayah laut Indonesia, tetapi belum banyak dimanfaatkan. Salah satu komponen utama yang terdapat di dalam rumput laut coklat adalah fukoidan. Beberapa sumber menyatakan bahwa fukoidan memiliki aktivitas biologis seperti antikoagulan, antitrombosis, antitumor, antivirus, immunomodulator, antiinflamasi, antioksidan, dan antikanker. Penelitian ini bertujuan untuk mengisolasi senyawa fukoidan dan memantau senyawa aktif yang bersifat toksik.
Penelitian ini meliputi penyiapan bahan tumbuhan, pemeriksaan karakteristik simplisia, proses isolasi fukoidan menggunakan HCl 0,1 N, identifikasi senyawa fukoidan secara spektrofotometri UV dan FTIR, serta uji sitotoksik terhadap larva Artemia salina Leach yang ditunjukkan oleh nilai LC50
Hasil isolasi diperoleh fukoidan sebesar 19,86 g. Hasil karakteristik senyawa fukoidan diperoleh susut pengeringan 19,32%, identifikasi senyawa fukoidan hasil isolasi secara spektrofotometri UV diperoleh panjang gelombang yang sama dengan baku pembanding yaitu pada 203,81 nm, sedangkan secara sprektrofotometri FTIR menunjukkan adanya gugus O-H, C-H alifatik, gugus S=O dan C-O. Pengujian sitotoksik diperoleh LC
dengan menggunakan metode Brine Shrimp Lethality Test. Pengujian ini menggunakan 3 konsentrasi isolat yaitu 10 µg/ml, 100 µg/ml, dan 1000 µg/ml serta kontrol negatif dengan menggunakan air laut buatan. Tiap konsentrasi berisi 10 ekor larva dengan 3 kali pengulangan. Kematian larva diamati setelah 24 jam pemberian isolat. Data hasil pengujian dianalisis dengan model analisis Probit.
50 sebesar 13658,4 µg/ml, menunjukkan bahwa isolat fukoidan tidak bersifat sitotoksik.
Kata kunci: Brine Shrimp Lethality Test, fukoidan, isolasi, Sargassum
ISOLATION OF FUCOIDAN FROM BROWN SEAWEED THALLUS (Sargassum ilicifolium (Turner) C.Agard) AND CITOTOXICITY TEST
USING BRINE SHRIMP LETHALITY TEST METHOD
ABSTRACT
Brown seaweed Sargassum ilicifolium (Turner) C. Agard grows in most of Indonesia’s coast, unfortunately it is not widely used yet. One of major components in brown seaweed is fucoidan. According to some source, fucoidan has many biological activities such as anticoagulant, antitrombotic, antitumor, antivirus, immunomodulator, antiinflammatory, antioxidants, and anticancer. This study aims to isolate fucoidan compound and to monitor the toxic effect of bioactive compound.
This study included the preparation of plant materials, determination the characteristics of simplex, isolation of fucoidan compound with 0.1 N HCl, identification of fucoidan compound, and cititoxicity test on Artemia salina Leach shown by LC50
The result of fucoidan isolation is 19.85 g, drying shrinkage is 19.32 %, identification isolates of fucoidan with UV spectrophotometric obtained similar wavelength to standart at 203.81 nm. FTIR spectrophotometric showed O-H, CH-aliphatic, group of S=O and C-O. Citotoxicity test obtained LC
using Brine Shrimp Lethality Test method. This test used 3 concentrations of isolate, 10 µg/ml, 100 µg/ml, and 1000 µg/ml, and negative control using sea water. Each concentration contain ten larvas and performed 3 replications. Death of larvas observed 24 hours after giving the isolate. Data were analyzed by Analytic Probit Model.
50 is on 13658.4 µg/ml, showed that isolates of fucoidan compound did not have citotoxic effect.
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
SURAT PENGESAHAN ... vi
ABSTRAK ... vii
ABSTRACT ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian... 4
1.5 Manfaat Penelitian ... 4
1.6 Kerangka Pikir Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Uraian Tumbuhan ... 5
2.1.1 Habitat tumbuhan rumput laut ... 5
2.1.2 Morfologi tumbuhan ... 6
2.1.4 Nama lain tumbuhan ... 7
2.1.5 Kandungan rumput laut coklat ... 7
2.2 Ekstraksi ... 7
2.3 Senyawa Fukoidan ... 9
2.3.1 Ekstraksi senyawa fukoidan ... 10
2.3.2 Pemurnian senyawa fukoidan ... 12
2.4 Artemia salina Leach ... 14
2.4.1 Klasifikasi Artemia salina ... 14
2.4.2 Morfologi ... 15
2.4.3 Siklus hidup ... 15
2.5 Uji Sitotoksisitas ... 17
2.5.1 Brine shrimp lethality test ... 17
2.5.2 Metode potato disk (menghambat tumor crown gall) 18 2.5.3 Uji terhadap Lemna minor L. ... 18
2.6 Spektrofotometri Ultraviolet ... 18
2.7 Spektrofotometri Inframerah ... 19
BAB III METODE PENELITIAN ... 21
3.1 Alat dan Bahan ... 21
3.1.1 Alat ... 21
3.1.2 Bahan ... 21
3.2 Pengumpulan dan Pengolahan Bahan Tumbuhan ... 22
3.2.1 Pengumpulan bahan tumbuhan ... 22
3.2.2 Identifikasi tumbuhan ... 22
3.3 Waktu dan Tempat Penelitian ... 23
3.4 Pemeriksaan Makroskopik ... 23
3.5 Pembuatan Larutan Pereaksi ... 23
3.5.1 Pereaksi asam klorida 1 N ... 23
3.5.2 Pereaksi asam klorida 0,1 N ... 23
3.6 Isolasi Senyawa Fukoidan ... 23
3.7 Penetapan Susut Pengeringan ... 24
3.8 Identifikasi Senyawa Fukoidan ... 24
3.8.1 Analisis secara spektrofotometri UV ... 26
3.8.2 Analisis secara spektrofotometri FTIR ... 26
3.9 Sitotoksik ... 25
3.9.1 Pembuatan air laut buatan ... 25
3.9.2 Penetasan telur Artemia salina Leach ... 26
3.9.3 Pengujian Brine Shrimp Lethality Test ... 26
3.10 Perhitungan LC50 3.11 Analisis Data Sitotoksik ... 28
... 27
BAB IV HASIL DAN PEMBAHASAN ... 29
4.1 Hasil Identifikasi Tumbuhan... 29
4.2 Hasil Pemeriksaan Makroskopik ... 29
4.3 Hasil Isolasi Senyawa Fukoidan ... 29
4.4 Hasil Penetapan Susut Pengeringan ... 30
4.5 Hasil Identifikasi Senyawa Fukoidan ... 30
4.5.1 Identifikasi secara spektrofotometri UV ... 30
4.6 Hasil Uji Sitotoksik ... 33
BAB V KESIMPULAN DAN SARAN ... 36
5.1 Kesimpulan ... 36
5.2 Saran ... 36
DAFTAR PUSTAKA ... 37
DAFTAR TABEL
Tabel Halaman
4.1 Hasil spektrofotometri FTIR senyawa isolat dan baku fukoidan
Sargassum ilicifolium (Turner) C. Agard ... 33 4.2 Persen kematian larva Artemia salina Leach dengan pemberian
DAFTAR GAMBAR
Gamba