GALUR CABAI TRANSGENIK
TOLERAN KEKERINGAN DENGAN GEN P5CS
PENYANDI ENZIM KUNCI BIOSINTESIS PROLINA:
REGENERASI DAN KARAKTERISASI REGENERAN
YUSNIWATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi yang berjudul : “Galur Cabai Transgenik Toleran Kekeringan dengan Gen P5CS-Penyandi Enzim Kunci Biosintesa Prolina : Regenerasi dan Karakterisasi Regeneran” adalah karya saya sendiri dengan arahan Komisi Pembimbing dan belum pernah diajukan dalam bentuk apapun untuk memperoleh gelar program sejenis di perguruan tinggi lain. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, November 2008
Yusniwati
ABSTRACT
YUSNIWATI. Drought Tolerance Transgenic Hot Chilli Line Carrying P5CS Transgene Encoding Key Enzyme for Proline Biosynthese : Plantlet Regeneration and Characterization. Supervisors Committee : SUDARSONO, HAJRIAL ASWIDINNOOR, SRI HENDRASTUTI HIDAYAT, dan DJOKO SANTOSO.
The objectives of this experiments were to evaluate effects of drought stress at vegetative stage on growth, yield and leaf proline content of hot pepper. Drought stress was conditioned by watering plants every five days during the period of 21 – 54 days after planting (DAP). Results of the experiment indicated that drought stress reduced plant height, branch numbers, stem diameter, root length, shoot, root and biomass dry weight and fruit yield. Sensivity index calculated based on biomass of five hot pepper cultivars showed that Prabu was the only tolerance cultivar while those based on proline concentration showed that Prabu, Laris and Jati Laba were the medium tolerance to drought stress. There was no drought tolerance cultivar if the sensitivity index was calculated based on fruit yield.
Genetic engineering manipulation to develop drought tolerance transgenic plant through over-expression of gene P5CS-key enzyme for proline biosinthesis is hot chilli needed regeneration of chilli by in vitro. Regeneration of Chilli by in vitro by using young leaf have been conducted to 13 varietas of chilli. Eksplant of culture at medium induce callus that is elementary medium of MS with vitamin of L2 enhanced by BAP 4 ppm and IAA 0.5 ppm. Then for medium of regeneration and elong of cell, callus subculture at medium of MS added by vitamin L2 , BAP 1 ppm, GA3 2 ppm, Calsium Pantotenat 2 ppm and AgNO3 5 ppm.
The result showed that all of the varieties were able to form callus, but do not all of callus can differentiate to be new bud. Amongs of 13 of varieties of hot chilli, the most responsive to differentiation and bud elongation was Tit Super variety.
With use chilli cv. Tit Super done genetic engineering, the objectives of this experiment were to (1) regenerate of transgenic chilli cv. Tit Super constitutively expressing P5CS transgene through Agrobacterium, (2) analyze integration of P5CS transgene in the genome of transgenic chilli by total nucleic acid PCR, (3) analyze proline accumulation in leaf tissues of the transgenic chilli. There were 67 transgenic line but only 5 transgenic line were positive based on
total nucleic acid PCR testing. The transgenic line also accumulate higher proline than control plant under drought stress which induced by Poly Ethylene Glicol (PEG) 15%.
Over-expression of gene P5CS for key enzyme for proline biosynthesis for tobacco as model plant to drought stress at vegetatif stage showed that drought stress reduced plant height, shoot diameter, leaf dry weight and leaf area.
SUMMARY
YUSNIWATI. Drought Tolerance Transgenic Hot Chilli Line Carrying P5CS Transgene Encoding Key Enzyme for Proline Biosynthese : Plantlet Regeneration and Characterization. Supervisors Committee : SUDARSONO, HAJRIAL ASWIDINNOOR, SRI HENDRASTUTI HIDAYAT, dan DJOKO SANTOSO.
Genetic engineering of chilli (Capsicum annuum L.), an important vegetable, crop is difficult to do. This was proven by the existence of only a few numbers of publication describing hot chilli genetic engineering in scientific journals. The difficulty of genetic engineering of this crop is because the in vitro
bud regeneration and Agrobacterium-mediated genetic transformation of hot chilli are both difficult to do.
This disertation was written based on results of experiments conducted to determine effects of drought stress on growth and development of hot chilli, to develop drought tolerance transgenic hot chilli, and to investigate possible drought tolerance mechanisms in transgenic plants using transgenic tobacco. Therefore, there are three major experiments associated with this dissertation.
The drought stress tolerance phenotype in various crops is a dynamic response. Testing for drought tolerance response need to be conducted at various stages of plant growth (i.e. vegetative and generatives stages). Moreover, glass house test might be the better alternative of evaluation techniques for drought tolerance than that of field evaluation since environmental conditions in the glass house test was more homogeneous than that of field stations. In this research a condition of reducing the amount of supplied water to irrigate the evaluated hot chilli cultivar was used as drought stress treatment.
Result of this experiment showed that the tested hot chilli cultivars (five cultivars) were all sensitive against drought stress. Drought stress under this experiments reduced production of hot chilli by as much as 50%. Such results further supported the need to develop more drought tolerance hot chilli cultivars.
Regeneration of drought tolerance transgenic hot pepper should be possible if the effective methods for in vitro bud regeneration and Agrobacterium-mediated genetic transformation are available. Parts of this desertation research were conducted to answer those question. In this disertation effective research methods for inducing in vitro bud regeneration among chilli cultivars (13 cultivars) were evaluated. Direct shoot regeneration from young seedling associated-leaf approach was employed in this research. Result of the experiment showed that inducing in vitro bud regeneration from experiments of hot chilli cv. Tit Super was easiest.
they were evaluated for their respons against in vitro simulated drought stress using polyethylene glycol (PEG).
Result of the experiment showed 67 kanamycine resistance planlets were regenerated after Agrobacterium-mediated transformation of hot chilli, indicating that they were transgenic carrying at least nptII transgene and probably also carry the P5CS one.
The hot chilli plantlets positively identified carrying P5CS transgene showed different phenotype than that of non-transgenic control. The transgenic shoots carrying P5CS transgene showed broader leaves than that of non-transgenic one. Subsequent result also indicated, non-transgenic shoots identified as carrying P5CS transgene tolerance were more against PEG treatment up to 15% (w/v) concentration. They also exhibited different pattern of proline accumulation in evaluated leaves under in vitro PEG stimulated strees condition.
To answer the possible mechanisms of drought tolerance in transgenic plants carrying P5CS transgene, R2 generation of transgenic tobacco carrying P5CS transgene were evaluated under glass house conditions. The stress conditions were either applied by reducing water supplies or simulated using PEG (0, 2.5, 5, 7.5, 10, 12.5 and 15% (w/v).
Testing of drought stress tolerance on transgenic crops carrying P5CS transgene was conducted using R2 generation of transgenic tobacco. Drought stress treatment on R2 progeny transgenic tobacco resulted. But R2 generation of transgenic P5CS tobacco showed better performance than R2 generation of non- transgenic tobacco. The high increased of proline content was seen on the tested transgenic tobacco. It proved that increasing of proline accumulation caused by over-expression of P5CS gen reduced negative effect of drought stress. Crop age also influence accumulation of praline. Progressively increase of age may increased leaf praline accumulation.
RINGKASAN
YUSNIWATI. Galur Cabai Transgenik Toleran Kekeringan dengan Gen P5CS- Penyandi Enzim Kunci Biosintesa Prolina : Regenerasi dan Karakterisasi Regeneran. Komisi Pembimbing: SUDARSONO, HAJRIAL ASWIDINNOOR, SRI HENDRASTUTI HIDAYAT, dan DJOKO SANTOSO.
Tanaman cabai merah (Capsicum annuum L.) adalah tanaman sayuran penting dan teknik rekayasa genetika pada cabai sulit dilakukan. Hal ini terbukti dari sedikitnya publikasi tentang rekayasa genetika cabai merah di jurnal ilmiah. Rekayasa genetika pada cabai merah sulit dilakukan karena sulitnya meregenerasikan tunas cabai secara in vitro serta sulitnya meregenerasikan eksplan hasil inokulasi Agrobacterium.
Disertasi ini ditulis berdasarkan hasil-hasil percobaan untuk menentukan pengaruh dari cekaman kekeringan terhadap pertumbuhan dan perkembangan cabai, mengembangkan tanaman cabai transgenik yang toleran kekeringan serta menentukan mekanisme tanggapan cekaman kekeringan pada tanaman transgenik menggunakan tanaman tembakau transgenik. Dengan demikian ada tiga kelompok besar percobaan dalam disertasi ini.
Respon dari berbagai genotipe tanaman terhadap cekaman kekeringan bersifat dinamis, sehingga pengujian tingkat toleransi terhadap cekaman kekeringan perlu dilakukan pada berbagai tingkat pertumbuhan tanaman (fase vegetatif dan generatif). Selain itu pengujian toleransi terhadap cekaman kekeringan di rumah kaca perlu dilakukan, karena kondisi di rumah kaca lebih baik dibandingkan di lapangan serta kondisi di rumah kaca lebih homogen di bandingkan lapangan. Evaluasi cekaman kekeringan pada cabai dilakukan dengan pengurangan pemberian air.
Hasil penelitian pengujian cekaman kekeringan terhadap lima kultivar cabai unggul nasional menunjukkan tidak satupun dari ke lima kultivar yang diuji toleran terhadap cekaman kekeringan, cekaman kekeringan yang diberikan menurunkan hasil sampai 50%. Hal tersebut memperkuat alasan perlunya pengembangan kultivar cabai yang toleran kekeringan
Pengembangan cabai transgenik yang toleran cekaman kekeringan dapat dilakukan jika metode regenerasi tunas cabai secara in vitro dan metode transformasi genetika dengan bantuan Agrobacterium telah tersedia. Sebahagian dari penulisan disertasi ini digunakan untuk menjawab pertanyaan tersebut. Dalam disertasi ini dievaluasi metode in vitro yang efektif untuk meregenerasikan 13 genotipe cabai. Regenerasi tunas langsung dilakukan dengan menggunakan daun kecambah cabai. Hasil percobaan menunjukkan bahwa kultivar Tit Super yang paling mampu menghasilkan regenerasi tunas secara in vitro paling banyak
fenotipe secara molekuler dari calon tunas transgenik yang dihasilkan kemudian dievaluasi responnya terhadap kondisi cekaman kekeringan yang disimulasikan secara in vitro dengan menggunakan PEG.
Hasil percobaan menunjukkan 67 planlet yang resisten kanamysin berhasil diregenerasikan setelah transformasi dengan menggunakan Agrobacterium yang mengindikasikan bahwa planlet tersebut merupakan planlet transgenik yang membawa gen nptII dan kemungkinan juga membawa gen P5CS.
Planlet cabai yang teridentifikasi secara positif sebagai pembawa gen P5CS menunjukkan fenotipe yang berbeda dibandingkan dengan tanaman kontrol non transgenik. Tunas cabai transgenik yang membawa gen P5CS menunjukkan daun yang lebih lebar dibandingkan dengan daun yang non transgenik. Hasil selanjutnya juga mengindikasikan bahwa tunas transgenik yang membawa gen P5CS lebih toleran terhadap perlakuan PEG pada konsentrasi 15% (w/v). Tunas transgenik juga menunjukkan pola yang berbeda pada akumulasi prolina daun.
Pengujian mekanisme cekaman kekeringan dilakukan pada tanaman tembakau transgenik generasi R2 yang membawa gen P5CS di rumah kaca Kondisi cekaman kekeringan disimulasikan dengan pengurangan pemberian air dan penyiraman dengan PEG (0, 2.5, 5, 7.5, 10, 12.5, 15% w/v).
Hasil penelitian menunjukkan bahwa cekaman kekeringan menghambat pertumbuhan semua tanaman tembakau R2 (tembakau transgenik dan non transgenik), tetapi generasi R2 transgenik memperlihatkan penampilan yang lebih baik dibandingkan tanaman tembakau non transgenik. Tanaman tembakau transgenik R2 juga menunjukkan pola akumulasi prolina yan berbeda pada daun yang diuji. Umur tanaman juga mempengaruhi akumulasi prolina dimana dengan semakin bertambahnya umur tanaman akumulasi prolina juga semakin meningkat.
Perlakuan cekaman kekeringan dengan penyiraman larutan PEG pada konsentrasi 5% sampai 15%, menunjukkan penurunan pertumbuhan. Akumulasi prolina yang terjadi awalnya lebih tinggi di akar, tetapi kemudian produksi prolina yang tinggi terjadi di jaringan daun. Peningkatan kandungan prolina yang lebih tinggi pada tanaman tembakau transgenik diduga berperan dalam mengurangi dampak negatif terhadap cekaman kekeringan.
©
Hak cipta milik IPB, tahun 2008
Hak cipta dilindungi
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tujuan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin IPB
GALUR CABAI TRANSGENIK TOLERAN KEKERINGAN
DENGAN GEN P5CS-PENYANDI ENZIM KUNCI
BIOSINTESIS PROLINA : REGENERASI DAN
KARAKTERISASI REGENERAN
YUSNIWATI
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada Departemen Agronomi dan Hortikultura
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Disertasi : Galur Cabai Transgenik Toleran Kekeringan dengan Gen P5CS-Penyandi Enzim Kunci Biosintesis Prolina: Regenerasi dan Karakterisasi Regeneran Nama Mahasiswa : Yusniwati
NRP : A. 361040041
Disetujui Komisi Pembimbing
Prof Dr Ir Sudarsono, MSc Ketua
Dr Ir Hajrial Aswidinnoor, MSc Anggota
Dr Ir Sri Hendrastuti Hidayat, MSc Anggota
Dr Ir Djoko Santoso, APU Anggota
Diketahui
Ketua Program Studi Agronomi Dekan Sekolah Pascasarjana IPB
Dr Ir Munif Ghulamahdi, MS Prof Dr Ir Khairil Anwar Notodiputro, MS
PRAKATA
Alhamdulillahirabbil ‘alamin, puji syukur yang sangat dalam penulis sampaikan kepada Allah SWT atas izin dan petunjuk-Nya yang Maha Rahman dan Rahim yang telah dilimpahkan kepada penulis sehingga penelitian dan penulisan Disertasi ini dapat diselesaikan. Disertasi ini merupakan salah satu syarat untuk mendapatkan gelar doktor dari Institut Pertanian Bogor.
Disertasi ini yang berjudul “Galur Cabai Transgenik Toleran Kekeringan dengan Gen P5CS-Penyandi Enzim Kunci Biosintesa Prolina: Regenerasi dan Karakterisasi Regeneran”, disusun berdasarkan penelitian yang dilakukan di Laboratorium Molekuler Tanaman Institut Pertanian Bogor dan Rumah Kaca Balitbio Cimanggu Bogor.
Jurusan Budidaya Pertanian, Ketua Program studi Pemuliaan Tanaman dan kepada seluruh staf pengajar dan pegawai jurusan Budidaya Pertanian Universitas Andalas Padang, atas izin, dukungan dan motivasi serta doa yang diberikan. Kepada Pimpinan Proyek BPPS Direktorat Jenderal Pendidikan Tinggi Departemen Pendidikan Nasional dan Yayasan DAMANDIRI yang telah memberi kesempatan beasiswa.
Dengan segenap rasa hormat dan terima kasih khusus penulis sampaikan kepada Ibunda tercinta Majiar dan Ayahanda tercinta Bismi Tk. Marajo, semua Kakak, Kakak Ipar, Adik dan Adik Ipar serta ponakan yang telah melimpahkan bantuan, kasih sayang, bimbingan, dan do’a yang tulus.
Terima kasih secara khusus disampaikan kepada Uda Apri Yendi, SPt, atas motivasi dan do’anya.
Ucapan terima kasih juga disampaikan kepada rekan-rekan mahasiswa dan staf teknisi di Laboratorium Molekuler Tanaman yang selama ini banyak membantu dalam pelaksanaan penelitian yaitu: Bapak Dr Ir Ahmad Riduan, MSi Ibu Dr Ir Endang Puji Hartati,MSi, Ibu Dr Ir Enni S. Rahayu,Msi, Dr Ir Desta Wirnas, MSi, Dr Susiyanti, SP.MP, Ibu Munarti, SP,MSi, Ibu Yuliasti, SP. M.Si, Bapak Ir. Syamsudin, MSi, Ibu Ir Lollie Agustina P Putri, MSi, Ibu Ir. Sukendah, M.Sc, Ibu Ir Reni, MSi, Darmawan S, SP.MSi, Zulherman S, SP, Susilawati, Mas Agus, dan Pak Juanda yang banyak membantu dalam penyelesaian penelitian serta semua anggota IMPACS (Ikatan Mahasiswa Pascasarjana Sumatera Barat) dan rekan-rekan di pondokan Ponytail atas bantuan dan persahabatan dan semua pihak yang tidak dapat disebutkan satu persatu dalam tulisan ini.
Akhirnya dengan segala kerendahan hati penulis berharap agar hasil penelitian ini dapat digunakan untuk kepentingan penelitian, kemajuan ilmu pengetahuan dan bermanfaat bagi kehidupan. Amin.
Bogor, November 2008 Penulis,
Yusniwati
RIWAYAT HIDUP
Penulis dilahirkan di Bukittinggi pada tanggal 17 Desember 1970, dari pasangan Bapak Bismi Tk. Marajo dan Ibu Majiar sebagai putri ke tiga dari lima bersaudara.
DAFTAR ISI
Halaman
DAFTAR ISI ... xiii
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR ISTILAH ... xx
I PENDAHULUAN ……….. 1
Latar belakang ………..……… 1
Tujuan penelitian ……….…….…. 5
Garis Besar Disertasi……… 6
II TINJAUAN PUSTAKA ………. 11
Tanaman Cabai………. 11
Perbanyakan Tanaman Cabai Secara In Vitro ... 14
Cekaman Kekeringan pada Tanaman... 16
Respon Tanaman terhadap Cekaman Kekeringan dengan Penyesuaian Osmotik ... 18
Plasmid pBI-P5CS ………..………….. 23
Sifat-sifat Biologi Agrobacterium ………..………... 24
Transfer Gen pada Genom Tanaman dengan Bantuan Agrobacterium . 25
III DAMPAK FISIOLOGIS STRES KEKERINGAN TERHADAP PERTUMBUHAN, HASIL DAN KANDUNGAN PROLINA DAUN CABAI ... 26
Abstrak ………. 26
Abstract ………. 27
Pendahuluan ………... 28
Bahan dan Metode ……….………. 29
Hasil ………..……….. 31
Pembahasan ……….………..………. 36
Simpulan ………..……… 39
IV STUDI REGENERASI BEBERAPA GENOTIPE CABAI (Capsicum annum L.) SECARA IN VITRO... 40
Abstrak ... 40
Abstract ……… 41
Pendahuluan ………... 42
Bahan dan Metode …….……….……… 43
Hasil ……….. 45
Pembahasan ………..……… 52
V. INTRODUKSI GEN P5CS KE DALAM GENOM CABAI DENGAN BANTUAN Agrobacterium DAN EKSPRESI TERHADAP CEKAMAN
AKIBAT PEMBERIAN PEG... 55
Abstrak ... 55
Abstract ……… 56
Pendahuluan ………... 57
Bahan dan Metode ……… 60
Hasil ……….. 64
Pembahasan ………..……… 69
Simpulan ……….…..……… 72
VI TOLERANSI TEMBAKAU TRANSGENIK GENERASI R2 YANG MENGEKSPRESIKAN GEN P5CS TERHADAP STRES KEKERINGAN AKIBAT PENGURANGAN PEMBERIAN AIR.. 73
Abstrak ……… 73
Abstract……… ... 74
Pendahuluan ………... 75
Bahan dan Metode …….……… 76
Hasil ……….. 78
Pembahasan ………..……… 89
Simpulan ……….…..……… 91
VII TOLERANSI TEMBAKAU TRANSGENIK GENERASI R2 YANG MENGEKSPRESIKAN GEN P5CS TERHADAP STRES AKIBAT PENYIRAMAN POLIETILEN GLIKOL (PEG)... 92
Abstrak……… ... 92
Abstract ……… 93
Pendahuluan ………... 94
Bahan dan Metode …….……… 97
Hasil ……….. 97
Pembahasan ………..……… 102
Simpulan ……….…..……… 102
VIII PEMBAHASAN UMUM... 104
IX SIMPULAN DAN SARAN UMUM ... 109
DAFTAR TABEL
Nomor J u d u l Halaman
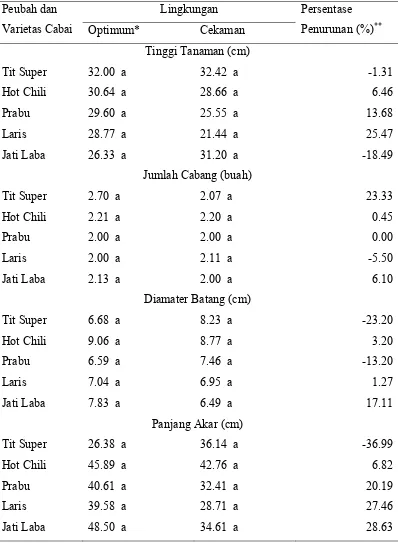
1 Pengaruh cekaman kekeringan pada periode 21 – 54 hari setelah tanam terhadap tinggi tanaman, jumlah cabang, diameter batang, dan panjang akar beberapa genotipe cabai...
3 2
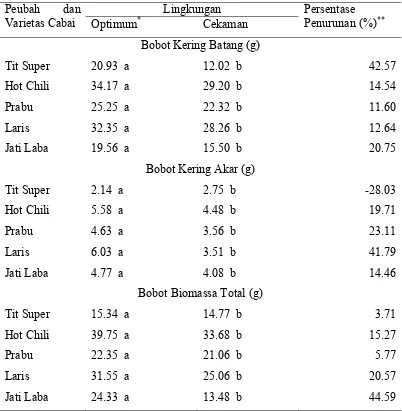
2 Pengaruh cekaman kekeringan pada periode 21 – 54 hari setelah tanam terhadap berat kering batang dan biomasa total beberapa genotipe abai...
3 3
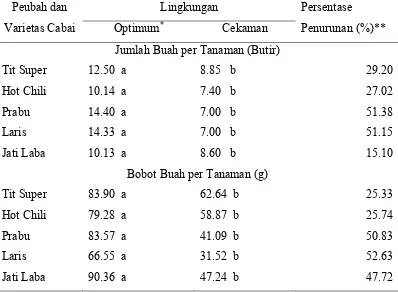
3 Pengaruh cekaman kekeringan pada periode 21 – 54 hari sesudah tanam terhadap bobot biomassa total, jumlah dan bobot buah per tanaman beberapa genotipe cabai...
3 4
4 Indeks kepekaan terhadap cekaman (S) yang dihitung berdasarkan biomasa total, jumlah dan bobot buah per tanaman beberapa genotipe cabai...
3 5
5 Kandungan Prolina daun beberapa genotipe cabai pada umur 37 HST pada kondisi tanam optimum dan cekaman kekeringan...
3 6
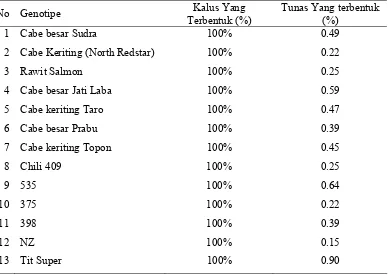
6 Persentase pembentukan kalus dan tunas serta persentase tunas yang terbentuk dari beberapa genotype cabai secara in vitro……
4 6
7 Rata-rata berat kalus, diameter kalus, jumlah tunas dan panjang tunas dari beberapa genotype cabai yang diinduksi secara in
vitro………
4 8
8 Perkembangan jaringan daun cabai var. Tit Super dalam berbagai tahapan transformasi genetika dengan bantuan Agrobacterium
hingga menjadi tanaman transgenik. Transformasi genetika untuk mengintroduksikan gen P5CS dengan bantuan Agrobacterium
dilakukan sebanyak empat eksperimen...
6 5
9 Kandungan prolina daun cabai transgenik dan non transgenik pada kondisi optimum dan dengan perendaman dalam larutan PEG 15% selama 10 hari ...
6 9
10 Pengaruh stres kekeringan pada periode 35 hari sesudah tanam (HST) terhadap tinggi tanaman, panjang buku dan diameter batang tanaman R2 zuriat dari tembakau GS transgenik P5CS generasi R1 dan tembakau GS non-transgenik...
Nomor J u d u l Halaman
11 Pengaruh stres kekeringan pada periode 35 hari sesudah tanaman (HST) terhadap berat kering daun, luas daun dan jumlah daun tanaman R2 zuriat dari tembakau GS transgenik P5CS generasi R1 dan tembakau GS non-transgenik………....
8 0
12 Pengaruh stres kekeringan pada periode 55 hari sesudah tanam (HST) terhadap tinggi tanaman, panjang buku dan diameter batang tanaman R2 zuriat dari tembakau GS transgenik P5CS generasi R1 dan tembakau GS non-transgenik... 81
13 Pengaruh stres kekeringan pada periode 55 hari sesudah tanaman (HST) terhadap berat kering daun, luas daun dan jumlah daun tanaman R2 zuriat dari tembakau GS transgenik P5CS generasi R1 dan tembakau GS non-transgenik………..……… 82
14 Pengaruh stres kekeringan pada periode 78 hari sesudah tanam (HST) terhadap tinggi tanaman, panjang buku dan diameter batang tanaman R2 zuriat dari tembakau GS transgenik P5CS generasi R1 dan tembakau GS non-transgenik... 83
15 Pengaruh stres kekeringan pada periode 78 hari sesudah tanaman (HST) terhadap berat kering daun, luas daun dan jumlah daun tanaman R2 zuriat dari tembakau GS transgenik P5CS generasi R1 dan tembakau GS non-transgenik……….……… 84
16 Pengaruh perlakuan stres kekeringan pada periode 15-78 hari sesudah tanam (HST) terhadap kandungan prolina daun tanaman R2 zuriat dari tembakau GS transgenik P5CS generasi R1 dan tembakau GS non-transgenik. Contoh daun diambil 78 HST... 86
17 Segregasi fenotipe bibit R2 yang ditanam dalam medium MS selektif dengan penambahan antibiotika kanamisin 100 mg/l, hasil analisis χ2, dan pendugaan jumlah lokus nptII fungsional yang terintegrasi dalam genom tembakau transgenik... 99
18 Pengaruh penyiraman polietilena glikol (PEG) dengan konsentrasi 0%,2.5%, 5%,7.5%, 10%,12.5% dan 15% pada umur 35 HST terhadap tinggi tanaman,bobot akar kering, bobot kering daun,dan panjang akar dari tanaman R1 zuriat tembakau GS transgenik P5CS generasi R2 dan tembakau GS non-transgenik... 100
DAFTAR GAMBAR
Nomor J u d u l Halaman
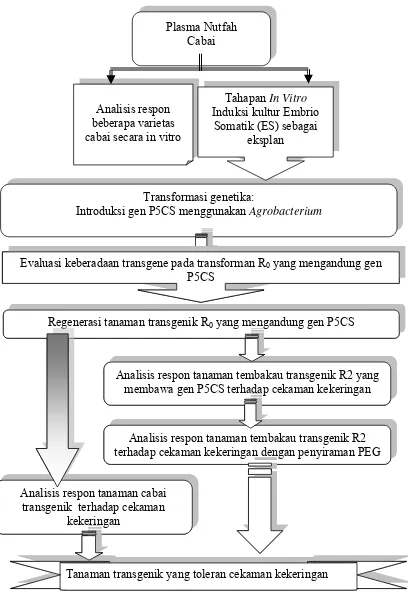
1 Skema strategi penelitian : Galur Cabai Transgenik dengan Gen P5CS-Penyandi Enzim Kunci Biosintesis Prolina Regenerasi dan
Karakterisasi Regeneran ……… 9
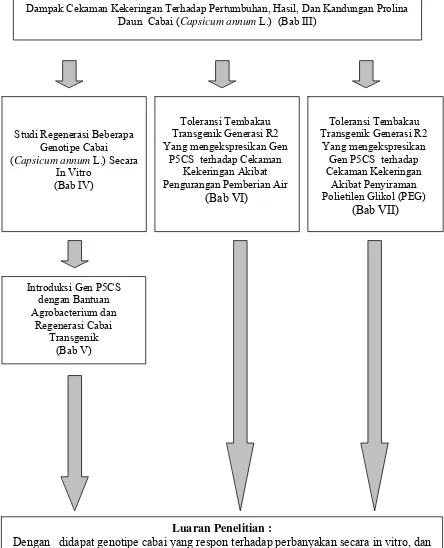
2 Alur disertasi Galur Cabai Transgenik dengan Gen P5CS-Penyandi Enzim Kunci Biosintesis Prolina Regenerasi Dan Karakterisasi Regeneran dan hubungan masing-masing topik
penelitian……… 10
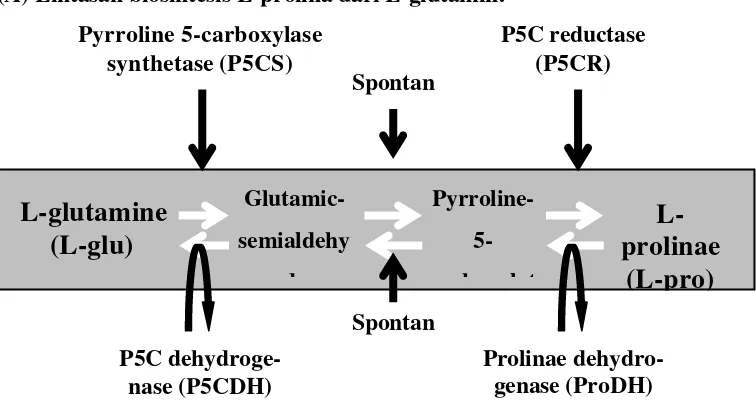
3 Lintasan biosintesis L-prolina dari L-glutamin dan berbagai gen penyandi ensim yang diperlukan untuk biosintesis L-prolina. Gen P5CS merupakan gen penyandi ensim kunci dalam biosintesis prolina, yang ekspresinya meningkat dengan adanya stres kekeringan (dehidrasi) dan menurun dalam kondisi non-stres
(rehidrasi)………... 22
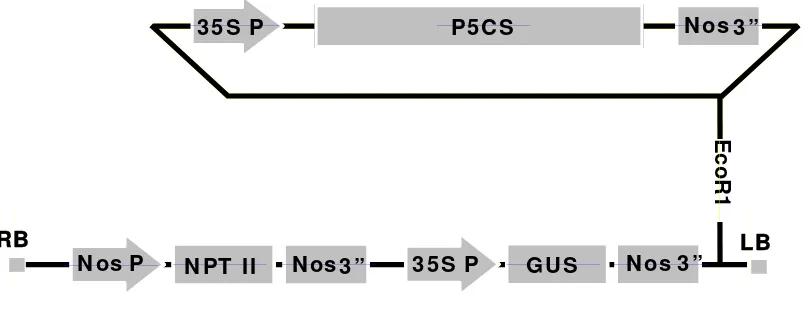
4 Peta restriksi plasmid pBI-P5CS... 23
5 a) Bibit cabai umur 21 hari yang ditanam secara in vitro
b) Daun muda cabai yang ditanam pada media induksi kalus…... 45
6 Kalus-kalus yang terbentuk dari beberapa varietas dan galur cabai
secara in vitro………... 47
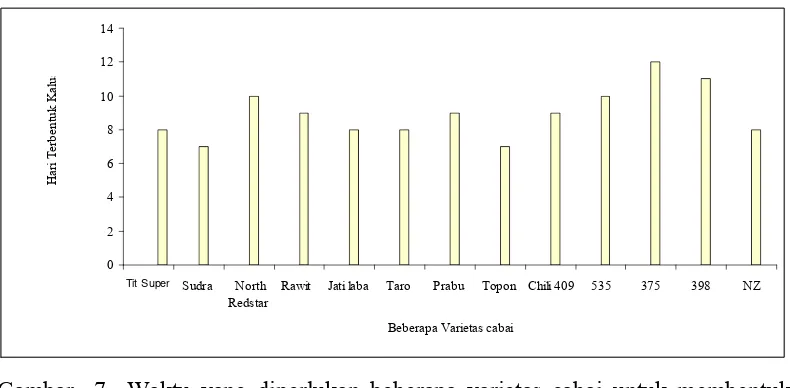
7 Waktu yang diperlukan beberapa varietas cabai untuk membentuk
kalus……… 48
8 Hubungan antara berat kalus dengan jumlah tunas yang terbentuk
pada beberapa varietas cabai………. 49
9 Kalus yang terbentuk dari daun muda setelah 14 hari induksi (9A) kalus yang berwarna putih yang akan berubah menjadi kehijauan dalam beberapa hari dan kalus ini merupakan kalus organogenik (organogenic callus) (OC)
(9B) kalus yang berwarna coklat merupakan kalus yang tidak dapat diregenerasikan (non-regenerable callus) (NRC)... 50
Nomor J u d u l Halaman
11 Tunas yang berkembang dalam media perpanjangan tunas (A) tunas yang abnormal, dimana tidak menghasilkan batang, (B) tunas yang normal yang dapat berkembang membentuk batang.... 51
12 Peta konstruksi plasmid biner pBI-P5CS yang membawa gen kimera P5CS, gen marker NPTII, dan gen marker GUS pada struktur T-DNA. Lokasi situs pemotongan oleh ensim restriksi pada T-DNA ditunjukkan dengan angka dan identitas ensimnya (Kavi Kishor et al., 1995)... 61
13 Hasil total nucleic acid PCR untuk mendeteksi integrasi gen P5CS: dalam genom cabai transgenik dengan marker NPT II... 65
14 Perkembangan eksplan daun muda cabai var Tit Super dalam tahapan transformasi dengan bantuan Agrobacterium (A1) Prekultur eksplan daun muda cabai var Tit Super dalam media MSR-I, (A2) Kokultivasi eksplan daun muda cabai var Tit Super dalam mdia MSR-I, (B1&2) Respon tunas cabai var Tit Super yang resisten dan sensitif terhadap kanamaycin dalam media MSR-II, (C1&2) Planlet cabai var Tit Super transgenik dalam
media perakaran………. 66
15 Penampilan daun regeneran cabai cv Tit Super yang direndam dalam larutan PEG 15% selama 10 hari secara in vitro (A) Kontrol dan (B) Transgenik P5CS………. 67
16 Pengaruh perendaman PEG 0 dan 15% selama periode 10 hari secara in vitro terhadap kandungan prolina total daun tanaman cabai kontrol dan transgenik R0………. 68
17 (A) Distribusi kandungan prolina total daun cabai transgenic R0 dan non transgenik dalam kondisi optimum, (B) Distribuís kandungan prolina total daun cabai transgenik R0 dan non tansgenik dalam kondisi cekaman dengan perendaman PEG 15%
selama 10 hari………. 68
18 Distribusi kandungan prolina total daun cabai transgenik R0 dan non transgenik dalam kondisi optimum dan dalam kondisi cekaman dengan perendaman PEG 15% selama 10 hari pada genotype yang sama………... 69
19 Penampilan regeneran cabai cv Tit Super secara in vitro (A) Kontrol dan (B) Transgenik………. 71
Nomor J u d u l Halaman
21 Tanaman tembakau transgenik R2 dalam media kanamisin (A dan B), tembakau R2 kontrol (non transgenik (C)... 78
22 Tanaman R2 zuriat dari tembakau GS transgenik P5CS generasi R1 dan tembakau GS non-transgenik pada kondisi optimum dan cekaman kekeringan, A1 = Tanaman tembakau non transgenik yang mendapat perlakuan cekaman kekeringan, B1= Tanaman tembakau non transgenik yang tidak mendapat perlakuan cekaman kekeringan, A2= Tanaman tembakau transgenik GS-1 yang tidak mendapat perlakuan cekaman, B2= Tanaman tembakau transgenik GS-1 yang mendapat perlakuan cekaman, A3= Tanaman tembakau transgenik GS-2 yang tidak mendapat perlakuan cekaman,B3= Tanaman tembakau transgenik GS-1 yang mendapat perlakuan cekaman, A4= Tanaman tembakau transgenik GS-3 yang tidak mendapat perlakuan cekaman, B4= Tanaman tembakau transgenik GS-3 yang mendapat perlakuan cekaman, A5= Tanaman tembakau transgenik GS-4 yang tidak mendapat perlakuan cekaman,B5=Tanaman tembakau transgenik GS-4 yang mendapat perlakuan cekaman,A6= Tanaman tembakau transgenik GS-5 yang tidak mendapat perlakuan cekaman,B6= Tanaman tembakau transgenik GS-5 yang mendapat perlakuan cekaman………...
85
23 Kandungan prolina beberapa galur tembakau pada kondisi stres
umur 35 dan 78 HST………. 86
24 Kandungan prolina beberapa galur tembakau pada kondisi optimum umur 35 dan 78 HST………... 86
25 Regresi antara kandungan prolina daun dari tembakau GS non- transgenik dan tanaman R2 zuriat dari tembakau GS transgenik R 1, dengan tinggi tanaman dan bobot kering daun per tanaman Kandungan prolina daun ditentukan umur 78 hari sesudah tanam (hst) sedangkan tinggi tanaman dan berat kering daun ditentukan 110 hari setelah tanam (hst). (■) tembakau GS-non transgenik, (♦)
tembakau GS transgenik P5CS……… 87
26 Keterkaitan antara indeks sensitivitas terhadap cekaman kekeringan yang dihitung menggunakan data tinggi tanaman dan panjang akar dari tembakau GS non-transgenik (♦) dan transgenic (Ο,♦■). Nilai indeks sensitivitas ≤ 0.5 dikategorikan toleran, diantara 0,5 dan 1 dikategorikan medium, dan >1 dikategorikan peka... 89
DAFTAR ISTILAH
Aklimatisasi
proses penyesuaian peralihan lingkungan hidup heterotroph menjadi autotroph pada planlet yang diperoleh melalui teknik in vitro
CaMV 35 S
promotor yang terdapat pada DNA viral yang ekspresinya bersifat konstitutif (di seluruh bagian), yang merupakan strong promoter
Cekaman kekeringan
kondisi ketersediaan air media tanaman yang tidak memadai baik jumlah maupun distribusinya, yang terjadi pada sebagian atau sepanjang siklus hidup tanaman sehingga tanaman tidak dapat mengekspresikan potensi genetiknya.
Embriosomatik
proses pembentukan embrio secara aseksual dari sel somatik dalam kultur
in vitro
Kultur in vitro
suatu metode untuk mengisolasi bagian dari tanaman seperti protoplasma sel, sekelompok sel, jaringan dan organ, serta menumbuhkannya dalam kondisi aseptik, sehingga bagian-bagian tersebut dapat memperbanyak diri dan beregenerasi menjadi tanaman lengkap.
Genersi R0
tanaman yang merupakan hasil regenerasi jaringan dari kultur in vitro
Generasi R1
tanaman yang merupakan zuriat dari tanaman generasi R0
Mekanisme avoidance (ketahanan)
mekanisme respon terhadap cekaman kekeringan yang ditunjukkan dengan kemampuan tanaman untuk mempertahankan potensial air jaringan yang relatif tinggi pada saat mengalami cekaman kekeringan
Mekanisme escape (pelarian)
mekanisme respon terhadap cekaman kekeringan yang ditunjukkan dengan kemampuan tanaman untuk menyelesaikan siklus hidupnya sebelum terjadi cekaman kekeringan sehingga tidak mengalami cekaman
Mekanisme tolerance (toleran)
Nisbah akar/tajuk
ratio bobot kering akar dan tajuk
Osmolit
senyawa yang terlarut dalam plasma sel yang dapat berperan untuk mempertahankan potensial osmotik sel dan melindungi kerusakan struktur sel akibat senyawa radikal pada saat mengalami cekaman
PCR (Polymerase Chain Reaction)
Amplifikasi enzimatik dari fragmen DNA spesifik dengan menggunakan siklus berulang dari denaturasi, penempelan primer, dan elongasi
Peka
respon tanaman yang tidak mampu mempertahankan diri atau mengatasi pengaruh cekaman kekeringan, yang ditunjukkan dengan menurunnya pertumbuhan dan atau hasil panen secara signifikan pada kondisi cekaman kekeringan
PEG (Poly Ethylene Glycol)
senyawa polimer yang tersusun atas sub unit etilen-oksida yang mampu mengikat molekul air pada atom oksigennya dengan ikatan hidrogen
Plasmid
elemen genetik ekstrakromosomal yang memiliki kemampuan untuk menggandakan diri sendiri. Untaian DNA berbentuk lingkaran diluar kromosom yang terdapat dalam sel bakteri.
Potensial osmotik
potensi suatu larutan untuk melakukan osmosis atau menarik molekul air, yang nilainya negatif dan ditentukan oleh konsentrasi larutan, suhu, konstanta gas dan konstanta ionisasi
Primer
sebuah oligonukleotida khusus yang komplemen pada region tertentu dari strand template, yang mana sintesis DNA baru terjadi
Prolina
salah satu jenis asam amino yang terlarut dalam plasma sel dan dapat berperan sebagai osmolit
T-DNA
utas nukleotida yang merupakan bagian dari sistem penginduksi tumor yang dimiliki oleh Agrobacterium tumefaciens yang terintegrasi dalam genom tanaman. Segmen dari plasmid Ti yang di transfer dan masuk dalam lokasi kromosomal pada inti sel tanaman.
Terminator
Transforman
sel yang telah mengalami proses transformasi
Transgenik
organisme yang genomnya telah disisipi dengan DNA asing
Toleran
respon tanaman yang mampu mempertahankan diri atau mengatasi pengaruh cekaman kekeringan, yang ditunjukkan dengan menurunnya pertumbuhan dan atau hasil panen yang tidak signifikan pada kondisi cekaman kekeringan
Vektor
I PENDAHULUAN
Latar Belakang
Cabai (Capsicum spp) merupakan sayuran penting di dunia dan termasuk spesies pertama yang ditemukan telah digunakan manusia di seluruh dunia (Berke 2002a). Cabai dapat dikonsumsi dalam bentuk buah segar, kering atau bentuk olahannya dan memiliki berbagai manfaat. Cabai telah menjadi bagian penting dalam resep masakan (Berke 2002b), kaya akan vitamin C, A, dan B, potasium, fosfor dan kalsium (Xuefeng 1999; Boslan and Votava 2000), dan kandungan kimianya merupakan bagian penting dalam obat-obatan, pewarna makanan, dan kosmetika (Taychasinpitak dan Taywiya 2003; IISR 2006).
Cabai merah (Capsicum annuum L.) merupakan spesies yang dibudidayakan paling luas (Zhang 1989) karena merupakan spesies cabai pertama yang ditemukan oleh Columbus dan diintroduksikan ke seluruh dunia. Cabai merah masuk ke Indonesia dibawa oleh bangsa Portugis sekitar 450 – 500 tahun yang lalu (Berke 2002b). Cabai merah beradaptasi dengan cepat dan diterima oleh bangsa Indonesia sehingga menjadi komoditi sayuran penting, mempunyai nilai ekonomis yang tinggi dan seiring dengan peningkatan jumlah penduduk maka permintaan akan cabai juga terus meningkat. Di Indonesia ternyata luasnya pertanaman cabai merah tidak diikuti oleh tingginya produktivitas. Data Dirjen Bina Produksi Hortikultura tahun 2000, tercatat bahwa luas areal pertanaman cabai merah adalah sebesar 183,347 ha, dengan rata-rata produktivitas 5,5 ton /ha, dan tahun 2001 menurun menjadi 4,17 ton/ha, yang masih jauh di bawah rata-rata produktivitas dunia sebesar 9,5 ton/ha, sehingga tidak mampu mencukupi kebutuhan nasional (Dirjen Produksi Hortikultura dan Aneka Tanaman 2001). Data BPS Produksi Tanaman Sayuran dan Buah-buahan Indonesia tahun 2002, rata-rata hasil pertanaman cabai dari semua provinsi di Indonesia kurang dari 2 ton/ha, sedangkan potensi produksi cabai merah dapat berkisar antara 12 – 20 ton/ha (Duriat 1996)
budidaya yang belum sempurna, dan tingginya serangan hama dan penyakit. Secara umum pertumbuhan dan perkembangan tanaman dipengaruhi oleh faktor genetik dan lingkungan. Kenyataan di lapangan lingkungan pertumbuhan tanaman tidak selalu merupakan kondisi yang optimum bagi tanaman, sehingga seringkali tanaman tidak mampu mengekspresikan seluruh potensi genetik yang dimilikinya. Menurut Blum (1982) cekaman lingkungan merupakan faktor yang paling berperan terhadap kesenjangan antara potensi dan hasil aktualnya.
Produksi cabai dapat ditingkatkan melalui program perluasan pertanaman dan intensifikasi budidaya. Kedua program ini sangat membutuhkan benih yang berkualitas, baik secara genetik maupun fisiologis. Benih yang berkualitas genetik tinggi dapat diperoleh melalui persilangan konvensional yang diikuti dengan proses seleksi dan melalui rekayasa genetika.
Kehadiran teknologi transformasi genetika memberikan wahana baru bagi para pemulia tanaman untuk memperoleh gen-gen baru (Greenberg dan Glick 1993). Rekayasa genetika akan memberikan perbaikan dari karakter-karakter penting pada tanaman. Sifat ketahanan tanaman terhadap beberapa cekaman biotik seperti gulma, virus, serangga dan mikroorganisme telah dapat diperbaiki dengan pendekatan ini. Demikian pula terhadap cekaman abiotik dan modifikasi kualitas dan kuantitas produk tanaman (Bennet 1993). Suatu gen yang tidak terdapat pada suatu spesies tanaman tertentu dimungkinkan untuk dapat diperoleh dari organisme lain seperti bakteri, virus, binatang dan tanaman lain (Herman 1996).
Teknik penyisipan gen (transformasi gen) akan menghasilkan tanaman transgenik yang kemudian dapat dimanfaatkan sebagai sumber plasma nutfah atau langsung diseleksi menjadi galur harapan. Transformasi gen secara in vitro
Kultur sel atau jaringan dan sistem regenerasinya memegang peranan yang sangat penting di dalam aplikasi bioteknologi atau transformasi genetika untuk program perbaikan sifat tanaman. Beberapa usaha yang dilakukan untuk mencapai sistem regenerasi yang efisien adalah dengan menentukan parameter penting yang spesifik pada tanaman (Parrot et al. 1992). Oleh karena itu, sebelum dilakukan transformasi genetik untuk memperoleh tanaman cabai yang tahan terhadap kondisi cekaman kekeringan diperlukan adanya sistem regenerasi yang efisien dan stabil secara in vitro.
Salah satu kendala pengembangan penanaman cabai adalah terbatasnya lahan yang sesuai sehingga harus menggunakan lahan-lahan marginal. Lahan marginal memiliki keterbatasan, khususnya dalam ketersediaan air yang menyebabkan tanaman mengalami kekeringan. Disamping itu, perubahan suhu global dengan siklus musim kemarau panjang yang semakin pendek (setiap 2-3 tahun) juga menyebabkan cekaman kekeringan pada tanaman (Winarso 1992).
Cekaman kekeringan menjadi masalah yang perlu diperhatikan dalam budidaya cabai karena penanaman cabai biasanya di lahan sawah dilakukan pada akhir musim hujan. Kondisi musim kemarau atau penanaman di lahan tegal meyebabkan ketersediaan air tidak selalu terjamin sepanjang musim tanam. Lahan pertanaman yang mengalami kekurangan air akan mengakibatkan fungsi dan pertumbuhan akar sebagai bagian tanaman yang penting akan terganggu. Akibatnya pertumbuhan seluruh tanaman akan ikut terganggu sehingga akan berefek juga pada perkembangan tanaman cabai, akhirnya, mutu, dan produksi cabai akan merosot (Setiadi 2004).
Toleransi cekaman kekeringan pada tanaman hampir selalu melibatkan akumulasi senyawa yang dapat melindungi sel dari kerusakan yang terjadi pada saat potensial air rendah. Sejalan dengan itu, hasil penelitian menunjukkan bahwa mekanisme adaptasi tanaman untuk mengatasi cekaman kekeringan adalah dengan pengaturan potensial osmotik sel. Pada mekanisme ini terjadi sintesis dan akumulasi senyawa organik yang dapat menurunkan potensial air dalam sel tanpa membatasi fungsi ensim serta menjaga turgor sel. Beberapa senyawa yang berperan dalam penyesuaian osmotikal sel diantaranya yaitu senyawa prolina dan gula total. Beberapa penelitian menunjukkan bahwa ketahanan terhadap cekaman kekeringan berhubungan dengan peningkatan kandungan prolina yang berperan penting dalam menjaga pertumbuhan akar pada Potensial Osmotik (PO) air yang rendah (Sharp 1994). Hasil penelitian lain menunjukkan terjadi peningkatan konsentrasi prolina 5-6 kali pada padi toleran kering TKM 1 sedangkan pada padi peka Sabarmati hanya meningkat 1-2 kali pada kondisi potensial osmotik –10 bar (Mali dan Mehta 1977).
Akumulasi prolina dalam respon terhadap cekaman kekeringan telah dilaporkan pada beberapa tanaman secara in vitro dan ex vivo (Hanson et al.
1979; Handa et al, 1986; Sarkar1993; Madan et al. 1995; Girousse et al. 1996). Jumlah prolina yang meningkat dianggap merupakan indikasi toleransi terhadap cekaman kekeringan karena prolina berfungsi sebagai senyawa penyimpan N dan osmoregulator dan/atau sebagai protektor ensim tertentu (Kim dan Janick 1991; Madan et al. 1995; Prasad dan Potluri 1996; Yoshiba et al. 1997). Sebagai akibatnya sel, jaringan atau tanaman yang overproduksi prolina dianggap mempunyai sifat toleransi terhadap cekaman kekeringan yang lebih baik.
Akumulasi prolina pada tanaman yang mengalami cekaman kekeringan disebabkan oleh aktivasi biosintesis prolina dan inaktivasi degradasi prolina. Pada tanaman tingkat tinggi, prolina disintesis melalui lintasan asam glutamin dan ornitin. Lintasan dari glutamin merupakan lintasan primer untuk biosintesis prolina dalam kondisi cekaman kekeringan (Madan et al. 1995; Yoshiba et al.
dan P5C reductase (P5CR) pada step kedua (Gambar 3). Gen yang menyandi P5CS dan P5CR telah diisolasi dari berbagai tanaman dan ekspresi serta fungsinya telah diteliti. Hasil penelitian menunjukkan bahwa gen P5CS merupakan penyandi ensim yang menjadi faktor pembatas dalam biosintesis prolina pada tanaman tingkat tinggi (Hu CA et al. 1992).
Over-ekspresi dari P5CS menghasilkan akumulasi prolina pada tanaman transgenik dan terbukti meningkatkan toleransi tanaman terhadap cekaman kekeringan. Over-produksi prolina mampu meningkatkan secara signifikan terhadap biomassa akar dan perkembangan bunga pada tanaman transgenik dibawah kondisi cekaman kekeringan atau cekaman osmotik. Transformasi gen P5CS yang berasal dari V. aconitifolia ke tanaman tembakau di bawah kendali promoter konstitutif CaMV 35S, secara nyata terbukti meningkatkan produksi prolina yang meningkatkan pula toleransi tanaman transgenik tersebut terhadap cekaman kekeringan (Kavi Kishor et al. 1995). Pada tanaman transgenik padi, over-ekspresi gen P5CS terbukti dapat meningkatkan kadar prolina daun dan mampu menghasilkan peningkatan biomassa tanaman dalam kondisi stres air dan garam tinggi (Zhu et al. 1998). Transformasi gen P5CS yang diikuti regenerasi tanaman transgeniknya diperkirakan mampu menghasilkan tanaman cabai transgenik yang toleran terhadap cekaman kekeringan.
Berdasarkan uraian di atas, terdapat peluang yang cukup besar dalam pengembangan galur cabai transgenik dengan karakter toleran terhadap cekaman kekeringan melalui over-ekspresi gen P5CS – penyandi enzim kunci biosintesis prolina, yaitu dengan mengintroduksi gen P5CS menggunakan Agrobacterium ke dalam genom cabai dan tembakau sebagai tanaman model.
Tujuan penelitian
1. Memperoleh informasi tentang respon fisiologis cabai sebagai bagian dari mekanisme toleransi tanaman terhadap cekaman kekeringan
2. Mendapatkan varietas cabai yang mempunyai daya regenerasi yang tinggi secara in vitro
4. Mengevaluasi regeneran cabai hasil transformasi gen P5CS
5. Memperoleh informasi apakah pada kondisi optimum terjadi ekspresi P5CS pada tanaman tembakau
6. Memperoleh informasi apakah over ekspresi terjadi di semua jaringan tanaman tembakau
7. Apakah umur/developmental tanaman berpengaruh pada ekspresi P5CS
Garis Besar Disertasi
Disertasi ini disusun berdasarkan pemikiran bahwa keberhasilan untuk mengembangkan tanaman cabai merah yang toleran terhadap cekaman kekeringan dan berdaya hasil tinggi melalui pemuliaan tanaman akan lebih tinggi jika: tersedia populasi tanaman cabai yang bersegregasi zuriat dari hasil persilangan antara tetua donor yang membawa sifat daya hasil tinggi dengan tetua donor yang membawa sifat toleransi cekaman kekeringan.
Toleransi terhadap cekaman kekeringan dikendalikan oleh banyak sifat (Blum 1983) maka untuk memperoleh metode seleksi yang efektif perlu dilakukan serangkaian percobaan identifikasi sifat toleransi cekaman kekeringan. Pada tahap awal, percobaan untuk memperoleh karakter yang dapat memberi petunjuk toleransi kekeringan pada cabai. Rangkaian percobaan respon cabai terhadap cekaman kekeringan dilakukan terhadap lima genotipe cabai. Karena toleransi kekeringan bersifat dinamik, diantaranya dipengaruhi oleh tingkat perkembangan tanaman, maka identifikasi sifat toleran tersebut dilakukan pada tahap pertumbuhan vegetatif dan pertumbuhan generatif.
Cekaman Kekeringan Terhadap Pertumbuhan, Hasil dan Kandungan Total Prolina Daun Cabai (Capsicum annuum L), dan tulisan ini telah diterbitkan di jurnal ilmiah nasional terakreditasi AGRISTA volume 12 nomor 1, halaman 19-27, April 2008, Universitas Syiah Kuala Banda Aceh. Percobaan-percobaan yang dilakukan untuk pembahasan tersebut ditujukan untuk menentukan keefektifan penggunaan simulasi cekaman kekeringan pada berbagai tahap pertumbuhan menggunakan pot dengan pengurangan penyiraman air dalam menapis karakter toleransi tanaman cabai. Hasil yang didapat akan dipakai sebagai penduga toleransi tanaman cabai terhadap cekaman kekeringan. Peubah yang diukur dalam percobaan ini adalah kandungan prolina daun, tinggi tanaman, jumlah cabang utama, dan bobot kering tajuk dan akar. Peubah yang terkait dengan pertumbuhan generatif meliputi jumlah dan bobot buah .
Sejalan dengan penelitian ini dilakukan penelitian tentang ”Studi Regenerasi Beberapa Genotipee Cabai (Capsicum Annum L.) Secara In Vitro” Hasil percobaan ditulis pada BAB IV, penelitian ini bertujuan untuk mendapatkan genotipe cabai yang respon untuk dikembangkan secara in vitro
untuk digunakan dalam rekayasa genétika tanaman guna memasukan gen ketahanan terhadap cekaman kekeringan pada genom cabai.
Hasil percobaan dan analisis studi tersebut kemudian digunakan untuk tahapan penelitian yang ditulis dalam BAB V dengan judul “Introduksi Gen P5CS ke dalam Genom Cabai dengan Bantuan Agrobacterium dan Ekspresinya terhadap Cekaman Akibat Pemberian PEG”.
cenderung lebih besar) dan genotipe peka (cenderung lebih kecil) menyebabkan perbedaan kebutuhan air di antara keduanya.
Gambar 1 Skema strategi penelitian : Galur Cabai Transgenik dengan Gen P5CS-Penyandi Enzim Kunci Biosintesis Prolina Regenerasi dan Karakterisasi Regeneran
Transformasi genetika:
Introduksi gen P5CS menggunakan Agrobacterium Analisis respon
beberapa varietas cabai secara in vitro
Tahapan In Vitro
Induksi kultur Embrio Somatik (ES) sebagai
eksplan Plasma Nutfah
Cabai
Analisis respon tanaman cabai transgenik terhadap cekaman
kekeringan
Analisis respon tanaman tembakau transgenik R2 yang membawa gen P5CS terhadap cekaman kekeringan Regenerasi tanaman transgenik R0 yang mengandung gen P5CS Evaluasi keberadaan transgene pada transforman R0 yang mengandung gen
P5CS
Analisis respon tanaman tembakau transgenik T2 terhadap cekaman kekeringan dengan penyiraman PEG
Tanaman transgenik yang toleran cekaman kekeringan Analisis respon tanaman cabai
transgenik terhadap cekaman kekeringan
Analisis respon tanaman tembakau transgenik R2 yang membawa gen P5CS terhadap cekaman kekeringan Regenerasi tanaman transgenik R0 yang mengandung gen P5CS Evaluasi keberadaan transgene pada transforman R0 yang mengandung gen
P5CS
Analisis respon tanaman tembakau transgenik R2 terhadap cekaman kekeringan dengan penyiraman PEG
Gambar 2 Alur disertasi Galur Cabai Transgenik dengan Gen P5CS-Penyandi Enzim Kunci Biosintesis Prolina Regenerasi Dan Karakterisasi Regeneran dan hubungan masing-masing topik penelitian
Dampak Cekaman Kekeringan Terhadap Pertumbuhan, Hasil, Dan Kandungan Prolina Daun Cabai (Capsicum annum L.) (Bab III)
Studi Regenerasi Beberapa Genotipe Cabai (Capsicum annum L.) Secara
In Vitro (Bab IV)
Toleransi Tembakau Transgenik Generasi R2 Yang mengekspresikan Gen
P5CS terhadap Cekaman Kekeringan Akibat Pengurangan Pemberian Air
(Bab VI)
Toleransi Tembakau Transgenik Generasi R2
Yang mengekspresikan Gen P5CS terhadap Cekaman Kekeringan
Akibat Penyiraman Polietilen Glikol (PEG)
(Bab VII)
Introduksi Gen P5CS dengan Bantuan Agrobacterium dan
Regenerasi Cabai Transgenik
(Bab V)
Luaran Penelitian :
Dengan didapat genotipe cabai yang respon terhadap perbanyakan secara in vitro, dan dilakukan introduksi gen P5CS maka diharapkan di dapatkan tanaman cabai transgenik
II TINJAUAN PUSTAKA
Tanaman Cabai
Berdasarkan klasifikasi tanaman cabai termasuk dalam kingdom: Plantae, Divisio: Magnoliophyta, Kelas: Magnoliopsida; Ordo: Solanales; Famili: Solanaceae; dan Genus: Capsicum. Kebanyakan spesies cabai adalah diploid dengan 24 kromosom (2N = 2 x = 24) dan mempunyai 1 atau 2 pasang kromosom acrosentrik dengan 10 atau 11 pasang metasentrik atau submetasentrik (Bosland dan Votata 2000).
Genus Capsicum adalah anggota dari famili Solanaceae yang di dalamnya termasuk tomat, kentang, tembakau dan petunia. Genus Capsicum terdiri dari 22 spesies liar dan 5 spesies yang dibudidayakan (Bosland 1994): C. annuum, C. baccatum, C. chinense, C. frutescens, dan C, pubescens.
Cabai (Capsicum spp) merupakan sayuran penting di dunia dan termasuk spesies pertama yang ditemukan telah digunakan manusia di seluruh dunia (Berke 2002a). Cabai dapat dikonsumsi dalam bentuk buah segar, kering atau bentuk olahannya dan memiliki berbagai manfaat. Cabai telah menjadi bagian penting dalam resep masakan (Berke 2002b), kaya akan vitamin C, A, dan B, potasium, fosfor dan kalsium (Xuefeng 1999; Boslan dan Votava 2000), dan kandungan kimianya merupakan bagian penting dalam obat-obatan, pewarna makanan, dan kosmetika (Taychasinpitak dan Taywiya 2003; IISR 2006).
buahnya lebih kecil disbanding cabai merah besar (Messiaen 1992; Rukmana 1996).
Cabai besar (Capsicum annuum L.) termasuk tanaman semusim yang berbentuk perdu, dan mempunyai akar yang menyebar. Penyebaran akarnya dangkal sehigga cabang dan rambut akar banyak terdapat di permukaan tanah, dan semakin ke dalam akar-akar tersebut semakin berkurang. Akar horizontal cepat berkembang di dalam tanah dan menyebar dengan ke dalaman 10 – 15 cm (Messiaen 1992). Tanaman ini mempunyai batang tegak, tingginya 50 – 90 cm dari permukaan tanah. Daun berbentuk lonjong dan bagian ujungnya meruncing. Panjang daun antara 4-10 cm, dan lebarnya antara 1,5 – 4 cm.
Cabai besar berbunga tunggal, yang keluar dari ketiak-ketiak daun. Posisi bunga menggantung, dan memiliki 5-6 daun mahkota bunga. Panjang bunga biasanya 1 - 1,5 cm, lebar 0,5 cm cm dan panjang tangkai bunga 1 – 2 cm. Tangkai putik berwarna putih, panjangnya sekitar 0,5 cm, sedangkan kepala putiknya berwarna kekuning-kuningan. Tangkai sari berwarna putih dengan panjangnya sekitar 0,5 cm. Kepala sari yang belum matang berwarna biru atau ungu (Rukmana 1996).
Berdasarkan data Informasi Hortikultura dan Aneka Tanaman, Departemen Pertanian (2000) produsen terbesar cabai adalah Jawa Timur, Jawa Barat, Jawa Tengah, Sumatera Utara, Nusa Tenggara Barat, dan Sulawesi selatan. Tanaman cabai ini mempunyai nilai ekonomis yang tinggi, sehingga berpeluang besar menjadi salah satu komoditas ekspor yang unggul. Berdasarkan data ekspor komoditi hortikultura, cabai merah telah berhasil diekspor ke Negara Singapura, Taiwan, Emirat Arab dan arab Saudi.
di Indonesia pada tahun 2000 adalah 4,2 ton/ha, sedangkan pada tahun 2004 dan 2005 berturut-turut 5,67 ton/ha dan 5,84 ton/ha (Direktorat Jendral Bina Produksi Hortikultura 2007). Potensi produksi cabai merah dapat mencapai 12-20 ton/ha (Duriat 1996). Jika dibandingkan dengan negara-negara Asia lainnya, daya hasil cabai merah Indonesia tertinggal jauh. Sebagai contoh daya hasil cabai merah Cina mencapai 14,5 ton/ha (Rubatzky dan Yamaguchi 1997).
Banyak faktor yang menyebabkan rendahnya produktivitas cabai di Indonesia di antaranya adalah: penggunaan benih yang kurang bermutu, teknik budidaya yang belum sempurna, dan tingginya serangan hama dan penyakit. Secara umum pertumbuhan dan perkembangan tanaman dipengaruhi oleh faktor genetika dan lingkungan. Kenyataan di lapangan lingkungan pertumbuhan tanaman tidak selalu merupakan yang optimum bagi tanaman, sehingga seringkali tanaman tidak mampu mengekspresikan seluruh potensi genetika yang dimilikinya. Menurut Blum (1982) cekaman lingkungan merupakan faktor yang paling berperan terhadap adanya kesenjangan antara potensi dan hasil aktualnya.
Produksi cabai dapat ditingkatkan melalui program perluasan pertanaman dan intensifikasi budidaya. Kedua program ini sangat membutuhkan benih yang berkualitas, baik secara genetika maupun fisiologis. Benih yang berkualitas genetika tinggi dapat diperoleh melaui persilangan konvensional yang diikuti dengan proses seleksi.
diperoleh dari organisme lain seperti bakteri, virus, binatang dan tanaman lain (Herman 1996).
Teknik penyisipan gen (transformasi gen) akan menghasilkan tanaman transgenik yang kemudian dapat dimanfaatkan sebagai sumber plasma nutfah atau langsung diseleksi menjadi galur harapan. Transformasi gen secara in vitro
dengan menggunakan vektor Agrobacterium akan berhasil dan bermanfaat apabila sudah diperoleh protokol regenerasi tanaman yang efisien dan stabil. Kompetensi untuk beregenerasi yaitu kemampuan membentuk tanaman lengkap (mempunyai tunas dan akar) dan kompetensi untuk ditransformasi merupakan dua kunci penting penentu keberhasilan program transformasi genetika.
Kultur sel atau jaringan dan sistem regenerasinya memegang peranan yang sangat penting di dalam aplikasi bioteknologi atau transformasi genetika untuk program perbaikan tanaman. Beberapa usaha yang dilakukan untuk mencapai sistem regerasi yang efisien adalah dengan menentukan parameter penting yang spesifik pada tanaman (Parrot et al. 1992). Oleh karena itu, sebelum dilakukan transformasi genetika untuk memperoleh tanaman cabai yang tahan terhadap kondisi kekeringan diperlukan adanya sistem regenerasi yang efisien dan stabil.
Perbanyakan Tanaman Cabai Secara In Vitro
Terbatasnya informasi tentang regenerasi langsung atau organogenesis tanaman cabai merah merupakan salah satu indikasi sulitnya tanaman ini untuk diregerasikan secara in vitro. Informasi yang ada umumnya merupakan hasil penelitian terhadap cabai manis atau páprika (Sweet pepper), sehingga penelitian yang dilakukan terhadap cabai merah banyak mengacu kepada hasil penelitian regenerasi tanaman cabai paprika.
Sistem transformasi genetika memerlukan sel/jaringan yang mampu untuk membelah dan dapat diregenerasikan serta dapat ditumbuhkan dalam media seleksi antibiotik atau herbisida yang sesuai dengan gen yang dibawa dalam DNA yang tertransformasi.
beregenerasi membentuk tanaman lengkap bila ditumbuhkan dalam lingkungan yang sesuai (Pierik 1987). George dan Sherington (1984) menyatakan bahwa keberhasilan perbanyakan tanaman dengan metode kultur jaringan dipengaruhi banyak faktor antara lain : sifat genetikaa tanaman, pemilihan bagian tanaman yang digunakan sebagai sumber eksplan, umur eksplan, komposisi media tumbuh, zat pengatur tumbuh, dan lingkungan kultur.
Bagian tanaman cabai yang digunakan sebagai eksplan adalah kotiledon, hipokotil, daun muda, embrio muda, dan embrio matang. Untuk studi regenerasi langsung eksplan kotiledon, hipokotil, dan daun muda banyak digunakan (Hyde dan Philips 1996; Valera-Montero dan Ochoa-Alejo 1992; Philips dan Hubstenberger 1985; Agrawal et al. 1989; Ochoa-Alejo dan Garcia-Bautista 1992; Ebida dan Hu 1993).
Umur eksplan dan orientasi pengambilan eksplan mempengaruhi kemampuan eksplan untuk membentuk tunas secara in vitro (Fari dan Zcako 1981; Kato et al. 1996). Fari dan Zcako (1981) melaporkan bahwa segmen bagian hipokotil dapat terinduksi membentuk tunas, segmen bagian tengah dominan membentuk akar, dan segmen bagian bawah cendrung membentuk kalus yang banyak. Kato et al. (1996) melaporkan bahwa umur kecambah 25 hari merupakan umur terbaik sebagai sumber eksplan daun.
Eksplan daun muda dan hipokotil mempunyai potensi yang sama dalam kapasitasnya untuk membentuk tunas secara in vitro. Perbedaan respon terutama disebabkan oleh perbedaan genotip tanaman (Mahmood et al. 1995). Menurut hasil penelitiannya, Christopher dan Rajam (1996) bahwa eksplan daun lebih konsisten untuk membentuk tunas dibandingkan dengan eksplan hipokotil dan kotiledon. Efisiensi tunas tergantung kepada eksplan yang digunakan (Fari dan Zcako 1981; Zhu et al. 1998).
ditemukan komposisi medium dasar lain yang digunakan terhadap regenerasi tanaman cabai.
Umumnya zat pengatur tumbuh yang paling banyak digunakan untuk regenerasi tanaman cabai adalah komposisi antara BAP dan IAA (Gunay dan Rao 1978; Fari dan Zcako; 1981; Philips dan Hubstenberger 1985; Agrawal et al. 1989; Arroyo dan Revilla 1991; Valer-Monero dan Ochoa-alejo 1992; Mahmood
et al. 1996). Pada studi generasi tanaman cabai secara in vitro kombinasi BAP dan IAA ekstensif digunakan. Penggunaan BAP tinggi dan IAA rendah untuk induksi tunas adventif, BAP rendah dan IAA rendah untuk pemanjangan tunas, dan IAA rendah untuk merangsang perakaran (Gunay dan Rao 1978; Philips dan Hubstenberger 1985). Beberapa laporan juga menyatakan bahwa medium regenerasi tunas yang han ya ditambah dengan BAP saja berhasil dilakukan (Mahmood et al. 1995; Agrawal et al. 1989).
Cekaman Kekeringan pada Tanaman
Cekaman kekeringan merupakan salah satu faktor lingkungan terpenting yang menjadi faktor pembatas pertumbuhan tanaman yang menghambat aktivitas fotosintesis dan translokasi fotosintat (Yakushiji et al. 1998; Savin dan Nicolas, 1996), selanjutnya mempengaruhi produktivitas tanaman. Istilah kekeringan ini menunjukkan bahwa tanaman mengalami kekurangan air akibat keterbatasan air dari lingkungan tumbuhnya yaitu media tanam. Menurut Levit (1980) dan Bray (1997) cekaman kekeringan yang biasa disebut drought stress pada tanaman dapat disebabkan oleh dua hal yaitu (1) kekurangan suplai air di daerah perakaran dan (2) permintaan air yang berlebihan oleh daun akibat laju evapotranspirasi melebihi laju absorpsi air walaupun keadaan air tanah tersedia cukup. Pada lahan kering, cekaman kekeringan pada tanaman terjadi karena suplai air yang tidak mencukupi.
kecepatan fotosintesis dan luas daun. Jika tanaman terkena cekaman kekeringan, potensial air daun akan menurun, pembentukan klorofil daun akan terganggu dan struktur kloroplas akan mengalami disintegnasi (Alberte et al. 1977). Kramer (1983) menjelaskan lebih lanjut bahwa pengaruh cekaman kekeringan pada pertumbuhan vegetatif terutama pada perluasan area daun dan pertumbuhan tunas baru dan nisbah akar-tajuk. Sedangkan pada pertumbuhan reproduktif mengakibatkan ketidaknormalan pembungaan, aborsi embrio, ketidaknormalan perkembangan biji dan buah. Ditambahkan oleh Sloane et al. (1990) bahwa tanaman pada fase perkembangan reproduktif sangat peka terhadap cekaman kekeringan. Kondisi cekaman kekeringan dapat menyebabkan gugurnya bunga, polong, dan biji yang telah terbentuk. Hal ini berhubungan dengan penurunan kecepatan fotosintesis akibat keterbatasan ketersediaan air.
Bray (1997) menyatakan respon tanaman terhadap cekaman kekeringan tergantung pada jumlah air yang hilang, tingkat kerusakan dan lama cekaman kekeringan, dan juga sangat tergantung pada genotipe tanaman, lama dan jenis penyebab kehilangan air, umur dan fase perkembangan, tipe organ dan tipe sel dan bagian-bagian sub seluler. Kehilangan air pada tingkat seluler dapat menyebabkan perubahan konsentrasi senyawa osmotik terlarut, perubahan volume sel dan bentuk membran, perubahan gradien potensial air, kehilangan turgor, kerusakan atau kehancuran integrasi membran dan denaturasi protein. Menurut Savin dan Nicolas (1996), cekaman kekeringan tidak hanya mengurangi laju fotosintesis tetapi juga dapat mengakibatkan terjadinya senesen pada organ-organ fotosintesis. Akibat cekaman kekeringan dapat menyebabkan perbedaan penurunan hasil antara pada tanaman yang peka, dan juga pada tanaman yang toleran tetapi berbeda tingkat penurunannya.
Toleransi tanaman terhadap cekaman kekeringan dapat terjadi jika tanaman dapat bertahan terhadap cekaman yang terjadi dan adanya toleransi atau mekanisme yang memungkinkan menghindari dampak buruk dari situasi cekaman tersebut. Karakter morfologi atau fenotipik (secara konvensional) umumnya digunakan untuk menduga tingkat toleransi tanaman terhadap cekaman kekeringan yaitu dengan mengamati gejala secara visual di tingkat in vitro
perkembangan perakaran, gejala layu sebagian atau keseluruhan pada organ vegetatif atau organ reproduktif, merosotnya hasil panen dan kualitas hasil, serta ketidaktahanan hasil dalam penyimpanan.
Respon Tanaman terhadap Cekaman Kekeringan dengan Penyesuaian Osmotik
Beberapa tanaman dapat mempertahankan tekanan turgor yang tinggi juga pada potensial air yang agak rendah dengan cara meningkatkan potensial osmotik melalui akumulasi zat terlarut yang meningkat di dalam sel. Proses ini disebut penyesuaian osmotik (osmotic adjustment) atau regulasi osmotik. Adanya penyesuaian osmotik, berarti menjaga turgor sel sehingga berarti pula menjaga integritas dan proses fisiologi sitoplasma. Penyesuaian osmotik berpotensi menjaga proses fotosintesis dan pertumbuhan tanaman (Riduan et al 2007).
Naiola dan Syarif (1996) dan Blum (1982) menyatakan bahwa potensial turgor merupakan faktor utama yang mempengaruhi pertumbuhan atau perluasan sel. Jika terjadi akumulasi atau peningkatan senyawa osmotik atau perpindahan K+, maka potensial osmotik menurun, sehingga air berdifusi ke dalam sel dan potensial turgor meningkat. Kandungan air tanaman untuk mempertahankan turgor ini dijaga oleh keseimbangan laju transpirasi dan penyerapan air oleh akar. Jika tanaman mengalami cekaman kekeringan, maka potensial turgor tanaman akan terganggu sebagai akibat ketidakseimbangan antara laju transpirasi yang terjadi dengan jumlah air yang dapat diserap oleh tanaman.
mekanisme efisiensi yaitu penggunaan air yang tersedia secara efisien dan memaksimalkan indeks panen.
Penyesuaian osmotik terjadi pada tanaman yang mengalami cekaman kekeringan secara perlahan dan juga pada cekaman medium. Namun, tidak semua tanaman mengembangkan penyesuaian osmotik sebagai respon terhadap cekaman kekeringan. Penyesuaian osmotik dipegaruhi oleh laju perkembangan cekaman, tingkat cekaman, kondisi lingkungan dan perbedaan genotipe tanaman. Disamping itu penyesuain osmotik melalui perubahan potenasial osmotik dipengaruhi oleh akumulasi senyawa terlarut, ukuran sel, volume senyawa terlarut dan ketebalan dinding sel. Menurut Levitt (1980) dan Blum (1996) penurunan potensial osmotik disebabkan oleh dua hal yaitu akibat menurunnya kadar air pada sel karena terjadi kehilangan air dan karena adanya tambahan akumulasi senyawa terlarut sehingga lebih menurunkan potensial osmotik. Ingram dan Bartels (1996) menyatakan potensial air daun total dapat dipelihara selama cekaman kekeringan sedang, melalui penyesuaian osmotik dengan melibatkan senyawa osmotik kompatibel.
Menurut Ingram dan Bartels (1996) dan Nguyen et al. (1977) senyawa organik terlarut yang terlibat pada penyesuaian osmotik bervariasi, antara lain gula-gula, asam organik, asam amino, dan senyawa terlarut kompatibel. ABA dan prolina merupakan senyawa yang memegang peranan penting untuk toleransi tanaman terhadap cekaman kekeringan (Kim & janick 1991; Hanson et al. 1979)
juga mempunyai peranan lain seperti menetralisir pengaruh toksik NH; hasil hidrolisis protein sebagai sumber energi dan sumber N bagi pemulihan proses tanaman pasca cekaman kekeringan (Levitt 1980).
Prolina dijumpai terakumulasi lebih banyak pada tanaman yang lebih toleran terhadap cekaman kekeringan dibandingkan dengan tanaman yang peka (Kirkham 1990; Yoshiba et al. 1997). Akumulasi prolina merupakan salah satu respon pada tanaman akibat cekaman kekeringan. Hasil penelitian Maesteri et al. (1995) menunjukkan bahwa kandungan prolina pada Coffea arabica clan C. canehora dapat meningkat dua kali lebih bayak pada kondisi cekaman kekeringan dibandingkan dengan tanpa perlakuan kekeringan. Dingkuhn et al. (1991) melaporkan bahwa akumulasi prolina berbeda antar kultivar padi dan berkorelasi negatif dengan potensial air dan berkorelasi positif dengan penyesuaian osmotik.
Delauney dan Verna (1983) menyatakan bahwa ditemukan indikasi korelasi positif antara akumulasi prolina dan adaptasi tanaman terhadap cekaman kekeringan dan garam positif. Oleh karena itu sejumlah peneliti menyatakan bahwa prolina dapat dipertimbangkan sebagai indikator seleksi menyangkut adaptasi tanaman terhadap cekaman lingkungan, terutama cekaman kekeringan dan salinitas (Kuznetsov dan Shevyakova 1997; Yoshiba et al. 1997).
Enzim P5CS adalah senyawa yang mengkatalis biosintesis prolina melalui jalur glutamat pada tanaman. Hasil penelitian menunjukkan bahwa P5CS merupakan penyandi enzim yang menjadi faktor pembatas dalam biosintesis prolina pada tanaman tingkat tinggi (Hu CA et al. 1992). Gen yang menyandi P5CS telah berhasil diisolasi dari berbagai tanaman yaitu dari Vigna aconitifolia (Hu CA et al. 1992), Arabidopsis thaliana dan padi serta ekspresi dan fungsinya telah diteliti. Dalam kondisi salinitas tinggi dan kekeringan, stimulasi biosistesis prolina berkorelasi dengan meningkatnya level P5CS.
Over-ekspresi dari P5CS menghasilkan akumulasi prolina pada tanaman transgenik dan terbukti meningkatkan toleransi tanaman terhadap cekaman kekeringan. Over-produksi prolina mampu meningkatkan secara significan terhadap biomassa akar dan perkembangan bunga pada tanaman transgenik di bawah kondisi cekaman kekeringan atau cekaman osmotik. Transformasi gen P5CS yang berasal dari V. aconitifolia ke tanaman tembakau di bawah kendali promoter konstitutif CaMV 35S, secara nyata terbukti menghasilkan aktivitas enzim P5CS yang lebih tinggi dan meningkatkan produksi prolina 10 sampai 18 kali lebih banyak dibandingkan tanaman non transgenik. Hasil membuktikan bahwa aktivitas enzim P5CS mempunyai peranan penentu dalam sintesis prolina. Hasil penelitian ini menyimpulkan bahwa over-ekspresi gen P5CS mampu meningkatkan kandungan prolina secara nyata dan over-produksi prolina dapat meningkatkan pula toleransi tanaman transgenik tersebut terhadap cekaman kekeringan (Kavi Kishor et al. 1995).
(A) Lintasan biosintesis L-prolina dari L-glutamin:
(B) Berbagai gen penyandi enzim untuk biosintesis L-prolina:
Gambar 3 Lintasan biosintesis L-prolina dari L-glutamin dan berbagai gen penyandi enzim yang diperlukan untuk biosintesis L-prolina. Gen P5CS merupakan gen penyandi enzim kunci dalam biosintesis prolina, yang ekspresinya meningkat dengan adanya cekaman kekeringan (dehidrasi) dan menurun dalam kondisi non-cekaman (rehidrasi)
L-glutamine
(L-glu)
Pyrroline-5- b l t Glutamic-
semialdehy d
L-prolinae
(L-pro)
P5C dehydroge- nase (P5CDH)
Prolinae dehydro- genase (ProDH) Spontan
Pyrroline 5-carboxylase synthetase (P5CS)
P5C reductase (P5CR) Spontan
Dehidrasi
Rehidrasi ABA
L-glu
GSA
P5C
L-pro
P5CDH ProDH
Spontan
P5CS P5CR Spontan
P5CDH gene ProDH gene
P5CS gene
P5CR geneDehidrasi
[image:45.595.115.493.95.296.2]Plasmid pBI-P5CS
Molekul DNA sirkular yang terdapat bebas di dalam sitoplasma sel bakteri dikenal dengan nama plasmid. Plasmid pBI-P5CS merupakan plasmid rekombinan yang digunakan untuk menghasilkan tanaman transgenik. Plasmid ini telah dimodifikasi dari plasmid alami. Plasmid alami direkonstruksi, dikurangi dan ditambah dengan sifat-sifat tertentu sehingga dihasilkan plasmid rekombinan. Plasmid rekombinan ini digunakan sebagai vektor untuk menyisipkan gen-gen ke dalam kromosom sel tanaman. Plasmid rekombinan P5CS, mempunyai promotor konsitutif 35S CaMV, dilengkapi juga gen npt II untuk seleksi ketahanan terhadap antibiotik kanamisin dan gen reporter GUS untuk mendeteksi keberadaan gen dalam jaringan tanaman tertentu. Peta restriksi dari plasmid pBI-P5CS dapat dilihat pada Gambar 4.
[image:46.595.109.511.545.702.2]Plasmid dari bakteri yang satu dapat memasuki sel bakteri lain. Plasmid juga mempunyai kemampuan memperbanyak diri dalam sel bakteri. DNA plasmid mempunyai kisaran ukuran dari 1 kb sampai 200 kb, plasmid ini berlaku sebagai unit genetika pelengkap yang bereplikasi dan diwariskan secara independen dari kromosom bakteri. Plasmid hampir selalu membawa satu gen yang merupakan ciri penting yang ditunjukkan bakteri donor, seperti kemampuan hidup dalam antibiotik tertentu dengan konsentrasi yang biasanya bersifat toksik seperti kanamisin dan higromisin. Hal ini disebabkan adanya plasmid yang membawa gen resistensi di dalam bakteri.
Gambar 4 Peta restriksi plasmid pBI-P5CS
EcoR1
RB LB
NPT II
NPT IINPT II NosNosNos 3”3”3” Nos
NosNos PPP 35S P35S P35S P GUSGUSGUS NosNosNos 3”3”3” P5CS
P5CSP5CS 35S P
35S P35S P P5 CS NosNosNos 3”3”3” 3 5 S P
N os3 ”
NPT II
NPT IINPT II NosNosNos 3”3”3” Nos
NosNosN osPPP N PT I I N os3 ” 35S P35S P35S P GUSGUSGUS NosNosNos 3”3”3” P 3 5 S P GU S N os 3 ”
Sifat-sifat biologi Agrobacterium
Agrobacterium adalah bakteri tanah yang dapat menyebabkan penyakit tumor (crown gall) atau akar rambut (hairy root) pada bagian tanaman terifeksi. Hal ini disebabkan karena bakteri ini mampu menstranfer T-DNA yang terdapat pada plasmid Ti ataupun plasmid Ri ke dalam sel tanaman (Zambryski et al.
1989). Dengan melakukan beberapa modifikasi, kemampuan alamiah
Agrobacterium mentransfer sebagian DNA-nya dapat dimanfaatkan untuk
memindahkan gen tertentu ke dalam tanaman.
T-DNA merupakan bagian dari megaplasmid yang ada dalam
Agrobacterium yaitu Ti-(tumor inducing) plasmid pada A. tumefaciens atau Ri-(root inducing) plasmid pada A. rhizogenes (Winans 1992). Ti-plasmid yang terdapat pada semua isolat virulen A. tumefaciens akan stabil selama