ISOLASI DAN PENCIRIAN PROTEASE DARI
BAKTERI ISOLAT NATO
SELVI YUNINGSIH
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Dibimbing oleh DONDIN SAJUTHI dan YANTI.
ABSTRACT
SELVI YUNINGSIH. Isolation and Characterization of Protease from Isolate
Natto. Supervised by DONDIN SAJUTHI and YANTI.
SELVI YUNINGSIH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Isolasi dan Pencirian Protease dari Bakteri Isolat Nato
Nama mahasiswa : Selvi Yuningsih
NIM : G44201025
Menyetujui:
Pembimbing I,
Pembimbing II,
Prof. drh. Dondin Sajuthi, MST, Ph.D.
Yanti, S. Si, M.Si
NIP 131 536 684 NIP 120 041 094
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr.Ir. Yonny Koesmaryono, M.S
NIP 131 473 999
dimudahkan dan diberi kekuatan untuk menyelesaikan karya ilmiah ini. Shalawat dan salam semoga selalu tercurah kepada suri teladan kita Nabi Muhammad saw. Tema yang dipilih dalam penelitian ini adalah isolasi protease dari pangan fermentasi, dengan judul Isolasi dan Pencirian Protease dari Bakteri Isolat Nato.
Penulis mengucapkan terima kasih kepada Bapak Prof. drh. Dondin Sajuthi MST, Ph.D. dan Ibu Irma Suparto MSi selaku pembimbing dari program studi kimia dan Ibu Yanti MSi selaku pembimbing lapangan dari Atma Jaya yang telah mencurahkan ilmu dan waktunya. Ucapan terima kasih yang tak terhingga teruntuk Ayahanda Momon Juanda, Ibunda Asroriah, aa dan teteh atas segala perhatian, doa, dan dorongannya. Ungkapan terima kasih juga disampaikan kepada semua teknisi dari Atma Jaya (Mas Yudi, Mas Bambang, Mas Ridwan dan Mas Nurdin), Mas Heri, penghuni Bagunde 12 (Mba Wiwin, dan Desi), Rini, teman-teman kimia 38, dan semua pihak yang telah membantu penulis, hingga karya ilmiah ini dapat diselesaikan. Terima kasih atas segala bantuan yang sudah diberikan
Semoga karya ilmiah ini bermanfaat. Amin.
Bogor, Maret 2006
RIWAYAT HIDUP
Penulis dilahirkan di Pandeglang pada tanggal 23 Juni 1983 dari ayah Momon Juanda dan ibu Asroriah. Penulis merupakan putri ketiga dari tiga bersaudara. Tahun 2001 penulis lulus dari SMA Negeri I Menes dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Masuk Seleksi IPB. Penulis memilih Program Studi Kimia, Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR TABEL...viii
DAFTAR GAMBAR ...viii
DAFTAR LAMPIRAN... ix
PENDAHULUAN ... 1
TINJAUAN PUSTAKA Nato... 1
Protease Fibrinolitik... 2
Pemurnian Enzim... 3
SDS-PAGE dan Zimografi... 4
BAHAN DAN METODE Alat dan Bahan... 4
Metode ... 4
HASIL DAN PEMBAHASAN Seleksi Isolat Bakteri Proteolitik ... 6
Pemurnian Enzim... 7
Penentuan Suhu Optimum ... 7
Penentuan pH Optimum... 8
Pengaruh Ion Logam... 8
Pengaruh Inhibibitor ... 9
Penentuan Nilai Km dan Vmaks... 9
Penentuan Bobot Molekul... 10
Zimografi ... 11
SIMPULAN DAN SARAN ... 11
DAFTAR PUSTAKA ... 12
DAFTAR TABEL
Halaman
1 Contoh enzim fibrinolitik dari mikroba beserta karakterisasinya ... 3
2 Komposisi gel pemisah dan penahan SDS-PAGE dan Zimografi ... 6
3 Ringkasan karakterisasi protease dari isolat NA
4... 11
DAFTAR GAMBAR
Halaman
1 Pertumbuhan isolat NA
4pada suhu 37
0C ... 7
2 Pengaruh suhu terhadap aktivitas enzim protease nato... 7
3 Pengaruh pH terhadap aktivitas enzim protease nato ... 8
4 Pengaruh ion logam terhadap aktivitas residu (%) enzim protease nato .. 9
5 Pengaruh inhibitor terhadap aktivitas residu (%) enzim protease nato... 9
6 Kurva Michaelis Menten protease kasar dan dialisat nato... 9
7 Kurva Lineweaver-Burk protease kasar dan dialisat nato... 10
8 Analisis SDS-PAGE 15% protease nato ... 10
9 Analisis zimogram pada berbagai substrat protein ... 11
10 Kurva hubungan konsentrasi dengan absorbansi standar protein ... 15
DAFTAR LAMPIRAN
Halaman
1 Bagan alir penelitian ... 14
2 Aktivitas enzim pada empat isolat nato ... 15
3 Kadar protein pada empat isolat nato... 15
4 Data kurva standar protein ... 15
5 Data presipitasi oleh amonium sulfat nato ... 16
6 Data semipemurnian protease dari isolat NA
4... 16
7 Pengaruh suhu terhadap aktivitas protease kasar dan dialisat nato... 16
8 Pengaruh pH terhadap aktivitas protease kasar dan dialisat nato ... 17
9 Pengaruh inhibitor terhadap aktivitas protease kasar dan dialisat nato... 17
10 Pengaruh ion logam terhadap aktivitas protease kasar dan dialisat nato 17
11 Penentuan kinetika enzim protease kasar dan dialisat nato ... 18
12 Contoh perhitungan aktivitas enzim dan aktivitas enzim spesifik ... 18
13 Kurva standar LMW SDS-PAGE 15% ... 18
14 Komposisi media pertumbuhan dan media produksi protease... 19
1
PENDAHULUAN
Proses fermentasi merupakan suatu proses yang mendayagunakan aktivitas metabolisme suatu mikrob tertentu atau campuran dari beberapa spesies mikrob untuk menghasilkan senyawa tertentu (Rahman 1992). Salah satu pemanfaatan teknologi fermentasi digunakan dalam bidang industri yang menghasilkan pangan fermentasi. Pangan fermentasi merupakan salah satu makanan yang banyak dikonsumsi sebagai menu makanan sehari-hari oleh masyarakat Indonesia karena rasanya yang enak dan harganya yang relatif murah. Contoh makanan fermentasi yang sudah dikenal luas, yaitu tempe, oncom, roti, tauco, dan lain-lain.
Belakangan ini banyak penelitian mengungkapkan bahwa pangan fermentasi merupakan makanan yang baik untuk kesehatan karena banyak mengandung vitamin, asam amino, dan enzim yang diduga diproduksi selama proses fermentasi. Enzim yang diperoleh dari pangan fermentasi diantaranya yaitu enzim fibrinolitik. Penelitian terhadap chungkook-jang, pangan fermentasi tradisional Korea dengan bahan pokok kacang kedelai menemukan bahwa chungkook-jang mengandung enzim protease fibrinolitik yang potensial (Kim et al. 1996). Penelitian yang dilakukan terhadap pangan fermentasi kedelai asal Thailand dari galur Bacillus 38 juga menemukan adanya kandungan enzim fibrinolitik potensial yang terdapat dalam pangan fermentasi asal Thailand tersebut (Chantawannakul et al. 2001).
Berbagai macam enzim fibrinolitik misalnya urokinase, streptokinase, rekombinan plasminogen aktivator jaringan, stafilokinase, dan rekombainan prourokinase telah dipelajari secara luas, namun obat-obat ini harganya mahal dan kemampuannya terbatas (misalnya mudah hancur dan dapat menimbulkan pendarahan). Oleh karena itu, obat-obat penemuan baru anti beku darah yang memiliki keefektifan lebih baik dan efek samping yang lebih rendah sangat diperlukan. Baru-baru ini, lumbrokinase dari cacing L.rubellus menunjukkan potensinya sebagai altenatif obat trombolitik baru yang bersifat aman, tidak toksik, dan tidak menimbulkan efek samping terhadap fungsi jantung, hati, ginjal, sisitem respirasi, dan sistem saraf. Lumbrokinase merupakan enam fraksi protease serin yang diekstraksi dari cacing tanah Lumbricus rubellus (Mihara et al, 1991). Kelebihan lumbrokinase adalah
dosisnya diberikan secara administrasi oral, sedangkan enzim trombolitik komersial lainnya (sterptokinase, urokinase, anistreplase, alteplase, dan lainnya) harus diberikan secara injeksi intravena.
Enzim fibrinolitik dapat juga dihasilkan dan diproduksi dari mikrob, yang bisa diisolasi dari pangan fermentasi. Protease yang dihasilkan oleh mikrob sangat potensial untuk digunakan karena sumbernya yang berlimpah, produksi enzim yang cepat, biaya produksi relatif murah, dan mudah dikontrol. Nato merupakan pangan fermentasi tradisional Jepang dengan bahan pokok kacang kedelai. Bacillus nato diduga memproduksi berbagai enzim, vitamin, dan asam amino selama proses fermentasinya. Kandungan kompleks nato itulah yang memungkinkan nato dipercaya bermanfaat untuk pencegahan dan penyembuhan berbagai penyakit seperti stroke, kanker, osteoporosis, dan juga dipercaya dapat memecah bekuan darah. Sehubungan dengan khasiatnya tersebut, maka nato diduga mengandung komponen enzim protease tertentu terutama protease fibrinolitik yang potensial untuk membantu proses penguraian darah kental atau beku.
Penelitian ini bertujuan mengisolasi bakteri penghasil protease dan melakukan kajian rinci tentang pencirian enzim protease potensial yang dihasilkan pada pangan fermentasi nato.
Hasil penelitian ini diharapkan dapat dijadikan informasi awal mengenai sifat biokimiawi enzim protease nato dan keamanan pemakaiannya sehingga kelak dapat dikembangkan sebagai bahan baku obat-obatan dalam industri biofarmasi.
TINJAUAN PUSTAKA
Nato
Gambar 1 Nato komersial.
Proses pembuatan nato relatif mudah, langkah awal dengan mencuci kacang kedelai dan merendamnya dalam air selama duabelas sampai dengan dua puluh jam. Selanjutnya dikukus selama 6 jam sampai lunak. Sementara itu siapkan jerami kering dan jerami tersebut dimasukkan ke dalam air mendidih untuk sterilisasi pada 100ºC selama 6 menit (Bacilus sp. masih bisa hidup pada kondisi ini). Kemudian nato dimasukkan ke dalam jerami yang sudah steril dan difermentasi pada 40ºC selama 24 jam. Fermentasi nato juga dapat dicampur dengan saus yang berisi gula, garam, yeast, dan sebagainya tergantung dari rasa diinginkan. Nato hasil fermentasi selanjutnya dimasukkan pada suhu 4ºC untuk kemudian dilakukan pengemasan (Japan Tips.net).
Nato selain memiliki rasa yang khas, juga dipercaya sebagai makanan yang baik bagi kesehatan. Penelitian menemukan bahwa nato mengandung suatu senyawa pyrazine, yang tidak hanya memberikan aroma khas untuk nato tetapi juga dapat menurunkan bekuan darah. Ekstrak nato yang mengandung nattokinase dapat juga dijadikan sebagai suplemen diet. Pemberian natokinase secara oral pada tikus dan anjing yang dilakukan dr. Sumi di Jepang (Focus Agustus 2002), menunjukkan adanya aktivitas fibrinolitik. Hal ini mendukung hipotesis bahwa nato dapat menurunkan bekuan darah pada manusia, meskipun belum dilakukan penelitian yang pasti secara medis.
Manfaat nato dalam bidang medis lainnya yaitu dapat mencegah osteoporosis karena nato ditemukan mengandung cukup besar vitamin K. Nato juga mengandung sejumlah zat kimia untuk mencegah kanker, seperti diadzein, genistein, infrabin, fitoestrogen, dan unsur selenium, akan tetapi kebanyakan dari zat-zat kimia ini dapat juga ditemukan pada produk lain kacang kedelai, dan nato juga belum tentu sebagai obat terbaik untuk kanker karena belum ada penelitian sejauh itu. Selain itu, nato diketahui mempunyai efek antibiotik dan digunakan sebagai obat disentri untuk tentara Jepang sebelum perang dunia ke-2,
tetapi belum ada penelitian secara kimia (Focus Agustus 2002).
Protease Fibrinolitik
Enzim fibrinolitik merupakan kelompok enzim protease yang mampu mendegradasi fibrin atau fibrinogen. Dalam tubuh, enzim fibrinolitik atau plasmin diproduksi oleh sel endotel dalam saluran pankreas. Seiring dengan pertambahan usia dan juga pola konsumsi pangan yang tidak seimbang, maka produksi plasmin alami oleh tubuh akan semakin berkurang sehingga kerja sistem fibrinolitik dalam tubuh akan terganggu. Bila hal ini berlangsung terus secara berkala maka akan memicu timbulnya penyakit trombosis yang akhirnya mengarah pada berbagai penyakit degeneratif, seperti stroke, asterosklorosis, hipertensi, dan diabetes (Suhartono 1992).
Berdasarkan reaksi yang dikatalisisnya, enzim ini tergolong hidrolase karena mengakatalis pemecahan substrat dengan pertolongan air (Suhartono 1992).
Protease fibrinolitik yang diperoleh dari mikroba mempunyai kelebihan, yaitu dapat diproduksi dalam jumlah besar, produktifitasnya mudah ditingkatkan dan mutunya lebih seragam dan harganya lebih murah (Stanbury & Whitaker 1984). Hal ini menyebabkan meluasnya penggunaan mikrob sebagai penghasil enzim.
Ward (1983) membagi enzim protease mikroorganisme ke dalam 6 kelompok, yaitu aminopeptidase, karboksipeptidase, proteinase serin, proteinase tiol, proteinase asam, dan proteinase metal (metaloproteinase).
Aminopeptidase mengkatalisis pemecahan protein pada ujung amina bebasnya, sedangkan karboksipeptidase mengkatalisis pemecahan molekul protein pada ujung karboksil bebasnya.
Protease serin ialah protease yang memiliki residu serin pada sisi akifnya. Protease seperti tripsin, kimotripsin, elastase, dan subtilisin termasuk ke dalam golongan ini. Protease golongan ini dihambat diisopropil fosfofluoridat (DPF) karena adanya reaksi DPF dengan gugus hidroksil dari residu serin pada sisi aktif.
3
jenis fisin dan bromelin digolongkan ke dalam golongan ini.
Aktivitas protease logam sangat ditentukan oleh adanya logam sebagai kofaktor enzim, sehingga sering disebut metaloprotease. Metaloprotease merupakan protease yang lazim dihasilkan oleh bakteri. Kehilangan logam pada metaloprotease karena adanya EDTA (senyawa pengkelat logam) akan menyebabkan berkurangnya aktivitas protease tersebut. Pada endopeptidase logam, aktivitas dan kestabilannya ditentukan oleh keberadaan ion Zn2+ dan ion Ca2+.
Protease asam merupakan protease yang mempunyai gugus karboksil pada sisi aktifnya. Aktivitas protease asam ini dihambat oleh p-bromofenasil bromida atau pelarut diazo. Enzim-enzim yang termasuk dalam golongan ini antara lain pepsin, renin dan beberapa protease dari kapang yang aktif pada pH dua sampai pH empat.
Contoh enzim fibrinolitik yang diisolasi dari mikroba beberapa pangan fermentasi disajikan dalam Tabel 1.
Tabel 1 Contoh dan ciri enzim fibrinolitik dari mikrob
Sumber Galur
bakteri Pencirian Refe-rensi Natto (Jepang) B.natto B.firmus NA-1
T dan pH optimum : 40oC dan
7-9 Sumi et al. 1987 Chungkok-jang (Korea) Bacillus sp. CK 11-4
T dan pH optimum: 70oC dan
10.5 BM: 28.2 Kim et al. 1996 Douchi (China) B.amyloli quefaciens DC-4 Protease serin BM 28 Peng et al. 2003 Doen-jang (Korea) Bacillus sp. DJ-4 B.subtilis KH-4
T dan pH optimum: 40oC dan
7-8 Kim & Choi 2000 Pemurnian Enzim
Dalam mempelajari ciri fisis dan biologis suatu enzim untuk memperoleh data yang lebih akurat biasanya diperlukan proses pemurnian. Secara umum pemurnian enzim dilakukan dalam tiga tahap, yaitu ekstraksi,
pemekatan, dan fraksinasi. Metode ekstraksi yang digunakan tergantung pada sumber dan lokasi enzim. Enzim yang dihasilkan dipisahkan dari sel dengan sentrifugasi.
Proses pemisahan dengan sentrifugasi merupakan sistem pemisahan berdasarkan ukuran dan berat molekul. Partikel dengan berat, ukuran, dan bentuk yang berbeda akan mengendap pada kecepatan yang berbeda. Dengan metode ini spora bakteri dan sel dapat dipisahkan pada proses klarifikasi dengan bagian enzimnya. Proses sentrifugasi terhadap enzim-enzim yang bersifat rapuh dilakukan pada suhu rendah, sehingga kehilangan aktivitas enzim dapat dijaga seminimal mungkin (Suhartono 1989).
Pemekatan enzim dilakukan untuk memisahkan protein enzim dari molekul lain seperti lipida dan karbohidrat. Molekul kompleks perlu dipecahkan, jika gugus non protein tempat enzim melekat tidak dibutuhkan untuk aktivitas enzim. Metode pemekatan yang sering digunakan adalah presipitasi dengan garam, pelarut organik, dialisis, dan ultrafiltrasi.
Metode presipitasi dengan garam (ion garam yang ditambahkan) mempengaruhi kelarutan protein. Ketika konsentrasinya rendah, ion-ion ini akan mengelilingi molekul protein dan mencegah bersatunya molekul-molekul ini, sehingga protein larut dan disebut salting in. Jika konsentrasinya tinggi, terjadi peningkatan muatan listrik disekitar protein yang akan menarik mantel air dari koloid protein. Interaksi hidrofobik diantara sesama molekul pada suasana ionik yang tinggi akan menurunkan kelarutan protein dan disebut salting out. Presipitasi dengan salting out dilakukan pada suhu rendah (4ºC). Enzim yang telah menggumpal dipisahkan dari supernatan dengan sentrifugasi atau penyaringan/filtrasi. Enzim ini masih belum murni dan tercampur dengan protein lainnya, walaupun sudah bebas dari kontaminan non protein (Suhartono 1989). Sisa garam dari proses presipitasi enzim dihilangkan dengan dialisis.
difusi selektif yang melewati membran selofan. Selofan yang membungkus larutan protein memungkinkan bufer dan molekul kecil seperti garam dengan bebas keluar selofan melalui pori-pori. Larutan di uar selofan adalah larutan yang memiliki konsentrasi yang lebih kecil agar molekul dapat berdifusi keluar.
SDS-PAGE dan Zimografi
Elektroforesis didefinisikan sebagai perpindahan partikel-partikel bermuatan karena pengaruh medan listrik. Beberapa jenis elektrofesis yang dikenal antara lain elektroforesis kertas, elektroforesis selulosa asetat atau selulosa nitrat, dan elektroforesis gel. Elektroforesis yang bermanfaat bagi pemisahan protein dan asam nukleat adalah elektroforesis gel, sedangkan jenis elektroforesis lainnya bermanfaat dalam pemisahan molekul yang lebih kecil. Bentuk elektroforesis gel dapat berupa kolom atau lempengan (slab). Jenis gel yang biasa digunakan antara lain gel pati, gel agarosa, dan gel poliakrilamida. Gel poliakrilamida merupakan polimer yang disusun oleh akrilamida dan N,N'-metilena-bis-akrilamida yang berpolimerisasi dengan bantuan suatu katalis atau sistem radikal bebas, seperti amonium persulfat dan katalis N,N,N',N'-tetrametiletilenadiamin (TEMED).
Elektroforesis gel poliakrilamida sodium dedosil sulfat (SDS-PAGE) merupakan teknik elektroforesis yang paling banyak digunakan untuk analisis campuran protein. Mekanisme pada SDS-PAGE yaitu protein akan bereaksi dengan SDS yang merupakan detergen anionik membentuk kompleks yang bermuatan negatif. Protein akan terdenaturasi dan terlarut membentuk kompleks berikatan dengan SDS yang berbentuk elips atau batang yang ukurannya sebanding dengan berat molekul protein. Protein dalam bentuk kompleks yang bermuatan negatif ini dipisahkan berdasarkan muatan dan ukurannya secara elektroforesis di dalam matriks gel poliakrilamida. Berat molekul protein dapat diukur dengan menggunakan protein standar yang telah diketahui bobot molekulnya dengan cara membandingkan nilai mobilitas relatif (Rf) (Smith 1980). Zimografi adalah teknik elektroforesis untuk menetapkan aktivitas proteolitik. Berbeda dengan SDS-PAGE, gel pemisah disispi substrat protein yang akan dihidrolisis oleh protease selama masa inkubasi. Enzim dipisahkan dalam gel denaturasi (SDS),
namun dalam kondisi tidak tereduksi. Penambahan detergen Triton X-100 akan melepaskan SDS dan kembali terjadi pelipatan protein (renaturasi). Gel diwarnai dengan coomassie blue, dan molekul yang memiliki aktivitas proteolitik tampak sebagai pita bening. Metode zimografi bersifat mudah, sensitif, dan kuantitatif dalam menganalisis aktivitas proteolitik.
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan adalah spektrofotometer UV/VIS (Optima), pH meter Orion, sentrifugasi mikro berpendingin Beckmann, otoklaf, inkubator, neraca analitik, oven, perangkat elektroforesis, deep-freezer, pipet mikro dan tipnya, tabung ependrof, tabung mikro, cawan petri, jarum ose, dan alat-alat gelas lainnya.
Bahan-bahan yang digunakan, yaitu nato, substrat protein (kasein hammarsten), standar L-tirosina, bovine serum albumin (BSA) fraktion V (Merck), amonium sulfat, polietilena glikol, bufer fosfat pH 7.0, pereaksi Folin Ciocalteau, garam NaCl, bufer tris-HCl 1 M (pH 6.8 dan 8.8), HCl 0.1 M, etilen diamiana tetra asetat (EDTA), inhibitor fenil metil sulfonil fluorida (PMSF), N-p-tosil-L-lisin klorometil keton (TLCK), soybean tripsin inhibitor (STI), sodium dodesil sulfat (SDS) 10% b/v, gliserol 15% v/v, akrilamida, N,N'-bis-akrilamida, amonium persulfat 10% b/v, N,N,N',N'-tetrametiletilenadiamin (TEMED), biru
bromfenol 1% b/v, glisin, fibrin,
merkaptoetanol, coomassie brilliant blue R-250, pereaksi Bradford, standar marker low molecular weight (LMW), metanol, asam asetat glasial, bufer elektroforesis, trichloroacetic acid (TCA), larutan pewarna dan peluntur, media skim milk agar (SMA), media luria bertani both (LB). Komposisi media dan pereaksi kimia secara lengkap terlihat pada Lampiran 2 dan 3.
Metode
Pemilahan dan Produksi Protease
5
Isolasi Mikrob. Tahapan awal untuk isolasi mikrob penghasil protease, yaitu dengan mengambil 10% b/v sampel nato yang telah dicampur dengan garam fisiologis (0.85% NaCl). Kultur disuspensi kemudian disebarkan pada media skim milk agar (SMA) yang steril, lalu diinkubasi selama 2 hari pada suhu 37ºC dan diamati adanya koloni mikrob yang memiliki zona bening. Koloni mikrob dipindahkan ke media SMA baru untuk isolasi sampai didapat mikrob koloni tunggal. Koloni tunggal yang dihasilkan kemudian disimpan dalam gliserol 15% sebagai stok bakteri untuk pengujian selanjutnya.
Produksi Protease. Sebanyak 2 ose bakteri diambil dari stok bakteri, lalu ditumbuhkan ke dalam 25 ml media LB steril yang telah ditambahkan 10 ml susu skim steril. Inkubasi selama 2 hari pada suhu 37ºC pada inkubator goyang dengan kecepatan 180 g. Media produksi yang telah mengandung protease kemudian disentrifugasi dengan kecepatan 7500 g selama 15 menit pada suhu 4ºC. Supernatan yang diperoleh merupakan ekstrak enzim kasar. Diagram alir penelitian secara lengkap terdapat pada Lampiran 1.
Pemurnian Enzim
Ekstrak enzim kasar dipresipitasi dengan garam amonium sulfat sampai dicapai kondisi optimum, lalu didialisis dengan menggunakan kolom PD-10 untuk menghilangkan pengaruh garam. Hasil dialisat (eluat enzim) digunakan untuk pencirian lebih lanjut.
Analisis Aktivitas Protase dan Kadar Protein
Aktivitas protase secara kuantitatif diukur dengan modifikasi metode Bergmeyer dan Grassl (1983)dengan menggunakan substrat kasein Hammarsten (2% b/v). Tedapat tiga perlakuan analisis yang dilakukan, yaitu blanko, standar, dan sampel. Larutan enzim yang sudah dipanaskan pada suhu dan waktu inkubasi tertentu (yang menghasilkan aktivitas maksimum) ditambahkan ke dalam tabung ependrof yang berisi 250 µl 50 mM bufer universal pH 7. Perlakuan pada blanko dan standar, enzim digantikan dengan akuades dan tirosine 5 mM.
Larutan diinkubasi pada variasi suhu 50ºC selama 10 menit ( suhu dan waktu inkubasi optimum enzim). Reaksi hidrolisis dihentikan dengan cara penambahan 500 µl TCA 0.1 M. Pada blanko dan standar ditambahkan 50 µl larutan enzim, sedangkan pada sampel
ditambahkan 50 µl akuades, kemudian larutan diinkubasi kembali pada suhu 37ºC selama 10 menit, dilanjutkan dengan sentrifugasi pada kecepatan 6000 g dan suhu 4ºC selama 10 menit.
Supernatan sebanyak 375 µl ditambahkan ke dalam tabung berisi 1.25 ml Na2CO3 0.4 M
dan pereaksi Folin Ciocalteau, lalu diinkubasi kembali pada suhu 37ºC selama 20 menit. Absorbans larutan diukur pada panjang gelombang 578 nm.
Analisis Kadar Protein
Kadar protein ditentukan dengan metode Bradford (1976), menggunakan bovine serum albumin (BSA) sebagai standar protein. Sebanyak 100 µl enzim ditambahkan ke dalam tabung yang berisi 1 ml akuades dan 1 ml pereaksi Bradford. Perlakuan pada blanko, larutan enzim diganti dengan akuades. Selamjutnya larutan tersebut divorteks dan didiamkan selama 20 menit pada suhu ruang. Absorbans larutan diukur pada panjang gelombang 595 nm.
Larutan enzim pada kurva standar protein diganti dengan BSA Fraktion V dengan kisaran konsentrasi 0-250 µg/ml. Konsentrasi protein larutan enzim ditentukan berdasarkan persamaan garis linier hubungan antara konsentrasi standar protein dan absorbans. Kurva standar protein terlihat pada Lampiran 6.
Pencirian Enzim
Pencirian enzim protease diuji secara kuantitatif dengan metode spektrofotometri (Bregmeyer 1983), yang meliputi pengaruh suhu dan waktu stabilitasnya, pengaruh pH optimum, pengaruh inhibitor, pengaruh ion logam, kinetika enzim, uji kualitatif dengan uji SDS-PAGE, dan zimografi.
Pengaruh enzim terhadap suhu. Penentuan suhu optimum dilakukan dengan uji aktivitas enzim pada berbagai suhu (30-80ºC) dalam bufer universal pH 7.0.
secara kuantitatif. Inhibitor yang digunakan, yaitu PMSF, EDTA, TLCK, dan STI.
Pengaruh ion logam. Pengaruh aktivitas protease terhadap ion logam dilakukan dengan cara inkubasi 100 µl enzim dan 100 µl larutan ion logam dengan konsentrasi akhir 5 mM selama satu jam pada suhu ruang, lalu diuji aktivitas residunya secara kuantitatif. Logam yang digunakan, yaitu KCl, NaCl, CaCl2,
MgCl2, dan ZnCl2.
Kinetika enzim. Analisis Km dan Vmaks dilakukan pada suhu dan pH optimum dengan berbagai variasi konsentrasi kasein (0.1, 0.5, 1.0, 1.5, dan 2.0)% b/v, lalu dianalisis aktivitas residunya secara kuantitatif.
Analisis SDS-PAGE dan Zimogran
Elektriforesis gel poliakrilamida yang dikombinasikan dengan suatu deterjen soduim dodesil sulfat (SDS) digunakan untuk memisahkan dan meneliti jumlah dan ukuran (bobot molekul) rantai protein dan rantai subunit protein. Zimografi merupakan salah satu teknik elektroforesis yang bertujuan untuk mendeteksi aktivitas enzim proteolitik secara langsung.
Tahapan kerja yang dilakukan dalam analisis SDS-PAGE dan zimografi meliputi penyiapan gel pemisah dan penahan, preparasi sampel dan loading, kondisi running, pewarnaan gel, dan pelunturan warna. Penyaipan gel pemisah dan penahan. Pembuatan gel pemisah 15% dan gel penahan 4% untuk SDS-PAGE dan zimografi dilakukan dengan komposisi yang tertera pada Tabel 2.
Preparasi sampel dan loading. Khusus SDS-PAGE, 20 µl sampel ditambahkan dengan 5 µl bufer sampel yang mengandung 2-merkaptoetanol, lalu dipanaskan pada suhu 100ºC selama 3-5 menit. Sampel pada
zimografi dilarutkan dalam bufer sampel yang tidak mengandung 2-merkaptoetanol dan tidak mengalami perlakuan pemanasan. Tiap sampel diinjeksikan ke dalam sumur gel dengan kisaran volume 10-20 µl, sedangkan volume marker LMW yang digunakan sebanyak 5 µl.
Kondisi running, pewarnaan, dan pelenturan warna. Gel dijalankan pada tegangan 100 V selama 1.5 jam dalam bufer elektoforesis. Pada SDS-PAGE, setelah elektroforesis, gel langsung diwarnai dengan menggunakan larutan pewarna (coomassie brilliant blue R-250) selama 15 menit. Pelenturan warna pada gel dilakukan dengan larutan peluntur berulang kali sampai
diperoleh pita protein biru dengan latar gel bening. Sementara pada zimografi, setelah elektroforesis, gel didenaturasi terlebih dahulu dalam larutan Triton X-100 2.5% v/v sambil digoyang selama 1 jam. Kemudian gel didigesti dalam 50 mM bufer universal pH 7 dan suhu 50ºC (kondisi suhu dan pH optimum enzim) selama 30 menit. Gel diwarnai dengan larutan pewarna (coomassie brilliant blue R-250) selama 15 menit. Pelunturan warna gel dilakukan dengan larutan peluntur berulang kali sampai diperoleh pita enzim proteolitik putih dengan latar gel biru.
Tabel 2 Komposisi gel pemisah dan gel penahan SDS-PAGE dan zimografi
Gel pemisah 15% (ml) Pereaksi
SDS-PAGE
Zimografi
Gel penahan 4% (ml) Larutan A 2.50 ml 2.50 ml 0.67 ml Larutan B 1.25 ml 1.25 ml -
Larutan C - - 1.25 ml
Susbtrat - 1.00 ml -
Akuades 1.25 ml 0.25 ml 3.00 ml Amonium
persulfat
100 µl 100 µl 50 µl
TEMED 10 µl 10 µl 5 µl
Total 5.00 5.00 5.00
HASIL DAN PEMBAHASAN
Seleksi isolat bakteri proteolitik
Hasil penapisan bakteri nato diperoleh empat isolat terpilih yang secara konsisten membentuk zona bening pada medium SMA yang diberi kode NA1, NA2, NA3, dan NA4.
NA4 merupakan isolat yang digunakan pada
penelitian ini berdasarkan aktivitas protease dan kadar proteinnya yang lebih tinggi dibandingkan dengan isolat lainnya, yaitu 0.2263 U/ml dan 0.1212 mg/ml seperti terlihat pada Lampiran 4 dan 5.
Produksi protease dilakukan pada media LB. Enzim yang telah dihasilkan oleh bakteri dipisahkan dari sel bakteri dengan menggunakan sentrifugasi. Melalui teknik ini, sel akan mengendap oleh adanya gaya gravutasi sedangkan enzim tetap terdapat pada supernatan. Sentrifugasi dilakukan pada suhu rendah untuk mencegah terjadinya kerusakan struktur enzim.
Gambar 2 menunjukkan isolat NA4, dari
7
lingkaran zona bening di sekeliling koloni mikrobnya pada media skim milk agar (SMA) suhu 37ºC, sehingga dapat digunakan sebagai sumber produksi enzim.
Gambar 2 Pertumbuhan isolat NA4 pada suhu
37ºC.
Pemurnian Enzim
Tahap awal pemurnian enzim ialah dilakukan presipitasi pada ekstrak kasar protease menggunakan amonium sulfat. Konsentrasi amonium sulfat yang digunakan ialah 75%, karena pada konsentrasi tersebut memberikan kadar protein terendah pada supernatan dan aktivitas tertinggi pada pelet, yaitu 0.1314 mg/ml, dan 0.367 U/ml (Lampiran 5). Pengaruh garam pada protein enzim dari hasil presipitasi dihilangkan dengan cara dialisis nitroselulosa asetat (cut-off 10 kD).
Pengukuran aktivitas protease pada penelitian ini menggunakan metode Bergmeyer (1983). Prinsip kerja metode ini ialah kasein akan terhidrolisis oleh protease dengan bantuan air menjadi peptida dan asam amino. Laju pembentukan peptida dan asam amino tersebut dapat dijadikan tolak ukur aktivitas katalisis protease. Asam amino yang terbentuk harus dipisahkan dari substrat yang tidak terhidrolisis. Umumnya pemisahan ini dilakukan dengan penambahan TCA (trichloroacetic acid). Penambahan TCA tersebut menyebabkan produk yang mengandung peptida dan asam amino akan larut dalam TCA, sedangkan protein yang terhidrolisis akan mengendap. Penambahan TCA ini sekaligus akan menginaktifkan enzim protease. Penambahan Na2CO3 bertujuan
mendapatkan pH sekitar 11.5 yang merupakan optimum untuk intensitas dan stabilitas warna. Warna yang terbentuk diukur absorbansnya pada daerah sinar tampak 578 nm. Besarnya serapan berbanding lurus dengan konsentrasi protein yang terhidrolisis.
Aktivitas enzim protease meningkat pada berbagai tahap pemurnian (Lampiran 8). Aktivitas enzim protease terendah terdapat pada crude yang merupakan enzim protease
kasar dengan aktivitas 0.2263 U/ml. Aktivitas protease tertinggi terdapat pada dialisat, yaitu 0.3516 U/ml dengan tingkat kemurnian 1.85 kali dibanding protease kasar.
Penentuan suhu optimum
Umumnya setiap enzim memiliki aktivitas maksimum pada suhu tertentu, aktivitas enzim akan semakin meningkat dengan bertambahnya suhu hingga suhu optimum tercapai. Setelah itu kenaikan suhu lebih lanjut akan menyebabkan aktivitas enzim menurun. Gambar 3 menunjukkan pengaruh suhu terhadap enzim protease natto pada ekstrak enzim kasar dan dialisat. Aktivitas protease kasar nato mencapai optimum pada suhu 70ºC dalam 50 mM bufer fosfat pH 7 dengan nilai 0.2669 U/ml, sedangkan suhu optimum dialisat dicapai pada suhu 50ºC (Lampiran 9).
0 0.1 0.2 0.3 0.4
37 50 70 80
Suhu (C) A kt ivi tas p ro tea se kasar (U /m l) 0 0.1 0.2 0.3 0.4 Akt ivi tas d ial si a t ( U /m l)
protease kasar (U/ml) dialisat (U/ml)
Gambar 3 Pengaruh suhu terhadap aktivitas enzim protease nato.
Perbedaan suhu optimum antara dialisat dan ekstrak enzim kasar ini disebabkan karena pada ekstrak enzim kasar masih terdapat biomolekul lain selain protein atau kontaminan-kontaminan yang ikut mempengaruhi aktivitas enzim sehingga suhu optimum yang dicapai lebih tinggi dibanding dialisat. Suhu di bawah suhu optimum aktivitas enzimnya rendah, hal ini disebabkan oleh rendahnya energi aktivasi yang tersedia. Aktivitas enzim mencapai kondisi yang maksimum saat suhu optimum ketika energi kinetik enzim dan substrat mencapai titik untuk bereaksi secara sempurna. Ketika suhu dinaikkan lagi di atas suhu optimum enzim terjadi penurunan aktivitas enzim karena energi kinetika molekul-molekul enzim menjadi demikian besar sehingga dapat mempengaruhi struktur 3D disertai hilangnya aktivitas hayati.
hasil fermentasi kedelai) ialah 70ºC (Kim et al. 1996). Penelitian lain yang dilakukan Chantawannakul et al. (2001) melaporkan suhu optimum protease fibrinolitk dari strain Bacillus 38 isolat fermentasi kedelai asal Thailand dicapai pada suhu 47ºC.
Suhu mempengaruhi laju reaksi katalisis dengan dua cara. Pertama, kenaikan suhu akan meningkatkan energi molekul substrat dan pada akhirnya meningkatkan laju reaksi enzim. Peningkatan suhu juga berpengaruh terhadap perubahan konformasi substrat sehingga sisi aktif substrat mengalami hambatan untuk memasuki sisi aktif enzim dan menyebabkan turunnya aktivitas enzim. Kedua, peningkatan energi termal molekul yang membentuk struktur protein enzim itu sendiri akan menyebabkan rusaknya interaksi-interaksi nonkovalen (ikatan hidrogen, ikatan van der Waals, ikatan hidrofobik, dan interaksi elektrostatik) yang menjaga struktur 3D enzim secara bersama-sama sehingga enzim mengalami denaturasi. Denaturasi menyebabkan struktur lipatan enzim membuka pada bagian permukaannya sehingga sisi aktif enzim berubah dan terjadi penurunan aktivitas enzim (Hames dan Hooper 2000).
Penentuan pH optimum
Enzim merupakan protein yang memiliki gugus amino dan karboksil pada molekulnya. Seperti halnya protein, semua reaksi enzimatis juga dipengaruhi pH sehingga diperlukan bufer untuk mengontrol pH reaksi.
Gambar 4 memperlihatkan pengaruh pH terhadap aktivitas enzim protease kasar dan dialisat nato, pH optimum yang dicapai sama, yaitu pada pH 4. Ketika pH 3 aktivitas enzim masih kecil, yaitu 0.993 U/ml untuk ekstrak enzim kasar (aktivitas relatif 30.26%), dan 0.221 U/ml untuk dialisat dengan aktivitas relatif hanya mencapai 11.26% dari kondisi optimum seperti terlihat pada Lampiran 10. Aktivitas enzim yang kecil ini menunjukkan gugus fungsional pada sisi aktif enzim terganggu dengan adanya ion H+ yang berlebihan pada pH 3. Saat pH 4 enzim mencapai tingkat ionisasi yang diinginkan enzim sehingga aktivitas enzim mencapai maksimum. Sedangkan pada pH 5 sampai pH 7 aktivitas enzim mengalami penurunan sedikit (nilai aktivitas relatif yang tersisa lebih dari 60%) sehubungan dengan perubahan ionisasi gugus-gugus fungsionalnya karena pada hakekatnya enzim adalah protein yang tersusun atas asam amino yang dapat
mengadakan ionisasi (mengikat) dan melepaskan proton atau ion hidrogen pada gugus amino, karboksil dan gugus fungsional lainnya. Pada pH 10 aktivitas enzim mengalami penurunan yang ekstrim, aktivitas relatif yang tersisa 8.78% untuk protease kasar dan 31.60% untuk dialisat, hal ini disebabkan karena ion OH- yang berlebihan.
0 0.1 0.2 0.3 0.4 0.5
3 4 5 6 7 10
pH A k ti vi ta s p ro tease kasa r (U /m l) 0 0.1 0.2 0.3 0.4 A kt ivi tas d ial isat (U /m l)
protease kasar (U/ml) dialisat (U/ml)
Gambar 4 Pengaruh pH terhadap aktivitas enzim protease nato.
Hasil uji fibrinolitik pH optimum dari protease dari strain Bacillus sp. CK 11-4 yang diisolasi dari chungkook-jang (makanan tradisional Korea hasil fermentasi kedelai) didapatkan pada pH 6.5 (Kim et al. 1996). Chantawannakul et al. (2001) melaporkan pH optimum protease fibrinolitk dari galur Bacillus 38 isolat fermentasi kedelai asal Thailand dicapai pada pH 10.5.
Pengaruh ion logam
Beberapa enzim membutuhkan ion logam sebagai kofaktor untuk mendukung efisiensi katalitik enzim. Logam tersebut membantu reaksi katalitik dengan cara mengikat substrat pada sisi pemotongan. Selain berperan dalam pengikatan antara enzim dengan substrat, beberapa logam juga dapat mengikat enzim secara langsung untuk menstabilkan konformasi aktifnya atau menginduksi formasi situs pengikatan atau situs aktif suatu enzim (Devlin 1982).
9
protease kasar dan dialisat nato karena ion logam tersebut mampu menghambat aktivitas enzim hingga aktivitas residu yang tersisa kurang dari 25%.
0 20 40 60 80 100 120 140 160
Kontrol K Na Ca Mg Zn
Ion logam (5 mM)
A k ti v ita s r e s id u ( % )
protease kasar(%) dialisat (%)
Gambar 5 Pengaruh ion logam terhadap aktivitas residu (%) enzim protease nato.
Pengaruh Inhibitor
Inhibitor merupakan senyawa yang dapat menghambat aktivitas enzim. Penambahan senyawa penghambat aktivitas merupakan salah satu metode untuk mengidentifikasi enzim.
Gambar 6 menunjukkan PMSF dan STI sama-sama menghambat dengan kuat aktivitas ekstak kasar dan dialisat nato hingga aktivitas residunya kurang dari 15% untuk dialisat dan bahkan nol atau kehilangan aktivitas untuk ekstrak kasar nato (Lampiran 11). Adanya penghambatan aktivitas enzim oleh PMSF dan STI ini menunjukkan bahwa protease nato tergolong ke dalam protease serin serupa tripsin.
0 50 100 150
Kontrol EDTA PMSF STI TLCK
Inhibitor A k ti v ita s r e s id u e n z im (% )
Protease kasar Dialisat
Gambar 6 Pengaruh inhibitor terhadap aktivitas residu (%) enzim protease nato.
EDTA menghambat aktivitas protease kasar nato dengan kuat hingga tersisa 3.80% aktivitas residunya dari kontrol. EDTA tidak menghambat aktivitas dialisat nato karena masih tersisa aktivitas residu 70.97%. Hal ini disebabkan pada tahap pemurnian saat
dialisis, molekul-molekul kecil yang berukuran <10 kD termasuk ion logam, inhibitor, dan peptida kecil lainnya dapat dipisahkan dari enzim. Dengan demikian EDTA tidak menghambat kuat aktivitas dialisat karena enzimnya sudah bebas dari ion-ion logam.
Chantawannakul et al. (2001) melaporkan inhibitor yang menghambat aktivitas protease fibrinolitik dari galur Bacillus 38 isolat fermentasi kedelai asal Thailand yaitu 1,10 fenantrolin dan diidentifikasi sebagai metaloprotease.
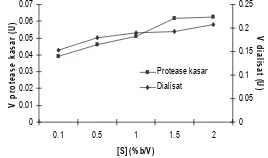
Penetuan Nilai Km dan Vmaks
Penetuan nilai Km dan Vmaks berguna untuk menentukan kinetika enzim sehingga dapat diketahui seberapa besar ikatan enzim dan subsrat dan seberapa cepat enzim dapat melakukan aktivitas. Penetuan nilai Vm dan Km dilakukan dengan cara mengukur kecepatan awal enzim protease pada berbagai konsentrasi substrat.
Perhitungan Km dan Vmaks menggunakan kurva Menten. Kurva Michaelis-Menten menyatakan adanya hubungan kuantitatif antara konsentrasi substrat dan kecepatan reaksi enzimatik.
Gambar 7 menunjukkan bahwa kenaikan konsentrasi substrat akan diikuti dengan kenaikan kecepatan reaksi enzimatiknya, hingga tercapai suatu titik batas yang membuat kecepatan meningkat sedemikian kecil. Nilai dugaan Km dan Vmaks dapat diperoleh dengan menggunakan kurva Michaelis-Menten itu, tetapi sangat sulit untuk menentukan Vmaks dengan tepat. Nilai Vmaks dari kurva Michaelis-Menten tidak akan pernah diketahui nilai sebenarnya. Oleh sebab itu diperlukan cara lain untuk memperoleh nilai Km yang lebih tepat, yaitu memetakan data dengan memanfaatkan transformasi aljabar persamaan Michaelis-Menten yang disebut persamaan Lineweaver-Burk. 0 0.01 0.02 0.03 0.04 0.05 0.06 0.07
0.1 0.5 1 1.5 2 [S] (% b/V)
V p ro teas e k asa r (U ) 0 0.05 0.1 0.15 0.2 0.25 V d ialis at ( U ) Protease kasar Dialisat
66 45 36 Gambar 8 menunjukkan persamaan
Lineweaver-Burk protease nato pada berbagai tahap pemurnian. Nilai Km dan Vmaks dari protease kasar ialah 0.0483 dan 17.2711 U. Dialisat mempunyai nilai Km 0.0813 dan Vmaks 3.067 U (Lampiran 13).
y = 0.0028x + 0.0579
R2 = 0.8683
0 0.02 0.04 0.06 0.08 0.1
0 2 4 6 8 10 12
1/[S] (% b/V)
1/ V ( U ) (a)
y = 0.0028x + 0.0579 R2 = 0.8683
0 0.01 0.02 0.03 0.04 0.05 0.06 0.07 0.08 0.09 0.1
0 2 4 6 8 10 12 1/[S] (% b/V)
1/ V ( U ) (b)
Gambar 8 Kurva Lineweaver-Burk (a) protease kasar, (b) dialisat nato.
Nilai Km protease kasar lebih rendah dari nilai Km dialisat. Hal ini dapat diartikan bahwa reaksi enzim pada ekstrak kasar dengan substratnya dalam membentuk kompleks enzim-substrat (E-S) lebih mudah terjadi dibandingkan dengan reaksi dialisat dengan substratnya. Nilai Km yang lebih kecil menunjukkan bahwa energi yang diperlukan untuk memulai terjadinya reaksi enzimatik lebih sedikit sehingga reaksi lebih mudah terjadi. Vmaks dialisat lebih rendah daripada ekstrak protease kasar. Hal ini menandakan bahwa secara keseluruhan laju reksi enzimatik ekstrak protease kasar lebih tinggi dari dialisat
Penentuan Bobot Molekul
Penentuan bobot molekul dari protease nato pada setiap tahap pemurnian menggunakan metode SDS-PAGE 15%, yang merupakan metode yang sudah digunakan secara luas. Elektroforesis dilakukan di ruang dingin untuk menghindari denaturasi protein
enzim. Running dalam penelitian ini dilakukan selama satu setengah jam denga voltase dan arus yang digunakan masing-masing 100 Volt dan 400 A. Pada tahap ini, protein yang lebih kecil melintasi gel lebih cepat daripada protein yang lebih besar. Ada hubungan linier antara bobot molekul dengan pergerakan molekul. Kurva standar LMW SDS-PAGE secara lengkap terlihat pada Lampiran 12.
Gambar 9 menunjukkan analisis SDS-PAGE protease nato pada berbagai tahap pemurnian. Dari gambar diperoleh protease nato mempunyai 3 pita protein dengan bobot molekul antara 14 sampai 43 kD. Ekstrak enzim kasar nato dengan bobot molekul masing-masing 42.88, 17.74, dan 14.64 kD, sedangkan hasil presipitasi dan dialisis bobot molekul yang didapatkan sama, yaitu 30.36, 19.90, dan 14.64 kD.
kD kD
(a) (b)
kD kD
(b) (d)
Gambar 9 Analisis SDS-PAGE 15% (a) ekstrak protease kasar, (b) presipitat, (c) dialisat, (d) marker LMW.
Penentuan bobot molekul dari strain
Bacillus sp. CK 11-4 yang diisolasi dari
11
hasil fermentasi kedelai) dengan SDS-PAGE yang dilakukan Kim et al. (1996) diperoleh satu pita protein dengan berat molekul 28.2 kD, sedangkan pada makanan tradisional China (douchi) dari galur B amyloliquefaciens DC-4, yaitu 28 kD bobot molekulnya (Peng et al. 2003).
Zimografi
Analisis zimografi dilakukan untuk mengetahui aktivitas proteolitik enzim. Substrat yang digunakan yaitu kasein, albumin, fibrin, dan gelatin. Zimogram kasein dan gelatin diaplikasikan pada analisis protease terutama untuk kuantifikasi metaloproteinase, sedangkan zimogram fibrin untuk identifikasi enzim fibrinolitik.
Gambar 10 menunjukkan gel hasil analisis zimogram 15% pada berbagai substrat protein. Dari gambar dapat dilihat bahwa enzim dapat mendegradasi substrat kasein dan gelatin dengan terbentuknya pita bening pada hasil zimogram. protease nato dapat diidentifikasi sebagai metaoloproteinase berdasar analisis zimogram. Hal ini sama dengan penentuan pengaruh inhibitor terhadap protease nato, yaitu ekstrak enzim kasar aktivitasnya dihambat oleh EDTA yang mencirikan ke dalam metaloprotease.
(a) (b)
(c) (d)
Gambar 10 Analisis Zimogram 15% pada berbagai substrat (a) gelatin, (b) albumin (c) kasein, dan (d) fibrin.
Analisis fibrinolitik menunjukkan hasil yang positif pada protease nato berbagai tahap
pemurnian dengan adanya 2 pita pada zimo fibrin. Berdasar hasil zimogram maka dapat disimpulkan bahwa protease nato memilki aktivitas fibrinolitik yang potensial. Analisis zimografi terhadap substrat albumin menunjukkan enzim tidak dapat mendegradasi albumin dengan tidak adanya pita bening. Ringkasan pencirian protease dari isolat bakteri NA4 asal nato yang dilakukan pada
penelitian ini dapat dilihat pada Tabel 3.
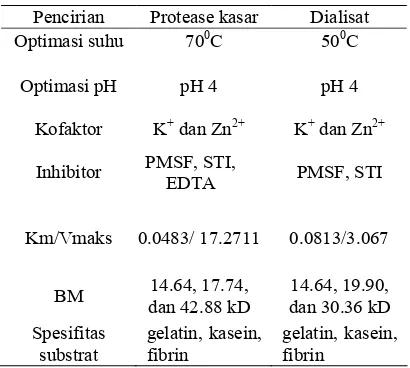
Tabel 3 Ringkasan pencirian protease dari isolat NA4
Pencirian Protease kasar Dialisat
Optimasi suhu 700C 500C
Optimasi pH pH 4 pH 4
Kofaktor K+ dan Zn2+ K+ dan Zn2+
Inhibitor PMSF, STI,
EDTA PMSF, STI
Km/Vmaks 0.0483/ 17.2711 0.0813/3.067
BM 14.64, 17.74, dan 42.88 kD
14.64, 19.90, dan 30.36 kD Spesifitas
substrat
gelatin, kasein, fibrin
gelatin, kasein, fibrin
SIMPULAN DAN SARAN
Simpulan
Pencirian protease dari isolat nato pada berbagai tahap pemurnian mempunyai sifat yang secara umum relatif sama. Ekstrak enzim kasar dan dialisat mempunyai aktivitas optimum pada pH 4, suhu optimum untuk ekstrak enzim kasar 70ºC, sedangkan suhu optimum dialisat 50ºC. Secara umum protease nato termasuk kelompok protease serin serupa tripsin karena aktivitasnya dihambat kuat oleh inhibitor PMSF dan STI. Aktivator kuat untuk protease nato adalah K+ dan ZN2+. Nilai Km dan V maks untuk ekstrak protease kasar, yaitu 0.0483 dan 17.2711 U, sedangkan untuk dialisat nilai Km 0.0813 dan Vmaks 3.067 U.
3 pita protein dengan bobot molekul, yaitu 14.64, 19.90, dan 30.36 kD.
Nato mempunyai aktivitas fibrinolitik, kaseinolitik, dan albuminolitik yang potensial berdasar kemampuannya untuk mendegradasi fibrin, kasein, dan albumin pada analisis zimogram.
Saran
Perlu dilakukan penelitian lebih lanjut dengan melakukan identifikasi bakteri isolat natto dan pemurnian enzim lebih lanjut untuk memperoleh aktivitas protease yang lebih tinggi dan spesifik misalnya pemurnian dengan kromatografi kolom, dan lain-lain.
DAFTAR PUSTAKA
Anonim. 2005. How to Make Natto. http:/www.ynest.com/index.htm. [28 Agustus 2005].
Bergmeyer LU, Grass M. 1976. Methods of Enzymatic Analysis. Vol 2. Weinheim: Verlay Chemie.
Bradford MM. 1976. A Rapid and Sensitive Method For quantitation of Microgram Quantities of Protein Utilizing the Principle of Protein Dybinding. Anal Biochem 72: 234-254.
Chantawannakul P et al. 2001. Characterization of proteases of Bacillus strain 38 isolated from traditionally fermented soybean in Northen Thailand. Science Asia 28:241-248.
Dunn MJ. 1989. Electrophoretic Analysis Methods. Di dalam: Harris ELV, Angal S, editor. Protein Purification Methods: A Practical Approach. Oxford: IRL. hlm 21-27.
Felix F. 1998. Characterization of Proteins. New Jersey: Humana Press.
Harris ELV, S. Angal. 1989. Protein Purification Methods. New York: Oxford University Press. hlm 67-122. Kim WK et al. 1996. Purification and
Characterization of a Fibrinolytic Enzyme Produced from Bacillus sp. Strain CK 11-4 Screened from
Chungkook-Jang. Appl Evirol
Microbiol 62:2482-2488.
Kim SH, Choi NS. 2000. Purification and characterization of subtilin DJ-4 secreted by Bacillus sp.strain DJ-4 secreened from Doenjang. Biosci Biotechnol Biochem 64:1722-1725
Lehninger A. 1993. Dasar-Dasar Biokimia. Jilid I. Thenewidjaja M, penerjemah. Jakarta: Erlangga.
Mihara H et al. 1991. A novel Fibrinolytic enzyme extrated from the earthworm,
Lumbricus rubellus. Japan J Physiol
41: 461-472.
Peng Y et al. 2003. Purification and characterization of a fibrinolytic enzyme produced by Bacillus
emyloliquefaciens. Biochem Mol Biol
134:45-52.
Rao MB et al. 1998. Molecular biotechnological aspect of microbial proteases. Microbial and Molec Biol Rev. 62:587-635.
Rahman A. 1992. Tekologi Fermentasi. Jakarta: Arcan.
Scopes R K.1987. Protein Purification. New York: Spinger-Verlag.
Smith BJ. 1980. SDS Polyacrylamide gel Electrophoresis of Proteins. In J.M. Walker. Methods in Molecular Biology Proteins. New Jersey: Humana Press. Stanbury WF, Whitaker A. 1984. Principles of
Fermentation Technology. Oxford: Pergamon Press, Ltd. Bagian 4, Media for Industrial Fermentation; hlm 74-78. Suhartono MT. 1989. Enzim & Bioteknologi. Pusat Antar Universitas Bioteknologi. IPB. Bogor. hlm: 59-99.
Suhartono MT. 1992. Protease. Bogor: IPB PAU Bioteknologi.
Sumi H et al. A novel fibrinolytic enzyme in the vegetable cheese Natto; a typical and popular soybean food in the Japanese diet. Experientia 43: 1110-1111.
Walter JM. 1992. Analysisis of Amino Acid, Proteins and Nucleic Acid. Oxford: Butterwort-Heineman.
Ward OP. 1983. Proteinases. Di dalam: Fogarty W, editor. Microbial Enzymes and Biotechnology. London: Applied Science. hlm 251-317.
Lampiran 1 Bagan Alir Penelitian
Sampel Nato
Analis SDS-PAGE dan Zimogram
Dialisis (cut off 10 kD) Produksi Ekstrak
EnzimKasar Penapisan & Isolasi Enzim Fibrinolitik Produksi Bakteri
Analisis Aktivitas Protease & Kadar
Protein Presipitasi
15
Lampiran 2 Komposisi media pertumbuhan dan media produksi protease
• Media Luria Bertani Borth (LB 50%) Yeast ekstrak 0.025 g
Tripton 0.5 g NaCl 0.025 g Akuades 100 ml
• Media Skim Milk Agar (SMA)
Agar 6.0 g Susu skim milk 100 ml Akuades 200 ml
Lampiran 3 Prosedur Pembuatan Pereaksi Kimia
Pereaksi untuk Analisis Aktivitas Enzim dan Kadar Protein
• Kasein Hammarsten 2% b/v
Sebanyak 0.5 g kasein ditimbang, lalu dilarutkan dalam 25 ml bufer fosfat 50 mM pH 7, pengadukan dilakukan dengan pengaduk magnet sampai seluruh kasein larut.
• Tirosin 5 mM
Sebanyak 0.0453 g tirosin dilarutkan dalam 40 ml akuades (ditambahkan sedikit-sedikit) sambil di aduk dengan pengaduk magnet sampai seluruh tirosin larut, lalu ditera dengan akuades hingga volume total 50 ml.
• TCA 0.1 M
Sebanyak 16.339 g TCA dilarutkan dalam 100 ml akuades, kemudian diaduk dengan pengaduk magnetik hingga larut homogen. Larutan kerja TCA 0,1 M dilakukan dengan mengancerkan 10 ml larutan TCA 1 M dengan akuades hingga volume total 100 ml.
• Na2CO3 0.4 M
Sebanyak 4.2404 g Na2CO3 dilarutkan dalam 100 ml akuades, lalu diaduk
menggunakan stirrer hingga larut.
• Pereaksi Folin-Ciocalteau (1:2)
Sebanyak 25 ml pereaksi Folin-Ciocalteau komersial diencerkan dengan akuades hingga volume 50 ml dan diaduk dengan stirrer hingga homogen.
• Pereaksi Bradford
Sebanyak 0.1 g coomassie briliant blue R-250 dilarutkan dalam 50 ml etanol 95% v/v. Setelah itu ditambahkan 100 ml asam fosfat 85% v/v, lalu ditera dengan akuades hingga volume total 200 ml. Larutan kerja Bradford dibuat dengan cara mengencerkan 5 ml larutan stok Bradford dengan akuades hingga volume 50 ml.
Pereaksi untuk Analisis SDS-PAGE dan Zimografi • Pereaksi A
Komposisi larutan terdiri dari 14.6 g akrilamida dan 0.4 g bis-akrilamida yang dilarutkan dalam 50 ml akuades dan diaduk dengan pengaduk magnetik hingga homogen.
• Pereaksi B
• Pereaksi C
Komposisi larutan terdiri atas 50 ml bufer Tris-HCl 1 M pH 6.8 dan 4 ml SDS 10% b/v ,lalu ditera dengan akuades hingga volume total 100 ml.
• Ammonium persulfat 10% b/v
Sebanyak 0.1 g ammonium persulfat dilarutkan dalam akuades (ditambahkan sedikit-sedikit) sambil diaduk dengan stirrer, lalu ditera hingga volume total 1 ml.
• Bufer Elektroforesis
Komposisi larutan terdiri dari 1.803 g Tris, 8.648 g glisin, dan 0.6 g SDS yang dilarutkan dalam 600 ml akuades sambil diaduk dengan pengaduk magnet, lalu ditera pH-nya hingga 8.3 dengan penambahan HCl 1 M.
• Bufer Sampel
Komposisi bufer sampel untuk SDS-PAGE terdiri dari 0.3 ml Tris-HCl 1 M pH 6.8, 2.5ml gliserol 50% (v/v), 1.0 ml SDS 10% (b/v), 0.25 ml 2-merkaptoetanol, 0.5 ml biru bromfenol 1% (b/v), dan 0.45 ml akuabides dengan volume total 5.0 ml. Sementara komposisi bufer sampel untuk zimogram terdiri atas 0.5 g SDS, 1 ml gliserol 50% (v/v), 1ml biru bromfenol, 0.625 ml Tris-HCl 1 M pH 6.8, dan ditambahkan 2.75 ml akuabides hingga volume total 5.0 ml.
• Larutan Pewarna (larutan staining)
Komposisi larutan terdiri dari 0.5 g coomassie brilliant blue R-250, 225 ml metanol, 50 ml asam asetat glasial yang diaduk dengan stirrer dan diencerkan dengan akuades hingga volume total 500 ml.
• Larutan Peluntur (larutan destaining)
Komposisi larutan terdiri dari 50 ml metanol, dan 50 ml asam asetat glasial yang diaduk dengan stirrer dan diencerkan dengan akuades hingga volume total 500 ml.
• Triton X-100 2,5% v/v
Sebanyak 2.5 ml Triton X-100 dilarutkan dalam 97.5 ml akuades (ditambahkan sedikt-sedikit) sambil diaduk dengan pengaduk magnet hingga larutan homogen.
Larutan Berbagai Bufer
Larutan kerja bufer 50 mM dibuat dengan cara mengencerkan 25 ml larutan stok 0.2 M dengan akuades hingga volume total 100 ml.
Bufer Universal
Larutan A : asam sitrat (6.008 g) + KH2PO4 (3.895 g) + H3BO3 (1.769 g) +
asam dietilbarbiturat (5.266 g) dilarutkan dalam 1 L akuades
Larutan B : 0.2 N NaOH
Rumus : 100 ml larutan A + x ml larutan B
X (ml) pH
17
Lampiran 4 Aktivitas enzim pada empat isolat nato
Sampel A blanko (nm)
A standar
(nm)
A sampel
(nm)
Aktivitas enzim (U/ml)
Natto 1 0.470 2.574 0.900 0.1226
Natto 2 0.333 1.977 0.475 0.0158
Natto 3 0.484 2.982 0.630 0.0351
Natto 2 0.748 2.119 1.265 0.2263
Lampiran 5 Kadar protein pada empat isolat nato
Sampel A blanko
(nm)
A sampel
(nm)
Kadar protein (mg/ml)
Natto 1 0.155 0.442 0.2562
Natto 2 0.155 0.357 0.1236
Natto 3 0.155 0.380 0.1594
Natto 4 0.155 0.464 0.2904
Lampiran 6 Data kurva standar protein
[BSA] (mg/ml) A
0.025 0.135 0.075 0.172 0.125 0.211 0.175 0.243 0.225 0.262 0.275 0.292 0.300 0.313
y = 0.641x + 0.1228 R2 = 0.9914
0 0.05 0.1 0.15 0.2 0.25 0.3 0.35
0 0.05 0.1 0.15 0.2 0.25 0.3 0.35
[BSA] (mg/ml)
Ab
s
o
rb
an
Lampiran 7 Data presipitasi oleh amonium sulfat pada nato
[garam] (%) A
30 0.487 40 0.451 45 0.484 50 0.482 55 0.456 60 0.501 70 0.497 75 0.452 80 0.454
Lampiran 8 Data semipemurnian protease dari isolat NA4
Tahapan Vol (ml)
AE (U/ml)
Total AE (U)
[Protein] (mg/ml)
Total protein
(mg)
A spesifik (U/mg)
Yield
(%)
Tingkat kemurnian
(kali) Protease
kasar 300 0.2263 67.89 0.2904 87.12 0.7793 100 1
Presipitat
75% 20 0.3370 6.74 0.6196 12.392 0.5438 6.67 1.40
Dialisat +
Konsentrasi 15 0.3516 5.274 0.8677 13.0155 0.4052 5 1.85
Lampiran 9 Pengaruh suhu terhadap aktivitas protease kasar dan dialisat nato
Sampel
Suhu (0C)
A blanko
(nm)
A standar
(nm)
A sampel
(nm)
Aktivitas enzim (U/ml)
Aktivitas spesifik (U/mg)
Aktivitas relatif (%)
37 0.623 1.354 0.748 0.1026 0.3533 38.44
50 0.717 1.617 0.790 0.0487 0.1677 18.25
70 0.676 1.781 1.173 0.2669 0.9191 100
Protease kasar
80 0.655 2.603 1.070 0.1278 0.4401 47.88
37 0.753 1.351 0.854 0.1013 0.3488 61.54
50 0.840 1.332 0.975 0.1646 0.5668 100
70 0.856 0.931 0.872 0.1280 0.4408 77.76
Dialisat
80 0.618 1.086 0.635 0.0218 0.0751 13.24
Lampiran 10 Pengaruh pH terhadap aktivitas protease kasar dan dialisat nato
Sampel pH A blanko
(nm)
A standar
(nm)
A sampel
(nm)
Aktivitas enzim (U/ml)
Aktivitas spesifik (U/mg)
Aktivitas relatif (%)
3 0.391 2.052 0.666 0.0993 0.3419 30.05
4 0.719 1.251 1.012 0.3304 1.1377 100
5 0.603 1.376 0.980 0.2926 1.0076 88.56
6 0.582 1.815 1.107 0.2555 0.8798 77.33
7 0.395 1.932 0.971 0.2248 0.7741 68.04
Pretease Kasar
10 0.572 1.355 0.610 0.0290 0.0999 8.78
3 0.702 1.325 0.725 0.0221 0.0761 11.26
4 0.735 1.469 0.975 0.1962 0.6756 100
5 0.681 1.100 0.804 0.1761 0.6064 89.75
6 0.575 1.435 0.755 0.1256 0.4304 64.02
7 0.523 1.296 0.677 0.1195 0.4115 60.91
Dialisat
19
Lampiran 11 Pengaruh inhibitor terhadap aktivitas protease kasar dan dialisat nato
Saampel Inhibitor A blanko (nm)
A standar
(nm)
A sampel
(nm)
Aktivitas enzim (U/ml)
Aktivitas residu (%)
EDTA 0.286 0.967 0.291 0.0044 3.80
PMSF 0.483 0.921 0.309 0.0000 0
STI 0.484 0.949 0.319 0.0000 0
TLCK 0.341 0.871 0.415 0.0837 72.28
Protease Kasar
Kontrol 0.398 1.108 0.535 0.1158 100
EDTA 0.188 0.668 0.382 0.2450 70.97
PMSF 0.187 0.645 0.217 0.0393 11.38
STI 0.181 0.603 0.194 0.0185 5.36
TLCK 0.507 0.507 0.281 0.1654 47.91
Dialisat
Kontrol 0.380 1.312 0.645 0.3452 100
Lampiran 12 Pengaruh ion logam terhadap aktivitas protease kasar dan dialisat nato
Sampel Logam A blanko
(nm)
A standar
(nm)
A sampel
(nm)
Aktivitas enzim (U/ml)
Aktivitas residu (%)
KCl 0.132 0.844 0.343 0.1778 128.37
NaCl 0.180 0.892 0.220 0.0337 24.33
CaCl2 0.128 0.719 0.144 0.0162 11.70
MgCl2 0.205 0.792 0.258 0.0542 39.13
ZnCl2 0.164 0.746 0.327 0.1680 12.,30
Protease Kasar
Kontrol 0.314 0.860 0.440 0.1385 100
KCl 0.285 0.793 0.715 0.5079 146.03
NaCl 0.409 0.824 0.464 0.0795 22.86
CaCl2 0.342 0.661 0.349 0.0132 3.79
MgCl2 0.271 0.748 0.369 0.1233 35.45
ZnCl2 0.188 0.659 0.472 0.3618 104.02
Dialisat
Kontrol 0.481 1.597 1.128 0.3478 100
Lampiran 13 Penentuan kinetika enzim protease kasar dan dialisat nato
Sampel Konsentrasi kasein (%)
A blanko
(nm)
A standar
(nm)
A sampel
(nm)
Aktivitas enzim (U/ml)
V (U) 1/V (U)
0.1 0.500 1.156 0.543 0.0393 11,79 0.0848
0.5 0.526 1.113 0.571 0.0460 13,80 0.0725
1.0 0.472 1.461 0.556 0.0510 15,30 0.0653
1.5 0.501 1.114 0.564 0.0617 18,51 0.0540
Protease Kasar
2.0 0.395 1.166 0.565 0.0625 18,75 0.0533
0.1 0.469 1.055 0.618 0.1526 1.689 0.5921
0.5 0.395 1.105 0.608 0.1800 2.700 0.3704
1.0 0.330 1.091 0.571 0.1900 2.784 0.3592
1.5 0.339 1.038 0.563 0.1923 2.8845 0.3467
Dialisat
Lampiran 14 Contoh perhitungan aktivitas enzim dan aktivitas enzim spesifik
Perhitungan aktivitas enzim (U/ml)
Aktivitas protease (U/ml) =
(menit)
hidrolisis
waktu
n
pengencera
faktor
Ablanko
-Astandar
Ablanko
-Asampel
×
Contoh perhitungan pada suhu 37ºC selama 10 menit (ekstrak protease kasar)
Aktivitas protease (U/ml) =
10
6
623
.
0
354
.
1
0.623
0.748
×
−
−
= 0.1026
Perhitungan kadar protein
Persamaan kurva standar Y = 0.641x + 0.1228 x = [BSA] mg/ml y = Absorbans Contoh perhitungan kadar protein ekstrak protease kasar isolat NA4
Y = 0.641x + 0.1228 0.309 – 0.1228 = 0.641x x = 0.2904
[protein] isolat NA4 (mg/ml) = 0.2904
Perhitungan aktivitas spesifik enzim (U/mg)
Aktivitas spesifik enzim (U/mg) =
(mg/ml)
protein]
[
(U/ml)
enzim
aktivitas
=
mg/ml
2904
.
0
U/ml
1026
.
0
21
Lampiran 14 Kurva standar LMW SDS-PAGE 15%
Marker Rf
(cm) BM (Kda) Log BM
Albumin 0.0816 66000 4.8195
Ovalbumin 0.1633 55000 4.7404
Gliseraldehida 0.3469 45000 4.6532
Karbonik anhidrase 0.5306 36000 4.5563
Tripsinogen 0.5918 29000 4.4624
Inhibitor tripsin 0.7143 24000 4.3802
Lactabumin 0.7755 20000 4.3010
Aprotinin 0.8979 14200 4.1523
y = -0.8166x + 4.8489 R2 = 0.957
4.0000 4.4000 4.8000 5.2000
0 0.2 0.4 0.6 0.8 1
Rf (cm)
log B