BAHAN SKRIPSI
UJI AKTIVITAS ANTIBAKTERI FRAKSI n-HEKSANA, ETILASETAT DAN ETANOL DAUN KECAPI (Sandoricum koetjape.Merr) TERHADAP
BEBERAPA BAKTERI PENYEBAB PENYAKIT KULIT SECARA IN VITRO
Diajukan Oleh: FERA ASTUTI NIM : 081524003
PROGRAM EKSTENSI FARMASI FAKULTAS FARMASI
UJI AKTIVITAS ANTIBAKTERI FRAKSI n-HEKSANA, ETILASETAT DAN ETANOL DAUN KECAPI (Sandoricum koetjape.Merr) TERHADAP
BEBERAPA BAKTERI PENYEBAB PENYAKIT KULIT SECARA IN VITRO
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk mencapai Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH: FERA ASTUTI NIM : 081524003
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
LEMBAR PENGESAHAN SKRIPSI
UJI AKTIVITAS ANTIBAKTERI FRAKSI n-HEKSANA, ETILASETAT DAN ETANOL DAUN KECAPI (Sandoricum koetjape Merr.) TERHADAP
BEBERAPA BAKTERI PENYEBAB PENYAKIT KULIT SECARA IN VITRO
OLEH: FERA ASTUTI NIM : 081524003
Dipertahankan di hadapan Panitia Penguji Fakultas Farmasi
Universitas Sumatera Utara Pada tanggal : Desember 2010
Pembimbing I, Panitia Penguji,
(Dra. Nazliniwaty, M.Si., Apt.) (Dr. Rosidah, M.Si., Apt) NIP. 196005111989022001 NIP. 195103261978022001
Pembimbing II, (Dra. Nazliniwaty, M.Si., Apt.) NIP. 196005111989022001
(Dra. Masfria, MS., Apt) (Dra.Suwarti Aris, M.Si., Apt) NIP. 195707231986012001 NIP. 195107231982032001
(Drs. Awaluddin Saragih, M.Si., Apt) NIP. 195008221974121002
Medan, Desember 2010
Fakultas Farmasi Universitas Sumatera Utara
Dekan,
KATA PENGANTAR
Puji dan syukur kehadirat Allah yang Maha Kuasa yang telah
melimpahkan rahmat, karunia dan ridhoNya, sehingga penulis dapat
menyelesaikan skripsi ini, serta shalawat beriring salam kepada Rasulullah Nabi
Muhammad SAW sebagai suri tauladan kita dalam kehidupan.
Terima kasih yang tulus tiada terhingga kepada Ayahanda H.Suryadi dan
Ibunda Hj.Maisarah, bunda Ratna Willis, bunda Nurjannah, serta
saudara-saudaraku Irma Aryani, Noni Sumeri, Maya Elisa Dora, Rina Ridara, Kartika Sari,
Rita Anggraini, dan Haris Putra Barona yang telah memberikan kasih sayang,
dorongan moril dan materil serta do’a yang tiada hentinya kepada penulis selama
ini.
Pada kesempatan ini dengan kerendahan dan ketulusan hati penulis juga
mengucapkan terima kasih yang sebesar-besarnya kepada Dra. Nazliniwaty,
M.Si., Apt. dan Dra Masfria, MS., Apt yang telah membimbing dengan penuh
kesabaran, tulus, ikhlas serta selalu memberi semangat dan dorongan selama
penelitian dan penulisan skripsi ini berlangsung.
Penulis juga menyampaikan terima kasih yang sebesar-besarnya kepada :
1. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas Farmasi
Universitas Sumatera Utara, yang telah memberikan bantuan dan fasilitas
selama masa pendidikan.
2. Ibu Dra. Aswita Hafni Lubis. M.Si., Apt, selaku Penasehat Akademik yang
3. Dr.R. Lia Kusumawati, MS.SpMK, Kakanda Lasmono Susanto, kak fitri, bang
riko, bang putra di Instalasi Mikrobiologi Klinik RSUP.H.ADAM MALIK
MEDAN yang telah memberikan fasilitas dan membantu penulis selama
melaksanakan penelitian tugas akhir ini.
4. Ibu Dr. Rosidah, M.Si., Apt, Ibu Suwarti Aris, M.Si., Apt, Bapak Drs.
Awaluddin Saragih, M.Si., Apt, dan Ibu Nazliniwaty, M.Si., Apt, selaku dosen
penguji yang telah memberikan masukan dan saran kepada penulis hingga
selesainya penulisan skripsi ini.
5. Staf pengajar dan Staf administrasi Fakultas Farmasi Universitas Sumatera
Utara yang telah mendidik penulis selama di perguruan tinggi dan membantu
kemudahan administrasi.
6. Bapak Kepala Laboratorium Obat Tradisional Fakultas Farmasi USU dan
Bapak Kepala Laboratorium Mikrobiologi Fakultas MIPA USU yang telah
memberikan izin dan fasilitas untuk penulis sehingga dapat mengerjakan dan
menyelesaikan penelitian.
7. Teman-teman Farmasi kak ira, kak astri, kak ratna, bang zakir, bang nasril,
pipi serta teman-teman Ekstensi Farmasi stambuk 2008 tanpa terkecuali, yang
selalu menghibur dan memberi semangat kepada penulis.
8. Bapak Prof. Dr. Dwi Suryanto, Ibu Ifit, yanti, Asril, Kasbih di Departemen
Biologi FMIPA USU yang telah membantu penulis selama melaksanakan
penelitian tugas akhir.
9. Serta pihak-pihak yang telah ikut membantu penulis namun tidak tercantum
Akhir kata, Semoga Allah SWT memberikan balasan yang berlipat ganda
atas kebaikan yang telah diberikan dan penulis menyadari sepenuhnya bahwa
dalam penulisan maupun penyajian dalam tulisan ini masih jauh dari
kesempurnaan, oleh karena itu dengan segala kerendahan hati penulis menerima
kritik dan saran yang sifatnya membangun. Kiranya skripsi ini dapat memberi
manfaat bagi para pembaca.
Medan, Desember 2010
Penulis,
UJI AKTIVITAS ANTIBAKTERI FRAKSI n-HEKSANA, ETILASETAT DAN ETANOL DAUN KECAPI (Sandoricum koetjape Merr.) TERHADAP
BEBERAPA BAKTERI PENYEBAB PENYAKIT KULIT SECARA IN VITRO
Abstrak
Telah dilakukan penelitian mikrobiologi terhadap uji aktivitas antibakteri dari fraksi n-heksana, etilasetat dan etanol terhadap beberapa bakteri penyebab penyakit kulit dari daun kecapi terhadap bakteri Staphylococcus epidermidis, Streptococcus viridans, Pseudomonas aeruginosa dan Citrobacter diversus.
Fraksi n-heksana, etilasetat dan etanol diperoleh dengan metode maserasi menggunakan n-heksana lalu etilasetat dan terakhir dengan etanol 96%. Uji aktivitas secara in-vitro dilakukan dalam berbagai konsentrasi dengan metode difusi agar dengan pencetak lubang (Punch hole) menggunakan media Mueller Hinton Agar. Sebagai ukuran aktivitas diukur daerah hambatan pertumbuhan bakteri.
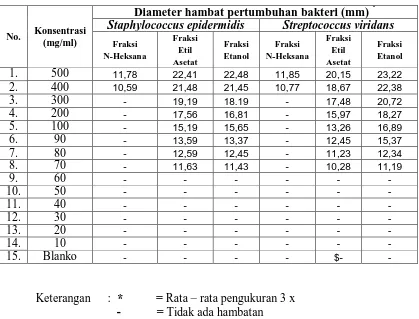
Hasil uji aktivitas antimikroba menunjukkan bahwa pengujian dengan menggunakan fraksi n-heksana daun kecapi tidak memberikan batas daerah hambat yang efektif terhadap keempat bakteri, dilanjutkan dengan menggunakan fraksi etilasetat daun kecapi memberikan batas daerah hambat yang efektif terhadap ketiga bakteri Staphylococcus epidermidis, Streptococcus viridans dan Citrobacter diversus dengan konsentrasi berbeda sedang untuk Pseudomonas aeruginosa tidak memberikan batas daerah hambat yang efektif. Terakhir dengan menggunakan fraksi etanol memberikan batas daerah hambat yang efektif terhadap keempat bakteri dengan konsentrasi yang berbeda. Dari hasil uji aktivitas antibakteri menunjukkan bahwa fraksi etanol yang paling efektif terhadap keempat bakteri yang diuji Staphylococcus epidermidis, Streptococcus viridans, Pseudomonas aeruginosa, Citrobacter diversus).
Activity Test Antibacterial from n-Heksana Fraction, Etilacetat and Etanolic of Kecapi Leaf (Sandoricum koetjape.Merr) With Respect to Some bacteria
of Cause Skin Disease In Vitro Method
Abstract
It has been done research of antibacterial activity testing from fraction of n-heksana, etilasetat fraction and ethanol fraction of kecapi leaf to some bacteria of cause skin disease. The research consisted aspect test of antibacterial activity testing of n-heksana fraction, etilacetat fraction and ethanol fraction of kecapi leaf to Staphylococcus epidermidis, Streptococcus viridans, Pseudomonas aeruginosa and Citrobacter diversus bacteria.
Fraction of n-heksana, etilacetat and ethanol obtained with maceration method by using n-heksana, etilacetat and last by ethanol 96%. In vitro antibacterial activity testing of kecapi leaves in various consentrationwith gelatin difuse method with Punch hole using media of Mueller Hinton Agar. As activity of size to measured resistance bacteria growth area.
Result of antibacterial activity testing n-heksana fraction of kecapi leaves not give the area boundary pursue effective to fourth bacteria, continued by using etilasetat fraction of kecapi leaves give the area boundary pursue effective with third bacteria Staphylococcus epidermidis, Streptococcus viridians and Citrobacter diversus with different of concentration, while Pseudomonas aeruginosa bacteria not give the area boundary pursue effective. By using ethanol fraction give the area boundary pursue effective to fourth bacteria with different of concentration. From result test the activity antibacterial indicate that the most effective etanol fraction to tested bacteria (Staphylococcus epidermidis, Streptococcus viridans, Pseudomonas aeruginosa, Citrobacter diversus).
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN... ii
KATA PENGANTAR... iii
ABSTRAK... iv
DAFTAR ISI... v
DAFTAR TABEL ... viii
DAFTAR GAMBAR... ix
DAFTAR LAMPIRAN ... x
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Kerangka Konsep Penelitian ... 3
1.3 Perumusan masalah ... 3
1.4 Hipotesis ... 4
1.5 Tujuan dan Manfaat Penelitian ... 4
1.5.1 Tujuan Penelitian ... 4
1.5.2 Manfaat Penelitian... ... 5
BAB II TINJAUAN PUSTAKA... 6
2.1 Uraian Tumbuhan... 6
2.1.1 Klasifikasi Tumbuhan kecapi... 6
2.1.2 Habitat Tumbuhan kecapi... 6
2.1.3 Nama Daerah... 7
2.1.4 Morfologi Tumbuhan kecapi... 7
2.1.5 Kandungan kimia... 8
2.1.6 Manfaat Tanaman kecapi... 8
2.2.1 Pengertian... 8
2.2.2 Metode Ekstraksi... 9
2.3 Bakteri... 10
2.3.1 Uraian Umum... 10
2.3.2 Bakteri Gram Positif... 13
2.3.2.1 Bakteri Staphylococcus epidermidis... 14
2.3.2.2 Bakteri Streptococcus viridans... 15
2.3.3 Bakteri Gram Negatif... 15
2.3.2.2 Bakteri Pseudomonas aeruginosa... 16
2.3.2.3 Bakter Citrobacter diversus ... 17
2.3.4 Fase Pertumbuhan Bakteri... 17
2.3.5 Media Pertumbuhan Bakteri... 18
2.3.6 Pengukuran Aktivitas Antibakteri ... 20
2.3.7 Identifikasi Bakteri... 21
BAB III METODOLOGI PENELITIAN... 23
3.1 Lokasi dan Waktu Penelitian... 23
3.2 Metode Penelitian... 23
3.3 Alat dan Bahan... 23
3.3.1 Alat... 23
3.3.2 Bahan –bahan... 24
3.4 Pembuatan Media dan Pereaksi... 24
3.4.1 Nutrient Agar (NA) ………. 24
3.4.2 Mueller Hinton Agar (MHA)... 25
3.4.3 Blood Agar………... 25
3.4.4 Media Mac. Conkey... 26
3.4.5 Manitol Salt Agar... 26
3.4.6 Larutan Gentian Violet... 27
3.4.8 Larutan Safranin... 28
3.4.9 Larutan Iodine………. 28
3.4.10 Larutan NaCl 0,9%... 28
3.4.11 Media Cair Glukosa... 28
3.4.12 Media Cair Laktosa (Oxoid, 2006)... 29
3.4.13 Media Cair Maltosa (Oxoid, 2006)... 30
3.4.14 Media Cair Manitol (Oxoid, 2006)... 30
3.4.15 Media Cair Sukrosa (Oxoid, 2006)……… 30
3.4.16 Media lndol (Oxoid, 2006)... 31
3.4.17 Media Methyl-red ( MR ) and Voges Prouskauer ( VP ) 31
3.4.18 Simmons Citrate Agar (Oxoid, 2006)... 32
3.4.19 Reagen test IMVIC (Oxoid, 2006)... 32
3.4.19.1 Reagen Kovacks (Oxoid, 2006)... 32
3.4.19.2 Reagen Methyl red (Oxoid, 2006)... 33
3.4.19.3 Reagen Voges Proskauer (Oxoid, 2006)... 33
3.4.20 Urease (Oxoid, 2006)... 34
2.4.21 Triple Sugar Iron Agar (TSI) (Oxoid, 2006) ... 34
2.4.22 Suspensi standar Mc.Farland... 35
3.5 Penyiapan Sampel... 35
3.5.1 Pengambilan sampel... 36
3.5.2 Identifikasi Sampel... 35
3.5.3 Pengolahan Sampel... 35
3.6 Pembuatan Ekstrak n-Heksana, Etil Asetat, dan Etanol Daun Tumbuhan Kecapi (Sandoricum koetjape. Merr)... 36
3.7 Uji Aktivitas Antibakteri ... 37
3.7.1 Sterilisasi Alat ... 37
3.7.2 Pembuatan Agar Miring ... 38
3.7.3 Pembuatan Stok Kultur ... 38
3.7.4 Uji Identifikasi Bakteri ... 38
3.7.4.1 Pengecatan Gram ... 38
3.4.7.4.2 Pertumbuhan Bakteri pada Media Selektif... 39
3.4.7.4.3 Uji Biokimia... ... 39
3.7.5 Persiapan inokulum Bakteri……….. 44
3.8 Pembuatan Larutan Uji Fraksi n-Heksana, etilasetat dan etanol Dari Daun Tumbuhan Kecapi (Sandoricum koetjape Merr.) dengan Berbagai Konsentrasi……… 44
3.8.1. Pembuatan Larutan Uji Fraksi n-Heksana……… 44
3.8.2. Pembuatan Larutan Uji Fraksi Etilasetat………. 45
3.8.3. Pembuatan Larutan Uji Fraksi Etanol……….. 45
3.9 Uji Aktivitas Antimikroba Daun Tumbuhan Kecapi (Sandoricum koetjape Merr.) Dengan Berbagai Konsentrasi Secara In vitro… 45
3.9.1. Uji Aktivitas Antimikroba Ekstrak n-Heksana………….. 45
3.9.2. Uji Aktivitas Antimikroba Ekstrak Etilasetat……… 46
3.9.3. Uji Aktivitas Antimikroba Ekstrak Etanol……… 46
BAB IV HASIL DAN PEMBAHASAN……… 48
BAB V KESIMPULAN DAN SARAN ... ... 58
5.1 Kesimpulan ... 58
5.2 Saran ... 59
DAFTAR PUSTAKA ... 60
UJI AKTIVITAS ANTIBAKTERI FRAKSI n-HEKSANA, ETILASETAT DAN ETANOL DAUN KECAPI (Sandoricum koetjape Merr.) TERHADAP
BEBERAPA BAKTERI PENYEBAB PENYAKIT KULIT SECARA IN VITRO
Abstrak
Telah dilakukan penelitian mikrobiologi terhadap uji aktivitas antibakteri dari fraksi n-heksana, etilasetat dan etanol terhadap beberapa bakteri penyebab penyakit kulit dari daun kecapi terhadap bakteri Staphylococcus epidermidis, Streptococcus viridans, Pseudomonas aeruginosa dan Citrobacter diversus.
Fraksi n-heksana, etilasetat dan etanol diperoleh dengan metode maserasi menggunakan n-heksana lalu etilasetat dan terakhir dengan etanol 96%. Uji aktivitas secara in-vitro dilakukan dalam berbagai konsentrasi dengan metode difusi agar dengan pencetak lubang (Punch hole) menggunakan media Mueller Hinton Agar. Sebagai ukuran aktivitas diukur daerah hambatan pertumbuhan bakteri.
Hasil uji aktivitas antimikroba menunjukkan bahwa pengujian dengan menggunakan fraksi n-heksana daun kecapi tidak memberikan batas daerah hambat yang efektif terhadap keempat bakteri, dilanjutkan dengan menggunakan fraksi etilasetat daun kecapi memberikan batas daerah hambat yang efektif terhadap ketiga bakteri Staphylococcus epidermidis, Streptococcus viridans dan Citrobacter diversus dengan konsentrasi berbeda sedang untuk Pseudomonas aeruginosa tidak memberikan batas daerah hambat yang efektif. Terakhir dengan menggunakan fraksi etanol memberikan batas daerah hambat yang efektif terhadap keempat bakteri dengan konsentrasi yang berbeda. Dari hasil uji aktivitas antibakteri menunjukkan bahwa fraksi etanol yang paling efektif terhadap keempat bakteri yang diuji Staphylococcus epidermidis, Streptococcus viridans, Pseudomonas aeruginosa, Citrobacter diversus).
Activity Test Antibacterial from n-Heksana Fraction, Etilacetat and Etanolic of Kecapi Leaf (Sandoricum koetjape.Merr) With Respect to Some bacteria
of Cause Skin Disease In Vitro Method
Abstract
It has been done research of antibacterial activity testing from fraction of n-heksana, etilasetat fraction and ethanol fraction of kecapi leaf to some bacteria of cause skin disease. The research consisted aspect test of antibacterial activity testing of n-heksana fraction, etilacetat fraction and ethanol fraction of kecapi leaf to Staphylococcus epidermidis, Streptococcus viridans, Pseudomonas aeruginosa and Citrobacter diversus bacteria.
Fraction of n-heksana, etilacetat and ethanol obtained with maceration method by using n-heksana, etilacetat and last by ethanol 96%. In vitro antibacterial activity testing of kecapi leaves in various consentrationwith gelatin difuse method with Punch hole using media of Mueller Hinton Agar. As activity of size to measured resistance bacteria growth area.
Result of antibacterial activity testing n-heksana fraction of kecapi leaves not give the area boundary pursue effective to fourth bacteria, continued by using etilasetat fraction of kecapi leaves give the area boundary pursue effective with third bacteria Staphylococcus epidermidis, Streptococcus viridians and Citrobacter diversus with different of concentration, while Pseudomonas aeruginosa bacteria not give the area boundary pursue effective. By using ethanol fraction give the area boundary pursue effective to fourth bacteria with different of concentration. From result test the activity antibacterial indicate that the most effective etanol fraction to tested bacteria (Staphylococcus epidermidis, Streptococcus viridans, Pseudomonas aeruginosa, Citrobacter diversus).
BAB I PENDAHULUAN 1.1.Latar Belakang
Indonesia merupakan negara agraris yang kaya akan keanekaragaman
hayati termasuk tumbuhan obat. Tumbuhan obat telah digunakan sejak dahulu
secara turun temurun untuk mencegah, menyembuhkan serta memelihara
kesehatan. Dewasa ini penggunaan obat tradisional sebagai alternatif pengobatan
mengalami peningkatan. Hal ini disebabkan kecenderungan masyarakat
menerapkan gaya hidup back to nature atau kembali ke alam serta ditunjang oleh
efek samping obat tradisional yang relatif kecil dan harganya dapat dijangkau oleh
masyarakat luas (Djauhariya dan Hermani, 2004).
Salah satu tumbuhan yang telah dikenal berkhasiat untuk obat tradisional
adalah tumbuhan kecapi (Sandoricum koetjape Merr.). Tumbuhan kecapi
diperkirakan berasal dari
silam, tumbuhan ini dibawa dan dimasukkan ke
ditanam secara luas. Tumbuhan ini sangat berguna, kulit batang, akar, daun dan
kulit buah digunakan untuk pengobatan (Verheij dan Coronel,1997). Daun kecapi
berkhasiat sebagai obat penurun demam dan peluruh keringat (Perry, 1980). Daun
kecapi juga berkhasiat sebagai obat batuk, obat mulas dan keputihan (Depkes dan
Kessos RI, 1994). Bagian tumbuhan lainnya juga sangat bermanfaat, kulit
batangnya untuk pengobatan cacing gelang dan kurap, akarnya untuk obat
kembung, diare, sakit pinggang serta untuk penguat tubuh wanita setelah
Hasil penelitian yang dilakukan oleh Risna. S (2009) terhadap skrining
fitokimia serbuk simplisia dan ekstrak etanol daun kecapi (Sandoricum koetjape
Merr.) menunjukkan adanya senyawa tanin, saponin, flavonoida, steroida dan
glikosida.
Hasil diskusi terhadap beberapa masyarakat yang disekitar lingkungan
mereka terdapat tumbuhan kecapi yaitu masyarakat desa Beras Basah Pangkalan
Brandan dan desa Pante Pisang Nanggroe Aceh Darussalam, ternyata mereka
menggunakan daun kecapi dan rebusan daunnya untuk penyakit kulit selain itu
rebusan daun kecapi ini juga digunakan mereka untuk pengobatan penyakit diare,
keputihan dan disentri.
Bakteri uji Staphylococcus epidermidis dan Streptococcus viridans
merupakan bakteri gram positif dan Pseudomonas aeruginosa dan Citrobacter
diversus merupakan bakteri gram negatif. Keempat bakteri ini sering ditemukan
pada infeksi kulit. Bakteri Pseudomonas aeruginosa sering ditemukan pada kulit
manusia, yang terinfeksi berupa luka bernanah berwarna kuning sampai kuning
kehijauan. Bakteri Citrobacter diversus dapat menginfeksi tubuh pada semua
tempat dapat ditemukan dalam air seni, dahak dan spesimen klinis lainnya
termasuk menginfeksi kulit. Bakteri Staphylococcus epidermidis terdapat pada
kulit, selaput lendir, bisul dan luka. Bakteri Streptococcus viridans merupakan
flora normal pada kulit, tenggorokan, saluran kemih serta penyebab penyakit
saluran pernapasan manusia. (Jawetz, dkk, 2001).
Berdasarkan uraian di atas dilakukan penelitian tentang uji aktivitas
koetjape Merr.) terhadap beberapa bakteri penyebab penyakit kulit. Adapun
bakteri yang digunakan adalah Staphylococcus epidermidis, Pseudomonas
aeruginosa, Citrobacter diversus, Streptococcus viridans secara in vitro yang
diambil dari spesimen.
1.2Kerangka Konsep Penelitian
Penelitian ini dilaksanakan dengan kerangka konsep seperti ditunjukkan dalam bagan berikut ini:
Variabel Bebas Variabel Terikat
Aktivitas antimikroba terhadap mikroba:
Gambar 1. Bagan Kerangka Konsep Penelitian 1.3Perumusan Masalah
1. Apakah fraksi n-heksana, etilasetat dan etanol daun kecapi
mempunyai aktivitas antibakteri terhadap bakteri yang diuji
(Staphylococcus epidermidis, Streptococcus viridans,
Pseudomonas aeruginosa, Citrobacter diversus) Daun Kecapi
Segar
Serbuk Simplisia ditambahkan
n-heksana
Eksrak n-Heksana
Fraksi Etilasetat
Fraksi Etanol
Staphylococcus epidermidis
Streptococcus viridans
Pseudomonas aeruginosa
Citrobacter diversus
Ampas dari Simplisia n-heksana ditambahkan etilasetat
Ampas dari Simplisia etilasetat ditambahkan
2. Dari fraksi n-heksana, etilasetat dan etanol daun kecapi fraksi
manakah yang paling efektif sebagai antibakteri terhadap bakteri
yang diuji (Staphylococcus epidermidis, Streptococcus viridans,
Pseudomonas aeruginosa, Citrobacter diversus).
1.4Hipotesis
Fraksi n-heksana, etilasetat dan etanol daun kecapi mempunyai
aktivitas antibakteri terhadap bakteri yang diuji (Staphylococcus
epidermidis, Streptococcus viridans, Pseudomonas aeruginosa,
Citrobacter diversus.
Dari fraksi n-heksana, etilasetat dan etanol daun kecapi fraksi etanol
yang paling efektif sebagai antibakteri terhadap bakteri yang diuji
(Staphylococcus epidermidis, Streptococcus viridans, Pseudomonas
aeruginosa, Citrobacter diversus).
1.5Tujuan dan Manfaat Penelitian 1.5.1 Tujuan Penelitian
Untuk mengetahui aktivitas bakteri dari fraksi n-heksana, etilasetat dan
etanol daun kecapi terhadap beberapa bakteri penyebab penyakit kulit
(Staphylococcus epidermidis, Streptococcus viridans, Pseudomonas
aeruginosa dan Citrobacter diversus)
Untuk mengetahui fraksi yang paling efektif dari fraksi n-heksana,
etilasetat dan etanol daun kecapi di duga fraksi etanol yang paling
efektif sebagai antibakteri terhadap beberapa bakteri penyebab
panyakit kulit yang diuji (Staphylococcus epidermidis, Streptococcus
1.5.2 Manfaat Penelitian
Sebagai bahan informasi kepada masyarakat Indonesia tentang khasiat
Kecapi (Sandoricum koetjape Merr.) sebagai antibakteri penyebab
penyakit kulit.
Bila memungkinkan dapat dikembangkan untuk diformulasi sebagai
BAB II
TINJAUAN PUSTAKA 2.1 Uraian Tumbuhan
2.1.1 Klasifikasi Tumbuhan kecapi (Sandoricum koetjape Merr.)
Tumbuhan kecapi (Sandoricum koetjape Merr.) ini diklasifikasikan
sebagai berikut (Tjitrosoepomo, 2004 dan Corner and Watanabe, 1969):
Kingdom : Plantae
Divisio : Spermatophyta
Sub Divisio : Angiospermae
Kelas : Dicotyledoneae
Anak Kelas : Dialypetalae
Ordo : Rutales
Famili : Meliaceae
Genus : Sandoricum
Spesies : Sandoricum koetjape Merr.
2.1.2 Habitat Tumbuhan kecapi (Sandoricum koetjape Merr.)
Tumbuhan kecapi banyak tumbuh secara alami di dataran rendah sampai
daerah pegunungan dengan ketinggian 1200 meter atau lebih. Kecapi diperkirakan
berasal dari
tumbuhan ini dibawa dan dimasukkan ke
umumnya ditanam di kebun atau pekarangan secara sederhana (Mabberley,D.J., et
2.1.3 Nama Daerah
Di Indonesia, Sandoricum koetjape Merr. sering disebut dengan kecapi
mempunyai nama daerah yang berbeda-beda, Misalnya Pono, Setul, Seutoy
(Aceh), Hasapi, Sotul (Batak), Kasapi, Santu (Makasar), Sentul (Jawa) (Anonim,
2008).
2.1.4 Morfologi Tumbuhan kecapi (Sandoricum koetjape Merr.)
Tumbuhan kecapi merupakan tumbuhan yang rimbun dan besar,
Batangnya tumbuh tegak dapat mencapai
seperti susu. Daun majemuk berselang-seling, bertangkai sampai dengan 18 cm,
menyirip beranak daun tiga, bentuk jorong sampai bundar telur, membulat atau
agak runcing di pangkal, meruncing di ujung, hijau berkilat di sebelah atas, hijau
kusam di bawahnya. Anak daun ujung bertangkai panjang, jauh lebih panjang dari
tangkai anak daun sampingnya. Bunga dalam malai di ketiak daun, berambut,
menggantung, sampai dengan 25 cm. Bunga berkelamin dua, bertangkai pendek;
kelopak bertaju 5, mahkota 5 helai, kuning hijau, samar-samar berbau harum.
Buah buni bulat agak gepeng, kuning atau kemerahan jika masak, berbulu halus
seperti
kemerahan, daging buah bagian dalam lunak dan berair, melekat pada biji, putih,
masam sampai manis. Biji 2-5 butir, besar, bulat telur agak pipih, coklat
kemerahan berkilat; keping biji berwarna merah (Verheij dan Coronel,1997).
Pohon kecapi berbunga dari bulan Juni sampai Oktober dan berbuah
masak dalam bulan Oktober-November. Perbanyakan biasanya dilakukan dengan
2.1.5 Kandungan Kimia
Daun kecapi mengandung saponin, flavonoida, tanin, glikosida dan
steroida/triterpenoida, fenol dan polifenol (Anonim, 2008)
2.1.6 Manfaat Tanaman kecapi (Sandoricum koetjape.Merr)
Daun kecapi berkhasiat sebagai antipiretik dan peluruh keringat (Perry,
1980) juga sebagai obat batuk, obat mulas dan keputihan (Depkes dan Kessos RI,
1994).
Bagian tanaman lainnya juga sangat bermanfaat, kulit batangnya untuk
pengobatan cacing gelang dan kurap, akarnya untuk obat kembung, diare, sakit
pinggang serta untuk penguat tubuh wanita setelah melahirkan (Anonim, 2008).
2.2 Ekstrak 2.2.1 Pengertian
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat
aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang
sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau
serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang telah
ditetapkan (Depkes RI, 1995).
Ekstraksi adalah suatu proses yang dilakukan untuk memperoleh
kandungan senyawa kimia dari jaringan tumbuhan maupun hewan. Ekstrak adalah
sediaan kering, kental atau cair dibuat dengan menyari simplisia nabati atau
hewani menurut cara yang cocok, di luar pengaruh cahaya matahari langsung,
ekstrak kering harus mudah digerus menjadi serbuk. Cairan penyari dapat berupa
2.2.2 Metode Ekstraksi
Menurut Ditjen POM (2000), beberapa metode ekstraksi:
1. Cara dingin
i. Maserasi, adalah proses pengekstrakan simplisia dengan menggunakan
pelarut dengan beberapa kali pengocokan atau pengadukan pada
temperatur ruangan (kamar).
ii. Perkolasi, adalah ekstraksi dengan pelarut yang selalu baru sampai
sempurna (exhaustive extraction) yang umumnya dilakukan pada
temperatur ruangan.
2. Cara panas
i. Refluks, adalah ekstraksi dengan pelarut pada temperatur titik didihnya,
selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan
dengan adanya pendingin balik.
ii. Soxhlet, adalah ekstraksi menggunakan pelarut yang selalu baru yang
umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu
dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
iii. Digesti, adalah maserasi kinetik (dengan pengadukan kontinu) pada
temperatur yang lebih tinggi dari temperatur ruangan, yaitu secara umum
dilakukan pada temperatur 40-50oC.
iv. Infus, adalah ekstraksi dengan pelarut air pada temperatur penangas air
(bejana infus tercelup dalam penangas air mendidih, temperatur terukur
v. Dekok, adalah infus pada waktu yang lebih lama ( + 30 menit) dan
temperatur sampai titik didih air.
2.3 Bakteri
2.3.1 Uraian Umum
Bakteri adalah mikroorganisme bersel satu, berbentuk bola,batang atau
spiral berdiameter sekitar 0,5 - 1,0 mikrometer (µ m) dan panjangnya 1,5 - 2,5
mikrometer (µm). Berkembang baik dengan cara membelah diri (Dwijoseputro,
1994). Dapat bersifat saprofit maupun parasit, penyebarannya sangat luas di
dalam dan pada permukaan bumi diatmosfer dan dilingkungan kita sehari- hari
(Pelczar et al, 1986).
Pertumbuhan dan perkembangan bakteri dipengaruhi oleh:
1. Zat makanan (nutrisi)
Sumber zat makanan bagi bakteri diperoleh dari senyawa karbon, nitrogen,
sulfur, fosfor, unsur logam (natrium, kalsium, magnesium, mangan, besi,
tembaga dan kobalt), vitamin dan air untuk fungsi-fungsi metabolik dan
pertumbuhannya.
2. Keasaman dan kebasaan (pH)
Kebanyakan bakteri mempunyai pH optimum pertumbuhan antara 6,5-7,5,
namun beberapa spesies dapat tumbuh dalam keadaan sangat asam atau
sangat alkali.
3. Temperatur
Proses pertumbuhan bakteri tergantung pada reaksi kimiawi dan laju
reaksi kimia yang dipengaruhi oleh temperatur. Berdasarkan ini maka
a. Bakteri psikofil, yaitu bakteri yang dapat hidup pada temperatur
0-30oC, temperatur optimum adalah 10-20oC.
b. Bakteri mesofil, yaitu bakteri yang dapat hidup pada temperature
5-6 oC, temperatur optimum adalah 25-40oC.
c. Bakteri termofil, yaitu bakteri yang dapat hidup pada temperatur
50-100oC, temperatur optimum adalah 55-65oC.
4. Oksigen
Beberapa spesies bakteri dapat hidup dengan adanya oksigen dan
sebaliknya spesies lain akan mati. Berdasarkan kebutuhan akan oksigen,
bakteri dapat dikelompokkan sebagai berikut:
a. Aerobik yaitu bakteri yang membutuhkan oksigen untuk
pertumbuhannya.
b. Anaerobik yaitu bakteri yang dapat tumbuh tanpa oksigen.
c. Anaerobik fakultatif yaitu bakteri yang dapat tumbuh dengan
oksigen ataupun tanpa oksigen.
d. Mikroaerofilik yaitu bakteri yang dapat tumbuh baik dengan
adanya sedikit oksigen.
5. Tekanan osmosa
Medium yang baik bagi pertumbuhan bakteri adalah medium isotonis
terhadap isi sel bakteri.
6. Kelembaban
Secara umum bakteri tumbuh dan berkembang biak dengan baik pada
lingkungan yang lembab. Kebutuhan akan air tergantung dari jenis
Berdasarkan morfologinya bakteri dapat dibedakan atas tiga bagian yaitu:
a. Bentuk basil
Basil adalah bakteri yang mempunyai bentuk menyerupai batang atau
silinder, membelah dalam satu bidang, berpasangan ataupun berbentuk rantai
pendek atau panjang. Bentuk basil dapat dibedakan atas:
- Monobasil yaitu basil yang terlepas satu sama lain dengan kedua ujung
tumpul.
- Diplobasil yaitu basil yang bergandeng dua dan kedua ujungnya tumpul.
- Streptobasil yaitu basil yang bergandengan panjang dengan kedua ujung
tajam.
Contoh: Escherichia coli, Bacillus anthracis, Salmonella typhimurium, Shigella
dysenteriae.
b. Bentuk kokus
Kokus adalah bakteri yang bentuknya seperti bola-bola kecil, ada yang
hidup sendiri dan ada yang berpasang-pasangan. Bentuk kokus ini dapat
dibedakan atas:
- Diplokokus yaitu kokus yang bergandeng dua.
- Tetrakokus yaitu kokus yang mengelompok empat.
- Stafilokokus yaitu kokus yang mengelompok dan merupakan suatu
untaian.
- Streptokokus yaitu kokus yang bergandeng-gandengan panjang berupa
- Sarsina yaitu kokus yang mengelompok seperti kubus.
Contoh: Monococcus gonorhoe, Diplococcus pneumoniae, Streptococcus
viridans, Staphylococcus epydermidis, Sarcina luten.
c. Bentuk spiral
Dapat dibedakan atas:
- Spiral yaitu bentuk yang menyerupai spiral atau lilitan.
- Vibrio yaitu bentuk batang yang melengkung berupa koma.
- Spirochaeta yaitu menyerupai bentuk spiral, bedanya dengan spiral
dalam kemampuannya melenturkan dan melengkukkan tubuhnya sambil
bergerak.
Contoh: Spirillum, Vibrio cholerae, Spirochaeta palida (Volk and Wheeler,
1989).
Berdasarkan reaksi bakteri terhadap pewarnaan gram, maka bakteri dapat
dibedakan menjadi dua bagian yaitu:
a. Bakteri gram positif, yaitu bakteri yang dapat mengikat zat warna utama
(kristal violet) sehingga tampak berwarna ungu tua.
b. Bakteri gram negatif, yaitu bakteri yang kehilangan warna utama (kristal
violet) ketika dicuci dengan alkohol dan menyerap zat warna kedua
sewaktu pemberian safranin tampak berwarna merah (Lay, 1994).
2.3.2 Bakteri Gram Positif
Bakteri gram positif mempunyai struktur dinding sel yang tebal (15-80µ m)
dan berlapis tunggal (mono). Komponen utama penyusun dinding sel adalah
2.3.2.1 Bakteri Stahpylococcus epidermidis
Berikut sistematika bakteri Sthapylococcus epidermidis (Breed, et al,
1957):
Divis (Dvisio) : Bacteriophyta
Kelas (Classis) : Schizomycetes
Bangsa (ordo) : Eubacteriales
Suku (Familia) : Micrococcaceae
Marga (Genus) : Staphylococcus
Jenis (Spesies) : Staphylococcus epidermidis
Staphylococcus epidermidis merupakan bakteri gram positif, aerob atau
anaerob fakultatif berbentuk bola atau kokus berkelompok tidak teratur, diameter
0,8 - 1,0 µm tidak membentuk spora dan tidak bergerak, koloni berwarna putih
bakteri ini tumbuh cepat pada suhu 37oC tetapi paling baik membentuk pigmen
pada suhu kamar 20oC. Koloni pada pembenihan padat berbentuk bulat halus,
menonjol, berkilau, tidak menghasilkan pigmen, berwarna putih porselen
sehingga Staphylococcus epidermidis disebut Staphylococcus albus,
koagulasi-negatif dan tidak meragi manitol.(Jawetz et al, 2001).
Staphylococcus epidermidis terdapat pada kulit, selaput lendir, bisul dan
luka. Dapat menimbulkan penyakit melalui kemampuannya berkembang biak dan
menyebar luas dalam jaringan (Jawetz et al, 2001). Bakteri penyebab utama dari
endokarditis bakterial pada penderita setelah operasi jantung(Tim Mikrobiologi
2.3.2.2 Bakteri Streptococcus viridans
Berikut sistematika bakteri Streptococcus viridans (Breed, et al, 1957):
Divis (Dvisio) : Bacteriophyta
Kelas (Classis) : Schizomycetes
Bangsa (ordo) : Lactobacillales
Suku (Familia) : Streptococcaceae
Marga (Genus) : Streptococcus
Jenis (Spesies) : Streptococcus Viridans
Streptococcus Viridans merupakan bakteri gram positif, anaerob fakultatif,
tidak bergerak, berbentuk koloni yang tersusun dalam bentuk rantai, diameter
0,6-1,0 µm. Tumbuh cepat pada suhu 37oC. Bakteri ini merupakan flora normal pada
tenggorokan, kulit, selaput otak, saluran kemih serta merupakan penyebab penting
dari penyakit saluran pernapasan manusia (endokarditis subakut)( Jawetz, et al,
2001).
Streptococcus Viridans tidak menghasilkan hemolisin yang mudah larut
(β-hemolisis) pada agar darah dan tidak menghasilkan karbohidrat C spesifik.
Sehingga Beberapa spesies menimbulkan α-hemolisis yaitu kuman mengubah
hemoglobin menjadi hijau. Beberapa spesies lagi tidak menghemolisis sel darah
disebut sebagai indefferent (α) Streptococcus(Tim Mikrobiologi FK Universitas
Brawijaya, 2003).
Bakteri gram negatif mempunyai struktur dinding sel yang tipis ( 10- 15
nm) dan berlapis tiga (multi). Dinding sel meliputi peptidoglikan dan selaput luar
yang mengandung tiga polimer yaitu lipoprotein, fosfolipida dan lipopolisakarida
(Pelczar et al, 1986 ).
2.3.3.1 Bakteri Pseudomonas aeruginosa
Berikut sistematika bakteri Pseudomonas aeruginosa (Breed, et al, 1957):
Divis (Dvisio) : Bacteriophyta
Kelas (Classis) : Schizomycetes
Bangsa (ordo) : Pseudomonadales
Suku (Familia) : Pseudomonodaceae
Marga (Genus) : Pseudomonas
Jenis (Spesies) : Pseudomonas aeruginosa
Pseudomonas aeruginosa merupakan bakteri gram negatif aerob abligat
berbentuk batang, bergerak, berukuran sekitar diameter 0,5 – 8 x 1,5 – 3,0 µm,
terlihat sebagai bakteri tunggal, berpasangan kadang – kadang membentuk rantai
yang pendek. Pseudomonas aeruginosa membentuk koloni halus bulat dengan
fluoresensi kehijauan. Bakteri ini menghasilkan piosianin suatu pigmen kebiru –
biruan yang tak berfluoresensi, yan berdifusi kedalam agar. Fluorensi dapat
dihasilkan bila biakan diinkubasi pada suhu 20 - 30o C dari pada yang diinkubasi
pada suhu 35 - 37o C (Jawetz et al, 2001).
Pseudomonas aeruginosa tersebar luas di alam biasanya terdapat di
lingkungan yang lembab. Bakteri ini menyebabkan penyakit bila pertahanan tubuh
inang abnormal. Dalam jumlah kecil, bakteri ini sering terdapat pada flora usus
Pseudomonas. Bakteri ini ini menimbulkan infeksi pada luka, meningitis, infeksi
saluran kemih dan infeksi mata (Jawetz et al, 2001).
2.3.3.2 Bakteri Citrobacter diversus
Berikut sistematika bakteri Citrobacter diversus (Breed et al, 1957):
Divis (Dvisio) : Bacteriophyta
Kelas (Classis) : Schizomycetes
Bangsa (ordo) : Eubacteriales
Suku (Familia) : Eubacteriaceae
Marga (Genus) : Citrobacter
Jenis (Spesies) : Citrobacter diversus
Citrobacter diversus sel terisolasi dari air, kotoran, tanah dan makanan
serta dari kotoran manusia dan hewan lainnya, dimana mereka mungkin penduduk
normal, Citrobacter diversus dapat ditemukan dalam air seni, dahak, dan
spesimen klinis lainnya. Organisme ini patogen opurtunistik dan dapat
menginfeksi tubuh pada semua tempat termasuk kulit (Tim Mikrobiologi FK
Universitas Brawijaya, 2003).
2.3.4 Fase Pertumbuhan Bakteri
Bakteri mengalami pertumbuhan melalui beberapa fase, yaitu:
1) Fase Penyesuaian Diri (Lag phase)
Pada saat dipindahkan ke media yang baru, bakteri tidak langsung tumbuh
dan membelah, meskipun kondisi media sangat mendukung untuk
pertumbuhan. Bakteri biasanya akan mengalami masa penyesuaian untuk
2) Fase Logaritmik (Exponensial phase)
Selama fase ini, populasi meningkat dua kali pada interval waktu yang
teratur. Jumlah koloni bakteri akan terus bertambah seiring lajunya
aktivitas metabolisme sel.
3) Fase tetap/ Fase Stasioner (Stationary phase)
Pada fase ini terjadi kompetisi antara bakteri untuk memperoleh nutrisi
dari media untuk tetap hidup. Sebagian bakteri mati sedangkan yang lain
tumbuh dan membelah sehingga jumlah sel bakteri yang hidup menjadi
tetap.
4) Fase kematian (Death phase)
Pada fase ini, sel bakteri akan mati lebih cepat daripada terbentuknya sel
baru. Laju kematian mengalami percepatan yang eksponensial (Lee, J,
1983).
Gambar 2. Kurva Fase Pertumbuhan dimana : 1. Fase penyesuaian diri
(Lag phase), 2. Fase Logaritmik (Exponensial phase), 3. Fase stasioner (Stationary phase), 4. fase kematian (Death phase).
Pembiakan bakteri dalam laboratorium memerlukan media yang berisi zat
hara serta lingkungan pertumbuhan yang sesuai bagi bakteri. Zat hara diperlukan
untuk pertumbuhan, sintesis sel, keperluan energi dalam metabolisme dan
pergerakan. Lazimnya, media biakan mengandung air, sumber energi, zat hara
sebagai sumber karbon, nitrogen, sulfur, fosfat, oksigen dan hidrogen. Dalam
bahan dasar media dapat pula ditambahkan faktor pertumbuhan berupa asam
amino dan vitamin. Media biakan dapat dikelompokkan dalam beberapa kategori,
yaitu:
I. Bedasarkan asalnya, media dibagi atas:
1) Media sintetik yaitu media yang kandungan dan isi bahan yang
ditambahkan diketahui secara terperinci. Contoh: glukosa, kalium fosfat,
magnesium fosfat.
2) Media non-sintetik yaitu media yang kandungan dan isinya tidak diketahui
secara terperinci dan menggunakan bahan yang terdapat di alam.
Contohnya: ekstrak daging, pepton (Lay, 1994).
II. Berdasarkan kegunaannya, dapat dibedakan menjadi:
1) Media selektif
Media selektif adalah media biakan yang mengandung paling sedikit satu
bahan yang dapat menghambat perkembang biakan mikroorganisme yang
tidak diinginkan dan membolehkan perkembang biakan mikroorganisme
tertentu yang ingin diisolasi.
2) Media diferensial
Media ini digunakan untuk menyeleksi suatu mikroorganisme dari
3) Media diperkaya
Media ini digunakan untuk menumbuhkan mikroorganisme yang diperoleh
dari lingkungan alami karena jumlah mikroorganisme yang ada terdapat
dalam jumlah sedikit (Irianto, K, 2006).
III. Berdasarkan konsistensinya, dibagi atas (Irianto, K, 2006):
1) Media padat/ solid
2) Media semi solid
3) Media cair
2.3.6 Pengukuran Aktivitas Antibakteri
Pengukuran aktivitas antibakteri dapat dilakukan dengan metode dilusi
(pengenceran) atau dengan metode difusi.
a. Metode Dilusi
Metode ini menggunakan antimikroba dengan konsentrasi yang
berbeda-beda dimasukkan pada media cair. Media tersebut langsung diinokulasikan
dengan bakteri dan diinkubasi. Tujuan dari percobaan ini adalah menentukan
konsentrasi terkecil suatu zat antibakteri dapat menghambat pertumbuhan atau
membunuh bakteri uji. Metode dilusi agar membutuhkan waktu lama dalam
pengerjaannya sehingga jarang digunakan (Jawetz et al, 2001).
b. Metode Difusi
Metode yang paling sering digunakan adalah metode difusi agar dengan
menggunakan cakram kertas, cakram kaca, pencetak lubang. Prinsip metode ini
zat yang bersifat sebagai antibakteri di dalam media padat melalui pencadang.
Daerah hambatan pertumbuhan bakteri adalah daerah jernih di sekitar cakram.
Luas daerah hambatan berbanding lurus dengan aktivitas antibakteri, semakin
kuat daya aktivitas antibakterinya maka semakin luas daerah hambatnya. Metode
ini dipengaruhi oleh banyak faktor fisik dan kimia, misalnya: pH, suhu, zat
inhibitor, sifat dari media dan kemampuan difusi, ukuran molekul dan stabilitas
dari bahan obat (Jawetz et al, 2001).
2.3.7 Identifikasi Bakteri
Identifikasi bakteri dilakukan berdasarkan pada morfologi, sifat biakan
dan sifat biokimia dari bakteri. Mikroorganisme yang akan diisolasi dapat berupa
biakan murni atau populasi campuran. Pemurnian dilakukan dengan cara
menggores suspensi mikroba yang akan diisolasi pada agar lempengn. Setelah
diperoleh biakan murni dapat dilakukan pewarnaan gram. Setelah diperoleh
biakan murni dapat dilakukan serangkaian uji untuk memperoleh ciri morfologi
dan biokimia (Lay,1994).
Metode Isolasi Biakan Bakteri
a) Cara gores
Ose yang telah steril dicelupkan ke dalam suspensi mikroorganisme yang
diencerkan, lalu dibuat serangkaian goresan sejajar yang tidak saling
menutupi di atas permukaan agar yang telah padat.
b) Cara sebar
Suspensi mikroorganisme yang telah diencerkan diinokulasikan secara
merata dengan menggunakan hockey stick pada permukaan media padat.
Pengenceran inokulum yang berturut-turut diletakkan pada cawan petri
steril dan dicampurkan dengan medium agar cair, lalu dibiarkan memadat.
Koloni yang berkembang akan tertanam di dalam media tersebut (Stanier,
RY et al, 1982).
Tahapan isolasi
a. Pembiakan
Suspensi bakteri digoreskan pada agar lempengan, agar miring atau media
cair. Sifat biakan dari suatu mikroorganisme tergantung penampilannya
pada berbagai media.
b. Pewarnaan
Dibuat pewarnaan gram untuk mengetahui sifat gram serta morfologi
suatu mikroorganisme.
c. Uji biokimia
Setelah diperoleh koloni yang terpisah dilakukan berbagai uji biokimia
yang didasarkan pada hasil metabolisme yang disebabkan oleh daya kerja
enzim.
d. Pengawetan biakan mikroorganisme
Bila biakan hasil isolasi koloni sudah ditentukan ciri-cirinya serta sudah
ditetapkan sebagai biakan murni maka biakan mikroorganisme ini dapat
BAB III
METODE PENELITIAN 3.1 Lokasi dan Waktu Penelitian
Penelitian dilaksanakan pada bulan Maret 2010 - Agustus 2010 di
laboratorium Obat Tradisional Fakultas Farmasi Universitas Sumatera Utara dan
laboratorium Mikrobiologi Departemen Biologi Fakultas MIPA Universitas
Sumatera Utara Medan.
3.2 Metode Penelitian
Penelitian ini dilakukan secara eksperimental. Metodologi penelitian
meliputi penyiapan sampel, identifikasi/determinasi sampel, pengolahan sampel,
pembuatan ekstrak, uji aktivitas antimikroba fraksi n-heksana, fraksi etilasetat dan
fraksi etanol dari daun tumbuhan kecapi (Sandoricum koetjape.Merr) terhadap
bakteri Staphylococcus epidermidis, Streptococcus viridans, Pseudomonas
aeruginosa dan Citrobacter diversus dengan metode difusi agar menggunakan
punch hole (Pencetak lubang), kemudian daya hambat (zona jernih) diukur
dengan menggunakan jangka sorong.
3.3 Alat dan Bahan 3.3.1 Alat
Alat-alat yang digunakan adalah: Neraca kasar (Ohaus), Neraca listrik
(Mettler Toledo), rotary evaporator, freeze dryer, alat destilasi, alat-alat gelas,
aluminium foil, eksikator (Glaswerk Werthein), krus porselin, mikroskop
autoklaf (Webeco), cawan petri, inkubator (Fischer Scientific), spatula, lemari
pendingin (Toshiba), jarum ose, pinset, hot plate (Fisons), lampu bunsen, Mikro
Pipet, Pipet serologi, Pipet Tetes, Bola Karet, Kertas Perkamen, Cawan Petri,
Pencetak lubang (Punch Hole), Jangka sorong.
3.3.2 Bahan –bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah daun Kecapi
(Sandoricum koetjape.Merr), n-heksana, Etilasetat, Etanol 96%, akuades, Nutrien
Agar, Mueller Hinton Agar, larutan fisiologis NaCl 0,9% steril, etanol 70%,
larutan kristal violet, aceton, larutan safranin, larutan iodine, Media Mac. Conkey
(Oxoid), Maltosa Salt Agar, gluko sa, maltosa, laktosa, manitol, sukrosa, lndol,
Methyl-red (MR) and Voges Prouskauer (VP), Simmons Citrate Agar, Urease,
Reagen Kovacks, Reagen MR dan VP, Triple Sugar Iron Agar (TSI), bakteri
Staphylococcus epidermidis, Streptococcus viridans, Pseudomonas aeruginosa
dan Citrobacter diversus.
3.4 Pembuatan Media dan Pereaksi 3.4.1 Nutrient Agar (NA) (Oxoid, 2006)
Komposisi: Lab-lemco powder 1,0 g
Yeast extract 2,0 g
Peptone 5,0 g
Sodium chloride 5,0 g
Bacto- Agar 15,0 g
Cara pembuatan: ditimbang sebanyak 28 g NA kemudian disuspensikan
dalam erlenmeyer dengan air suling yang ditambahkan sedikit demi sedikit hingga
sempurna. Tutup erlenmeyer dengan kapas yang dilapisi aluminium foil.
Disterilkan di dalam autoklaf pada suhu 121oC tekanan 2 atm selama 15 menit.
3.4.2 Mueller Hinton Agar (MHA) (Oxoid, 2006 )
Komposisi : Beef, dehydrated infusion from 300 g
Casein hydrolysate 17,5 g
Starch 1,50 g
Bacto – Agar 17,0 g
Cara pembuatan: ditimbang sebanyak 38 g MHA kemudian disuspensikan
dalam erlenmeyer dengan air suling yang ditambahkan sedikit demi sedikit hingga
1000 ml. Dipanaskan hingga mendidih sambil sekali-kali diaduk sampai media
larut sempurna. Tutup erlenmeyer dengan kapas yang dilapisi aluminium foil.
Disterilkan di dalam autoklaf pada suhu 121o C tekanan 2 atm selama 15 menit.
3.4.3 Blood Agar (Oxoid, 2006)
Komposisi : Spesial Peptone 23,0 g
Starch 1,50 g
Sodium chloride 5,0 g
Agar 10,0 g
Cara pembuatan: ditimbang sebanyak 39 g serbuk blood agar kemudian
disuspensikan dalam erlenmeyer dengan air suling yang ditambahkan sedikit demi
sedikit hingga 1000 ml. Dipanaskan hingga mendidih sambil sekali-kali diaduk
sampai media larut sempurna. Tutup erlenmeyer dengan kapas yang dilapisi
aluminium foil. Disterilkan di dalam autoklaf pada suhu 121o C tekanan 2 atm
Jika blood agar untuk segera dipakai, dinginkan media yang telah steril
pada suhu 40-50 0C dan ketika masih cair tambahkan 3 ml darah kambing diaduk
terus untuk mencegah timbulnya gelembung udara, kemudian distribusikan
kecawan petri.
3.4.4 Media Mac. Conkey (Oxoid, 2006)
Komposisi: Peptone 20,0 g
Lactose 20,0 g
Bile Salt 1,5 g
Sodium chloride 5,0 g
Agar 12,0 g
Phenol red 0,075 g
Cristal violet 0.001 g
Cara pembuatan: ditimbang sebanyak 52 g bahan, kemudian disuspensikan
dalam erlenmeyer dengan air suling yang ditambahkan sedikit demi sedikit hingga
1000 ml. Dipanaskan sebentar sambil sekali-kali diaduk sampai media larut
sempurna. Tutup erlenmeyer dengan kapas yang dilapisi aluminium foil.
Disterilkan dalam autoklaf pada suhu 121o C dan tekanan 2 atm selama 15 menit.
3.4.5 Manitol Salt Agar (Oxoid, 2006)
Komposisi: Lab-Lemco powder 3,0 g
Peptone 5,0 g
Mannitol 5,5 g
Sodium chloride 75,0 g
Phenol red 0,025 g
Cara pembuatan: ditimbang sebanyak 111 g bahan, kemudian
disuspensikan dalam erlenmeyer dengan air suling yang ditambahkan sedikit demi
sedikit hingga 1000 ml. Dipanaskan sebentar sambil sekali-kali diaduk sampai
media larut sempurna. Lalu tutup erlenmeyer dengan kapas yang dilapisi
aluminium foil. Disterilkan dalam autoklaf pada suhu 121o C dan tekanan 2 atm
selama 15 menit.
3.4.6 Larutan Gentian violet
Komposisi: Gentian violet 5 g
Alkohol 96% hingga 100 ml
Fenol 5 g
Air suling hingga 100 ml
Cara pembuatan: ditimbang sebanyak 5 g gentian violet, kemudian dalam
erlenmeyer bertutup dilarutkan bahan dengan alkohol 96% hingga 100 ml.
Ditimbang 5 g fenol dan dilarutkan dalam air suling hingga 100 ml. Untuk
pemakaian dicampur 10 ml larutan gentian violet dan 90 ml larutan fenol, dikocok
hingga homogen (Hadioetomo, 1993).
3.4.7 Larutan Aceton-Alkohol
Komposisi: Alkohol 96% 250 ml
Aceton 250 ml
Cara pembuatan: dicampurkan alkohol 96% dan aceton, dikocok hingga
3.4.8 Larutan Safranin
Komposisi: Safranin 0,25 g
Alkohol 96% 10 ml
Air suling hingga 100 ml
Cara pembuatan: ditimbang 0,25 g safranin, kemudian dilarutkan dalam
alkohol 96% lalu ditambahkan air suling hingga 100 ml (Hadioetomo, 1993).
3.4.9 Larutan Iodine
Komposisi: Iodium 1 g
Kalium iodida 2 g
Air suling hingga 100 ml
Cara pembuatan: ditimbang 2 g kalium iodida, kemudian dilarutkan
dengan sebagian air suling. Ditimbang iodium sebanyak 1 g dan dilarutkan sedikit
demi sedikit ke dalam larutan kalium iodida, diaduk hingga larut sempurna
kemudian diencerkan dengan sisa air suling hingga 100 ml. Larutan disimpan
dalam wadah berwarna coklat (Cappuccino and Sherman, 1987).
3.4.10 Larutan NaCl 0,9%
Komposisi: Natrium Klorida 9 g
Air suling steril hingga 1000 ml
Cara pembuatan: Natrium klorida ditimbang sebanyak 9 g lalu dilarutkan
dalam air suling steril sedikit demi sedikit dalam labu takar 1000 ml sampai media
dalam erlenmeyer steril yang bertutup lalu disterilkan pada autoklaf suhu 121o C
tekanan 2 atm selama 15 menit (Depkes RI, 1979).
3.4.11 Media Cair Glukosa (Oxoid, 2006)
Komposisi: Lab-Lemco powder 3,0 g
Peptone 5,0 g
Glucose 5,5 g
pH = 6,9±0,2
Cara pembuatan:
Ditimbang sebanyak 13 g bahan, kemudian disuspensikan dalam
erlenmeyer dengan air suling yang ditambahkan sedikit demi sedikit hingga 1000
ml. Dipanaskan sebentar sambil sekali-kali diaduk sampai media larut sempurna.
Lalu masukkan media kedalam tabung reaksi sebanyak 15 ml, lalu mulut tabung
disumbat dengan kapas yang dilapisi aluminium foil. Disterilkan dalam autoklaf
pada suhu 121o C selama tekanan 2 atm selama 15 menit.
3.4.12 Media Cair Laktosa (Oxoid, 2006)
Komposisi: Lab-Lemco powder 3,0 g
Peptone 5,0 g
Lactose 5,5 g
Cara pembuatan: ditimbang sebanyak 13 g bahan, kemudian disuspensikan
dalam erlenmeyer dengan air suling yang ditambahkan sedikit demi sedikit hingga
1000 ml. Dipanaskan sebentar sambil sekali-kali diaduk sampai media larut
mulut tabung disumbat dengan kapas yang dilapisi aluminium foil. Disterilkan
dalam autoklaf pada suhu 121o C tekanan 2 atm selama 15 menit.
3.4.13 Media Cair Maltosa (Oxoid, 2006)
Komposisi: Lab-Lemco powder 3,0 g
Peptone 5,0 g
Maltose 5,5 g
Cara pembuatan: ditimbang sebanyak 13 g bahan, kemudian disuspensikan
dalam erlenmeyer dengan air suling yang ditambahkan sedikit demi sedikit hingga
1000 ml. Dipanaskan sebentar sambil sekali-kali diaduk sampai media larut
sempurna. Lalu masukkan media kedalam tabung reaksi sebanyak 15 ml, lalu
mulut tabung disumbat dengan kapas yang dilapisi aluminium foil. Disterilkan
dalam autoklaf pada suhu 121o C tekanan 2 atm selama 15 menit.
3.4.14 Media Cair Manitol (Oxoid, 2006)
Komposisi: Lab-Lemco powder 3,0 g
Peptone 5,0 g
Mannitol 5,5 g
Cara pembuatan: ditimbang sebanyak 17 g bahan, kemudian disuspensikan
dalam erlenmeyer dengan air suling yang ditambahkan sedikit demi sedikit hingga
1000 ml. Dipanaskan sebentar sambil sekali-kali diaduk sampai media larut
sempurna. Lalu masukkan media kedalam tabung reaksi sebanyak 15 ml, lalu
mulut tabung disumbat dengan kapas yang dilapisi aluminium foil. Disterilkan
3.4.15 Media Cair Sukrosa (Oxoid, 2006)
Komposisi: Lab-Lemco powder 3,0 g
Peptone 5,0 g
Sukrose 5,5 g
Cara pembuatan: ditimbang sebanyak 13 g bahan, kemudian disuspensikan
dalam erlenmeyer dengan air suling yang ditambahkan sedikit demi sedikit hingga
1000 ml. Dipanaskan sebentar sambil sekali-kali diaduk sampai media larut
sempurna. Lalu masukkan media kedalam tabung reaksi sebanyak 15 ml, lalu
mulut tabung disumbat dengan kapas yang dilapisi aluminium foil. Disterilkan
dalam autoklaf pada suhu 121o C tekanan 2 atm selama 15 menit.
3.4.16 Media lndol (Oxoid, 2006)
Komposisi: Sodium chloride cristal 5,0 g
Peptone 10,0 g
Cara pembuatan: ditimbang sebanyak 15 g bahan, kemudian disuspensikan
dalam erlenmeyer dengan air suling yang ditambahkan sedikit demi sedikit hingga
1000 ml. Dipanaskan sebentar sambil sekali-kali diaduk sampai media larut
sempurna. Lalu masukkan kedalam tabung reaksi 10 ml mulut tabung disumbat
dengan kapas yang dilapisi aluminium foil. Disterilkan dalam autoklaf pada suhu
121o C tekanan 2 atm selama 15 menit.
3.4.17 Media Methyl-red ( MR ) and Voges Prouskauer ( VP ) (Oxoid, 2006)
Komposisi: Peptone 7,0 g
Glukose 5,0 g
Cara pembuatan: ditimbang sebanyak 17 g bahan, kemudian disuspensikan
dalam erlenmeyer dengan air suling yang ditambahkan sedikit demi sedikit hingga
1000 ml. Dipanaskan sebentar sambil sekali-kali diaduk sampai media larut
sempurna. Lalu masukkan kedalam tabung reaksi 10 ml mulut tabung disumbat
dengan kapas yang dilapisi aluminium foil. Disterilkan dalam autoklaf pada suhu
121o C tekanan 2 atm selama 15 menit.
3.4.18 Simmons Citrate Agar (Oxoid, 2006)
Komposisi: Magnesium sulphate 0,2 g
Ammonium dihydrogen phosphate 0,2 g
Sodium ammonium phosphate 0,8 g
Sodium citrate, tribasic 2,0 g
Sodium chloride 5,0 g
Cristal violet 0,08 g
Agar 15,0 g
Cara pembuatan: ditimbang sebanyak 23 g bahan, kemudian disuspensikan
dalam erlenmeyer dengan air suling yang ditambahkan sedikit demi sedikit hingga
1000 ml. Dipanaskan sebentar sambil sekali-kali diaduk sampai media larut
sempurna. Lalu masukkan kedalam tabung reaksi 10 ml mulut tabung disumbat
dengan kapas yang dilapisi aluminium foil. Disterilkan dalam autoklaf pada suhu
121o C tekanan 2 atm selama 15 menit. Kemudian keluarkan tabung reaksi dari
autoklaf letakkan pada posisi miring dan biarkan hingga membeku.
3.4.19 Reagen test IMVIC (Indol, Methyl red, Voges proskauer, Simon sitrat) 3.4.19.1 Reagen Kovacks (Oxoid, 2006)
Amyl alkohol 75 ml
HCl pekat 25 ml
Cara pembuatan: didalam botol P.Dimethyl amino benzaldehid
dilarutkan dalam Amy alkohol. Bila tidak larut panaskan di water bath
lalu dinginkan, setelah dingin tambahkan HCl pekat perlahan – lahan
melalui dinding botol.
3.4.19.2 Reagen Methyl red (Oxoid, 2006)
Komposisi: Methyl red 0,02 g
Etanol 95 % 60 ml
Cara pembuatan: Methyl red dilarutkan dalam etanol 95 %, setelah
larut cukupkan
volume air suling sampai 100 ml.
3.4.19.3 Reagen Voges Proskauer (Oxoid, 2006)
Komposisi terdiri dari 2 larutan:
1. Larutan Naphtol 5 %
Komposisi: Alpha Naphtol 5 g
Etanol 95 % ad 100 ml
Cara pembuatan:
Alpha Naphtol dilarutkan dalam etanol 95 %, kocok
hingga larut sempurna.
2. Larutan KOH 40 %
Air suling ad 100 ml
Cara pembuatan:
KOH dilarutkan dalam 100 ml air suling, kocok
hingga larut sempurna.
3.4.20 Urease (Oxoid, 2006)
Komposisi: Peptone 1,0 g
Dextrose 1,0 g
Sodium chloride 5,0 g
Disodium phosphate 1,2 g
Potassium dihydrogen phosphate 0,8 g
Phenol red 0,08 g
Agar 15,0 g
Cara pembuatan: ditimbang sebanyak 24 g bahan, kemudian disuspensikan
dalam erlenmeyer dengan air suling yang ditambahkan sedikit demi sedikit hingga
1000 ml. Dipanaskan sebentar sambil sekali-kali diaduk sampai media larut
sempurna. Lalu masukkan kedalam tabung reaksi 10 ml mulut tabung disumbat
dengan kapas yang dilapisi aluminium foil. Disterilkan dalam autoklaf pada suhu
121o C tekanan 2 atm selama 15 menit. Kemudian keluarkan tabung reaksi dari
autoklaf letakkan pada posisi miring dan biarkan hingga membeku.
3.4.21 Triple Sugar Iron Agar (TSIA) (Oxoid, 2006)
Komposisi: Lab-lemco powder 3,0 g
Yeast extract 3,0 g
Peptone 20,0 g
Lactose 10,0 g
Sukrose 10,0 g
Glucose 1,0 g
Ferric citrate 1,0 g
Sodium thiosulphate 0,3 g
Phenol red 0,024 g
Agar 12,00 g
Cara pembuatan: ditimbang sebanyak 65 g bahan, kemudian disuspensikan
dalam erlenmeyer dengan air suling yang ditambahkan sedikit demi sedikit hingga
1000 ml. Dipanaskan sebentar sambil sekali-kali diaduk sampai media larut
sempurna. Lalu masukkan kedalam tabung reaksi 10 ml mulut tabung disumbat
dengan kapas yang dilapisi aluminium foil. Disterilkan dalam autoklaf pada suhu
121o C tekanan 2 atm selama 15 menit. Kemudian keluarkan tabung reaksi dari
autoklaf letakkan pada posisi miring dan biarkan hingga membeku.
3.4.22 Suspensi standar Mc.Farland
Suspensi standar yang menunjukkan konsentrasi kekeruhan suspensi
bakteri sama dengan 108 CFU/ml.
Komposisi: Larutan asam sulfat 1% 99,5 ml
Larutan barium klorida 1,175% b/v 0,5 ml
Cara pembuatan:
Kedua larutan dicampurkan dalam tabung reaksi steril, dikocok sampai
homogen dan ditutup. Apabila kekeruhan hasil suspensi bakteri sama dengan
kekeruhan suspensi standar berarti konsentrasi bakteri 108 CFU/ml (Vandepitte,
3.5 Penyiapan Sampel
Penyiapan sampel meliputi pengambilan sampel, identifikasi sampel dan
pengolahan sampel.
3.5.1 Pengambilan sampel
Pengambilan sampel dilakukan secara purposif yaitu tanpa
membandingkan dengan tumbuhan yang sama dari daerah lain. Sampel yang
digunakan adalah daun tumbuhan kecapi (Sandoricum koetjape.Merr) yang
diperoleh dari daerah jln. Pangkalan Brandan Dusun II Desa Beras Basah, Gang
Nusantara Kecamatan Pangkalan Susu Kabupaten Langkat. Gambar Morfologi
sampel Tumbuhan dapat dilihat pada lampiran 2 halaman 64
3.5.2 Identifikasi Sampel
Identifikasi sampel dilakukan di Laboratorium Taksonomi Tumbuhan
Departemen Biologi Fakultas MIPA Universitas Sumatera Utara Medan.
Hasil identifikasi sampel dapat dilihat pada lampiran I halaman 63
3.5.3 Pengolahan Sampel
Sampel yang digunakan adalah daun kecapi (Sandoricum koetjape Merr.)
yang masih segar, dicuci bersih dengan air mengalir, ditiriskan lalu ditimbang
berat basahnya yaitu 12,7 Kg, dikeringkan dalam lemari pengering pada suhu 40 –
50 oC hingga kering. Daun telah dianggap kering jika daun diremas menjadi
hancur, Setelah kering sampel ditimbang sebagai berat kering yaitu 5 Kg,
selanjutnya diserbukkan dengan menggunakan blender, diayak lalu ditimbang
beratnya yaitu 4,7 Kg. Serbuk simplisia disimpan dalam wadah.
Sebanyak 1200 g serbuk simplisia daun kecapi dimaserasi dengan 4 liter
n-heksana dalam wadah tertutup rapat, rendam selama 5 hari terlindung dari
cahaya dan sering diaduk, kemudian disaring, ampas dimaserasi kembali dengan 3
liter pelarut n-heksana dan filtrat yang diperoleh dienapkan selama 2 hari
kemudian dituang melalui penyaring. Semua maserat digabung menjadi satu lalu
dipekatkan dengan bantuan alat rotari evaporator sampai diperoleh fraksi kental,
kemudian fraksi di freeze dryer dan ditimbang. Diperoleh berat fraksi n-heksana
daun kecapi 24,5 g.
Kemudian ampasnya dimaserasi kembali dengan 4 liter etilasetat dalam
wadah tertutup rapat, rendam selama 5 hari terlindung dari cahaya dan sering
diaduk, kemudian disaring, ampas dimaserasi kembali dengan 3 liter pelarut
etilasetat dan filtrat yang diperoleh dienapkan selama 2 hari kemudian dituang
melalui penyaring. Semua maserat digabung menjadi satu lalu dipekatkan dengan
bantuan alat rotari evaporator sampai diperoleh fraksi kental, kemudian fraksi di
freeze dryer dan ditimbang. Diperoleh berat fraksi etilaetat daun kecapi 38,6 g.
Kemudian ampasnya dimaserasi kembali dengan 4 liter etanol 96% dalam
wadah tertutup rapat, rendam selama 5 hari terlindung dari cahaya dan sering
diaduk, kemudian disaring, ampas dimaserasi kembali dengan 3 liter pelarut
etanol 96% dan filtrat yang diperoleh dienapkan selama 2 hari kemudian dituang
melalui penyaring. Semua maserat digabung menjadi satu lalu dipekatkan dengan
bantuan alat rotari evaporator sampai diperoleh fraksi kental, kemudian ekstrak di
freeze dryer ( + - 40oC) dan ditimbang. Diperoleh berat fraksi etanol daun kecapi
38,5 g.
3.7.1 Sterilisasi Alat
Alat-alat yang digunakan dalam uji aktivitas antimikroba ini disterilkan
terlebih dahulu sebelum dipakai. Alat – alat gelas disterilkan di dalam oven pada
suhu 1700C selama 1 jam. Sebelum mulai pengerjaan meja dibersihkan dari debu
dan dilap menggunakan cairan desinfektan, untuk daerah sekitar pengerjaan
disemprot dengan etanol 70% dan dibiarkan selama 15 menit sebelum digunakan.
Media disterilkan di autoklaf pada suhu 121o C tekanan 2 atm selama 15 menit.
Jarum ose dan pinset disterilkan dengan cara dibakar dengan lampu bunsen (Lay
dan Sugyo, 1992).
3.7.2 Pembuatan Agar Miring
Ke dalam tabung reaksi dimasukkan 5 ml media nutrien agar, didiamkan
pada suhu kamar sampai sediaan membeku pada posisi miring kira-kira 45o C
kemudian disimpan dalam lemari pendingin.
3.7.3 Pembuatan Stok Kultur
Masing-masing sebanyak satu ose dari biakan murni bakteri
Staphylococcus epidermidis, Streptococcus viridans, Pseudomonas aeruginosa,
Citrobacter diversus, digoreskan dengan metode sinambung pada permukaan
Nutrien Agar miring, ditutup mulut tabung reaksi dengan kapas. Diinkubasi
selama 18-24 jam pada suhu 35 + 2 oC.
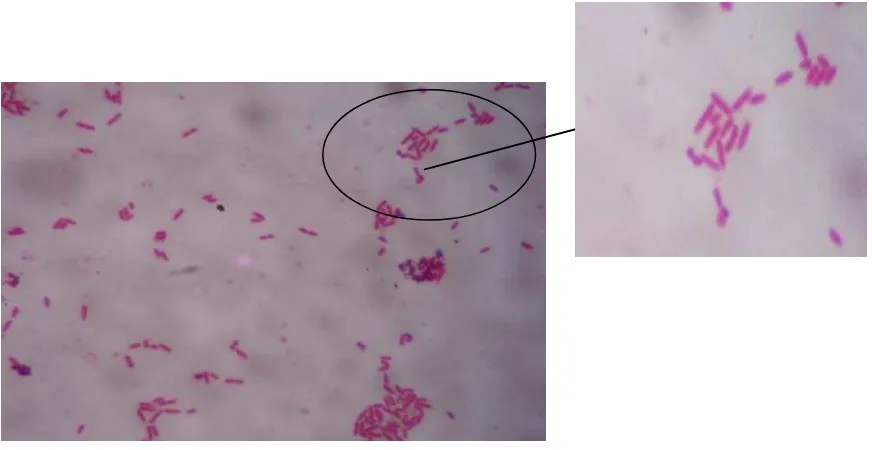
3.7.4 Uji Identifikasi Bakteri 3.7.4.1 Pengecatan Gram
Cara : Sediakan objek glass, dicuci dengan alkohol lalu difiksasi di atas
api bunsen. Lalu teteskan satu tetes air suling pada objek glass, lalu ambil
Streptococcus viridans, Pseudomonas aeruginosa dan Citrobacter diversus
dihomogenkan atau disuspensikan, ratakan dan keringkan dengan fiksasi.
Kemudian tambahkan satu tetes gentian violet sampai menutupi seluruh
sediaan. Didiamkan selama 1 menit dan dibilas dengan air suling. Lalu
tambahkan satu tetes larutan iodium dan dibilas dengan air suling. Dibilas
objek glass dengan aceton-alkohol hingga sediaan tidak berwarna, keringkan.
Kemudian tetesi dengan larutan safranin, biarkan 30-60 detik, Dibilas larutan
safranin dengan air suling sampai bersih dan dikeringkan. Tetesi dengan
minyak imersi, dilihat dibawah mikroskop (Hadioetomo, 1993).
Hasilnya dapat dilihat pada lampiran 6 halaman 71-72
3.7.4.2 Pertumbuhan Bakteri pada Media Selektif
- Masing-masing sebanyak satu ose dari stok kultur Pseudomonas aeruginosa
dan Citrobacter diversus digoreskan dengan metode sinambung pada
permukaan cawan petri yang berisi media Mac. Conkey, tutup cawan petri
dan dibungkus. Diinkubasi selama 18-24 jam pada suhu 35 + 2 oC.
- Masing-masing sebanyak satu ose dari stok kultur bakteri Staphylococcus
epidermidis dan Staphylococcus aureus digoreskan dengan metode
sinambung pada permukaan cawan petri yang berisi media MSA, tutup
cawan petri dan dibungkus. Diinkubasi selama 18-24 jam pada suhu 35 +
2 oC
- Sebanyak satu ose dari stok kultur bakteri Streptococcus viridans digoreskan
dengan metode sinambung pada permukaan cawan petri yang berisi media
blood agar, tutup cawan petri dan dibungkus. Diinkubasi selama 18 – 24 jam
Hasilnya dapat dilihat pada lampiran 7 halaman 73-74
(Cappuccino and Sherman, 1987).
3.7.4.3 Uji Biokimia
A. Uji Karbohidrat (Cappuccino and Sherman, 1987)
Siapkan media cair Glukosa (tabung I), Laktosa (tabung II), Maltosa
(tabung III), Manitol (tabung IV) dan Sukrosa (tabung V). Sediakan satu
tabung sebagai kontrol. Pada masing-masing tabung diberi tabung Durham
(mulut tabung di bawah). Tutup semua mulut tabung reaksi dengan kapas dan
disterilkan di autoklaf pada suhu 121o C selama 15 menit. Inokulasikan
bakteri Pseudomonas aeruginosa dan Citrobacter diversus ke dalam tabung I
dan II. Diinkubasi pada suhu 35 + 2 oC selama 24 jam. Lalu amati.
Hasilnya:
karbohidrat (+) : Jika terjadi perubahan dari warna biru tua menjadi kuning
karbohidrat (-) : Jika tidak terjadi perubahan warna ( Tetap biru tua )
Hasilnya dapat dilihat pada lampiran 9 halaman 76-80.
B. Uji Katalase
Sebanyak satu ose dari stok kultur bakteri Staphylococcus epidermidis dan
Staphylococcus aureus diletakkan pada objek gelas. Tambahkan 1 – 2 tetes
H202 3%. Lalu amati.
Hasilnya: Katalase (+) : adanya gelembung - gelembung udara (ada aktivitas)
Katalase (-) : tidak adanya gelem