THE INFLUENCE OF MICROWAVE PRETREATMENT TO THE
CHARACTERISTIC OF ENZYMES ACCEPTANCE IN FERMENTABLE SUGAR
PRODUCTION FROM SAGO PITH (Metroxylon sagu)
Mangunwidjaja, D., Sunarti, TC., Sitanggang, JM.
Department of Agroindustrial Technology, Faculty of Agricultural Technology, Bogor Agricultural University, Darmaga IPB Campus, PO Box 220, Bogor, West Java, Indonesia.
Phone : 62 813 65567571, email: jacqualineolin@yahoo.com
I. PENDAHULUAN
A. LATAR BELAKANG
Kebutuhan masyarakat akan Bahan Bakar Minyak (BBM) sejatinya akan terus menimbulkan permasalahan, kebutuhan yang kian meningkat tidak sepadan dengan ketersediaan bahan bakar fosil yang pada dasarnya bersifat unrenewable. Pengembangan Bahan Bakar Nabati seperti bioetanol merupakan strategi yang tepat guna mengurangi pemakaian BBM yang jumlahnya semakin menipis. Terkait dengan diversifikasi konsumsi bahan nabati sebagai bahan baku bioetanol, harus diperhatikan bahwa konsumsi bahan nabati sebagai bahan baku bioetanol seharusnya tidak sampai mengganggu fungsi utama bahan nabati itu sendiri yaitu sebagai sumber karbohidrat manusia. Artinya, bahan bakar nabati tersebut merupakan sumber karbohidrat yang bersifat non competitive dengan bahan nabati lainnya dalam hal pangan.
Sagu merupakan sumber karbohidrat yang potensial untuk digunakan bahan baku pembuatan bioetanol, dilihat dari luas areal sagu di Indonesia yang saat ini sekitar 51.3% dari luas perkebunan sagu dunia sementara pemanfaatannya di Indonesia saat ini hanya sekitar 4-5% dari potensi produksinya yaitu sekitar 5 juta ton pati kering. Empulur sagu merupakan substrat yang heterogen karena terdiri dari pati dan komponen serat. Komponen serat dapat dikonversi menjadi gula-gula sederhana namun keberadaannya dapat mengurangi efisiensi hidrolisis akibat dari keterbatasan aksesibilitas dari enzim untuk selulosa. Oleh karena itu, perlakuan pendahuluan (pretreatment) menjadi penting dalam meningkatkan efisiensi hidrolisis enzimatik. Pretreatment dengan menggunakan gelombang mikro (microwave) dapat membuat pati tergelatinisasi, menghilangkan lignin, mengurangi kristalinitas dan meningkatkan porositas selulosa dalam biomassa. Hidrolisis enzimatis empulur sagu untuk menghasilkan gula-gula sederhana terdiri dari dua tahap yaitu likuifikasi (α-amilase) dan sakarifikasi (dextrozyme, selulase dan xilanase). Dalam tahap konversi empulur sagu menjadi gula-gula sederhana, dibutuhkan konsorsium enzim dalam tahap sakarifikasi agar komponen serat juga dapat dikonversi menjadi gula-gula sederhana.
Konsentrasi enzim berpengaruh terhadap hidrolisis substrat. Konsentrasi enzim mempengaruhi kinetika reaksi hidrolisis dimana dengan semakin meningkatnya jumlah enzim yang ditambahkan ke dalam substrat maka kinetika enzim dalam menghidrolisis substrat semakin meningkat sehingga jumlah produk yang terbentuk semakin meningkat dan jumlah substrat yang tersisa semakin sedikit. Namun, pada konsentrasi tertentu, aktivitas enzim tidak akan meningkat lagi karena jumlah enzim dalam substrat sudah mengalami kejenuhan.
2
diharapkan akan meningkatkan konsentrasi gula-gula sederhana yang dihasilkan sebagai substrat pada fermentasi bioetanol sehingga juga dapat meningkatkan rendemen bioetanol.
B. TUJUAN
II. TINJAUAN PUSTAKA
A. SAGU (
Metroxylon sagu
)
1. Botani dan Budidaya Sagu
Sagu adalah tanaman sumber karbohidrat berbiji tunggal yang batangnya menghasilkan sagu. Sagu memiliki daun sirip, menyerupai daun kelapa yang tumbuh pada tangkai daun kelapa. Daun sagu muda berangsur-angsur berubah menjadi coklat kemerah-merahan apabila sudah tua dan matang. Bunga sagu berbentuk rangkaian yang keluar pada ujung batang. Bunga ini tumbuh didahului dengan tanda mengecilnya daun bendera. Tanaman sagu berbunga pada umur 8-15 tahun, tergantung pada kondisi tanah, tinggi tempat tumbuh dan varietas. Batang pohon sagu dapat dilihat pada Gambar 1 di bawah ini.
Gambar 1. Batang pohon sagu
Pohon sagu (Metroxylon sp.) berkembang biak melalui tunas akar sehingga tumbuh berkelompok atau dengan bijinya. Di Maluku dan Papua, pohon sagu tumbuh secara alami tanpa adanya budidaya. Taksonomi tanaman sagu menurut Haryanto dan Pangloli (1992) adalah sebagai berikut :
Divisi : Spermathophyta Ordo : Spadiciflorae Kelas : Angiospermae Subkelas : Monocotyledonae Famili : Palmae
Genus : Metroxylon
4 dan Arenga, karena kandungan patinya cukup tinggi. Sagu dari genus Metroxylon, secara garis besar digolongkan menjadi dua, yaitu : yang berbunga/berbuah dua kali (Pleonanthic) dan berbunga/berbuah sekali (Hapaxantic) yang mempunyai nilai ekonomis penting, karena kandungan karbohidratnya lebih tinggi. Golongan ini terdiri dari 5 varietas penting, yaitu :
a) Metroxylon sagus, Rottbol atau sagu Molat. b) Metroxylon rumphii, Martius atau sagu Tuni.
c) Metroxylon rumphii, Martius varietas Sylvestre Martius atau sagu Ihur.
d) Metroxylon rumphii, Martius varietas Longispinum Martius atau sagu Makanaru. e) Metroxylon rumphii, Martius varietas Microcanthum Martius atau sagu Rotan.
Dari kelima varietas tersebut, yang memiliki arti ekonomis penting adalah Ihur, Tuni, dan Molat (Anonim 2004).
Tumbuhan sagu banyak terdapat di daerah rawa air tawar, rawa bergambut, rawa air payau dengan kadar garam rendah, di sepanjang aliran sungai, dan di sekitar sumber air (Soeroso 2008). Persyaratan ekologis untuk pertumbuhan tanaman sagu adalah pada ketinggian 0-700 m di atas permukaan laut, jumlah curah hujan antara 2000-4000 mm per tahun yang tersebar merata sepanjang tahun (Restiwati 1996).
2. Potensi dan Produksi Sagu
Indonesia memiliki pertanaman sagu dan hutan sagu yang luas dan tersebar di berbagai pulau. Areal sagu di Indonesia dapat dijumpai dari Sabang sampai Merauke dengan karakteristik yang beraneka dan nama lokal yang beragam. Pertanaman sagu dan hutan sagu di dunia diperkirakan mencapai 2 juta ha, 51.3% (1.12 juta ha) berlokasi di Indonesia (Flach 1983) dalam Abbas et al. (2009). Kertopermono (1996) dalam Abbas et al. (2009) melaporkan bahwa luas areal sagu di Indonesia jauh lebih luas dibanding dengan yang dilaporkan Flach (1983) yaitu seluas 1,528,917 ha dengan penyebaran : Irian Jaya 1,406,469 ha; Maluku 41,949 ha; Sulawesi 45,540 ha; Kalimantan 2,795 ha; Jawa Barat 292 ha; dan Sumatera 31,872 ha. Luas areal penyebaran tanaman sagu di Indonesia tidak menyebar rata. Flach (1983) memperkirakan keragaman sagu di Indonesia lebih tinggi dijumpai di propinsi Papua dibandingkan dengan pulau-pulau lainnya di Indonesia.
Sagu adalah tanaman sumber pati di daerah tropis dan banyak memberikan perhatian karena produktivitas pati yang cukup tinggi. Bahkan sagu adalah satu-satunya tanaman yang dapat tumbuh di lahan gambut dimana pH areanya sangat rendah, level air tanahnya tinggi dan kandungan mineralnya sangat rendah tanpa adanya perbaikan tanah. Lahan gambut di Asia diperkirakan mencapai 20-30 juta ha (Fukui 1984 and Kyuma 1992 dalam Yamamoto 2004).
5
B. SIFAT FISIK DAN KIMIA EMPULUR SAGU
Salah satu bagian terpenting dari tumbuhan sagu adalah batang sagu. Di dalam batang sagu tersimpan sejumlah amilum (pati). Batang tumbuhan sagu adalah biomassa karbohidrat bersifat polisakarida dengan struktur rantai panjang dan dapat bercabang yang tersusun dari unit-unit monosakarida. Empulur sagu merupakan batang sagu yang telah dipisahkan dari kulit dan serat batang sagu. Batang sagu sendiri menurut Haryanto dan Pangloli (1992) terdiri dari lapisan bagian luar yang keras, dan bagian dalam yang mengandung pati dan serat.
Gambar 2. Penampang membujur batang sagu (Ramalatu 1981)
Yamamoto (2004) menjelaskan bahwa pati pada empulur sagu terakumulasi dari bagian tengah di batang bawah sampai ke sekeliling bagian batang atas. Persentase maksimum pati sagu dicapai beberapa tahun sesudah pembentukan batang. Persentase pati menunjukkan hubungan positif dan negatif dengan persentase bobot kering empulur dan persentase total gula masing-masing. Perubahan kandungan pati sesudah pembentukan batang berhubungan dengan bobot kering empulur daripada persentase patinya. Kandungan pati tertinggi di dalam empulur (200-250 kg pati kering) telah diteliti di sepanjang tahap berbunga dan setelah itu kandungannya berkurang karena tranlokasi menjadi bunga dan buah.
Menurut Safitri et al. (2009), empulur sagu mengandung 57.25% pati, 31.59% serat, dan mengandung air sebanyak 11.16%. Komposisi kimia empulur sagu berdasarkan penelitian Fuji et al.
(1986) disajikan pada Tabel 1.
Tabel 1. Komposisi Kimia Empulur Sagu
Komponen Empulur utuh (%) Bagian Luar (%) Bagian Tengah (%) Bagian Dalam (%)
Pati 83.50 81.51 83.20 84.72
Lemak kasar 0.38 0.49 0.38 0.31
Serat kasar 3.32 4.20 3.33 3.20
Abu 3.80 4.00 3.50 3.20
Protein 1.15 1.76 1.27 1.06
Pentosan 2.87 - - -
Air 9.79 12.03 12.74 12.67
6 Menurut Haryanto dan Pangloli (1992), kandungan pati dalam empulur batang sagu berbeda-beda tergantung dari umur, jenis, dan lingkungan tempat tanaman sagu tersebut tumbuh. Semakin tua umur tanaman sagu maka kandungan pati dalam empulur sagu semakin besar dan pada umur tertentu kandungan pati tersebut akan menurun. Penurunan kandungan pati biasanya ditandai dengan mulai terbentuknya primordial bunga. Demikian pula seperti yang diutarakan oleh Yamamoto (2004), bahwa kandungan pati tertinggi di dalam empulur berada di sepanjang tahap berbunga dan setelah itu kandungannya berkurang karena translokasi menjadi bunga dan buah. Selain mengandung pati, pada empulur masak panen terdapat senyawa lignin sebesar 9-22% serta senyawa fenolik <1% (Cecil et al. 1982).
Menurut Safitri et al. (2009), empulur sagu dengan cepat menjadi coklat di sepanjang bagian vaskular dan timbul titik coklat di bagian empulurnya. Warna coklat yang terbentuk berikatan kuat dengan pati empulur sagu sehingga akan berdampak pada penurunan kualitas pati dan berpengaruh negatif pada kerja enzim sehingga empulur sagu yang telah dikeringkan selanjutnya disimpan dengan cara dikemas dalam plastik. Intensitas warna coklat ini dipengaruhi oleh senyawa-senyawa fenolik yang dapat berasal dari air yang digunakan selama proses penanganan pasca panen. Menurut Subagyo et al. (1996), wilayah pertumbuhan tanaman sagu sebagian besar berada pada hutan rawa yang dialiri oleh sungai yang berwarna hitam. Sungai yang berwarna hitam memiliki nutrisi yang rendah dan tinggi akan kandungan senyawa polifenol yang memberikan warna coklat pada air di sekitar tempat tumbuhnya tanaman sagu.
C. PEMANASAN DENGAN GELOMBANG MIKRO (
MICROWAVE
)
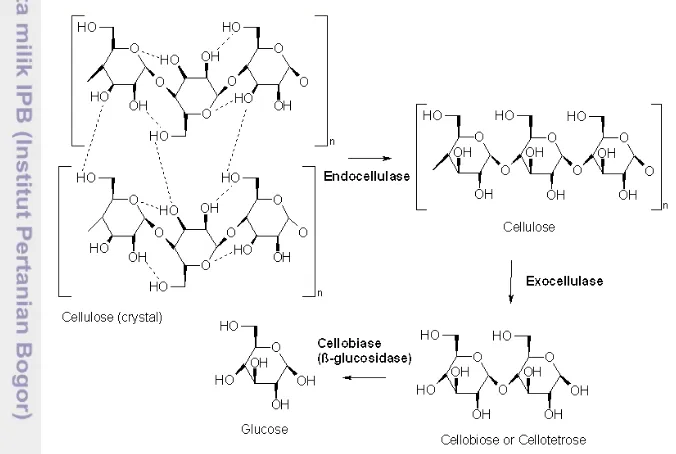
Empulur sagu merupakan substrat yang heterogen, karena selain mengandung pati juga mengandung komponen serat. Serat kasar merupakan komponen yang terdiri dari dinding sel, pektin, selulosa, hemiselulosa, lignin, dan pentosan. Sebagian besar serat mengandung tiga komponen utama, yaitu : selulosa, lignin, dan hemiselulosa dengan perbandingan sekitar 4 : 3: 3 sehingga sering disebut dengan istilah lignoselulosa. Besarnya perbandingan antara ketiga komponen tersebut tergantung pada jenis tanamannya. Selulosa merupakan bagian terbesar dari komponen lignoselulosa tanaman, dapat dicirikan sebagai polimer linier yang memiliki berat molekul tinggi. Ikatan β-1,4 glikosida yang kuat dari selulosa dapat berbentuk kristal mikrofibril, yang kemudian bersama-sama membentuk serat selulosa yang bersifat tidak larut (Winarno 1998). Hemiselulosa merupakan selulosa yang memiliki berat molekul rendah dan monomer gula penyusun yang bervariasi daripada selulosa. Monomer penyusun selulosa ialah glukosa sedangkan pada hemiselulosa terdiri dari kelompok heksosa, pentosa, asam heksuronat, dan deoksi heksosa. Lignin merupakan senyawa polimer yang berikatan dengan selulosa dan hemiselulosa pada jaringan tanaman (Gambar 3).
7 Gambar 3. Struktur ligoselulosa (Anonim 2008)
Metode perlakuan pendahuluan (pretreatment) dengan pemanasan gelombang mikro (microwave) melibatkan penerapan radiasi gelombang mikro untuk biomassa pada lingkungan yang cair (slurry). Alasan pemilihan pemanasan gelombang mikro sebagai perlakuan pendahuluan dilihat dari dua aspek. Pertama dari aspek fisik, radiasi gelombang mikro memberikan pasokan panas internal ke biomassa yang dihasilkan dari polar di biomassa dan sekitar media air. Radiasi ini menghasilkan medan magnet yang berubah secara terus menerus hingga menyebabkan kutub (polar) mendadak bergerak karena sejajar dengan medan magnet. Adanya perubahan yang mendadak tersebut menyebabkan autoreaksi kimia dan fisik pada substrat yang menghasilkan energi panas dengan medium air. Energi panas yang dihasilkan mampu merusak struktur kristalin pati dan serat serta membuat kondisi pati tergelatinisasi (Sridar 1998 Dalam Deepak 2010). Kedua, perlakuan termal bahan lignoselulosa dalam media air bermanfaat untuk melepaskan asam asetat, sehingga memberikan lingkungan yang asam untuk autohidrolisis (Lora dan Wayman 1978 Dalam Deepak 2010). (Gambar 4).
Gambar 4. Proses perusakan lignoselulosa oleh gelombang mikro (Anonim 2011)
Perlakuan pendahuluan menggunakan gelombang mikro dilakukan dengan tujuan : 1) meningkatkan pembentukan gula-gula sederhana melalui hidrolisis enzimatik dengan membentuk kondisi pati dan serat yang sesuai untuk hidrolisis enzimatis; 2) menghindari degradasi atau kehilangan karbohidrat yang tidak dapat terhidrolisis oleh enzim; 3) menghindari pembentukan produk samping yang dapat menghambat proses hidrolisis dan fermentasi, 4) meminimumkan biaya untuk perlakuan pendahuluan.
Lignin
Selulosa Hemiselulosa
8
D. ENZIM AMILOLITIK DAN HOLOSELULOLITIK
1.
α
-amilase
Pada proses likuifikasi, α-amilase hanya memecah ikatan α-1,4-glikosidik yang terdapat pada amilosa menghasilkan polimer yang dikenal sebagai dekstrin. Ikatan α-1,6- dalam amilopektin tidak bisa dihidolisa oleh enzim ini (Meyer, 1973). Mekanisme kerja α-amilase terdiri dari dua tahap, yaitu tahap pertama degradasi amilosa menjadi maltosa dan maltotriosa yang terjadi secara acak. Hal ini diikuti menurunnya viskositas dengan cepat. Tahap kedua terjadi pembentukan glukosa dan maltosa sebagai hasil akhir dan tidak acak. Pada tahap ini pembentukan relatif sangat lambat, sedangkan pada molekul amilopektin kerja α-amilase akan menghasilkan glukosa, maltosa, dan satu seri α-limit dekstrin, serta oligosakarida yang terdiri dari empat atau lebih glukosa yang mengandung ikatan α-1,6-glikosidik (Winarno 1986). Pengukuran aktivitas enzim alfa amilase ini akan ditentukan mengukur hasil degradasi pati, yaitu penurunan kadar pati menjadi bahan yang terlarut atau jumlah dekstrin yang dihasilkan. Selain itu menurut Winarno (1986), pengukuran pati juga dapat dilakukan dengan pengukuran total gula dan gula pereduksi yang terbentuk.
Enzim α-amilase atau endoamilase dapat berasal dari hewan, tumbuhan, maupun mikroorganisme. Termamyl adalah nama dagang enzim α-amilase yang berasal dari Bacillus licheniformis. Enzim ini berupa cairan dengan berat jenis 1.20-1.25 g/ml dan stabil pada suhu 110oC (Anonim 1984). Fullbrook (1984), menyebutkan bahwa α-amilase yang berasal dari Bacillus licheniformis
optimum pada suhu tinggi bahkan melebihi 90oC. Selain itu menurut Naz (2002), alfa amilase yang berasal dari Bacillus licheniformis memiliki pH kisaran optimum pada 5-7 dengan suhu optimum 90o -105oC.
2. Dextrozyme
Dextrozyme merupakan gabungan enzim amiloglusidase (AMG) atau α-1,4-D-glukan glukohidrolase dan pullulanase atau α-dextrin endo-1,6-glukosidase. Amiloglukosidase murni memecah ikatan α-1,4-glikosidik secara sempurna pada amilosa, amilopektin, dan glikogen dari ujung non pereduksi. Amiloglukosidase juga dapat memotong ikatan α-1,6-glikosidik. Produk yang dihasilkan oleh enzim amiloglukosidase ialah glukosa sehingga dapat dibedakan dengan α-amilase dan β-amilase (Winarno 1983).
Amiloglukosidase memecah ikatan polisakarida dari luar dan melepaskan unit-unit glukosa
secara teratur dari ujung non reduksi polimer-polimer pati (Kulp 1975). Meskipun amiloglukosidase dapat memotong ikatan cabang α-1,6-glikosidik, namun kerja enzim amiloglukosidase relatif lambat sehingga diperlukan debrancing enzyme yang kerjanya relatif lebih cepat dibandingkan kerja amiloglukosidase sehingga mempercepat pemotongan ikatan α-1,6-glikosidik. Salah satunya adalah enzim pullulanase yang dapat memotong ikatan α-1,6-glikosidik pada amilopektin menjadi maltotriosa dan maltosa (Fullbrook 1984).
Dextrozyme yang diproduksi Novo terdiri dari amiloglukosidase yang dihasilkan oleh galur
9 48-72 jam dapat menghasilkan sirup glukosa dengan DE 96. Menurut Kulp (1975), pada umumnya aktivitas amiloglukosidase optimum pada pH 4-5 dan suhu 50-60oC.
3. Selulase
Selulase merupakan enzim kompleks yang bekerja secara sinergis satu sama lain, terdiri dari β -D-glukanase (endo β-D-glukosidase dan ekso β-D-glukosidase) serta β-D-glukosidase (Miyamoto 1997). β -D-glukanase bekerja untuk menghasilkan selobiosa dengan cara : (1) endo β-D-glukosidase menghidrolisis bagian amorf selulosa dan (2) ekso β-D-glukosidase bekerja pada ujung rantai untuk membebaskan glukosa. Pada tahap ini enzim bekerja paralel sehingga dihasilkan selobiosa dan glukosa (Judoamidjojo et al. 1989) . Selanjutnya, β-D-glukosidase akan mengubah 1 molekul selobiosa menjadi 2 molekul glukosa sehingga hasil akhir dari hidrolisis selulosa ialah glukosa (Perez et al. 2002 dalam Suparjo 2008).
Gambar 5. Proses hidrolisis selulosa oleh selulase (Anonim 2011)
4. Xilanase
Xilanase merupakan kelompok enzim yang memiliki kemampuan menghidrolisis hemiselulosa, dalam hal ini ialah xilan atau polimer dari xilosa dan xilo-oligosakarida. Xilanase dapat diklasifikasikan berdasarkan substrat yang dihidrolisis, yaitu β-xilosidase, eksoxilanase, dan endoxilanase. β-xilosidase, yaitu xilanase yang mampu menghidrolisis xilooligosakarida rantai pendek menjadi xilosa. Aktivitas enzim akan menurun dengan meningkatnya rantai xilooligosakarida (Reilly 1991). Xilosa selain merupakan hasil hidrolisis juga merupakan inhibitor bagi enzim β-xilosidase. Sebagian besar enzim β -xilosidase yang berhasil dimurnikan masih menunjukkan adanya aktivitas transferase, hal ini menyebabkan enzim ini kurang dapat digunakan industri penghasil xilosa.
10 mengandung sedikit aktivitas transferase sehingga potensial dalam industri penghasil xilosa. Endoxilanase mampu memutus ikatan β 1-4 pada bagian dalam rantai xilan secara teratur. Ikatan yang diputus ditentukan berdasarkan panjang rantai substrat, derajat percabangan, ada atau tidaknya gugus substitusi, dan pola pemutusan dari enzim hidrolase tersebut (Reilly 1991).
Xilanase umumnya merupakan protein kecil dengan berat molekul antara 15.000-30.000 Dalton, aktif pada suhu 55oC dengan pH 9 (Yang et al., 1988). Pada suhu 60oC dan pH normal, xilanase lebih stabil (Tsujibo et al., 1992).
III. METODOLOGI
A. BAHAN DAN ALAT
Bahan baku yang digunakan pada penelitian ini adalah batang sagu yang telah dicacah sebelum diambil patinya atau disebut dengan empulur sagu. Bahan kimia yang digunakan untuk analisa adalah glukosa standar, xilan (birchwood), CMC, soluble starch, NaOH, DNS, H2SO4, bufer fosfat 0.2 M, bufer sitrat 0.1 M, serta larutan ADF dan NDF. Enzim yang digunakan pada tahap hidrolisis empulur sagu ialah
α-amilase (Termamyl), dextrozyme (AMG dan Pullulanase), selulase, dan xilanase dari NOVO enzyme. Bahan yang digunakan untuk fermentasi etanol ialah PDA (Potato Dextrose Agar), PDB (Potato Dextrose Broth), NPK, dan ZA.
Alat-alat yang digunakan untuk perlakuan pendahuluan adalah oven gelombang mikro merk SHARP tipe R-348 C dengan output 1000W dan otoklaf sebagai pembanding. Pada tahap hidrolisis enzimatis digunakan shaker waterbath dan erlenmeyer 250 ml. Peralatan yang digunakan pada tahap fermentasi adalah inkubator goyang (shaker incubator), labu erlenmeyer 300 ml, dan leher angsa. Peralatan lainnya yang digunakan selama tahap perlakuan pendahuluan (pretreatment), hidrolisis, fermentasi, dan analisa adalah timbangan, desikator, cawan aluminium, oven, spektrofotometer HACH 2500, sentrifuse, Kromatografi Gas (GC), mikroskop cahaya, dan peralatan gelas lainnya.
B. METODE PENELITIAN
1. Penyiapan dan Karakterisasi Empulur Sagu
Empulur sagu yang diperoleh dari industri pati sagu rakyat di Cimahpar, Bogor dikeringkan terlebih dahulu untuk mencegah adanya perubahan karakteristik empulur sagu tersebut. Setelah dikeringkan, empulur sagu dihancurkan dan diayak hingga lolos pada saringan 30 mesh sehingga menjadi tepung empulur sagu yang siap untuk digunakan pada tahap selanjutnya.
Karakterisasi tepung empulur sagu terdiri dari uji komponen proksimat (air, abu, protein, lemak, serat kasar, dan karbohidrat by difference) sesuai dengan metode AOAC (1999) serta komponen serat (selulosa, hemiselulosa, dan lignin) berdasarkan metode Van Soest (1969). Prosedur analisa komponen proksimat dan komponen serat disajikan pada Lampiran 1.
2. Karakterisasi Enzim
12
3. Produksi F
ermentable Sugar
Proses produksi gula terfermentasikan dilakukan secara hidrolisis enzimatis dan dibagi menjadi (1) perlakuan pendahuluan atau pretreatment yaitu pemanasan menggunakan gelombang mikro (microwave pretreatment), dan (2) hidrolisis enzimatis.
a. Pemanasan dengan gelombang mikro
Penggunaan gelombang mikro untuk pemanasan empulur sagu dilakukan berdasarkan perlakuan terbaik yang diperoleh dari penelitian Derosya (2010), yaitu tepung empulur sagu yang telah dicampur dengan air sehingga membentuk slurry 8% (b/v) pada wadah gelas, lalu dipanaskan menggunakan oven gelombang mikro merk SHARP tipe R-348 C pada aras daya 30% dan 50%. Sebagai kontrol, slurry 8% dipanaskan dengan menggunakan otoklaf pada 121oC selama 15 menit. Slurry hasil pemanasan menggunakan gelombang mikro pada aras daya 30% dan 50% serta pemanasan menggunakan otoklaf akan diamati pada tingkat gelatinisasi substrat empulur sagu di dalam air, ketersediaan air pada slurry
yang telah dipanaskan, dan tidak terjadinya browning. Pengamatan ini dilakukan secara visual dan mikroskopik. Selain itu dilakukan juga analisa yang bersifat kuantitatif, yaitu : (1) volume filtrat, (2) analisa gula (gula pereduksi dan total gula), dan (3) pengukuran bobot residu.
b. Hidrolisis enzimatis
Hidrolisis enzimatis pada substrat empulur sagu yang telah dikenai perlakuan pemanasan terdiri dari dua tahap, yaitu likuifikasi menggunakan enzim α-amilase dan sakarifikasi yang menggunakan konsorsium enzim dextrozyme, selulase, dan xilanase. Pada tahap likuifikasi, empulur sagu (slurry 8%) ditambahkan enzim α-amilase sebanyak 3.5 U/g, 7 U/g, dan 1.75 U/g sebagai kontrol (Derosya 2010) yang
dikondisikan pada suhu 95oC selama 3 jam pada shaker waterbath. Pada akhir masa inkubasi, filtrat dipisahkan untuk diukur volumenya sedangkan ampas yang diperoleh dikeringkan di dalam oven pada suhu 105oC agar diketahui bobot residu yang diperoleh. Filtrat diambil untuk diketahui volume, total gula dan gula pereduksinya sehingga dapat ditentukan perlakuan terbaik dari tahap ini untuk selanjutnya masuk ke tahap sakarifikasi. Selain itu juga dilakukan analisa terhadap kejernihan filtrat.
Pada tahap sakarifikasi, perlakuan terbaik yang berasal dari tahap likuifikasi akan disakarifikasi menggunakan konsorsium enzim. Konsorsium enzim tersebut terdiri atas dexrozyme (AMG dan pullulanase) pada konsentrasi 0.3 U/g dan 0.6 U/g, serta selulase dan xilanase pada konsentrasi masing-masing 1 U/g dan 2 U/g. Proses sakarifikasi dilakukan pada suhu 50oC yang merupakan titik optimum aktivitas enzim-enzim konsorsium tersebut selama 48 jam pada shaker waterbath. Pada akhir inkubasi, filtrat dipisahkan untuk diukur volumenya serta dianalisa total gula dan gula pereduksinya sedangkan ampas yang masih tersisa dikeringkan di oven pada suhu 105oC untuk mengetahui bobot residunya. Dari tahap likuifikasi dan sakarifikasi ini akan ditentukan perlakuan terbaik untuk selanjutnya memasuki tahap fermentasi.
4. Produksi Bioetanol
a. Persiapan biakan mikroba
Biakan mikroba yang digunakan pada tahap produksi bioetanol yaitu Saccharomyces elippsoides
13 selama 24 jam. Setelah diinkubasi pada medium PDB, biakan Saccharomyces elippsoides dan Pichia stipitis digunakan untuk fermentasi bioetanol sebanyak 10 ml kultur tiap 100 ml substrat.
b. Fermentasi
Tahap fermentasi sirup glukosa untuk menghasilkan bioetanol ini menggunakan metode modifikasi berdasarkan penelitian Derosya (2010). Untuk tahap fermentasi ini, perlakuan yang dipilih sebagai substrat ialah : (1) sirup glukosa dari perlakuan dari pemanasan gelombang mikro dan kombinasi konsentrasi enzim terbaik, (2) sirup glukosa dari perlakuan kombinasi enzim terbaik dengan pemanasan otoklaf sebagai pembanding, dan (3) sirup glukosa dari glukosa teknis. Substrat yang digunakan diinkubasi menggunakan Saccharomyces elippsoides dan Pichia stipitis secara simultan atau tanpa inaktivasi enzim.
Masing-masing sirup glukosa dari (1) perlakuan dari pemanasan gelombang mikro dan kombinasi konsentrasi enzim terbaik, (2) perlakuan kombinasi enzim terbaik dengan pemanasan otoklaf sebagai pembanding, dan (3) glukosa teknis diperkaya dengan pupuk NPK (0.04 g) dan ZA (0.15 g). Fermentasi dilakukan pada sistem tertutup tanpa aerasi (Derosya 2010) menggunakan labu leher angsa seperti yang disajikan pada Gambar 6. Pembentukan CO2 dari proses fermentasi alkohol diukur setiap 6 jam dan ditetapkan sebagai laju pembentukan gas. Inkubasi berlangsung selama 72 jam, setelah masa inkubasi berakhir, kultur ditetapkan pH-nya, kandungan total gula residu, gula pereduksi, total asam, dan konsentrasi etanol (P). Konsentrasi etanol dianalisa menggunakan metode Kromatografi Gas (GC). Prosedur analisa gula, kejernihan filtrat, dan kaldu fermentasi disajikan pada Lampiran 3 hingga 7.
Gambar 6. Rangkaian peralatan pada fermentasi etanol sistem tertutup
5. Rancangan Percobaan
Penelitian ini dilakukan untuk mengetahui pengaruh aras daya(P) pemanasan gelombang mikro dan konsentrasi enzim (U) terhadap substrat empulur sagu untuk memperoleh karakteristik sirup glukosa terbaik yang sesuai untuk dijadikan substrat fermentasi etanol. Perlakuan terbaik ditentukan berdasarkan pengamatan terhadap volume filtrat, total gula, gula pereduksi, derajat polimerisasi, dekstrose ekivalen, bobot residu, dan kejernihan filtrat. Dari tiap perlakuan diuji homogenitasnya menggunakan SAS dimana tiap perlakuan dianggap berbeda dan terpisah.
14 H1 : σ12≠σ22
σ12 : varians skor kelompok eksperimen
σ22 : varians skor kelompok kontrol
Fhitung : = (varians terbesar)
(varians terkecil)
Jika Fhitung < Ftabel, maka Ho diterima
Tabel 2. Faktor Perlakuan Pemanasan dan Hidrolisis Enzimatis
Faktor Kode
Aras Daya Konsentrasi Enzim
50% 1. Likuifikasi :
1.75 U/g P5U1
3.5 U/g P5U3
7 U/g P5U7
2. Sakarifikasi :
0.3 U/g Dekstrozyme, 1 U/g Selulase, 1 U/g Xilanase P5U1K P5U7K 0.6 U/g Dekstrozyme, 2 U/g Selulase, 2 U/g Xilanase P5U1P P5U7P 30% 1. Likuifikasi :
1.75 U/g P3U1
3.5 U/g P3U3
7 U/g P3U7
2. Sakarifikasi :
0.3 U/g Dekstrozyme, 1 U/g Selulase, 1 U/g Xilanase P3U1K P3U7K 0.6 U/g Dekstrozyme, 2 U/g Selulase, 2 U/g Xilanase P3U1P P3U7P
Perlakuan pada pemanasan menggunakan gelombang mikro yaitu aras daya 30% (P3) dan aras daya 50% (P5) sedangkan pada tahap likuifikasi yaitu konsentrasi enzim α-amilase 1.75 U/g (U1), 3.5 U/g (U3), dan 7 U/g (U7). Untuk tahap sakarifikasi, perlakuannya yaitu 0.3 U/g Dekstrozyme, 1 U/g Selulase, dan 1 U/g Xilanase (K) serta 0.6 U/g Dekstrozyme, 2 U/g Selulase, dan 2 U/g Xilanase (P). Pembanding perlakuan pendahuluan empulur sagu menggunakan gelombang mikro, dilakukan dengan pemanasan menggunakan otoklaf. Perbedaan aras daya dan konsentrasi enzim merupakan satu perlakuan dengan dua kali ulangan. Perlakuan terbaik dari kombinasi perlakuan pendahuluan menggunakan gelombang mikro (aras daya 30% dan 50%) dan konsentrasi enzim pada hidrolisis enzimatis akan digunakan untuk produksi bioetanol dengan menggunakan Saccharomyces elippsoides dan Pichia stipitis.
IV. PEMBAHASAN
A. KARAKTERISTIK EMPULUR SAGU
Empulur sagu merupakan salah satu bagian dalam pohon sagu sebagai tempat cadangan makanan, sebagian akan digunakan untuk pembentukan bunga pada akhir pertumbuhannya (Flach 1977). Pada tahap pengolahan sagu, batang sagu yang telah ditebang akan dipotong-potong sepanjang 2.5-3 m dan dihancurkan untuk selanjutnya digunakan pada tahap ekstraksi pati (Ditjen Aninkra-IPB 1978). Empulur sagu yang digunakan pada penelitian ini berasal dari industri rakyat di daerah Cimahpar dalam keadaan basah sehingga dilakukan pengeringan terlebih dahulu. Setelah dikeringkan empulur sagu digiling menggunakan hammer mill hingga lolos ayakan 35 mesh seperti yang terlihat pada Gambar 7.
Gambar 7. Tepung empulur sagu
Seperti yang terlihat pada Gambar 7, tepung empulur sagu berwarna kecoklatan. Hal ini menandakan empulur sagu tersebut sudah mengalami browning atau reaksi pencoklatan. Perubahan warna menjadi coklat atau browning ini diduga diakibatkan rentang waktu yang cukup lama antara panen sagu dengan pengolahan pasca panennya dan transportasi empulur sagu yang memungkinkan kondisi untuk terbentuknya reaksi kimiawi seperti browning secara enzimatis. Menurut Eskin et al. (1977) warna coklat pada batang sagu timbul karena jaringannya terluka atau rusak. Kerusakan jaringan dapat terjadi karena perlakuan pasca panen sehingga jaringan akan memar, terpotong, dan rusak. Menurut Safitri et al. (2009), empulur sagu dengan cepat menjadi coklat di sepanjang bagian vaskular dan timbul titik coklat di bagian empulurnya.
16 yang terbentuk berikatan kuat dengan pati empulur sagu sehingga akan berdampak pada penurunan kualitas pati sehingga empulur sagu yang telah dikeringkan selanjutnya disimpan dengan cara dikemas dalam plastik untuk menghindari kontak empulur sagu dengan udara. Intensitas warna coklat ini juga dapat dipengaruhi oleh senyawa-senyawa fenolik yang dapat berasal dari air yang digunakan selama proses pengolahan pasca panen, sebab menurut Subagyo et al. (1996), wilayah pertumbuhan tanaman sagu sebagian besar berada pada hutan rawa yang dialiri oleh sungai yang berwarna hitam. Sungai yang berwarna hitam memiliki nutrisi yang rendah namun tinggi kandungan senyawa polifenol yang memberikan warna coklat pada air.
Karbohidrat merupakan komponen utama pada empulur sagu, seperti terlihat pada Tabel 3. Komponen utama lainnya dari empulur sagu yaitu air dan serat. Kadar air empulur sagu cukup tinggi, hal ini sangat dipengaruhi oleh kelembaban relatif lingkungan, jumlah air yang ditambahkan selama proses pasca panen, dan juga proses pengeringan empulur sagu. Menurut Hodge dan Osman (1976), gugus hidrofilik pada molekul pati menyebabkan penyerapan air sesuai dengan kelembaban udara di sekitarnya. Pada keadaan normal, pati mengandung air sekitar 12-14%. Hal ini dikarenakan adanya struktur amorf pada pati, struktur amorf tersebut memiliki ikatan antar molekul yang tidak kuat sehingga air mudah masuk meskipun tanpa dilakukan pemanasan. Kandungan air yang tinggi ditambah dengan bagian jaringan yang terluka akibat pemotongan dan penebangan serta kontak dengan udara dapat membantu tumbuhnya mikroba kontaminan (Ditjen Aninkra-IPB 1978).
Tabel 3. Komposisi Proksimat Tepung Empulur Sagu
Parameter Nilai
Kadar Air (% basis basah) 14.53
Kadar Abu (% basis kering) 5.16
Kadar Protein (% basis kering) 1.59
Kadar Lemak (% basis kering) 3.72
Kadar Serat (% basis kering) 7.93
Karbohidrat (by diffrence) (% basis kering) 81.60 Kadar Pati (% basis kering) 55.86
Kadar pati tepung empulur sagu yang digunakan pada penelitian lebih rendah dibandingkan dengan hasil penelitian Fuji et al. (1986) yang tersaji pada Tabel 1, demikian pula dengan hasil penelitian Derosya (2010), diperoleh kadar pati sebesar 73%. Akan tetapi, kandungan pati pada empulur sagu yang diteliti oleh Safitri et al. (2009) ialah sebesar 57,25%. Menurut Haryanto dan Pangloli (1992), kandungan pati dalam empulur batang sagu berbeda-beda tergantung dari umur, jenis, dan lingkungan tempat tanaman sagu tersebut tumbuh. Semakin tua umur tanaman sagu maka kandungan pati dalam empulur sagu semakin besar dan pada umur tertentu kandungan pati tersebut akan menurun. Penurunan kandungan pati biasanya ditandai dengan mulai terbentuknya primordial bunga.
17 panen empulur sagu memberi pengaruh terhadap kualitas empulur sagu terutama kandungan patinya. Selain dapat berkurang akibat terjadinya fermentasi selama tahap pengolahan pasca panen dan transportasi, pati empulur sagu juga dapat berkurang akibat serangan hewan-hewan perusak seperti tikus dan unggas (Stanton 1977 dalam Handoko 2010). Semua hewan perusak ini juga membantu menghantarkan mikroorganisme kontaminan pada ujung potongan batang sagu, sehingga kandungan pati pada empulur sagu semakin berkurang.
Yamamoto (2004) menjelaskan bahwa kandungan pati tertinggi di dalam empulur berada di sepanjang tahap berbunga dan setelah itu kandungannya berkurang karena tranlokasi menjadi bunga dan buah. Dapat disimpulkan bahwa kandungan pati yang rendah ini pada tepung empulur sagu dapat diakibatkan oleh : (1) waktu dan kondisi pengolahan pasca panen serta transportasi yang memungkinkan batang sagu terfermentasi oleh mikroorganisme, (2) serangan hewan-hewan perusak, dan (3) perbedaan varietas, tingkat kematangan, dan lingkungan tempat sagu tumbuh.
Empulur sagu memiliki kandungan mineral yang cukup tinggi dan hal ini sesuai dengan hasil penelitian Fuji et al. (1986), bahwa kadar abu empulur sagu berkisar 4-5%. Kadar abu memperlihatkan komponen mineral atau bahan organik yang tidak ikut terbakar saat bahan organik dibakar. Kandungan mineral empulur sagu dipengaruhi oleh kandungan mineral pada lahan tempat sagu tumbuh. Kandungan unsur makro yaitu Ca, K, dan Mg serta unsur Cu, B, dan Zn yang terdapat pada lahan tempat tanaman sagu tumbuh mempengaruhi jumlah kandungan mineral sagu. Apabila tanaman sagu ditanam di lahan gambut yang memiliki tingkat keasaman tanah yang cukup tinggi maka unsur-unsur mikro yang terdapat dalam tanah membentuk kation-kation dengan asam organik dari asam karboksilat dan fenolat yang terdapat pada lahan gambut (Setiawan et al. 2005). Akibatnya mineral yang dapat diserap oleh tumbuhan sagu juga akan berkurang sehingga kandungan mineral sagupun berkurang.
Kadar lemak empulur sagu yaitu 3.72%, sementara berdasarkan penelitian oleh Fuji et al. (1986) kadar lemak kasar empulur sagu tidak melebihi 0.5%. Hal ini dapat disebabkan oleh adanya komponen lain yang bukan lemak namun larut dalam pelarut yang digunakan yaitu n-heksana. Menurut Natsir (2004), pelarut n-heksana merupakan senyawa hidrokarbon rantai panjang sehingga gugus nonpolar yang bersifat hidrofob mendominasi sifat senyawa ini. Senyawa lainnya seperti sikloheksana, minyak tanah, dan asam asetat mempunyai kesamaan struktur molekul serta merupakan senyawa karbon sehingga senyawa-senyawa tersebut dapat larut dalam n-heksana. Dengan demikian dimungkinkan kadar lemak yang terdapat di dalam empulur sagu juga berasal dari senyawa nonpolar namun non trigliserida yang larut dalam n-heksana.
Kadar lemak yang tinggi dapat mengganggu proses gelatinisasi, sebab lemak mampu membuat kompleks yang menyebabkan amilosa tidak dapat keluar dari granula pati (Sunarti 2007). Keberadaan lemak yang tinggi dapat mengganggu proses gelatinisasi karena akan diserap oleh permukaan granula sehingga terbentuk lapisan lemak yang bersifat hidrofobik di sekeliling granula. Hal ini dapat terlihat dari kekentalan dan kelekatan pati yang berkurang karena jumlah air serapan yang digunakan untuk mengembangkan granula pati berkurang.
18 apabila pati atau tepung tersebut digunakan untuk kebutuhan non pangan, sebab dengan semakin meningkatnya jumlah protein maka jumlah kadar pati dalam bahan semakin berkurang.
Kadar protein dalam pati dapat mempengaruhi warna sirup glukosa. Reaksi yang terjadi antara gula pereduksi dengan senyawa amino (asam amino, peptide, dan protein) pada kondisi suhu yang tinggi akan menghasilkan warna coklat atau browning. Reaksi browning ini berlangsung secara non enzimatik (Handoko 2010). Namun reaksi pencoklatan secara non enzimatis tidak hanya terjadi dengan adanya senyawa amino pada protein sebab pada teori aldehid aktif, terjadinya pencoklatan dapat diakibatkan dehidrasi gula yang mengakibatkan terbentuknya aldehid aktif. Hasil dehidrasi gula akan berwarna coklat karena karamelisasi gula sehingga reaksi pencoklatan enzimatis dapat terjadi tanpa adanya protein maupun asam amino (Marlet et al. 1960 dalam Handoko 2010)
Kandungan serat pada tepung empulu sagu lebih tinggi daripada yang terkandung di dalam pati sagu kriteria SNI 01-3729-1995 yaitu sebesar 0.11%. Hal ini dikarenakan pada pati, empulur sagu telah mengalami proses ekstraksi sehingga serat ikut terpisah dari pati, sedangkan pada empulur sagu serat dan pati belum terpisah. Sama halnya dengan kandungan pati, kandungan serat kasar juga dipengaruhi oleh varietas, umur, dan lingkungan tempat tanaman sagu tumbuh.
Serat mengandung tiga komponen utama, yaitu : selulosa, lignin, dan hemiselulosa dengan perbandingan sekitar 4 : 3: 3 sehingga sering disebut dengan istilah lignoselulosa. Besarnya perbandingan antara ketiga komponen tersebut tergantung pada jenis tanamannya. Selulosa merupakan bagian terbesar dari komponen lignoselulosa tanaman, dapat dicirikan sebagai polimer linier yang memiliki berat molekul tinggi. Ikatan β-1,4 glikosida yang kuat dari selulosa dapat berbentuk kristal mikrofibril, yang kemudian bersama-sama membentuk serat selulosa yang bersifat tidak larut (Winarno 1998).
Hemiselulosa merupakan polimer yang memiliki berat molekul rendah dan monomer gula penyusun yang bervariasi daripada selulosa. Monomer penyusun selulosa ialah glukosa sedangkan hemiselulosa terdiri dari kelompok heksosa, pentosa, asam heksuronat, dan deoksi heksosa. Lignin merupakan polimer fenil propan yang diikat dengan eter sehingga berfungsi sebagai perekat. Lignin merupakan material paling kuat di dalam biomas dan resisten terhadap degradasi baik secara biologis, enzimatis, maupun kimiawi. Lignin memiliki kandungan karbon yang jauh lebih tinggi dibandingkan komponen penyusunnya yang lain sehingga menyebabkan lignin memiliki energi yang tinggi. Lignin merupakan perekat antara selulosa dan hemiselulosa sehingga memperkuat struktur lignoselulosa.
Serat kasar didefinisikan sebagai fraksi yang tersisa setelah didigesti dengan larutan asam sulfat (H2SO4) standar dan sodium hidroksida (NaOH) pada kondisi yang terpembanding. Metode pengukuran kandungan serat kasar adalah menghilangkan semua bahan yang larut dalam asam dengan pendidihan dengan menggunakan asam sulfat (H2SO4). Bahan yang larut dalam alkali dihilangkan dengan pendidihan dalam larutan sodium alkali. Residu yang tidak larut dikenal sebagai serat kasar. Pengukuran kadar serat kasar tidak dapat menentukan jumlah kandungan komponen lignoselulosa yang terdapat di dalam suatu bahan. Metode yang dapat mengukur masing-masing komponen selulosa, hemiselulosa, dan lignin ialah metode Van Soest (1969). Analisa komponen serat dengan metode Van Soest (1969) dilakukan dengan metode NDF (Neutral Detergent Fiber), ADF (Acid Detergent Fiber), dan selulosa.
19 dan substansi pektat sehingga dianggap hanya terdiri dari selulosa dan lignin. Hasil uji komponen serat tepung empulur sagu disajikan pada Tabel 4.
Tabel 4. Komposisi Serat Tepung Empulur Sagu
Komponen Nilai
NDF (% basis kering) 14.51
ADF (% basis kering) 9.79 Selulosa (% basis kering) 2.93
Hemiselulosa (% basis kering) 4.72
Lignin (% basis kering) 6.86
Terdapat perbedaan yang signifikan diantara hasil analisa kadar serat kasar dengan analisa komponen serat dimana jumlah lignoselulosa pada uji serat kasar adalah 7.93% sedangkan pada uji komponen serat, jumlah total lignoselulosa yang merupakan nilai NDF ialah 14.51%. Hal ini dapat dijelaskan sesuai dengan penuturan Simanjuntak (2007) bahwa hemiselulosa lebih mudah larut dalam pelarut alkali dan lebih mudah dihidrolisis dengan asam menjadi komponen monomernya yang terdiri dari D-glukosa, D-manosa, D-galaktosa, D-xilosa dan L-arabinosa. Pelarut yang digunakan untuk hidrolisis pada analisa kadar serat ialah H2SO4. Sesuai dengan penuturan Simanjuntak (2007), bahwa hemiselulosa yang terdapat di dalam tepung empulur sagu terhidrolisis oleh asam sulfat menjadi gula-gula sederhana sehingga larut dan terbuang ketika dilakukan penyaringan. Hal ini juga sesuai dengan pernyataan Suparjo (2010) bahwa salah satu kelemahan analisa proksimat ialah data yang kurang tepat terutama untuk analisa kadar serat kasar dikarenakan hemiselulosa dan sebagian lignin menjadi larut dalam larutan asam yang digunakan. Larutnya hemiselulosa dalam larutan asam ini membuat pengukuran komponen serat berkurang dari yang seharusnya dan seperti yang juga diungkapkan oleh Suparjo (2010) bahwa pengukuran serat kasar hanya merupakan pedoman proporsional dalam pakan yang digunakan oleh ternak. Oleh sebab itu pula, diperlukan analisa komponen serat (Van Soest 1969) untuk memperoleh data komponen serat yang lebih akurat.
Berdasarkan uji komponen serat, tepung empulur sagu yang digunakan pada penelitian ini sebagian besar mengandung lignin (6.86%), hemiselulosa (4.72%), dan selulosa (2.93%). Selulosa dan hemiselulosa dapat dihidrolisis menggunakan enzim menjadi monomer glukosa dan xilosa sehingga dengan konsorsium enzim akan meningkatkan jumlah gula yang terbentuk untuk selanjutnya dapat digunakan sebagai substrat pada tahap fermentasi. Namun pada bahan empulur sagu ini terkandung lignin yang cukup tinggi yaitu 6.86% jika dibandingkan dengan penelitian terdahulu oleh Derosya (2010), yaitu 1.40%. Kadar lignin tinggi ini diduga berasal dari tanaman sagu yang masak panen, seperti yang diutarakan oleh Runcang et al. (1998), setelah tanaman sagu berbunga dan berbuah, kadar pati cepat menurun. Selain mengandung pati, pada empulur masak panen terdapat senyawa lignin sebesar 9-22% serta senyawa fenolik <1% (Cecil et al. 1982).
Kandungan lignin yang tinggi dapat menghalangi hidrolisis enzim sebab struktur lignin melekat pada selulosa dan hemiselulosa serta membentuk bagian kristal di bagian luar lignoselulosa sementara
20
B. KARAKTERISTIK ENZIM
Enzim sebagai katalis proses hidrolisis pati memiliki beberapa kelebihan dibandingkan katalis asam, diantaranya adalah reaksi hidrolisis yang terjadi beragam, kondisi proses yang digunakan tidak ekstrim, tingkat konversi tinggi, polutan rendah, dan diperoleh reaksi yang spesifik (Judoamidjojo 1989). Melalui karakterisasi enzim, dapat diketahui suhu dan pH optimum pada saat enzim bekerja sehingga hidrolisis berlangsung pada kondisi optimum enzim. Akitivitas enzim umumnya dinyatakan dengan satuan unit (U). Satu unit menyatakan jumlah enzim yang dibutuhkan untuk mengkatalis substrat dan menghasilkan satu µmol produk per satuan waktu (menit) pada kondisi standar. Kondisi standar adalah dimana enzim bekerja secara optimal, yaitu meliputi pH dan suhu (Chaplin dan Buckle 1990).
Karakterisasi dilakukan pada enzim-enzim yang digunakan baik pada tahap likuifikasi maupun sakarifikasi. Aktivitas enzim alfa amilase yang diperoleh yaitu 6.74 x 102 U/ml pada pH 6 dengan suhu optimum 95oC. Aktivitas enzim dextrozyme, selulase, dan xilanase selengkapnya disajikan pada Tabel 5.
Tabel 5. Karakteristik Enzim Amilolitik dan Holoselulolitik
Enzim pH optimum Suhu Optimum Aktivitas (U/ml)
Alfa amilase 6 95oC 6.74 x 102 Dextrozyme (AMG dan
Pullulanase)a
4.5 60oC 1.45 x 102
Selulase 5 60oC 4.4 x 102
Xilanase 6 50oC 1.82 x 102
Sumber : aAkyuni (2004)
Berdasarkan hasil uji aktivitas enzim, enzim yang akan digunakan pada tahap likuifikasi ialah
enzim α-amilase yang dikondisikan pada pH 6 dan suhu 95oC. Pada tahap sakarifikasi digunakan konsorsium enzim yang terdiri dari dextrozyme, selulase, dan xilanase. Kondisi pH masing-masing enzim berbeda sehingga dikondisikan sesuai pH optimum masing-masing enzim. Dikarenakan suhu optimum kerja masing-masing enzim berada pada suhu 50oC dan 60oC maka suhu optimum kerja konsorsium enzim untuk tahap sakarifikasi dilakukan pada suhu 50oC. Hal ini dilakukan karena suhu sangat mempengaruhi kerja enzim, apabila suhu optimum enzim diturunkan maka aktivitasnya akan menurun. Namun, penurunan aktivitas enzim akibat suhunya yang diturunkan tidak sebesar penurunan aktivitas enzim yang kondisi suhunya dinaikkan melebihi suhu optimumnya (Derosya 2010). Makin tinggi suhu maka makin cepat jalannya reaksi. Namun, harus diperhatikan jika katalisator yang dipakai adalah enzim, karena enzim sensitif terhadap suhu tinggi maka jika suhu terlalu tinggi aktivitas enzim akan menurun bahkan enzim dapat rusak (Griffin dan Brooks 1989).
C. PEMANASAN EMPULUR SAGU MENGGUNAKAN GELOMBANG MIKRO
(
MICROWAVE
)
21 sehingga enzim bercampur dengan substrat. Dengan demikian, agar enzim dapat bercampur dengan substrat maka substrat terlebih dahulu harus dilarutkan dalam air.
Substrat empulur sagu merupakan substrat yang heterogen dimana di dalamnya mengandung pati dan serat (selulosa dan hemiselulosa). Pati dan serat merupakan komponen polisakarida yang dapat dihidrolisis oleh enzim menjadi monosakarida. Namun hidrolisis enzim tidak dapat langsung dilakukan tanpa pemanasan sebab granula pati tidak larut dalam air dingin (Wirakartakusumah 1981 dalam Widiyanto 1984). Selain itu, penggabungan molekul linier pati (amilosa) dengan molekul bercabang pati (amilopektin) melalui ikatan hidrogen akan membentuk struktur kristalin. Adanya struktur kristalin menghambat penetrasi enzim ke dalam substrat sehingga secara umum pati tidak dapat dicerna oleh enzim.
Volume granula pati akan mengembang jika suspensi pati dan air dipanaskan. Pengembangan volume granula akan meregangkan misella sehingga air akan terperangkap ke dalam granula, granula akan semakin membesar sampai pada suatu keadaan dimana pati kehilangan struktur kristalinnya. Dengan adanya pemanasan maka granula pati yang semula resisten terhadap aktivitas enzim, setelah digelatinisasi maka akan mengembang sehingga mudah dipengaruhi oleh kerja enzim. Pada umumnya pengembangan granula pati terjadi pada suhu 60-70oC (Hodge dan Osman 1976) dan pada suhu yang lebih tinggi maka pati akan mengalami gelatinisasi membentuk pasta atau sol yang tergantung asal dan konsentrasi pati.
Selulosa mengandung ikatan hidrogen intra molekuler yang mempertahankan kekuatan rantai selulosa dan ikatan inter molekul yang menyebabkan rantai selulosa saling berikatan membentuk mikrofibril (Tsao 1978). Bila dibandingkan dengan selulosa, hemiselulosa lebih mudah dihidrolisis menjadi monomer gula serta lebih siap untuk dicerna oleh enzim (Crowder dan Chheda 1982). Komponen hemiselulosa dan selulosa berikatan kuat dengan lignin yang merupakan fraksi yang sukar dicerna oleh enzim. Lignin merupakan polimer aromatik polifenolat yang terdiri atas unit-unit oksifenilpropana yang tergabung dalam ikatan silang yang kompleks dan memiliki rantai karbon yang panjang sehingga sukar dihidrolisis (McDonnald dan Roderick 1999).
Struktur lignin harus dirusak terlebih dahulu agar selulosa dan hemiselulosa dapat diakses oleh enzim. Menurut Deepak et al. (2010) pemanasan dengan gelombang mikro (microwave) mampu merusak struktur lignin pada empulur sagu dalam paparan waktu yang singkat. Selulosa membutuhkan suhu di atas 100oC untuk dapat tergelatinisasi (Safitri et al. 2009). Akan tetapi pada pemanasan dengan otoklaf pada suhu 121oC selama 15 menit belum dapat dipastikan mampu merusak struktur selulosa sementara dengan pemanasan di atas 150oC warna sampel akan mulai gelap dan terus meningkat dengan naiknya suhu hingga pada suhu 200oC akan terbentuk furfural (Derosya 2010).
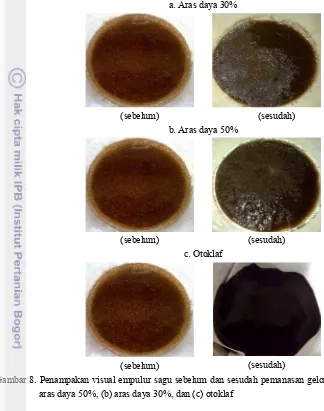
22 Metode pemanasan menggunakan gelombang mikro melibatkan penerapan radiasi gelombang mikro untuk biomassa pada lingkungan yang berair (slurry). Slurry yang digunakan pada penelitian ini ialah slurry 8%. Pada konsentrasi slurry yang lebih tinggi, energi pemanasan yang dipasok tidak merata sehingga terdapat komponen pati dan serat yang tidak terkena perlakuan pemanasan gelombang mikro sementara pada konsentrasi yang lebih rendah, jumlah air bebas di sekitar lingkungan slurry lebih tinggi dibandingkan pada slurry 8% sehingga akan mengurangi efisiensi penggunaan air (Derosya 2010). Pemanasan dengan gelombang mikro dilakukan pada aras daya (power level) 50% dan 30% sesuai dengan penelitian Derosya (2010) bahwa derajat polimerisasi (DP) dan dextrose equivalent (DE) terbaik diperoleh dari pemanasan dengan gelombang mikro pada aras daya 30% (3 menit) dan 50% (2 menit). Perbandingan sebelum dan sesudah bahan dikenai perlakuan pemanasan dengan gelombang mikro disajikan pada Gambar 8.
Berdasarkan pengamatan secara visual, tampak bahwa pemanasan dengan menggunakan aras daya 30% menyisakan fraksi air bebas yang lebih banyak dibandingkan dengan aras daya 50%. Fraksi air yang tersisa tersebut menandakan bahwa ada sejumlah bagian air di lingkungan slurry yang tidak larut bersama dengan substrat empulur sagu. Pemanasan dengan aras daya 50% memiliki output energi yang lebih besar daripada aras daya 30% sehingga energi pemanasan yang diberikan terhadap substrat empulur sagu lebih tinggi. Jumlah fraksi air bebas yang lebih tinggi menandakan energi pemanasan yang diterima oleh substrat pada pemanasan dengan aras daya 30% lebih rendah daripada pemanasan pada aras daya 50%. Konversi aras daya (power level)gelombang mikro (microwave) disajikan pada Tabel 6.
Tabel 6. Konversi Aras Daya (Power Level) pada Gelombang Mikro (Microwave)
Output Energi Aras Daya
850-800 watts Tinggi 100% 650 watts Medium Tinggi 70% 500 watts Medium 50-60% 350 watts Medium-Rendah/Defrost 30%
160 watts Rendah 20%
90 watts Sangat Rendah 10%
Sumber : Mauritus (2008)
Pengembangan granula pati disebabkan oleh energi kinetik molekul-molekul air setelah terkena perlakuan pemanasan menjadi lebih kuat daripada daya tarik-menarik antar molekul pati di dalam granula. Semakin tinggi energi yang diberikan maka energi kinetik molekul air akan semakin kuat untuk melawan daya tarik menarik molekul pati sehingga air bebas dapat infiltrasi ke dalam granula pati. Secara visual, hal ini ditandai dengan pengembangan granula pati atau meningkatnya kekentalan larutan (slurry). Berdasarkan pengamatan pada kondisi slurry yang telah dikenai pemanasan gelombang mikro, slurry pada pemanasan aras daya 50% memiliki kekentalan yang lebih tinggi dibandingkan dengan pemanasan pada aras daya 30%.
Kekentalan menunjukkan komponen pati yang tergelatinisasi dimana struktur kristalin pati rusak oleh pemanasan dan gugus hidrofilik pati menyerap air bebas pada lingkungan slurry, akibatnya granula pati mengembang. Pengembangan granula pati inilah yang menyebabkan timbulnya kekentalan pada
23 tergelatinisasi lebih baik pada pemanasan dengan menggunakan aras daya 50%. Pengamatan visual slurry
sebelum dan sesudah pemanasan yang disajikan pada Gambar 8.
a. Aras daya 30%
(sebelum) (sesudah) b. Aras daya 50%
(sebelum) (sesudah) c. Otoklaf
(sebelum) (sesudah)
Gambar 8. Penampakan visual empulur sagu sebelum dan sesudah pemanasan gelombang mikro pada (a) aras daya 50%, (b) aras daya 30%, dan (c) otoklaf
Sebagai pembanding, slurry 8% dipanaskan dengan menggunakan otoklaf, yaitu pada suhu 121oC selama 15 menit. Pemanasan dengan menggunakan otoklaf tidak menyisakan air bebas seperti pada pemanasan dengan gelombang mikro, selain itu juga mencipatakan kondisi slurry yang sangat kental sehingga tidak diperoleh filtrat. Pemanasan dengan otoklaf berlangsung pada suhu 121oC selama 15 menit sedangkan menurut Knight (1969), suhu gelatinisasi pati sagu adalah 60-72oC sehingga pemanasan yang menggunakan otoklaf menyebabkan kondisi pati empulur sagu mengalami gelatinisasi pati berlangsung dengan sempurna, ditandai dengan kekentalan dan tidak adanya air bebas pada slurry.
24 disajikan pada Gambar 9, terlihat pembengkakan granula yang ditandai dengan bagian bulat utuh maupun tidak beraturan yang lebih transparan akibat penetrasi air dan panas yang bersamaan ke dalam granula pati. Hal ini memperlihatkan bahwa semakin tinggi energi pemanasan yang digunakan maka semakin besar energi yang diterima oleh substrat empulur sagu.sehingga air yang diserap oleh pati juga semakin meningkat. Penetrasi air dan panas yang bersamaan menyebabkan granula membengkak. Dengan membengkaknya granula pati maka akan kehilangan pola birefringence dan kejernihan campuran meningkat. Peningkatan kejernihan campuran inilah yang menyebabkan terbentuknya bagian yang transparan pada campuran empulur sagu (Hodge dan Osman 1976).
Pada Gambar 9 tampak bagian serat yang berwarna biru keunguan semakin memudar dari hasil pemanasan gelombang mikro pada aras daya 30% ke aras daya 50%. Adanya bagian yang lebih transparan pada penampakan secara mikroskopik juga menandakan terdapat komponen serat yang juga mengalami pembengkakan. Pembengkakan tersebut disebabkan oleh pembesaran pori pada komponen serat akibat iradiasi gelombang mikro sebagaimana pada granula pati (Magara dan Kojima 1990 dalam Derosya 2010). Adanya pembesaran pori ini juga menandakan bahwa struktur lignin telah rusak sehingga selulosa dan hemiselulosa juga mendapatkan radiasi gelombang mikro. Pembesaran pori pada serat akan memudahkan infiltrasi enzim selulase dan xilanase pada tahap sakarifikasi.
a. Aras daya 30%
b. Aras daya 50%
Keterangan: 1. Biru-keunguan : komponen pati dan serat yang telah rusak struktur kristalinnya 2. Biru : struktur kristalin pati dan serat
3. Bulat transparan : granula pati
4. Susunan biru : komponen ujung serat 5. Bulat hitam : struktur serat yang masih utuh 6. Kekuningan : struktur serat yang telah rusak
Gambar 9. Penampakan mikroskopik (cahaya terpolarisasi perbesaran 100x) empulur sagu setelah pemanasan gelombang mikropada aras daya (a) 30% dan (b) 50%
Slurry hasil pemanasan dengan menggunakan gelombang mikro menyisakan air bebas baik pada aras daya 30% maupun aras daya 50% sehingga dapat dilakukan penyaringan pada slurry untuk
3
4 5
6
25 memperoleh filtratnya.Volume filtrat lebih tinggi diperoleh dari pemanasan gelombang mikro dengan tingkat daya 30%, disebabkan air bebas yang terdapat di lingkungan slurry lebih tinggi dibandingkan
slurry hasil pemanasan gelombang mikro pada aras daya 50%. Tidak tersedianya air bebas pada slurry
menandakan bahwa pemanasan berlangsung pada suhu di atas 120oC sehingga terjadi pemekatan substrat menjadi gel (Safitri et al. 2009).
Menurut Kunlan et al. (2001), pemanasan menggunakan gelombang mikro secara langsung dapat mengonversi pati menjadi gula dalam waktu yang singkat. Pemanasan bahan dengan paparan waktu yang singkat juga menghindari terbentuknya produk samping yang tidak diinginkan. Hal ini dapat ditemui pada hasil pemanasan menggunakan gelombang mikro, baik pada aras daya 50% dan 30%, sudah terbentuk gula-gula sederhana seperti yang tertera pada Tabel 7.
Tabel 7. Nilai Bobot Residu dan Karakteristik Filtrat Hasil Pemanasan Menggunakan Gelombang Mikro dan Otoklaf
Slurry Hasil Pemanasan Volume Filtrat (ml) Bobot Residu (g) Total Gula (g/l) Gula Pereduksi (g/l) DP
Aras Daya 50% 11.5 82.03 6.31 0.10 61.00
Aras Daya 30% 35 79.68 10.04 0.10 97.91
Otoklaf - 86.58 - - -
Pemanasan dengan aras daya 30% membentuk gula-gula sederhana dengan jumlah yang lebih besar daripada aras daya 50%. Bobot residu terendah diperoleh dari pemanasan dengan gelombang mikro pada aras daya 30%. Azuma et al. (1986) menjelaskan bahwa penurunan bobot residu pada pemanasan dengan menggunakan gelombang mikro mengindikasikan terdapat sejumlah karbohidrat yang terlarutkan di dalam air dan setelah bahan terlarut, dengan pemanasan yang sama karbohidrat akan terdegradasi menjadi gula-gula sederhana (autohidrolisis). Melalui data di atas, terlihat bahwa empulur sagu yang terdegradasi secara langsung lebih banyak diperoleh dari pemanasan dengan aras daya 30% meskipun energi yang diterima oleh substrat lebih rendah dibandingkan dengan aras daya 50%.
Dapat dipahami bahwa pada pemanasan gelombang mikrodengan aras daya 50%, jumlah energi yang diberikan pada substrat lebih besar sehingga pemanasan terhadap substrat lebih merata namun reaksi autohidrolisis lebih banyak berlangsung pada pemanasan dengan aras daya 30% sehingga dapat dikatakan bahwa mekanisme pemanasan gelombang mikro pada aras daya 30% cenderung untuk autohidrolisis daripada pemerataan pemanasan untuk gelatinisasi dan perusakan struktur serat serta lignin yang terdapat di dalam substrat. Hal ini terlihat dari kondisi substrat setelah dipanaskan yang lebih kental pada aras daya 50% namun bobot residu lebih besar dan gula yang terbentuk lebih sedikit daripada pemanasan dengan aras daya 30%.
26
D. PENGARUH PEMANASAN GELOMBANG MIKRO (
MICROWAVE
) PADA
SIFAT PENERIMAAN ENZIM AMILOLITIK DAN HOLOSELULOLITIK
UNTUK PRODUKSI GULA TERFERMENTASIKAN
1. Likuifikasi
Pemanasan substrat empulur sagu menggunakan gelombang mikro bertujuan untuk menciptakan kondisi bahan yang sesuai agar enzim dapat mudah menghidrolisis substrat (pati, selulosa, dan hemiselulosa) empulur sagu. Hal ini merupakan hubungan antara sifat penerimaan enzim dan daya cerna substrat. Kinerja enzim yang tinggi mengindikasikan daya cerna substrat yang baik. Daya cerna substrat (pati dan serat) merupakan tingkat kemudahan suatu jenis substrat untuk dapat dihidrolisis oleh enzim pemecah pati dan serat menjadi unit-unit yang lebih sederhana.
Pemanasan gelombang mikro merupakan faktor utama yang mempengaruhi sifat penerimaan enzim terhadap kondisi substrat setelah dipanaskan. dengan aspek aras daya (power level) dan lama pemanasan. Sebelumnya telah dikemukakan bahwa aras daya merupakan sejumlah energi yang dihantarkan ke substrat melalui media air sebagai molekul polar. Perbedaan aras daya dan waktu paparan memberikan pengaruh yang berbeda terhadap perubahan struktur empulur sagu terutama dari segi jumlah pati yang tergelatinisasi dan jumlah pori pada serat yang terbentuk. Fenomena ini membuat enzim dapat dengan mudah menghidrolisis substrat karena enzim dapat bekerja dengan kondisi substrat yang telah dikenai perlakuan pemanasan tertentu. Sebaliknya, apabila pemanasan tidak menciptakan kondisi substrat yang tepat untuk kerja enzim maka akan mengakibatkan daya cerna substrat terbatas atau dengan kata lain terbentuk substrat yang bersifat resisten.
Agar pemanasan dapat merata ke seluruh bagian substrat maka substrat yang digunakan harus pada ukuran partikel yang tepat. Perbedaan ukuran partikel (mesh) berpengaruh terhadap sifat fisik dan mekanis dari slurry, ukuran mesh yang besar menghasilkan permukaan kasar dan ikatan antar partikelnya sangat kuat sehingga akan sukar dihidrolisis oleh enzim. Ukuran partikel yang kecil menghasilkan permukaan yang halus dan ikatan antar partikel yang cenderung lemah. Ukuran partikel substrat empulur sagu yang digunakan pada penelitian ini adalah 35 mesh. Menurut Zhongli et al. (2007), partikel dengan mesh 10-20 masih terlalu besar untuk dijadikan suatu larutan (slurry) dan mengakibatkan kontak yang lemah antara partikel dengan air sehingga pori di antara partikel-partikel bisa dengan mudah dilihat. Ukuran partikel yang berbeda akan memberikan perbedaan yang signifikan dalam penyerapan air dan
thickness swelling. Partikel dengan mesh 20-40 memiliki penyerapan air dan thickness swelling terbaik yang konsisten dengan hasil sifat mekanis dan fisik terhadap perlakuan pemanasan.
Pati dan serat yang terdapat di dalam empulur sagu terletak di bagian paling dalam batang sagu yang juga diselubungi oleh komponen lignin. Adanya komponen lignin ini dapat mencegah kerusakan fisik dan biologis pada pati dan serat dengan cara mempertahankan struktur kekakuannya, namun hal ini berdampak pada kesukaran bahan untuk dapat dihidrolisis oleh enzim. Karena pati dan serat dilindungi oleh permukaan lignin yang kaku dan keras maka dengan semakin kecilnya ukuran partikel akan menyebabkan semakin tinggi jumlah pati dan serat yang terlepas dari lignin sehingga selain dapat langsung kontak dengan pemanasan gelombang mikro, juga akan memudahkan enzim infiltrasi ke dalamnya sebab sebagaimana diketahui lignin tidak dapat terdegradasi oleh enzim.
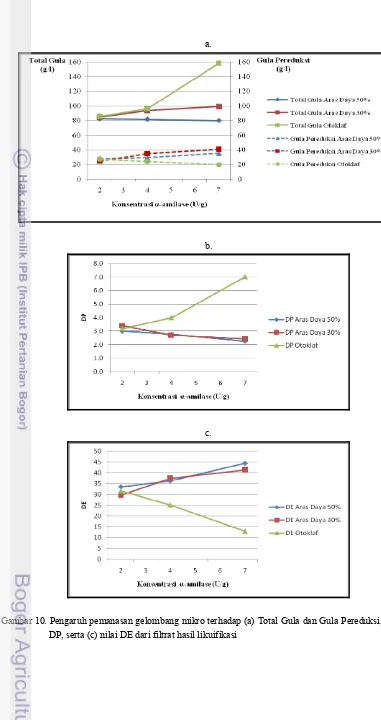
27 Pada penelitian sebelumnya, Derosya (2010) menggunakan konsentrasi enzim α-amilase sebesar 1.75 U/g terhadap semua level pemanasan. Pemanasan terbaik yaitu 50% dan 30% menghasilkan nilai DP (Derajat Polimerisasi) sebesar 3.9 (aras daya 50%) dan 5.5 (aras daya 30%). Derajat polimerisasi merupakan rasio atau perbandingan berat molekul polisakarida dengan berat molekul monosakarida. Semakin kecil nilai DP artinya semakin banyak jumlah monosakarida (glukosa, xilosa, pentosa) yang terdapat di dalam bahan. Nilai DP yang diinginkan disini ialah nilai DP yang mendekati 1 namun dari hasil penelitian Derosya (2010), dengan konsentrasi enzim α-amilase 1.75 U/g diperoleh nilai DP yang masih di atas 3. Hal ini menandakan di dalam slurry masih terdapat sejumlah oligosakarida yang belum terhidrolisis sehingga jumlah gula-gula pereduksi yang terbentuk masih sedikit.
Berdasarkan penelitian yang dilakukan oleh Akyuni (2004), DP yang diperoleh dari tahap likuifikasi pati sagu berkisar 2.85-3.31. Dengan demikian dapat diduga adanya kemungkinan konsentrasi enzim α-amilase yang ditambahkan pada likuifikasi empulur sagu masih dapat ditingkatkan sehingga pada penelitian ini konsentrasi enzim α-amilase yang digunakan untuk tahap likuifikasi empulur sagu yaitu 3.5 U/g dan 7 U/g, sebagai pembanding yaitu 1.75 U/g (Derosya 2010).
Peningkatan konsentrasi enzim bertujuan untuk meningkatkan kinetika enzim sehingga dalam paparan waktu pemanasan yang sama akan meningkatkan jumlah pembentukan gula-gula sederhana. Apabila jumlah gula-gula sederhana semakin meningkat sehingga nilai DP mencapai 1 maka dapat dikatakan bahwa tahap sakarifikasi tidak diperlukan lagi. Namun apabila dengan peningkatan konsentrasi enzim tidak memberi dampak penurunan nilai DP atau peningkatan perolehan jumlah gula pereduksi maka hal ini memperlihatkan adanya kecenderungan sifat resisten yang terbentuk dan diduga diakibatkan oleh mekanisme tertentu pada iradiasi menggunakan gelombang mikro sehingga pati sukar dicerna oleh enzim
α-amilase.
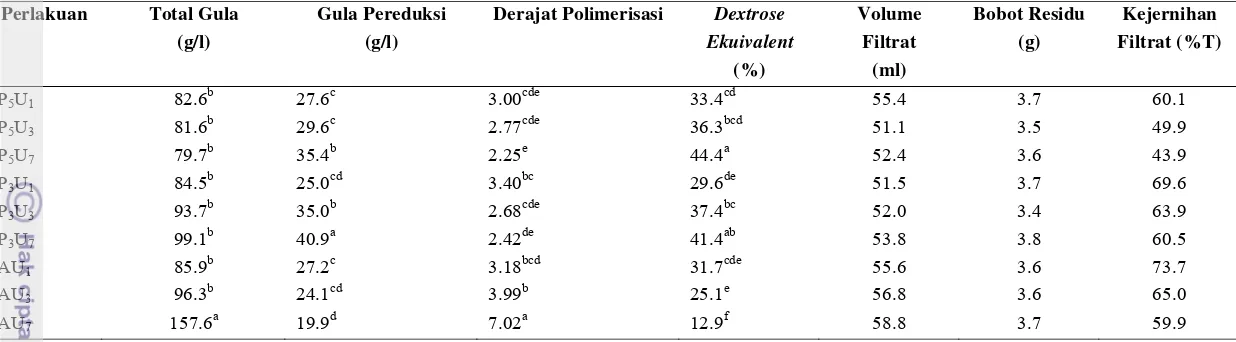
Tahap likuifikasi terdiri dari 9 perlakuan yaitu masing-masing pemanasan : otoklaf, gelombang mikro dengan aras daya 30% dan 50% dengan masing-masing konsentrasi enzim : 1.75 U/g (sebagai pembanding), 3.5 U/g, dan 7 U/g. Likuifikasi dilakukan dengan shaker waterbath pada suhu 95oC selama 3 jam. Pada akhir likuifikasi, sampel dipisahkan untuk diambil filtratnya. Filtrat sampel digunakan untuk menganalisis total gula, gula pereduksi, derajat polimerisasi (DP), dan dextrose equivalent (DE). Bagian ampas sampel dikeringkan untuk dihitung bobot residu yang diperoleh. Selain untuk analisa gula, filtrat juga akan diukur volume dan kejernihannya. Hasil pengujian disajikan pada Tabel 8.
28 Tabel 8. Karakteristik Filtrat dan Residu Hasil Likuifikasi
Perlakuan Total Gula (g/l)
Gula Pereduksi (g/l)
Derajat Polimerisasi Dextrose Ekuivalent
(%)
Volume Filtrat
(ml)
Bobot Residu (g)
Kejernihan Filtrat (%T)
P5U1 82.6b 27.6c 3.00cde 33.4cd 55.4 3.7 60.1
P5U3 81.6b 29.6c 2.77cde 36.3bcd 51.1 3.5 49.9
P5U7 79.7b 35.4b 2.25e 44.4a 52.4 3.6 43.9
P3U1 84.5b 25.0cd 3.40bc 29.6de 51.5 3.7 69.6
P3U3 93.7b 35.0b 2.68cde 37.4bc 52.0 3.4 63.9
P3U7 99.1b 40.9a 2.42de 41.4ab 53.8 3.8 60.5
AU1 85.9b 27.2c 3.18bcd 31.7cde 55.6 3.6 73.7
AU3 96.3b 24.1cd 3.99b 25.1e 56.8 3.6 65.0
AU7 157.6a 19.9d 7.02a 12.9f 58.8 3.7 59.9
29 a.
b.
[image:30.595.110.491.80.800.2]c.
30 Pada pemanasan gelombang mikro dengan aras daya 30%, perlakuan terbaik juga diperoleh dari konsentrasi enzim tertinggi yaitu 7 U/g. Sama halnya pada pemanasan dengan aras daya 50%, enzim dapat menerima kondisi substrat yang telah dikenai perlakuan pemanasan sehingga substrat yang telah dikenai pemanasan dapat membuat aksestibilitas enzim menjadi lebih mudah. Itu sebabnya, dengan semakin tinggi konsentrasi enzim maka jumlah enzim yang mengakses substrat semakin meningkat. Peningkatan konsentrasi enzim memberikan nilai DP yang semakin kecil namun pada konsentrasi enzim 7 U/g, nilai DP tidak berbeda jauh dengan konsentrasi enzim 3 U/g, artinya peningkatan konsentrasi enzim α-amilase
setelah konsentrasi 3.5 U/g tidak terlalu berpengaruh pada peningkatan jumlah gula yang terbentuk. Sesuai dengan yang dituliskan oleh Wulansari (2004), pada konsentrasi tertentu aktivitas enzim tidak akan
meningkat lagi karena jumlah enzim dalam substrat sudah mengalami kejenuhan. Jika hal ini terjadi maka penambahan dosis enzim ke dalam substrat tidak akan meningkatkan aktivitas enzim (Wulansari 2004).
Dextrose equivalent (DE) menyatakan persentase hidrolisis banyaknya pati terkonversi menjadi monomer-monomernya terutama glukosa. Nilai DE mengindikasikan banyaknya polimer pati yang telah terpotong menjadi molekul-molekul glukosa yang lebih sederhana (Wulansari 2004). Seperti pada nilai DP, nilai DE terbaik yakni nilai DE tertinggi diperoleh dari perlakuan dengan pemanasan gelombang mikro dengan aras daya 50% dan konsentrasi enzim 7 U/g. Substrat yang belum terhidrolisis sama sekali akan memiliki nilai DE = 0, berarti belum adanya pembentukan gula-gula sederhana dan dengan DE = 44.4%, maka sudah ada pembentukan gula-gula sederhana sebesar 44.4% dari total keseluruhan pati dan komponen serat yang terdapat di dalam substrat.
Pemanasan dengan menggunakan otoklaf mengubah slurry menjadi gel yang menandakan terjadinya pemekatan. Dengan kondisi tergelatinisasi yang sempurna maka akan semakin mempermudah akses dan kontak enzim α-amilase terhadap slurry. Dapat dikatakan bahwa jumlah bagian yang tergelatinisasi pada pemanasan menggunakan gelombang mikro (aras daya 50% dan 30%) lebih terbatas dibandingkan dengan pemanasan menggunakan otoklaf. Dengan adanya peningkatan konsentrasi enzim maka tahap awal dari likuifikasi yaitu degradasi amilosa berlangsung lebih cepat dan sempurna karena dengan meningkatnya jumlah enzim yang diberikan maka kontak enzim dengan bahan berlangsung lebih baik.
Kecenderungan hidrolisis pada slurry dengan pemanasan menggunakan otoklaf ialah degradasi amilosa menjadi maltosa dan maltotriosa sedangkan pada slurry yang dipanaskan dengan menggunakan gelombang mikro,dikarenakan jumlah bahan yang tergelatinisasinya tidak sebesar pada pemanasan dengan otoklaf maka kecenderungan hidrolisis ialah pembentukan gula-gula sederhana yang merupakan tahap lanjutan setelah degradasi amilosa. Artinya, dengan jumlah bahan yang tergelatinisasi lebih sedikit dibandingkan dengan pemanasan menggunakan otoklaf maka tahap degradasi amilosa berlangsung lebih singkat. Setelah tahap degradasi amilosa berakhir, maka enzim α-amilase terus melakukan pemotongan secara acak pada maltosa dan maltotriosa yang sudah terbentuk lebih dulu sehingga akhirnya juga membentuk gula-gula sederhana. Itulah sebabnya pada pemanasan menggunakan gelombang mikro dengan semakin ditingkatnya konsentrasi enzim, jumlah gula pereduksi yang terbentuk semakin meningkat.
31 Jika dosis enzim terlalu tinggi atau hidrolisis berlangsung terlalu lama maka sebagian glukosa dapat berpolimerisasi kembali sedangkan menurut Berghmans (1981), keadaan ini disebut over-conversion.
Jumlah total gula dan gula pereduksi yang diperoleh dari pemanasan menggunakan gelombang mikro, lebih tinggi diperoleh dari pemanasan pada aras daya 30% meskipun selisih pada aras daya 50% dan 30% tidak terlalu jauh. Hal ini disebabkan oleh adanya komponen bahan yang mengalami autohidrolisis pada aras daya 30% hingga membentuk gula-gula sederhana. Adanya mekanisme autohidrolisis ini menyebabkan jumlah total gula dan gula pereduksi lebih tinggi diperoleh pada
pemanasan dengan menggunakan aras daya 30%. Pemanasan menggunakan gelombang mikro tidak semata-mata hanya untuk gelatinisasi pati dan perusakan struktur serat akan tetapi juga autohidrolisis
substrat. Diduga mekanisme kecenderungan pemanasan gelombang mikro pada aras daya 50% ialah perusakan struktur lignin dan serat daripada autohidrolisis seperti pada aras daya 30%.
Pada pemanasan yang menggunakan otoklaf, jumlah gula yang terbentuk lebih besar dibandingkan dengan pemanasan menggunakan gelombang mikro karena hidrolisis yang terjadi cenderung memotong rantai pada pati untuk membentuk maltosa dan maltotriosa. Kenaikan dosis α-amilase selanjutnya tidak menghasilkan kenaikan rendemen gula pereduksi sehingga meskipun total gulanya tinggi akan tetapi gula pereduksi yang terbentuk lebih rendah . Dengan demikian nilai DP pemanasan dengan menggunakan otoklaf lebih tinggi dibandingkan pemanasan dengan gelombang mikro.
Berdasarkan nilai total gula, gula pereduksi, DP, dan DE, perlakuan yang terbaik diperoleh dari pemanasan menggunakan aras daya 30% dengan konsentrasi enzim 7 U/g (P3U7) dan pemanasan menggunakan gelombang mikro pada aras daya 50% dengan konsentrasi enzim 7 U/g (P5U7). Nilai total gula dan gula pereduksi terbaik diperoleh dari perlakuan P3U7 namun untuk nilai DP terendah dan DE tertinggi diperoleh dari perlakuan P5U7. Nilai DP terendah diperoleh dari perlakuan P5U7 yaitu 2.42. Hal ini menandakan dari tahap likuifikasi belum tercapai dekstrosa murni karena pemutusan rantai amilosa dan amilopektin masih menyisakan oligosakarida dan α-limit dekstrin sehingga selanjutnya slurry
disakarifikasi menggunakan konsorsium enzim (Winarno 1986).
32 karena air sepenuhnya telah terperangkap di dalam substrat. Hal ini yang memudahkan enzim untuk kontak dengan substrat.
Secara umum untuk pemanasan menggunakan otoklaf, peningkatan konsentrasi enzim menyebabkan peningkatan jumlah filtrat. Namun, untuk perlakuan pemanasan gelombang mikro pada aras daya 30% peningkatan volume juga dapat diakibatkan dari air bebas yang sejak semula berada pada
slurry. Pada pemanasan gelombang mikro dengan aras daya 50%, volume filtrat tertinggi diperoleh dari konsentrasi enzim terendah yaitu 1.75 U/g atau perlakuan pembanding. Dalam hal ini, dapat diduga bahwa
peningkatan konsentrasi enzim tidak meningkatkan degradasi amilosa secara acak akan tetapi enzim α -amilase terus memotong hasil degradasi amilosa untuk membentuk glukosa dan maltosa. Sebagai mana
diketahui bahwa degradasi amilosa menyebabkan penurunan viskositas dengan cepat. Hal ini juga sesuai dengan hasil analisa gula yang meliputi nilai DP dan DE dimana meskipun total gula dan gula pereduksi yang dihasilkan lebih rendah dari perlakuan lainnya akan tetapi nilai DP dan DE perlakuan P5U7 merupakan nilai terbaik yaitu DP terkecil (2.42) dan DE tertinggi yang menandakan pembentukan gula-gula pereduksi meningkat dari konsentrasi enzim sebelumnya.
Hasil likuifikasi memperlihatkan bahwa dengan semakin meningkatnya konsentrasi enzim menyebabkan bobot residu pada sampel semakin berkurang. Bobot residu terkecil pada tahap likuifikasi diperoleh pada pemanasan dengan gelombang mikro pada aras daya 30% (P3U7). Idealnya hal ini menandakan bahwa jumlah pati yang terhidrolisis paling besar diperoleh dari pemanasan dengan gelombang mikro pada aras daya 30% sehingga total gula yang diperoleh paling tinggi diantara perlakuan lainnya, namun total gula terbesar diperoleh dari pemanasan dengan otoklaf. Menurut Azuma (1986), perbedaan diantara bobot residu dan gula yang terbentuk berasal dari komponen yang bukan gula namun larut akibat pemanasan dengan gelombang mikro. Selain itu juga disebabkan oleh autohidrolisis pada komponen serat yang menyebabkan bobot residu oleh pemanasan gelombang mikro pada aras daya 30% berkurang.
Kejernihan filtrat dinyatakan dengan nilai transmitan (%T). Semakin rendah nilai kejernihan, menandakan jumlah padatan gula terlarut dalam filtrat semakin tinggi dan begitu pula sebaliknya. Dari hasil likuifikasi, peningkatan konsentrasi enzim pada semua perlakuan pemanasan menyebabkan peningkatan pembentukan padatan gula dalam filtrat sehingga kejernihan filtrat semakin berkurang. Kejernihan filtrat terendah atau filtrat dengan padatan gula terlarut tertinggi diperoleh pada pemanasan gelombang mikro pada aras daya 50% dan konsentrasi enzim 7 U/g.
Struktur pati dan serat residu dari likuifikasi empulur sagu diamati menggunakan mikroskop cahaya terpolarisasi. Warna biru keunguan menandakan komponen pati dan serat yang telah rusak struktur kristalinnya. Warna biru mengindikasikan komponen pati dan ser