SIFAT FISIOLOGIS DAN PRODUKSI
NURHADIAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Transgenik IPB 1 pada berbagai Aras Pemupukan N dan P berdasarkan Sifat Fisiologis dan Produksi adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka pada bagian akhir tesis ini.
Bogor, April 2012
Nurhadiah
NRP. A154090011
NURHADIAH. Selection of Transgenic Sugarcane Clones IPB 1 at various Level of Fertilizer N and P based on Physiological Properties and Production. Supervised by DWI ANDREAS SANTOSA, ANAS MIFTAH FAUZI and AGUS PURWITO.
IPB 1 transgenic sugarcane clones are clones of sugarcane expressing phytase gene cv. PS 851, which has been done by previous researchers. In the process of genetic transformation, stages of regeneration through callus formation process will induce genetic variation. The process of transformation induced to somaclonal variation can contribute to differences among transgenic clones. This study aims to get the best clones of transgenic sugarcane IPB 1 which has high efficiency of N and P fertilizer use, high chlorophyll content, high phytase activity, high biomass and sugar production. This study is also aimed to know the effect of ZA and SP 36 fertilizer to N and P content in leaves, chlorophyll content, phytase activity and production of transgenic sugarcane IPB1. Experimental design used was split plot design in randomized block design, consists of two factors, i.e. factor A as the main plot: the level of fertilizer nitrogen (N) and phosphorus (P). Factor B as the subplot: sugarcane clones IPB 1 transgenic and PS 851 isogenic as a control. DMRT (Duncan Multiple Range Test) at the level of 5% is used analyze the differences between treatments. In average the results showed that to transgenic sugarcane clones IPB 1-3 is the best transgenic sugarcane clones that have the highest rates of sugar production of 98.32 quintal/hectare. Then followed by the transgenic sugarcane clones IPB 1-1 (97.86 quintal/hectare), IPB 1-59 (96.93 quintal/hectare), IPB 1-52 (96.63 quintal/hectare), and IPB 1-56 (96.18 quintal/hectare). Specifically on fertilizer treatment at rate of N 50% and P 50%, transgenic sugarcane clones IPB 1-7 is the best transgenic sugarcane clones that produced 108.57 quintal of sugar /hectare. Then followed by the transgenic sugarcane clones IPB 1-3 (104.80 quintal/hectare) and IPB 1-1 (104.57 quintal/hectare). Besides having a high sugar production, there is also a correlation between N and P content, chlorophyll content, phytase activity and production. N and P fertilization as done did not give significant effect on N and P content, chlorophyll content, phytase activity and production. Fertilizer treatment at rate of N 50% and P 50% which is the lowest, having the same effect with fertilizer treatment at rate of N 100% and P 100% on N and P content, chlorophyll content, phytase activity and production. With this results, it can be concluded that transgenic sugarcane IPB 1 can reduced 50% of N and P fertilizer use.
NURHADIAH. Seleksi Klon-Klon Tebu Transgenik IPB 1 pada berbagai Aras Pemupukan N dan P berdasarkan Sifat Fisiologis dan Produksi. Dibimbing oleh DWI ANDREAS SANTOSA, ANAS MIFTAH FAUZI dan AGUS PURWITO
Tanaman tebu (Saccharum officinarum L.) merupakan salah satu
komoditas perkebunan penting yang ditanam untuk bahan baku utama gula. Rendahnya produksi tebu saat ini, diantaranya disebabkan oleh penataan varietas dan pembibitan yang masih rendah, praktek budidaya yang kurang maksimal dan ketersediaan hara dalam tanah yang kurang.
Kultivar PS 851 yang disisipi gen fitase adalah salah satu upaya untuk memperbaiki varietas tebu dengan meningkatkan aktivitas fitase dalam melepaskan P yang terikat dalam bentuk organik (fitat). Dalam proses transformasi genetik, terbentuknya organ tanaman tebu secara in-vitro, dengan menumbuhkan kalus merupakan hal yang penting. Dalam kasus perbanyakan kultur jaringan yang terjadi adalah mutasi somatik. Kejadian ini banyak dipengaruhi oleh sel itu sendiri. Sel yang bermutasi dapat membelah, kemudian membentuk kumpulan sel yang berbeda dengan sel asalnya. Sel-sel yang bermutasi ini akan membentuk tanaman, yang merupakan klon baru yang berbeda dengan induknya. Keragaman somaklonal yang diperoleh dari
perbanyakan secara in-vitro ini, menyebabkan adanya keragaman klon tebu
transgenik IPB 1 di lapang.
Penelitian ini bertujuan untuk mendapatkan klon terbaik tebu transgenik IPB1 yang memiliki efisiensi tinggi terhadap penggunaan pupuk N dan P, kandungan klorofil tinggi, aktivitas fitase tinggi dan produksi biomassa dan gula yang tinggi. Selain itu, juga untuk mengetahui pengaruh pemupukan ZA dan SP-36 terhadap kandungan N dan P pada daun, kandungan klorofil, aktivitas fitase serta produksi tebu transgenik IPB 1.
Penelitian dilaksanakan di Kebun Percobaan PG Djatiroto, Jawa Timur. Untuk analisis, dilakukan di Laboratorium Departemen Ilmu Tanah dan
Sumberdaya Lahan Fakultas Pertanian IPB, Laboratorium Indonesian Center for
Biodiversity and Biotechnology (ICBB), dan PT Saraswanti Indo Genetech (SIG) Bogor, yang di mulai pada bulan Nopember 2010 sampai bulan Desember 2011.
Penelitian ini menggunakan rancangan split plot dalam RAK, yang terdiri dari dua faktor, yaitu faktor A sebagai petak utama: pemupukan Nitrogen (N) dan Fosfor (P). Faktor B sebagai anak petak: klon tebu transgenik IPB 1 dan isogenik PS 851 sebagai kontrol.
Pemupukan N dan P terdiri atas 4 aras perlakuan. Aras perlakuan yang dimaksud yaitu: perlakuan a: pemupukan N 50% dan P 50%, perlakuan b: pemupukan N 100% dan P 50%, perlakuan c: pemupukan N 50% dan P 100%, perlakuan d: pemupukan N 100% dan P 100%. Pupuk yang digunakan adalah pupuk ZA, SP 36, dan KCl. Pemupukan normal untuk tanaman tebu adalah 8 ku ZA/ha, 2 ku SP 36/ha, dan 1 ku KCl/ha. Selain pemupukan N dan P, dilakukan juga pemupukan K yang diberikan sesuai dengan rekomendasi. Pupuk ZA 50% dan SP 36 100% dari perlakuan, diberikan pada saat tanam. Kemudian pupuk ZA 50% dari perlakuan dan KCl sesuai rekomendasi diberikan pada saat tanaman berumur 1,5 bulan setelah tanam. Penanaman dilakukan pada minggu kedua bulan Juli tahun 2010.
1-transgenik IPB 1 dan 1 klon tebu isogenik) x 4 aras pemupukan N dan P = 96 perlakuan. Tiap perlakuan diulang 3 kali sehingga terdapat 288 unit percobaan.
Bahan yang digunakan dalam penelitian ini terdiri dari daun dan meristem pucuk. Pengambilan daun dilakukan pada umur 3 dan 6 bulan setelah tanam, sedangkan meristem pucuk hanya pada umur 6 bulan setelah tanam. Daun ketiga dari daun teratas digunakan untuk analisis kandungan klorofil dan aktivitas fitase. Daun kedua dari bawah digunakan untuk analisis kandungan N dan P. Kemudian meristem pucuk digunakan untuk deteksi gen fitase.
Data yang diperoleh pada umur 3 bulan, dilakukan secara deskripsi pada ulangan 1. Pada umur 6 bulan setelah tanam, data dianalisis dengan mengggunakan Statistical Analysis Software (SAS) dengan model split plot dalam RAK untuk mengetahui pengaruh perlakuan. Perlakuan yang berpengaruh
dilanjutkan dengan uji DMRT (Duncan Multiple Range Test) pada taraf 5%, untuk
mengetahui beda nyata antar perlakuan. Berdasarkan data yang diperoleh pada umur 3 dan 6 bulan, dilakukan seleksi klon tebu berdasarkan rerata klon tebu pada setiap peubah (kandungan N dan P, kandungan klorofil (rasio rerata klorofil a/b), aktivitas fitase dan produksi). Nilai rerata tersebut dibandingkan dengan nilai rerata kontrol (PS 851). Klon tebu transgenik IPB 1 yang memiliki nilai rerata lebih tinggi dari kontrol, menjadi klon tebu transgenik yang terseleksi. Klon tebu transgenik terseleksi tersebut, yang memiliki produksi biomassa dan gula yang tinggi, dipilih sebagai klon terbaik dibandingkan dengan klon tebu transgenik yang lain.
Hasil penelitian menunjukan bahwa klon tebu transgenik IPB 1-3 merupakan klon tebu transgenik terbaik yang memiliki rerata produksi gula tertinggi 98,32 ku/ha. Kemudian menyusul klon tebu transgenik IPB 1-1 (97,86 ku/ha), IPB 1-59 (96,93 ku/ha), IPB 1-52 (96,63 ku/ha), dan IPB 1-56 (96,18 ku/ha). Khusus pada perlakuan pemupukan N 50% dan P 50%, klon tebu transgenik IPB 1-7, merupakan klon tebu transgenik terbaik, yang memiliki produksi 108,57 ku/ha. Kemudian menyusul klon tebu transgenik IPB 1-3 (104,80 ku/ha) dan IPB 1-1 (104,57 ku/ha). Selain memiliki produksi gula yang tinggi, juga terjadi korelasi antar kandungan N dan P, kandungan klorofil, aktivitas fitase dan produksi. Pemupukan N dan P tidak memberikan pengaruh yang nyata terhadap kandungan N dan P, kandungan klorofil, aktivitas fitase dan produksi. Pemupukan N 50% dan P 50% yang merupakan pemupukan terendah, memberikan pengaruh yang sama dengan pemupukan N 100% dan P 100% yang merupakan aras pemupukan tertinggi. Untuk itu, pemupukan N 50% dan P 50% menjadi perlakuan pemupukan terbaik karena dapat mengurangi 50% penggunaan pupuk N dan P pada tebu transgenik IPB 1.
@Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
SIFAT FISIOLOGIS DAN PRODUKSI
NURHADIAH
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Bioteknologi Tanah dan Lingkungan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Aras Pemupukan N dan P berdasarkan Sifat Fisiologis dan Produksi
Nama : Nurhadiah
NRP : A154090011
Program Studi : Bioteknologi Tanah dan Lingkungan
Disetujui
Komisi Pembimbing
Dr. Ir. Dwi Andreas Santosa, MS. Ketua
Prof. Dr. Ir. Anas Miftah Fauzi, M.Eng. Anggota
Dr. Ir. Agus Purwito, M.Sc.Agr. Anggota
Mengetahui
Ketua Program Studi
Bioteknologi Tanah dan Lingkungan
Dr. Ir. Dwi Andreas Santosa, MS.
Dekan Sekolah Pascasarjana IPB
Dr. Ir. Dahrul Syah, M.Sc.Agr.
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karuniaNya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian yang
berjudul “Seleksi Klon-Klon Tebu Transgenik IPB 1 pada berbagai Aras
Pemupukan N dan P berdasarkan Sifat Fisiologis dan Produksi” ini disusun sebagai salah satu syarat tugas akhir untuk memperoleh gelar Magister Sains pada Program Studi Bioteknologi Tanah dan Lingkungan, Institut Pertanian Bogor.
Penulis menyampaikan rasa hormat dan terima kasih kepada bapak Dr. Ir. Dwi Andreas Santosa, MS., bapak Prof. Dr. Ir. Anas Miftah Fauzi, M.Eng., dan bapak Dr. Ir. Agus Purwito, M.Sc.Agr., atas bimbingan, arahan, serta perhatian dalam penelitian dan penulisan karya ilmiah ini. Terima kasih kepada bapak Dr. Ir. Syaiful Anwar M.Sc, atas waktu dan kesediaan Bapak menjadi penguji luar komisi. Terima kasih kepada bapak Prof. Dr. Arkanudin, M.Si, selaku Rektor Universitas Kapuas Sintang, yang telah memberikan ijin tugas belajar di Sekolah Pascasarjana IPB. Terima kasih kepada Ditjen DIKTI Kementerian Pendidikan Nasional, atas kesempatan yang diberikan kepada penulis melalui Beasiswa Program Pascasarjana di Sekolah Pascasarjana IPB. Terima kasih kepada PTPN XI PG Djatiroto Jawa Timur, atas bantuan yang telah diberikan dalam penelitian ini. Terima kasih kepada PT Saraswanti Indo Genetech (SIG), terutama staf Laboratorium bagian DNA molekuler. Terima kasih kepada seluruh staf Laboratorium Indonesian Center for Biodiversity and Biotechnology (ICBB), terutama kepada ibu Yanti, mba Salmah dan teteh Hartati. Terima kasih kepada seluruh staf Laboratorium Bioteknologi tanah, Laboratorium Kesuburan Tanah terutama kepada Bapak Sarjito, ibu Asih Karyati, ibu Julaeha atas bimbingan bantuannya. Terima kasih kepada Ibu Ir. Ermin Widjaja, M.Si, Hadi Wisa Nugraha, SP, dan Rifki Rahmatullah, SP, atas kerjasama yang baik dalam penelitian tebu transgenik ini. Terima kasih kepada Desi Arisanti, SP, atas kebersamaan dan bantuannya selama kuliah pada Program Studi Bioteknologi Tanah dan Lingkungan, Sekolah Pascasarjana IPB. Terima kasih kepada Herlina Kurniawati, SP, atas kebersamaan dan bantuannya. Terima kasih kepada Syofia Asridawati, SP, Rani Chahyani Ansor, S.Si., M.Si dan Devy Sandra, SP, serta semua teman-teman yang telah membantu dan memotivasi baik secara langsung maupun tidak langsung. Terima kasih terutama kepada ayahanda tercinta Muhammad Amin serta abang Halim Wijaya, abang M. Kalam, Siti Raudhah, Abdurrahim dan Shadri, atas doa, motivasi dan pengertiannya.
Akhir kata, semoga karya ilmiah ini dapat bermanfaat bagi pihak terkait dan semua pihak yang membutuhkan informasi.
Bogor, April 2012
Penulis dilahirkan di Sekadau, Kalimantan Barat pada tanggal 14 Agustus 1974. Lahir sebagai anak ketiga dari enam bersaudara dari pasangan ayah Muhammad Amin dan ibu Nurani (almh).
Aklimatisasi: proses penyesuaian peralihan lingkungan hidup heterotrof menjadi autotrof pada planlet yang diperoleh melalui teknik in-vitro.
Amplikon: untai ganda DNA hasil amplifikasi
Annealing: pembentukan double strand asam nukleotida dari 2 untaian single strand molekul asam nukleotida.
DNA polymerase: sebuah enzim yang menghubungkan sebuah deoksiribonukleotida yang komlpemen dengan deoksiribonukleotida pada
template untaian DNA, dengan sebuah ikatan fosfor diester pada kelompok ‘3
hidroksil, yang pada akhirnya akan menghasilkan untaian nukliotida selama replikasi.
Elektoforesis: teknik pemisahan molekul (DNA, RNA, protein) berdasarkan pergerakan migrasi akibat pemberian arus listrik.
Element transposable: bagian DNA yang dapat berpindah dari satu kromosom ke kromosom yang lain.
Elongation: perpanjangan dari rantai nukleotida dengan menambahkan nukleotida baru atau rantai asam amino dengan menambahkan asam amino baru.
Epigenetik: perubahan fenotipe atau ekspresi genetika yang disebabkan oleh mekanisme selain perubahan sekuens DNA dasar.
Fitase: enzim yang dapat menghidrolisis fitat, sehingga P menjadi terlepas.
Fitat: bahan organik yang mengikat P.
Gen: unit dari pewarisan. Penentuan suatu sifat oada suatu organism yang terdiri dari molekul-molekul DNA yang teratur secara linier dalam kromosom yang dapat diturunkan pada keturunan berikutnya.
Gene cassette: elemen yang bersifat mobil, yang berukuran 262-1549 bp yang mengandung hanya satu gen tunggal 59 bp situs rekombinan yang berada di ujung gen (down stream).
Induksi: inisiasi dari suatu proses khusus yang menghasilkan perkembangan dari suatu organ.
Isogenik: klon yang mempunyai latar belakang genetika yang lebih seragam, digunakan untuk memantau perubahan klon tebu transgenik.
Mispriming: penempelan primer di luar sekuen target.
Mutasi adalah perubahan yang terjadi pada bahan genetik (DNA maupun RNA), baik pada taraf urutan gen (disebut mutasi titik) maupun pada taraf kromosom. Mutasi pada tingkat kromosomal biasanya disebut aberasi. Mutasi pada gen dapat mengarah pada munculnya alel baru dan menjadi dasar munculnya variasi-variasi baru pada spesies.
PCR: amplifikasi enzimatik dari fragmen DNA spesifik dengan menggunakan
siklus berulang dari denaturasi, annealing dan elongation.
Primer: sebuah oligonukleotida khusus yang komplemen pada region tertentu dari strand template, yang mana sintesis DNA baru terjadi.
Regenerasi: proses pembentukan organ-organ dari suatu eksplan yang digunakan dalam kultur in-vitro.
Rendemen: produksi gula per produksi tebu (hablur per bobot).
Rhizosfer: tempat pertemuan antara tanah dengan akar tanaman
Plot amplifikasi: plot dari sinyal fluoresen yang dibandingkan dengan jumlah siklus.
Promotor: situs di DNA tempat RNA polymerase terikat untuk memulai transkripsi.
Poliploidi: suatu organisme yang memiliki jumlah kromosom menyimpang atau memiliki lebih dari 2 set kromosom.
Siklus Threshold (CT): pertemuan siklus dengan threshold
Sister chromatid exchange: pertukaran kromatid, terjadi bila keadaannya tidak simetris.
Somatik: proses non seksual ataupun bagian vegetatif tanaman.
Threshold: tingkat deteksi di mana reaksi mencapai intensitas fluoresen di atas dasar (over background/baseline).
Transforman: sel yang telah mengalami proses transformasi.
Transformasi: proses memasukan DNA asing ke dalam sel. Sebuah pertukaran dalam morfologi sel ke genom sebuah sel oleh aplikasi eksternal dari sel lain, juga DNA rekombinan dari sel lain yang berbeda.
xix
Halaman
DAFTAR GAMBAR . . . xxi
DAFTAR TABEL . . . xxiii
DAFTAR LAMPIRAN . . . xxv
PENDAHULUAN Latar Belakang . . . 1
Tujuan Penelitian . . . 3
Hipotesis Penelitian . . . 4
Ruang Lingkup Penelitian . . . 4
Manfaat Penelitian . . . 4
TINJAUAN PUSTAKA Tebu . . . 5
Botani dan Syarat Tumbuh . . . 5
Tebu Transgenik . . . 7
Fitase . . . 8
Peranan N, P dan K . . . 9
Keragaman Somaklonal . . . 10
METODE PENELITIAN Waktu dan Tempat Penelitian . . . 13
Bahan dan Alat . . . 13
Rancangan Percobaan . . . 13
Tahapan Penelitian . . . 16
HASIL DAN PEMBAHASAN Tanaman Berumur 3 Bulan setelah Tanam . . . 23
Kandungan N . . . 23
Kandungan P . . . 25
Kandungan klorofil . . . 27
Aktivitas fitase . . . 31
Tanaman berumur 6 dan 12 Bulan setelah Tanam . . . 34
Aktivitas Fitase . . . 34
Kandungan P . . . 36
Rendemen . . . 37
Deteksi Gen Fitase . . . 42
Pembahasan Umum . . . 44
SIMPULAN DAN SARAN Simpulan . . . 47
Saran . . . 48
DAFTAR PUSTAKA . . . 49
xxi
Halaman
1 Diagram alir penelitian, garis putus-putus ( - - - -) merupakan
keterkaitan penelitian yang dilakukan secara terpisah . . . 16 2 Konversi klorofil a menjadi klorofil b, A secara tidak langsung
dan B secara langsung . . . 30 3 Struktur konformasi asam fitat . . . 33 4 Real-time PCR primer EC13 menunjukan klon IPB 1-3 (5), Grafik
berwarna biru, dan klon IPB 1-62 (M), Grafik berwarna merah,
melewati threshold pada plot amplifikasi . . . 43 5 Real-time PCR primer EC13 menunjukan klon IPB 1-3 (5), Grafik
berwarna biru, dan klon IPB 1-62 (M), Grafik berwarna merah,
xxiii
Halaman
1 Kandungan N (%) pada umur 3 bulan setelah tanam . . . 23
2 Kandungan P (%) pada umur 3 bulan setelah tanam . . . 25
3 Kandungan klorofil (µg/ml) pada umur 3 bulan setelah tanam . . . . 29
4 Aktivitas fitase (U/ml) pada umur 3 bulan setelah tanam . . . 32 5 Rekapitulasi analisis ragam aktivitas fitase, kandungan klorofil,
kandungan N dan P (peubah pada umur 6 bulan setelah tanam), serta bobot, rendemen dan hablur (peubah pada umur 12 bulan
setelah tanam) . . . 34
6 Aktivitas fitase klon tebu transgenik IPB 1 pada umur 6 bulan
setelah tanam . . . 35
7 Kandungan P (%) klon tebu transgenik IPB 1 pada umur 6 bulan
setelah tanam . . . 36 8 Produksi tebu transgenik IPB 1 . . . 38
9 Rerata produksi tebu transgenik IPB 1 pada berbagai aras
pemupukan . . . 39
10 Klon tebu transgenik yang memiliki nilai peubah lebih tinggi
dibandingkan dengan kontrol (PS 851) . . . 40
11 Klon tebu transgenik yang memiliki nilai peubah lebih tinggi dibandingkan dengan kontrol (PS 851) pada pemupukan N 50%
xxv
Halaman
1 Hasil analisis tanah pada lokasi penelitian . . . 57 2 Deskripsi varietas PS 851 . . . 58 3 Denah Penelitian . . . 60
4 Rentang konsentrasi hara optimum daun tebu dan konsentrasi
di mana 5-10% atau 25% dari kerugian produksi optimal yang
diharapkan . . . 62
5 Analisis ragam aktivitas fitase (U/ml) pada umur 6 bulan setelah
tanam . . . 63
6 Analisis ragam kandungan klorofil a (µg/ml) pada umur 6 bulan
setelah tanam . . . 63
7 Analisis ragam kandungan klorofil b (µg/ml) pada umur 6 bulan
setelah tanam . . . 63
8 Analisis ragam rasio klorofil a/b (µg/ml) pada umur 6 bulan setelah
tanam . . . 64
9 Analisis ragam kandungan Nitrogen (%) pada umur 6 bulan setelah
tanam . . . 64
10 Analisis ragam kandungan Fosfor (%) pada umur 6 bulan setelah
tanam . . . 64
11 Analisis ragam bobot (kui/ha) pada umur 12 bulan setelah tanam . . . 65
12 Analisis ragam rendemen (%) pada umur 12 bulan setelah tanam . . 65
13 Analisis ragam hablur (kui/ha) setelah tanam . . . 65 14 Korelasi antar peubah yang diamati . . . 66 15 Korelasi antar peubah yang diamati pada pemupukan N 50% dan
P 50%, umur 3 bulan setelah tanam . . . 67 16 Korelasi antar peubah yang diamati pada pemupukan N 50% dan
P 50%, umur 6 bulan setelah tanam. . . 67 17 Data aktivitas fitase (U/ml) pada umur 6 bulan setelah tanam . . . 68 18 Data kandungan klorofil a (µg/ml) pada umur 6 bulan setelah tanam 69
19 Data kandungan klorofil b (µg/ml) pada umur 6 bulan setelah tanam 70
20 Data rasio klorofil a/b (µg/ml) pada umur 6 bulan setelah tanam . . . . 71
21 Data kandungan N (%) pada umur 6 bulan setelah tanam . . . 72
22 Data kandungan P (%) pada umur 6 bulan setelah tanam . . . 73
23 Data kandungan N (%) komposit pada umur 6 bulan setelah tanam . 74
24 Data kandungan P (%) komposit pada umur 6 bulan setelah tanam . 74
PENDAHULUAN
Latar Belakang
Tanaman tebu (Saccharum officinarum L.) merupakan salah satu
komoditas perkebunan penting yang ditanam untuk bahan baku utama gula. Gula adalah salah satu komoditas strategis dalam perekonomian Indonesia, karena disamping sebagai salah satu kebutuhan pokok masyarakat, juga sebagai sumber kalori yang relatif murah. Saat ini, Indonesia baru bisa memenuhi kebutuhan gula konsumsi sebanyak 2,7 juta ton per tahun, sedangkan kebutuhan industri sebanyak 1,8 juta ton per tahun dipenuhi dengan gula impor (Fazli 2009). Untuk itu, peningkatan produksi gula perlu terus dilakukan, supaya kebutuhan gula selain sebagai konsumsi, juga bahan baku industri dapat terpenuhi.
Pada prinsipnya peningkatan produksi gula dapat dilaksanakan dengan perluasan areal, peningkatan bobot tebu perhektar dan peningkatan rendemen. Peningkatan rendemen akan meningkatkan produktivitas (produksi) tanpa perlu meningkatkan kapasitas pabrik gula. Kisaran rendemen rata-rata hanya sebesar 6,9%, dengan kinerja rendemen di Jawa selama lima tahun terakhir sangat rendah yaitu rata-rata 6,25% selama 1998-2002. Adapun rendahnya kinerja rendemen saat ini adalah merupakan akibat dari tidak diterapkannya secara baik teknologi yang tersedia. Teknologi yang dimaksud diantaranya: penataan varietas dan pembibitan, waktu tanam dan pengaturan kebutuhan air, pemupukan yang berimbang, pengendalian hama dan penyakit, penentuan awal giling, tebang, muat dan angkut, serta analisa kemasakan (P3GI 2008).
membuktikan adanya korelasi yang positif antara kandungan hara P2O5 dalam daun, terhadap hasil dan hablur gula tebu. Semua reaksi metabolisme penting,
memerlukan H2PO4- dan turunannya. Sebagai akibatnya, kekurangan P
berhubungan dengan terhambatnya pertumbuhan dan perkembangan.
Fosfor (P) di dalam tanah dapat dibedakan dalam dua bentuk, yaitu P organik dan P anorganik. Kandungannya sangat bervariasi tergantung pada jenis tanah, tetapi pada umumnya rendah. P organik di dalam tanah terdapat sekitar 50% dari P total tanah dan bervariasi sekitar 15-80% pada kebanyakan tanah. Bentuk-bentuk P ini berasal dari sisa tanaman, hewan dan mikrob. P ini terdapat sebagai senyawa ester dari asam ortofosfat, yaitu inositol, fosfolipid, asam nukleat, nukleotida, dan gula fosfat. Tiga senyawa pertama sangat dominan di dalam tanah, dan diperkirakan proporsi senyawa ini dalam total P organik adalah inositol fosfat 10-30%, fosfolipid 1-5% dan asam nukleat 0.2-2.5%. Inositol fosfat dapat mempunyai satu sampai enam atom P setiap unitnya, dan senyawa ini dapat ditemukan dalam tanah atau organisme hidup yang dibentuk secara enzimatik (Havlin et al. 2005).
Menurut Kerovuo et al. (2000), fitat (inositolhexakisphosphat, IP6) merupakan sumber P dalam tanaman yang mencapai lebih dari 80% dari total P pada tanaman sereal dan legum. P yang terdapat dalam fitat sukar untuk digunakan tanaman (Greiner 2007) dan baru dapat dilepaskan bila ada aktivitas enzim fitase.
Fitase merupakan enzim yang mampu menghidrolisis inositol fosfat (fitat) menjadi ortofosfat anorganik yang sangat penting dalam proses metabolisme tanaman. Untuk itu beberapa peneliti dari IPB berusaha meningkatkan aktivitas fitase, dengan menyisipkan gen fitase asal bakteri, yang menggunakan metode Santosa et al. (2004) melalui Agrobacterium tumefaciens GV 2260 pada tebu, sebagai upaya perbaikan genetik tanaman tersebut. Adapun peneliti yang dimaksud diantaranya telah berhasil menyisipkan gen fitase melalui
Agrobacterium tumefaciens GV 2260 dengan konstruksi gene cassette p Bin1-ECS (Farouk dan Greiner, tidak dipublikasikan) pada tebu cv. PSJT 9443, cv. PA 183, cv. Triton (Wulandari 2005), cv. PSJT 94-33, cv. PA 183 (Hayatyzul 2007).
Peneliti lainnya melakukan penyisipan gen fitase melalui Agrobacterium
tumefaciens GV 2260, dengan menggunakan konstruksi gene cassette yang
berbeda yaitu pBinP1-IIEC (Farouk dan Greiner, tidak dipublikasikan) pada tebu
PA 117 (Pesik 2005), cv. PS 851, cv. PA 198 (Nurhasanah 2007) dan cv. Triton, cv. PSJT 94-41, cv. PA 175 (Susiyanti 2008).
Dalam proses transformasi genetik, terbentuknya organ tanaman tebu
secara in-vitro, dengan menumbuhkan kalus merupakan hal yang penting. Dalam
kasus perbanyakan kultur jaringan yang terjadi adalah mutasi somatik. Kejadian ini banyak dipengaruhi oleh sel itu sendiri. Sel yang bermutasi dapat membelah, kemudian membentuk kumpulan sel yang berbeda dengan sel asalnya. Sel-sel yang bermutasi ini akan membentuk tanaman, yang merupakan klon baru yang berbeda dengan induknya (Wattimena et al. 2011). Faktor yang mempengaruhi keragaman somaklonal ini, yaitu: fisiologi, genetik, dan biokimia (Jayasankar 2005). Penyisipan gen fitase pada tebu cv. PS 851 telah dilakukan oleh Nurhasanah (2007), yang dalam penelitiannya, kode PST 851-1 digunakan untuk kode klon pertama PS 851 transgenik. Selanjutnya dalam penelitian ini, kode tersebut berubah menjadi IPB 1-1 dan angka terakhir menunjukan urutan klon yang diamati.
Adanya transformasi genetik dan keragaman somaklonal pada in-vitro
kultur jaringan, diduga menyebabkan keragaman klon-klon tebu transgenik pada tahap uji lapang. Berdasarkan adanya keragaman ini, maka perlu untuk menyeleksi klon-klon tebu transgenik IPB 1 pada berbagai aras pemupukan N dan P.
Tujuan Penelitian
Penelitian ini dilakukan dengan tujuan:
1. Untuk mendapatkan klon terbaik tebu transgenik IPB 1 yang memiliki efisiensi tinggi terhadap penggunaan pupuk N dan P, kandungan klorofil tinggi, aktivitas fitase tinggi dan produksi biomassa dan gula yang tinggi.
Hipotesis Penelitian
Hipotesis yang diajukan dalam penelitian ini adalah:
1) Terdapat klon terbaik tebu transgenik IPB 1 yang memiliki efisiensi tinggi terhadap penggunaan pupuk N dan P, kandungan klorofil tinggi, aktivitas fitase tinggi dan produksi biomassa dan gula yang tinggi.
2) Pemupukan ZA dan SP-36 meningkatkan kandungan N dan P, kandungan klorofil, aktivitas fitase serta produksi tebu transgenik IPB 1.
Ruang Lingkup Penelitian
Lingkup penelitian meliputi pengambilan sampel daun dan meristem, serta analisis laboratorium.
Manfaat Penelitian
Tebu
Botani dan Syarat Tumbuh
Tebu adalah tanaman tahunan yang tumbuh di daerah tropis, dan termasuk dalam famili rumput-rumputan (Gramineae). Tebu memiliki tunas-tunas dari pangkal batang yang tumbuh membentuk batang-batang yang tidak bercabang (rumpun). Tinggi batang tebu 2 sampai 4 m atau lebih, dengan diameter sekitar 5
cm. Pada genus Saccharum terdapat beberapa spesies, yaitu: Saccharum
officinarum, S. robustum, S. spontaneum, S. barberi, S. sinense, dan S. edule
(James 2004).
Batang tebu tersusun dalam ruas-ruas, di antara ruas-ruas terdapat buku-buku ruas. Pada setiap buku-buku terdapat mata yang dapat tumbuh menjadi kuncup tanaman baru, dan juga terdapat mata akar tempat keluarnya akar untuk kehidupan kuncup tersebut (Sastrowijono 1996). Selanjutnya James (2004) menambahkan bahwa umumnya nodus (buku-buku) berjarak pada interval sekitar 12 sampai 25 cm, tetapi lebih dekat jaraknya di bagian atas, dimana proses perpanjangan berlangsung. Nodus juga lebih dekat pada dasar (yaitu pada atau dibawah tanah) tempat tumbuhnya anakan baru.
Batang adalah penyokong dan penghasil daun dan bunga. Fungsi utama batang yaitu mendistribusikan daun pada jarak tertentu, sehingga daun dapat menyerap cahaya untuk fotosintesis. Batang juga dapat menyimpan makanan dan menyediakan tempat pergerakan air dan nutrisi menuju daun dan dari daun (Decoteau 2005).
Selain batang, daun juga merupakan organ tanaman yang berperan melakukan fotosintesis. Beberapa daun tidak melakukan fotosintesis, bahkan ada daun yang telah beralih fungsi, seperti sebagai penyimpan makanan dan air, reproduksi, pembentukan akar, memanjat, perlindungan atau pembentuk bunga (Decoteau 2005).
lurus dan mengecil kemudian meruncing di bagian ujungnya. Daun tebu agak keras dan berbulu agak kasar, tepinya seperti rata, namun sebenarnya bergigi yang sangat halus (Muljana 1982).
Secara umum, akar berfungsi untuk menambat tanaman dan menyerap air dan nutrisi dari tanah. Pada beberapa kasus, akar juga berfungsi sebagai penyimpan makanan (Decoteau 2005). Tebu mempunyai dua jenis akar, yaitu: akar bibit dan akar biasa. Akar bibit adalah akar yang tumbuh pada stek, sedangkan akar biasa adalah akar yang tumbuh dari tunas baru (Sutardjo 2002). Akar bibit tipis dan bercabang, namun akar yang berasal dari tunas lebih tebal dan lebih sedikit bercabang. Pada awalnya, bibit yang baru ditanam tergantung sepenuhnya pada akar bibit untuk penyerapan air dan hara, tetapi umur akar bibit ini terbatas. Fungsi akar bibit diambil alih oleh akar biasa yang dihasilkan oleh tunas baru. Tiap-tiap tunas berkembang sistem perakarannya sendiri. Akar bibit kemudian mati (James 2004). Perkembangan pertumbuhan akar dibagi menjadi 3 bagian yaitu: akar dangkal, akar penegak dan akar dalam. Akar dangkal, letak tumbuhnya dekat dengan permukaan tanah. Akar penegak, letak dan tumbuhnya bersudut 45-60o ke bawah dan berukuran paling besar. Akar dalam, letak dan tumbuhnya tegak lurus ke bawah dan menerobos tanah sampai dalam. Pada tanah yang padat, akar tumbuh pendek dan bercabang banyak. Pada tanah yang strukturnya baik (subur), akar tumbuh panjang-panjang dan bercabang sedikit (Sutardjo 2002).
Menurut Muljana (1982), tebu bisa berbunga dan berbuah. Bentuk bunganya seperti kerucut/piramida dengan panjang sekitar 50-80 cm. Cabang bunga pertama merupakan untaian dan yang kedua merupakan tandan. Pada untaian dan tandan tersebut terdapat bulir-bulir yang berpasang-pasangan, dengan panjang kurang lebih 2-4 mm. Pada bulir terdapat benangsari, putik dengan 2 kepala putik. Buah tebu termasuk buah padi-padian, berbiji satu. Biji tebu dapat tumbuh menjadi individu baru.
cocok ditanam pada daerah dataran yang ketinggiannya di bawah 500 m dpl. Curah hujan minimal 2000 mm per tahunnya. Keadaan iklim yang lebih baik adalah yang memiliki pergantian antara musim kemarau dan musim penghujan.
Tebu Transgenik
Tanaman transgenik adalah tanaman yang ke dalam komposisi bahan genetiknya telah ditambahkan seperangkat gen asing yang diisolasi dari jasad lain sehingga tanaman tersebut mempunyai kemampuan fisiologis baru yang tidak pernah ada sebelumnya di alam (Yuwono 2006). Beberapa teknik yang sering digunakan untuk menyisipkan DNA ke dalam sel adalah transformasi dengan Agrobacterium tumefaciens, elektroforasi, biolistik, serat silicon, makro dan mikro injeksi, dan sonifikasi. Teknik transformasi tersebut masing-masing memiliki efisiensi yang berbeda. Namun dalam semua teknik transformasi akan menempatkan transgen di bawah kendali promotor yang sifatnya konstitutif atau yang bisa terekspresi pada organ-organ spesifik (Skinner et al. 2004).
Transformasi gen fitase pada jaringan embriogenik melalui Agrobacterium tumafaciens akan memudahkan integrasi gen yang dikehendaki ke dalam tanaman. Santosa et al. (2004) melakukan transformasi dengan A. tumafaciens
GV2260 dengan gene cassette pBinI-ECS dan pBinPI-IIEC (Farouk dan Greiner,
tidak dipublikasikan) terhadap jaringan meristem dan kalus tebu yang diberikan antioksidan untuk menghindari proses nekrotik. Setelah melalui penelitian lebih lanjut, Santosa et al. (2004) dapat mengembangkan teknik transformasi melalui
kalus yang memiliki persentase keberhasilan pembentukan chimeric phytase
gene yang tinggi pada kultivar PSJT 94-33 (mencapai 100%).
Penyisipan gen fitase dengan menggunakan Agrobacterium tumafaciens
GV2260 (pBinPI-IIEC) ke dalam genom tanaman tebu telah berhasil dilakukan oleh Ananda (2004) pada cv. PSJT 94-33 dan cv. BR 194, oleh Nurhasanah (2007) pada cv. PS 851 yang dapat dideteksi dengan PCR pita ukuran 900 bp, serta oleh Susiyanti (2008) pada cv. Triton, cv. PSJT 94-41 dan cv. PA 175 dengan efisiensi regenerasi tebu transforman berturut-turut 30%, 20% dan 30%.
baru setelah tiga minggu penanaman. Namun kalus yang mengalami sub-kultur beberapa kali akan memiliki kemampuan yang rendah.
Fitase
Fitase (myo-inositol heksakisfosfat fosfohidrolase) merupakan suatu fosfomonoesterase yang mampu menghidrolisis asam fitat menjadi monofosfat anorganik dan ester fosfat (Dvorakova 1998). Fosfomonoesterase adalah kelompok enzim yang terdiri dari beragam enzim fosfatase yang mencakup berbagai ukuran, struktur dan mekanisme katalitik. Enzim fosfatase ini dibagi dalam empat kelas, yaitu: histidine acid phosphatase (HAP), β-propeller phytase
(BPP), cysteine phosphatase (CP) dan purple acid phosphatase (PAP) (Mullaney
dan Ullah 2007). The International Union of Pure and Applied Chemistry and the
International Union of Biochemistry (IUPAC–IUB), mengenal dua kelas enzim pendegradasi fitat yang berdasarkan posisi awal hilangnya fosfat (P) dari cincin myo-inositol, yaitu: 3-fitase (EC 3.1.3.8), yang kehilangan P berawal pada posisi D-3, dan 6-fitase (EC 3.1.3.26), yang kehilangan P berawal pada posisi L-6 (D-4). Enzim pendegradasi fitat yang berasal dari mikroorganisme digolongkan ke dalam 3-fitase, sedangkan 6-fitase berasal dari benih tanaman tingkat tinggi (Greiner 2007).
Sumber fitase sangat beragam, mulai dari berbagai jenis mikrob, tanaman, hingga jaringan hewan mamalia. Beberapa jenis tanaman yang sudah diketahui memproduksi fitase diantaranya adalah kacang hijau, kedelai, gandum, padi,
Peranan N, P dan K
Pada tebu, untuk memacu pertumbuhan vegetatif dilakukan dengan pemupukan N yang memadai, sedangkan pertumbuhan generatif dilakukan dengan pemupukan P dan K. Pada fase pertunasan dan pemanjangan batang, tebu harus mendapatkan hara N yang cukup. Hara N berperan dalam
pembelahan sel, sehingga mendukung pertunasan secara horizontal
(terbentuknya anakan) dan pertumbuhan vertikal (pemanjangan batang) (Sudiatso 1980). Menurut Havlin et al. (2005), N merupakan penyusun asam amino yang selanjutnya bergabung membentuk protein dan asam nukleat. Selain membentuk protein, N merupakan bagian integral dari klorofil, yang mengubah cahaya menjadi energi kimia yang diperlukan untuk fotosintesis. Struktur dasar klorofil adalah cincin porfirin, disusun dari 4 cincin pirol, tiap cincin mengandung 1 N dan 4 atom C. Satu atom Mg diikat di tengah dari tiap-tiap cincin porfirin. Bennett (1996) menambahkan bahwa N juga merupakan struktur pokok dari dinding sel. Ketersediaan N yang cukup dihubungkan dengan tingginya aktivitas fotosintesis, pertumbuhan vegetatif yang baik dan daun berwarna hijau tua (Havlin et al. 2005).
Menurut Havlin et al. (2005), seperti N, P diperlukan dalam berbagai proses
penting pertumbuhan tanaman. P terkandung dalam nicotinamide adenine
dinucleotide phosphate (NADP), bagian dari proses fotosintesis (Bennett 1996). Fungsi utama P yaitu dalam menyimpan dan mentransfer energi melalui
senyawa-senyawa adenosine diphosphates (ADP) dan adenosine triphosphates
(ATP) (Bennett 1996; Havlin et al. 2005). P merupakan bagian integral dari sistem reproduksi yaitu sebagai komponen sistem memori genetik dari RNA dan DNA, sehingga P terlibat dalam transfer informasi genetik. P juga berperan dalam transportasi elektron dalam reaksi oksidasi-reduksi (Bennett 1996).
Kalium (K) merupakan aktivator berbagai reaksi enzimatik (Decoteau 2005), lebih dari 60 enzim dalam jaringan meristematik yang berpengaruh pada pemanjangan sel (Bennett 1996). Hardjowigeno (2007) menambahkan bahwa K berperan dalam pembentukan pati, mengaktifkan enzim, mengatur respirasi dan penguapan, mempengaruhi perkembangan akar serta penyerapan unsur-unsur lain, mempertinggi daya tahan terhadap kekeringan dan penyakit. Menurut Bennett (1996), K diperlukan untuk mengokohkan turgor dalam tanaman dan menjaga potensial osmotik sel. Selain itu, K berperan menentukan proses membukanya stomata dan menstabilkan pH di dalam sel. Dengan K yang cukup, dinding sel lebih tebal dan jaringan lebih stabil (Decoteau 2005). Pada sel yang tumbuh normal, K meningkatkan resisten terhadap hama dan penyakit (Bennett 1996).
Keragaman Somaklonal
Skirvin et al. (1993) mendefinisikan keragaman somaklonal sebagai
keragaman genetik tanaman yang dihasilkan melalui kultur jaringan. Keragaman tersebut dapat berasal dari keragaman genetik eksplan yang digunakan atau yang terjadi dalam kultur jaringan. Keragaman somaklonal yang terjadi dalam kultur jaringan merupakan hasil kumulatif dari mutasi genetik pada eksplan dan
yang diinduksi pada kondisi in-vitro. Keragaman somaklonal merupakan
perubahan genetik yang bukan disebabkan oleh segregasi atau rekombinasi gen, seperti yang biasa terjadi akibat proses persilangan.
Keragaman somaklonal yang dihasilkan dari teknik kultur jaringan dalam budidaya tanaman, merupakan suatu bukti bahwa melalui perbanyakan secara vegetatif memungkinkan diperolehnya individu baru yang tidak seperti induknya. Penggunaan zat pengatur tumbuh telah memungkinkan terjadi penyimpangan dari induknya, sekalipun mungkin hanya bersifat epigenetik. Keragaman ini terjadi karena faktor fisiologi, genetik dan biokimia (Jayasankar 2005).
metabolisme karbon yang menyebabkan kurangnya kemampuan fotosintesis (kejadian albino pada padi), biosintesis pati, lintasan karotenoid, metabolisme nitrogen, dan resisten terhadap antibiotik (Jayasankar 2005).
Selain keragaman somaklonal, transformasi gen fitase mempengaruhi
proses fisiologi di dalam tanaman. Menurut Hernandez et al. (2000), perubahan
morfologi/agronomi pada tanaman sereal transgenik dalam kondisi lapang, disebabkan adanya transformasi yang mempengaruhi fisiologi tanaman transgenik. Metodologi yang ada, tidak dapat memberikan kontrol atas jumlah salinan gen yang disisipkan. Hasil dari transformasi, DNA asing dapat disisipkan pada lokasi acak dalam kromosom inang. Akibatnya, tanaman transgenik bebas
membawa cassette sekuen gen asing yang sama, akan berperilaku berbeda
tergantung pada konteks genom mereka dalam genom inang (efek posisi) (Topping et al. 1991).
Keragaman somaklonal dapat dikelompokkan menjadi keragaman yang diwariskan (heritable), yaitu yang dikendalikan secara genetik, dan keragaman yang tidak diwariskan, yakni yang dikendalikan secara epigenetik. Keragaman somaklonal yang dikendalikan secara genetik biasanya bersifat stabil dan dapat diturunkan secara seksual ke generasi selanjutnya. Keragaman epigenetik biasanya akan hilang bila diturunkan secara seksual (Skirvin et al. 1993).
Perubahan genetik yang berhubungan dengan keragaman somaklonal adalah mutasi titik, perubahan karyotype (jumlah kromosom dan struktur),
perubahan cryptic yang berhubungan dengan penyusunan kembali kromosom,
perubahan jumlah kopi, element transposable, pindah silang sel somatik,
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilakukan di Kebun Percobaan PG Djatiroto, Jawa Timur. Untuk analisis, dilakukan di Laboratorium Kesuburan Tanah, Departemen Ilmu
Tanah dan Sumberdaya Lahan Fakultas Pertanian IPB, Laboratorium Indonesian
Center for Biodiversity and Biotechnology (ICBB), dan PT Saraswanti Indo Genetech (SIG) Bogor, yang di mulai pada bulan Nopember 2010 sampai bulan Desember 2011.
Bahan dan Alat
Bahan yang digunakan adalah daun dari klon tebu transgenik IPB 1 dan isogenik, es, aquadest, HClO4, HNO3, NH4 Molibdat, H3BO4, H2SO4 pekat,
Larutan Bray, NaOH 50%, HCl pekat, indicator Conway, Paraffin cair, Na acetat
pH 5, larutan AAM (aseton : 5 N asam sulfur : 10 mM amonium molibdat dengan perbandingan 1:1:2), asam sitrat, asam borax, agarose, ethidium bromida,
kloroform, isoamilalkohol, penol, etanol absolut, etanol 70%, CTAB, mercapto,
RNAse, aquabidest, tris HCl, asam asetat, EDTA, master mix, primer EC1, EC3
dan SYBR green.
Alat-alat yang digunakan: oven, mortal dan pestle, pipet, mikropipet, tabung eppendorf, erlenmeyer, timbangan, hot plate, stirer, termometer, kuvet, autoklaf, sarung tangan, masker, sentrifuse, perangkat elektroforesis, real-time PCR, freezer, spektrofotometer.
Rancangan Percobaan
1) Percobaan pada umur 3 bulan setelah tanam, dilakukan secara deskripsi pada ulangan 1, dengan jumlah sampel 96 (24 klon tebu x 4 aras pemupukan).
2) Percobaan pada umur 6 bulan setelah tanam dirancang berdasarkan rancangan split plot dalam RAK.
- Klon tebu transgenik IPB 1 adalah klon yang berasal dari kultivar PS 851 yang telah mengalami penyisipan gen fitase.
- Klon tebu isogenik adalah klon yang mempunyai latar belakang genetika yang lebih seragam, digunakan untuk memantau perubahan klon tebu transgenik (Hifni dan Kardin 1998).
Pemupukan N dan P terdiri atas 4 aras perlakuan. Aras perlakuan yang dimaksud yaitu: perlakuan a: pemupukan N 50% dan P 50%, perlakuan b: pemupukan N 100% dan P 50%, perlakuan c: pemupukan N 50% dan P 100%, perlakuan d: pemupukan N 100% dan P 100%. Pupuk yang digunakan adalah pupuk ZA, SP 36, dan KCl. Pemupukan normal untuk tanaman tebu adalah 8 ku ZA/ha, 2 ku SP 36/ha, dan 1 ku KCl/ha. Selain pemupukan N dan P, dilakukan juga pemupukan K yang diberikan sesuai dengan rekomendasi. Pupuk ZA 50% dan SP 36 100% dari perlakuan, diberikan pada saat tanam. Kemudian pupuk ZA 50% dari perlakuan dan KCl sesuai rekomendasi diberikan pada saat tanaman berumur 1,5 bulan setelah tanam. Penanaman dilakukan pada minggu kedua bulan Juli tahun 2010 (Surendra 2011, komunikasi pribadi).
Klon tebu transgenik IPB 1 yaitu: A: IPB 1-34, B: IPB 1-56, C: IPB 1-59, D: IPB 6, E: IPB 37, F: IPB 7, G: IPB 3, H: IPB 46, I: IPB 40, J: IPB 1-53, K: IPB 1-36, L: IPB 1-2, M: IPB 1-62, N: IPB 1-12, O: IPB 1-51, P: IPB 1-71, Q: IPB 1-4, R: IPB 1-55, S: IPB 1-1, T: IPB 1-52 U: IPB 1-5, V: IPB 1-17, W: IPB 1-21, X: PS 851 (Lampiran 3). Total kombinasi perlakuan adalah 24 klon tebu (23 klon tebu transgenik IPB 1 dan 1 klon tebu isogenik) x 4 aras pemupukan N dan P = 96 perlakuan. Tiap perlakuan diulang 3 kali sehingga terdapat 288 unit percobaan. Ulangan 1 berada dekat saluran irigasi, kemudian ulangan 2 dan ulangan 3 yang berada dekat saluran drainase (Surendra 2011, komunikasi pribadi). Peubah yang diamati adalah aktivitas fitase. Selain melihat data aktivitas fitase yang diperoleh, juga melihat data kandungan N dan P, kandungan klorofil pada umur 6 bulan (data Nugraha 2012) dan produksi (data Rahmatullah 2012).
rerata peubah kandungan N dan P, kandungan klorofil (rasio rerata klorofil a/b), aktivitas fitase dan produksi dari klon tebu transgenik IPB 1 yang lebih tinggi dari kontrol (PS 851), menjadi klon tebu transgenik yang terseleksi. Klon tebu transgenik IPB 1 terseleksi yang produksi biomassa dan gula yang tinggi, dipilih menjadi klon terbaik tebu transgenik IPB 1.
Model linier aditif untuk rancangan split plot dalam RAK dapat dituliskan sebagai berikut:
i =1,2,3,4 (a) j = 1,2,3,4,…,β4 (b) k=1,2,3 (r)
Yijk : nilai pengamatan pada faktor A taraf ke-i faktor B taraf ke-j dan
ulangan ke- k
: komponen aditif dari rataan
i : pengaruh petak utama A (aras pemupukan N dan P) taraf ke-i
j : pengaruh anak petak B (klon tebu) taraf ke-j
k : pengaruh blok taraf ke-k (blok/kelompok, dalam penelitian ini
disebut dengan ulangan)
()ij : komponen interaksi dari faktor A taraf ke-i dan faktor B taraf ke-j
(α )ik : sisaan petak utama (blok x A)
Tahapan Penelitian
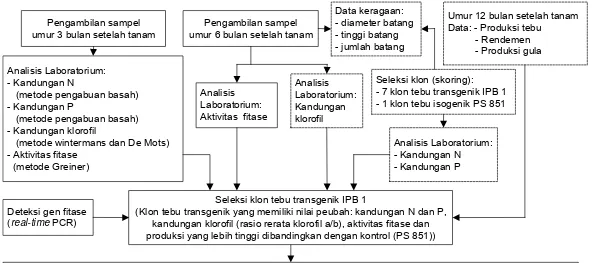
Gambar 1 Diagram alir penelitian, garis putus-putus ( - - - -) merupakan keterkaitan penelitian yang dilakukan secara terpisah
Pengambilan sampel
(metode wintermans dan De Mots) - Aktivitas fitase
(metode Greiner)
Deteksi gen fitase
(real-time PCR)
Seleksi klon (skoring): - 7 klon tebu transgenik IPB 1 - 1 klon tebu isogenik PS 851
Analisis Laboratorium:
Klon terbaik tebu transgenik IPB 1 yang memiliki efisiensi tinggi terhadap penggunaan pupuk N dan P, kandungan klorofil tinggi, aktivitas fitase tinggi dan produksi biomassa dan gula yang tinggi dibandingkan dengan kontrol
Analisis Laboratorium: Kandungan klorofil
Seleksi klon tebu transgenik IPB 1
Pengambilan Sampel
1. Pengambilan sampel daun pada umur 3 bulan setelah tanam dilakukan pada seluruh klon tebu pada ulangan 1 yang berjumlah 96 sampel, untuk memberikan gambaran pertumbuhan awal dengan mengetahui kandungan N, P, klorofil dan aktivitas fitase.
2. Pengambilan sampel pada umur 6 bulan setelah tanam dilakukan pada seluruh klon tebu pada ulangan 1, 2 dan 3. Sampel yang di ambil terdiri atas daun dan meristem yang berjumlah 288 sampel. Daun digunakan untuk pengukuran aktivitas fitase dan meristem digunakan untuk deteksi gen fitase.
Teknik Sampling
Sampel daun tebu transgenik diambil dari Kebun Percobaan PG Djatiroto, Jawa Timur. Daun yang diambil adalah daun ke dua dari bawah dari setiap klon tebu transgenik IPB 1 yang masih berwarna hijau dan belum mengalami klorosis, untuk analisis N dan P. Untuk analisis kandungan klorofil dan aktivitas fitase diambil daun ke tiga dari atas, sedangkan untuk deteksi gen fitase dengan menggunakan meristem pucuk. Sampel diambil ketika tebu transgenik berumur 3 bulan dan 6 bulan setelah tanam.
Daun yang telah dipotong, dibersihkan kemudian dimasukkan ke dalam plastik dan disimpan di dalam kotak pendingin. Untuk analisis kandungan klorofil, aktivitas fitase dan deteksi gen fitase, sampel disimpan di dalam freezer supaya tetap dalam keadaan segar. Daun untuk analisis N dan P, dikeringkan di dalam oven selama 48 jam pada suhu 60oC, kemudian digiling dan disimpan dalam plastik untuk selanjutnya dilakukan analisis.
Analisis Laboratorium
Analisis kandungan N dan P. Analisis kandungan N dan P dilakukan dengan metode Pengabuan Basah yaitu dengan cara sebagai berikut: sampel daun tebu yang telah digiling halus ditimbang sebanyak 0,5 g, dan dimasukkan ke dalam labu didih (labu destruksi). Kemudian ditambahkan H2O2 5 ml dan H2SO4 5 ml (campuran berwarna putih), dipanaskan dengan suhu 230 0C selama ± 1 jam, lalu didinginkan. Selanjutnya, ditambahkan kembali 1 ml H2O2, kemudian
dipanaskan lagi dengan suhu 230 0C selama 30 menit. Setelah dingin, aquadest
digunakan untuk mengukur kandungan hara jaringan tanaman, selain kandungan N dan P, juga K, Ca, Mg, Na dan unsur mikro.
Kandungan N (N total). Kandungan N dianalisis dengan cara sebagai berikut: hasil destruksi dipipet 25 ml ke dalam erlenmeyer, 100 ml aquadest dan 20 ml NaOH (teknis) 50% ditambahkan ke dalam erlenmeyer tersebut, kemudian dilakukan destilasi. Hasil destilasi ditampung dalam erlenmeyer lain yang telah berisi H3BO3 10 ml dan indikator Conway 5 tetes (1 tetes ± 0,05 ml), hingga mencapai volume ± 100 ml (larutan berwarna hijau). Larutan berwarna hijau tersebut dititrasi dengan HCl 0,05 N hingga warna berubah menjadi merah, kemudian dicatat jumlah titrasi (ml) yang digunakan. Selain sampel, juga dibuat blanko dengan prosedur yang sama. Besarnya kandungan N dapat diketahui dengan rumus:
ml HCl (contoh – blanko) x 14 x 1000 Kandungan N (ppm) =
Berat sampel
Kandungan N (ppm) Kandungan N (%) =
10000
Kandungan P (P total). Kandungan P dianalisis dengan cara sebagai
berikut: hasil destruksi dipipet 5 ml ke dalam tabung reaksi, kemudian ditambahkan PB 5 ml dan PC 5 tetes (biru tua). Selain sampel, juga dibuat standar 0 ppm, 1 ppm, 2 ppm, 3 ppm, 4 ppm dan 5 ppm. Kemudian sampel dan standar diukur dengan spektrofotometer dengan panjang gelombang 660 nm. Besarnya kandungan P dapat diketahui dengan rumus:
50 ml 10 ml
Kandungan P (ppm) = x x absorban x rata-rata kurva standar 0,5 2
Kandungan P (ppm) Kandungan P (%) =
Analisis Kandungan Klorofil. Analisis kandungan klorofil dilakukan berdasarkan metode Wintermans dan De Mots (1965), dengan cara sebagai berikut: sampel daun ditimbang 0,1 g, dicuci dengan air mengalir, kemudian dikeringkan dengan menggunakan kertas pengering (tissue) dan dipotong kecil-kecil (kira-kira lebar 2 mm). Daun tersebut ditempatkan dalam mortal, dan ditambah 500 µl borat 10 mM dingin kemudian digerus menggunakan pestle. Hasil gerusan dimasukan dalam tabung eppendorf 1,5 ml, dan disentrifugasi dengan kekuatan relatif 21382 xg selama 10 menit. Supernatannya diambil dan dimasukan dalam eppendorf yang lain. Supernatan tersebut dipindahkan sebanyak 50 µl (tergantung jumlah supernatan yang diperoleh) dalam eppendorf yang lain lagi, kemudian ditambahkan etanol hingga volume mencapai 1000 µl,
kemudian divortek. Campuran supernatan dan etanol diinkubasi pada suhu 4 0C
dalam ruang gelap selama 30 menit, kemudian disentrifugasi dengan kekuatan relatif 9503 xg selama 5 menit. Campuran supernatan tersebut dipindahkan ke
dalam kuvet, kemudian diukur absorbannya dengan menggunakan
spektrofotometer pada panjang gelombang 649 nm dan 665 nm. Etanol 96% digunakan sebagai pembanding. Kandungan klorofil dapat diketahui dengan rumus:
Klorofil a = (13,7 x λ 665) –(5,76 x λ 649) = µg klorofil ml-1
Klorofil b = (β5,8 x λ 649) –(7,60 x λ 665) = µg klorofil ml-1 Rasio klorofil a/b = klorofil a : klorofil b
dengan perbandingan 2:1:1) sebanyak 1,5 ml dan asam sitrat sebanyak 100 µl. Larutan diukur absorbannya dengan menggunakan spektrofotometer pada panjang gelombang 355 nm. Besarnya aktivitas fitase dapat diketahui dengan rumus:
Keterangan:
∆E = Esampel– Eblanko
Esampel = Absorban larutan sampel Volume total = 2000 µl
Eblanko = Absorban larutan tanpa enzim Volume enzim = 50 µl
∑ = 8,7 cm2 µmol-1 (tetapan Greiner) t = 30 menit
Secara visual aktivitas fitase akan membentuk warna kekuningan (yang menunjukan suasana agak asam) pada larutan sampel bila dibandingkan dengan larutan blanko. Hal ini disebabkan adanya aktivitas fitase yang menguraikan fitat dalam larutan sampel. Satu unit aktivitas fitase didefinisikan sebagai ukuran fosfat anorganik yang dapat dibebaskan oleh setiap 1 ml larutan enzim kasar
dalam waktu 30 menit pada suhu 370C.
Deteksi Gen Fitase. Deteksi gen fitase yang telah disisipkan dapat diketahui dengan mengisolasi DNA dan dilanjutkan dengan analisis PCR. Isolasi DNA dilakukan dengan metode CTAB, yaitu dengan cara sebagai berikut:
sampel ditimbang sebanyak 0,1 gram, lalu digerus dalam mortal dengan N2 cair.
Hasil gerusan dimasukan dalam eppendorf yang telah berisi 600 µl buffer CTAB
dan 1,2 µl mercapto. Eppendorf dibolak-balik supaya hasil gerusan tercampur
dengan baik, dan kemudian diinkubasi pada suhu 650C selama 30-60 menit. Setelah inkubasi, eppendorf diletakkan dalam wadah yang berisi es dan ditambahkan ke dalam eppendorf tersebut kloroform dan isoamilalkohol dengan perbandingan 24:1 sebanyak 600 µl. Selanjutnya disentrifugasi dengan kekuatan relatif 9503 xg selama 10 menit pada suhu 4 0C. Supernatan (fase atas) dipindahkan ke dalam eppendorf yang lain. Supernatan tersebut dicampur dengan penol, kloroform, isoamilalkohol, dengan perbandingan (25:24:1) sebanyak 1 kali volume supernatan yang diperoleh. Setelah larutan bercampur
U ∆E Volume total = x
dengan baik, selanjutnya disentrifugasi dengan kekuatan relatif 9503 xg selama 10 menit. Supernatan dipindahkan dalam eppendorf yang lain lagi dan ditambahkan natrium acetat 2M pH 5,2 sebanyak 0,1 kali volume supernatan. Etanol absolut juga ditambahkan sebanyak 2 kali volume supernatan tersebut. Eppendorf dibolak-balik supaya supernatan dan larutan yang ditambahkan bercampur dengan merata. Kemudian disimpan dalam freezer minimal 1 jam. Setelah disimpan di freezer, disentrifugasi dengan kekuatan relatif 9503 xg
selama 30 menit pada suhu 4 0C. Supernatannya dibuang dan peletnya diambil.
Pelet yang diambil, ditambahkan etanol 70% ± 500 µl dan disentrifugasi kembali dengan kekuatan relatif 9503 xg selama 5 menit pada suhu 4 0C. Setelah sentrifugasi, etanol kemudian dibuang, dan peletnya dikeringkan. Setelah pelet
kering, ditambahkan ddH2O sebanyak 20 µl (dilarutkan). Kemudian ditambahkan
RNAse 0,2 kali volume larutan pelet. Larutan pelet tersebut disimpan selama 10 menit pada suhu 37 0C dan 10 menit pada suhu 70 0C, selanjutnya disimpan dalam freezer. Untuk mengetahui kuantitas dan kualitas DNA yang diperoleh, dilakukan pengukuran spektrofotometer pada panjang gelombang 260 nm dan 280 nm serta elektroforesis pada gel agarose 1%.
Menurut Santosa et al. (2004), analisis PCR dilakukan untuk mengetahui integrasi gen pada tanaman dengan menggunakan primer spesifik untuk gen
fitase. Primer tersebut adalah EC1: 5’CA GGC TCT ATC CGC TAA TCG-3’ dan
EC3: 5’-GG CGC GGT GGG GCA ATA ATC-3’ (Greiner, tidak dipublikasikan). Prinsip metode yang digunakan adalah mengamplifikasi fagmen DNA yang telah
diisolasi dengan menggunakan real-time PCR. Program termal untuk setiap
reaksi diatur sebagai berikut: pra PCR pada 950C selama 5 menit, denaturasi pada 95oC selama 30 detik, annealing pada 55oC selama 40 detik dan
pemanjangan pada 72oC selama 50 detik. Jumlah setiap campuran reaksi adalah
HASIL DAN PEMBAHASAN
Tanaman Berumur 3 Bulan setelah Tanam
Kandungan N
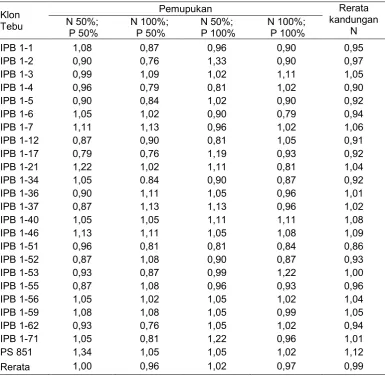
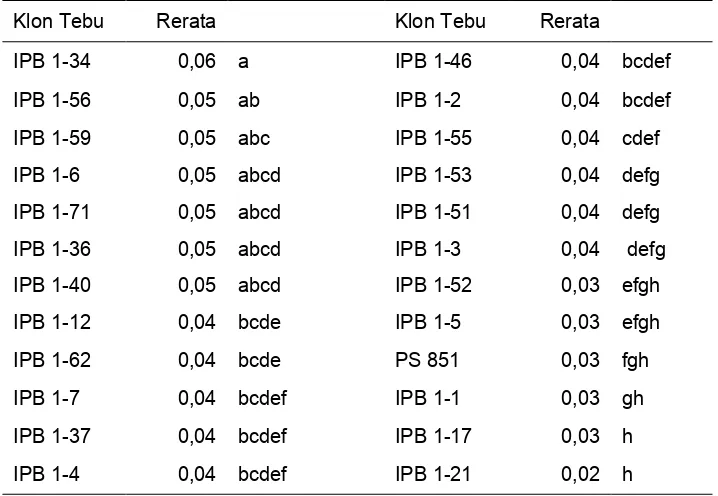
Kandungan N pada klon tebu transgenik IPB 1 berkisar antara 0,76%-1,33%, sedangkan klon tebu isogenik PS 851 berkisar antara 1,02%-1,34%. Rerata kandungan N pada klon tebu isogenik PS 851 lebih tinggi dari klon tebu transgenik. Rerata kandungan N tertinggi berturut-turut, yaitu klon PS 851, klon IPB 1-46, IPB 1-40, IPB 1-7, IPB 1-3, IPB 1-59, IPB 1-56, IPB 1-21 dan IPB 1-37 (Tabel 1).
Tabel 1 Kandungan N (%) pada umur 3 bulan setelah tanam
pada klon tebu transgenik IPB 1 diduga karena transformasi gen fitase terjadi secara acak pada kalus tebu. Menurut Topping et al. (1991), hasil dari transformasi, DNA asing dapat disisipkan pada lokasi acak dalam kromosom
inang. Akibatnya, tanaman transgenik bebas membawa cassette sekuen gen
asing yang sama akan berperilaku berbeda, tergantung pada konteks genom mereka dalam genom inang (efek posisi). Bhat dan Srinivasan (2002) menjelaskan bahwa proses transformasi genetik yang disertai dengan keragaman somaklonal dapat memberikan kontribusi perbedaan antara tanaman transgenik. Besar dan jenis keragaman yang muncul tidak dapat diprediksi dan tidak dapat dikontrol dengan baik.
Respon klon tebu dalam bentuk kandungan N terhadap pemupukan, tertinggi pada pemupukan N 50% dan P 100%, kemudian N 50% dan P 50%, N 100% dan P 100%, serta pemupukan N 100% dan P 50%. Kandungan N pada pemupukan tersebut, berturut-turut 1,02%, 1,00%, 0,97% dan 0,96% (Tabel 1). Kandungan N ini masih rendah, jika dibandingkan dengan kandungan N optimum pada daun tebu, yang berkisar antara 2,0%-2,6% (Lampiran 4). Rendahnya kandungan N ini, diduga karena faktor lingkungan. Menurut Schulze et al. (2005) pertumbuhan bergantung secara linier terhadap N tersedia pada kisaran yang luas. Kisaran N yang luas ini, menyebabkan respon tanaman menjadi terpenuhi. Namun faktor lingkungan menjadi pembatas tersedianya N untuk tanaman. Pate (1973), juga menjelaskan bahwa penyerapan N sangat bervariasi dengan umur dan nutrisi tanaman serta kondisi lingkungan dimana tanaman tersebut tumbuh.
Tanaman menyerap N dalam dua bentuk, yaitu dalam bentuk nitrat (NO3-)
dan ammonium (NH4+). Pada tanah yang basah, kering, aerasi yang baik, NO3 -dalam larutan tanah umumnya lebih tinggi daripada NH4+. Keduanya bergerak menuju perakaran tanaman melalui aliran massa dan difusi. NH4+ diserap tanaman dengan baik pada pH netral dan menurun dengan meningkatnya
keasaman. Penyerapan NH4+ mengakibatkan pH rhizosfer menurun, yang
NH4+ atau NO3- ditentukan oleh jenis dan umur tanaman, lingkungan dan faktor-faktor lainnya. Serealia, jagung, gula bit, nanas, padi dan gandum menggunakan kedua bentuk N tersebut (Havlin et al. 2005).
Kandungan P
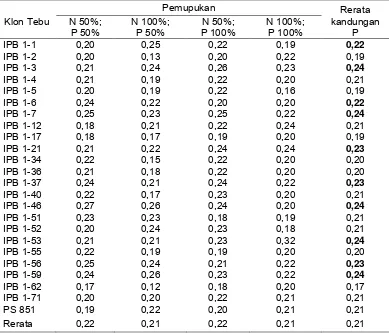
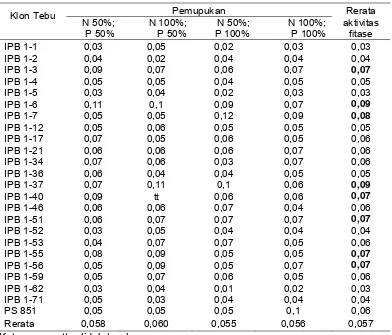
Respon klon tebu transgenik IPB 1 terhadap pemupukan dalam bentuk kandungan P, menunjukan adanya perbedaan antara klon tebu transgenik dan klon tebu isogenik PS 851 yang diuji. Rerata kandungan P pada klon tebu transgenik berkisar antara 0,17%-0,24%. Rerata kandungan P pada beberapa klon tebu transgenik mencapai kandungan P optimum, yang berkisar antara 0,22%-0,30% (Lampiran 4). Klon tebu transgenik yang mempunyai kandungan P optimum, juga merupakan klon tebu transgenik yang mempunyai kandungan P lebih tinggi dibandingkan dengan klon tebu isogenik PS 851. Klon tebu transgenik tersebut, yaitu: IPB 3, IPB 7, IPB 46, IPB 53, IPB 59, IPB 1-21, IPB 1-37, IPB 1-56, IPB 1-1 dan IPB 1-6 (Tabel 2).
Tabel 2 Kandungan P (%) pada umur 3 bulan setelah tanam
Kandungan P yang berbeda pada masing-masing klon tebu transgenik (Tabel 2), diduga selain karena proses transformasi genetik dan variasi somaklonal, juga karena kondisi rhizosfer yang berbeda dari setiap klon tebu transgenik tersebut. Menurut Miller et al. (1989), setiap jenis tanaman memiliki komposisi eksudat dan mikroflora yang berbeda pada rhizosfernya. Besarnya kehilangan C dari akar atau rhizodeposition dapat mengakibatkan perubahan
dalam struktur komunitas mikrob rhizosfer (De Leij et al. 1993). Ini
mengindikasikan bahwa fitase yang dikeluarkan oleh akar menjadi penting untuk menghidrolisis fitat di dalam tanah. Peningkatan sekresi fitase oleh akar tanaman memberikan kontribusi perolehan P anorganik yang dihidrolisis dari P organik di rhizosfer (Li et al. 1997). Reaksi enzim bergantung pada temperatur (Dick dan Tabatabai 1986), dan Ghareib (1990) melaporkan bahwa aktivitas fitase hilang
sekitar 68% bila dipanaskan pada 45 0C selama 60 menit.
Respon klon tebu dalam bentuk kandungan P terhadap pemupukan, tertinggi pada pemupukan N 50% dan P 50% dengan rerata kandungan P yang sama pada pemupukan N 50% dan P 100% yaitu 0,22%. Kemudian pemupukan N 100% dan P 50% dengan rerata kandungan P yang sama pada pemupukan N 100% dan P 100% yaitu 0,21% (Tabel 2). Jika dibandingkan dengan kandungan P optimum pada daun tebu, 0,22%-0,30% (Lampiran 4), maka rerata kandungan P pada setiap aras pemupukan berada pada batas terendah kandungan P optimum. Hasil analisis tanah (Lampiran 1) menunjukkan bahwa P tersedia tanah sangat tinggi (160,35 ppm), diduga karena terjadi fiksasi P sehingga menyebabkan P menjadi kurang tersedia bagi tanaman.
Havlin et al. (2005), mengatakan bahwa fiksasi P tergantung pada
beberapa faktor, terutama pH tanah. Pada tanah masam, P anorganik difiksasi oleh Fe dan Al membentuk Fe/Al-P, atau dijerap oleh permukaan oksida Fe/Al dan mineral-mineral liat. Pada tanah netral dan basa, P anorganik difiksasi oleh Ca dan Mg membentuk Ca-P dan Mg-P pada tanah yang kandungan Mg-nya
tinggi atau dijerap oleh permukaan mineral-mineral liat dan CaCO3. Schachtman
(1998) menjelaskan bahwa tanaman pada umumnya menyerap P tanah dalam bentuk P anorganik. Namun, 50% sampai 80% dari total P pada tanah pertanian berada sebagai fosfat organik, di mana 60% sampai 80% adalah myo inositol heksakisfosfat (fitat) (Turner et al. 2002).
tergantung pada pH tanah. Pada tanah dengan pH < 7,2, H2PO4- < HPO4 2-(Havlin et al. 2005), sehingga dapat diketahui klon tebu dalam penelitian ini lebih banyak menyerap P dalam bentuk H2PO4-. Selanjutnya Havlin et al. (2005) menjelaskan, bahwa konsentrasi P dikontrol oleh kelarutan mineral P. Umumnya mineral P pada tanah masam adalah mineral Al-P dan Fe-P. Kelarutan mineral mewakili konsentrasi ion yang dipertahankan dalam larutan tanah oleh mineral tertentu. Tiap-tiap mineral P akan mendukung konsentrasi ion tertentu yang tergantung pada produk kelarutan mineral. Sebagai contoh, FePO4.2H2O akan larut menurut:
Konsentrasi H2PO4- menurun dengan penyerapan P oleh tanaman, strengit
(FePO4.2H2O) larut/menyediakan kembali atau mempertahankan konsentrasi
larutan H2PO4-. Reaksi strengit ini, juga menunjukan bahwa konsentrasi H+ meningkat, pH tanah menurun, dengan berkurangnya H2PO4-. Greaves dan Webley (1969) juga melaporkan bahwa laju hidrolisis fitat di dalam tanah, sangat diatur oleh daya larutnya. Ini disebabkan senyawa fitat lebih resisten terhadap serangan enzim. Sebagai contoh, garam besi dan alumunium dari asam fitat sangat resisten terhadap hidrolisis mikroorganisme tanah. Selanjutnya Greiner et al. (1998) menjelaskan, dari analisis diketahui bahwa Fe3+, Hg2+, Cu2+ dan Zn2+ menunjukkan pengaruh penghambatan yang kuat. Aktivitas fitase berkurang
dengan kehadiran Fe2+ dan Fe3+ yang menyebabkan rendahnya konsentrasi fitat
karena pengendapan Fe-fitat.
Kandungan Klorofil
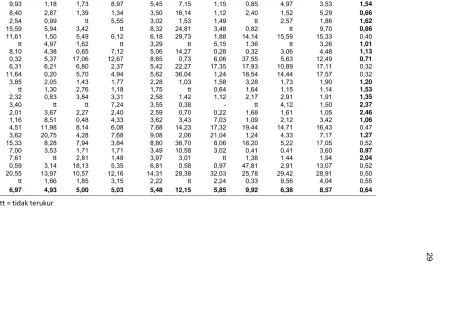
Rerata rasio klorofil a/b klon tebu transgenik berkisar antara 0,32-2,46, dengan rerata rasio klorofil a/b klon tebu isogenik PS 851 0,55 (Tabel 3). Rasio klorofil a/b ini dapat berubah, seiring dengan berubahnya kandungan klorofil a dan klorofil b. Perubahan kandungan klorofil disebabkan oleh faktor lingkungan yang mempengaruhinya. Menurut Dwijoseputro (1980) pembentukan klorofil dipengaruhi oleh beberapa faktor, diantaranya: faktor pembawaan, cahaya, oksigen, karbohidrat, nitrogen, magnesium, besi, air dan suhu. Lichtenthaler et
al. (2007) melaporkan pengaruh cahaya matahari pada daun yang tidak
ternaungi dan daun yang ternaungi. Pada daun yang tidak ternaungi (menerima cahaya matahari langsung), memiliki luas daun yang lebih kecil, kandungan air
yang lebih rendah, kandungan total klorofil dan total karotenoid lebih tinggi per unit daun, dan juga memiliki rasio klorofil a/b lebih tinggi dibandingkan dengan daun yang ternaungi.
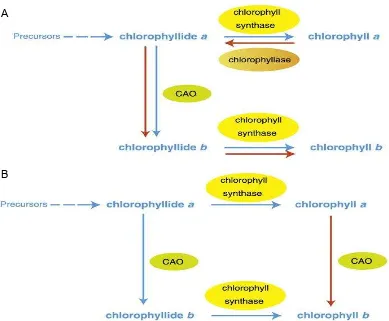
Klorofil merupakan molekul organik yang kompleks. Struktur dasar klorofil a dan b adalah seperti porfirin, terdiri dari empat cincin pirol dengan atom Mg ditengahnya. Rumus empiris klorofil a dan b adalah C55H72O5N4Mg dan C55H70O6N4Mg. Perbedaan kedua rumus tersebut terletak pada cincin ketiga, dimana pada posisi tersebut klorofil a memiliki satu gugus metil (-CH3) sedangkan klorofil b memiliki gugus aldehid (-CHO) (Cooper 2000). Klorofil a merupakan pusat reaksi dalam fotosistem, dimana terjadi reaksi kimiawi pertama fotosintesis yang digerakkan oleh cahaya. Klorofil b bersama-sama dengan klorofil a dan molekul karotenoid, membentuk kumpulan yang tersusun dalam fotosistem, yang dikenal sebagai kompleks antena. Jumlah dan keragaman molekul pigmen, membuat fotosistem dapat mengumpulkan cahaya pada permukaan yang lebih luas, dan spektrum yang lebih lebar (Campbell 2002).
Pada Tabel 3 dapat dilihat bahwa rerata kandungan klorofil b (12,15 µg/ml, 5,85 µg/ml, 9,92 µg/ml, 6,38 µg/ml) lebih tinggi dari kandungan klorofil a (6,97 µg/ml, 4,93 µg/ml, 5,00 µg/ml,5,03 µg/ml) pada setiap perlakuan pemupukan. Ini diduga pada setiap daun yang dianalisis masing-masing memiliki mekanisme perubahan kandungan klorofil. Menurut Sakuraba et al. (2009), klorofil b adalah salah satu dari pigmen fotosintesis tanaman utama. Biosintesis klorofil b adalah penting bagi tanaman dalam rangka untuk menyesuaikan diri terhadap perubahan kondisi lingkungan.
Menurut Tanaka et al. (2001), efisiensi pemanenan cahaya dari fotosistem
sebagian besar tergantung pada ukuran antena fotosintetiknya. Ukuran antena
dikendalikan oleh biosintesis klorofil b. Dalam penelitiannya yang
mengekspresikan enzim untuk biosintesis klorofil b, chlorophyllide a oksigenase
(CAO), dalam Arabidopsis thaliana dengan transformasi cDNA tanaman untuk CAO, di bawah kontrol promotor 35S virus mosaik kembang kol. Pada tahap awal pertumbuhan tanaman disimpan pada tempat yang gelap, ketika ekspresi CAO sangat rendah, rasio klorofil a/b menurun drastis dari 28 menjadi 7,3. Ini menunjukan terjadi peningkatan biosintesis klorofil b. Secara khusus,
meningkatnya klorofil b mengakibatkan akumulasi LHC (Light-Harvesting
Complexes) (Tanaka et al. 2001; Tanaka R dan Tanaka A 2005; Hirashima et al.
Klon Tebu
Kandungan Klorofil a (µg/ml) Rerata
kandungan klorofil a
Kandungan Klorofil b (µg/ml) Rerata
kandungan
Tabel 3 Kandungan klorofil (µg/ml) pada umur 3 bulan setelah tanam
Keterangan: tt = tidak terukur