Lampiran 2.Gambartumbuhan landoyung
Tumbuhan landoyung
landoyung
Simplisia kulit batang landoyung
Lampiran 4.Bagan penelitian
1. Pembuatan serbuk simplisia, karakterisasi, skrining fitokimia, dan ekstraksi
Serbuk simplisia Kulit batang landoyung
Simplisia
Dicuci,ditiriskan, dipotong menjadi bagian kecil dan ditimbang sebagai berat basah
Dikeringkan dalam lemari pengering
Dihaluskan
Karakterisasi simplisia meliputi pemeriksaan: - makroskopik
- kadar air
- kadar sari larut air - kadar sari larut etanol - kadar abu total - kadar abu tidak larut
asam Skrining fitokimiameliputi pemeriksaan: - alkaloid - glikosida - saponin - flavonoid - tanin - triterpenoid/steroid
Ditimbang 500 g
Dimaserasi dengan 75 bagian etanol 80%, dibiarkan selama 5 hari, sesekali diaduk Disaring
Maserat I Ampas
Dicuci dengan etanol 80% 25 bagian, dibiarkan selama 2 hari
Disaring
Maserat II
Digabung dan dienaptuang
Diuapkan dengan rotary evaporator
2. Bagan uji aktivitas antioksidan
Larutan induk EEKBL (1000µg/mL)
Masing-masing dipipet 0,25; 0,50; 0,75; dan 1,00 mL
Dimasukkan ke dalam labu ukur 25 mL, ditambahkan 5 mL larutan DPPH (200 µg/mL) ke dalam labu tentukur
Dicukupkan volumenya dengan metanol sampai garis tanda
Larutan uji 10, 20, 30, dan 40 µg/mL
Didiamkan 60 menit Diukur serapannya dengan spektrofotometer UV-vis Dihitung IC50
Lampiran 5.Perhitungan pemeriksaan karakteristik serbuk simplisia kulitbatang landoyung
1. Perhitungan kadar air serbuk simplisia dan ekstrak etanol kulitbatang landoyung
% Kadar air simplisia = x100% (g) sampel berat (ml) air volume
No. Berat sampel (g) Volume awal
(mL) Volume akhir (mL)
1. 5,00 1,9 2,2
2. 5,00 2,2 2,5
3. 5,00 2,5 2,7
1. Kadar air = 2,2 – 1,9
5,00
×
100% = 6%2. Kadar air = 2,5 – 2,2
5,00
×
100% = 6%3. Kadar air = 2,7 – 2,5
5,00
×
100% = 4%% Rata-rata kadar air = 6% + 6% + 4%
3 = 5,33%
% Kadar air ekstrak = x100%
(g) sampel berat (ml) air volume
No. Berat sampel (g) Volume awal
(mL) Volume akhir (mL)
1. 5,00 1,9 2,4
2. 5,00 2,4 2,8
3. 5,00 2,8 3,3
1. Kadar air
=
2,4 – 1,95,00
×
100% = 10%2. Kadar air = 2,8 – 2,4
5,00
×
100% = 8%3. Kadar air = 3,3 – 2,8
% Rata-rata kadar air = 10% + 8% + 10%
3 = 9,33%
2. Perhitungan kadar sari larut dalam air - Simplisia
% Kadar sari larut dalam air = x 100% 20 100 x (g) sampel Berat (g) sari Berat
No. Berat sampel (g) Berat sari (g)
1. 5,00 0,10
2. 5,00 0,10
3. 5,00 0,08
1. Kadar sari larut dalam air = 0,10
5,00
×
10020
×
100% = 10%2. Kadar sari larut dalam air = 0,10
5,00
×
10020
×
100%= 10%3. Kadar sari larut dalam air = 0,08
5,00
×
10020
×
100% = 8%% Rata-rata kadar sari larut air = 10% + 10% + 8%
3 = 9,33%
- Ekstrak
% Kadar sari larut dalam air = x 100% 20 100 x (g) sampel Berat (g) sari Berat
1. Kadar sari larut dalam air = 0,30
5,00
×
10020
×
100% = 30%2. Kadar sari larut dalam air = 0,25
5,00
×
10020
×
100%= 25%No. Berat sampel (g) Berat sari (g)
1. 5,00 0,30
2. 5,00 0,25
Lampiran 5 (Lanjutan)
3. Kadar sari larut dalam air = 0,25
5,00
×
10020
×
100% = 25%% Rata-rata kadar sari larut air = 30% + 25% + 25%
3 = 26,66 %
3. Perhitungan kadar sari simplisia larut dalam etanol - Simplisia
% Kadar sari larut dalam etanol = x 100% 20 100 x (g) simplisia Berat (g) sari Berat
No. Berat sampel (g) Berat sari (g)
1. 5,00 0,10
2. 5,00 0,07
3. 5,00 0,08
1. Kadar sari larut dalam etanol
=
0,105,00
×
10020
×
100%= 10%2. Kadar sari larut dalam etanol = 0,07
5,00
×
10020
×
100%= 7%3. Kadar sari larut dalam etanol = 0,08
5,00
×
10020
×
100%= 8%% Rata-rata kadar sari larut etanol =10% + 7% + 8%
3 = 8,33%
- Ekstrak
% Kadar sari larut dalam etanol = x 100% 20 100 x (g) ekstrak Berat (g) sari Berat
No. Berat sampel (g) Berat sari (g)
1. 5,00 0,30
2. 5,00 0,30
3. 5,00 0,27
1. Kadar sari larut dalam etanol = 0,30
5,00
×
10020
×
100%= 30%2. Kadar sari larut dalam etanol = 0,30
5,00
×
1003. Kadar sari larut dalam etanol = 0,27
5,00
×
10020
×
100%= 27%% Rata-rata kadar sari larut etanol =30% + 30% + 27%
3 = 29%
4. Perhitungan kadar abu total simplisia - Simplisia
% Kadar abu total = x 100% (g) simplisia Berat (g) abu Berat
No. Berat sampel (g) Berat abu (g)
1. 2,02 0,05
2. 2,05 0,05
3. 2,02 0,06
1. Kadar abu total = 0,05
2,02
×
100% = 2,47%2. Kadar abu total =0,05
2,05
×
100% = 2,43%3. Kadar abu total = 0,06
2,02
×
100% = 2,62%% Rata-rata kadar abu total = 2,47% + 2,43% + 2,97%
3 = 2,62%
- Ekstrak
% Kadar abu total = x 100% (g) ekstrak Berat (g) abu Berat No. Berat sampel (g) Berat abu (g)
1. 2,02 0,05
2. 2,05 0,05
3. 2,02 0,06
1. Kadar abu total = 0,05
2,02
×
100% = 2,47%2. Kadar abu total = 0,05
Lampiran 5 (Lanjutan)
3. Kadar abu total = 0,06
2,02
×
100% = 2,62%% Rata-rata kadar abu total = 2,47% + 2,43% + 2,97%
3 = 2,62%
5. Perhitungan kadar abu simplisia tidak larut dalam asam - Simplisia
% Kadar abu tidak larut dalam asam = x 100% (g)
simplisia Berat
(g) abu Berat
No. Berat sampel (g) Berat abu (g)
1. 2,02 0,01
2. 2,05 0,02
3. 2,02 0,01
1. Kadar abu tidak larut dalam asam = 0,01
2,02
×
100% = 0,49%2. Kadar abu tidak larut dalam asam = 0,02
2,05
×
100% = 0,97%3. Kadar abu tidak larut dalam asam = 0,01
2,02
×
100% = 0,49%% Rata-rata kadar abu tidak larut asam = 0,49% + 0,97% + 0,49%
3 = 0,65%
- Ekstrak
% Kadar abu tidak larut dalam asam = x 100% (g)
ekstrak Berat
(g) abu Berat
No. Berat sampel (g) Berat abu (g)
1. 2,10 0,01
2. 2,07 0,01
3. 2,05 0,01
1. Kadar abu tidak larut dalam asam
=
0,012,10
×
100% = 0,47%2. Kadar abu tidak larut dalam asam = 0,01
3. Kadar abu tidak larut dalam asam = 0,01
2,05
×
100% = 0,48%% Rata-rata kadar abu tidak larut asam = 0,47% + 0,48% + 0,48%
Lampiran 6. Hasil pengukuran operating time
Menit ke- Absorbansi 41 0,6945 42 0,6925 43 0,6904 44 0,6885 45 0,6870 46 0,6856 47 0,6848 48 0,6834 49 0,6821 50 0,6802 51 0,6791 52 0,6777 53 0,6769 54 0,6757 55 0,6743 56 0,6727 57 0,6718 58 0,6710 59 0,6707 60 0,6695 61 0,6683 62 0,6679 63 0,6665 64 0,6655 65 0,6646 66 0,6641 67 0,6627 68 0,6613 69 0,6608 70 0,6595 71 0,6592 72 0,6580 73 0,6573 74 0,6569 75 0,6559 76 0,6550 77 0,6541 78 0,6537 79 0,6497 80 0,6479 Menit ke- Absorbansi
a. Perhitungan persen peredaman EEKBL 1. Tabel data absorbansi DPPH pengukuran I
No. Konsentrasi Larutan Uji (µg/mL)
Absorbansi
1. 0 0,95778
2. 10 0,76460
3. 20 0,60564
4. 30 0,47903
5. 40 0,37721
Aktivitas Peredaman (%) = x 100% kontrol A sampel A -kontrol A
Keterangan : Akontrol = Absorbansi tidak mengandung sampel
Asampel = Absorbansi sampel
Perhitungan % peredaman EEKBL (pengukuran I) - Konsentrasi 10 µg/mL
% Peredaman= x 100%
kontrol A sampel A -kontrol A
% Peredaman= x 100%
0,95778 0,76460 0,95778−
= 20,17% - Konsentrasi 20 µg/mL
% Peredaman= x 100%
kontrol A sampel A -kontrol A
% Peredaman= x 100%
0,95778 0,60564 0,95778−
= 36,76% - Konsentrasi 30 µg/mL
% Peredaman= x 100%
kontrol A sampel A -kontrol A
% Peredaman= x 100%
0,95778 0,47903 0,95778−
Lampiran 7(Lanjutan) - Konsentrasi 40 µg/mL
% Peredaman= x 100%
kontrol A sampel A -kontrol A
% Peredaman= x 100%
0,95778 0,37721 0,95778−
= 60,62%
2. Tabel data absorbansi DPPH pengukuran II
No. Konsentrasi Larutan Uji (µg/mL) Absorbansi
1. 0 0,95760
2. 10 0,77797
3. 20 0,60616
4. 30 0,47673
5. 40 0,37494
Aktivitas Peredaman (%) = x 100% kontrol A sampel A -kontrol A
Keterangan : Akontrol = Absorbansi tidak mengandung sampel
Asampel = Absorbansi sampel
Perhitungan % peredaman EEKBL pengukuran II - Konsentrasi 10 µg/mL
% Peredaman= x 100%
kontrol A sampel A -kontrol A
% Peredaman= x 100%
0,95760 0,77797
0,95760− = 18,76%
- Konsentrasi 20 µg/mL
% Peredaman= x 100%
kontrol A sampel A -kontrol A
% Peredaman= x 100%
0,95760 0,60616
- Konsentrasi 30 µg/mL
% Peredaman = x 100%
kontrol A sampel A -kontrol A
% Peredaman= x 100%
0,95760 0,47673 0,95760−
= 50,22% - Konsentrasi 40 µg/mL
% Peredaman = x 100%
kontrol A sampel A -kontrol A
% Peredaman = x 100%
0,95760 0,37494 0,95760−
= 60,84% 3. Tabel data absorbansi DPPH pengukuran III
No. Konsentrasi Larutan Uji (µg/mL) Absorbansi
1. 0 0,95731
2. 10 0,77052
3. 20 0,61626
4. 30 0,46533
5. 40 0,38319
Aktivitas Peredaman (%) = x 100% kontrol A sampel A -kontrol A
Keterangan : Akontrol = Absorbansi tidak mengandung sampel
Asampel = Absorbansi sampel
Perhitungan % peredaman EEKBL pengukuran III - Konsentrasi 10 µg/mL
% Peredaman= x 100%
kontrol A sampel A -kontrol A
% Peredaman= x 100%
0,95731 0,77052
0,95731− = 19,51%
- Konsentrasi 20 µg/mL
% Peredaman= x 100%
Lampiran 7(Lanjutan)
% Peredaman= x 100%
0,95731 0,61626
0,95731− = 35,63%
- Konsentrasi 30 µg/mL
% Peredaman = x 100%
kontrol A sampel A -kontrol A
% Peredaman= x 100%
0,95731 0,46533 0,95731−
= 51,39%
- Konsentrasi 40 µg/mL
% Peredaman = x 100%
kontrol A sampel A -kontrol A
% Peredaman = x 100%
0,95731 0,38319
0,95731− = 59,97%
b. Perhitungan persen peredaman Vitamin C 1. Tabel data absorbansi DPPH pengukuran I
No. Konsentrasi Larutan Uji
(µg/mL) Absorbansi
1. 0 0,95990
2. 2 0,77063
3. 4 0,51370
4. 6 0,48529
5. 8 0,12027
Aktivitas Peredaman (%) = x 100% kontrol A sampel A -kontrol A
Keterangan : Akontrol = Absorbansi tidak mengandung sampel
Asampel = Absorbansi sampel
Perhitungan % peredamanvitamin C (pengukuran I) - Konsentrasi 2 µg/mL
% Peredaman= x 100%
kontrol A sampel A -kontrol A
% Peredaman = x 100%
0,95990 0,77063
- Konsentrasi 4 µg/mL
% Peredaman= x 100%
kontrol A sampel A -kontrol A
% Peredaman = x 100%
0,95990 0,51370 0,95990−
= 46,48% - Konsentrasi 6 µg/mL
% Peredaman = x 100%
kontrol A sampel A -kontrol A
% Peredaman = x 100%
0,95990 0,48529 0,95990−
= 49,44% - Konsentrasi 8 µg/mL
% Peredaman = x 100%
kontrol A sampel A -kontrol A
% Peredaman = x 100%
0,95990 0,12027 0,95990−
= 87,47%
2.Tabel data absorbansi DPPH pengukuran II
No. Konsentrasi Larutan Uji
(µg/mL) Absorbansi
1. 0 0,96678
2. 2 0,76593
3. 4 0,51427
4. 6 0,48151
5. 8 0,11708
Aktivitas Peredaman (%) = x 100%
kontrol A sampel A -kontrol A
Keterangan : Akontrol = Absorbansi tidak mengandung sampel
Asampel = Absorbansi sampel
Perhitungan % peredaman vitamin C(pengukuran II) - Konsentrasi 2 µg/mL
% Peredaman= x 100%
Lampiran 7(Lanjutan)
% Peredaman = x 100%
0,96678 0,76593
-0,96678
= 20,77% - Konsentrasi 4 µg/mL
% Peredaman= x 100%
kontrol A sampel A -kontrol A
% Peredaman = x 100%
0,96678 0,51427
-0,96678
=46,81% - Konsentrasi 6 µg/mL
% Peredaman = x 100%
kontrol A sampel A -kontrol A
% Peredaman = x 100%
19418 , 1 0,48151 0,96678 = 50,19% - Konsentrasi 8 µg/mL
% Peredaman = x 100%
kontrol A sampel A -kontrol A
% Peredaman =
x
100%
0,96678
0,11708
-0,96678
= 87,89% 3. Tabel data absorbansi DPPH pengukuran III
No. Konsentrasi Larutan Uji
(µg/mL) Absorbansi
1. 0 0,96942
2. 2 0,76459
3. 4 0,51279
4. 6 0,48207
5. 8 0,11658
Aktivitas Peredaman (%) = x 100%
kontrol A sampel A -kontrol A
Keterangan : Akontrol = Absorbansi tidak mengandung sampel
Perhitungan % peredaman vitamin C(pengukuran II) - Konsentrasi 2 µg/mL
% Peredaman= x 100%
kontrol A sampel A -kontrol A
% Peredaman = x 100%
0,96942 0,76459
-0,96942
= 21,13% - Konsentrasi 4 µg/mL
% Peredaman= x 100%
kontrol A sampel A -kontrol A
% Peredaman = x 100%
0,96942 0,51279
-0,96942
= 47,10% Konsentrasi 6 µg/mL
% Peredaman = x 100%
kontrol A sampel A -kontrol A
% Peredaman = x 100%
0,96942 0,48207
-0,96942
= 50,27% - Konsentrasi 8 µg/mL
% Peredaman = x 100%
kontrol A sampel A -kontrol A
% Peredaman = x 100%
0,96942 0,11658
-0,96942
Lampiran 8. Hasil uji aktivitas antioksidan EEKBL
1. Tabel hasil uji aktivitas antioksidan EEKBL Larutan
uji
Konsentrasi (µg/mL)
Absorbansi % Peredaman
I II III I II III Rata-rata
EEKBL
0 0,95778 0,95760 0,95731 0,00 0,00 0,00 0,00 10 0,76460 0,77797 0,77052 20,17 18,76 19,51 19,48 20 0,60564 0,60616 0,61626 36,76 36,70 35,63 36,36 30 0,47903 0,47673 0,46533 49,98 50,22 51,39 50,53 40 0,37721 0,37494 0,38319 60,62 60,84 59,97 60,48
2. Perhitungan nilai IC50
Tabel IC50 dari EEKBL
X Y XY X2
0,00 0,00 0,00 0,00
10,00 19,48 194,80 100,00
20,00 36,36 727,20 400,00
30,00 50,53 1515,90 900,00
40,00 60,48 2419,20 1600,00
ΣX = 100 X = 20
ΣY = 166,85 Y = 33,37
ΣXY = 4857,10 ΣX2
= 3000,00
Keterangan: X = Konsentrasi (µg/mL) Y = % Peredaman
a = n / X) ( ) X ( n / Y) X)( ( -XY) ( 2 2 − ∑
∑ ∑ ∑ ∑ 1,5201 1000 1520,1 5 / ) 100 ( ) 3000 ( 5 / ) 85 , 166 )( 100 ( ) 4857,10 ( 2 = = − − =
b = Y−aX
Jadi, persamaan garis untukmendapatkan IC50adalah Y = 1,5201X + 2,968
Nilai IC50 = > Y = 0,24656 X + 2,968
Lampiran 9.Hasil uji aktivitas antioksidan vitamin C
1. Tabel hasil uji aktivitas antioksidan vitamin C Larutan
Uji
Konsentrasi (ppm)
Absorbansi % Peredaman
I II III I II III
Rata-rata
Vitamin C
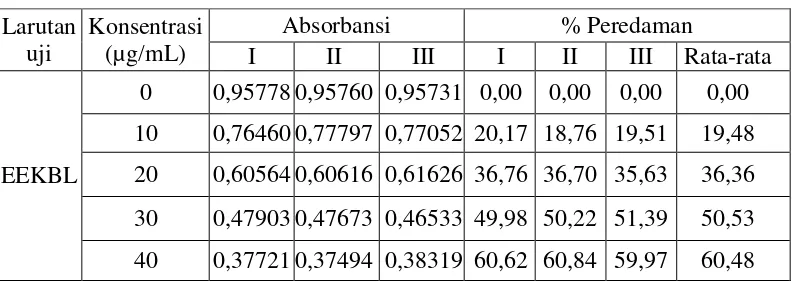
0 0,95990 0,96678 0,96942 0,00 0,00 0,00 0,00 2 0,77063 0,76593 0,76459 19,72 20,77 20,54 20,54 4 0,51370 0,51427 0,51279 46,48 46,81 46,79 46,79 6 0,48529 0,48151 0,48207 49,44 50,19 49,97 49,97 8 0,12027 0,11708 0,11658 87,47 87,89 87,78 87,78 2. Perhitungan nilai IC50
Tabel IC50 dari Vitamin C
X Y XY X2
0 0,00 0,00 0,00
2 20,54 41,08 4,00
4 46,79 187,16 16,00
6 49,97 299,82 36,00
8 87,78 702,24 64,00
ΣX = 20 X = 4
ΣY = 205,08
Y = 41,016 ΣXY = 1230,30 ΣX
2
= 120,00 Keterangan: X = Konsentrasi (µg/mL)
Y = % Peredaman
a =
n / X) ( ) X ( n / Y) X)( ( -XY) ( 2 2 − ∑
b = Y−aX
= 41,016 – (10,2495) (4) = 0,010
Jadi, persamaan garis untukmendapatkan IC50adalah Y = 10,2495X + 0,010
Nilai IC50 = > Y = 10,2495X + 0,010
KC KC KC KC U KC UM UM KC KC U KC KC UM UC KC U KC KC KC UM KC U UM UM UM KC UM UM UC KC U KC KC KC KC UM UM UM UM
Lampiran 10.Hasil pola kromatogram dan harga Rf EEKBL secara KLT 1. Gambar kromatogram dengan fase gerak n-heksan:etilasetat
1 2 3 4 5
Keterangan:Fase diam = plat pra lapis silika gel 60 F254,penampak noda=
Liebermann-Burchard, kc=kuning coklat, u=ungu, uc=ungu coklat, um=ungu muda, bp=batas pengembang, tp=titik penotolan.
(50:50) (60:40) (70:30) (80:20) (90:10)
2. Tabel harga Rf secara KLT dengan fase gerak n-heksan:etil asetat
No Fase gerak Harga Rf Noda
Penampak bercak LB
1 50:50
0,04 ungu muda
0,08 ungu muda
0,12 ungu muda
0,18 kuning cokelat
0,25 ungu
0,46 kuning cokelat
0,79 kuning cokelat
0,87 kuning cokelat
0,95 kuning cokelat
2 60:40
0,03 ungu muda
0,06 ungu muda
0,16 kuning cokelat
0,39 kuning cokelat
0,52 ungu
0,76 kuning cokelat
0,84 kuning cokelat
0,92 ungu muda
0,97 ungu muda
3 70:30
0,04 ungu muda
0,07 ungu muda
0,12 ungu muda
0,19 ungu muda
0,29 kuning cokelat
0,44 kuning cokelat
0,61 kuning cokelat
0,71 ungu
0,84 kuning cokelat
0,92 ungu cokelat
0,97 ungu muda
4 80:20
0,07 ungu muda
0,15 ungu muda
0,25 ungu muda
0,31 ungu muda
0,41 kuning cokelat
0,56 kuning cokelat
0,64 kuning cokelat
0,72 kuning cokelat
0,82 ungu
0,89 kuning cokelat
0,95 ungu cokelat
5 90:10
0,11 ungu muda
0,2 ungu muda
0,29 kuning cokelat
0,34 ungu muda
0,52 ungu muda
0,66 ungu muda
0,91 ungu
CJ CJ CJ CJ
J
J
KJ
KJ KJ
J
J
J J
J
KJ
KJ KJ KJ
J
J
J
J
J
KJ
J J J Lampiran 10(Lanjutan)
3. Gambar kromatogram dengan fase gerak kloroform:metanol
1 2 3 4 5
Keterangan:Fase diam = plat pra lapis silika gel 60 F254, penampak noda=
pereaksi Dragendorff, cj= coklat jingga, j=jingga, kj=kuning jingga, bp=batas pengembang, tp=titik penotolan.
(50:50) (60:40) (70:30) (80:20) (90:10)
BP
4. Tabel harga Rf secara KLT dengan fase gerak kloroform:metanol
No
Fase gerak
Harga Rf
Noda
kloroform:metanol Penampak bercak Dragendorff
1 50:50
0,16 jingga
0,56 kuning jingga
0,66 jingga
0,73 jingga
0,79 cokelat jingga
0,83 cokelat jingga
0,89 cokelat jingga
0,94 cokelat jingga
2 60:40
0,04 jingga
0,08 jingga
0,14 jingga
0,17 kuning jingga
0,51 jingga
0,83 jingga
0,87 kuning jingga
0,93 kuning jingga
3 70:30
0,27 jingga
0,71 jingga
0,9 jingga
0,95 kuning jingga
4 80:20:
0,07 jingga
0,22 jingga
0,62 jingga
0,79 kuning jingga
0,87 kuning jingga
0,90 kuning jingga
5 90:10
0,04 jingga
0,10 jingga
0,21 jingga
0,42 kuning jingga
0,59 jingga
K J BK
PK
U B Lampiran 11.Hasil pola kromatogram EEKBL secara KKt
1. Gambar kromatogram dengan fase gerak BAW (4:1:5) Visual
UV Penampak bercak
Uap NH3 AlCl3 FeCl3
1 2 3 4
Keterangan:Fase diam =kertas whattman no. 1, b=biru, bk=biru kehitaman, j=jingga, k=kuning, u=ungu, bp=batas pengembang, tp=titik penotolan.
BP
2. Gambar kromatogram dengan fase gerak asam asetat 50%
1 2 3 4
Keterangan:Fase diam = kertas whattman no. 1, b=biru, bk=biru kehitaman, j=jingga, k=kuning, u=ungu, bp=batas pengembang, tp=titik penotolan.
Visual
UV Penampak bercak
Uap NH3 AlCl3 FeCl3
K J BK
U B
Lampiran 11(Lanjutan)
3. Gambar kromatogram dengan fase gerak asam klorida 1%
1 2 3 4
Keterangan:Fase diam = kertas whattman no. 1, fase, b=biru, bk=biru kehitaman, j=jingga, k=kuning,bp=batas pengembang, tp=titik penotolan.
Visual
UV Penampak bercak
Uap NH3 AlCl3 FeCl3
K
J
BK
B
DAFTAR PUSTAKA
Amelia, P. (2011). Isolasi, Elusidasi Struktur, dan Uji Aktivitas Antioksidan Senyawa Kimia dari Daun Garcinia benthami Pierre. Tesis Universitas indonesia.
Cechinel, V.F. (2012). Plant Bioactives and Drug Discovery. Brazil: Wiley. Page 367.
Cheng, M.C., and Cheng, Y.S.(1983). Composition of the essential oils of Litsea kostermanin Chang, Litsea Gerciae Vidal and Litsea cubeba (Lour.) Persoon. J Chinese Chem. Soc., 30: 59-62.
Depkes RI. (1979).Farmakope Indonesia. Edisi Ketiga. Jakarta: Departeman Kesehatan Republik Indonesia. Halaman 9 dan 33.
Depkes RI. (1986). Sediaan Galenik. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 6-7.
DepkesRI. (1995). Materia Medika Indonesia. Edisi Keenam. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 297-307, 321-325, 333-337.
Ditjen POM. (2000). ParameterStandar Umum Ekstrak Tumbuhan Obat. JakartaDepartemen Kesehatan Republik Indonesia. Halaman 30.
Depkes RI. (2008). Farmakope Herbal Indonesia. Edisi Kesatu. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman: 70-71.
Farnsworth, N.R. (1996). Biological and Phytochemical Screeningof Plants. Journal of Pharmaceutical Sciences. Volume 55. No.3. Chiccago: Rheis Chemical Company Pages 263-264.
Garcia J.E., Oldoni, C.L.T., Alencar, D.M.S., Reis, A., Loguercio, D.A., and Grande, M.H.R. (2012). Antioxidant Activity by DPPH Assay of Potential Solution to be Applied on Bleaced Teeth. Braz Dent Journal. 23(1): 22-27. Giorgio, P. (2000). Flavonoid as Antioxidant. Journal National Product. 63.
1035-1045.
Gritter, R.J., Bobbit, J.M., dan Schwarting, A.E. (1985). Introduction to Chromatography. Penerjemah: Kosasih Padmawinata. (1991). Pengantar Kromatografi Terbitan Kedua. Bandung: Penerbit ITB. Hal. 109, 157. Gunawan, I.W.G.,Gede, B.I.G.A., dan Sutrisnayanti, N.L. (2008). Isolasi dan
Handa, S.S., Khanuja, S.P.S., Longo, G., and Rakes, D.D. (2008). Extraction Technologies for Medical and Aromatic Plants. Trieste: Internaional Centre for Sciences and High Technology. Halaman 21-25.
Harbone, J.B. (1987). Metode Fitokimia. Edisi Kedua. Bandung: Institut Teknologi Bandung. Halaman 239.
Heinrich, M., Joanne, B., Simon, G., dan Elizabeth, M.W. (2009). Farmakognosi dan Fitoterapi. Jakarta: EGC. Halaman 123-124.
Heryati, Y., N. Mindawati dan A.S., Kosasih. (2009). Prospek pengembangan Lemo (Litsea cubeba L. Persoon) di Indonesia. Tekno. Hutan Tanaman, 2 (1): 9-17.
Heyne, K. (1987). Tumbuhan Berguna Indonesia. Jilid II. Cetakan I. Jakarta: Badan Penelitian dan Pengembangan Kehutanan Departemen Kehutanan. Halaman 67.
Hudaya,T., Alex, S., and Susiana., P.S. (2015). Tannin Removal by Hot Water as the Pretreatment of the Multi Stages Extraction of Phaleria macrocarpa Bioactive Compounds. Prosiding Seminar Nasional Teknik Kimia.Yogyakarta: Fakultas Teknik Kimia UPN.
Hutapea, J.R. (1994). Inventaris Tanaman Obat Indonesia III. Jakarta: Departemen Kesehatan Republik Indonesia. Halman 69.
Isnindar, Subagus, W., dan Erna, P.S. (2011). Isolasi dan Identifikasi Senyawa antioksidan Daun Kesemek (Diospyros kaki Thumb.) dengan Metode DPPH (2,2 Diphenyl-1-pikrilhidrazil). Majalah Obat Tradisional 16(3). Halaman 157-164.
Ionita, P. (2005). Is DPPH Stable Free Radical A Good Scavanger for Oxygen Active Species. Institute of Physical Chemistry, Bucharest, Romania. 59(1): 11-16.
Iqbal, K., Alam, K., and Muzaffar, M.A.K.K. (2004). Biological Significance of Ascorbic Acid (Vitamin C) in Human Health. Pakistan Journal of Nutrition 3 (1): 5-13
Kayang, H., Kharbuli, B.,and Syeim, D. (2009). Litsea cubeba Pers. an untapped economic plant species of Meghalaya. Natural Product Radiance.A Bimontly Journal on Natural Product,8(1): 1-2.
Kotoky, R., Pathak, M.B., and Kanjilal, P.B. (2007). Pyisico-chemical characteristics of seed oils of some Litsea species found in North-East India. Natural Product Radiance, 6(4): 297-300.
Krisna, I.G.A.P.S.A., Sri, R.S., dan Luh, N.R. (2014). Senyawa steroid pada Daun Gayam (Inocarpus fagiferus Fosb) dan aktivitasnya sebagai antioksidan terhadap DPPH. Jurnal Kimia8 (2), Juli 2014: 251-256.
Kumar, S., Kumar, V., and Chandrashekhar, M.S. (2011). In-Vitro Antioxidant and alpha-Amylase Inhibitory Activity of Isolated Fractions from Methanolic Extract of Asystasia dalzelliana Leaves.International Journal Pharm Tech Res. 3(2), 889-894.
Lin, C.T., Chu,F.H., Tseng,Y.H., Tsai,J.B., Chang,S.T., and Wang, S.Y. (2007). Bioactivity Investigation of Lauraceae tress grown in Taiwan. Pharmaceutical Biology, 45(8): 638-644.
Malangngi, L.P., Meiske, S.S., dan Jessy, J.E.P. (2012). Penentuan Kandungan Tanin dan Uji Aktivitas Antioksidan Ekstrak Biji Buah Alpukat (Persea americana Mill). Jurnal MIPA UNSRAT Online 1 (1) 5-10
Marina, E., Hetty, M., dan Rudy, A.N. (2015). Uji Fitokimia dan Antibakteri Ekstrak etanol Daun Balangla (Litsea cubeba (Lour.) Pers.) Terhadap Bakteri Stapylococcus aureus dan Escherichia coli. Prosiding Seminar Sains dan Teknologi FMIPA Unmul.Vol. 1.
Mardawati, E., Achyar, C., dan Marta, H. (2008). Kajian Aktivitas Antioksidan Ekstrak Kulit Manggis (Garcinia mangostana L) dalam Rangka Pemanfaatan Limbah Kulit Manggis di Kecamatan Puspahiang Kabupaten Tasikmalaya. Bandung: Lembaga Penelitian Universitas Padjadjaran. Halaman 17.
Marinova, G. dan Batchvarov, V. (2011). Evaluation of the Methods for Determination of the Free Radical Scavenging Activity by DPPH. Bulg. J. Agric. Sci. 17(1): 13-14.
Markham, K.R. (1988). Cara Mengidentifikasi Flavonoida. Terjemahan Kosasih Padmawinata. Bandung: ITB. Halaman 78.
Mohan, M. (2013). Determination of Andrographolide in Andrographydis Serum by High Performance Thin Layer Chromatography. Int. Res. J. Pharm. ISSN 2230-1470:41-49.
Molineux, P. (2004). The Use of Stable Free radical Diphenyl Picrylhidrazil (DPPH) for Estimating Antioxidant Activity.Sonklanakarin J. Sci. Technol., 26(2), 211-219.
L.) Terhadap Bilangan Peroksida dan Asam Lemak Bebas pada Minyak Goreng Curah. Jurnal Penelitian Sains. Vol 14 No 2C.
Pekiner, D.B. (2003). Vitamin E as Anioxidant. J. Fac. Pharm, Ankara. 32 ($) 243-267.
Pommeger, W, Budur, K., Dorji, and Chhetri, P.B. (2005). Lemon grass distillation in Eastern Bhutan- A scenario analysis. Coret and RC-Wengkhar.
Prakash, A., Fred, R., and Eugene, M. (2001). Antioxidant Activity. Medallion Laboratory: Analytical Progres, Vol 19 No: 2.1-4.
Prapti, U. (2008). Buku Pintar tanaman Obat. Jakarta: PT. Agromedia Pustaka. Halaman 233.
Purwaningsih, S. (2012). Aktivitas antioksidan dan Komposisi kimia Keong Mentah Merah (Cerithidea obtusa). Jurnal Ilmu Kelautan Vol. 17 (1) 39-48.
Purwasih, S., Ella, S., Aditya, Y.P.S. (2013). Aktivitas Antioksidan dari Buah Mangrove (Rhizopora mucronata Lamk) pada Suhu yang Berbeda. JPHPI Volume 16. Bogor: Institut Pertanian Bogor. Halaman 199-200.
Raaman, N. (2006). Phytochemical Techniques. New Delhi: NIDA. Page 10. Rahmawati, D. (2004). Mempelajari Aktifitas Antioksidan dan Antimikrobia
Ekstrak Antarasa (Litsea cubeba) dan Aplikasinya sebagai Pengawet Alami pada Bahan Makanan. Skripsi. FakultasTeknologi Pertanian, IPB, Bogor.
Rohdiana, D. (2001). Aktivitas Daya Tangkap Radikal Polifenol dalam Daun Teh.Majalah Jurnal Indonesia12, (1), 53-58.
Rohman, A. (2009). Kromatografi untuk Analisis Obat. Yogyakarta: Graha Ilmu. Hal. 1, 47.
Rumagit, H.M. (2015). Uji Fitokimia dan Uji Aktivitas Antioksidan dari Ekstrak Etanol Spons (Lamellodysidea herbacea). Jurnal Ilmiah Farmasi – UNSRAT Vol. 4 No:3.184.
Saefudin., Marusin, S., dan Chairul. (2013). Aktivitas Antioksidan pada Enam Jenis Tumbuhan Sterculiaceae. JurnalPenelitian Hasil Hutan Vol. 31 No. 2, Juni 2013: 103-109.
Senja, R.Y., Issusilaningtyas, E., Nugroho, A.K., dan Styowati, E.P. (2014). Perbandingan Metode Ekstraksi dan Variasi Pelarut Terhadap Rendemen dan Aktivitas Antioksidan Ekstrak Kubis Ungu ((Brassica oleracea L. var. capitata f. rubraTraditional Medicine Journal, 19(1), p 43-48.
Silalahi, J. (2006). Makanan Fungsional. Yogyakarta: Penerbit Kanisius. Halaman 40,47-48.
Suhartono, E., dan Fujiati, A.I. (2002). Oxygen Toxicity by Radiation and Effect of Glutamic Piruvat Transamine (GPT) Activity Rat Plasma After Vitamin C Treatment. Diajukan pada Internasional Seminar on Environmental Chemistry and Toxicology Yogyakarta.
Sunarni, T. (2005). Aktivitas Antioksidan Penangkap Radikal Bebas Beberapa kecambah Dari Biji Tanaman Familia Papilionaceae. Jurnal Farmasi Indonesia 4, 34-39.
Supriyatna, Moelyono, M.W., Yoppi, I., dan Maya, R.F. (2014). Prinsip Obat Herbal. Yogyakarta; CV. Budi Utama. Halaman 52.
Susianti, S. (1996). Peran Baleng la (Litsea cubeba) sebagai tumbuhan obat dan aroma pada masyarakat Dayak Kenyan di Pujungan Kalimantan Timur. Prosiding Simposium Nasional Tumbuhan Obat dan Aromatik APINMAP. Halaman634-639.
Syamsul, R.H., dan Rodame, M.N. (2015) Kitab Tumbuhan Obat. Jakarta: Agriflo. Halaman 231.
Tiong, S.H., Chung, Y.L., dan Hazrina, H. (2013). Antidiabetic and antioxidant Properties of Alkaloids from Catharanthus roseus (L.) G. Don. Molecules 2013, 18, 9770-9784.
Titiek, S., Tajaudin, E.K., Marfuah, W., Made, H., Wayan, I.S.D., dan Ragil, S.B.I. (2014). Prosiding Gelar Teknologi Hasil Penelitian. Waikabubak: Kementrian Kehutanan. Halaman 21.
Triyati, E.. (1985). Spektrofotometer Ultraviolet dan Sinar Tampak Serta Aplikasinya dalam Oseanologi. Oseana 1(10): 39-47.
Tyas, K.N., Hadiah,J.T., dan Soejono. (1999). Studi flora berpotensi obat di hutan sekitar desa parang, Grogol, Kediri, Jawa Timur. Makalah disampaikan pada Seminar Sehari PERHIBA, Jur. Farmasi, Fak. MIPA. UI.
Werdhasari, A. (2014). Peran Antioksidan Bagi Kesehatan. Jurnal Biotek Medisiana Indonesia . Vol.3.2.2014: 59-68.
Tradisional. Halaman 1-2.
Winarsih, H. (2007). Antioksidan Alami dan Radikal Bebas, Potensi dan Aplikasinyadalam Kesehatan. Yogyakarta: Kanisius. Halaman 4.
World Health Organization. (1998). Quality Control Methods for Medical Plant Materi LS. Switzerland: Geneva. Halaman 25-28.
Yuliani, S., dan Suyanti, H. (2012) Panduan Lengkap Minyak Atsiri. Jakarta: Penebar Swadaya. Halaman 46.
BAB III
METODE PENELITIAN
Jenis penelitian yang dilakukan adalah penelitian eksperimental yang meliputi pengumpulan dan preparasi bahan, karakterisasi simplisia, pembuatan ekstrak etanol, skrining fitokimia,uji aktivitas antioksidan dengan metode aktivitas pemerangkapan radikal bebas DPPH dengan menggunakan alat spektrofotometer visibel, serta analisis kandungan kimianya secara KLT dan KKt.
3.1Alat
Alat-alat yang digunakan terdiri dari: alat-alat gelas laboratorium, chamber, desikator,hair dryer (Maspion), kertas whattman no 1, krus porselin, lampu UV (Camag), lemari es (Panasonic), lemari pengering, neraca analitis(Vibra AJ), pipa kapiler, penangas air, penguap vakum putar (Eyela), spektofotometer UV/Vis (Shimadzu), tanur (Nabertherm), timbangan (Sartorius), Oven (Memmert) dan plat silika 60 F254.
3.2Bahan
Penyiapan bahan tanaman meliputi pengambilan bahan tanaman identifikasi tanaman, dan pengolahan bahan tanaman.
3.3.1 Pengambilan bahan tanaman
Pengambilan bahan tanaman dilakukan secara purposive. Kulit batang landoyung diambil dari kebun di daerah Gambiri Kecamatan Dolok Pardamean Kota Pematang Siantar Kabupaten Simalungun Sumatera Utara
3.3.2 Identifikasi tanaman
Identifikasi tanaman dilakukan di Herbarium Bogoriense, Bidang Botani, Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong. 3.3.3 Pengolahan bahan tanaman
Kulit batang landoyung diambil dari pohon landoyung, dibersihkan, dipotong kira-kira berukuran 5x9 cm. Kulit batang kemudian dikeringkan hingga kering, jika simplisia diremas akan patah, kemudian ditimbang.
3.4Pembuatan Pereaksi
3.4.1 Larutan asam klorida 2N
Sebanyak 17 mL asam klorida pekat diencerkan dengan air suling sampai 100 mL (Depkes RI., 1995).
3.4.2 Larutan pereaksi asam sulfat 2 N
Sebanyak 5,5 mL asam sulfat pekat diencerkan dengan air suling hingga diperoleh 100 mL (Depkes RI., 1995).
3.4.3 Pereaksi besi (III) klorida 1%
3.4.4 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida dilarutkan dalam air suling secukupnya kemudian ditambahkan 2 g iodida sedikit demi sedikit cukupkan dengan air suling sampai 100 mL (Depkes RI., 1995).
3.4.5 Larutan DPPH 0,5 mM (Konsentrasi 200 µg/mL)
Sebanyak 20 mg DPPH ditimbang, kemudian dimasukkan ke dalam labu tentukur, dilarutkan dengan sedikit metanol lalu dicukupkan hingga volume 100 mL (Molyneux, 2004).
3.4.6 Pereaksi Dragendorf
Sebanyak 0,8 g bismut nitrat dilarutkan dalam asam nitrat pekat 20 mL kemudian dicampurkan dengan larutan kalium iodida sebanyak 27,2 g dalam 50 mL air suling. Campuran didiamkan sampai memisah sempurna. Larutan jernih diambil dan diencerkan dengan air suling secukupnya hingga 100 mL (Depkes RI., 1995).
3.4.7 Pereaksi Liebermann-Burchard
Campur secara perlahan 5 mL asam asetat anhidrit dengan 5 mL asam sulfat pekat tambahkan etanol hingga 50 mL (Depkes RI., 1995).
3.4.8 Pereaksi Mayer
Sebanyak 1,4 g raksa (II) klorida, kemudian dilarutkan dalam air suling hingga 60 mL. Ditimbang sebanyak 5 g kalium iodida lalu dilarutkan dalam 10 mL air suling. Larutan dicampurkan dan ditambahkan air suling hingga diperoleh larutan 100 mL (Depkes RI., 1995).
3.4.9 Pereaksi Molisch
Timbal (II) asetat sebanyak 15,17 g dilarutkan dalam air suling bebas CO2
hingga 100 mL (Depkes RI., 1995).
3.5Pemeriksaan Karakteristik Simplisia
3.5.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk luar dari simplisia kulit batang landoyung (Litsea cubeba (Lour.) Pers.)
3.5.2 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen). Alat terdiri dari alas bulat 500 mL, alat penampung, pendingin, tabung penyambung dan tabung penerima.
a. Penjenuhan toluen
Sebanyak 200 mL toluena dan 2 mL air suling dimasukkan ke dalam labu alas bulat, dipasang alat penampung dan pendingin, kemudian didestilasi selama 2 jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit, kemudian volume air dalam tabung penerima dibaca dengan ketelitian 0,05 mL.
b. Penetapan kadar air simplisia
memisah sempurna, volume air dibaca dengan ketelitian 0,05 mL. Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa (WHO, 1998).
3.5.3 Penetapan kadar sari yang larut dalam air
Sebanyak 5 gram serbuk simplisia dimaserasi selama 24 jam dalam 100 mL air-kloroform (2,5 mL kloroform dalam air suling sampai 1 liter) dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam, kemudian disaring. Sejumlah 20 mL filtrat pertama diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105oC sampai bobot tetap. Kadar dalam persen sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan di udara (Depkes RI., 1995).
3.5.4 Penetapan kadar sari yang larut dalam etanol
Sebanyak 5 gram serbuk simplisia dimaserasi selama 24 jam dalam 100 mL etanol 96% dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Maserat disaring cepat untuk menghindari penguapan etanol. Sejumlah 20 mL filtrat diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105oC sampai bobot tetap. Kadar dalam persen sari yang larut dalam etanol 96% dihitung terhadap bahan yang telah dikeringkan di udara (Depkes RI., 1995).
3.5.5 Penetapan kadar abu total
bobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan di udara (Depkes RI., 1995).
3.5.6 Penetapan kadar abu yang tidak larut dalam asam
Abu yang diperoleh dalam penetapan kadar abu dididihkan dalam 25 mL asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring dipijarkan sampai bobot tetap, kemudian didinginkan dan ditimbang. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan di udara dalam bentuk persen (Depkes RI., 1995).
3.6Skrining Fitokimia
Skrining fitokimia dilakukan untuk senyawa alkaloid, glikosida, dan saponin menurut Depkes RI (1995) dan Farnsworth (1966) untuk mengetahui golongan senyawa tanin, dan triterpenoida /steroida.
3.6.1 Pemeriksaan alkaloid
Serbuk simplisia ditimbang sebanyak 0,5 g, kemudiaan ditambahkan 1 mL asam klorida 2 N dan 9 mL air suling, dipanaskan diatas penangas air selama 2 menit, didinginkan dan disaring, filtrat dipakai untuk uji alkaloida sebagai berikut: a. filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Mayer akan
terbentuk endapan menggumpal berwama putih atau kuning.
b. filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Bouchardat akan terbentuk endapan berwama coklat sampai kehitaman.
3.6.2 Pemeriksaan glikosida
Sebanyak 3 g serbuk simplisia ditimbang, lalu disari dengan 30 mL campuran dari 7 bagian etanol 95% dan 3 bagian air suling. Kemudiaan direfluks selama 10 menit, didinginkan, lalu disaring. Diambil 20 mL filtrat, ditambahkan 25 mL air suling dan 25 mL timbal (II) asetat 0,4 M dikocok, didiamkan 5 menit lalu disaring. Filtrat disari dengan 20 mL campuran 2 bagian isopropanol dan 3 bagian kloroform, perlakuan ini diulangi sebanyak 3 kali. Sari air dikumpulkan dan ditambahkan Na2SO4anhidrat, disaring, kemudiaan diuapkan pada temperatur
tidak lebih dari 500C, sisanya dilarutkan dalam 2 mL metanol. Larutan sisa digunakan untuk percobaan berikut: 0,1 mL larutan percobaan dimasukkan dalam tabung reaksi, kemudian diuapkan di atas penangas air. Pada sisa ditambahkan 2 mL air dan 5 tetes larutan perekasi Molisch, lalu ditambahkan dengan hati-hati 2 mL asam sulfat pekat, terbentuk cincin ungu pada batas kedua cairan, menunjukkan adanya ikatan gula (glikon) (Depkes RI., 1995).
3.6.3 Pemeriksaan triterpenoida/steroida
Sebanyak 1 g serbuk simplisia dimaserasi dengan eter 20 mL selama 2 jam, disaring, lalu filtrat diuapkan dalam cawan penguap. Pada sisa ditambahkan 20tetes asam asetat anhidrat dan 1 tetes asam sulfat pekat (pereaksi Lieberman-Burchard). Apabila terbentukwarna biru atau biru hijau menunjukkan adanya steroida sedangkan warna merah,merah muda atau ungu menunjukkan adanya triterpenoid (Farnsworth, 1966).
3.6.4 Pemeriksaan flavonoida
terjadi warna merah kekuningan atau jingga (Farnsworth, 1966). 3.6.5 Pemeriksaaan tanin
Sebanyak 0,5 g serbuk simplisia disari dengan 10 mL air suling lalu disaring, filtratnya diencerkan sampai tidak berwarna. 2 mL larutan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1%. Terbentuknya warna biru atau kehitaman menunjukkan adanya tanin (Farnsworth, 1966).
3.6.6 Pemeriksaan saponin
Sebanyak 0,5 g serbuk simplisia dimasukkan ke dalam tabung reaksi, ditambahkan 10 mL air suling panas, didinginkan, kemudian dikocok kuat-kuat selama 10 detik. Saponin positif jika terbentuk busa yang stabil tidak kurang dari 10 menit setinggi 1 sampai 10 cm dan dengan penambahan 1 tetes asam klorida 2 N buih tidak hilang (Depkes RI., 1995).
3.7Pembuatan Ekstrak Etanol Kulit Batang Landoyung (Litsea cubeba (Lour.) Pers.) (EEKBL)
3.8Pengujian Kemampuan Antioksidan dengan Spektrofotometer Visibel 3.8.1 Prinsip metode aktivitas antiradikal bebas DPPH
Kemampuan sampel uji dalam meredam proses oksidasi DPPH sebagai radikal bebas dalam larutan metanol (sehingga terjadi peredaman warna ungu) reaksi ini menyebabkan perubahan warna yang dapat di ukur dengan spektrofotometer dengan panjang gelombang 516 nm. Aktivitas peredaman radikal bebas dapat ditentukan dengan nilai Inhibitor Consentration 50 (IC50).
3.8.2 Pembuatan larutan blanko
Larutan DPPH 0,5 mM dipipet sebanyak 5 mL, kemudian dimasukkan ke dalam labu tentukur 25 mL, dicukupkan volumenya dengan metanol sampai garis tanda, diperoleh larutan DPPH konsentrasi 40 µg/mL.
3.8.3 Pembuatan larutan induk EEKBL
Sebanyak 25 mg sampel uji ditimbang kemudian dilarutkan dalam labu tentukur 25 mL dengan metanol lalu volumenya dicukupkan dengan metanol sampai garis tanda (konsentrasi 1000 µg/mL).
3.8.4 Penentuan panjang gelombang serapan maksimum
Larutan DPPH konsentrasi 40 µg/mL dihomogenkan dan diukur serapannya pada panjang gelombang 400-800 nm.
3.8.5 Waktu pengukuran
Larutan induk dipipet sebanyak 0,25; 0,50; 0,75; 1,00mL kemudian dimasukkan ke dalam labu tentukur 25 mL (untuk mendapatkan konsentrasi 10, 20, 30, 40 µg/mL), Masing-masing ke dalam labu tentukur ditambahkan 5 mL larutan DPPH 0,5 mM (konsentrasi 200 µg/mL) lalu volume dicukupkan dengan metanol sampai garis tanda. Larutan uji dihomogenkan dan didiamkan selama 60 menit, lalu diukur serapannya menggunakan spektrofotometer UV-visibel pada panjang gelombang 516 nm.
3.8.7 Pembuatan larutan induk vitamin C
Sebanyak 25 mg serbuk vitamin C ditimbang, dimasukkan ke dalam labu tentukur 50 mL dilarutkan dengan metanol lalu volumenya dicukupkan dengan metanol sampai garis tanda (konsentrasi 500µg/mL).
3.8.8 Pembuatan larutan uji vitamin C
Larutan induk dipipet sebanyak 0,10; 0,20; 0,30; 0,40mL ke dalam labu ukur 25 mL untuk mendapatkan konsentrasi larutan uji 2, 4, 6, dan 8 µg/mL, kemudian masing-masing ditambahkan 5 mL larutan DPPH 0,5 mM (konsentrasi 200 µg/mL) lalu volumenya dicukupkan dengan metanol sampai garis tanda. Diamkan selama 60 menit, lalu diukur serapannya menggunakan spektrofotometer UV-visibel pada panjang gelombang 516 nm.
3.8.9 Penentuan persen peredaman
%Peredaman = x 100% kontrol
A
sampel A -kontrol A
Keterangan : A kontrol = Absorbansi tidak mengandung sampel A sampel = Absorbansi sampel
3.8.10 Penentuan nilai IC50
Nilai IC50 merupakan bilangan yang menunjukkan konsentrasi sampel uji
(μg/mL) yang memberikan peredaman DPPH sebesar 50% (mampu menghambat/ meredam proses oksidasi sebesar 50%). Nilai 0% berarti tidak memunyai aktivitas antioksidan, sedangkan nilai 100% berarti peredaman total dan pengujian perlu dilanjutkan dengan pengenceran larutan uji untuk melihat batas konsentrasi aktivitasnya. Hasil perhitungan dimasukkan ke dalam persamaan regresi dengan konsentrasi ekstrak (μg/mL) sebagai absis (sumbu X) dan nilai %peredaman (antioksidan) sebagai ordinatnya (sumbu Y) sehingga diperoleh nilai IC50
(Inhibitor Concentration50).
3.9Analisis Kandungan Kimia EEKBL 3.9.1 Kromatografi lapis tipis (KLT)
Ekstrak etanol ditotolkan pada plat pra lapis, kemudian dimasukkan kedalam bejana yang telah jenuh dengan uap pengembang. Ditutup rapat dan dibiarkan naiksampai batas pengembang.Plat dikeluarkan dan dikeringkan, catat harga Rf, lalu disemprot dengan penempak bercak, diamati bercak yang terbentuk dan catat harga Rfnya.
BAB IV
HASIL DAN PEMBAHASAN
4.1Hasil Identifikasi Tanaman
Hasil identifikasi tanaman yang dilakukan di Herbarium Bogoriense,Bidang Botani Pusat Penelitian Biologi-LIPI Bogor menunjukkan bahwasampel kulit batang landoyung termasuk suku Lauraceae, jenis Litsea cubeba (Lour.) Pers. Hasil identifikasi dapat dilihat pada Lampiran 1 Halaman 47. Gambar tumbuhan dapat dilihat pada Lampiran 2 Halaman 48.
4.2Hasil Karakterisasi Simplisia 4.2.1 Pemeriksaan makroskopik
Hasil pemeriksaan makroskopik simplisia kulit batang landoyung berbentuk gelondong atau pipa, menggulung, tebal 0,5 mm-1,5 mm. Permukaan luar kasar tidak beraturan, warna coklat. Permukaan dalam rata, warna coklat sampai coklat kehitaman. Sangat mudah patah dan bekas patahan tidak rata. Memiliki aroma yang khas. Gambar simplisia dapat dilihat pada Lampiran 3 Halaman 49.
4.2.2 Hasil pemeriksaan katrakteristik serbuk simplisia dan EEKBL
Hasil pemeriksaan karakteristik serbuk simplisia dan EEKBL dapat dilihat pada Tabel 4.1 dan hasil perhitungannya pada Lampiran 5 Halaman 52.
Tabel 4.1Hasil pemeriksaan karakteristik simplisia kulit batang landoyung dan EEKBL
No Karakteristik Simplisia Syarat
(MMI) Ekstrak
Syarat (FHI)
1 Kadar air 5,66% < 10% 9,33% < 10%
[image:50.595.116.513.649.751.2]landoyung dan EEKBL memenuhi persyaratan. Penetapan kadar air dilakukan untuk memberi batasan atau rentang besarnya kandungan air di dalam simplisia, karena tingginya kandungan air dapat mempercepat pertumbuhan jamur (Ditjen POM., 2000).
Penetapan kadar abu dimaksudkan untuk mengetahui kandungan mineral internal yang terdapat di dalam simplisia yang diteliti serta senyawa anorganik yang tersisa selama pembakaran. Abu total terbagi dua yang pertama abu fisiologis adalah abu yang berasal dari jaringan tanaman itu sendiri dan abu non fisiologis adalah sisa setelah pembakaran yang berasal dari bahan-bahan dari luar yang terdapat pada permukaan simplisia. Kadar abu tidak larut asam untuk menentukan jumlah silika, khususnya pasir yang ada pada simplisia dengan cara melarutkan abu total dalam asam klorida (WHO, 1998).
4.3Hasil Skrining Fitokimia
[image:52.595.113.511.218.392.2]Hasil skrining fitokimia terhadap serbuk simplisia kulit batang landoyung dan EEKBL mengandung golongan senyawa kimia seperti yang terlihat pada Tabel 4.2.
Tabel 4.2 Hasil pemeriksaan skrining fitokimia simplisia kulit batang landoyung dan EEKBL
No Pemeriksaan
Hasil
Simplisia Ekstrak
1 Alkaloid + +
2 Glikosida + +
3 Triterpenoid/steroida + +
4 Flavonoid + +
5 Tanin + +
6 Saponin + +
Keterangan: (+) positif : mengandung golongan senyawa, (-) negatif: tidak mengandung golongan senyawa
Hasil di atas menunjukkan bahwa kulit batang landoyung mengandung alkaloid, triterpenoid/steroid, flavonoid, glikosida, tanin dan saponin. Kulit batang landoyung memiliki potensi sebagai antioksidan karena mengandung metabolit sekunder yang bersifat antioksidan diantaranya adalah flavonoid (Giorgio, 2000;Saefudin, dkk., 2013), tanin (Malangngi, dkk.,2012), steroid (Krisna, dkk., 2014), dan alkaloid (Tiong, et al., 2013).
4.4 Hasil Analisis Aktivitas Antioksidan
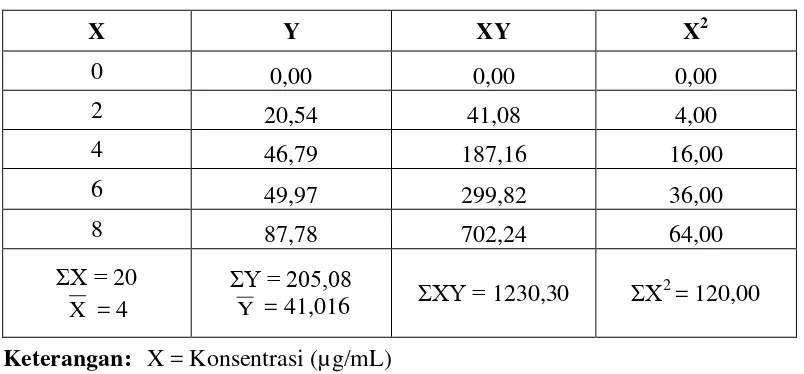
Hasil pengukuran serapan maksimum larutan DPPH 40 µg/mL dalam metanol dengan menggunakan spektrofotometer UV-Visible, menunjukkan bahwa larutan DPPH (1,1-diphenyl-2-picrylhidrazyl) dalam metanol menghasilkan serapan maksimum sebesar 0,97227 pada panjang gelombang 516 nm termasuk dalam kisaran panjang gelombang sinar tampak (400-800 nm) (Rohman, 2007) dan termasuk dalam rentang panjang gelombang DPPH (1,1-diphenyl-2 -picrylhidrazyl) yang berkisar antara 515 – 520 nm dengan warna violet gelap (Molyneux, 2004).Data hasil pengukuran panjang gelombang dapat diihat pada Gambar 4.1.
Gambar 4.1 Kurva serapan maksimum larutan DPPH 40 µg/mL dalam metanol menggunakan spektrofotometer UV-visibel
4.4.2 Hasil penentuan operating time
DPPH menurut beberapa literatur yang direkomendasikan adalah selama 60 menit(Marinova dan Batchvarov, 2011). Hasil pengukuran dapat dilihat pada Lampiran 6 Halaman 58.
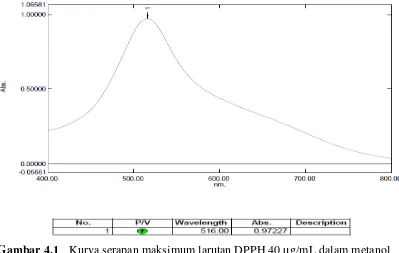
4.4.3 Hasil persen peredaman DPPH
[image:54.595.113.510.300.584.2]Hasil persen peredaman DPPH terhadap EEKBL dan vitamin C dapat dilihat pada Tabel 4.3 dan hasil perhitungannya dapat dilihat pada Lampiran 7 Halaman 59.
Tabel 4.3 Persen peredaman DPPH
Larutan uji Konsentrasi(µg/mL) % Peredaman rata-rata
EEKBL
0 0,00
10 19,48
20 36,36
30 50,53
40 60,48
Vit C
0 0,00
2 20,54
4 46,79
6 49,97
8 87,78
antioksidan yang semakin besar. EEKBL menunjukkan nilai % peredaman DPPH yang lebih kecil dibandingkan vitamin C.
Penurunan nilai absorbansi terjadi karena larutan uji memerangkap DPPH dan pemerangkapan terjadi karena senyawa yang bereaksi sebagai penangkap radikal yang akan mereduksi DPPH membentuk DPPH-H yang tereduksi. Reaksi ini diamati dengan adanya perubahan warna dari ungu menjadi kuning ketika elektron ganjil dari radikal DPPH telah berpasangan dengan hidrogen dari senyawa penangkap radikal bebas. Keberadaan antioksidan dalam ekstrak tumbuhan akan menetralisasi radikal dengan menyumbangkan elektron kepada DPPH, menghasilkan perubahan warna dari ungu menjadi kuning atau intensitas warna ungu larutan jadiberkurang (Molyneux, 2004).Penghilangan warna akan
sebanding dengan jumlah elektron yang diambil oleh DPPH sehingga dapat diukur secara spektrofotometris (Garcia, et al., 2012).
4.4.4 Hasil analisis nilai IC50 (inhibitory concentration)
[image:55.595.113.510.553.736.2]Hubungan antara konsentrasi dengan % peredaman radikal bebas DPPH oleh EEKBL dapat dilihat pada Gambar 4.2 berikut.
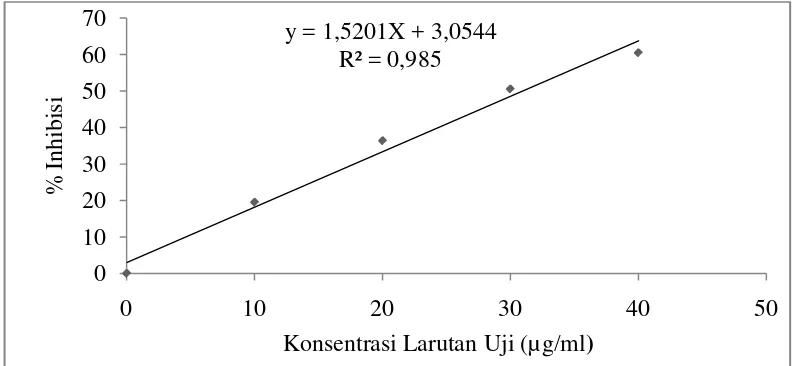
Gambar 4.2 Grafik Hasil Uji Aktivitas Antioksidan EEKBL y = 1,5201X + 3,0544
R² = 0,985
0 10 20 30 40 50 60 70
0 10 20 30 40 50
%
I
nhi
bi
si
Pada Gambar 4.2 dapat dilihat hasil uji aktivitas antioksidan EEKBL diperolehpersamaan regresi linier dengan cara memplot konsentrasi larutan uji dan persen peredaman DPPH, dimana konsentrasi sampel (µg/mL) sebagai absis dan nilai %inhibisi sebagai ordinat yaitu Y = 1,5201X + 3,0544. Dari persamaan tersebut maka dapat di peroleh nilai IC50EEKBL sebesar 30,94 µg/mL termasuk
dalam kategori sangat kuat yaitu lebih kecil dari 50 µg/mL. Perhitungan dapat dilihat pada Lampiran 8 Halaman 68.
[image:56.595.112.509.331.561.2]Hubungan antara konsentrasi dengan % peredaman radikal bebas DPPH oleh vitamin C dapat dilihat pada Gambar 4.3berikut.
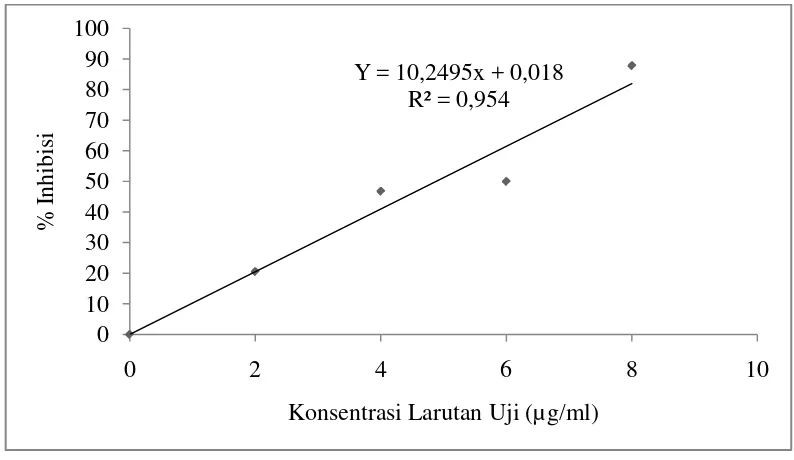
Gambar 4.3 Grafik Hasil Uji Aktivitas Antioksidan Vitamin C
Gambar 4.3 menunjukkan bahwa hasil uji aktivitas antioksidan vitamin C diperolehpersamaan regresi linier dengan cara memplot konsentrasi larutan uji dan persen peredaman DPPH, dimana konsentrasi sampel (µg/mL) sebagai absis dan nilai %inhibisi sebagai ordinat yaitu Y = 10,2495x + 0,018. Dari persamaan tersebut maka dapat di peroleh nilai IC50vitamin C sebesar 4,87µg/mL.
Perhitungan dapat dilihat pada Lampiran 9 Halaman 69. Y = 10,2495x + 0,018
R² = 0,954
0 10 20 30 40 50 60 70 80 90 100
0 2 4 6 8 10
%
I
nhi
bi
si
jika nilai IC50kurang dari 50, kuat untuk IC50 bernilai 50-100, sedang jika IC50
bernilai 100-150, dan lemah jika IC50 adalah 151-200 (Mardawati, dkk., 2008).
4.5Hasil Analisis Kandungan KimiaEEKBL
4.5.1 Kromatografi lapis tipis
Hasil analisis kandungan kimia EEKBL secara KLT menggunakan fase gerak n-heksan:etil asetat dengan perbandingan (90:10), (80:20), (70:30), (60:40), dan (50:50) dengan fase diam silika gel 60 F254. Pengamatan bercak yang
dilakukan secara visual tidak dijumpai adanya noda dan setelah dilakukan penyemprotan dengan LB, fase gerak yang memberikan pola yang terbaik adalah perbandingan 80:20 diperoleh 11 noda berwarna kuning cokelat, ungu muda, dan ungu yang menujukkan adanya senyawa triterpenoid. Gambar kromatogram dan harga Rf dapat dilihat pada Lampiran 10Halaman 71.
KLT digunakan untuk mencari eluen terbaik dari beberapa eluen yang baik dalam pemisahan senyawa triterpenoid. Eluen yang baik adalah eluen yang dapat memisahkan senyawa dalam jumlah yang banyak ditandai dengan munculnya banyak noda. Noda yang terbentuk tidak berekor dan jarak antara noda satu dengan yang lainnya jelas (Harbone, 1987). Gunawan, dkk., (2008) menyebutkan bahwa senyawa triterpenoid memberikan warna merah muda atau ungu muda setelah dilakukan pengemprotan dengan pereaksi Lieberman Burchard.
Hasil analisis kandungan kimia EEKBL secara KLT menggunakan fase gerak kloroform:metanol dengan perbandingan (90:10), (80:20), (70:30), (60:40), dan (50:50) dengan fase diam silika gel 60 F254. Pengamatan bercak yang
penyemprotan dengan Dragendorff, fase gerak yang memberikan pola yang terbaik adalah perbandingan 50:50 diperoleh 8 noda yang berwarna kuning jingga, jingga dan coklat jingga. Hal ini sesuai dengan Harbone (1987) yang menyatakan alkaloid dikatakan positif apabila ada bercak berwarna jingga dan dapat dilihat secara langsung setelah disemprot dengan pereaksi Dragendorff (Harbone, 1987). Gambar kromatogram dan harga Rf dapat dilihat pada Lampiran 10Halaman 73. 4.5.2 Kromatografi kertas
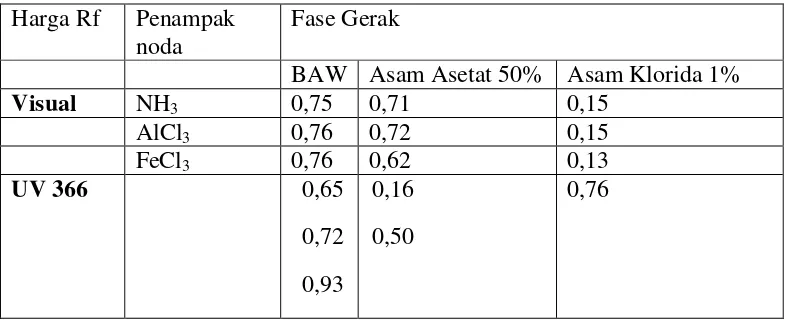
[image:58.595.115.516.377.539.2]Hasil kromatografi kertas ekstrak etanol kulit batang landoyung menggunakan fase gerak BAW (4:1:5), asam asetat 50%, dan asam klorida 1% dengan berbagai penyemprot dapat dilihat pada Tabel 4.4 berikut.
Tabel 4.4 Data harga Rf kromatografi kertas EEKBL
Pada Tabel 4.4 di atas terlihat yang memberikan kromatogram terbaik adalah fase gerak BAW dengan 1 noda bila dilihat secara visual setelah disemprot dengan uap NH3, AlCl3, dan FeCl3. Setelah dilihat di UV 366 nm akan
berfluoresensi warna biru, ungu, serta kuning lemah. Disemprot uap NH3 terdapat
noda berwarna kuning dan dengan AlCl3 berwarna jingga menunjukkan adanya
senyawa flavonoid. Penampak bercak FeCl3 terdapat noda warna biru kehitaman
jika dilihat secara visual yang menjukkan bahwa terdapat senyawa tanin. Gambar kromatogram dapat dilihat pada Lampiran 11 Halaman 75.
Harga Rf Penampak noda
Fase Gerak
BAW Asam Asetat 50% Asam Klorida 1%
Visual NH3 0,75 0,71 0,15
AlCl3 0,76 0,72 0,15
FeCl3 0,76 0,62 0,13
UV 366 0,65
0,72 0,93
0,16 0,50
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan dapat disimpulkan: a. Hasil karakteristik simplisia kulit batang landoyung memenuhi persyaratan
yang tertera dalam Materia Medika Indonesia. Hasil karakteristik ekstrak etanol kulit batang landoyung memenuhi persyaratan Farmakope Herbal Indonesia.
b. Hasil pengukuran aktivitas antioksidan dengan metode pemerangkapan radikal bebas 1,1-diphenyl-2-picrylhydrazil (DPPH), EEKBLmenunjukkan kekuatan antioksidan dalam kategori sangat kuat dengan nilai IC50 30,94
µg/mL.
c. Hasil skrining fitokimia simplisia kulit batang landoyung menunjukkan adanya senyawa kimia golongan alkaloid, saponin, flavonoid, tanin, dan steroid/triterpenoid. Hasil KLT EEKBL mengandung 11 senyawa triterpenoid dengan penampak bercak LB dan 8 senyawa alkaloid dengan penampak bercak Dragendorf serta hasil KKt EEKBL mengandung 3 senyawa flavonid dengan penampak bercak uap ammonia dan 1 senyawa tanin dengan FeCl3.
5.2 Saran
BAB II
TINJAUAN PUSTAKA
2.1Uraian Tanaman Landoyung
2.1.1 Morfologi
Litsea cubeba (Lour.) Pers. berupa pohon dengan diameter batang 6-20 cm, serta tinggi pohon 5 – 10 meter (Marina, 2015). Batangnya tegak, berkayu, bulat, percabangan simpodial, putih kotor. Daun berbentuk tunggal, lonjong, tepi rata ujung runcing, pangkal meruncing, pertulangan menyirip, panjang 10-14 cm, lebar 7-9 cm, berwarna hijau. Bunganya majemuk, bentuk malai, berkelamin dua, kelopak hijau muda berbentuk mangkok, berbulu halus, mahkota bulat melengkung, kepala sari bulat berwarna hijau kehitaman. Memiliki buah bulat, keras, hitam. Bijinya bulat berwarna putih kotor. Akarnya tunggang berwarna coklat kehitaman (Hutapea, 1994).
2.1.2Habitat
Menurut Hutapea (1994), klasifikasi tumbuhan landoyung sebagai berikut:
Kerajaan : Plantae
Divisi : Spermatophyta Sub divisi : Angiospermae Kelas : Dicotyledoneae Bangsa : Rhamnales Suku : Lauraceae Marga : Litsea
Jenis : Litsea cubeba (Lour.) Pers. 2.1.4 Sinonim
Sinonim dari Litsea cubeba (Lour.) Pers. adalah Litsea citrate BL., Theterantera citrate Ness., dan Theterentera pollyantha Wall (Prapti, 2008). 2.1.5 Nama asing
Litsea cubeba (Lour.) Pers. di China dikenal dengan May Chang (Syamsul dan Rodame, 2015).
2.1.6Nama daerah
Litsea cubeba (Lour.) Pers. mempunyai nama lain seperti: krangean (Jawa tengah), ki lemo (Jawa barat), Attarasa (Sumatra utara), sedangkan daerah Kalimantan khususnya pada suku Dayak Kenyan dikenal dengan nama balangla (Marina, dkk., 2015).
2.1.7 Manfaat
a. Kulit sebagai bahan minyak atsiri, pembuat parem, obat penurun panas, obat sakit perut, tonikum, dan obat penawar racun.
b. Daun sebagai obat demam, sakit perut, dan penawar racun.
c. Buah sebagai bahan minyak atsiri, buah muda sebagai bahan sambal, bumbu bandrek, bahan jamu untuk vertigo, dan lemas otot.
d. Batang cabang sebagai alat untuk mengusir binatang berbisa
f. Akar dan cabang sebagai obat sakit pencernaan, sakit kepala, sakit otot, sakit saat menstruasi, dan obat mabuk perjalanan.
2.1.8 Kandungan kimia
Kulit segar kering udara mengandung 1,25% minyak atsiri yang terdiri dari sitronelal dan sitral, serta mengandung 0,4% alkaloid berupa laurotetanin (Heyne, 1987). Buah Litsea mengandung minyak esensial yang biasa disebut may chang oil. Kulit batang dan daun mengandung saponin, flavonoid dan tanin (Hutapea, 1994). Susunan minyak Litsea cubeba asal Indonesia memiliki konsentrasi Sineol 30%, Sitronellal 0,94%, Linallol 8,95% dan Sitral 16,02%. Penyulingan kulit kayu segar kering angin 2 kg menghasilkan 25 ml minyak atsiri Penyulingan 100 grambuah l menghasilkan 3,9 ml minyak atsiri (Heryati, dkk., 2009).
2.2 Ekstraksi
lain yaitu:
2.2.1 Cara dingin 2.2.1.1Maserasi
Maserasi adalah proses penyarian simplisia dengan cara perendaman selama 5-12 hari menggunakan pelarut dengan sesekali pengadukan pada temperatur kamar. Maserasi yang dilakukan pengadukan secara terus-menerus disebut maserasi kinetik sedangkan yang dilakukan pengulangan panambahan pelarut setelah dilakukan penyaringan terhadap maserat pertama dan seterusnya disebut remaserasi (Cechinel, 2012).
2.2.1.2Perkolasi
Perkolasi adalah proses penyarian simplisia dengan pelarut yang selalu baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada temperatur kamar. Proses perkolasi terdiri dari tahap pelembaban bahan, tahap perendaman antara, tahap perkolasi sebenarnya (penetesan/penampungan ekstrak) terus-menerus sampai diperoleh perkolat yang jumlahnya 1-5 kali bahan (Raaman, 2006).
2.2.2 Cara panas 2.2.2.1Refluks
Refluks adalah proses penyarian simplisia dengan menggunakan alat pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik (Mohan, 2013).
2.2.2.2Digesti
Digesti adalah proses penyarian dengan menggunakan air pada temperatur lebih tinggi daripada temperatur ruangan, yaitu secara umum dilakukan pada temperatur 40-60°C selama 2-6 jam (Cechinel, 2012).
2.2.2.3Sokletasi
Sokletasi adalah proses penyarian dengan menggunakan pelarut yang selalu baru, dilakukan dengan menggunakan alat soklet sehingga menjadi ekstraksi kontinu dengan pelarut relatif konstan dengan adanya pendingin balik (Depkes RI., 2000). Sampel dan pelarut ditempatkan dalam wadah yang terpisah. Pelarut akan menguap sesuai dengan tiitik didihnya dan akan membasahi larutan sampel. Hasil sari akan mengisi sifon sampai tercapai satu siklus. Keuntungannya adalah banyaknya bagian tanaman yang akan terlarut dengan kondisi pemanasan. Kelemahannya tidak dapat digunakan untuk yang tidak tahan pemanasan (Nikhal, et al., 2010).
2.2.2.4Infudasi
Infudasi adalah proses penyarian dengan menggunakan pelarut air pada temperatur 90°C selama 15 menit (Titiek, dkk., 2011).
2.2.2.5Dekoktasi
Radikal bebas adalah setiap molekul yang mengandung satu atau lebih elektron yang tidak berpasangan. Radikal bebas sangat reaktif dan dengan mudah menjurus ke reaksi yang tidak terkontrol, menghasilkan ikatan dengan DNA, protein, lipida, atau kerusakan oksidatif pada gugus fungsional yang penting pada biomolekul ini. Radikal bebas juga terlibat dan berperan dalam patologi dari berbagai penyakit degeneratif, yakni kanker, aterosklerosis, jantung koroner, katarak, dan penyakit degeneratif lainnya (Silalahi, 2006).
Pembentukan radikal bebas dan reaksi oksidasi pada biomolekul akan berlangsung sepanjang hidup. Terbentuk akibat hilangnya maupun penambahan elektron dilintasannya pada saat terputusnya ikatan kovalen atom atau molekul bersangkutan sehingga bersifat amat reaktif. Radikal bebas yang sangat berbahaya dalam makhluk hidup antara lain adalah golongan hidroksil (OH-), superoksida (O-2), nitrogen monooksida (NO), peroksidal (RO-2), peroksinitrit (ONOO-), asam hipoklorit (HOCl), hidrogen peroksida (H2O2) (Kosasih, 2004).
2.4Antioksidan
Antioksidan adalah senyawa yang mempunyai struktur molekul yang dapat memberikan elektronnya kepada molekul radikal bebas dan dapat memutus reaksi berantai dari radikal bebas. Peran positif dari antioksidan adalah membantu sistem pertahanan tubuh bila ada unsur pembangkit penyakit memasuki dan menyerang tubuh (Winarsi, 2007).
1) Antioksidan primer yang berfungsi untuk mencegah pembentuk senyawa radikal baru karena dapat merubah radikal bebas yang ada menjadi molekul yang berkurang dampak negatifnya, sebelum radikal bebas ini sempat bereaksi. Contohnya adalah enzim superoksida dismutase (SOD), glutathion peroksidase, dan katalase.
2) Antioksidan sekunder merupakan senyawa yang berfungsi menangkap senyawa serta mencegah terjadinya reaksi berantai. Contohnya adalah vitamin E, vitamin C, dan betakaroten yang dapat diperoleh dari buah-buahan.
3) Antioksidan tersier merupakan senyawa yang memperbaiki kerusakan sel-sel dan jaringan yang disebabkan radikal bebas. Contoh enzim yang memperbaiki DNA pada inti sel adalah metionin sulfoksidan reduktase. Adanya enzim ini untuk mencegah penyakit misalnya kanker.
2.4.1 Sumber-Sumber Antioksidan
Berdasarkan sumber perolehannya ada 2 macam antioksidan, yaitu antioksidan alami dan antioksidan buatan (sintetik) (Senja, dkk., 2014).
2.4.1.1Antioksidan alami
Antioksidan alami merupakan jenis antioksidan yang berasal dari tumbuhan dan hewan (Purwaningsih, 2012). Antioksidan alami umumnya mempunyai gugus hidroksi dalam struktur molekulnya. Antioksidan alami yang berasal dari tumbuhan adalah senyawa fenolik berupa golongan betakaroten, flavonoid, tanin, vitamin C dan vitamin E (Isnindar, dkk., 2011).
A.Betakaroten
suplemen. (Kosasih, 2004). B.Flavonoid
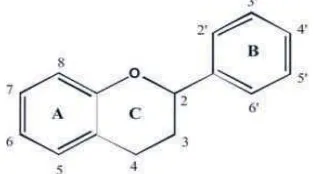
[image:67.595.229.386.295.382.2]Senyawa flavonoid adalah senyawa polifenol yang mempunyai 15 atom karbon yang tersusun dalam konfigurasi C6 -C3 -C6, yaitu dua cincin aromatik yang dihubungkan oleh 3 atom karbon yang dapat atau tidak dapat membentuk cincin ketiga (Markham, 1988).Struktur dasar flavonoid dapat dilihat pada Gambar 2.1 berikut:
Gambar 2.1 Struktur dasar flavonoid(Silalahi, 2006).
Flavonoid bersifat antioksidan yang berperan sebagai penangkap radikal bebas karena mengandung gugus hidroksil. Sebagai reduktor, flavonoid dapat bertindak sebagai donor hidrogen terhadap radikal bebas (Silalahi, 2006).
C.Tanin
Tanin merupakan golongan metabolit fenolik yang unik dan memiliki berat molekul yang tinggi. Tersebar di daun, akar, dan buah untuk melindungi tanaman (Hudaya, dkk., 2015). Senyawa aktif metabolit sekunder yang diketahui mempunyai beberapa khasiat yaitu sebagai astringen, anti diare, anti bakteri dan antioksidan (Malangngi, dkk., 2012).
D.Vitamin C
Vitamin C atau asam askorbat mempunyai berat molekul 176,13 dengan rumus bangun C6H8O6, dengan titik lebur 190-192°C. Asam askorbat
atau agak kuning, tidak berbau, rasa asam, oleh pengaruh cahaya lambat laun menjadi gelap, dalam larutan cepat teroksidasi. Kelarutannya mudah larut dalam air, agak sukar larut dalam etanol (95%) P, praktis tidak larut dalam kloroform P, dalam eter P dan dalam benzen P. Penyimpanan dalam wadah tertutup rapat, terlindung dari cahaya. Vitamin C mengandung khasiat sebagai antiskorbut (Depkes RI., 1979).
Gambar 2.2 Rumus bangun vitamin C (Iqbal, et al., 2004).
Vitamin C berperan dalam pencegahan penyakit jantung koroner, mencegah kanker, meningkatkan sistem kekebalan tubuh terhadap infeksi virus dan bakteri, dan berperan dalam regenerasi vitamin E (Silalahi, 2006).Asam askorbatapabila terkena pengaruh oksigen, zat-zat pengoksidasi lemah, atau oleh pengaruh enzim asam askorbat oksidase, akan mempermudah senyawa ini mengalami oksidasi menjadi asam dehidroaskorbat, karena memiliki sifat mudah teroksidasi, asam askorbat digunakan sebagai antioksidan (Iqbal, et al., 2004). E. Vitamin E
(Pekiner, 2003).
2.4.1.2 Antioksidan sintetik
Antioksidan sintetik yang diizinkan dan umum digunakan untuk makanan yaitu BHA (Butylated hydroxy anisole), BHT ( Butylated hydroxy toluene), dan profil galat. Saat ini penggunaan antioksidan sintetik mulai dibatasi karena ternyata dari hasil penelitian yang telah dilakukan bahwa antioksidan sintetik seperti BHT (Butylated Hydroxy Toluena) ternyata dapat meracuni binatang percobaan dan bersifat karsinogenik (Zuhra, dkk., 2008). Butylated Hydroxyanisol (BHA) dapat menimbulkan akibat buruk terhadap kesehatan manusia seperti gangguan fungsi hati, paru, mukosa usus dan keracunan. Penggunaan antioksidan sintetik dapat menimbulkan keracunan pada dosis tertentu, menurut rekomendasi Food and Drug Administration dosis antioksidan sintetik yang diizinkan dalam pangan adalah 0,01%- 0,1% (Panagan, 2011).
2.4.2 Penentuan Aktivitas Antioksidan
Untuk menentukan aktivitas antioksidan secara in-vitro dapat dilakukan dengan beberapa metode antara lain:
2.4.2.1Metode DPPH (1,1-difenil-2-pikrilhidrazil)
[image:69.595.258.384.646.711.2]Pada tahun 1922, Goldschmidt dan Renn menemukan senyawa berwarna ungu radikal bebas stabil DPPH. Berwarna sangat ungu dan tidak larut dalam air (Ionita, 2005).