PENGARUH PENGGUNAAN
FUNGISIDA TERHADAP PERKECAMBAHAN SPORA
FUNGI MIKORIZA ARBUSKULA
TESIS
Oleh:
SUDIRMAN
077030022/BIOPROGRAM MAGISTER BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PENGARUH PENGGUNAAN
FUNGISIDA TERHADAP PERKECAMBAHAN SPORA
FUNGI MIKORIZA ARBUSKULA
TESIS
Diajukan Untuk Melengkapi Tugas dan Memenuhi Syarat Memperoleh Gelar Magister Sains dalam Program Magister Biologi Fakultas Matematika
dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Oleh
SUDIRMAN
077030022/BIOPROGRAM MAGISTER BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
Judul Tesis : PENGARUH PENGGUNAAN FUNGISIDA TERHADAP PERKECAMBAHAN SPORA FUNGI MIKORIZA ARBUSKULA
Nama Mahasiswa : Sudirman Nomor Pokok : 077030022 Program Studi : Biologi
Menyetujui Komisi Pembimbing
Dr. Delvian, SP. MP. Prof. Dr. Dwi Suryanto, MSc. Ketua Anggota
Ketua Program Studi Dekan
Prof. Dr. Dwi Suryanto, MSc. Prof. Dr. Eddy Marliyanto, MSc.
PERNYATAAN ORISINALITAS
PENGARUH PENGGUNAAN
FUNGISIDA TERHADAP PERKECAMBAHAN SPORA FUNGI MIKORIZA ARBUSKULA
T E S I S
Dengan ini saya nyatakan bahwa saya mengakui semua karya tesis/disertasi ini adalah hasil kerja saya sendiri kecuali kutipan dan ringkasan yang tiap satunya telah dijelaskan sumbernya dengan benar.
Medan, 30 Desember 2009
Sudirman
Telah diuji pada
Tanggal : 30 Desember 2009
PANITIA PENGUJI TESIS
Ketua : Dr. Delvian, SP. MP. Anggota : 1. Prof. Dr. Dwi Suryanto, MSc.
ABSTRAK
Penelitian pengaruh penggunaan fungisida terhadap perkecambahan spora FMA telah dilakukan. Tujuan untuk mengetahui pengaruh fungisida terhadap perkecambahan spora FMA. Untuk menguji pengaruh fungisida digunakan rancangan acak lengkap faktorial. Dua fungisida dengan bahan aktif berbeda yaitu asam fosfit konsentrasi 0.04%, 0.12%, 0.20% dan metalaksil konsentrasi 0.0525%, 0.0875%, 0.1225%. Air digunakan sebagai kontrol. Dua fungisida ini digunakan kepada dua jenis spora yaitu Gigaspora margarita dan Acaulospora tuberculata. Hasil menunjukkan bahwa peningkatan konsentrasi dari kedua fungisida memberikan pengaruh menghambat namun tidak mencegah perkecambahan Gigaspora margarita yang ada tanaman inangnya maupun yang tidak ada tanaman inangnya. Pada sisi lain, spora Acaulospora tuberculata yang tidak ada tanaman inangnya tidak berkecambah, tapi Acaulospora tuberculata
yang ada tanaman inangnya berkecambah.
ABSTRACT
A study on effect of fungicide application to germination of FMA spore has been carried out. The objective of research is to know the effect of fungicide application to the germination of FMA spore. To examine the fungicide effect, a complete factorial random design was used. Two fungicides with different active compounds, i.e., phosphit acid and metalaxil were used at concentrations of 0.04%, 0.12%, 0.20% and 0.0525%, 0.0875%, 0.1225%, respectively. Water was
used as control. These two fungicides were applied for 2 spore types, i.e., Gigaspora margarita and Acaulospora tuberculata. The result showed that
increasing concentration of the two fungicides gave an effect on inhibiting germination but not preventing the germination of Gigaspora margarita without host plant or with host plant. On the other hand, spore of Acaulospora tuberculata
did not germinate without host plant. However it still germinated with host plant. Keywords: Gigaspora margarita, Acaulospora tuberculata, fungicide,
KATA PENGANTAR
Syukur Alhamdulillah saya ucapkan kehadirat Allah SWT atas rahmat kesehatan dan kesempatan yang telah diberikan Nya sehingga penelitian tesis berjudul Pengaruh Penggunaan Fungisida Terhadap Perkecambahan Spora Fungi Mikoriza Arbuskula ini dapat terselesaikan.
Selama pelaksanaan penelitian ini penulis banyak mendapat bantuan baik moril, material maupun spiritual. Untuk itu penulis menyampaikan terimakasih kepada :
1. Dr. Delvian, SP. MP. selaku Ketua Komisi Pembimbing (Pembimbing I) dan Prof. Dr. Dwi Suryanto, MSc. selaku Pembimbingn II, sekaligus sebagai Ketua Departemen Biologi, atas bimbingan dan arahan yang telah diberikan kepada penulis.
2. Prof. Dr. Erman Munir, MSc. sebagai Penguji I serta Dr. Deni Elfiati, SP. MP. sebagai Penguji II yang telah banyak memberikan masukan dalam penyempurnaan tesis ini.
3. Pemerintah Provinsi Sumatera Utara dalam hal ini Badan Perencanaan Pembangunan Daerah Sumatera Utara (BAPPEDASU) yang telah memberikan bantuan finansial kepada penulis untuk mengikuti perkuliahan Pasca Sarjana ini.
4. Istri tercinta Dra. Farida Nadeak dan anak-anak tersayang Widiya Sari Sufa, Muhammad Ridho Sufa, Hafizah Ilmi Sufa, dan Imam Penggowo Darojatun Sufa yang telah berperan sebagai sumber motivasi dan inspirasi dalam penyelesaian studi ini.
5. Orang tua tercinta Senun dan Bariyah juga saudara kandung serta seluruh keluarga dan teman yang telah memberikan motivasi dan doa sehingga saya dapat menyelesaikan S2 ini.
Akhirnya saya menyadari bahwa penelitian ini masih jauh dari sempurna oleh karena itu kritik dan saran dari semua pihak sangat diharapkan. Dengan demikian akan menjadikan tesis ini lebih sempurna dan lebih bermanfaat tidak hanya bagi saya sendiri tapi juga bagi orang lain.
RIWAYAT HIDUP
Penulis dilahirkan di Kampung Penaga, Kecamatan Bandar Khalifah, Kabupaten Serdang Bedagai, Provinsi Sumatera Utara pada tanggal 28 Oktober 1963, anak keempat dari delapan bersaudara, dari pasangan Senun (ayah) dan Bariyah (ibu).
Penulis menamatkan pendidikan formal SD Negeri 102076 Kampung Juhar Kabupaten Serdang Bedagai pada 30 Nopember 1976, SMP Negeri Manggadua Kabupaten Serdang Bedagai pada 7 Mei 1980, SMA Negeri 1 Tebing Tinggi Provinsi Sumatera Utara pada 28 April 1983, S-1 Pendidikan Biologi IKIP Medan pada 20 Juni 1988, S-1 Budidaya Pertanian UMTS Padangsidimpuan pada 28 September 1995, dan S2 Biologi Universitas Sumatera Utara pada 30 Desember 2009.
DAFTAR TABEL
Tabel Judul Halaman
1. Hari mulai berkecambah spora FMA (hari) ... 20
2. Persentase perkecambahan spora FMA (%) ... 22
3. Laju perkecambahan spora FMA (% / hari)... 22
DAFTAR GAMBAR
Gambar Judul Halaman
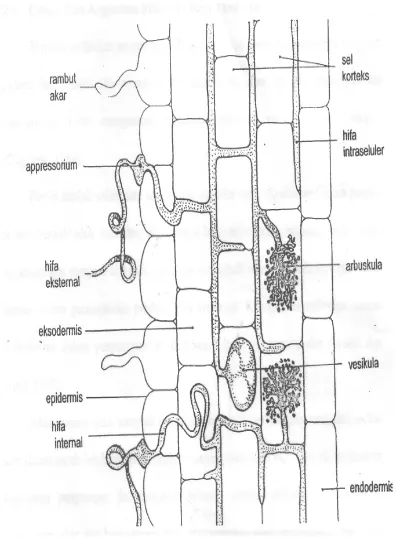
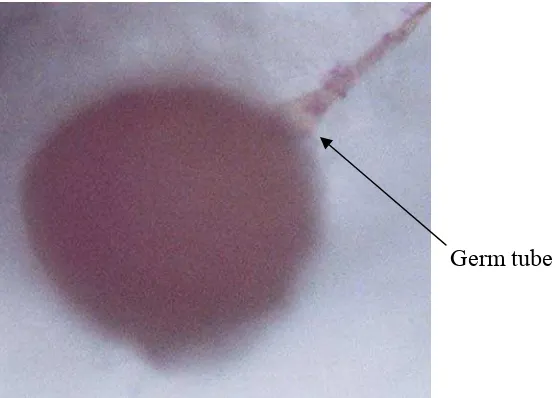
1. Penampang membujur akar terinfeksi FMA (Brundrett dkk., 1996) ... 5 2. Phylogeny perkembangan dan taksonomi ordo Glomeromycota
(sumber: INVAM, 2009)... 6 3. Tabung perkecambahan (germ tube) spora FMA perlakuan F3M1
DAFTAR LAMPIRAN
Lampiran Judul Halaman
1.a Hari mulai berkecambah (hari) ... 32
1.b Data transformasi V(y+0,5) hari mulai berkecambah (hari)... 33
1.c Daftar sidik ragam hari mulai berkecambah ... 34
2.a Persentase perkecambahan (%)... 35
2.b Data transformasi V(y+0,5) persentase perkecambahan (%)... 36
2.c Daftar sidik ragam persentase perkecambahan ... 37
3.a Laju perkecambahan (% / hari) ... 38
3.b Data transformasi V(y+0,5) laju perkecambahan (% / hari) ... 39
3.c Daftar sidik ragam laju perkecambahan... 40
4.a Persentase kolonisasi FMA pada akar tanaman inang (%) ... 41
ABSTRAK
Penelitian pengaruh penggunaan fungisida terhadap perkecambahan spora FMA telah dilakukan. Tujuan untuk mengetahui pengaruh fungisida terhadap perkecambahan spora FMA. Untuk menguji pengaruh fungisida digunakan rancangan acak lengkap faktorial. Dua fungisida dengan bahan aktif berbeda yaitu asam fosfit konsentrasi 0.04%, 0.12%, 0.20% dan metalaksil konsentrasi 0.0525%, 0.0875%, 0.1225%. Air digunakan sebagai kontrol. Dua fungisida ini digunakan kepada dua jenis spora yaitu Gigaspora margarita dan Acaulospora tuberculata. Hasil menunjukkan bahwa peningkatan konsentrasi dari kedua fungisida memberikan pengaruh menghambat namun tidak mencegah perkecambahan Gigaspora margarita yang ada tanaman inangnya maupun yang tidak ada tanaman inangnya. Pada sisi lain, spora Acaulospora tuberculata yang tidak ada tanaman inangnya tidak berkecambah, tapi Acaulospora tuberculata
yang ada tanaman inangnya berkecambah.
ABSTRACT
A study on effect of fungicide application to germination of FMA spore has been carried out. The objective of research is to know the effect of fungicide application to the germination of FMA spore. To examine the fungicide effect, a complete factorial random design was used. Two fungicides with different active compounds, i.e., phosphit acid and metalaxil were used at concentrations of 0.04%, 0.12%, 0.20% and 0.0525%, 0.0875%, 0.1225%, respectively. Water was
used as control. These two fungicides were applied for 2 spore types, i.e., Gigaspora margarita and Acaulospora tuberculata. The result showed that
increasing concentration of the two fungicides gave an effect on inhibiting germination but not preventing the germination of Gigaspora margarita without host plant or with host plant. On the other hand, spore of Acaulospora tuberculata
did not germinate without host plant. However it still germinated with host plant. Keywords: Gigaspora margarita, Acaulospora tuberculata, fungicide,
BAB I PENDAHULUAN 1.1 Latar Belakang
Fungi patogen hidup berasosiasi parasitik dengan tanaman pertanian. Asosiasi parasitik ini menimbulkan kerugian yang besar bagi petani yaitu merusak benih dorman, benih di persemaian, dan tanaman (akar, batang, daun, bunga dan buah). Hal yang biasa dilakukan petani dalam memutuskan asosiasi parasitik antara tumbuhan dan fungi patogen adalah dengan menggunakan fungisida. Fungisida merupakan racun kimia yang diracik untuk membunuh fungi penyebab penyakit tanaman (Rahayu dan Akbar, 2003).
Penggunaan fungisida dapat menimbulkan masalah lingkungan, residunya tidak terdegradasi oleh organisma kecuali mikroorganisma tertentu, akibatnya residu fungisida terakumulasi dalam sel/jaringan organisma dengan konsentrasi berbeda-beda antara tingkat tropik yaitu dari tingkat tropik terbawah sampai tingkat tropik teratas terjadi peningkatan konsentrasi residu. Manusia berpeluang menempati tingkat tropik teratas berarti berpeluang pula sel/jaringan tubuhnya mendapat residu konsentrasi tertinggi.
meningkatkan ketahanan tanaman terhadap stres kekeringan (Setiadi, 1993). Dengan demikian berarti penggunaan fungisida menimbulkan kerugian terhadap keanekaragaman dan aktivitas mikroba tanah bermanfaat seperti FMA.
Penggunaan fungisida walaupun telah banyak disebut-sebut menimbulkan pengaruh buruk terhadap lingkungan, namun banyak pengguna fungisida yang tidak bersedia meninggalkan fungisida untuk beralih ke jenis pengendali hayati. Permasalaahan tersebut disebabkan yang pertama hambatan pertumbuhan dan perkembangan fungi patogen yang dikendalikan menggunakan fungisida lebih cepat dapat diamati hasilnya daripada menggunakan pengendali hayati, dan yang kedua pengguna fungisida tidak merasakan akibat buruk penggunaan fungisida berupa kerugian secara langsung dari sisi nilai nominal hasil usaha pertaniannya.
Hasil penelitian tentang pengaruh penggunaan fungisida terhadap pertumbuhan dan aktifitas FMA masih ditemukan perbedaan yaitu sebagaimana dikemukakan Carrencho dkk. (2000) bahwa ada fungisida yang sifatnya menghambat pertumbuhan dan aktifitas FMA dan ada pula yang justru sebaliknya yaitu mempercepat. Adanya fungisida yang bisa menghambat dan ada yang bisa mempercepat pertumbuhan dan aktifitas FMA inilah membuat penulis tertarik melakukan penelitian pengaruh penggunaan fungisida terhadap pertumbuhan dan aktifitas FMA.
itu penelitiannya dibatasi menjadi pengaruh penggunaan fungisida terhadap perkecambahan spora FMA.
1.2 Perumusan Masalah
Apakah konsentrasi fungisida bahan aktif asam fosfit dan bahan aktif metalaksil berpengaruh terhadap perkecambahan spora FMA (Gigaspora margarita, Acaulospora tuberculata)?
1.3 Tujuan
Menguji pengaruh konsentrasi fungisida bahan aktif asam fosfit dan bahan aktif metalaksil terhadap perkecambahan spora FMA (Gigaspora margarita,
Acaulospora tuberculata).
1.4 Hipotesis
Konsentrasi fungisida bahan aktif asam fosfit dan bahan aktif metalaksil berpengaruh terhadap perkecambahan spora FMA Gigaspora margarita, spora
BAB II
TINJAUAN PUSTAKA
2.1 Mikoriza
Mikoriza merupakan asosiasi mutualistik antara jamur dengan akar tumbuhan tingkat tinggi (Smith dan Read, 1997). Mikoriza banyak mendapat perhatian karena kemampuannya berasosiasi membentuk simbiosis mutualistik dengan hampir 80% spesies tanaman (Steussy, 1992)
Pertumbuhan dan aktivitas mikoriza berbeda sesuai spesies dan lingkungan mikoriza (Hetrick, 1984). Sejalan dengan itu Abbott dan Robson (1984) menyatakan setiap spesies mikoriza mempunyai innate effectiveness atau kemampuan spesifik dari setiap spesies mikoriza untuk meningkatkan pertumbuhan tanaman pada kondisi tanah yang kurang menguntungkan. Faktor kemampuan spesifik dimaksud adalah kemampuan membentuk hifa yang ekstensif di dalam tanah, membentuk infeksi hifa yang ekstensif pada seluruh sistem perakaran yang berkembang dari suatu tanaman, menyerap fosfor dari larutan tanah oleh hifa dan lamanya mekanisme transpor sepanjang hifa ke dalam
akar tanaman.
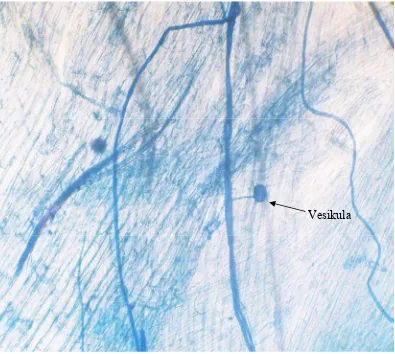
menggelembungnya hifa jamur mikoriza fungsinya sebagai organ penyimpan makanan (Bonfante dan Fasolo, 1984). Untuk lebih jelasnya bentuk dari arbuskula dan vesikula berikut ditampilkan dalam Gambar 1.
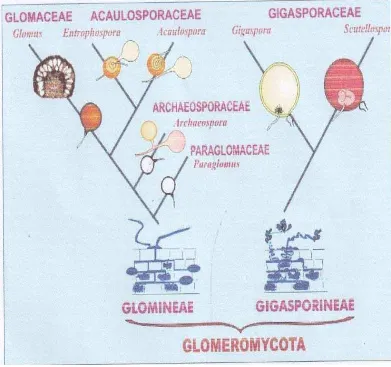
Fungi mikoriza arbuskula merupakan endomikoriza tergolong ke dalam ordo
Glomeromycota yang kemudian dibedakan menjadi 2 sub ordo yaitu
Gigasporineae dan Glominae. Sub ordo Gigasporineae memiliki 1 famili yaitu
Gigasporaceae dengan 2 genus yaitu genus Gigaspora dan Scutelospora. Sub ordo Glominae memiliki 4 famili yaitu famili Glomaceae dengan genus Glomus, famili Acaulosporaceae dengan genus Acaulospora dan Entrophospora, famili
Paraglomaceae dengan genus Paraglomus dan famili Archaeosporaceae dengan genus Archaeospora (INVAM, 2009). Untuk memperjelas klasifikasi ordo
Glomeromycota berikut ditampilkan dalam Gambar 2.
Gambar 2. Phylogeny perkembangan dan taksonomi ordo Glomeromycota
2.2 Manfaat Mikoriza Bagi Tanaman
Keuntungan yang didapat dari simbiosis mutualistik antara jamur dan tanaman adalah tanaman memberi karbon untuk jamur dan jamur memberi peningkatan kemampuan penyerapan fosfat, mineral dan nutrisi lainnya bagi tumbuhan (Anonimus, 2006). Peningkatan pengambilan nutrisi oleh akar tanaman bermikoriza terjadi karena perakaran menjadi tambah panjang, diameter tambah besar, sehingga permukaan absorbsi akar semakin luas (Abbott dan Robson, 1984). Mikoriza membantu pertumbuhan tanaman dengan meningkatkan penyerapan fosfat. Fosfat merupakan unsur essensial yang diperlukan tanaman dalam jumlah banyak. Sementara pada tanah asam, fosfat dalam bentuk tidak tersedia bagi tanaman. Mikoriza pada akar tanaman mampu mengubah fosfat yang tidak tersedia bagi tanaman menjadi tersedia (Powell dan Bagyaraj, 1984).
Akar tanaman yang bermikoriza mampu menghambat infeksi patogen melalui mekanisme mikoriza menciptakan lingkungan yang tidak menguntungkan buat pertumbuhan patogen dengan jalan menggunakan karbohidrat dan eksudat akar yang lebih. Dengan cara lain mikoriza juga mengeluarkan zat yang dapat mematikan patogen (Abbott dan Robson, 1984).
2.3 Perkecambahan Spora Mikoriza
1. Pengaruh suhu
Perkecambahan spora Gigaspora coralloidea (Schenck dan Schroder, 1975) terjadi pada suhu optimum 34oC, Gigaspora margarita (Clark, 1978) dan
Gigaspora gigantea (Koske, 1981) kedua spora tidak berkecambah pada suhu 15oC dan berkecambah pada suhu optimum 31oC, Glomus epigaeum (Daniel dan Trappe, 1980) berkecambah pada suhu 18-25oC, Glomus mosseae (Schenck dan Schroder, 1975) berkecambah pada suhu optimum 20oC, Glomus caledonium
(Tommerup dan Kidby, 1980) spora mati pada suhu 60oC untuk waktu 1-5 menit. Suhu berpengaruh pada perkecambahan spora mikoriza. Hal itu dimungkinkan lebih disebabkan oleh secara genetis ada perbedaan ketahanan enzim masing-masing spesies mikoriza terhadap suhu.
2. Pengaruh kelembaban
Percobaan Daniel dan Trappe (1980) pada perkecambahan Glomus epigaeum menggunakan lempung berdebu dengan berbagai kandungan air, menunjukkan bahwa perkecambahan paling baik pada kandungan air mulai air jenuh sampai dengan kapasitas lapang (0-1/3 bar). Perkecambahan menurun drastis mulai di atas kapasitas lapang sampai dengan titik layu permanen (di atas 1/3-15 bar) dan perkecambahan tidak ada sama sekali mulai di atas titik layu permanen sampai dengan koefisien higroskopis (di atas 15-31 bar).
air selain merupakan komponen dasar pembentukan zat makanan, air juga berfungsi membantu mengedarkan nutrisi ke bagian jaringan yang aktif membelah dan sebagai media berlangsungnya reaksi enzimatik proses perkecambahan spora.
3. Pengaruh pH
Perkecambahan spora fungi mikoriza arbuskula pH optimumnya berbeda-beda. Glomus mosseae mengalami perkecambahan dengan baik pada pH 6,0-9,0,
Gigaspora coralloidea dan Gigaspora heterogama pada pH 4,0-6,0, Glomus epigaeum pada pH 6,0-8,0 (Daniel dan Trappe, 1980).
Powell dan Bagyaraj (1984) mengemukakan antara pH dengan perkecambahan spora fungi mikoriza arbuskula terdapat hubungan yaitu pH berpengaruh pada aktivitas enzim, aktivitas enzim berpengaruh pada perkecambahan. Selain itu pH rendah atau asam juga berpengaruh menjadi tidak tersedianya fosfat sebagai unsur penting dalam pembelahan sel pada proses perkecambahan spora mikoriza.
4. Pengaruh mikroba tanah
Kegagalan perkecambahan dikemukakan Daniel dan Trappe (1980) karena pada tanah steril tidak ada kehidupan berbagai mikroba tanah termasuk bakteri endofitik diazotrop yang diharapkan mampu memproduksi zat perangsang perkecambahan spora mikoriza. Hal yang serupa dikemukakan (Hetrick, 1984) bahwa peningkatan perkecambahan terjadi dikarenakan pada tanah nonsteril terdapat mikroba tanah yang memberikan zat perangsang pertumbuhan bagi perkecambahan spora mikoriza.
5. Pengaruh tanaman inang
Perkecambahan spora tidak mutlak tergantung pada tanaman inang (Giovannetti dkk., 1993), tetapi proses selanjutnya membutuhkan tanaman inang. Tanaman inang penting dalam melanjutkan pertumbuhan dan perkembangan spora mikoriza setelah berkecambah, karena tanaman inang memberi ketersediaan karbon bagi mikoriza (Anonimus, 2006). Eksudat akar tanaman inang berpengaruh positif terhadap pertumbuhan FMA dan pengaruh akan meningkat jika dikombinasi dengan CO2 konsentrasi tinggi (Be’card dan Piche’, 1989).
6. Pengaruh fungisida
Fungisida benomyl konsentrasi relatif rendah (0,001-0,1µm/ml) berpengaruh meningkatkan perkecambahan spora Glomus mosseae. Fungisida benomyl konsentrasi relatif tinggi (1-2,12µm/ml) berpengaruh menghambat perkecambahan spora Glomus mosseae. Fungisida benomyl konsentrasi relatif sangat tinggi (10-21,25µm/ml) berpengaruh menggagalkan perkecambahan spora mikoriza (Chiocchio dkk., 2000).
Berkecambahnya spora pada perlakuan yang diberi benomyl konsentrasi relatif rendah (0,001-0,1µm/ml) meningkatkan perkecambahan spora Glomus mosseae, pertama: dikarenakan pemberian fungisida dengan konsentrasi rendah tersebut masih belum menghalangi proses pindahnya air dari larutan fungisida ke larutan sel spora secara osmosis, dan kedua: pemberian fungisida tersebut diduga mengakibatkan terangsangnya tanaman inang menghasilkan eksudat akar. Terangsangnya tanaman inang menghasilkan eksudat akar dapat berpengaruh mempercepat perkecambahan spora Glomus mosseae. Hal tersebut sesuai yang dikemukakan Melin (1963) dalam Imas dkk. (1989) yaitu eksudat akar yang dikeluarkan tanaman inang dapat merangsang perkecambahan spora FMA. Eksudat yang dapat merangsang perkecambahan spora FMA tersebut kemudian dikenal dengan faktor M.
BAB III
METODOLOGI PENELITIAN 3.1 Tempat dan Waktu
Penelitian ini dilaksanakan dari bulan Juni 2009 sampai Agustus 2009 bertempat di Laboratorium Bioteknologi Hutan Departemen Kehutanan Fakultas Pertanian Universitas Sumatera Utara.
3.2 Bahan dan Alat
Bahan yang digunakan adalah spora FMA (Gigaspora margarita,
Acaulospora tuberculata), fungisida dengan bahan aktif asam fosfit dan metalaksil, bahan sterilisasi (chlorox), pasir sungai, kertas saring, kertas HVS, aquades, glukosa. Alat yang digunakan adalah saringan bertingkat, cawan petri, rak kultur, mikroskop dissecting,otoklaf, sentrifuse, pinset spora, pipet mikro.
3.3 Metode Penelitian
Penelitian ini menggunakan rancangan acak lengkap faktorial dengan 2 faktor yang diuji yaitu:
2. Perbedaan spesies spora FMA (M):
Gigaspora margarita (M1)
Acaulospora tuberculata (M2)
Kombinasi perlakuan:
F0M1: Tanpa penggunaan fungisida (0,0000%) terhadap Gigaspora margarita
F1M1: Bahan aktif asam fosfit 0,0400% terhadap Gigaspora margarita
F2M1: Bahan aktif asam fosfit 0,1200% terhadap Gigaspora margarita
F3M1: Bahan aktif asam fosfit 0,2000% terhadap Gigaspora margarita
F4M1: Bahan aktif metalaksil 0,0525% terhadap Gigaspora margarita
F5M1: Bahan aktif metalaksil 0,0875% terhadap Gigaspora margarita
F6M1: Bahan aktif metalaksil 0,1225% terhadap Gigaspora margarita
F0M2: Tanpa penggunaan fungisida (0,0000%) terhadap Acaulospora tuberculata
F1M2: Bahan aktif asam fosfit 0,0400% terhadap Acaulospora tuberculata
F2M2: Bahan aktif asam fosfit 0,1200% terhadap Acaulospora tuberculata
F3M2: Bahan aktif asam fosfit 0,2000% terhadap Acaulospora tuberculata
F4M2: Bahan aktif metalaksil 0,0525% terhadap Acaulospora tuberculata
F5M2 : Bahan aktif metalaksil 0,0875% terhadap Acaulospora tuberculata
F6M2: Bahan aktif metalaksil 0,1225% terhadap Acaulospora tuberculata
3.4 Pelaksanaan Penelitian
1. Sterilisasi alat dan bahan
Cawan petri, gelas ukur, tabung reaksi, erlenmeyer, pinset spora, pipet mikro, kertas saring, pasir sungai, dicuci bersih, dibungkus kertas HVS, dimasukkan ke dalam otoklaf pada suhu 1210C tekanan 1 atm selama 60 menit.
2. Isolasi spora
Teknik mengisolasi spora FMA menggunakan teknik tuang saring dan dilanjutkan dengan teknik sentrifugasi. Prosedur kerja teknik tuang saring yang digunakan berdasarkan Pacioni (1992), pertama adalah mencampurkan mikofer sampel sebanyak 50 g dengan 200-300 ml air dan diaduk. Selanjutnya disaring dalam satu set saringan bertingkat ukuran 710 µm, 425 µm dan 45 µm secara berurutan dari atas ke bawah. Dari saringan bagian atas disemprot dengan air kran untuk memudahkan bahan saringan lolos. Kemudian saringan paling atas dilepas dan saringan ke dua kembali disemprot dengan air kran. Setelah saringan kedua dilepas sejumlah mikofer sisa yang tertinggal pada saringan terbawah dipindahkan ke dalam tabung sentrifuse untuk dilanjutkan dengan teknik sentrifugasi.
Prosedur kerja teknik sentrifugasi yang digunakan berdasarkan Brundrett
3. Sterilisasi spora
Spora yang diperoleh dari kegiatan isolasi spora dimasukkan ke dalam tabung, kemudian dimasukkan bahan sterilan (chlorox 5%) dan disentrifugasi dengan 2500 rpm selama 2 menit. Setelah disentrifugasi sterilan yang terdapat di dalam tabung disedot dengan pipet sampai habis dan kemudian dimasukkan larutan pembilas (aquades) ke dalam tabung tersebut dan kemudian tabung dikocok/digoyang dengan tangan dan setelah itu larutan pembilas disedot. Kegiatan membilas spora dilakukan sebanyak 3 kali. Spora-spora yang telah disterilisasi diletakkan di cawan petri (wadah sementara) dan kemudian diletakkan ke dalam cawan petri perlakuan dan untuk seterusnya dilakukan pembuatan kultur.
4. Pembuatan kultur
5. Pemeliharaan
Seluruh cawan petri yang telah berisi FMA tanpa tanaman inang yang telah diberi perlakuan dimasukkan ke dalam rak kultur selama 42 hari pada suhu kamar, tanpa cahaya/ruang gelap.
3.5 Variabel yang Diamati
Tiga variabel yang diamati yaitu persentase perkecambahan, hari mulai berkecambah dan laju perkecambahan. Pengamatan dilaksanakan setiap hari dimulai hari ke-1 sampai dengan hari ke-42.
1. Hari mulai berkecambah
Dilakukan pengamatan hari mulai berkecambah menggunakan mikroskop dissecting. Spora berkecambah ditandai dengan adanya hifa. Kemudian dihitung rata-rata hari mulai berkecambah dari setiap cawan petri dengan rumus sebagai berikut :
X1 + X2 + X3 + ... + Xn
X =
n Dimana:
X : Rata-rata hari mulai berkecambah spora dalam 1 cawan petri X1: Hari mulai berkecambah data 1
X2: Hari mulai berkecambah data 2
X3: Hari mulai berkecambah data 3
Xn: Hari mulai berkecambah data n
2. Persentase perkecambahan
Laju perkecambahan dihitung dengan menggunakan rumus berikut : (100) (A1 + A2 + ... + An)
C.G =
A1T1 + A2T2 + ... + AnTn
Dimana :
A : Jumlah benih yang berkecambah pada hari tertentu. T : Waktu yang bersesuaian dengan A.
n : Jumlah hari pada penilaian/perhitungan akhir. CG: Koefisiensi perkecambahan.
4. Uji kolonisasi FMA pada akar tanaman inang
Untuk membandingkan bagaimana pengaruh konsentrasi fungisida bahan aktif asamfosfit dan metalaksil terhadap FMA yang ada tanaman inangnya menjadi penting dalam penelitian ini. Variabel yang diamati adalah persentase kolonisasi FMA pada akar tanaman inang (Zea mays L).
tuberculata) dan benih tanaman inang (Zea mays L). Setiap pot plastik yang telah berisi FMA dan tanaman inang (Zea mays L) disirami dengan air secukupnya hingga tercapai keadaan kapasitas lapang, interval penyiraman 1 kali dalam 1 hari, diberi larutan pupuk hyponex merah konsentrasi 1 gram/2 liter air, interval penyiraman 1 kali dalam 3 hari dan diberi konsentrasi larutan fungisida asam fosfit dan metalaksil sesuai perlakuan, interval penyiraman 1 kali dalam 1 minggu. Penyiraman air, larutan pupuk hyponex merah dan larutan fungisida dilakukan
sampai tanaman berumur 42 hari.
Setiap preparat diberi label perlakuan dan ulangan. Selanjutnya kolonisasi FMA pada akar tanaman inang siap diamati menggunakan mikroskop compoun.
Penghitungan persentase kolonisasi FMA pada akar tanaman inang menggunakan metode panjang akar terkolonisasi (Giovannetti dan Mosse, 1980). Potongan akar tanaman yang tersusun pada preparat diamati di bawah mikroskop compoun untuk setiap bidang pandang. Bidang pandang yang menunjukkan tanda-tanda kolonisasi (terdapat hifa dan atau arbuskula dan atau vesikula) diberi tanda (+), sedangkan yng tidak terdapat tanda-tanda kolonisasi diberi tanda negatif (-). Selanjutnya dihitung persentase kolonisasi FMA pada akar tanaman inang menggunakan rumus :
∑ bidang pandang bertanda (+)
% kolonisasi FMA pada akar tanaman = x 100%
BAB IV
HASIL DAN PEMBAHASAN 4.1 Hasil
1. Hari mulai berkecambah spora FMA
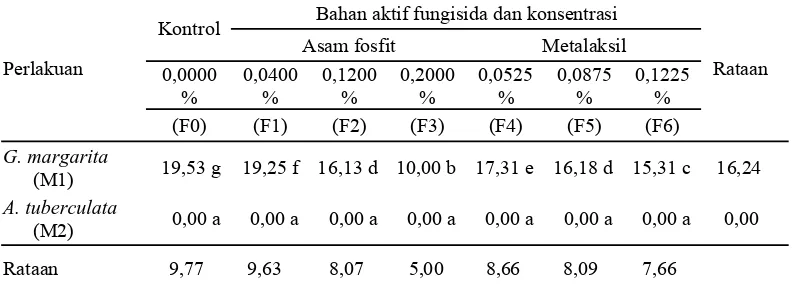
Perlakuan interaksi fungisida dan mikoriza berpengaruh sangat nyata terhadap hari mulai berkecambah spora FMA. Data dan analisis sidik ragamnya dapat dilihat pada Lampiran 1a-1c. Uji beda rataan antar perlakuan dapat dilihat pada Tabel 1.
Keterangan: Angka yang diikuti oleh huruf yang sama menunjukkan berbeda tidak nyata.
memberikan pengaruh berbeda, namun dalam penelitian ini tidak dilakukan pengujian pengaruh jenis fungisida terhadap perkecambahan spora FMA.
Penggunaan fungisida dengan semakin dinaikkan konsentrasi bahan aktifnya F0(0,0000%), F1(0,0400%), F4(0,0525%), F5(0,0875%), F2(0,1200%), F6(0,1225%), F3(0,2000%) tidak tergantung apakah yang dinaikkan konsentrasinya adalah bahan aktif asam fosfit ataukah bahan aktif metalaksil, terlihat berpengaruh terhadap hari mulai berkecambah spora Gigaspora margarita
yaitu menjadi lebih lambat beraturan 5,13; 5,20; 5,78; 6,20; 6,22; 6,53; 10,00 hari. Semakin tinggi konsentrasi bahan aktif fungisida yang digunakan menjadikan semakin sedikit jumlah air yang dapat pindah masuk secara osmosis ke dalam sel-sel spora, yang kemudian akan berpengaruh menghambat perkecambahan. Cukupnya jumlah air mutlak bagi spora untuk berkecambah yaitu diperlukan sebagai media reaksi kimia di dalam sel, mengaktifkan enzim, mengedarkan nutrisi ke seluruh bagian sel-sel spora yang sedang aktif melakukan pembelahan sel untuk berkecambah (Priadi, 2009 ).
2. Persentase perkecambahan spora FMA
Tabel 2. Persentase perkecambahan spora FMA (%)
Keterangan: Angka yang diikuti oleh huruf yang sama menunjukkan berbeda tidak nyata.
Dari Tabel 1 diketahui bahwa konsentrasi fungisida berpengaruh menghambat hari mulai berkecambah spora FMA. Sementara dari Tabel 2 diketahui bahwa konsentrasi fungisida tidak berpengaruh menurunkan persentase perkecambahan spora FMA. Dari Tabel 1 dan 2 berarti konsentrasi fungisida hanya bersifat menunda tetapi tidak mencegah perkecambahan spora FMA.
3. Laju perkecambahan spora FMA
Perlakuan interaksi fungisida dengan mikoriza berpengaruh sangat nyata terhadap laju perkecambahan spora FMA. Data dan analisis sidik ragam terdapat pada Lampiran 3a-3c. Uji beda rataan antar perlakuan terdapat pada Tabel 3. Tabel 3. Laju perkecambahan spora FMA (%/hari)
Dari Tabel 3 diketahui bahwa konsentrasi fungisida berpengaruh menghambat laju perkecambahan spora FMA. Sementara dari Tabel 2 diketahui bahwa konsentrasi fungisida tidak berpengaruh menurunkan persentase perkecambahan spora FMA. Tabel 2 dan 3 terlihat bahwa konsentrasi fungisida hanya menunda tetapi tidak mencegah perkecambahan spora FMA.
4. Persentase kolonisasi FMA pada akar tanaman inang
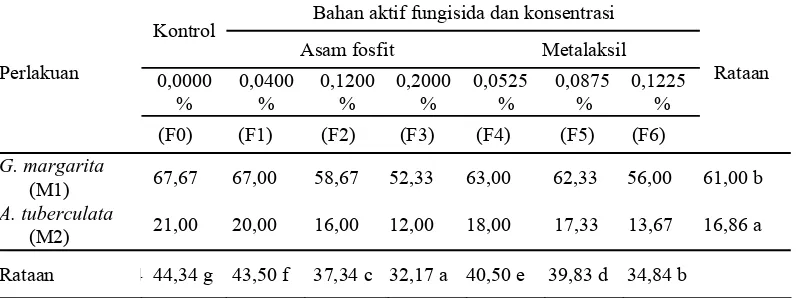
Perlakuan fungisida dan mikoriza berpengaruh sangat nyata terhadap persentase perkecambahan spora FMA. Data dan analisis sidik ragamnya dapat dilihat pada Lampiran 4a-4b. Uji beda rataan antar perlakuan dapat dilihat pada Tabel 4.
Tabel 4. Persentase kolonisasi FMA pada akar tanaman inang (%)
Bahan aktif fungisida dan konsentrasi
Keterangan: Angka yang diikuti oleh huruf yang sama dalam kolom dan lajur yang sama menunjukkan berbeda tidak nyata.
4.2 Pembahasan
Pemberian fungisida dengan semakin dinaikkan konsentrasi bahan aktifnya F0(0,0000%), F1(0,0400%), F4(0,0525%), F5(0,0875%), F2(0,1200%), F6(0,1225%), dan F3(0,2000%) berpengaruh semakin memperlambat hari mulai berkecambah spora FMA (Tabel 1), dan juga berpengaruh semakin memperlambat laju perkecambahan spora FMA (Tabel 3). Namun demikian pemberian konsentrasi fungisida tersebut tidak berpengaruh menurunkan persentase perkecambahan spora FMA (Tabel 2). Dari ketiga data tersebut berarti pengaruh konsentrasi fungisida hanya bersifat menghambat, artinya bersifat menunda perkecambahan tetapi tidak mencegah.
Terhambatnya perkecambahan spora FMA pada penelitian ini diperkirakan karena penyerapan air oleh spora FMA menjadi semakin lambat seiring kenaikan konsentrasi fungisida. Penyerapan air menjadi lambat berpengaruh terhadap perkecambahan spora FMA menjadi terhambat, sebab penyerapan air menurut Gazey dkk. (1993) merupakan salah satu tahapan dalam perkecambahan spora FMA disamping tiga tahapan lainnya yaitu pengaktifan, pemunculan tabung perkecambahan dan pembentukan hifa. Lebih lanjut menurutnya bahwa mekanisma perkecambahan spora FMA dimulai dengan masuknya air ke dalam spora, diikuti dengan terhidrasinya komponen-komponen organel dan makromolekul dalam spora, kemudian enzim menjadi aktif, sehingga aktifitas metabolisma meningkat. Dua hingga sepuluh hari setelah spora diaktifkan, tabung perkecambahan nampak dan diikuti oleh pertumbuhan hifa.
F5(0,0875%), F2(0,1200%), F6(0,1225%), F3(0,2000%) tidak tergantung apakah yang dinaikkan konsentrasinya adalah bahan aktif asam fosfit ataukah bahan aktif metalaksil, terlihat berpengaruh terhadap persentase kolonisasi spora Gigaspora margarita menjadi turun secara beraturan 67,67%; 67,00%; 63,00%; 62,33%; 58,67%; 56,00%; 52,33%. Pengaruhnya terlihat juga pada persentase kolonisasi spora Acaulospora tuberculata menjadi turun secara beraturan 21,00%; 20,00%; 18,00%; 17,33%; 16,00%; 13,67%; 12,00%. Pengaruhnya terhadap kedua spora FMA dalam hal ini Gigaspora margarita dan Acaulospora tuberculata menjadi turun secara beraturan 44,34%; 43,50%; 40,50%; 39,83%; 37,34%; 34,84%; 32,17%. Hasil penelitian tersebut sejalan dengan hasil penelitian Carrenho dkk. (2000) maupun Chiocchio dkk. (2000).
Data Tabel 2 memperlihatkan bahwa Acaulospora tuberculata pada kultur cawan petri tanpa tanaman inang sama sekali tidak berkecambah, sementara data Tabel 4 memperlihatkan bahwa Acaulospora tuberculata pada kultur pot yang diberi tanaman inang berkecambah. Dari kedua data tersebut menunjukkan adanya suatu kondisi yang dibutuhkan spora Acaulospora tuberculata untuk berkecambah yang tidak tersedia pada kultur cawan petri. Kondisi dimaksud adalah faktor karbohidrat dan faktor M (Imas dkk., 1989).
Faktor karbohidrat mempengaruhi perkecambahan spora FMA sesuai teori faktor karbohidrat yang dikemukakan Bjorkman (1942) dalam Imas dkk. (1989) menyatakan bahwa perkecambahan mikoriza sangat tergantung kepada tersedianya karbohidrat-karbohidrat sederhana yang berlebihan di dalam akar tumbuhan. Sehubungan dengan ketersediaan karbohidrat yang berlebihan, Bjorkman (1942) dalam Imas (1989) menunjukkan bahwa mikoriza berkembang dengan baik jika tumbuhan mendapat cahaya 25% lebih dari cahaya siang penuh dan status unsur hara N dan P dalam kondisi sedikit.
Untuk menunjang teori faktor karbohidrat, Bjorkman (1942) dalam Imas
dkk. (1989) melakukan percobaan pencekikan pada Pinus sylvestri umur 3 tahun dengan memakai kawat tipis digunakan untuk membatasi pengangkutan gula dari daun ke akar melalui floem. Hasil percobaan menunjukkan bahwa tanaman yang dicekik mempunyai sistem perakaran yang kerdil dan jelek.
akar-akar Pinus sylvestri dapat mengeluarkan satu atau lebih metabolit yang dapat merangsang pertumbuhan FMA yang kemudian metabolit tersebut dikenal dengan faktor M.
Tanaman inang mempengaruhi perkecambahan spora FMA juga ditunjukkan Giovanneti dkk. (1993) dari hasil observasi yang lebih detail terhadap hifa-hifa FMA diameter 20-30 µm yang mendekati akar tanaman inang. Karakteristik hifa-hifa FMA yang kontak langsung dengan akar tanaman inang berbentuk seperti kipas yang komplek dengan percabangan lateral. Sementara pencegahan hifa-hifa FMA kontak langsung dengan perakaran tanaman inang mencegah pembentukan struktur seperti kipas tersebut. Dari data observasi ini terlihat bahwa morfogenesis spesifik dari mikoriza terjadi pada kondisi bila ada tanaman inang.
Masih berkisar peranan tanaman inang terhadap kolonisasi FMA, David
BAB V
KESIMPULAN DAN SARAN 5.1 Kesimpulan
1. Konsentrasi bahan aktif fungisida yang diberikan berpengaruh hanya bersifat menghambat perkecambahan spora FMA artinya bersifat menunda tetapi tidak mencegah.
2. Ada perbedaan respon terhadap kondisi lingkungan dalam proses perkecambahan dan kolonisasi spora FMA antar mikoriza.
3. Keberadaan tanaman inang mempengaruhi perkecambahan dan kolonisasi spora FMA.
5.2 Saran
1. Perlu dilakukan penelitian tentang pengaruh penggunaan fungisida terhadap perkecambahan spora Acaulospora tuberculata pada kultur tanpa tanaman inang dengan memperpanjang waktu pengamatan perkecambahan mendekati masa dormansi spora Acaulospora tuberculata berkisar tiga bulan atau lebih. 2. Dalam penelitian ini hanya dilakukan pengujian pengaruh konsentrasi
DAFTAR PUSTAKA
Abbott LK dan AD Robson. 1984. The Effect of Mycorrhizae on Plant Growth. CRC Press. Inc. Boca Raton. Florida. Hlm: 113-130.
Anonimus. 2006. The Use of Mycorrhiza in Native Plant Production. University of Washington. USA.
Be`card G dan Piche´ Y. 1989. Fungal growth stimulation by CO2 and root
exudates in vesicular-arbuscular mycorrhizal symbiosis. Appl Environ Microbiol. 55: 2320-2325.
Bonfante dan Fasolo P. 1984. Anatomy and Morphology of V A Mycorrhizae. CRC Press. Inc. Boca Raton. Florida. Hlm: 6-33.
Brundrett MC, Bougher N, Dells B, Grove T, dan Malajczuk N. 1996. Working with mycorrhizas in forestry and agriculture. ACIAR. Canberra. 374 hlm. Carrenho Rosilaine, VLR Bononin, dan LA Graciolli. 2000. Effect of the
fungicides Fosetyl-Al and Metalaxyl on arbuscular mycorrhizal colonization of seedlings of Citrus sinensis (L.) Osbeck grafted onto C. limon (L.) Burmf. Acta Scientiarum. 22(2): 305-310.
Chiocchio V, Nadia V, Alicia EM, Ana M, Juan AO, dan Alicia G. 2000. Effect Of The Fungicide Benomyl On Spore Germination And Hyphal Length On The Arbuscular Mycorrhizal Fungus Glomus Mosseae. Spain Internatl Microbiol. 3: 173-175.
Clark CA. 1978. Requirements for germination and growth of VA mycorrhizal spores. Rhoamsted Experiment Static. Annual Report. Hlm: 234.
Daniel BA dan IM Trappe. 1980. Factor affecting spore germination of the VAM fungus Glomus epigaeun. Mycologia. 69: 237-247.
David Schwartz R, Badani H, Wininger S, Levy AA, Galili G, dan Kapulnik Y. 2001. Identification of a novel genetically controlled step in mycorrhizal colonization: Plant resistance to infection by fungal spores but not to extraradical hyphae. Plant J. 27: 561-569.
Davies FT Jr. 2000. Benefits and Opportunities with Mycorrhizal Fungi in Nursery Propagation and Production System. Dept. of Horticultural Sciences, Texas A & M University, College Station, Texas.
Gazey C, Abbott LK dan Robson AD. 1993. VA Mycorrhizal spores from three species of Acaulospora: germination, longevity and hyphal growth. Mycol Res. 97(7): 785-790.
Hetrick BAD. 1984. Ecology of VA Mycorrhizal Fungi. CRC Press. Inc. Boca Raton. Florida. Hlm: 35-56.
Imas T, Hadioetomo RS, Gunawan AW, dan Setiadi Y. 1989. Mikrobiologi Tanah II. Dirjen Dikti. PAU Bioteknologi IPB. 145 hlm.
INVAM. 2009. International ulture Collection of (Vesicular) Arbuskular Mycorrhizal Fungi. [9 Maret 2009].
Kartasapoetra AG. 2003. Teknologi Benih Pengolahan Benih dan Tuntunan Praktikum. Rineka Cipta.
Kormanik PP dan McGraw AC. 1982. Quantification of VA mycorrhizae in plant root. Dalam: NC Schenk (Ed.) Methods and principles of mycorrhizae research. The American Phytop Soc. 46: 37-45.
Koske RE. 1981. Gigaspora gigantea observation on spore germination of VA mycorrhizal fungus. Mycologia. 72: 288-300.
Pacioni G. 1992. Wet sieving and decanting techniques for the extraction of spores of VA mycorrhizal fungi. Hlm: 317-322. Dalam: Norris JR, DJ Read dan AK Varma (Eds). Methods in Microbiology. Vol 24. Academic Press Inc. San Diego.
Perrin R dan Plenchette C. 1993. Effects of some fungicides applied as soil drenches on the mycorrhizal infectivity of two cultivated soils and their receptiveness to Glomus intraradices. Crop Protection. 12: 127-133
Peterson LR dan Guinel FC. 2000. The use of plant mutants to study regulation of colonization by AM fungi. Dalam: Y Kapulnik, DD Douds. Arbuscular Mycorrhizas: Physiology and Function. Kluwer Academic Publishers, Dordrecht, The Netherlands. Hlm: 147-171.
Powel CL dan Bagyaraj DJ. 1984. Ecology of VA Mycorrhiza; Why All the Interest?. CRC Press. Inc. Boca Raton. Florida. Hlm: 1-3.
Priadi Arif. 2009. Biology 3 For Senior High School Year XII. Yudhistira. Hlm: 6-9.
Rajapakse S dan Miller Jr JC. 1992. Methods for studying vesicular-arbuscular mycorrhizal root colonization and related root physical properties. Hlm: 301-316. Dalam: Norris JR, Read DJ dan Varma AK (Eds). Methods of microbiology vol 24. Academic Press.
Rao NSS. 1994. Mikroorganisme Tanah dan Pertumbuhan Tanaman. Terjemahan Herawati Susilo. UI Press. Jakarta.
Schenck NC dan Schroder VN. 1975. Temperature Response of Endogone mycorrhiza on soybean roots. Mycologia. 66: 600-601.
Setiadi Y. 1993. Prospek Pengembangan Pupuk Biologis untuk Tanaman Kehutanan. Makalah disampaikan dalam Forum Komunikasi Hasil Penelitian Bioteknologi. Bogor.
Smith SE dan Read DJ. 1997. Mycorrhizal Symbiosis. New York: Academic Press.
Steussy TF. 1992. The Systematics of Arbuscular Mycorrhizal Fungi in Relation to Current Approaches to Biological Classification. Mycorrhiza. 1: 113-121.
Lampiran 1.a. Hari mulai berkecambah (hari)
Perlakuan Ulangan Total Rataan
I II III
Lampiran 1.b. Data transformasi V(y+0,5) hari mulai berkecambah (hari)
Perlakuan Ulangan Total Rataan I II III
Lampiran 1.c. Daftar sidik ragam hari mulai berkecambah
SK DB JK KT Fh F.05 F.01
Perlakuan 13 39.8276 3.064 1532.00 ** 2.12 2.90
F 6 0.7708 0.128 64.00 ** 2.44 2.53
M 1 38.2859 38.286 19143.00 ** 4.20 7.64
FM 6 0.7789 0.130 65.00 ** 2.44 2.53
Galat 28 0.0422 0.002
Total 41 39.8698
Lampiran 2.a. Persentase perkecambahan (%)
Perlakuan Ulangan Total Rataan I II III
Lampiran 2.b. Data transformasi V(y+0,5) persentase perkecambahan (%)
Perlakuan Ulangan Total Rataan I II III
Lampiran 2.c. Daftar sidik ragam persentase perkecambahan
SK DB JK KT Fh F.05 F.01
Perlakuan 13 854,176 65,706 625.77 ** 2,12 2,90
F 6 0,892 0,149 1.42 tn 2,44 2,53
M 1 852,391 852,391 8118.01 ** 4,20 7,64
FM 6 0,893 0,149 1.42 tn 2,44 2,53
Galat 28 2,940 0,105
Total 41 857,116
Lampiran 3.a. Laju perkecambahan (% / hari)
Perlakuan Ulangan Total Rataan I II III
Lampiran 3.b. Data transformasi V(y+0,5) laju perkecambahan (% / hari)
Perlakuan Ulangan Total Rataan I II III
Lampiran 3.c. Daftar sidik ragam laju perkecambahan
SK DB JK KT Fh F.05 F.01
Perlakuan 13 121.838 9.372 1874.43 ** 2,12 2,90
F 6 1.531 0.255 51.00 ** 2,44 2,53
M 1 118.776 118.776 23755.20 ** 4,20 7,64
FM 6 1.531 0.255 51.00 ** 2,44 2,53
Galat 28 0.133 0.005
Total 41 121.971
Lampiran 4.a. Persentase kolonisasi FMA pada akar tanaman inang (%)
Perlakuan Ulangan Total Rataan I II III
Lampiran 4.b. Daftar sidik ragam persentase kolonisasi akar
SK DB JK KT Fh F.05 F.01
Perlakuan 13 21224,7857 1632,6758 268,91 ** 2,12 2,90
F 6 710,6190 118,4365 19,51 ** 2,44 2,53
M 1 20460,2143 20460,2143 3369,93** 4,20 7,64
FM 6 53,9524 8,9921 1,48 tn 2,44 2,53
Galat 28 170,0000 6,0714
Total 41 21394,7857
Germ tube
Vesikula