RINI SYAHRAYNI HASIBUAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Aktivitas Antioksidan Ekstrak Selaginella adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juli 2011
RINI SYAHRAYNI HASIBUAN. Antioxidant Activity of Selaginella Extract. Under direction of TATIK CHIKMAWATI and MIFTAHUDIN.
Selaginella (Selaginellaceae) is a pteridophyte plant, having a lot of potential and benefits as food material and pharmaceutical. As a medicinal plant, Selaginella has been used as anti-cancer, anti-tumor, and antioxidant. The objective of the study was to analyze the potential of S. ornata, S. plana, and S. willdenovii extract as antioxidant by measuring lipid peroxidation (MDA level) and Superoxide Dismutase (SOD) activity. This experiment was started with LD50
test of three kinds of Selaginella extract as preliminary experiment. The experiment was designed as complete randomize design with two factors. The first factor was three species of Selaginella and the second factor was four doses of Selaginella extracts, which were 0, 0.3, 0.6, and 1.2 g extract/kg bw. The result showed that at the dose of 0.6 g extract/kg bw, Selaginella extract could decrease the MDA level to the lowest level. The dose of 0.3 g extract/kg bw could increase the SOD activity. Among the three species of Selaginella extract, S. ornata showed the best antioxidant activity.
RINI SYAHRAYNI HASIBUAN. Aktivitas Antioksidan Ekstrak Selaginella. Dibimbing oleh TATIK CHIKMAWATI dan MIFTAHUDIN.
Pemenuhan kebutuhan manusia untuk meningkatkan kesehatan dan mencegah terjadinya cekaman oksidatif dewasa ini sangat perlu dilakukan. Banyak hal yang mendukung pemenuhan kebutuhan tersebut, diantaranya pemanfaatan tumbuhan alami terutama mengandung bahan-bahan antioksidan. Pemanfaatan tumbuhan obat sebagai antioksidan tradisional sudah mulai banyak dilakukan, diantaranya Selaginella. Kemampuan Selaginella sebagai antioksidan ditunjukkan dari beberapa penelitian sebelumnya, diantaranya dapat memicu peningkatan pertumbuhan dan aktivitas perlindungan terhadap hidrogen peroksida (H2O2), menghambat produksi nitrat oksida, dan penghambatan terhadap
peroksidasi lipid.
Penelitian ini bertujuan untuk menganalisis aktivitas antioksidan ekstrak S. ornata, S. plana, dan S. willdenovii secara in vivo dan in vitro dengan analisis peroksida lipid dan Superoksida Dismutase. Penelitian ini dilakukan mulai bulan Juni 2010 sampai dengan bulan Maret 2011. Pada tahap awal penelitian dengan mengambil sampel dan mempersiapkan ekstrak ketiga jenis Selaginella. Pengujian toksisitas akut (LD50), uji in vivo serta pemeliharaan mencit dalam
perlakuan dilakukan di Laboratorium Farmakologi Fakultas Kedokteran Hewan, IPB, sedangkan uji in vitro aktivitas antioksidan ekstrak Selaginella dilakukan di Laboratorium Penelitian Fisiologi Tumbuhan, Departemen Biologi, IPB.
Hasil pengujian LD50 dari ketiga jenis ekstrak Selaginella menunjukkan
bahwa ekstrak S. ornata dan S. plana dikategorikan hanya sedikit toksik yaitu berturut-turut 9 dan 5.2 g ekstrak/kg bb, sedangkan mencit yang memperoleh ekstrak S. willdenovii dikategorikan cukup toksik (3 g ekstrak/kg bb). Setelah memperoleh hasil LD50 dilanjutkan dengan uji in vivo menggunakan dosis 0, 0.3,
0.6, dan 1.2 g ekstrak/kg bb. Pengujian aktivitas antioksidan ekstrak Selaginella dilakukan dengan memberikan ketiga jenis ekstrak Selaginella yang berbeda dan cekaman oksidatif pada mencit yaitu tidak diberi pakan (puasa/starvation) dan berenang selama 5 menit setiap hari selama 3 hari percobaan.Pengujian in vitro dilakukan setelah memperoleh hasil in vivo dengan menguji homogenat hati mencit yang diperoleh dari hasil pembedahan. Pengujian in vitro menggunakan homogenat hati dilakukan dengan analisis peroksidasi lipid dan superoksida dismutase.
Selaginella menggunakan dosis 0.3 g ekstrak/kg bb menunjukkan nilai aktivitas SOD paling tinggi (54.6%), namun tidak berbeda secara nyata dengan nilai aktivitas SOD dosis 0.6 g ekstrak/kg bb (54.4%) dan dosis 1.2 g ekstrak/kg bb (52.4%).
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
RINI SYAHRAYNI HASIBUAN
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Biologi Tumbuhan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
NIM : G353090091
Disetujui
Komisi Pembimbing
Dr. Ir. Tatik Chikmawati, M. Si. Ketua
Dr. Ir. Miftahudin, M. Si. Anggota
Mengetahui
Ketua Program Studi Biologi Tumbuhan
Dekan Sekolah Pascasarjana
Dr. Ir. Miftahudin, M. Si. Dr. Ir. Dahrul Syah, M.Sc. Agr
Puji dan syukur penulis ucapkan kepada Allah SWT atas segala nikmat, kasih sayang dan hidayah-Nya sehingga karya ilmiah ini dapat diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juni 2010 sampai dengan Maret 2011 ini ialah Aktivitas Antioksidan Ekstrak Selaginella. Penelitian ini didanai oleh Departemen Agama Republik Indonesia melalui program beasiswa utusan daerah (BUD Depag).
Terima kasih yang tulus penulis ucapkan kepada Ibu Dr. Ir. Tatik Chikmawati, M. Si dan Bapak Dr. Ir. Miftahudin, M. Si yang telah banyak memberikan bimbingan dan saran dalam penelitian dan penulisan tesis ini. Terima kasih juga penulis sampaikan kepada Ibu drh. Dewi Ratih Agungpriyono, Ph.D, APVet yang telah bersedia menjadi penguji luar komisi pada ujian tesis dan memberikan saran untuk kelengkapan informasi pada tesis ini.
Ucapan terima kasih penulis sampaikan kepada staf dosen dan tata usaha Departemen Biologi Pascasarjana IPB, teknisi dan laboran, teman-teman di Laboratorium Penelitian Fisiologi Tumbuhan IPB, staf dosen dan laboran di Laboratorium Farmakologi Fakultas Kedokteran Hewan IPB, teman-teman mahasiswa pascasarjana Biologi Tumbuhan angkatan 2009 dan BUD Biologi 2009.
Terima kasih untuk kesabaran dan pengertian suami tercinta Yasser Arafat Sari Siregar yang telah memberikan do’a dan motivasi pada penulis, juga kepada kedua orangtua Bapak H. Syahril Hasibuan dan Ibu Hj. Nilawaty, adek-adek tercinta, serta kedua mertua Drs. H. Saridin Siregar dan Hj. Siti Aminah Harahap atas dukungan dan do’anya serta semua pihak yang telah banyak membantu penulis hingga dapat menyelesaikan studi.
Akhirnya penulis berharap semoga karya ilmiah ini bermanfaat dan dapat memberikan informasi untuk kepentingan dan perkembangan ilmu pengetahuan, guna kemaslahatan dan kesejahteraan manusia.
Bogor, Juli 2011
H. Syahril Hasibuan dan Ibu Hj. Nilawaty. Penulis merupakan putri pertama dari tiga bersaudara.
Tahun 1999 penulis lulus dari SMA Negeri 1 Tebing Tinggi dan pada tahun yang sama penulis lulus seleksi masuk Universitas Negeri Medan melalui jalur Ujian Masuk Perguruan Tinggi Negeri. Penulis memilih program studi Pendidikan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam dan lulus pada tahun 2003.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xxi
DAFTAR GAMBAR ... xxiii
DAFTAR LAMPIRAN ...xxv
PENDAHULUAN ...1
Latar Belakang ...1
Tujuan Penelitian ...2
TINJAUAN PUSTAKA ...3
Deskripsi dan Distribusi Selaginella ...3
Selaginella ornata (Hook & Grev.) Spring. ...4
Selaginella plana (Desv. ex Poir.) Hieron ...4
Selaginella willdenovii (Desv. ex Poir.) Baker ...5
Senyawa Bioaktif pada Selaginella ...5
Antioksidan ...7
METODE PENELITIAN ...11
Waktu dan Tempat Penelitian ...11
Bahan Tanaman ...11
Diagram Alir penelitian ...11
Rancangan Percobaan...11
Pelaksanaan Penelitian ...13
1. Pembuatan Ekstrak Selaginella ... 13
2. Aktivitas Antioksidan ... 13
2.1 Uji LD50 ...13
2.2 Pemberian Ekstrak Selaginella dan Cekaman Oksidatif...14
2.3 Persiapan Homogenat Hati ...15
2.4 Analisis Peroksidasi Lipid ...15
2.5 Analisis Superoksida Dismutase (SOD) ...17
Analisis Data ...18
HASIL DAN PEMBAHASAN ...19
Hasil ...19
1. Kondisi mencit dan Nilai LD50 (Dosis Letal Median) ... 19
2. Efektifitas Pemberian Cekaman Oksidatif ... 21
3. Peroksidasi Lipid ... 22
4. Aktivitas SOD (Superoksida Dismutase) ... 23
Pembahasan ...26
SIMPULAN DAN SARAN ...33
Simpulan ...33
Saran ...33
DAFTAR PUSTAKA ...35
DAFTAR TABEL
Halaman
1 Pengujian LD50 ekstrak S. ornata, S. plana, dan S. willdenovii ...21
2 Pengujian efektifitas pemberian cekaman oksidatif pada mencit
dengan nilai MDA dan SOD ...212
DAFTAR GAMBAR
Halaman
1 Selaginella ornata di Kebun Raya Cibodas Cianjur ...6
2 Selaginella plana di Kampus IPB Dramaga Bogor. ...6
3 Selaginella willdenovii di Kampus IPB Dramaga Bogor...6
4 Struktur dasar flavonoid dan biflavonoid (Rahman et al. 2007) ...7
5 Diagram alir penelitian Aktivitas Antioksidan Ekstrak Selaginella. ...12
6 Perubahan bobot badan mencit di akhir uji pendahuluan LD50 pada S. ornata (SO), S. plana (SP), dan S. willdenovii (SW). ...19
7 Perubahan bobot badan mencit selama uji pendahuluan LD50 dengan 15 g ekstrak/kg bb. Mencit mendapat ekstrak S. ornata ( ), S. plana ( ) dan S. willdenovii ( ). ...20
8 Konsentrasi MDA mencit yang mendapat ekstrak S. ornata ( ), S. plana ( ), dan S. willdenovii ( )pada empat taraf dosis ekstrak setelah mendapat cekaman oksidatif. Mencit yang mendapat dosis 0 merupakan kontrol negatif, yaitu mencit yang tidak mendapat ekstrak, namun mendapat cekaman. ...23
9 Konsentrasi MDA mencit pada tiga jenis ekstrak S. ornata, S. plana, dan S. willdenovii setelah mendapat ekstrak dengan dosis 0.6 g ekstrak/kg bb. Mencit yang mendapat cekaman oksidatif ( ) dan mencit yang tidak mendapat cekaman oksidatif ( ) ...24
10 Nilai SOD (%) kontrol dan perlakuan ekstrak S. ornata, S. plana, dan S. willdenovii pada semua mencit yang mendapat cekaman. Kontrol merupakan mencit yang tidak mendapat ekstrak, namun mendapat cekaman ...25
11 Nilai SOD (%) mencit yang mendapat ekstrak S. ornata, S. plana, dan S. willdenovii dengan dosis 0.3, 0.6, dan 1.2 g ekstrak/kg bb dan mendapat cekaman. ...24
DAFTAR LAMPIRAN
Halaman
1 Mencit putih untuk percobaan LD50 dan uji in vivo ...43
2 Bobot badan mencit pada pengujian awal LD50 menggunakan
dosis 15 g ekstrak/kg bb mulai hari ke-1 sampai dengan hari ke-7
pengamatan ...44
3 Bobot badan mencit pada pengujian LD50 menggunakan dosis 1, 3, 9,
dan 27 g ekstrak/kg bb pada hari ke-1 sampai dengan hari ke-7 ...45
4 Perhitungan LD50 ekstrak S. ornata, S. plana, dan S. willdenovii dengan
menggunakan perhitungan LD50 (Weil 1952) ...46
5 Analisis Sidik Ragam terhadap peubah MDA, menggunakan
kontrol negatif yaitu mencit yang tidak mendapat ekstrak ...47
6 Konsentrasi MDA (nmol/µg protein) pada mencit yang mendapat
ekstrak dan kontrol tidak mendapat ekstrak pada semua mencit yang
mendapat cekaman ...47
7 Analisis sidik ragam untuk SOD menggunakan kontrol negatif
yaitu mencit yang tidak mendapat ekstrak ...48
8 Larutan dan bahan kimia yang digunakan dalam penelitian
peroksidasi lipid dan SOD ...49
9 Bobot hati mencit untuk pembuatan homogenat 25%
dengan aquabides ...50
PENDAHULUAN
Latar Belakang
Penurunan kualitas lingkungan hidup yang semakin cepat, menyebabkan
manusia terus-menerus dihadapkan pada lingkungan tercemar, radiasi ultraviolet
yang tinggi dan bahan-bahan polutan serta radikal bebas lain yang mengakibatkan
cekaman oksidatif (oxidative stress). Hal ini dapat menimbulkan proses penuaan dini dan berbagai penyakit degeneratif yang membahayakan kesehatan manusia.
Konsumsi bahan antioksidan diperlukan untuk menangkal stres tersebut
yang dapat menurunkan tingkat cekaman oksidatif sehingga memperlambat
terjadinya penuaan dini dan mencegah terjadinya komplikasi berbagai penyakit.
Antioksidan merupakan senyawa yang dapat menunda, memperlambat, atau
mencegah proses peroksidasi lipid. Dalam pengertian lainnya antioksidan adalah
zat yang dapat menunda atau mencegah terjadinya radikal bebas dalam
peroksidasi lipid. Senyawa antioksidan berperan penting untuk mengurangi
kerusakan oksidatif sel maupun jaringan yang disebabkan Reactive Oxygen Spesies (ROS) termasuk radikal bebas seperti radikal anion superoksida, radikal hidroksil, singlet oksigen, dan senyawa yang bukan radikal bebas seperti hidrogen
peroksida (Hariyatmi 2004; Kumar et al. 2010).
Pemanfaatan tumbuhan obat sebagai antioksidan tradisional sudah mulai
banyak dilakukan. Indonesia merupakan salah satu negara megabiodiversitas
dengan tingkat keanekaragaman hayati tergolong tinggi di dunia termasuk
tumbuhan obat dan memiliki jenis-jenis tumbuhan yang berpotensi sebagai bahan
baku untuk antioksidan, salah satunya adalah Selaginella. Selaginella memiliki karakter morfologi khas berupa percabangan pada batang menggarpu, daun-daun
kecil menyerupai sisik pada beberapa spesies, dengan dua ukuran yang berbeda
(Jermy 1990). Struktur reproduksinya tersusun dalam strobili yang terdapat di
ujung percabangan. Selaginella ornata memiliki strobili yang rata dan sangat rapat, sedangkan S. plana dan S. willdenovii memiliki strobili bersegi empat (Winter & Amoroso 2003; Chikmawati et al. 2007).
(Winter & Amoroso 2003). Sebagai tanaman obat, Selaginella dimanfaatkan sebagai anti kanker (Thomson 2007), anti tumor (Khoiri 2009), dan antioksidan
(Gayathri et al. 2005; Chikmawati et al. 2009).
Kemampuan Selaginella sebagai antioksidan ditunjukkan dari beberapa penelitian sebelumnya. Sah et al. (2005) melaporkan bahwa ekstrak air S. bryopteris mampu memicu peningkatan pertumbuhan serta aktivitas perlindungan terhadap cekaman oksidatif. Perlakuan kultur sel mamalia dengan
1–2.5% ekstrak air dapat melindungi kultur sel dari hidrogen peroksida (H2O2).
Selanjutnya Gayathri et al. (2005) menyatakan bahwa penghambatan peroksidasi lipid secara in vitro pada ekstrak S. involvens hampir 50% memiliki aktivitas meningkatkan pertumbuhan pada konsentrasi 2 µg/ml, dan juga perlindungan
melawan kematian sel yang terinduksi stress dalam sejumlah sistem sel
eksperimen termasuk sel mamalia. Ekstrak lainnya yaitu dari S. tamariscina mampu menghambat produksi nitrat oksida, dan kerjanya tergantung pada
konsentrasinya (Woo et al. 2005). Kemampuan Selaginella sebagai antioksidan tersebut dipengaruhi oleh senyawa metabolit sekunder yang terkandung di
dalamnya. Anggota marga ini kaya akan bahan aktif biflavonoid, suatu metabolit sekunder yang dihasilkan tumbuhan tertentu dalam bentuk dimer dari flavon dan
flavanon (Rahman et al. 2007).
Selaginella ornata, S. plana, dan S willdenovii merupakan tiga contoh jenis Selaginella yang banyak ditemukan melimpah di Indonesia dan telah dimanfaatkan sebagai tumbuhan obat oleh penduduk setempat. Chikmawati et al. (2009) telah mengkaji aktivitas antioksidan ketiga jenis tersebut secara
in vitro, namun kajian aktivitasnya secara in vivo belum terungkapkan. Oleh karena itu perlu dilakukan penelitian lanjutan untuk melengkapi informasi yang
telah tersedia agar dapat memberikan kontribusi yang lebih besar pada bidang
ilmu dasar, farmasi dan kesehatan.
Tujuan Penelitian
Penelitian ini bertujuan untuk menganalisis aktivitas antioksidan ekstrak
S. ornata, S. plana, dan S. willdenovii secara in vivo dan in vitro.
TINJAUAN PUSTAKA
Deskripsi dan Distribusi Selaginella
Selaginella termasuk divisi Lycopodiophyta, kelas Lycopodiopsida, ordo Selaginellales, famili Selaginellaceae. Selaginella termasuk tumbuhan herba perennial. Akar ada yang panjang, pendek, atau rizosfor. Batang kecil, tegak, atau
menjalar dengan akar di setiap intervalnya. Percabangannya menggarpu, daun
tersusun spiral atau berhadapan, sepasang daun kecil meyerupai sisik di bagian
lateral dan median batang yang sebagian besar dengan ukuran yang berbeda.
Sporangia tersusun dalam strobili dan terdapat di ujung percabangan. Sporangia
pada permukaan atas, di ketiak sporofil sporangium bertangkai, ada dua macam
yaitu megaspora dan mikrospora. Selaginella dapat tumbuh pada berbagai tipe iklim dan tanah, dengan tingkat keanekaragaman tertinggi di hutan hujan tropis
(Tjitrosoepomo 1994; Zhang 2001).
Spesies Selaginella banyak terdapat di Indonesia dan negara-negara Malesia, tetapi informasi tentang takson ini masih terbatas. Di pulau Jawa
ditemukan 18 spesies tersebar dalam 29 lokasi dengan jumlah spesies terbesar
ditemukan di Jawa Barat seperti S. willdenovii. Beberapa spesies yang umum ditemukan melimpah di pulau Jawa antara lain S. plana, S. ornata, S. opaca,dan S. ciliaris (Chikmawati et al. 2007). Selaginella juga ditemukan di pulau-pulau besar Indonesia lainnya seperti Kalimantan, Sumatera, Sulawesi,
serta pulau-pulau kecil seperti Maluku dan Sunda Kecil. Sejumlah spesies juga
ditemukan di negara Filipina, Thailand, Semenanjung Malaya, dan kepulauan
Solomon (Camus 1997).
Di Indonesia, Selaginella memiliki beberapa nama lokal seperti rumput solo, cemara kipas gunung, cakar ayam (Jawa), paku rane (Sunda), menter
(Jakarta), tai lantuan (Madura), usia (Ambon), sikili batu (Minangkabau),
rutu-rutu (Maluku) (Winter & Amoroso 2003; Setyawan & Darusman 2008), dan
ringan, rorak (Minahasa) (Zumsteg & Weckerle 2007). Jenis-jenis Selaginella memiliki banyak kesamaan tetapi umumnya dapat dibedakan berdasarkan bentuk
Selaginella ornata (Hook & Grev.) Spring.
Selaginella ornata memiliki batang utama tegak, warna merah hati, kaku, mudah patah, ujung batang keemasan, ada satu akar keluar dari percabangan, daun
dimorfik seluruhnya, bentuk lembaran daun garis-bundar telur, daun lateral
oblong-garis, nampak persisten, warna hijau muda, hijau sedang, dan coklat
(merah hati) (Gambar 1).
Strobili rata dan sangat rapat, sporofil dimorfik, sporofil dari daun di
bawah lebih kecil dari bagian atas. Selaginella ornata tersebar luas di Asia Tenggara. Sementara di Indonesia, khususnya pulau Jawa persebaran spesies ini
terdapat di beberapa daerah seperti Gunung Wiru, G. Salak, G. Gede, Cibodas,
Cibeber, Paninggaran-Pekalongan, G. Selamet, dan G. Argopuro. Habitat yang
disukai oleh spesies ini adalah tempat yang lembab, ternaungi tumbuhan lain
maupun terbuka serta terkena sinar matahari, di tebing pinggir jalan dan tebing
persawahan dengan sumber air di sekitarnya, dan hutan sekunder (Winter &
Amoroso 2003; Chikmawati et al. 2007).
Selaginella plana (Desv. ex Poir.) Hieron
Selaginella plana merupakan tumbuhan yang memiliki batang yang tegak, bagian pangkal batangnya memanjat atau menjalar, bagian atas cabangnya
membentuk seperti frond yang cukup besar tumbuh dari batang utamanya (Gambar 2). Daunnya dimorfik, warna hijau, sporofilnya seragam dan strobili
bersegi empat. Daun lateral oblong-garis. Ada beberapa variasi yang terlihat
diantaranya batang coklat dominan, batang hijau, daun hijau dominan, dan daun
cokelat. Spesies ini dapat ditemukan di dekat sawah, di tebing dengan aliran air
kecil di bawah tebing, tepi sungai, hutan sekunder, ternaungi, dan terbuka pada
ketinggian antara 250-2771 m dpl. S. plana dapat tumbuh dengan baik pada tanah lempung liat, batu, dan tanah pasir berbatu (Winter & Amoroso 2003;
Selaginella willdenovii (Desv. ex Poir.) Baker
Tumbuhan S. willdenovii merupakan semak dengan tinggi antara 1–2 meter, memanjat, batang utamanya tegak, bentuk segi empat, coklat kemerahan,
licin, cabang dengan sudut 45º terhadap cabang utama. Cabang ada yang merayap, teratur, dan median daun berbentuk lanset. Pada bagian atas permukaan daun
berwarna hijau kebiruan, ujung keemasan (Gambar 3).
Sporofil seragam dan strobili bersegi empat. S. willdenovii dapat ditemukan pada daerah yang cukup panas pada ketinggian +250 m dpl, diantara
semak belukar di hutan, di bawah pohon damar, dan di bawah pohon pinus
(Winter & Amoroso 2003; Chikmawati et al. 2007).
Senyawa Bioaktif pada Selaginella
Senyawa bioaktif pada tumbuhan dihasilkan dari proses metabolisme
sekunder. Metabolit sekunder merupakan senyawa organik yang tidak langsung
berfungsi dalam pertumbuhan dan perkembangan. Senyawa ini tersebar terbatas
hanya pada beberapa spesies tumbuhan. Senyawa metabolit sekunder memiliki
suatu fungsi ekologi seperti perlindungan tumbuhan dari herbivora, patogen, dan
atraktan terhadap polinator hewan penyebar biji. Contoh metabolit sekunder pada
tumbuhan adalah terpenoid (isoprenoid), alkaloid serta senyawa N lainnya, dan
phenol seperti biflavonoid. Menurut Seigler (1998) distribusi senyawa biflavonoid
ini terbatas pada beberapa tumbuhan seperti Selaginellales, Psilotales, dan
Gymnospermae.
Biflavonoid yaitu metabolit sekunder utama pada Selaginella merupakan dimer flavonoid yang dibentuk dari dua unit flavon atau campuran antara flavon
Gambar 1 Selaginella ornata di Kebun Raya Cibodas Cianjur.
Gambar 2 Selaginella plana di Kampus IPB Dramaga Bogor.
Biflavonoid yang paling banyak diteliti adalah ginkgetin, isoginkgetin,
amentoflavon, morelloflavon, robustaflavon, hinokiflavon, dan ochnaflavon.
Senyawa-senyawa ini memiliki struktur dasar yang serupa yaitu 5,7,4’-trihidroksi
flavonoid, tetapi berbeda pada sifat dan letak ikatan antar flavonoid (Rahman et al. 2007).
Flavonoid Biflavonoid
Gambar 4 Struktur dasar flavonoid dan biflavonoid (Rahman et al. 2007)
Hasil penelitian Zheng et al. (2007) menunjukkan bahwa dari empat biflavonoid yakni, robustaflavone, 4′-methyl ether, tetrahydrorobustaflavone, dan
2′′, 3 ′′-dihydrorobustaflavone 4′-methyl ether, yang diisolasi dari fraksi larutan
ethanol 60% dari seluruh herba S. uncinata (Desv.) Spring, diperoleh bahwa senyawa 2′′, 3 ′′-dihydrorobustaflavone 4′-methyl ether adalah merupakan
biflavonoid baru. Hal ini dapat menjadi suatu petunjuk baru untuk mendapatkan
senyawa-senyawa biflavonoid lainnya yang belum terungkap pada spesies
Selaginella lainnya karena beberapa senyawa biflavonoid dengan mudah ditemukan pada berbagai spesies Selaginella. Selanjutnya Sun et al. (2006) melaporkan bahwa amentoflavon dan ginkgetin merupakan senyawa biflavonoid
pada Selaginella yang paling melimpah, luas sebarannya, dan paling mudah ditemukan.
Antioksidan
Antioksidan adalah senyawa kimia yang dapat menyumbangkan satu atau
lebih elektron kepada radikal bebas, sehingga radikal bebas tersebut dapat
(2008) antioksidan juga dapat menginaktifkan radikal bebas, molekul tidak stabil
yang dihasilkan oleh berbagai jenis proses kimia normal tubuh atau oleh radiasi
matahari, asap rokok, dan pengaruh-pengaruh lingkungan lainnya. Secara alamiah
semua organisme memiliki mekanisme untuk mengatasi radikal bebas, misalnya
dengan enzim superoksida dismutase dan katalase, atau dengan senyawa asam
askorbat, tokoferol, dan glutation (Tuminah 2000; Mau et al. 2002). Superoksida dismutase mengkatalisis reaksi dismutasi, dimana dua radikal superoksida
ditransformasikan menjadi molekul hidrogen peroksida dan satu molekul oksigen
(Heikkila et al. 1976). Reaksinya adalah sebagai berikut: 2 O2 + 2H+ H2O2 + O2
Senyawa antioksidan berperan penting untuk mengurangi kerusakan
oksidatif sel maupun jaringan yang disebabkan antara lain oleh ROS seperti
radikal superoksida, radikal nitrat hidroksida, radikal lipid peroksil, dan radikal
hidroksil (Tuminah 2000; Blokhina et al. 2003; Ali et al. 2008). Radikal bebas merupakan molekul yang sangat reaktif sekali, karena memiliki elektron yang
tidak berpasangan dan merupakan molekul yang dapat mengakibatkan kerusakan
pada membran. Selanjutnya Blokhina et al. (2003) menyatakan bahwa kerusakan pada komponen membran sel seperti lipid (peroksidasi dari asam lemak tidak
jenuh pada membran), protein (denaturasi), karbohidrat, dan asam nukleat dapat
dilihat dari perubahan komposisi dan kandungan lipid, pengaktifan lipid
peroksidase dan meningkatnya kebocoran membran.
Berbagai senyawa antioksidan yang dihasilkan tumbuhan untuk
menangkal radikal bebas, diantaranya biflavanoid, β-karoten, vitamin C, dan E
(Gaspar et al. 1994). Kemampuan Selaginella sebagai antioksidan dipengaruhi oleh senyawa metabolit sekunder yang terkandung di dalamnya. Diantara
beberapa jenis antioksidan yang dihasilkan oleh tumbuhan tersebut, yang
menunjukkan aktivitas antioksidan terbaik adalah biflavonoid (Myara et al. 1993). Biflavonoid efektif dalam penghilangan radikal hidroksil, radikal peroksil, dan
anion superoksida (Packer & Cadenas 2002). Potensi antioksidan senyawa
biflavonoid diperkirakan disebabkan oleh pelepasan atom hidrogen yang terdapat
pada gugus hidroksil (–OH). Gugus hidroksil hampir selalu terdapat dalam
7, atau cincin C pada posisi 3 (Gambar 4). Gugus hidroksil ini merupakan tempat
menempelnya berbagai gula yang dapat meningkatkan kelarutan flavonoid dalam
air. Sebagian besar flavonoid disimpan dalam vakuola tengah, walaupun disintesis
di luar vakuola (Salisbury & Ross 1995).
Radikal bebas berikatan dengan atom hidrogen tersebut sehingga energi
aktivasinya berkurang (Gurr et al. 2002). Selanjutnya Rose et al. (1982) menyatakan bahwa pemberian antioksidan dapat menurunkan tingkat cekaman
oksidatif sehingga memperlambat terjadinya penuaan dini dan mencegah
terjadinya komplikasi berbagai penyakit.
Hasil penelitian Sah et al. (2005) menunjukkan bahwa ekstrak air S. bryopteris mampu memicu peningkatan pertumbuhan serta aktivitas perlindungan terhadap cekaman oksidatif. Perlakuan kultur sel mamalia dengan
1-2.5% ekstrak air dapat melindungi kultur sel dari hidrogen peroksida. Gayathri
et al. (2005) meneliti tentang ekstrak air dari tiga spesies tumbuhan S. involvens, S. delicatula, dan S. wightii yang bersifat antioksidan. Dari ketiga spesies tumbuhan tersebut, yang berpengaruh secara signifikan terhadap anti
peroksidasi lipid adalah S. involvens (EC50 = 2 µg/ml). Hal ini mendukung
pandangan masyarakat tradisional (India) yang menganggap bahwa tumbuhan
S. involvens ini dapat memperpanjang usia.
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan mulai bulan Juni 2010 sampai dengan Maret
2011. Sampel tumbuhan untuk pembuatan ekstrak S. plana dan S. willdenovii diambil dari kampus IPB Dramaga Bogor sedangkan S. ornata berasal dari Kawasan Kebun Raya Cibodas Cianjur. Pemeliharaan mencit dalam perlakuan
dilakukan di Laboratorium Farmakologi Fakultas Kedokteran Hewan, IPB,
sedangkan uji in vitro aktivitas antioksidan ekstrak Selaginella dilakukan di Laboratorium Penelitian Fisiologi Tumbuhan, Departemen Biologi, IPB.
Bahan Tanaman
Bahan tanaman yang dipakai dalam penelitian adalah ekstrak dari
S. ornata, S. plana, dan S. willdenovii.
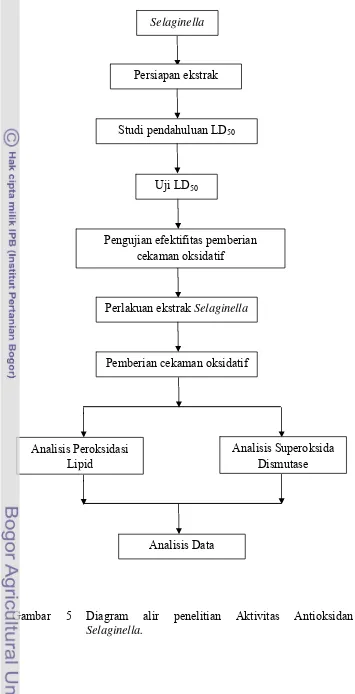
Diagram Alir penelitian
Penelitian ini diawali dengan pengambilan sampel Selaginella, persiapan ekstrak, dan selanjutnya analisis aktivitas antioksidan. Adapun alir penelitian ini
ditunjukkan pada Gambar 5.
Rancangan Percobaan
Percobaan aktivitas antioksidan menggunakan Rancangan Acak Lengkap
dengan Percobaan Faktorial yang terdiri dari dua faktor. Faktor pertama adalah
jenis ekstrak Selaginella yang terdiri dari 3 taraf yaitu S. ornata, S. plana dan S. willdenovii. Faktor kedua adalah dosis pemberian ekstrak Selaginella dengan empat taraf yaitu 0, 0.3, 0.6, dan 1.2 g ekstrak/kg bb. Tiap kombinasi perlakuan
Selaginella
Pengujian efektifitas pemberian cekaman oksidatif
Analisis Superoksida Dismutase Analisis Peroksidasi
Lipid
Pemberian cekaman oksidatif Perlakuan ekstrak Selaginella
Uji LD50
Studi pendahuluan LD50
Persiapan ekstrak
Analisis Data
Pelaksanaan Penelitian
1. Pembuatan Ekstrak Selaginella
Ekstraksi dimulai dengan membersihkan bagian tajuk (daun dan batang)
ketiga spesies Selaginella dengan air kemudian dikeringkan dengan oven pada suhu 50ºC selama 3 hari. Bahan kering kemudian dihaluskan dengan menggunakan blender sampai terbentuk tepung. Tepung kemudian dimaserasi
dengan etanol 70% dengan komposisi 5 g dimasukkan dalam 100 ml etanol 70%
selama 24 jam (Gayathri et al. 2005). Selanjutnya dilakukan pengadukan selama 4 jam dengan menggunakan stirer pada kecepatan 300 rpm.
Hasil maserasi disaring dengan menggunakan kertas saring Whatman no.
42 dan diuapkan dengan menggunakan rotary vaccum evaporator pada suhu 60ºC selama 3 sampai dengan 4 jam dengan kecepatan 200 rpm (Markham 1988).
Untuk menghilangkan air yang tersisa, filtrat dikeringbekukan dengan freeze dryer sampai terbentuk pasta dan hasilnya disimpan dalam ruang pendingin pada suhu 4ºC.
2. Aktivitas Antioksidan
2.1 Uji LD50
Studi pendahuluan pada pengujian LD50 menggunakan dosis 15 g
ekstrak/kg bb (bobot badan) bertujuan untuk mencari efek toksik. Pemberian
ekstrak Selaginella dilakukan secara oral sebanyak satu kali. Mencit yang digunakan adalah mencit jantan, strain DDY (Deutch Danken Yolken) dengan bobot badan berkisar 28.5–34.5 g yang berumur 2.5−3 bulan. Jumlah mencit
untuk setiap kelompok ekstrak S. ornata, S. plana, dan S. willdenovii masing-masing sebanyak 5 ekor. Pengamatan bobot badan dan kematian (mortalitas)
dilakukan selama 7 hari (Harmita & Radji 2008).
Pengujian LD50 selanjutnya pada ketiga jenis ekstrak Selaginella dilakukan
dengan menggunakan metode Weil (1952). Pemberian ekstrak pada hewan mencit
Pemilihan dosis mengikuti progresi geometris (Harmita & Radji 2008).
Rumus yang digunakan sebagai berikut:
YN = Y1 RN-1
Keterangan: YN = dosis ke-N
Y1 = dosis pertama
R = faktor pemacu
N = deret dosis
Mencit yang digunakan adalah mencit betina, strain DDY dengan bobot
badan berkisar 21.7–40.8 g yang berumur 2.5−3 bulan. Jumlah mencit untuk
setiap jenis ekstrak S. ornata, S. plana, dan S. willdenovii masing-masing sebanyak 4 ekor. Selanjutnya efek toksik ekstrak dievaluasi selama 7 hari
(Harmita & Radji 2008) dan dihitung dosis letal median (LD50). Rumus yang
digunakan pada metode Weil (1952) sebagai berikut:
Log m = log D + d(f+1)
Keterangan: m = nilai LD50
D = Dosis terkecil yang diberikan
d = log dari kelipatan dosis (log R)
f = suatu faktor dalam tabel Weil
2.2 Pemberian Ekstrak Selaginella dan Cekaman Oksidatif
Metode pemberian ekstrak dan cekaman oksidatif merupakan modifikasi
dari metode yang digunakan oleh Gayathri et al. 2005 dan Wresdiyati et al. (2007). Cekaman oksidatif diberikan dengan cara puasa (tidak diberi pakan) dan
berkisar 21.3–43 g yang berumur 2.5−3 bulan. Kontrol terdiri dari: (1) kontrol
negatif yaitu mencit yang tidak mendapat ekstrak, namun mendapat cekaman
oksidatif, (2) kontrol positif yaitu mencit yang mendapat ekstrak (dosis 0.6 g
ekstrak/kg bb), tetapi tanpa cekaman oksidatif, dan (3) kontrol netral yaitu mencit
yang tetap mendapatkan pakan dan tidak mendapat cekaman maupun ekstrak.
Pada setiap ekor mencit percobaan diberi 0.5 ml ekstrak dengan dosis sesuai
perlakuan. Pada hari kelima mencit-mencit tersebut dimatikan dan contoh hati
diambil.
2.3 Persiapan Homogenat Hati
Hati yang telah diperoleh dari hasil pembedahan direndam dengan NaCl
0.9% dan selanjutnya disimpan dalam larutan KCl 1.15% (Ohkawa et al. 1979). Dari larutan KCl 1.15%, dicuci dengan aquabides dan dibuat homogenat 25%
menggunakan aquabides (Gayathri et al. 2005 dan Lampiran 9). Pembuatan homogenat dengan cara dihaluskan, disaring, dan disimpan pada suhu –20ºC
untuk pengujian selanjutnya (Hasani et al. 2007). Dari bahan homogenat tersebut, diambil masing-masing 0.1–1 ml untuk analisis peroksidasi lipid dan analisis
Superoksida Dismutase.
2.4 Analisis Peroksidasi Lipid
Analisis peroksidasi lipid untuk penentuan konsentrasi MDA
(malondialdehyde) dalam nmol/µg protein dimulai dengan analisis protein. Analisis protein pada homogenat hati mencit menggunakan metode biuret.
Metode biuret merupakan salah satu cara yang terbaik untuk menentukan kadar
protein suatu larutan (Apriyantono et al. 1989).
Pereaksi biuret terdiri dari larutan 3 g CuSO4.5H2O dan 9 g Na-K-Tartrat
dalam 500 ml NaOH 0.2 N. Selanjutnya larutan ditambah 5 g KI kemudian
diencerkan sampai 1000 ml dengan menggunakan NaOH 0.2 N. Larutan protein
standar merupakan larutan bovine serum albumin (BSA) dalam aquades dengan konsentrasi 5 mg/ml.
Kurva standar dibuat dengan menggunakan larutan BSA dengan
0.2, 0.4, 0.6, 0.8 dan 1 ml larutan protein standar dengan menambahkan aquades sampai volume total masing-masing 4 ml. Selanjutnya larutan ditambah dengan 6
ml pereaksi Biuret dan dicampur dengan menggunakan vortex. Larutan tersebut
kemudian diinkubasi pada suhu 37ºC selama 10 menit sampai pembentukan warna biru sempurna dan pengukuran absorbansinya dilakukan pada panjang gelombang
520 nm.
Untuk penetapan sampel sebanyak 0.5 ml dilakukan dengan membagi
homogenat ke dalam tabung reaksi seperti pada waktu penetapan standar,
kemudian ditambah air sampai volume total masing-masing 1 ml. Selanjutnya
larutan ditambah 1 ml Trichloroacetic acid (TCA) 10% sehingga protein akan
terdenaturasi. Selanjutnya larutan disentrifus pada kecepatan 3000 rpm selama 10
menit sampai protein yang terdenaturasi mengendap, dan supernatan dibuang
dengan cara dekantasi. Endapan ditambah 2 ml etil eter dan dicampur merata lalu
disentrifus kembali untuk menolong menghilangkan residu TCA dan dibiarkan
mengering pada suhu kamar. Selanjutnya endapan kering ditambah 4 ml aquades
dan dicampur merata, sampai larut seluruhnya. Larutan ditambah dengan 6 ml
pereaksi Biuret, dan larutan alkali dalam pereaksi ini akan melarutkan endapan
yang tersisa. Larutan tersebut dicampur dan diinkubasi pada suhu 37ºC selama 10 menit sampai terbentuk warna biru sempurna dan pengukuran absorbansinya
dilakukan pada panjang gelombang ( ) 520 nm.
Analisis peroksidasi lipid diuji dengan sistem Fe2+ - askorbat (Gayathri et al. 2005). Campuran reaksi terdiri dari 0.1 ml homogenat hati 25%, 0.1 ml larutan penyangga Tris-HCl 1M (pH 7), 0.1 ml asam askorbat 1.5 mM, 0.1 ml
Fe-ammonium sulfat 4 mM, dan 0.1 ml aquabides hingga seluruhnya mencapai
volume 0.5 ml. Campuran kemudian diinkubasi pada suhu 37ºC selama 1 jam. Kandungan peroksidasi lipid diukur sebagai senyawa asam tiobarbiturat yang
terukur dengan metode dari Ohkawa et al. (1979) dan Mihara et al. (1980).
Setelah diinkubasi selama 1 jam pada suhu 37ºC, campuran tersebut
ditambah dengan 0.5 ml larutan Trichloroacetic Acid (TCA) 0.1% (w/v) yang mengandung Butylated Hydroxytoluene (BHT) 1mM pada suhu 4ºC. Homogenat tersebut kemudian ditambah 3 ml larutan H3PO4 2% (v/v) dan 1 ml TBA 0.6%
selama 30 menit, kemudian didinginkan sampai mencapai suhu ruang. Setelah
dingin campuran ditambah 4 ml n-butanol 100% (v/v) kemudian di kocok dengan
kuat menggunakan vortex. Fase butanol dan fase larutan dipisahkan dengan
sentrifugasi 3000 rpm selama 30 menit (Labofuge 400R). Absorbansi kompleks
TBA-MDA pada fase butanol diukur dengan spektrofotometer pada 532 nm,
sedangkan untuk nilai absorban non spesifik diukur pada 520 nm. Konsentrasi
MDA sebagai produk akhir peroksidasi lipid dapat dihitung dengan mengurangi
nilai absorban pada 532 nm dengan nilai absorban pada 520 nm.
Tingkat peroksidasi lipid dicerminkan oleh konsentrasi MDA yang
terbentuk yang dapat dihitung dengan menggunakan rumus:
MDA Ɛ x d
Keterangan: [MDA] = Konsentrasi MDA yang terbentuk (nmol)
A = Selisih nilai absorban
Ɛ = Nilai ekstansi MDA (155 mM-1cm-1) d = Lebar kuvet (cm)
v = Volume sampel (ml)
Persen penghambatan dari pembentukan peroksida lipid ditentukan dengan
cara membandingkan hasil dari contoh yang diberi dan tidak diberi perlakuan
ekstrak Selaginella.
2.5 Analisis Superoksida Dismutase (SOD)
Analisis SOD menggunakan metode Kubo et al. (2002), Wijeratne et al. (2005), dan Prangdimurti et al. (2006) dengan sedikit modifikasi. Penggunaan metode ini untuk mengukur aktivitas menangkap radikal anion superoksida yang
dihasilkan secara enzimatis oleh sistem xantin-xantin oksidase.
Sebanyak 0.06 ml homogenat hati direaksikan dengan larutan yang terdiri
dari 2.7 ml bufer Natrium Karbonat 40 mM yang mengandung EDTA 0.1 mM
(pH 10), 0.06 ml Xantin 10 mM, 0.03 ml BSA 0.5%, dan 0.03 ml NBT (nitroblue
Oksidase (0.04 units). Absorbansi yang dihasilkan setelah 30 menit diukur pada
panjang gelombang 560 nm. Sebagai kontrol digunakan larutan yang digunakan
dalam persiapan sampel hati yaitu 11.5 g/l KCl (PBS yang mengandung 11.5 g/l
KCl). Aktivitas SOD (%) dihitung dengan menggunakan persamaan berikut:
B
Keterangan: A= absorbansi larutan sampel
B= absorbansi larutan kontrol
Analisis Data
Analisis data dilakukan dengan uji sidik ragam (ANOVA). Jika dari hasil
analisis ragam perlakuan berpengaruh nyata terhadap peubah yang diamati maka
dilanjutkan dengan uji Duncan Multi Range Test (DMRT) dengan tingkat
kepercayaan 95%.
HASIL DAN PEMBAHASAN
Hasil
1. Kondisi mencit dan Nilai LD50 (Dosis Letal Median)
Mencit yang digunakan dalam uji LD50 adalah strain DDY berwarna putih
(Lampiran 1) yang memenuhi syarat untuk digunakan dalam penentuan LD50.
Adapun alasan digunakan mencit dalam percobaan karena selain hewan-hewan
tersebut ekonomis, mudah didapat, dan mudah dirawat, data-data toksikologinya
sudah tersedia sehingga memudahkan pembandingan toksisitas zat kimia satu
dengan yang lain (Harmita & Radji 2008).
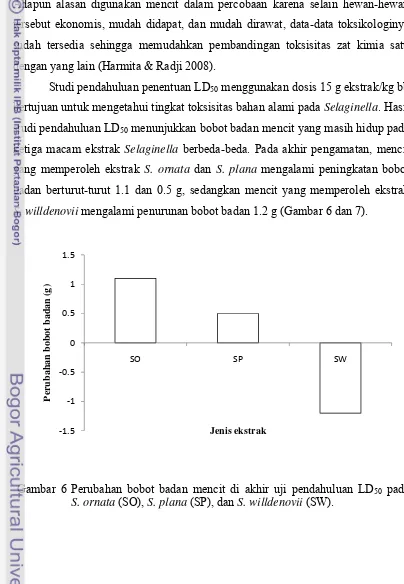
Studi pendahuluan penentuan LD50 menggunakan dosis 15 g ekstrak/kg bb
bertujuan untuk mengetahui tingkat toksisitas bahan alami pada Selaginella. Hasil studi pendahuluan LD50 menunjukkan bobot badan mencit yang masih hidup pada
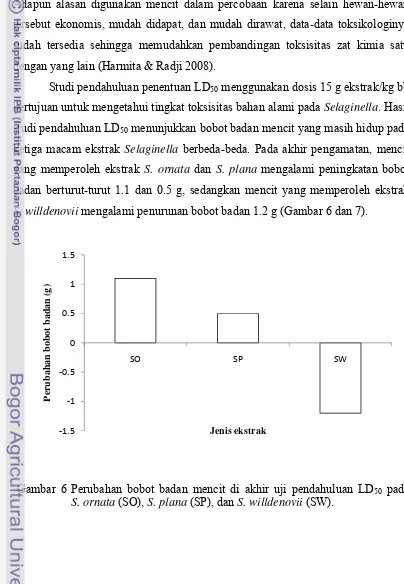
ketiga macam ekstrak Selaginella berbeda-beda. Pada akhir pengamatan, mencit yang memperoleh ekstrak S. ornata dan S. plana mengalami peningkatan bobot badan berturut-turut 1.1 dan 0.5 g, sedangkan mencit yang memperoleh ekstrak
S. willdenovii mengalami penurunan bobot badan 1.2 g (Gambar 6 dan 7).
‐1.5
‐1
‐0.5 0 0.5 1 1.5
SO SP SW
Perubahan
bobot badan (g)
[image:33.595.101.505.208.792.2]Jenis ekstrak
Gambar 6 Perubahan bobot badan mencit di akhir uji pendahuluan LD50 pada S. ornata (SO), S. plana (SP), dan S. willdenovii (SW).
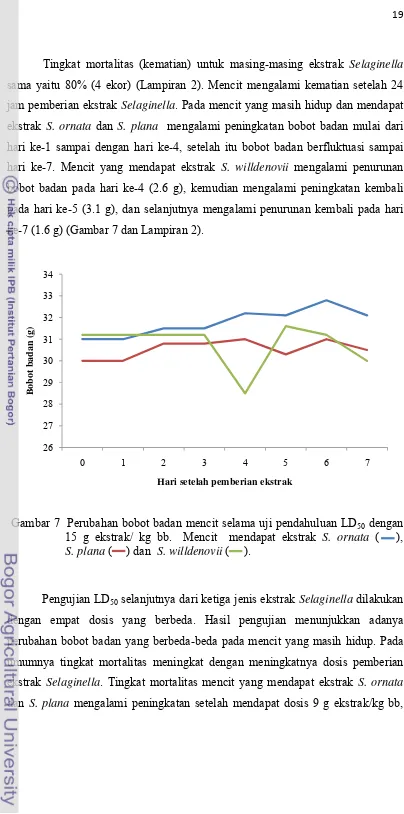
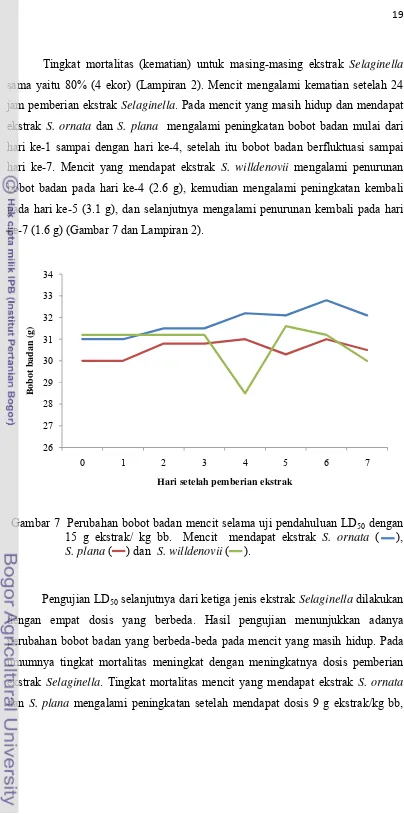
Tingkat mortalitas (kematian) untuk masing-masing ekstrak Selaginella sama yaitu 80% (4 ekor) (Lampiran 2). Mencit mengalami kematian setelah 24
jam pemberian ekstrak Selaginella. Pada mencit yang masih hidup dan mendapat ekstrak S. ornata dan S. plana mengalami peningkatan bobot badan mulai dari hari ke-1 sampai dengan hari ke-4, setelah itu bobot badan berfluktuasi sampai
hari ke-7. Mencit yang mendapat ekstrak S. willdenovii mengalami penurunan bobot badan pada hari ke-4 (2.6 g), kemudian mengalami peningkatan kembali
pada hari ke-5 (3.1 g), dan selanjutnya mengalami penurunan kembali pada hari
ke-7 (1.6 g) (Gambar 7 dan Lampiran 2).
[image:34.595.107.511.28.842.2]
Gambar 7 Perubahan bobot badan mencit selama uji pendahuluan LD50 dengan
15 g ekstrak/ kg bb. Mencit mendapat ekstrak S. ornata ( ), S. plana ( ) dan S. willdenovii ( ).
26 27 28 29 30 31 32 33 34
0 1 2 3 4 5 6 7
Bobot badan (g)
Hari setelah pemberian ekstrak
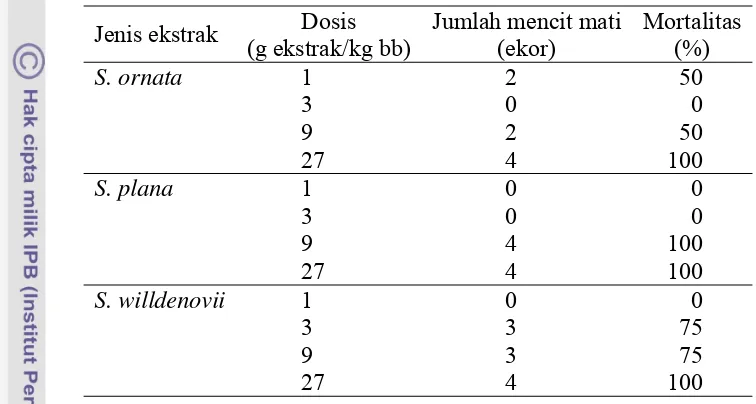
Pengujian LD50 selanjutnya dari ketiga jenis ekstrak Selaginella dilakukan
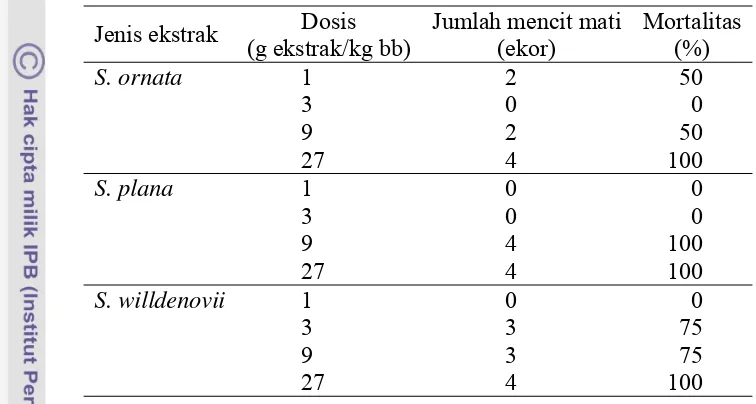
dengan empat dosis yang berbeda. Hasil pengujian menunjukkan adanya
perubahan bobot badan yang berbeda-beda pada mencit yang masih hidup. Pada
umumnya tingkat mortalitas meningkat dengan meningkatnya dosis pemberian
sedangkan tingkat mortalitas pada mencit yang mendapat ekstrak S. willdenovii mengalami peningkatan mulai dari pemberian dosis 3 g ekstrak/kg bb (Tabel 1
[image:35.595.103.481.182.384.2]dan Lampiran 3).
Tabel 1 Pengujian LD50 ekstrak S. ornata, S. plana, dan S. willdenovii
Jenis ekstrak Dosis (g ekstrak/kg bb)
Jumlah mencit mati (ekor)
Mortalitas (%)
S. ornata 1 2 50
3 0 0
9 2 50
27 4 100
S. plana 1 0 0
3 0 0
9 4 100
27 4 100
S. willdenovii 1 0 0
3 3 75
9 3 75
27 4 100
Berdasarkan jumlah kematian mencit diperoleh nilai LD50 yang berbeda
dari ketiga jenis ekstrak. Nilai LD50 ekstrak S. ornata, S. plana, dan S. willdenovii
berturut-turut 9, 5.2, dan 3 g ekstrak/kg bb (Lampiran 4). Selanjutnya untuk
pengujian in vivo digunakan tiga macam dosis yaitu 0.3, 0.6, dan 1.2 g ekstrak/kg bb. Penentuan dosis ini berdasarkan kurva hubungan antara sifat kurva dosis
dengan efek kuantal yang menunjukkan adanya suatu jarak antara ED50 dengan
LD50 sebesar sepersepuluh sampai seperduapuluh dari hasil distribusi frekuensi
kumulatif (Harmita & Radji 2008).
2. Efektifitas Pemberian Cekaman Oksidatif
Cekaman oksidatif bertujuan untuk mengetahui efektifitas perlakuan
cekaman oksidatif yang diberikan pada mencit dengan mengamati tingkat MDA
dan aktivitas SOD pada mencit yang mendapat cekaman dan tidak mendapat
cekaman. Mencit yang diuji efektifitas cekaman oksidatif tersebut tidak mendapat
Mencit yang mendapat cekaman menunjukkan nilai konsentrasi MDA
yang lebih tinggi dan nilai aktivitas SOD yang lebih rendah dibandingkan mencit
yang tidak mendapat cekaman. Dalam pengertian lain, mencit yang tidak
mendapat cekaman menunjukkan aktivitas peroksidasi lipid yang lebih rendah dan
aktivitas SOD yang lebih tinggi (Tabel 2). Hal ini menunjukkan bahwa pemberian
cekaman efektif menyebabkan mencit mengalami cekaman oksidatif.
Tabel 2 Pengujian efektifitas pemberian cekaman oksidatif pada mencit dengan nilai MDA dan SOD
Cekaman MDA SOD
(nmol/µg protein) (%)
− 0.360±0.048 52.600±0.481
+ 1.010±0.006 32.000±0.127
Keterangan: Mencit mendapat cekaman (+) (kontrol negatif) dan mencit tidak mendapat cekaman (−) (kontrol netral). Nilai rata-rata dengan standar deviasi pada masing-masing peubah yang diamati.
3. Peroksidasi Lipid
Pengaruh pemberian ketiga jenis ekstrak Selaginella terhadap konsentrasi MDA bergantung pada dosis yang diberikan. Ekstrak S. ornata menunjukkan aktivitas penghambatan peroksidasi lipid yang paling besar pada dosis 0.6 g
ekstrak/kg bb yang mampu menekan kadar MDA sampai dengan 0.170 nmol/µg
protein. Ekstrak S. plana juga menunjukkan aktivitas penghambatan peroksidasi lipid yang relatif sama dengan ekstrak S. ornata hingga pada dosis 0.6 g ekstrak/kg bb (0.240 nmol/µg protein), namun pada dosis 1.2 g ekstrak/kg bb
kembali menunjukkan konsentrasi MDA yang tinggi. Pemberian ekstrak dengan
dosis 0.3 g ekstrak/kg bb sudah menunjukkan nilai konsentrasi MDA yang relatif
rendah pada ketiga jenis ekstrak Selaginella, yaitu berturut-turut 0.590, 0.615, dan 0.565 nmol/µg protein. Hal ini berarti dengan menggunakan dosis 0.3 g
ekstrak/kg bb sudah cukup membuktikan kemampuan aktivitas penghambatan
terhadap peroksidasi lipid. Namun demikian, hasil penelitian dari ketiga macam
dosis 0.6 g ekstrak/kg bb merupakan dosis terbaik karena mampu menekan kadar
MDA sampai tingkat terendah berturut-turut 0.170 dan 0.240 nmol/µg protein
(Gambar 8 dan Lampiran 6).
0.00 0.20 0.40 0.60 0.80 1.00 1.20 1.40
0 0.3 0.6 1.2
MDA (nmol
/µ
g
protei
n)
Dosis (g ekstrak/kg bb)
Gambar 8 Konsentrasi MDA mencit yang mendapat ekstrak S. ornata ( ), S. plana ( ), dan S. willdenovii ( ) pada empat taraf dosis ekstrak setelah mendapat cekaman oksidatif. Mencit yang mendapat dosis 0 merupakan kontrol negatif, yaitu mencit yang tidak mendapat ekstrak, namun mendapat cekaman.
Data hasil pemberian ekstrak dengan dosis 0.6 g ekstrak/kb bb sangat
menarik terlihat pada mencit yang tidak tercekam, pemberian ketiga jenis ekstrak
Selaginella tidak berpengaruh nyata terhadap konsentrasi MDA. Namun demikian, jika dibandingkan dengan mencit yang tercekam, konsentrasi MDA
dari kedua jenis ekstrak yaitu S. ornata (0.170 nmol/µg protein) dan S. plana (0.240 nmol/µg protein) relatif sama dan jauh lebih rendah daripada konsentrasi
0.00 0.20 0.40 0.60 0.80 1.00 1.20 1.40
S. ornata S. plana S. willdenovii
MDA (nmol
/µ
g
protei
n)
Jenis Ekstrak
Gambar 9 Konsentrasi MDA mencit pada tiga jenis ekstrak S. ornata, S. plana, dan S. willdenovii setelah mendapat ekstrak dengan dosis 0.6 g ekstrak/kg bb. Mencit yang mendapat cekaman oksidatif ( ) dan mencit yang tidak mendapat cekaman oksidatif ( ).
4. Aktivitas SOD (Superoksida Dismutase)
Dalam analisis Superoksida dismutase yang dilakukan, radikal superoksida
dihasilkan terlebih dahulu dari reaksi antara xantin dan xantin oksidase. Radikal
superoksida akan mengoksidasi garam tetrazolium (berwarna kuning) menjadi
formazan yang berwarna biru. Semakin tinggi aktivitas SOD berarti semakin
banyak radikal superoksida yang dinetralisir, dan hal ini menunjukkan bahwa
semakin rendahnya jumlah formazan yang terbentuk.
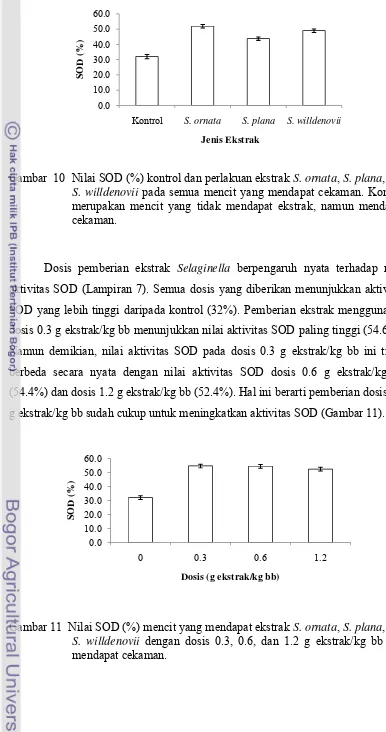
Pemberian jenis ekstrak Selaginella pada mencit memberikan pengaruh yang berbeda terhadap nilai aktivitas SOD. Ekstrak S. ornata dan S. willdenovii menghasilkan nilai aktivitas SOD berturut-turut 51.9% dan 49.0 %, lebih tinggi
0.0 10.0 20.0 30.0 40.0 50.0 60.0
Kontrol S. ornata S. plana S. willdenovii
SOD (%
)
[image:39.595.105.491.82.814.2]Jenis Ekstrak Kontrol
Gambar 10 Nilai SOD (%) kontrol dan perlakuan ekstrak S. ornata, S. plana, dan S. willdenovii pada semua mencit yang mendapat cekaman. Kontrol merupakan mencit yang tidak mendapat ekstrak, namun mendapat cekaman.
Dosis pemberian ekstrak Selaginella berpengaruh nyata terhadap nilai aktivitas SOD (Lampiran 7). Semua dosis yang diberikan menunjukkan aktivitas
SOD yang lebih tinggi daripada kontrol (32%). Pemberian ekstrak menggunakan
dosis 0.3 g ekstrak/kg bb menunjukkan nilai aktivitas SOD paling tinggi (54.6%).
Namun demikian, nilai aktivitas SOD pada dosis 0.3 g ekstrak/kg bb ini tidak
berbeda secara nyata dengan nilai aktivitas SOD dosis 0.6 g ekstrak/kg bb
(54.4%) dan dosis 1.2 g ekstrak/kg bb (52.4%). Hal ini berarti pemberian dosis 0.3
g ekstrak/kg bb sudah cukup untuk meningkatkan aktivitas SOD (Gambar 11).
0.0 10.0 20.0 30.0 40.0 50.0 60.0
0 0.3 0.6 1.2
SOD (%
)
Dosis (g ekstrak/kg bb)
Pembahasan
Pemanfaatan Selaginella sebagai antioksidan sudah mulai banyak dilakukan. Pengujian aktivitas antioksidan dimulai dengan pengujian LD50 untuk
mendapat tingkat toksisitas bahan alami pada Selaginella. Hasil pengujian LD50
dari ekstrak S. ornata, S. plana, dan S. willdenovii menunjukkan nilai yang bervariasi. Pengujian toksisitas akut (LD50) dilakukan sebanyak satu kali dalam
jangka waktu 24 jam untuk memperoleh tingkat toksisitas zat kimia yang diuji
(Weil 1952; Harmita & Radji 2008). Berdasarkan toksisitas relatif dari klasifikasi
zat kimia oleh Harmita dan Radji (2008), maka ekstrak S. ornata dan S. plana dikategorikan hanya sedikit toksik, sedangkan ekstrak S. willdenovii dikategorikan cukup toksik. Pada umumnya semakin besar nilai LD50, semakin rendah
toksisitasnya. Ekstrak S. ornata memiliki nilai LD50 terbesar dibandingkan dengan
dua jenis ekstrak lainnya. Dengan demikian, ekstrak S. ornata memiliki toksisitas yang lebih rendah jika dibandingkan dengan kedua jenis ekstrak Selaginella lainnya dan diharapkan akan memiliki tingkat keamanan yang lebih tinggi.
Perbedaan hasil pengujian LD50 ditunjukkan dengan adanya perbedaan
respon pada setiap mencit yaitu perubahan bobot badan mencit di akhir
pengamatan uji LD50. Perubahan bobot badan mencit diduga karena perbedaan
tingkat toksisitas dan kandungan senyawa dari jenis ekstrak Selaginella dengan jumlah dan kadar tidak sama. Tingkat toksisitas tanaman berhubungan dengan
metabolit sekunder yang terkandung di dalamnya (Hutapea 1999). Tingkat
toksisitas hanya sedikit toksik pada ekstrak S. ornata dan S. plana mampu meningkatkan bobot badan mencit berturut-turut 1.1 dan 0.5 g, sedangkan tingkat
toksisitas cukup toksik pada ekstrak S. willdenovii menyebabkan penurunan bobot badan (1.2 g) (Gambar 6 dan 7). Senyawa metabolit sekunder yang utama pada
Selaginella adalah biflavonoid (Seigler 1998). Akan tetapi, informasi lain dari hasil uji fitokimia dengan menggunakan pelarut etanol menunjukkan bahwa
Pengujian aktivitas antioksidan menggunakan ekstrak Selaginella dilakukan dengan pemberian cekaman pada mencit. Pemberian cekaman telah
menunjukkan efektivitasnya untuk menyebabkan mencit mendapat cekaman
oksidatif. Hal ini ditunjukkan dari hasil pengujian aktivitas antioksidan ekstrak
Selaginella dengan uji peroksidasi lipid yang memperoleh konsentrasi MDA yang berbeda-beda pada mencit yang tercekam dan tidak tercekam. Pada kondisi
tercekam membutuhkan senyawa penghasil energi. Secara fisiologis, pada kondisi
kekurangan pangan, tubuh harus mempertahankan kadar glukosa darah. Glikogen
hati hanya dapat menyediakan glukosa selama beberapa jam, dan setelah itu
terjadi proses glukoneogenesis dalam hati yang membutuhkan substrat dari
jaringan lain. Substrat tersebut berasal dari asam amino glikogenik dan lemak
(Montgomery et al. 1983). Lemak netral dikatabolisme menjadi asam lemak dan gliserol. Asam lemak merupakan bahan bakar utama. Katabolisme asam lemak
pada saat kondisi normal berbeda dengan kondisi saat kelaparan. Katabolisme
asam lemak pada kondisi normal terjadi di dalam mitokondria melalui proses β
-oksidasi. Akan tetapi, pada kondisi kelaparan, terjadi peningkatan proses β
-oksidasi pada peroksisom (jalur minor proses β-oksidasi). Peningkatan aktivitas β
-oksidasi di dalam peroksisom tersebut mengakibatkan peningkatan jumlah radikal
bebas (oksidan) yang merupakan hasil samping metabolisme (Orellana et al. 1992; Wresdiyati & Makita 1995). Alfarabi et al. (2010) melaporkan bahwa radikal bebas yang diproduksi dari proses biokimia dari dalam tubuh seperti ROS
dapat mengakibatkan peningkatan peroksidasi lipid dari lipid tak jenuh. Lipid
yang mengandung asam lemak tak jenuh tersebut mudah diserang oleh radikal
bebas pada ikatan gandanya dan membentuk peroksidasi lipid yang menyebabkan
terjadinya kerusakan strukturnya. Serangan radikal bebas tersebut selanjutnya
akan berakibat munculnya berbagai penyakit seperti penyakit jantung,
aterosklerosis, stroke, dan kanker (Hariyatmi 2004; Alfarabi et al. 2010).
Pengujian tingkat peroksidasi lipid dengan mengukur konsentrasi MDA
dalam materi biologi telah digunakan secara luas sebagai indikator adanya
Pada kondisi tercekam, pemberian ekstrak S. ornata menggunakan dosis 0.6 g ekstrak/kg bb mampu menekan peroksidasi lipid sampai dengan 0.170 nmol/µg
protein (14% lebih rendah) dibandingkan mencit yang tidak mendapat ekstrak
(1.010 nmol/µg protein) (Gambar 8). Aktivitas penghambatan peroksidasi lipid
pada hati mencit diduga terjadi karena kandungan biflavonoid Selaginella berpotensi sebagai antioksidan (Gayathri et al. 2005; Chikmawati et al. 2007). Biflavonoid pada Selaginella memiliki gugus pendonor hidroksil (OH) yang diduga dapat menghambat proses terjadinya peroksidasi lemak pada tahap inisiasi,
sehingga radikal bebas tidak dapat berkembang membentuk radikal bebas yang
baru (Rahman et al. 2007). Ekstrak Selaginella yang memiliki kandungan senyawa flavonoid menunjukkan aktivitas antioksidan yang kuat dengan
menghambat terjadinya peroksidasi lipid. Kandungan senyawa tersebut diduga
memiliki kemampuan untuk melindungi membran sel dari serangan radikal bebas
(Saija et al. 1995).
Pemberian ekstrak S. ornata, S. plana, dan S. willdenovii pada mencit dapat menekan tingkat peroksidasi lipid yang relatif sama pada dosis 0.3 g
ekstrak/kg bb. Namun demikian, pemberian ekstrak S. plana (1.2 g ekstrak/kg bb) dan S. willdenovii (0.6 dan 1.2 g ekstrak/kg bb) menyebabkan meningkatnya aktivitas peroksidasi lipid yang lebih tinggi dibandingkan dengan pemberian
ekstrak dosis 0.3 g ekstrak/kg bb. Tingginya tingkat peroksidasi lipid pada kedua
ekstrak Selaginella tersebut diduga telah menunjukkan efek toksik (Gambar 8). Hal ini berarti pemberian ekstrak S. plana dan S. willdenovii menggunakan dosis tersebut tidak memberikan efek antioksidan. Efek toksik diduga karena
kandungan bahan bioaktif lainnya yang terkandung di dalam ekstrak Selaginella, diantaranya saponin dan alkaloid. Hasil uji fitokimia menunjukkan bahwa ekstrak
S. willdenovii memiliki kandungan saponin yang lebih banyak dibandingkan ekstrak lainnya (Chikmawati et al. 2007). Nio (1989) melaporkan bahwa saponin mempunyai rasa pahit dan mempunyai efek racun yang kuat untuk ikan dan
amfibi. Bahan bioaktif lainnya yaitu alkaloid yang mempunyai rasa pahit dan
berfungsi sebagai antiserangga yang diduga juga dapat mempengaruhi efek toksik
Data yang sangat menarik juga terlihat pada mencit yang tidak mendapat
cekaman, namun mendapat ekstrak Selaginella dengan dosis 0.6 g ekstrak/kg bb. Nilai-nilai MDA untuk ketiga pemberian ekstrak tersebut berturut-turut 0.045,
0.140, dan 0.155 nmol/µg protein untuk ekstrak S. ornata, S. plana, dan S. willdenovii (Gambar 9). Ketiga nilai MDA tersebut lebih rendah dari nilai MDA mencit yang tidak mendapat cekaman dan tidak mendapat ekstrak (0.360
nmol/µg protein) (Tabel 2). Hal ini membuktikan bahwa ekstrak Selaginella dapat menekan tingkat peroksidasi lipid tidak hanya pada mencit yang mendapat
cekaman tetapi juga pada mencit yang tidak mendapat cekaman. Hal ini berarti
ekstrak Selaginella yang berpotensi sebagai antioksidan dapat dimanfaatkan untuk pengobatan (kuratif) dan pencegahan (preventif).
Superoksida dismutase merupakan enzim yang berada pada cairan
intraseluler yang berpartisipasi pada proses degadrasi senyawa radikal bebas
intraseluler, seperti anion superoksida menjadi hidrogen peroksida dan oksigen.
Enzim ini menghambat kehadiran simultan dari anion superoksida dan hidrogen
peroksida yang berasal dari pembentukan radikal hidroksil (Wresdiyati et al. 2007). Pemberian ekstrak S. ornata (dosis 0.3 g ekstrak/kg bb) pada mencit menunjukkan nilai aktivitas antioksidan yang tinggi (aktivitas SOD tertinggi
51.9%), hampir 20% lebih tinggi daripada nilai SOD pada mencit kontrol negatif
(32%). Aktivitas SOD meningkat dengan pemberian ekstrak Selaginella diduga dapat menghambat produksi ion superoksida (O2–) dan peroxynitrite (ONOO–)
dengan cara memicu kerja sel-sel sesuai dengan dosis yang ditentukan
(Menvielle-Bourg 2005).
Aktivitas antioksidan yang tinggi ditunjukkan dari nilai penghambatan
terhadap peroksidasi lipid (konsentrasi MDA rendah) dan peningkatan aktivitas
SOD yang tinggi. Enzim SOD merupakan suatu kelompok enzim protektif yang
bekerja sebagai sistem pertahanan yang mampu melindungi sel dari pengaruh
metabolit oksigen (Hariyatmi 2004). Konsumsi antioksidan dari tumbuhan juga
dapat meningkatkan daya tahan tubuh terhadap cekaman oksidatif
biflavonoid. Hasil identifikasi biflavonoid dari beberapa ekstrak Selaginella menunjukkan adanya amentoflavon pada ekstrak S. willdenovii (2.46 ppm), namun tidak terdeteksi pada S. ornata dan S. plana. Tipe biflavonoid lain yang diduga terdapat dalam spesies Selaginella ini antara lain seperti ginkgetin dan robustaflavon (Chikmawati et al. 2007), namun hingga saat ini untuk pengujian kandungan biflavonoid dari ketiga ekstrak Selaginella tersebut menggunakan standar ginkgetin dan robustaflavon belum bisa dilakukan. Yang et al. (2006) melaporkan bahwa S. tamariscina yang mengandung amentoflavon dapat menghambat produksi NO (nitrat oksida) pada makrofage melalui inaktivasi
nuclear factor- B (NF- B), akan tetapi robustaflavon tidak dapat menghambat produksi nitrat oksida. Ginkgetin memberikan beberapa pengaruh yang
berbeda-beda, antara lain berkhasiat sebagai antioksidan (Sah et al. 2005) dan meningkatkan kadar hidrogen peroksida (Su et al. 2000).
Pengujian aktivitas antioksidan dengan mengukur kadar MDA dan SOD
menunjukkan perbedaan untuk ketiga jenis esktrak Selaginella. Metode pengujian analisis aktivitas antioksidan dengan peroksidasi lipid menunjukkan tingkat
sensitifitas yang lebih baik dibandingkan pengujian aktivitas SOD. Hal ini
ditunjukkan oleh pengujian peroksidasi lipid yang dapat memperoleh jenis data
yang lebih representatif untuk dideskripsikan.
Selaginella memiliki potensi antioksidan diantaranya karena memiliki metabolit sekunder terutama biflavonoid, perlu dikembangkan menjadi herbal
yang berstandar dan fitofarmaka. Obat herbal terstandar adalah sediaan obat
bahan alam yang telah dibuktikan keamanan dan khasiatnya secara ilmiah dengan
uji praklinik dan bahan bakunya telah distandarisasi. Fitofarmaka adalah sediaan
obat bahan alam yang telah dibuktikan keamanan dan khasiatnya secara ilmiah
dengan uji praklinik dan uji klinik, bahan baku dan produk jadinya telah
distandarisasi (BPOM 2005). Tahap-tahap dalam pengembangan obat herbal
diantaranya: (1) isolasi senyawa aktif, (2) identifikasi senyawa aktif, (3)
penentuan potensi senyawa aktif, (4) penentuan kadar (%) senyawa aktif
sehat, (2) standarisasi dosis ekstrak Selaginella, (3) standarisasi bahan baku, dan (4) standarisasi produk jadinya (BPOM 2005; Khoiri 2009). Pelaksanaan
tahapan-tahapan tersebut akan mendukung terwujudnya Selaginella sebagai bahan antioksidan yang bermanfaat bagi kesehatan manusia, khususnya masyarakat
Indonesia.
SIMPULAN DAN SARAN
Simpulan
Ekstrak S. ornata, S. plana, dan S. willdenovii memiliki aktivitas antioksidan yang berbeda. Pengujian aktivitas antioksidan yang dimulai dengan
uji toksisitas akut menunjukkan nilai LD50 ekstrak S. ornata dan S. plana
dikategorikan hanya sedikit toksik (9 dan 5.2 g ekstrak/kg bb), sedangkan ekstrak
S. willdenovii dikategorikan cukup toksik (3 g ekstrak/kg bb).
Aktivitas antioksidan tertinggi terdapat pada ekstrak S. ornata dengan konsentrasi MDA terendah 0.170 nmol/µg protein (14% lebih rendah dari kontrol)
dan nilai SOD tertinggi (51.9%) (20% lebih tinggi dari kontrol). Dosis 0.6 g
ekstrak/kg bb merupakan dosis terbaik untuk S. ornata dan S. plana yang mampu menekan peroksidasi lipid berturut-turut 0.170 dan 0.240 nmol/µg protein.
Namun, dosis ekstrak 0.3 g/kg bb sudah cukup untuk meningkatkan aktivitas SOD
(54.6%). Pengujian aktivitas antioksidan ekstrak Selaginella dengan analisis peroksidasi lipid lebih baik daripada pengujian dengan analisis SOD.
Saran
Pemberian ekstrak pada rentangan dosis 0.3–0.6 g ekstrak/kg bb
memerlukan pengujian lebih lanjut untuk mendapatkan konsentrasi MDA yang
lebih tepat untuk ketiga jenis ekstrak Selaginella, khususnya S. willdenovii sehingga akan mendapat suatu potensi aktivitas antioksidan yang lebih tinggi.
Pemanfaatan Selaginella sebagai salah satu obat herbal yang dapat memenuhi standar sebagai bahan antioksidan bagi manusia perlu dikaji lebih lanjut.
Standarisasi perlu didukung dengan data ilmiah dan uji klinis bertujuan untuk
DAFTAR PUSTAKA
Alfarabi M, Bintang M, Suryani, Safithri M. 2010. The comparative ability of antioxidant activity of Piper crocatum in inhibiting fatty acid oxidation and free radical scavenging. Hayati J Biosci 17:201–204.
Ali SS, Kasoju N, Luthra A, Singh A, Sharanabasava H, Sahu A, Bora U. 2008. Indian medicinal herbs as sources of antioxidants [review]. Food Res Int 41:1–15.
Apriyantono A, Fardiaz D, Puspitasari N L, Sedarnawati, Budiyanto S. 1989. Analisis Pangan. Penerbit IPB Press.
[BPOM] Badan Pengawas Obat dan Makanan. 2005. Kriteria dan Tata Laksana Pendaftaran Obat Tradisional, Obat Herbal Terstandar dan Fitofarmaka. Jakarta. Jakarta. BPOM RI No: HK.00.05.41.1384.
Blokhina O, Virolainen E, Fagerstedt. 2003. Antioxidant, oxidative damage and oxygen deprivation stress [review]. Ann Bot 91:179–194.
Camus JM. 1997. The genus Selaginella (Selaginellaceae) in Malesia. Di dalam: Dransfield. J Plant Diversity of Malesia III: 59–69.
Chikmawati T, Setyawan AD, Miftahudin. 2007. Kandungan Fitokimia Ekstrak Tumbuhan Selaginella dari Pulau Jawa. Seminar Nasional Penggalang Taksonomi Tumbuhan Indonesia. Bogor, 17–19 November 2007.
Chikmawati T, Wijayanto A, Miftahudin. 2009. Potensi Selaginella Sebagai Antioksidan. Seminar Nasional Biologi XX, Universitas Islam Negeri Malang, 25 Juli 2009.
Gaspar J, Rodrigues A, Laires A, Silva F, Costa S, Monteiro MJ, Monteiro C, Rueff J. 1994. On the mechanism of genotoxicity and metabolism of quercetin. Mutagenesis 9:445–449.
Gayathri V, Asha V, Subromanian A. 2005. Preliminary studies on the immunomodulatory and antioxidant properties of Selaginella species. Indian J Pharmacol 37:381–385.
Gurr MI, Harwood JL, Frayn KN. 2002. Lipid Biochemistry 5th edition. UK: Blackwell Science.
Hariyatmi. 2004. Kemampuan vitamin E sebagai antioksidan terhadap radikal bebas pada lanjut usia. MIPA 14:52–60.
Harmita, Radji M. 2008. Analisis Hayati. Jakarta: Penerbit Buku Kedokteran. EGC.
Hasani P, Yasa N, Vosough-Ghanbari S, Mohammadirad A, Dehghan G, Abdollahi M. 2007. In vivo antioxidant potential of Teucrium polium, as compared to α-tocopherol. Acta Pharm 57:123–129.
Heikkila RE, Cabbat FS, Cohen G. 1976. In Vivo Inhibition of Superoxide Dismutase in Mice By Diethyldithiocarbamate. J Biol Chem 251:2182– 2185.
Hutapea JR. 1999. Inventaris Tanaman Obat Indonesia. Jilid V. Jakarta : Badan Penelitian dan Pengembangan Kesehatan. Departemen Kesehatan.
Jermy AC. 1990. Selaginellaceae. Di dalam: Kubitzki K, Kramer KU, Green PS. The Families and Genera of Vascular Plants, 1. Pteridophytes and Gymnosperms. Berlin: Springer.
Khoiri M. 2009. Aktivitas Anti Tumor Ekstrak Etanol Selaginella pada Sel Tumor Kelenjar Mamari mencit (Mus musculus) C3H. [tesis]. Bogor: Sekolah Pasca Sarjana Institut Pertanian Bogor.
Kubo I, Masuoka N, Xiao P, Haraguchi H. 2002. Antioxidant Activity of Dodecyl Gallate. J Agric Food Chem 50: 3533–3539.
Kumar A, Kaur R, Arora S. 2010. Free radical scavenging potential of some Indian medicinal plants. J Medicinal Plants Res.4:2034–2042.
Markham KR. 1988. Cara Mengidentifikasi Flavonoid. Penerbit ITB Bandung. Mau JL, Lin HC, Song SF. 2002. Antioxidant properties of several specialty
mushrooms. Food Res Int 35:519–526.
Menvielle-Bourg FJ. 2005. Superoxide dismutase (SOD), a powerful antioxidant, is now available orally. Phytothérapie 3:1–4
Mihara M, Uchiyama M, Fukazawa K. 1980. Thiobarbituric acid value on fresh homogenate of rat as parameter of lipid peroxidation in aging, CCl4
intoxication and vitamin e deficiency. Biochem Med 23:302–311.
Myara I, Pico I, Vedie B, Moatti N. 1993. A method to screen for the antioxidant effect of compounds on low-density lipoprotein (LDL): illustration with flavonoids. J Pharmacol and Toxicology Methods 30:69–73.
Nio KO. 1989. Zat-zat toksik yang secara alamiah ada pada bahan makanan nabati. J Cermin Dunia Kedokteran 58:24–28.
Ohkawa H, Ohishi N, Yagi K. 1979. Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction. Anal Biochem 95:351–358.
Orellana M, Fuentes O, Rosenbluth H, Lara M, Valdes F. 1992. Modulatios of rats liver peroxisomal and microsomal fatty acids oxidation by starvation. FEBS 310:193–196.
Packer L, Cadenas E, editor. 2002. Handbook of Antioxidant 2nd edition. New York: Marcel Dekker Inc.
Prangdimurti E, Muchtadi D, Astawan M, Zakaria FR. 2006. Aktivitas Antioksidan Ekstrak Daun Suji (Pleomele angustifolia N. E. Brown). J Teknol dan Industri Pangan 17:79–86.
Rahman M, Riaz M, Desai UR. 2007. Synthesis of bologically relevant biflavonoids [review]. Chemistry and Biodiversity 4:2495–2527.
Rose WM, Creighton MO, Stewart DHPJ, Sanwal M, Trevithick GR. 1982. In vivo effects of vitamin E on cataractogenesis in diabetic rats. Canadian J Ophtalmology 17:61–66.
Sah NK, Singh SNP, Sahdev S, Banerji S, Jha V, Khan Z, Hasnain SE. 2005. Indian herb ‘Sanjeevani’ (Selaginella bryopteris) can promote growth and protect against heat shock and apoptotic activities of ultra violet and oxidative stress. J Biosci 30:499–505.
Saija A, Scalese M, Lanza M, Marzullo D, Bonina F, Castelli F. 1995. Flavonoids as antioxidant agents: importance of their interaction with biomembranes. Free Radical Biol & Medicine 19:481–486.
Salisbury FB, Ross CW. 1995. Fisiologi Tumbuhan Jilid II. Diah R Lukman dan Sumaryono, penerjemah. Bandung : ITB Press. Terjemahan dari : Plant Physiology.
Sanchez-Moreno C, Larrauri JA, Saura-Calixto F. 1999. Free radical scavenging capacity an inhibition of lipid oxidation of wines, grape juices and related polyphenolic constituents. Food Res Int 32:407–412.
Seigler DS. 1998. Plant Secondary Metabolism. Dodrecht: Kluwer.
Suhartono E, Fujiati, Aflanie I. 2002. Oxygen toxicity by radiation and effect of glutamic piruvat transamine (GPT) activity rat plasma after vitamin C treatment. Diajukan pada International seminar on Environmental chemistry and Toxicology, Yogyakarta.
Sun DM, Luo WH, Li ZY. 2006. Determination of amentoflavone in 11 Spesies of Selaginella medical material by HPLC. Zhong-Yao-Cai 29: 26–28. Su Y, Sun CM, Chuang HH, Chang PT. 2000. Studies on the cytotoxic
mechanisms of ginkgetin in a human ovarian adenocarcinoma cell line. NaunynSchmiedebergs Arch Pharmacol 362:82–90.
Thomson GE. 2007. The Health Benefit of Traditional Chinese Plant Medicine: Weighing the scientific evidence. Australia: RIRDC Pr.
Tjitrosoepomo G. 1994. Taksonomi Tumbuhan. Jakarta: Bhratara Karya Aksara Pr.
Tuminah S. 2000. Radikal bebas dan antioksidan kaitannya dengan nutrisi dan penyakit kronis. J Cermin Dunia Kedokteran 128:49–51.
Weil CS. 1952. Tables for convenient calculation of median eff