LAMPIRAN 1.SKEMA ALUR PIKIR
● Pada perawatan endodontik, medikamen saluran akar digunakan sebagai agen
antimikroba beberapa diantaranya untuk mengeliminasi organisme, mengurangi rasa sakit, mempercepat penyembuhan dan pembentukan jaringan keras dan mencegah terjadinya infeksi ulang.Menurut Nikita IU (2012) dasar keberhasilan perawatan endodontik adalah mengeliminasi mikroorganisme pada saluran akar.
• Menurut Athanassiadis B (2007) tujuan utama perawatan saluran akar : menghilangkan bakteri sebanyak mungkin dari saluran akar dan menciptakan lingkungan organisme yang tersisa agar tidak dapat bertahan hidup.
● Kalsium Hidroksida (Ca(OH)2 merupakan medikamen saluran akar yang paling sering digunakan sejak tahun 1920.
● Menurut Attanassiadis, (2007) Adanya aktivitas antimikroba kalsium
hidroksida dikarenakan pelepasan dan difusi bagi hidupnya mikroorganisme.
● Menurut Gomes et al (2002), walaupun kalsium hidroksida direkomendasikan sebagai bahan medikamen saluran akar pada periodontitis apikali, bukan berarti bahwa pemakaian kalsium hidroksida dapat digunakan secara universal, karena kalisum hidroksida tidak menunjukkan kemampuan yang sama terhadap
seluruh bakteri.
• Streptococcus mutans berperan dalam kolonisasi awal pembentukan plak dalam gigi .menurut Hejo et al (2009) pembentukan bioflim merupakan faktor virulensi dari Streptococcus mutans.
• Menurut Sundqvist (1994) Sterptococcussp adalah bakteri yang paling banyak ke dua ditemukan pada saluran akar yaitu sebanyak 40%.
● Obat herbal secara umum dinilai lebih aman dibandingkan dengan obat modern, karena efek samping dari obat herbal lebih sedikit dari obat modern.
● Daun Afrika (Vernomia amygdalina) merupakan tanaman herbal yang memiliki aktivitas antibakteri yaitu dengan kandungan fitokimia yang dimiliki seperti Flavonoid,Tanmin, Anthraquinones, dan Saponin.
● Daun afrika (Vernonia amygdalina) memiliki aktifitas antibakteri yang lebih tinggi dibandingkan dengan batang dan akar.
● Di Nigeria Anibijuwon et al (2012), menyatakan ekstrak etanol Vernonia amygdalina menunjukkan hasil KHM 30 Mg/Ml dan KBM 50 mg/ml terhadap
pertumbuhan bakteri Streptococcus mutans.
Berdasarkan uraian di atas diketahui bahwa daun Afrika (Vernonia amygdalina ) memiliki aktifitas antibakteri, namun hingga saat ini belum ada penelitian
mengenai daya antibakteri ekstrak etanol daun Afrika (Vernonia amygdalina ) di Medan, Indonesia terhadap bakteri Streptococcus mutans sehingga dapat
digunakan sebagai bahan alternatif medikamen saluran akar.
Yang menjadi permasalahan :
Apakah ada daya antibakteria ekstrak etanol daun Afrika (Vernonia amygdalina )di Medan, Indonesia sebagai bahan alternatif medikamen saluran akar terhadap
Streptococcus mutansdengan mencari konsentrasi minimal ekstrak etanol daun
Afrika (Vernonia amygdalina ) yang dapat membunuh Streptococcus mutans ?
Tujuan Penelitian :
Untuk mengetahui daya antibakteria ekstrak etanol daun Afrika (Vernonia amygdalina)di Medan, Indonesia sebagai bahan alternatif medikamen saluran
akar terhadap Streptococcus mutans dengan mencari konsentrasi minimal ekstrak etanol daun Afrika (Verninia amygdalina) yang dapat membunuh Streptococcus mutans.
Judul penelitian :
LAMPIRAN 2. ALUR PENELITIAN
1. Alur Ekstraksi Daun Afrika (Vernonia amygdalina)
Daun Afrika (Vernonia amygdalina) 2 kg dicuci dan dikeringkan di lemari pengering
Daun Afrika yang telah kering diblender dan diayak
350 gram serbuk simplisia direndam dengan etanol 70% selama 15 menit
Simplisia yang telah direndam dipindahkan ke dalam perkolator dan tambahkan etanol
Perkolator ditutup dengan aluminium foil dan dibiarkan selama 24 jam
Cairan diteteskan dan ulangi sampai jernih
Ekstrak cair
Diuapkan dengan vacuum rotapavor sampai kental
Ekstrak kental berwarna kecoklatan
Disimpan dalam botol kaca tertutup, simpan di tempat sejuk
Diberi label
2. Uji Dilusi Efek Antibakteri Ekstrak Etanol Daun Afrika
Ekstrak etanol daun Afrika (Vernonia amygdalina) direplikasi 4x dengan konsentrasi 100%, 50%, 25%, 12,5%, 6,25%, 3,125% (masing-masing
konsentrasi = 1 ml) + suspensi bakteri Streptococcus mutan (100 µl)
Diinkubasi dalam inkubator CO2 dengan suhu 37˚C selama 24 jam
Semua konsentrasi dibandingkan dengan kekeruhan
Masing-masing kelompok konsentrasi dicampur dengan menggunakan vorteks
Ambil 100 µl dan teteskan pada media padat (Trypticase Soy Agar)
Dimasukkan ke dalam inkubator CO2 dengan suhu 37˚C selama 24 jam
Hitung jumlah koloni bakteri pada tiap petri
Hasil
3. Uji Difusi Efek Antibakteri Ekstrak Etanol Daun Afrika
Siapakan lempengan agar yang telah disimpan pada lemari pendingin
Bila permukaan inkubasi dalam inkubator CO2 dengan suhu 37˚C selama 30 menit
Bakteri yang di uji, dengan ose diambil dari koloninya dan masukkan ke tabung reaksi yang berisi medium cair eramkan selaman 2 jam pada suhu 37˚C
Penyemaian bakteri dengan menggunakan kapas lidi streril dicelupkan ke media bakteri yang telah di inkubasi
Kapas lidi disemaikan pada permukaan media hingga rata
Letakkan cakram antimikroba/ blankdisk di atas permukaan lempeng agar dengan pinset
Diinkubasi dengan suhu 37˚C selama 24 jam
Mengukur daerah inhibisi dengan jangka sorong
Hasil
Kesimpulan
LAMPIRAN 4
LAMPIRAN 6
HASIL UJI STATISKA UJI DIFUSI Descriptivesa
kelompok Statistic Std. Error
difusi 100% Mean 23.5000 .35355
95% Confidence Interval for Mean
Lower Bound 22.3748
Upper Bound 24.6252
5% Trimmed Mean 23.4722
Median 23.2500
Variance .500
Std. Deviation .70711
Minimum 23.00
Maximum 24.50
Range 1.50
Interquartile Range 1.25
Skewness 1.414 1.014
Kurtosis 1.500 2.619
50% Mean 20.2500 .14434
95% Confidence Interval for Mean
Lower Bound 19.7907
Upper Bound 20.7093
5% Trimmed Mean 20.2500
Median 20.2500
Variance .083
Std. Deviation .28868
Minimum 20.00
Maximum 20.50
Range .50
Interquartile Range .50
Skewness .000 1.014
Kurtosis -6.000 2.619
25% Mean 15.2500 .14434
95% Confidence Interval for Lower Bound 14.7907
Mean Upper Bound 15.7093
5% Trimmed Mean 15.2500
Median 15.2500
Variance .083
Std. Deviation .28868
Minimum 15.00
Maximum 15.50
Range .50
Interquartile Range .50
Skewness .000 1.014
Kurtosis -6.000 2.619
12,5% Mean 12.2500 .14434
95% Confidence Interval for Mean Lower Bound 11.7907
Upper Bound 12.7093
5% Trimmed Mean 12.2500
Median 12.2500
Variance .083
Std. Deviation .28868
Minimum 12.00
Maximum 12.50
Range .50
Interquartile Range .50
Skewness .000 1.014
Kurtosis -6.000 2.619
3,125% Mean .3025 .14436
95% Confidence Interval for Mean
Std. Deviation .28872
Minimum .05
Maximum .60
Interquartile Range .52
Skewness .102 1.014
Kurtosis -5.403 2.619
a. difusi is constant when kelompok = 6,25%. It has been omitted.
Kruskal-Wallis Test
a. Kruskal Wallis Test
Test Statisticsb
difusi
Mann-Whitney U .000
Wilcoxon W 10.000
Z -2.352
Asymp. Sig. (2-tailed) .019
Exact Sig. [2*(1-tailed Sig.)] .029a a. Not corrected for ties.
b. Grouping Variable: kelompok
Mann-Whitney Test
Mann-Whitney U .000
Wilcoxon W 10.000
Z -2.352
Asymp. Sig. (2-tailed) .019 Exact Sig. [2*(1-tailed Sig.)] .029a a. Not corrected for ties.
b. Grouping Variable: kelompok
Test Statisticsb
difusi
Mann-Whitney U .000
Wilcoxon W 10.000
Z -2.366
Asymp. Sig. (2-tailed) .018
Exact Sig. [2*(1-tailed Sig.)] .029a a. Not corrected for ties.
b. Grouping Variable: kelompok
Mann-Whitney Test
Mann-Whitney U .000
Wilcoxon W 10.000
Z -2.352
Asymp. Sig. (2-tailed) .019 Exact Sig. [2*(1-tailed Sig.)] .029a a. Not corrected for ties.
b. Grouping Variable: kelompok
Test Statisticsb
difusi
Mann-Whitney U .000
Wilcoxon W 10.000
Z -2.366
Asymp. Sig. (2-tailed) .018 Exact Sig. [2*(1-tailed Sig.)] .029a a. Not corrected for ties.
b. Grouping Variable: kelompok
Mann-Whitney Test
Mann-Whitney U .000
Wilcoxon W 10.000
Z -2.366
Asymp. Sig. (2-tailed) .018
Exact Sig. [2*(1-tailed Sig.)] .029a a. Not corrected for ties.
b. Grouping Variable: kelompok
Test Statisticsb
difusi
Mann-Whitney U .000
Wilcoxon W 10.000
Z -2.477
Asymp. Sig. (2-tailed) .013
Exact Sig. [2*(1-tailed Sig.)] .029a a. Not corrected for ties.
b. Grouping Variable: kelompok
Mann-Whitney Test
Ranks
kelompok N Mean Rank Sum of Ranks
difusi 50% 4 6.50 26.00
6,25% 4 2.50 10.00
Total 8
Test Statisticsb
difusi
Mann-Whitney U .000
Wilcoxon W 10.000
Z -2.494
Asymp. Sig. (2-tailed) .013
Exact Sig. [2*(1-tailed Sig.)] .029a a. Not corrected for ties.
b. Grouping Variable: kelompok
Mann-Whitney Test
Mann-Whitney U .000
Wilcoxon W 10.000
Z -2.494
Asymp. Sig. (2-tailed) .013
Exact Sig. [2*(1-tailed Sig.)] .029a a. Not corrected for ties.
b. Grouping Variable: kelompok
Mann-Whitney Test
Mann-Whitney U .000
Wilcoxon W 10.000
Z -2.494
Asymp. Sig. (2-tailed) .013 Exact Sig. [2*(1-tailed Sig.)] .029a a. Not corrected for ties.
Mann-Whitney Test
Mann-Whitney U .000
Wilcoxon W 10.000
Z -2.323
Asymp. Sig. (2-tailed) .020
Exact Sig. [2*(1-tailed Sig.)] .029a a. Not corrected for ties.
b. Grouping Variable: kelompok
Mann-Whitney Test
Mann-Whitney U .000
Wilcoxon W 10.000
Z -2.337
Asymp. Sig. (2-tailed) .019
Exact Sig. [2*(1-tailed Sig.)] .029a a. Not corrected for ties.
Test Statisticsb
difusi
Mann-Whitney U .000
Wilcoxon W 10.000
Z -2.337
Asymp. Sig. (2-tailed) .019
Exact Sig. [2*(1-tailed Sig.)] .029a a. Not corrected for ties.
b. Grouping Variable: kelompok
Mann-Whitney Test
Ranks
kelompok N Mean Rank Sum of Ranks
difusi 25% 4 6.50 26.00
3,125% 4 2.50 10.00
Total 8
Test Statisticsb
difusi
Mann-Whitney U .000
Wilcoxon W 10.000
Z -2.337
Asymp. Sig. (2-tailed) .019
Exact Sig. [2*(1-tailed Sig.)] .029a a. Not corrected for ties.
Mann-Whitney Test
Mann-Whitney U .000
Wilcoxon W 10.000
Z -2.337
Asymp. Sig. (2-tailed) .019 Exact Sig. [2*(1-tailed Sig.)] .029a a. Not corrected for ties.
b. Grouping Variable: kelompok
Mann-Whitney Test
Mann-Whitney U .000
Wilcoxon W 10.000
Z -2.460
Asymp. Sig. (2-tailed) .014 Exact Sig. [2*(1-tailed Sig.)] .029a a. Not corrected for ties.
b. Grouping Variable: kelompok
Mann-Whitney Test
Ranks
kelompok N Mean Rank Sum of Ranks
difusi 100% 4 6.50 26.00
6,25% 4 2.50 10.00
Total 8
Test Statisticsb
difusi
Mann-Whitney U .000
Wilcoxon W 10.000
Z -2.477
Asymp. Sig. (2-tailed) .013
Exact Sig. [2*(1-tailed Sig.)] .029a a. Not correcte d for ties.
Descriptivesa,b,c,d,e
kelompok Statistic Std. Error
dilusi 6,25% Mean 1.05E7 1.291E5
95% Confidence Interval for Mean
Lower Bound 1.01E7
Upper Bound 1.09E7
5% Trimmed Mean 1.05E7
Median 1.05E7
Variance 6.667E10
Std. Deviation 2.582E5
Minimum 1.E7
Maximum 1.E7
Range 600000
Interquartile Range 500000
Skewness .000 1.014
Kurtosis -1.200 2.619
Kontrol + Mean 5.05E7 1.109E5
95% Confidence Interval for Mean
Lower Bound 5.02E7
Upper Bound 5.09E7
5% Trimmed Mean 5.05E7
Median 5.05E7
Variance 4.917E10
Std. Deviation 2.217E5
Minimum 5.E7
Maximum 5.E7
Range 500000
Interquartile Range 425000
UJI DILUSI
a. Lilliefors Significance Correction
b. dilusi is constant when kelompok = 100%. It has been omitted. c. dilusi is constant when kelompok = 50%. It has been omitted. d. dilusi is constant when kelompok = 25%. It has been omitted. e. dilusi is constant when kelompok = 12,5%. It has been omitted. f. dilusi is constant when kelompok = kontrol -. It has been omitted.
Skewness .482 1.014
Kurtosis -1.700 2.619
a. dilusi is constant when kelompok = 100%. It has been omitted. b. dilusi is constant when kelompok = 50%. It has been omitted. c. dilusi is constant when kelompok = 25%. It has been omitted. d. dilusi is constant when kelompok = 12,5%. It has been omitted. e. dilusi is constant when kelompok = kontrol -. It has been omitted.
Mann-Whitney Test
Mann-Whitney U .000
Wilcoxon W 10.000
Z -2.309
Asymp. Sig. (2-tailed) .021 Exact Sig. [2*(1-tailed Sig.)] .029a a. Not corrected for ties.
b. Grouping Variable: kelompok
Mann-Whitney Test
Mann-Whitney U .000
Wilcoxon W 10.000
Z -2.460
Asymp. Sig. (2-tailed) .014 Exact Sig. [2*(1-tailed Sig.)] .029a a. Not corrected for ties.
Mann-Whitney Test
Mann-Whitney U .000
Wilcoxon W 10.000
Z -2.460
Asymp. Sig. (2-tailed) .014 Exact Sig. [2*(1-tailed Sig.)] .029a a. Not corrected for ties.
b. Grouping Variable: kelompok Mann-Whitney Test
Mann-Whitney U 8.000
Wilcoxon W 18.000
Z .000
Asymp. Sig. (2-tailed) 1.000 Exact Sig. [2*(1-tailed Sig.)] 1.000a a. Not corrected for ties.
b. Grouping Variable: kelompok
Ranks a. Kruskal Wallis Test
b. Grouping Variable: kelompok
Descriptives
kelompok Statistic Std. Error
difusi 100% Mean 23.5000 .35355
95% Confidence Interval for Mean
Lower Bound 22.3748
Upper Bound 24.6252
5% Trimmed Mean 23.4722
Median 23.2500
Variance .500
Std. Deviation .70711
Minimum 23.00
Maximum 24.50
Range 1.50
Interquartile Range 1.25
Skewness 1.414 1.014
Kurtosis 1.500 2.619
50% Mean 20.2500 .14434
95% Confidence Interval for Mean
Lower Bound 19.7907
Upper Bound 20.7093
5% Trimmed Mean 20.2500
Median 20.2500
Std. Deviation .28868
Minimum 20.00
Maximum 20.50
Range .50
Interquartile Range .50
Skewness .000 1.014
Kurtosis -6.000 2.619
25% Mean 15.2500 .14434
95% Confidence Interval for Mean
Lower Bound 14.7907
Upper Bound 15.7093
5% Trimmed Mean 15.2500
Median 15.2500
Variance .083
Std. Deviation .28868
Minimum 15.00
Maximum 15.50
Range .50
Interquartile Range .50
Skewness .000 1.014
Kurtosis -6.000 2.619
12,5% Mean 12.2500 .14434
95% Confidence Interval for Mean
Lower Bound 11.7907
Upper Bound 12.7093
5% Trimmed Mean 12.2500
Median 12.2500
Variance .083
Std. Deviation .28868
Minimum 12.00
Maximum 12.50
Range .50
Interquartile Range .50
Skewness .000 1.014
Kurtosis -6.000 2.619
6,25% Mean 9.2500 .14434
95% Confidence Interval for Mean
Lower Bound 8.7907
Upper Bound 9.7093
5% Trimmed Mean 9.2500
Median 9.2500
Variance .083
Std. Deviation .28868
Minimum 9.00
Maximum 9.50
Range .50
Interquartile Range .50
Skewness .000 1.014
Kurtosis -6.000 2.619
3,25% Mean .3025 .14436
95% Confidence Interval for Mean
Lower Bound -.1569
Upper Bound .7619
5% Trimmed Mean .3000
Median .2800
Variance .083
Std. Deviation .28872
Minimum .05
Maximum .60
Range .55
Interquartile Range .52
Skewness .102 1.014
49
DAFTAR PUSTAKA
1. Athanassiadis B, Abbott PV, Walsh LJ. The Use of Calcium Hydroxides Antibiotics and Biocides as Antimicrobial Medicamen in Endodontic. Aust Dent
J 2007 ;52(1):64-8.
2. Grossman LI, Oliet S, Rio CED. Ilmu Endodontik dalam Praktek. Edisi 11. Ahli bahasa: Abyono R. Jakarta: EGC, 1995 : 248-50.
3. Nikita IU. Efek antibakteri dari lima bahan root canal sealing yang berbeda. 19 november 2012. http/scribd.com/doc/113745966/Efek-antibakteri-Dari-Lima-Bahan-Root-Canal-Sealing-Yang-Berbeda. (18 juni 2015).
4. Walton RE, Rivera EM. Pembersihan dan Pembentukan Saluran Akar dalam Prinsip dan Praktek Ilmu Endodonsia. Edisi 2. Ahli bahasa: Sumanwirata N,
dkk. Jakarta. EGC, 1997 : 263-303.
5. Gomes et al. In vitro Antimikrobial Activity of Calcium Hydroxida Pastes and their Vehivle Against Selected Microorganisme. Braz Dent j 2002;13(3):155-61.
6. Samaranayake L. Essential Microbiology for Dentistry. Chapter 11, Streptococci, staphylococci and micrococci; Elsevier. 3thed, 2006: 115-122.
7. Coykendall AL. Four Type of Streptococcus mutans Based on Their Genetic, Antigenetic and Biochemical Characteristics. Microbiology. 1974; 83(2):
327-38.
8. Baumgartner JC, Bakland L.K, Sugita E.I. Chapter 3, Microbiology of Endodontics and Asepsis in Endodontic Practice: Ingle and Backland.
Endodontics 5thed, 2002; 63-6, 77-9.
9. Pazelli LC, Freitas CA, Ito YI, Filho NP et al. Prevalence of Microorganisme in Root Canal of Human Deciduous Teeth with Necrotic pupl and Cronic
Periapical Lesions. Pesqui Odontol Bras J 2003; 17(4): 367-71.
10. Peciuliene V, Maneline R, Balcikonyte E, Drukteinis S, Rutkunas V. Microorganisms in root canal infections: a review. Baltic Dent Max-fac J 2008;
10: 4, 6-7.
50
11. Mohammadi Z, Palazzi F, Giardino L, Shadavi S. Microbial biofilms in endodontic infections: an update review. Biomed J 2013; 36(2): 59.
12. Bahrira Islam; et al, Dental Caries ; From Infection to Prevention, Med Sci monit, 2007;13(11) : RA 196-203.
13. Forssten SD et al. Streptococcus mutans, Caries and Simulation Models. Nutrients 2010: 2,290-298
14. Sari LORK. Pemanfaatan Obat Tradisional dengan Pertimbangan Manfaat dan Keamanannya. Majalah ilmu kefarmasian 2006; 3(1): 1-7.
15. Pujar M, Makandar S. Herbal Usage in Endodontics- a review. Int J contemporary Dent 2011; 2(1): 34-7.
16. Imaga NOA, Bamigbetan DO. In vivo Biochemical Assesment of Aqueous extracts of Vernonia amygdalina (bitter leaf). Int J Nutri Met 2013;5(2):22-7.
17. Nwaoguikpe RN. The Effect of Extract Vernonia amygdalina (bitter leaf) on Blood Glucose Levels of Diabetic rats. Int J biol Chem Sci 2010; 4(3): 721-9.
18. Sule IO, Agababiaka TO. Antibacterial Effect of Some plant Extract on Selected Enterobacteriaceae. Ethnobotanical leaflets 2008; 12: 1035-42.
19. Tula MY, Azih AV, Iroulaje FO, Okojie RO, Elimian KO, TOY BD. Systematic Study on Comparing Phytochemicals and the Antimicrobial Activities from
Different parts of Vernonia amydalina. African journal Microbiology Reseach.
2012; 6(43): 7089-93.
20. Anibijuwon II, Oladejo BO, Adetitun DO, kolawole OM. Antimicrobial activities of Vernonia amygdalina against oral microbes. Global Journal of pharmacology.
2012; 6(3):178-185.
21. Handayani V. Daya antibakteri ekstrak etanol daun Afrika (Vernoniaa amygdalina) terhadap bakteri fusobacterium nucleatum sebagai bahan
alternatif medikamen saluran akar (in vitro). Skripsi : Medan: Fakultas
kedokteran gigi USU 2010; 22-5.
51
faecalis (secara in vitro). Skripsi: Medan: Fakultas kedokteran gigi USU 2014;
20-22.
23. Sitompul T. Daya antibakteri ekstrak etanol daun Afrika (Vernoniaa amygdalina) terhadap bakteri Porphyromonas gingivalis sebagai bahan
alternatif medikamen saluran akar (in vitro). Skripsi : Medan: Fakultas
kedokteran gigi USU 2010; 12-5
24. Pramudia et al. Fenomena dan Perubahan Iklim di Indonesia serta Pemanfaatan
Informasi Iklim untuk Kalender Tanam. 3:52-3.
25. Dharma Wanita Persatuan KBRI Abuja. Informasi umum Nigeria.13 desember
2011. 2015)
26. Forsythia J. Daya antibakteri ekstrak etanol kulit buah manggis (Garcinia Mangostana Linn.) terhadap bakteri Streptococcus mutans sebagai bahan
alternatif medikamen saluran akar (in vitro). Skripsi : Medan: Fakultas
kedokteran gigi USU 2010; 5-6.
27. Bidarisugma B, Timur SP, Purnamasari R. Antibodi Monoklonal streptococcus mutans 1(c)67 kDa sebagai imunisasi Pasif dalam alternatif pencegahan karies
gigi secara topical. BIMKGI, 2012; 1(1); 1-2.
28. Toyang NJ, Verpoorte R. A review of the medicinal potentials of plants of the genus vernonia (asteraceae). J Ethnopharm 2013; 146; 681-723.
29. Yeap SK, Ho WY, beh BK, dkk. Vernonia amygdalina, an ethnoveterinary and ethnomedical used green vegeTabels with multiple bioactivities. J Med Plant Res
2010; 4(25); 2787-812.
30. Audu SA, Taiwo AE, Ojuolape AR, dkk. A study review of documented phytochemistry of Vernonia amygdalina (Family asteraceae) as the basic for
pharmacologic activity of plant extract. J Natural Sciences Res 2012; 2(7): 1-8.
31. Akpaso MI, Atangvho IJ, Akpantah A, Fischer VA, Igiri AO, Ebong PE. Effect of combined extracts of Vernonia amygdalina (bitter leaf ) and gongronema
52
latifolium (Utazi) on the pancreatic β-cells of streptozotocin-induced diabetic rats. British J Medicine & Medical Res 2011; 1(1); 24-34.
32. Oboh F, Masodje HI. Nutritional and antimicrobial properties of Vernonia amygdalina leaves. Int J Biomed Health Sci 2009; 5(2); 51-6.
33. Ilondo EM, Arimoro FO, Sodje AP. The use of aqueous extracts of Vernonia amygdalina in the control of saprolegniasis in Clarias gariepinus, a Freshwater
fish. African J Biotech 2009; 8(24); 7130-2.
34. Cowan MM. Plant products as antimicrobial agents. Clin Mirobiol Rev 1999; 12(4) : 564.
35. Bhattacharjee B, Lakshminarasimhan P, Bhattacherjee A, Agrawala D.K, Pathak M.K. Vernonia amygadalina Delile (Asteraceae)-An Africa medicinal plant 2013; 28(5); 18-20.
36. Simatumpang M. Penuntun Praktikum Mikrobiologi Medik : Medan; Fakultas kedokteran USU 2015; 55-58.
37. Wadani A. Pengaruh Pemberian Larutan Ekstrak Siwak (Salvadora persica) Pada Berbagai Konsentrasi Terhadap Pertumbuhan Streptococcus mutans
Skripsi: Semarang: Fakultas kedokteran UNDIP 2012; 33-39.
38. Ramdhania Q. Pengaruh konsentrasi ekstrak etanol daun salam (Eugenia polyantha) terhadap pertumbuhan Streptococcus mutans (secara in vitro).
Skripsi: Surakarta: Fakultas kedokteran gigi muhammadiyah Surakarta 2014; 5-6.
39. Adentuji CO, Olaniyi OO, Ogunkunle ATJ. Bacterial activity of crude extracts of Vernonia amygdalina on clinical isolates. J of Microbiol and Antimicrob
2013;5(6): 60-4.
18
BAB 3
KERANGKA KONSEP
3.1 Kerangka Konsep
Penelitian ini dilakukan dengan menguji daya antibakteri ekstrak etanol daun Afrika (Vernonia amygdalina) sebagai bahan alternatif medikamen saluran akar terhadap bakteri Streptococcus mutans dengan penentuan nilai Kadar Hambat Minimum (KHM) dan nilai Kadar Bunuh Minimum (KBM). Suhu inkubasi bakteri, waktu inkubasi dan konsentrasi ekstrak etanol daun Afrika (Vernonia amygdalina) yang digunakan dapat mempengaruhi penentuan KHM dan KBM.
3.2 Hipotesis Penelitian
Adanya daya antibakteri ekstrak etanol daun Afrika (Vernonia amygdalina) sebagai bahan alternatif medikamen saluran akar terhadap pertumbuhan bakteri Streptococcus mutans dengan mencari nilai KHM dan KBM.
Ekstrak etanol daun Afrika (Vernonia amygdalina) dengan konsentrasi 100%, 50%, 25%, 12,5 %, 6,25%, 3,125%
Pertumbuhan bakteri Streptococcus mutans pada media MHB dan MHA penentuan nilai KHM dan KBM
Waktu inkubasi 24 jam dengan suhu 370c
19
BAB 4
METODE PENELITIAN
4.1 Rancangan dan Jenis Penelitian 4.1.1 Rancangan Penelitian
Rancangan penelitian yang digunakan dalam penelitian ini adalah posttest only control grup design.
4.1.2 Jenis Penelitian
Jenis penelitian yang digunakan dalam penelitian ini adalah eksperimental laboratorium.
4.2 Lokasi dan Waktu Penelitian 4.2.1 Lokasi Penelitian
Lokasi yang digunakan dalam penelitian ini adalah : 1. Laboratorium Obat Tradisional Fakultas Farmasi USU 2. Laboratorium Mikrobiologi Fakultas Kedokteran USU
4.2.2 Waktu Penelitian
Waktu penelitian ini Mei 2015 – Maret 2016
4.3 Populasi, Sampel dan Besar Sampel 4.3.1 Populasi
Populasi dalam penelitian ini adalah bakteri Streptococcus mutans
4.3.2 Sampel
Sampel yang digunakan dalam penelitian ini adalah koloni bakteri Streptococcus mutans ATCC 2517 yang telah diisolasi dan dibiakkan dalam media
20
4.3.3 Besar Sampel
Penentuan Besar sampel dilakukan berdasarkan SOP (Standard Operational Procedure) yang ada di Laboratorium Mikrobiologi Fakultas Kedokteran, Universitas
Sumatera Utara dan jumlah pengulangan ditentukan dengan menggunakan rumus fedeerer, yaitu :
Jumlah perlakuan ulang (r) yang digunakan dalam penelitian ini adalah 4 kali pengulangan. Adapun penentuan besar sampel dilakukan sebagai berikut :
a. Penentuan nilai Kadar Hambat Minimum (KHM)
Bahan coba dibagi ke dalam 6 kelompok dengan 2 kelompok control, yaitu :
● Kelompok I : ekstrak dengan konsentrasi 100% = 4 sampel
● Kelompok II : ekstrak dengan konsentrasi 50% = 4 sampel
● Kelompok II I : ekstrak dengan konsentrasi 25% = 4 sampel
● Kelompok IV : ekstrak dengan konsentrasi 12,5% = 4 sampel
● Kelompok V : ekstrak dengan konsentrasi 6,25% = 4 sampel
● Kelompok VI : ekstrak dengan konsentrasi 3,125% = 4 sampel
● Kelompok VII : kontrol Mc. Farland = 4 sampel
● Kelompok VIII : kontrol negatif (ekstrak daun Afrika
tanpa suspensi S.mutans) = 4 sampel Pada Penelitian nilai KHM, jumlah keseluruhan sampel adalah 32 sampel b. Penentuan nilai KBM
Kelompok larutan dilanjutkan dengan perhitungan jumlah koloni bakteri dengan metode Drop Plate Miles Mesra, adalah :
● Kelompok I : ekstrak dengan konsentrasi 100% = 4 sampel
(t-1) (r-1)
≥
15
Keterangan :t : jumlah perlakuan dalam penelitian
r: jumlah perlakuan ulang (sampel)
21
● Kelompok II : ekstrak dengan konsentrasi 50% = 4 sampel
● Kelompok II I : ekstrak dengan konsentrasi 25% = 4 sampel
● Kelompok IV : ekstrak dengan konsentrasi 12,5% = 4 sampel
● Kelompok V : ekstrak dengan konsentrasi 6,25% = 4 sampel
● Kelompok VI : ekstrak dengan konsentrasi 3,125% = 4 sampel
● Kelompok VII : kontrol Mc. Farland = 4 sampel
● Kelompok VIII : kontrol negatif (ekstrak daun Afrika
22
Variable tergantung
Pertumbuhan bakteri S.mutans pada media MHA dan MHB dengan pengukuran nilai KHM dan KBM
Variabel bebas
Ekstrak etano daun Afrika (Vernonia amygdalina) dengan konsentrasi 100%, 50%, 25%, 12,5%, 6,25% dan 3,125%
a. Variable terkendali
b. Jenis dan asal daun Afrika (Vernonia amydalina) c. Berat daun Afrika sebelum pengeringan dan sesudah pengeringan (350gram)
d. Lama dan suhu pengeringandaun Afrika (40ºC) e. Volume etanol yang dipakai 5 litter
f. Konsentrasi etanolyang dipakai (70%) g. Waktu Perendaman daun Afrika (15 menit) h. Suhu saat perendaman daun Afrika (25ºC) i. Waktu Perkolasi (2 minggu)
j. Nomor kertas saring yang dipakai (Whatman No.42)
k. Jumlah kertas saring saar perkolasi (3 lapis)
l. Kecepatan tetes cairan dalam perkolator (20 tetes/menit)
m.Suhu penguapan rotavapor (40ºC) n. Waktu penguapan rotavapor (10jam)
o. Media pertumbuhan bakteri yaitu MHB dan MHA p. .Suhu inkubasi Streptococcus mutans (37ºC) q. Waktu pembiakan Streptococcus mutan (24 jam) r. Suspensi Streptococcus mutans ATCC 25175
s. Jumlah suspensi bakteri yang diteteskan tiap replikasi (1ml)
t. Jumlah bahan percobaan yang diteteskan ke media padat (50µl)
u. Suhu yang digunakan untuk menumbuhkan
S.mutans (37ºC)
v. Sterilisasi alat, bahan coba, dan media
b. Variabel tidak terkendali
a.Lingkungan (kondisi tanah dan iklim) tempat tumbuh daun afrika
b.Usia daun Afrika
c.Perlakuan terhadap daun Afrika selama tumbuh
d.Lama penyimpanan daun Afrika sampai proses ekstraksi
e.Suhu penyimpanan daun Afrika sampai proses ekstraksi
f. Lama penyimpanan, suhu saat pengiriman bahan coba daun Afrika sampai ke Laboratorium
Mikrobiologi Fakultas
kedokteran USU
4.4 Variabel Penelitiandan Definisi Operasional
Skema 2.Variabel penelitian
23
4.4.1 Variabel Penelitian 4.4.1.1 Variabel Bebas
Variabel bebas pada penelitian ini adalah ekstrak etanol daun Afrika (Vernonia amydalina) dalam pelarut etanol dengan konsentrasi 100%, 50%, 25%,12,5%, 6,25% dan 3,125%.
4.4.1.2 Variabel Tergantung
Variabel tergantung pada penelitian ini adalah pertumbuhan bakteri Streptococcus mutans pada media MHA dan MHB dengan pengukuran nilai KHM
dan KBM.
4.4.1.3 Variabel Terkendali
Variabel terkendali pada penelitian ini terdiri dari : 1. Jenis dan asal daun Afrika (Vernonia amygdalina)
2. Berat daun Afrika(Vernonia amygdalina) sebelum pengeringan dan sesudah pengeringan (300gram)
3. Lama dan suhu pengeringandaun Afrika(Vernonia amygdalina) (40ºC) 4. Volume etanol yang dipakai 5 liter
5. Konsentrasi etanolyang dipakai (70%)
6. Waktu Perendaman daun Afrika (Vernonia amygdalina) (15 menit) 7. Suhu saat perendaman daun Afrika(Vernonia amygdalina) (25ºC) 8. Waktu perkolasi (2 minggu)
9. Nomor kertas saring yang dipakai (Whatman No.42) 10. Jumlah kertas saring saat perkolasi (3 lapis)
11. Kecepatan tetes cairan dalam perkolator (20 tetes/menit) 12. Suhu penguapan rotavapor (40ºC)
13. Waktu penguapan rotavapor (10jam)
24
17. Suspensi Streptococcus mutans ATCC 25175
18. Jumlah suspensi bakteri yang diteteskan tiap replikasi (1ml) 19. Jumlah bahan percobaan yang diteteskan ke media padat (50µl)
20. Suhu yang digunakan untuk menumbuhkan Streptococcus mutans (37ºC) 21. Sterilisasi alat, bahan coba dan media.
4.4.1.4 Variabel Tidak Terkendali
Variabel tidak terkendali pada penelitian ini terdiri atas :
1. Lingkungan (kondisi tanah dan iklim) tempat tumbuh daun afrika 2. Usia daun Afrika
3. Perlakuan terhadap daun Afrika selama tumbuh
4. Lama penyimpanan daun Afrika sampai proses ekstraksi 5. Suhu penyimpanan daun Afrika sampai proses ekstraksi
6. Waktu dan suhu penyimpanan bahan coba sebelum ke laboratorium mikrobiologi fakultas kedokteran USU.
4.4.2 Definisi Operasional
Ekstrak kental daun Afrika sebanyak1 ml dakan tabung reaksi tanpa dilarutkan dengan aquabides.
mililiter Nominal Electronic balance,
Ekstrak yang didapat dengan mengambil 0,5ml dari konsentrasi ekstrak etanol daun Afrika 100%. Dan dilarutkan dalam 0,5 ml
aquabides.
Milliliter Nominal Mikropipet
3 Ekstrak etanol daun Afrika konsentrasi 25%,
Ekstrak yang didapat dengan mengambil 0,25ml dari konsentrasi ekstrak etanol daun Afrika 50%. Dan dilarutkan dalam 0,75 ml
aquabides.
Milliliter Nominal Mikropipet
25
Ekstrak yang didapat dengan mengambil 0,125ml dari konsentrasi ekstrak etanol daun Afrika 25% dan dilarutkan dalam 0,875 ml
aquabides.
Milliliter Nominal Mikropipet
5 Ekstrak etanol daun Afrika konsentrasi 6,25%,
Ekstrak yang didapat dengan mengambil 0,0625ml dari konsentrasi ekstrak etanol daun Afrika 12,5% dan
dilarutkan dalam 0,9375mlaquabides.
Mililiter Nominal Mikropipet
6 Ekstrak etanol daun Afrika konsentrasi 3,125%,
Ekstrak yang didapat dengan mengambil 0,0416ml dari konsentrasi ekstrak etanol daun Afrika 6,25% dan dilarutkan dalam 0,958 ml
aquabides
Milliliter Nominal Mikropipet
Variabel Tergantung
No Variabel Definisi Operasional Cara Ukur Skala
Ukur bakteri (50%) setelah diinkubasi 24 jam. coba yang dapat membunuh 99.9% bakteri setelah di inkubasi 24 jam.
CFU/ml (colony
forming
unit/millimeter)
Rasio Visual
4.5 Metode Penatalaksanaan Penelitian 4.5.1 Bahan Penelitian
Bahan penelitian yang digunakan adalah :
1. Daun Afrika (Vernonia amygdalina) 2 kg yang dipetik di Medan, Sumatera Utara, Indonesia
2. Etanol 70% sebanyak 5 liter (Kimia Farma, Indonesia) 3. Akuades 1 liter (Kimia Farma, Indonesia)
26
5. Media Mueller Hinton Agar (Difco, USA) 6. NaCl 0,9% (Kimia Farma, Indonesia) 7. Media blood agar
4.5.2 Alat Penelitian
Alat yang digunakan pada penelitian ini adalah : 1. Timbangan (Home Line, China)
2. Timbangan analaitik (Vibra, Japan) 3. Kertas perkamen 2 kajang
4. Blender (Panasonic, Japan)
5. Kapas 250gr (Bio Panca, Indonesia) 6. Kertas saring (Whatman no.42, England)
7. Aluminium foil 1 gulungan (Total Wrap, Indonesia) 8. Perkolator
9. Erlenmeyer (Pyrex, USA) 10. Vaccum rotavapor(Stuart, 2010)
11. Electronic balance (Ohyo, JP2 6000, Japan dan Denver Instrument Company, USA)
12. Autoklaf (Tomy, Japan)
13. Vortex (Iwaki model TM-100, Japan) 14. Inkubator (Sanyo, Japan)
15. Pipet mikro (Gilson, France) 16. Piring petri (Pyrex, Japan) 17. Ose dan Bunsen
18. Pinset 19. Mikroskop
20. Tabung reaksi + Rak 21. Densi check
22. BSC (Bio Safety Cabinet)
27
4.5.3 Prosedur Penelitian
4.5.3.1 Pembuatan Ekstrak Etanol Daun Afrika (Vernonia Amygdalina)
Proses pembuatan ekstrak etanol daun Afrika (Vernonia amygdalina) dilakukan berdasarkan standar operasional prosedur laboratorium obat tradisional Fakultas Farmasi USU dengan langkah-langkah sebagai berikut :
a. Pembuatan simplisia
Daun Afrika (Vernonia amygdalina) dipetik dan ditimbang sebanyak 2 kg (Gambar 3). Kemudian dikeringkan didalam lemari pengering dengan suhu 40ºC hingga kering (Gambar 4).Daun dikatakan sudah kering apabila diremas akan mudah hancur. Selanjutnya daun Afrika (Vernonia amygdalina) yang telah kering tersebut dihaluskan dengan diblender (Gambar 5). Sehingga didapat serat-serat halus (Simplisia) daun Afrika (Vernonia amygdalina) (Gambar 6).
Gambar.3. Penimbangan daun Afrika
28
Gambar 5.Daun Afrika dihaluskan Gambar 6. Simplisia daun Afrika
b. Proses Maserasi
Sebanyak 350 gr simplisia diletakkan dalam bejana tertutup dan direndam dengan etanol 70% dengan suhu 25ºC.
Gambar 7. Proses Maserasi
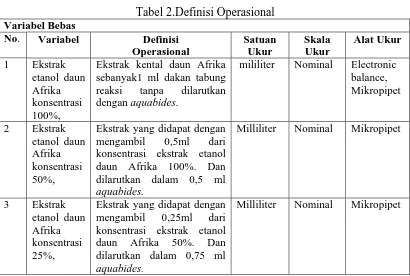
c. Proses Perkolasi
Perkolator disiapkan dengan cara meletakkan kapas secukupnya pada bagian dasar wadah percolator. Diatas kapas tersebut diletakkan kertas saring sebanyak 2 lembar. Kemudian, massa simplisia yang telah direndam tersebut dipindahkan sedikit demi sedikit kedalam perkolator dengan hati-hati sambil sesekali ditekan dengan sendok. Setelah itu etanol 70% dituangkan kedalam perkolator dan massa disaring dengan lapisan kertas saring sambil cairan tersebut mulai menetes dan diatas
29
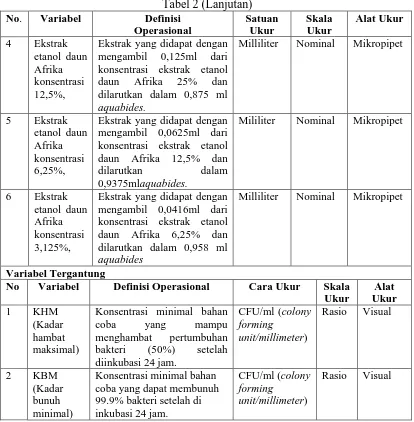
simplisia masih terdapat selapis cairan penyaring untuk mengetahui apakah perkolator sudah berfungsi dengan baik. Perkolator ditutup dengan aluminium foil dan dibiarkan selama 24 jam. Setelah 24 jam, perkolator dibuka kembali dan cairan dibiarkan menetes dengan kecepatan 1 ml/menit atau 20 tetes/menit. Tambahkan etanol 70% secukupnya dengan berulang-ulang sehingga selalu terdapat selapis cairan penyaring diatas simplisia, hingga diperoleh ekstrak air(gambar 8). Ekstrak air diuapkan dengan Vacum rotavapor pada suhu 40ºC hingga konsestisensi seperti madu (gambar 10).
Gambar 8. Proses Perkolasi
Gambar 9. Vacuum rotavapor
4.5.3.2 Pengenceran Bahan Coba
30
Disediakan 6 buah tabung, pada masing-masing tabung diisi 1 ml MHB. Pada tabung pertama diisi ekstrak kental daun Afrika (Vernonia amygdalina) kemudian divortex sehingga diperoleh ekstrak daun Afrika (Vernonia amygdalina) dengan konsentasi 100%. Kemudian dilakukan pengenceran dengan cara pengambilan setengah dari ekstrak daun Afrika (Vernonia amygdalina) konsentrasi 100% menggunakan mikropipet dan diletakkan pada tabung ke-2 untuk mendapatkan ekstrak daun Afrika (Vernonia amygdalina) konsentrasi 50% (pengenceran ganda). Demikian seterusnya sampai tabung ke-6 sehingaa dihasilkan konsentrasi 100%, 50%, 25%, 12,5%, 6,25% dan 3,125%. Beri label pada setiap label sesuai konsentrasinya.
4.5.3.3 Pembuatan Media Bakteri
Sebelum spesimen dibiakkan, terlebih dahulu dahulu dibuat media Mueller Hinton Agar (MHA), sebanyak 12 gram dilarutkan dalam 240 ml aquades kemudian
dituangkan ke dalam pertri (20 ml/petri) lalu dipanaskan diatas tunggu pemanas magnetik sampai mendidih. Kemudian media yang telah masak disterilkan dalam autoklaf selama 15 menit dengan tekanan 2 atm dan suhu 151ºC.Kemudian media disimpan ke dalam lemari pendingin. Jika digunakan kembali, media dipanaskan kembali hingga mendidih, lalu dituangkan ke dalam masing-masing petri dan dibiarkan hingga dingin.
4.5.3.4 Pembiakan Spesimen
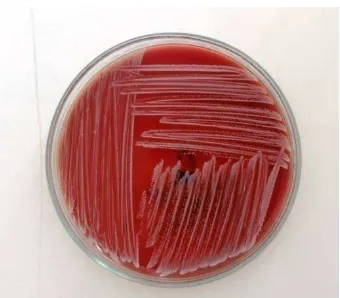
Kegiatan pembiakan spesimen dilakukan dalam suasana anaerob. Streptococcus mutans yang digunakan adalah spesimen Streptococcus mutans ATCC
25175 yang telah dibiakkan secara murni pada media Mueller Hinton Broth (MHB) yang telah disiapkan pada prosedur sebelumnya dalam suasana anaerob Sebanyak 1-2 ose dari biakan murni bakteri uji yang telah dikultur dan tumbuh dengan subur di suspensikan dengan menggunakan larutan NaCl 0,9% sampai diperoleh kekeruhan sesuai standar 0,5 Mac Farland atau sebanding dengan jumlah bakteri 1 x 106 CFU/ml.
31
Gambar 10. Streptococcus mutans ATCC 25175
4.5.3.5 Penentuan KHM Bahan Coba
Bahan coba ekstrak daun Afrika (Vernonia amygdalina) yang digunakan terdiri dari konsentrasi 100%, 50%, 25%, 12,5%, 6,25% dan 3,125%. Dari masing-masing konsentrasi tersebut, diambil 1 ml lalu dimasukkan ke dalam tabung reaksi, lalu tambahkan 1 ml suspensi bakteri dengan menggunkan mikropipet ke dalam masing-masing tabung bahan coba tersebut kemudian dicampurkan dengan vortex, lalu diinkubasi pada suhu 37°C selama 24 jam. Kemudian amati perubahan kekeruhan yang terjadi dengan membandingkan tabun-tabung tersebut dengan kontrol Mc Farland untuk menentukan nilai KHM dari masing-masing bahan coba. Tabung
dengan kekeruhan yang mulai tampak jernih untuk setiap kelompok perlakuan merupakan KHM yaitu konsentrasi minimal ekstrak atau bahan coba apapun yang mampu menghambat pertumbuhan Streptococcus mutans dalam media perbenihan setelah diinkubasi 24 jam dan tidak tumbuh koloni kuman dalam perbenihan tersebut.
4.5.3.6 Penentuan KBM Bahan Coba
32
diteteskan ke dalam media padat Mueller Hilton Broth(MHB), direplikasi 4 petri, diamkan selama 15-20 menit sampai mengering dan diinkubasi dengan suhu 37°C selama 24 jam dan media padat akan tumbuh menjadi 1 koloni bakteri. Dilakukan perhitungan jumlah koloni bakteri untuk mendapatkan KBM dengan bantuan kaca pembesar. Perhitungan adalah bila bentuk koloni melebar dianggap berasal dari 1 koloni, bila bentuknya 2 koloni bersinggungan dianggap sebagai 2 koloni. Satuan yang dipakai adalah CFU (Colony Forming Unit )/ml cairan (suspensi).
Setelah dihitung jumlah koloni bakteri pada masing-masing tetesan, kemudian dibuat jumlah rata-ratanya dengan dikalikan dengan faktor pengenceran dan faktor pengali. Karena pada penelitian konsentrasi yang dilakukan perhitungan jumlah koloni bakteri merupakan konsentrasi awal (sebelum dilakukan dilusi) maka faktor pengenceran x 1, selain itu karena pada penetesan suspensi bahan coba dan bakteri pada media padat sebanyak 50µl, maka hasil perhitungan harus dikali dengan faktor pengali 20 untuk mendapatkan hasil sesuai satuan standar (CFU/ml).
4.6 Pengolahan dan Analisis Data
Oleh karena data tidak terdistribusi normal, maka data dari setiap pemeriksaan dianalisis dengan memakai uji statistik yaitu:
1. Uji Kruskal-Wallis, untuk melihat efek antimikroba ekstrak daun Afrika (Vernonia amygdalina) terhadap pertumbuhan Streptococcus mutans
2. Uji Mann-Whitney untuk melihat perbedaan efek antimikroba antar kelompok perlakuan.
33
BAB 5
HASIL PENELITIAN
Penelitian mengenai Daya Antibakteri Ekstrak Etanol Daun Afrika (Vernonia amygdalina) di Medan, Indonesia sebagai Bahan Alternatif Medikamen Saluran Akar
terhadap Streptococcus mutans (in Vitro). Sample Streptococcus mutans diperoleh dari Lab. Mikrobiologi FK USU dan daun Afrika di dapat di kota medan. Penelitian ini menggunakan 2 metode yaitu dilusi dan difusi untuk mengetahui kepekaan bakteri sehingga dapat diketahui apakah ekstrak etanol daun afrika dapat menghambat atau membunuh Streptococcus mutans.
5.1 Ekstrak Daun Afrika (Vernonia amygdalina)
Ekstrak etanol daun Afrika (Vernonia amygdalina) diperoleh dari 2 kg daun basah yang kemudian dikeringkan dan dihaluskan menjadi bentuk simplisia sebanyak 350 gram. Simplisia tersebut kemudian diperkolasi dengan menggunakan pelarut etanol 70% sebanyak 6 litter, didapat maserasi cair sebanyak 3 litter dari proses tersebut. Kemudian maserasi air di uapkan dalam alat Vacuum Rotary Evaporator sehingga dihasilkan ekstrak kental daun Afrika sebanyak 135 gram.
34
5.2 Uji Kepekaan Daya Antibakteri
Uji kepekaan dapat dilakukan dengan dua cara yaitu dilusi dan difusi.
5.2.1 Metode Dilusi
Uji kepekaan dengan metode dilusi (metode pengenceran ganda) dapat dikerjakan memakai media cair yaitu dengan sederetan tabung reaksi dan media padat yaitu dengan media agar padat.
Pengujian daya antibakteri dilakukan dengan mengamati perubahan kekeruhan pada tiap konsentrasi bahan coba. Dimulai dari konsentrasi 100%, 50%, 25%, 12,5%, 6,25% dan 3,125%. Penetapan konsentrasi berdasarkan pada strandart laboratorium Mikrobiologi, USU. Perubahan yang terjadi ditandai dengan hasil biakan mulai tampak jernih bila dibandingkan dengan control Mc. farland yang diinkubasi 24 jam. Pada gambar 13 menunjukan tabung dengan konsentrasi 100% hingga 3,125% yang direplikasi 4 kali. Dari hasil pengujian tersebut terdapat kekeruhan pada tabung kelompok bahan coba.
a b.
Gambar 12. Uji antibakteri daun Afrika terhadap Streptococcus mutans dengan metode dilusi diinkubasi 24 jam.(a) metode dilusi yang direplikasi 4 kali (b). tidak menunjukan perubahan kekeruhan.
Secara kekeruhan tidak menunjukan perubahan warna karena warna ekstrak pekat. Maka untuk membuktikan bahwa adanya tingkat kekeruhan pada setiap konsentrasi menunjukkan bahan coba memiliki daya hambat bakteri maka dilanjutkan dengan media padat sebagai berikut.
35
Gambar 13. Kontrol positif media MHB+S.mutans menunjukan S.mutan tumbuh dengan baik
Gambar 14. Kontrol negatif media MHB + S.mutans + Formalin menandakan bakteri tidak tumbuh sehingga tampak jernih
12,5% 6,25 3,125%
Gambar 16. Hasil Peletakan
Konsentasi 12,5%, 6,25% dan
3,125% ekstrak daun Afrika yang diinkubasi selama 24 jam.
100% 50% 25%
Gambar 15. Hasil peletakan
36
Pada media padat ini, pada konsentrasi 100%, 50%, 25%, 12,5% tidak dijumpai adanya pertumbuhan bakteri tetapi pada konsentrasi 6,25% dan 3,125% terlihat adanya pertumbuhan bakteri dalam media perbenihan.
Dari hasil pengujian secara difusi kadar bunuh minimum (KBM) dapat ditentukan dengan bahan coba yang dapat membunuh bakteri 99% mati. Maka dari itu konsentrasi antimikroba terendah dimana tidak ada pembentukan koloni dari bakteri yang di uji yaitu pada konsentrasi 12,5%. Setelah itu dengan melihat kekeruhan pada tabung kadar hambat minimum (KHM) yaitu konsentrasi terendah dimana bahan coba yang mampu menghambat pertumbuhan bakteri (50%) setelah diinkubasi 24 jam. Pada tabung tidak dapat menentukan pertumbuhan bakteri dengan melihat kekeruhan campuran dalam tabung. Selanjutnya dipastikan dengan melakukan subkultur dari tabung untuk media padat dan dilihat pada konsentrasi 6,25% masih terdapat pertumbuhann bakteri yang tidak semua mati.
Dengan konsentrasi 6,25% bakteri yang belum mati semua pada konsentrasi tersebut dilanjutkan dengan metode serial dilusi yaitu pengenceran bertahap secara konstan sehingga jumlah koloni bakteri dapat dihitung. Dengan cara pengerjaan dengan menyediakan 4 tabung berisi 0,9 NaCl, lalu pada tabung pertama di tambahkan 1 µl suspensi bakteri dengan menggunakan mikropipet. Pada tabung kedua 1 µl dari tabung pertama dan tambahkan pada tabung kedua, lalukan berulang hingga tabung keempat. Setelah itu, masing masing tabung divorteks dan di inkubasi selama 24 jam pada suhu 37º lalu tabung diteteskan pada media agar dan di diamkan selama 15-20 menit sampai kering dan di inkubasi lagi selama 24 jam pada suhu 37º. Kemudian dilakukan perhitungan jumlah koloni bakteri. Berdasarkan hasil perhitungan koloni seperti pada (gambar 17) dapat dilihat bahwa jumlah koloni dapat dihitung pada serial dilusi atau pengenceran yang ke empat yaitu dengan faktor dilusi 106.
37
103 104
105 106
Gambar 17. Hasil Perhitungan koloni bakteri serial dilusi pada konsentrasi 6,25%
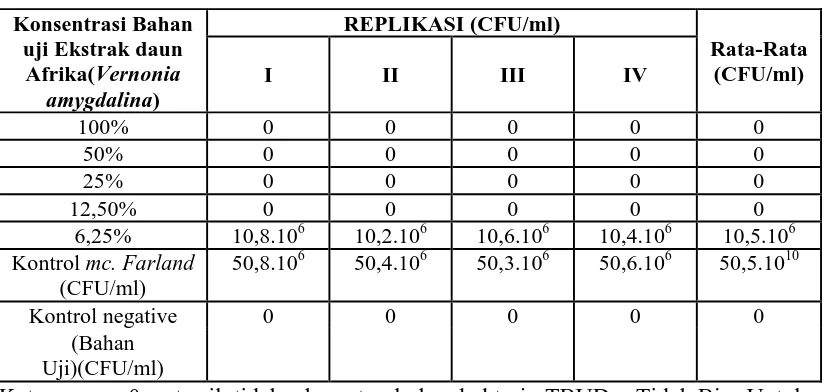
Tabel 3. Hasil Metode Dilusi Uji Efektivitas Antibakteri Ekstrak Daun Afrika (Vernonia amygdalina) dalam Pelarut Etanol 70% terhadap Streptococcus mutans
50,8.106 50,4.106 50,3.106 50,6.106 50,5.1010
Kontrol negative 0 0 0 0 0
(Bahan Uji)(CFU/ml)
38
Tabel 3 menunjukkan hasil efek antibakteri ekstrak etanol daun Afrika (Vernonia amygdalina) dengan konsentrasi 100%, 50%, 25%, 12,5%, 6,25% dan 3,125% terhadap pertumbuhan Streptococcus mutans. Pada Konsentrasi 100% dan 50%, 25%, 12,5% yang mampu membunuh bakteri yang tumbuh sebanyak 0 CFU/ml dan menunjukan hasil yang sama pada setiap replikasi yang berarti bahwa setelah penanaman pada media dan diinkubasi selama 24 jam tidak terlihat adanya pertumbuhan bakteri atau semua bakteri mati. Pada konsentrasi 6,25% ditemukan pertumbuhan koloni bakteri dengan jumlah yang bervariasi pada setiap replikasi dengan nilai rata-rata 10,5.106 CFU/ml sementara pada konsentrasi 3,125% juga dijumpai pertumbuhan bakteri yang masih subur dan tumpang tindih sehingga hasil dikatagorikan TBUD (Tidak Bisa Untuk Dihitung).
Hasil data pengamatan uji dilusi kemudian di analisi dengan Uji Kruskal-Wallis dan uji Man-Whitney.
Tabel 4. Uji Kruskal-Wallis Konsentrasi Ekstrak Daun Afrika (Vernonia amygdalina) Secara Dilusi
Konsentrasi Median±Inerquartil Range Hasil Uji Statistik
100% 0
Tabel 4 menunjukkan tabel uji Kruskal-Wallis yang menunjukkan rata-rata dari masing-masing konsentrasi ekstrak daun Afrika (Vernonia amygdalina) beserta standar deviasi dan signifikansinya dengan menggunakan uji statistik Kruskal-Wallis. Median menunjukkan nilai tengah dari masing-masing konsentrasi. Interquartil range menunjukkan nilai dari batas atas dan batas bawah sedangkan Hasil Uji Statistik menunjukkan nilai p yang menyatakan bahwa terdapat perbedaan pada data-data yang diujikan. Pada Tabel 4 diperoleh nilai p sebesar 0,000 dimana nilai p < 0,05 sehingga
39
dapat ditarik kesimpulan bahwa terdapat perbedaan yang signifikan dari data yang diuji antara masing-masing konsentrasi ekstrakdaun Afrika (Vernonia amygdalina).
Tabel5. Uji Mann-Whitney Konsentrasi Ekstrak Daun Afrika (Vernonia amygdalina) Secara Dilusi
Nilai p perbedaan mean pada 0,05
Tabel 5 merupakan tabel uji Mann-Whitney yang menunjukkan nilai signifikansi hubungan antara masing-masing konsentrasi mulai dari konsentrasi 100% hingga 6,25% daun Afrika (Vernonia amygdalina) dengan perbedaan signifikansi pada angka 0,05. Apabila nilai p lebih kecil dari 0,05 menunjukkan bahwa terdapat perbedaan signifikan antara data yang dibandingkan sedangkan apabila nilai p lebih besar dari 0,05 menunjukkan bahwa terdapat perbedaan yang tidak signifikan dan tidak terdapat perbedaan. Pada tabel 6 terlihat bahwa p data yang lebih kecil dari 0,05 terdapat pada hubungan data konsentrasi 6,25% dan kontrol + dengan 100% dan 6,25% dengan kontrol +.
5.2.2 Metode Difusi
40
.
Gambar 18.Pengukuran zona hambat. Gambar 19.Uji antibakteri daun Afrika terhadap Streptococcus mutans dengan metode difusi yang menunjukan zona hambat yang berbeda pada setiap konsentrasi.
Tabel 6. Hasil Metode Difusi Uji Efektivitas Antibakteri Ekstrak Daun Afrika (Vernonia amygdalina) dalam Pelarut Etanol 70% terhadap Streptococcus mutans pada Konsentrasi 100%, 50%, 25%, 12,5%, 6,25% dan 3,125%.
Konsen trasi Diameter Zona Hambat (mm) Rata-Rata
(mm)
I II III IV
100% 23,5 23 23 24,5 23,5
50% 20,5 20 20,5 20 20,25
25% 15,5 15,5 15 15 15,25
12,50% 12,5 12 12,5 12 12,25
6,25% 9 9,5 9 9,8 9,32
Keterangan: Nilai rata-rata setelah 4 kali pengulangan didapat nilai pada konsentrasi 100% dengan zona hambat 23,5 mm pada konsentrasi 50% dengan zona hambat 20,25% . Pada konsentrasi 25% dengan zona hambat 15,25 mm. Pada konsentrasi 12,5% dengan zona hambat 12,25 mm. Pada
konsentrasi 6,25%dengan konsentrasi 9,32 mm.
Hasil data pengamatan uji difusi kemudian di analisi dengan Uji Kruskal-Wallis dan uji Man-Whitney.
41
Tabel 7. Uji Kruskal-Wallis Konsentrasi Ekstrak Daun Afrika (Vernonia amygdalina) secara Difusi
Konsentrasi Median±Inerquartil Range Hasil Uji Statistik
100% 23,25 ± 1,25
Tabel 7 menunjukkan tabel uji Kruskal-Wallis yang menunjukkan rata-rata dari masing-masing konsentrasi ekstrak daun Afrika (Vernonia amygdalina) beserta standar deviasi dan signifikansinya dengan menggunakan uji statistik Kruskal-Wallis. Median menunjukkan nilai tengah dari masing-masing konsentrasi. Interquartil range menunjukkan nilai dari batas atas dan batas bawah sedangkan Hasil Uji Statistik menunjukkan nilai p yang menyatakan bahwa terdapat perbedaan pada data-data yang diujikan. Pada tabel 5 diperoleh nilai p sebesar 0,000 dimana nilai p < 0,05 sehingga dapat ditarik kesimpulan bahwa terdapat perbedaan yang signifikan dari data yang diuji antara masing-masing konsentrasi ekstrakdaun Afrika (Vernonia amygdalina).
Tabel8. Uji Mann-Whitney Konsentrasi Ekstrak Daun Afrika (Vernonia amygdalina) secara difusi
Nilai p perbedaan mean pada 0,05
42
tidak terdapat perbedaan. Pada tabel 8 terlihat bahwa p data yang lebih kecil dari 0,05 terdapat pada hubungan data dengan semua konsentrasi mulai dari 100%, 50%, 25%, 12,5% hingga 6,25%.
5.3 Kadar Hambat Minimal (KHM)
Kadar hambat minimum (KHM ) yaitu konsentrasi terendah dimana tidak ada pertumbuhan bakteri yang mampu menghambat pertumbuhan bakteri 50% setelah diinkubasi 24 jampengukuran dengan metode dilusi. Konsentrasi antimikroba terendah dimana masih ada pertumbahan bakteri dan tidak semua mati yaitu di dapat pada konsentrasi 6,25%.
5.3 Kadar Bunuh Minimal (KBM)
Kadar bunuh minimum (KBM) yaitu konsentrasi terendah yang dapat membunuh pertumbuhan bakteri pada media MHA. Pada metode dilusi nilai KBM dipastikan dengan melakukan subkultur dari tabung untuk media padat. Konsentrasi antimikroba terendah dimana tidak ada pembentukan koloni dari bakteri yang di uji yaitu pada konsentrasi 12,5%. Dilanjutkan dengan metode difusi untuk memastikan kadar bunuh minimal bakteri dengan konsentrasi terendah pada 12,5% memperlihatkan adanya zona bening yang berarti bakteri pada sekitar blankdisk 100% mati.
43
BAB 6 PEMBAHASAN
Penelitian eksperimental laboratorium secara in vitro mengenai esktrak etanol daun Afrika terhadap Streptococcus mutans dilakukan untuk membuktikan bahwa ekstrak etanol daun Afrika memiliki efek antibakteri dalam menghambat dan membunuh pertumbuhan Streptococcus mutans. Penelitian ini dimulai dengan melakukan identifikasi terhadap daun Afrika yang akan digunakan di Lembaga Ilmu Pengetahuan Indonesia (LIPI). Dari hasil identifikasi diperoleh bahwa daun Afrika merupakan salah satu jenis tumbuhan Vernonia sp dengan suku composite. Setelah dilakukan pengidentifikasian dilanjutkan dengan pembuatan ekstrak daun Afrika dengan 350 gram serbuk simplisia daun Afrika yang dilarutkan dengan pelarutkan etanol 70% etanol hingga diperoleh hasil ekstrak etanol daun Afrika sebanyak 135 gram yang diperkirakan cukup sebagai bahan coba dalam pengujian aktivitas antibakteri terhadap Streptococcus mutans.Uji aktivitas antibakteri pada dasarnya dapat dilakukan dengan dua metode yaitu metode dilusi dan difusi.
44
terkontrol dengan baik dan memberikan pertumbuhan yang baik pada berbagai jenis mikroorganisme.
Metode dilusi dilakukan dengan cara mengambil 1 ml suspensi bakteri yang telah dipersiapkan sebelumnya dengan mengunakan mikropipet lalu dimasukkan ke dalam sederet tabung reaksi dengan berbagai konsentrasi bahan coba daun Afrika yang telah diberi label konsentrasi yang berbeda, kemudian divortek dan diinkubasi 37ºC selama 24 jam dan diamati kekeruhan yang terjadi dengan membandingkan tabung-tabung tersebut dengan kontrol untuk menentukan nilai KHM (Kadar Hambat Minimal). Hasil pengamatan menunjukakan bahwa tidak dapat dilihat secara makroskopik dari hasil biakan pada daun afrika tidak menunjukan kejernihan di karenakan warna ekstrak pekat.
Setelah itu dilanjutkan dengan menyemaikan hasil dari tabung dengan berbagai konsetrasi tersebut ke media agar padat. Setelah itu diinkubasi 24 jam lalu dapat dilihat secara visual pembentukan koloni bakteri yang tumbuh pada konsentrasi tertentu. Metode dilusi media padat ini yang menunjukan hasil pertumbuhan bakteri yang berbeda disetiap konsentrasi dan untuk memastikannya dilakukan perhitungan koloni serial dilusi. Maka dari itu di dapatkan pada penelitian ini nilai KBM secara dilusi diperoleh pada konsentrasi 12,5% dimana pada konsentrasi tersebut tidak dijumpai pertumbuhan bakteri dan nilai KHM yaitu pada konsentasi 6,25% dimana pada konsentrasi tersebut adalah konsentrasi terendah dengan masih adanya pertumbuhan bakteri yang tidak semuanya mati pada media padat. Dilanjutkan dengan media agar padat juga pada konsentrasi 6,25% adalah konsentrasi yang masih terlihat pertumbuhan koloni bakteri dan dengan metode perhitungan bakteri serial dilusi memperlihatkan pertumbuhan bakteri pada nilai 10,5.106.
Pengujian antibakteri selanjutnya yaitu dilakukan dengan metode difusi untuk melihat zona hambat bakteri dan membuktikan bahwa bakteri tersebut dapat menghambat ataupun membunuh bakteri. Dengan cara media padat yang sebelumnya telah di inokulasi dengan Streptococcus mutans yang akan dites diletakkan blank disk yang berisi bahan coba ekstrak etanol daun Afrika lalu diinkubasi selama 24 jam
45
setelah itu dilakukan pengukuran zona inhibisi yang jernih disekitar blank disk tersebut sebagai hasil pembuktian kalau hasil pemeriksaan yang terdapat zona bening. secara difusi nilai KBM pada konsentrasi 12,5% dimana zona bening dari konsentrasi terendah dengan diameter lebih luas yang berarti konsentrasi tersebut tidak terdapat pertumbuhan bakteridan KHM pada konsentrasi 6,25% dimana konsentrasi tersebut konsentrasi terendah yang masih terdapat zona bening.
Berdasarkan hasil penelitian, maka hipotesis ini diterima yaitu ada efek antibakteri ekstrak daun Afrika (Vernonia amygdalina) terhadap Streptococcus mutans dengan metode dilusi nilai KHM 6,25% dan KBM 12,5%. Pada Pengujian
dengan metode dilusi dan difusi terdapat zona hambat yang berbeda pada setiap konsentrasi yang kemudian dianalisi dengan uji statistik Kruskal-Wallis dan uji Mann-Whitney.
Pada hasil uji statistik Kruskal-Wallis terlihat bahwa nilai signifikansi 0,000. Nilai tersebut lebih kecil dari standar nilai signifikansi yaitu 0,05 sehingga membuktikan bahwa data-data zona hambat bakteri dari tiap konsentrasi mempunyai perbedaan secara dilusi maupun difusi. Pada uji statistik lanjutan Mann-Whitney secara uji difusi menunjukkan bahwa data nilai p lebih kecil dari 0,05 terdapat pada hubungan data dengan berbagai konsentrasi mulai dari 100%, 50%, 25%, 12,5% hingga 6,25% yang berarti terdapat signifikansi antara konsentrasi 100% dengan 50%, 25% 12,5% dan 6,25% lalu 50% dengan 100%, 50%, 25%, 12,5% dan 6,25% hingga konsentrasi 6,25% terhadap 100%, 50%, 25%, 12,5% dan 6,25% konsentrasi zona hambat esktrak etanol daun Afrika (Vernonia amygdalina) terhadap Streptococcus mutans. Namun berdasarkan uji statistik lanjutan Mann-Whitney
secara uji dilusi singnifikasinya hanya terdapat pada konsentrasi 6,25% dan kontrol + dengan konsentrasi 100% dan konsentrasi 6,25% dengan kontrol positif.
46
Streptococcus mutan dengan ekstrak daun salam dilakukan oleh Ramadhania Q
(2014) menyatakan dengan metode difusi Hasil ekstrak etanol daun salam (Eugenia polyantha W) konsentrasi 5%, 10%, 20%, 40%, 80% dan 100% mempunyai daya
antibakteri yang efektif terhadap Streptococcus mutans.38
Penelitian ekstrak etanol daun Afrika di Nigeria juga telah dilakukan dengan metode difusi mengujikannya kepada bakteri Streptococcus mutans dan Staphylococcus aurens oleh Anibijuwon et al (2012), menjunjukan nilai KHM pada
konsentrasi 30 mg/ml atau setara dengan 3% dan KBM pada konsentrasi 50mg/ml setara dengan 5%. sedangkan pada Staphylococcus aurens menunjukan nilai KHM pada konsentrasi 45 mg/ml setara dengan 4,5% dan nilai KBM pada konsentrasi 125mg/ml setara dengan 12,5%.20 Penelitian lain terhadap beberapa bakteri juga telah dilakukan oleh Tula et al (2012), menyatakan ekstrak etanol daun Afrika (Vernonia amygdalina) memiliki daya antibakteri terhadap Shigella sp, Staphylococcus aureus,
Salmonella thypi, Escherichia coli, Proteus mirabilis, Klebsiella pneumonia,
Pseudomonas aeruginosa yang menunjukkan KHM pada konsentrasi 150 mg/ml atau
setara 15% efektif terhadap bakteri Shigella sp, Escherichia coli, Proteus mirabilis, Klebsiella pneumonia, Pseudomonas aeruginosa pada konsentrasi 175 mg/ml setara
17,5% efektif terhadap bakteri S.thypi dan pada konsentrasi 125 mg/ml setara 12,5% efektif terhadap bakteri S.aurens.19Penelitian Adetunji et al. (2013), Ekstrak etanol daun Afrika (Vernonia amygdalina) menunjukan aktifitas antibakteri dengan nilai KHM pada S.aureus 12,5%, S.typhi 17,5% E.coli 15% dan P. aeruginosa 15%.39
Di Indonesia juga telah dilakukan penelitian mengenai pengembangan bahan alami sebagai obat herbal dan juga sebagai bahan alternatif medikamen saluran akar dengan ekstrak etanol daun Afrika pada beberapa bakteri. Pada Penelitian Vika (2014) ekstrak etanol daun Afrika (Vernonia amygdalina) terhadap bakteri fusobacterium nucleatum dengan metode dilusi tidak menunjukan hasil KHM dan
dengan metode difusi menunjukan nilai KBM 12,5 %.21 Penelitian Jocelyn 2014 ektrak etanol daun Afrika (Vernonia amygdalina) terhadap bakteri Enterococcus faecalis dengan metode dilusi tidak menunjukan nilai KHM dan dengan metode
difusi menunjukan nilai KBM 6,25%.22 Dan Menurut Penelitian lain oleh Sitompul T
47
(2015) ekstrak etanol daun Afrika (Vernonia amygdalina) terhadap bakteri Porphyromonas gingivalis denngan metode dilusi tidak menunjukan nilai KHM dan
dengan metode difusi diperoleh nilai KBM 50%.23
Hasil yang diperoleh oleh Peneliti memiliki perbedaan dengan penelitian yang ada sebelumnya dikarenakan ada nya perbedaan kualitas ekstrak dan perbedaaan jenis dan morfologi bakteri yang diujikan. Pada negara lain kemungkinan jenis daun Afrika dipengaruhi oleh perbedaan iklim tropis kering di Nigeria. Sedangkan peneliti menggunakan daun afrika yang berasal dari Kota Medan, Sumatera utara, Indonesia dengan iklim tropis basah. Selain dipengaruhi oleh faktor biologis tumbuhan, kualitas ekstrak juga dipengaruhi oleh faktor kimia salah satunya adalah pelarut etanol 70% karena sifatnya yang universal, relatif aman dan tidak toksik. Penelitian Adetunji et al (2013) menunjukan bahwa ekstrak etanol daun Afrika memiliki aktivitas yang lebih tinggi terhadap bakteri yang disolasi dibandingkan ekstrak air yang disebakan oleh polaritas yang lebih tinggi dari etanol yang cenderung untuk lebih mengestrakkan senyawa aktif daripada air.39 Hal ini di dukung oleh penelitian Tula et al dan Anibijuwon et al (2012) yang menunjukkan bahwa antibakteri ekstrak etanol daun afrika (Vernonia amygdalina) lebih tinggi nilai signifikannya dibandingkan dengan ekstrak methanol ataupun ekstrak air.19,20 Perbedaan morfologi dari jenis bakteri yang berbeda merupakan salah satu faktor yang menyebabkan perbedaan. Setiap bakteri terdapat perbedaan struktur dinding bakteri sehingga diduga menyebabkan perbedaan aktivitas dan besar konsentrasi bahan coba dalam menghambat ataupun membunuh sel bakteri tersebut.40
48
BAB 7
KESIMPULAN DAN SARAN
7.1 Kesimpulan
Berdasarkan hasil penelitian eksperimental yang dilakukan maka dapat disimpulkan bahwa ekstrak etanol daun Afrika (Vernonia amygdalina) memiliki efek anti bakteri terhadap Streptococcus mutans secara in vitro dengan metode dilusi dan difusi yang terdapatnilai KBM pada konsentrasi 12,5 % dan nilai KHM terdapat pada konsentrasi 6,25 %.Analisi dengan Uji Kruskal-Wallis dan uji Man-Whitney setiap hubungan antara masing-masing konsentrasi menunjukan hasil yang signifikan.
7.2 Saran
Adapun saran penulis dalam penelitian ini adalah sebagai berikut :
1. Disarankan untuk melakukan kultur bakteri sendiri agar mengetahui cara memperoleh isolat bakteri uji yang murni
2. Diharpakn untuk penelitian selanjutnya menggunakan alat perhitungan koloni bakteri (colony counter) agar hasil yang di dapatkan lebih pasti dan cara kerja lebih praktis.
3. Perlu dilakukan penelitian tentang uji efek antibakteri daunAfrika (Vernonia amygdalina) terhadap genotif dan fenotif bakteri Streptococcus mutans dan bakteri
lainnya yang diambil secara langsungdari infeksi endodontik primer secara in vitro. 4. Disarankan perlu dilakukan penelitian lebih lanjut untuk mengetahui efek daun Afrika (Vernonia amygdalina) sebagai alternatif medikamen saluran akar secara in vivo sehingga didapat konsentrasi yang dapat digunakan secara klinis dalam
perawatan endodontik.
7
BAB 2
TINJAUAN PUSTAKA
Keberhasilan perawatan saluran akar secara instumentasi, irigasi dan medikamen saluran akar merupakan bagian penting dalam mengeliminasi mikroorganisme pada saluran akar.3 Salah satu mikroorganisme yang banyak terdapat pada rongga mulut maupun dalam saluran akar adalah Streptococcus mutans.9,13 Bahan desinfeksi saluran akar yang sering digunakan sebagai medikamen saluran akar adalah kalsium hidroksida. Namun, kalsium hidroksida tidak menunjukkan kemampuan yang sama terhadap seluruh bakteri.5 Penggunaaan bahan obat tradisional seperti Daun Afrika (Vernonia amygdalina) yang memiliki daya antibakteri sehingga ekstrak etanol daun Afrika (Vernonia amygdalina) diharapkan dapat digunakan sebagai bahan medikamen saluran akar.18,19,20
2.1 Streptococcus mutans
Streptococcuss mutanspertama kali di isolasi dari plak gigi oleh Clacrk Pada
tahun 1924.7 Bakteri ini temasuk dalam kelompok gram positif, tidak bergerak dan fakultatif anaerob.26 Klasifikasi Streptococcuss mutansmenurut Bergey dalam Capuccino (1998) adalah sebagai berikut :27
Kingdom : Monera Divisio : Firmicutes Class : Bacilli
Order : Lactobacilalles Family : Streptococcaceae Genus : Streptococcus
8
Gambar 1.Streptococcus sp6
Streptococcus mutans berbentuk kokus yang mempunyai karakteristik
membentuk rantai panjang dalam pertumbuhannya. Bakteri ini juga memiliki kemampuan untuk melekat dan berkolonisasi pada jaringan mulut karena diperantarai oleh permukaan seperti permukaan sel protein.12 Mikroorganisme dalam saluran akar juga tidak hanya tumbuh sebagai bakteri plantonik, tetapi juga dalam membentuk bioflim.10 Bioflim adalah suatu komunitas mikroba yang ditandai dengan adanya
mikroba bersel yang melekat erat ke permukaan dan terjerat dalam matrik. Matrik tersebut terdiri dari eksopolisakarida, protein, garam dan mineral sel dalam bentuk larutan.10,11 Struktur bioflim bakteri planktonik dalam saliva berfungsi sebagai sumber utama pembentukan plak.11 Tiga langkah dalam pembentukan plak yaitu yang pertama molekul saliva yang terabsorpsi ke enamel setelah dibersihkan, sehingga enamel berlapis dengan campuran kompleks seperti glikoprotein, protein kaya prolin asam, mucins, exoproduct dan asam sialic. Langkah kedua interaksi dengan pelikel diperoleh melalui interaksi sel-sel bakteri ke permukaan spesifik. Pembentukan bioflim dengan infeksi primer terutama Streptococcus sanguis dan Actinomyces viscosus, dipengaruhi oleh sejumlah parameter lingkungan, seperti osmolaritas,
sumber karbon dan pH. Langkah ketiga Streptococcus mutans mematuhi penjajah