PEMACUAN PERTUMBUHAN MELON (
Cucumis melo
L.)
DENGAN MENGGUNAKAN CENDAWAN MIKORIZA
ARBUSKULA DAN BAKTERI
Azospirillum
sp.
LADY DIANA TETELEPTA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Pemacuan Pertumbuhan Melon (Cucumis melo L.) dengan Menggunakan Cendawan Mikoriza Arbuskula dan Bakteri Azospirillum sp. adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2014
Lady Diana Tetelepta
RINGKASAN
LADY DIANA TETELEPTA. Pemacuan Pertumbuhan Melon (Cucumis melo L.) dengan Menggunakan Cendawan Mikoriza Arbuskula dan Bakteri Azospirillum
sp. Dibimbing oleh TRIADIATI dan NAMPIAH SUKARNO.
Melon (Cucumis melo L.) merupakan tanaman yang memiliki potensi ekonomi dan dibudidayakan di beberapa wilayah Indonesia dengan managemen pemupukan. Pemanfaatan pupuk anorganik secara terus menerus akan menurunkan kelimpahan mikroba tanah. Salah satu mikroba tanah yang dapat memacu pertumbuhan tanaman ialah cendawan mikoriza arbuskula (CMA) dan
Azospirillum sp.
Penelitian ini bertujuan untuk menguji peranan CMA dan Azospirillum sp. dalam meningkatkan pertumbuhan tanaman melon (C. melo L.). Benih melon yang digunakan dalam penelitian ini adalah melon hibrid Ivory. Eksperimen dilakukan di rumah kaca dengan menggunakan rancangan acak lengkap yang terdiri dari lima perlakuan, yaitu kontrol, pemupukan dengan NPK, inokulasi dengan CMA, inokulasi dengan Azospirillum sp., inokulasi dengan CMA +
Azospirillum sp. Setiap perlakuan diulang 5 kali.
Hasil menunjukkan bahwa efek CMA terhadap panjang akar, jumlah akar lateral, bobot basah dan bobot kering akar, jumlah daun, luas daun total, diameter batang, bobot basah dan bobot kering tajuk, tingkat kemanisan dan tekstur buah sama dengan yang dihasilkan oleh pemupukan NPK. Azospirillum sp. meningkatkan panjang akar, jumlah akar lateral, bobot basah dan bobot kering akar, tetapi efeknya terhadap jumlah daun, luas daun total, diameter batang, bobot basah dan bobot kering tajuk, tingkat kemanisan dan tekstur buah sama dengan yang dihasilkan oleh pemupukan NPK. Inokulasi dengan CMA + Azospirillum sp. mampu meningkatkan kandungan nitrogen, fosfor, dan karbon daun melon, tinggi tanaman, panjang akar, jumlah akar lateral, bobot basah dan bobot kering akar, jumlah daun, luas daun total, diameter batang, bobot basah dan bobot kering tajuk, bobot buah, diameter buah, aroma dan umur simpan buah melon pada suhu ruang. Meskipun demikian, CMA dan Azospirillum sp. mampu meningkatkan bobot buah, diameter buah, aroma dan umur simpan buah melon pada suhu ruang dibandingkan dengan pemupukan NPK. Oleh karena itu, aplikasi CMA dan
Azospirillum sp. akan memberikan hasil yang lebih baik dalam budi daya tanaman
melon, dibandingkan dengan pemupukan NPK.
SUMMARY
LADY DIANA TETELEPTA. Promoting Growth of Melon (Cucumis melo L.) by Arbuscular Mycorrhizal Fungi and Azospirillum sp. Bacteria. Supervised by TRIADIATI and NAMPIAH SUKARNO.
Melon (Cucumis melo L.) is an economic value crop that is cultivated in some regions of Indonesia under fertilization management. Application of inorganic fertilizer continuously can reduce soil microbial abundance. One of the soil microbial that promote plants growth is arbuscular mycorrhizal fungi (AMF) and Azospirillum sp.
The effectiveness of AMF and Azospirillum sp. in promoting growth of
C. melo L. was investigated in hybrid melon (Ivory). Experiment was carried out
in a greenhouse and arranged in a completely randomized design with five replications. Five treatments were tested which included uninoculated control plants, plants fertilized with NPK, plants inoculated with AMF, plants inoculated with Azospirillum sp., plants inoculated with AMF + Azospirillum sp.
The results showed that effect of AMF on root length, number of lateral roots, root fresh and root dry weight, number of leaves, total leaves area, stem diameter, shoot fresh and shoot dry weight, sweetness and texture of fruit were similar with NPK fertilizer. Azospirillum sp. increased root length, number of lateral roots, root fresh and root dry weight, but effect of Azospirillum sp. on number of leaves, total leaves area, stem diameter, shoot fresh and shoot dry weight, sweetness and texture of fruit were similar with NPK fertilizer. Meanwhile, inoculated with AMF + Azospirillum sp. increased nitrogen, phosphor, and carbon contents of melon leaves, plant height, root length, number of lateral roots, root fresh and root dry weight, total leaves area, stem diameter, shoot fresh and shoot dry weight, fruit weight, fruit diameter, aroma and duration of fruit storage. However, AMF and Azospirillum sp. increased plant height, fruit weight, fruit diameter, aroma and duration of fruit storage. Therefore, application of AMF and Azospirillum sp. in melon cultivation was better than NPK fertilizer.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biologi Tumbuhan
PEMACUAN PERTUMBUHAN MELON (
Cucumis melo
L.)
DENGAN MENGGUNAKAN CENDAWAN MIKORIZA
ARBUSKULA DAN BAKTERI
Azospirillum
sp.
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Pemacuan Pertumbuhan Melon (Cucumis melo L.) dengan Menggunakan Cendawan Mikoriza Arbuskula dan Bakteri Azospirillum sp.
Nama : Lady Diana Tetelepta
NIM : G353100111
Disetujui oleh Komisi Pembimbing
Dr Dra Triadiati, MSi Ketua
Dr Ir Nampiah Sukarno Anggota
Diketahui oleh
Ketua Program Studi Biologi Tumbuhan
Dr Ir Miftahudin, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Penulis memanjatkan puji dan syukur kepada Tuhan Yang Maha Kuasa atas segala karunia-Nya, sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan April 2012 ini ialah pupuk hayati, di bawah judul Pemacuan Pertumbuhan Melon (Cucumis melo L.) dengan Menggunakan Cendawan Mikoriza Arbuskula dan Bakteri Azospirillum sp.
Penulis mengucapkan terima kasih kepada Ibu Dr Dra Triadiati, MSi dan Ibu Dr Ir Nampiah Sukarno selaku pembimbing yang telah membimbing serta banyak memberi saran mulai dari perencanaan dan pelaksanaan penelitian hingga penyusunan karya ilmiah ini. Ungkapan terima kasih yang tak terhingga dari penulis kepada papa dan mama tercinta (Marthin Tetelepta dan Anthonia Wenno) atas segala kasih sayang, doa, dan dukungan yang tak pernah putus-putusnya, baik dukungan moral maupun dukungan dana selama studi dan pelaksanaan penelitian hingga penyelesaian karya ilmiah ini. Terima kasih juga kepada ketiga kakak tersayang (Nancy Ervany Tetelepta, Alex Moshe Tetelepta, Josi Silfa Tetelepta) dan terkhusus untuk kelima keponakan yang adalah malaikat-malaikat kecilnya penulis (Alexsandra Jennifer, Angel, In, Dennzell Vlady, dan Dean Valdano) atas segala kasih sayang, doa, dan dukungannya bagi perampungan studi dan karya ilmiah ini.
Penulis juga ingin menyampaikan terima kasih kepada Kementerian Pendidikan Nasional Republik Indonesia yang telah memberi bantuan dana melalui beasiswa on going Direktorat Jenderal Pendidikan Tinggi tahun 2011, serta kepada Yayasan Beasiswa Oikoumene (YBO) dan Yayasan Toyota Astra Indonesia yang telah turut membantu biaya penelitian ini hingga dapat terlaksana. Ungkapan terima kasih juga untuk teman-teman dan semua pihak yang secara langsung maupun tidak langsung telah membantu serta memberikan dorongan dengan sepenuh hati kepada penulis dalam menyelesaikan karya ilmiah ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vii
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 2
Biologi Tanaman Melon 2
Peranan Cendawan Mikoriza Arbuskula bagi Pertumbuhan Tanaman 3
Peranan Azospirillum sp. bagi Pertumbuhan Tanaman 4
Interaksi Cendawan Mikoriza Arbuskula dengan Azospirillum sp. 5
3 METODE 6 Bahan 6 Rancangan Percobaan dan Analisis Data 6 Prosedur Penelitian 6 Analisis Pertumbuhan Tanaman Melon 8 Analisis Kandungan Nitrogen, Fosfor, dan Karbon Daun Melon 9
Analisis Kualitas Buah Melon 9 Analisis Kolonisasi CMA pada Akar Tanaman Melon 9 Analisis Kolonisasi Bakteri Azospirillum sp. pada Media Tanam 10 4 HASIL DAN PEMBAHASAN 10 Hasil 10 Pembahasan 17 5 SIMPULAN DAN SARAN 21 Simpulan 21 Saran 21 DAFTAR PUSTAKA 21 LAMPIRAN 26
DAFTAR TABEL
1 Jadwal pemberian pupuk susulan untuk perlakuan pemupukan NPK 8 2 Panjang akar tanaman melon kontrol, perlakuan NPK, CMA,
Azospirillum sp., CMA + Azospirillum sp. 11
3 Jumlah akar lateral tanaman melon kontrol, perlakuan NPK, CMA,
Azospirillum sp., CMA + Azospirillum sp. 11
4 Bobot basah dan bobot kering akar tanaman melon kontrol, perlakuan NPK, CMA, Azospirillum sp., CMA + Azospirillum sp. 12 5 Jumlah daun tanaman melon kontrol, perlakuan NPK, CMA,
Azospirillum sp., CMA + Azospirillum sp. 12
6 Luas daun total tanaman melon kontrol, perlakuan NPK, CMA,
Azospirillum sp., CMA + Azospirillum sp. 12
7 Diameter batang tanaman melon kontrol, perlakuan NPK, CMA,
Azospirillum sp., CMA + Azospirillum sp. 13
8 Bobot basah dan bobot kering tajuk tanaman melon kontrol, perlakuan NPK, CMA, Azospirillum sp., CMA + Azospirillum sp. 13 9 Kandungan nitrogen, fosfor, dan karbon daun tanaman melon kontrol,
perlakuan NPK, CMA, Azospirillum sp., CMA + Azospirillum sp. 13 10 Bobot buah tanaman melon kontrol, perlakuan NPK, CMA,
Azospirillum sp., CMA + Azospirillum sp. 14
11 Diameter buah tanaman melon kontrol, perlakuan NPK, CMA,
Azospirillum sp., CMA + Azospirillum sp. 14
12 Tingkat kemanisan buah tanaman melon kontrol, perlakuan NPK, CMA,
Azospirillum sp., CMA + Azospirillum sp. 14
13 Nilai uji organoleptik untuk aroma buah tanaman melon kontrol, perlakuan NPK, CMA, Azospirillum sp., CMA + Azospirillum sp. 15 14 Nilai uji organoleptik untuk tekstur buah tanaman melon kontrol,
perlakuan NPK, CMA, Azospirillum sp., CMA + Azospirillum sp. 15 15 Umur simpan buah tanaman melon kontrol, perlakuan NPK, CMA,
Azospirillum sp., CMA + Azospirillum sp. pada suhu ruang 15
16 Kolonisasi CMA pada akar tanaman melon kontrol, perlakuan NPK, CMA, Azospirillum sp., CMA + Azospirillum sp. 16 17 Kolonisasi bakteri Azospirillum sp. pada media tanam tanaman melon
kontrol, perlakuan NPK, CMA, Azospirillum sp., CMA + Azospirillum
sp. 17
DAFTAR GAMBAR
1 Tinggi tanaman melon kontrol (◊), perlakuan NPK (∆), perlakuan CMA (□), perlakuan Azospirillumsp. (○), perlakuan CMA + Azospirillum sp.
(▲) 10
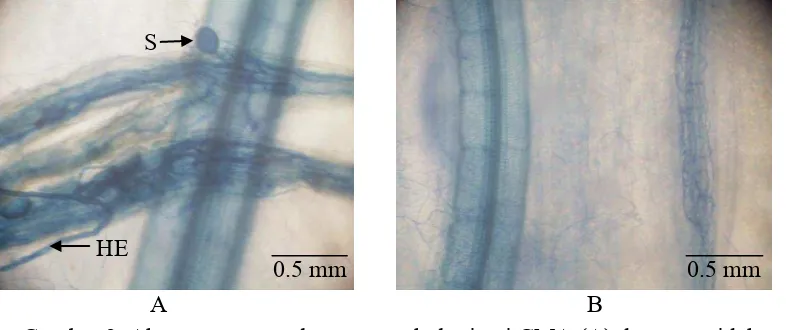
2 Akar tanaman melon yang terkolonisasi CMA (A) dan yang tidak terkolonisasi CMA (B); S = spora, HE = hifa eksternal 16
DAFTAR LAMPIRAN
1 Kuesioner untuk uji skor aroma buah melon 26
2 Kuesioner untuk uji skor tekstur buah melon 26
3 Hasil ANOVA dari tinggi tanaman melon 27
4 Hasil ANOVA dari panjang akar, jumlah akar lateral, bobot basah dan
bobot kering akar melon 27
5 Hasil ANOVA dari jumlah daun, luas daun total, diameter batang,
bobot basah dan bobot kering tajuk melon 28
6 Hasil ANOVA dari kandungan N, P, dan C daun melon 28 7 Hasil ANOVA dari bobot buah, diameter buah, tingkat kemanisan buah,
dan umur simpan buah melon pada suhu ruang 29
8 Hasil ANOVA dari kolonisasi CMA pada akar melon 29 9 Hasil ANOVA dari kolonisasi bakteri Azospirillum sp. pada media
tanam melon 30
1
PENDAHULUAN
Latar Belakang
Melon (Cucumis melo L.) merupakan tanaman buah semusim yang memiliki potensi ekonomi yang tinggi, sehingga melon banyak dibudidayakan di Indonesia. Seperti halnya budi daya tanaman lain, pemupukan merupakan salah satu faktor yang penting dalam budi daya melon. Pemupukan yang dilakukan pun meliputi pupuk dasar yang diberikan pada awal penanaman serta pupuk susulan. Pupuk dasar yang umum diberikan dalam budi daya melon adalah pupuk organik berupa kompos dan pupuk kandang serta pupuk anorganik berupa pupuk NPK, sedangkan pupuk susulan yang umum diberikan adalah pupuk NPK dan pupuk KNO3 dengan frekuensi pemberian setiap sepuluh hari sampai 2 atau 3 minggu sebelum masa panen.
Pemakaian pupuk anorganik secara terus menerus dapat menyebabkan penurunan keberadaan mikroba tanah. Sementara di alam, lebih dari 80% tanaman diketahui membentuk simbiosis dengan cendawan mikoriza arbuskula (CMA). Pemanfaatan CMA dapat membantu tanaman dalam penyerapan berbagai hara terutama hara P pada kondisi P rendah, meningkatkan pertumbuhan tanaman, serta meningkatkan ketahanan tanaman terhadap penyakit dan cekaman, seperti kekeringan dan salinitas (Jeffries et al. 2003; Porras-Soriano et al. 2009; Cruz et al. 2014).
Melon merupakan salah satu spesies tanaman yang juga membentuk simbiosis dengan CMA (Srivastava et al. 2012). CMA membantu tanaman melon dalam menghadapi cekaman kekeringan dan mereduksi cendawan patogen, seperti
Fusarium (Huang et al. 2011; Martínez-Medina et al. 2011b). Selain itu, CMA membantu tanaman melon dalam penyerapan berbagai unsur hara (Sensoy et al. 2013), serta meningkatkan pertumbuhan tanaman melon dengan meningkatkan tinggi tanaman, panjang akar, diameter batang, bobot basah dan bobot kering tanaman (Huang et al. 2011).
Selain CMA, mikroba tanah yang diketahui berperan dalam pertumbuhan tanaman, yaitu Azospirillum sp. Bakteri ini berperan sebagai penambat nitrogen dan juga menghasilkan hormon pertumbuhan IAA (indole-3-acetic acid), sehingga dapat meningkatkan pertumbuhan tanaman dengan meningkatkan panjang akar, jumlah akar lateral, bobot basah akar, tinggi tajuk, bobot basah dan bobot kering tajuk (Barassi et al. 2007). Dalam interaksi dengan CMA,
Azospirillum sp. merupakan salah satu spesies yang termasuk dalam kelompok
bakteri yang dapat memacu aktivitas dan perkembangan CMA (Miransari 2011). Hormon IAA yang dihasilkan oleh Azospirillum sp. dapat meningkatkan pertumbuhan akar tanaman, sehingga dapat memacu perkembangan CMA pada akar tanaman.
2
Perumusan Masalah
Berdasarkan latar belakang, maka yang menjadi masalah dalam penelitian ini adalah bagaimana peranan CMA dan Azospirillum sp. dalam meningkatkan pertumbuhan tanaman melon.
Tujuan Penelitian
Penelitian ini bertujuan untuk menguji peranan CMA dan Azospirillum sp. dalam meningkatkan pertumbuhan tanaman melon.
Manfaat Penelitian
Hasil dari penelitian ini diharapkan dapat menjadi informasi ilmiah bagi pemanfaatan dan pengembangan pupuk hayati dalam budi daya tanaman melon, sehingga dapat mereduksi penggunaan pupuk anorganik.
2
TINJAUAN PUSTAKA
Biologi Tanaman Melon
Melon (C. melo L.) merupakan anggota famili Cucurbitaceae, tumbuh merambat, dan andromonoecious. Buah melon tergolong buah sederhana yang menyimpan cadangan makanan dalam bentuk gula (Srivastava 2002). Buah melon memiliki aroma yang khas karena kandungan berbagai senyawa volatil yang terdiri dari sejumlah senyawa ester, asetat, alkohol, aldehid, dan senyawa sulfur (Beaulieu 2006). Buah melon mengandung kalori, air, karbohidrat, lemak, protein, serat, kalsium, kalium, fosfor, besi, tiamin, riboflavin, niasin, dan asam askorbat (FAO 2006), sehingga melon memiliki potensi ekonomi untuk dibudidayakan. Secara umum, melon dikelompokkan dalam 2 tipe, yaitu netted melon (melon berjala) dan winter melon (melon tidak berjala), sedangkan varietas melon yang dibudidayakan terbagi dalam 3 kelompok, yaitu C. melo L. var. reticulatus
(muskmelon), C. melo L. var. cantaloupensis (cantaloup), dan C. melo L. var.
indorus. Varietas reticulatus dan cantaloupensis termasuk dalam tipe netted
melon, sedangkan varietas indorus merupakan tipe winter melon (Prihatman 2000).
Pada umumnya, pemupukan sering dilakukan untuk memenuhi kebutuhan hara tanaman melon yang dibudidayakan. Pupuk NPK merupakan pupuk yang umumnya digunakan dalam budi daya tanaman melon. Pupuk NPK dapat meningkatkan pertumbuhan tanaman melon yang dibudidayakan. Bahkan, pemberian pupuk NPK diketahui dapat meningkatkan luas daun dan bobot buah melon, tetapi tidak meningkatkan kandungan gula buah melon (Ayoola & Adeniyan 2006; Ayoola & Makinde 2007; Budiastuti et al. 2012; Nkansah et al.
3 Pemanfaatan CMA diketahui dapat mengurangi penggunaan pupuk pada tanaman melon karena dapat memenuhi kebutuhan hara yang dibutuhkan untuk pertumbuhan tanaman melon (Guzmán-Loza et al. 2000), sedangkan semua anggota famili Cucurbitaceae, termasuk melon secara alami mampu membentuk simbiosis dengan CMA (Ortas 2012).
Peranan Cendawan Mikoriza Arbuskulabagi Pertumbuhan Tanaman
Tanaman memerlukan berbagai unsur hara untuk pertumbuhannya. Fosfor merupakan hara makro yang dibutuhkan untuk pertumbuhan tanaman. Kelompok mikroba yang berperan dalam penyerapan hara P adalah mikoriza yang merupakan hubungan simbiosis pada akar tanaman. Mikoriza berperan dalam melarutkan P dan membantu penyerapan P oleh tanaman. Mikoriza merupakan simbiosis mutualisme antara cendawan dengan akar tanaman. Dalam hubungan ini, cendawan memperoleh karbohidrat dalam bentuk glukosa dari tanaman dan sebaliknya, cendawan menyalurkan air dan hara bagi tanaman. Hubungan ini memberikan manfaat yang sangat baik bagi tanah dan akar tanaman inang, sehingga hampir semua tanaman membentuk mikoriza. Pada umumnya, mikoriza meningkatkan pertumbuhan tanaman karena cendawan mengeksplorasi hifa eksternalnya, sehingga memperbesar dan memperluas area penyerapan akar tanaman. Selain itu, mikoriza membantu tanaman dalam melawan mikroba tanah patogen, menekan infeksi tanaman parasitik, dan menyehatkan tanah (Smith & Read 1997).
Mikoriza yang paling umum dijumpai di alam adalah arbuskula. Mikoriza arbuskula merupakan simbiosis mutualisme antara akar tanaman berpembuluh dengan cendawan yang merupakan anggota filum Glomeromycota. Menurut Brundrett et al. 1996, cendawan mikoriza arbuskula (CMA) akan membentuk organ-organ khusus, antara lain:
Vesikel
Vesikel merupakan struktur cendawan yang berasal dari pembengkakan hifa internal secara terminal dan interkalar. Pada umumnya, vesikel berbentuk bulat telur dan berisi banyak senyawa lemak, sehingga merupakan organ penyimpanan cadangan makanan dan dapat berperan sebagai spora atau alat untuk mempertahankan kehidupan cendawan pada keadaan tertentu.
Arbuskula
Arbuskula merupakan struktur bercabang halus yang dibentuk oleh percabangan dikotom yang berulang-ulang, sehingga menyerupai pohon dari dalam sel inang. Hifa intraseluler yang telah mencapai sel korteks akan menembus dinding sel dan membentuk sistim percabangan hifa yang kompleks, sehingga tampak sebagai pohon kecil yang mempunyai cabang-cabang kecil.
Spora
Spora terbentuk pada ujung hifa eksternal. Spora ini dapat dibentuk secara tunggal, berkelompok atau di dalam sporakarp, tergantung dari jenis cendawannya.
4
terinfeksi akan terbentuk arbuskula, vesikel intraseluler, hifa internal di antara sel-sel korteks, dan hifa eksternal. Perkembangan hifa terjadi tanpa merusak sel-sel. CMA tidak memiliki inang yang spesifik. Cendawan yang sama dapat mengkolonisasi tanaman yang berbeda, tetapi kapasitas cendawan untuk meningkatkan pertumbuhan tanaman dapat bervariasi. Tingkat kolonisasi akar merupakan persyaratan CMA pada tanaman inang. Persentasi kolonisasi juga tergantung pada kepadatan akar (Smith & Read 1997).
Eksplorasi hifa eksternal CMA menyebabkan tersedianya hara P bagi tanaman. Sumber hara P bagi tanaman dapat berasal dari senyawa P organik di dalam tanah. Namun, hara P di dalam tanah terkadang ada dalam bentuk P terikat dengan Al atau Fe, sedangkan tanaman menyerap unsur P dalam bentuk ion ortofosfat (H2PO4-, HPO42-, PO43-). CMA dapat membantu tanaman dalam penyerapan hara P melalui tiga mekanisme, yaitu memperluas eksplorasi di dalam volume tanah, mempercepat pergerakan P ke dalam hifa, dan pelarutan P tanah. CMA memperluas eksplorasi di dalam volume tanah dengan memperpendek jarak difusi P ke akar tanaman dan meningkatkan luas permukaan akar untuk penyerapan. CMA dapat mempercepat pergerakan P ke dalam hifa melalui peningkatan afinitas ion P dan dengan menurunkan konsentrasi ambang yang diperlukan untuk penyerapan P, sehingga penyerapan P dapat tetap terjadi pada akar tanaman bermikoriza sekalipun ion fosfat berada di bawah konsentrasi minimum yang dapat diserap oleh akar. Pelarutan P dapat terjadi karena adanya pelepasan asam organik dan enzim fosfatase (Bolan 1991). Perubahan fisiologis pada akar yang bermikoriza dapat mempengaruhi eksudasi akar berupa asam-asam organik dan enzim fosfatase. Asam-asam-asam organik bermuatan negatif dapat mengkelat Al3+ dan Fe3+, sehingga hara P yang terfiksasi oleh kation-kation dapat larut dalam tanah dan dapat diserap oleh tanaman, sedangkan enzim fosfatase dapat memacu proses mineralisasi P organik (Dodd et al. 1987; Smith & Read 1997).
CMA juga dapat membantu tanaman dalam penyerapan berbagai hara lainnya, seperti nitrogen dan sulfur, serta berbagai hara mikro (Ames et al. 1983; Smith & Read 1997; Allen & Shachar-Hill 2009; Leigh et al. 2009; Casieri et al.
2012). Oleh karena CMA dapat membantu tanaman dalam penyerapan berbagai hara, maka CMA dapat meningkatkan pertumbuhan tanaman. CMA diketahui dapat meningkatkan pertumbuhan dan produksi beberapa tanaman holtikultura, seperi cabai, tomat, dan terung (Ortas 2012). Selain itu, CMA dapat meningkatkan tinggi tanaman, panjang akar, bobot basah dan bobot kering akar, bobot basah dan bobot kering tajuk, diameter batang, jumlah daun, luas daun, kandungan N daun, bobot buah, dan diameter buah tomat (Dasgan et al. 2008; Lenin et al. 2010; Guru
et al. 2011; Wahb-Allah et al. 2014), serta meningkatkan diameter batang dan panjang akar ketimun (Tufenkci et al. 2012).
Peranan Azospirillum sp. bagi Pertumbuhan Tanaman
5 diserap oleh tanaman. Mikroba penambat N2 udara, ada yang hidup bersimbiosis dan ada pula yang hidupnya bebas. Mikroba penambat N2 udara yang hidup bersimbiosis, antara lain: Rhizobium sp. yang hidup di dalam bintil akar tanaman kacang-kacangan (Leguminosae), sedangkan mikroba penambat N2 udara yang hidup bebas, antara lain: Azospirillum sp. dan Azotobacter sp. Bakteri penambat N2 udara ini akan mereduksi N2 menjadi NH4+ dengan melibatkan aktivitas enzim nitrogenase (Mantelin & Touraine 2004; Taiz & Zeiger 2010).
Selain sebagai penambat N2 udara, Azospirillum merupakan salah satu genus yang telah diketahui mampu berperan sebagai plant growth
promoting-rhizobacteria. Pada mulanya diduga bahwa peningkatan pertumbuhan tanaman
yang diinokulasi dengan Azospirillum hanya disebabkan oleh penambatan N2 udara, tetapi kemudian diketahui bahwa ternyata ada faktor lain yang berperan dalam peningkatan pertumbuhan tanaman, yaitu Azospirillum dapat menghasilkan hormon pertumbuhan IAA (indole-3-acetic acid) (Kanchana et al. 2013). Hormon IAA berperan dalam pembelahan sel, perpanjangan batang, pertumbuhan akar tanaman, dan perkembangan buah (Srivastava 2002; Taiz & Zeiger 2010).
Kemampuan Azospirillum sebagai penambat N2 udara serta kemampuannya untuk menghasilkan hormon pertumbuhan IAA menyebabkan Azospirillum
mampu meningkatkan pertumbuhan tanaman dengan meningkatkan panjang akar, jumlah akar lateral, dan bulu-bulu akar (Aloni et al. 2006; Ribaudo et al. 2006). Inokulasi Azospirillum sp. pada tanaman tomat dapat meningkatkan tinggi tanaman, panjang akar, bobot kering akar, jumlah daun, luas daun total, kandungan nitrogen daun, bobot kering tanaman, dan bobot buah tomat (Hadas & Okon 1987; Guru et al. 2011; Ramakrishnan & Selvakumar 2012). Selain itu,
Azospirillum sp. juga dapat meningkatkan kandungan karbohidrat, nitrogen, dan fosfor daun tanaman legum anual Cyamopsis tetragonoloba (Gendy et al. 2013).
Interaksi Cendawan Mikoriza Arbuskula dengan Azospirillum sp.
Interaksi CMA dengan Azospirillum merupakan hubungan yang sinergi (Bashan & Holguin 1997). Inokulasi CMA dan Azospirillum sp. secara bersamaan akan menghasilkan peningkatan pertumbuhan tanaman yang signifikan, meliputi peningkatan infeksi CMA pada akar tanaman. Inokulasi Glomus intraradices dan
A. brasilense secara bersamaan dapat meningkatkan persentase kolonisasi CMA
pada akar tanaman padi dibandingkan dengan inokulasi tunggal G. intraradices
(Ruíz-Sánchez et al. 2011). Inokulasi G. fasciculatum dan A. vinelandi secara bersamaan pada tanaman tomat varietas PKM 1 menghasilkan persentase kolonisasi CMA yang lebih tinggi dibandingkan dengan inokulasi tunggal G. fasciculatum (Guru et al. 2011).
Selain meningkatkan persentase kolonisasi CMA pada akar, inokulasi CMA
dan Azospirillum secara bersamaan juga menghasilkan pertumbuhan tanaman
6
mampu menghasilkan pertumbuhan tajuk tertinggi, bobot basah tajuk, dan bobot basah akar yang lebih besar, serta jumlah daun yang lebih banyak dibandingkan dengan inokulasi tunggal G. intraradices maupun inokulasi tunggal A. brasilense
(Ruíz-Sánchez et al. 2011).
3
METODE
Penelitian ini merupakan penelitian eksperimen yang berlangsung dari April 2012 sampai Juli 2013 yang dilakukan di Laboratorium Fisiologi Tumbuhan, Laboratorium Mikologi, Laboratorium Mikrobiologi, Laboratorium Terpadu, rumah kaca Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam IPB, serta di Laboratorium Bioteknologi Kehutanan PPSHB IPB.
Bahan
Bahan yang digunakan dalam penelitian ini adalah benih melon hibrid (Ivory) produksi PT Agri Makmur Pertiwi-Surabaya, inokulum CMA (Glomus sp. dan Gigaspora sp.) dan isolat Azospirillum sp. (IDM-3).
Rancangan Percobaan dan Analisis Data
Percobaan disusun dalam rancangan acak lengkap dengan 5 perlakuan, yaitu kontrol, pemupukan dengan NPK, inokulasi dengan CMA, inokulasi dengan
Azospirillum sp., inokulasi dengan CMA + Azospirillum sp. Setiap perlakuan
diulang 5 kali.
Analisis data menggunakan analysis of varience (ANOVA) dan uji lanjut beda nilai terkecil (BNT) pada taraf 5%, sedangkan data hasil organoleptik dianalisis dengan uji Kruskal-Wallis dan uji lanjut Dunn pada taraf 5%.
Prosedur Penelitian
Perbanyakan Inokulum CMA
Perbanyakan inokulum CMA menggunakan metode biakan pot dengan sumber inokulum yang digunakan berupa inokulum campuran yang terdiri dari zeolit yang mengandung spora dan akar yang terinfeksi CMA. Tanaman inang yang digunakan untuk perbanyakan inokulum CMA adalah sorgum, Pueraria sp.,
Centrosema sp. dengan zeolit steril sebagai media tanamnya.
Zeolit yang akan dipakai sebagai media tanam dicuci dengan air kran yang mengalir sebanyak beberapa kali untuk menghilangkan partikel-partikel debu dan tanah, kemudian dikering anginkan hingga kering dan disterilisasi pada autoklaf dengan suhu 121 0C dan tekanan 1 atm selama 1 jam.
7 kemudian dibilas dengan aquades sebanyak 3 kali dengan masing-masing pembilasan selama 5 menit. Setelah itu, benih direndam di dalam larutan Clorox 0.05% selama 1 menit, kemudian dibilas dengan aquades sebanyak 3 kali dengan masing-masing pembilasan selama 5 menit. Selanjutnya, benih diletakan pada tisu steril selama ± 2 jam sampai kering. Benih kemudian ditanam di dalam baki plastik yang telah berisi media zeolit steril. Penyiraman dilakukan dengan aquades. Setelah itu, bagian atas baki ditutup dengan alumunium foil dan dibiarkan semalaman. Selanjutnya, bagian atas baki dibuka dan dibiarkan benihnya berkecambah hingga terbentuk daun kotiledon dan akar lembaga. Setelah terbentuk daun kotiledon dan akar lembaga pada semaian tanaman inang, maka inokulasi CMA dilakukan.
Inokulasi CMA ke akar tanaman inang dilakukan dengan mengusahakan terjadi kontak langsung antara CMA dengan akar tanaman inang pada bagian yang masih muda, yaitu dengan menempelkan 25 spora/akar tanaman inang. Selanjutnya, tanaman inang ditanam di dalam gelas plastik yang berisi zeolit steril sebanyak 250 g.
Kultur CMA ini disiram dengan menggunakan aquades setiap hari dan dipelihara selama 6 bulan. Pengecekan kolonisasi dilakukan setelah 6 bulan pemeliharaan. Jika kolonisasi mencapai 70% atau lebih, maka dilakukan cekaman kekeringan selama beberapa hari. Setelah media tanam kering, bagian tajuk tanaman dipotong, kemudian seluruh akar dan media tanam dipanen untuk digunakan sebagai inokulum CMA bagi perlakuan sebanyak 1 kg/polibag perlakuan CMA.
Penyiapan Inokulum Azospirillum sp.
Isolat Azospirillum sp. ditumbuhkan dalam 1 L media NFB dan diinkubasi selama 48 jam (Cáceres 1982), kemudian disentrifugasi pada 4500 x g selama 5 menit (Ruíz-Sánchez et al. 2011). Selanjutnya, 50 ml hasil sentrifugasi dicampur ke dalam 1 kg gambut yang telah disterilkan terlebih dahulu dengan autoclave. Sebanyak 2 g inokulum Azospirillum sp. dengan kepadatan 2.2 x 107 cfu/g gambut ditambahkan ke dalam setiap polibag perlakuan Azospirillum sp.
Penyiapan Media Tanam
Tanah yang digunakan sebagai media tanam diambil dari daerah Dramaga, Bogor dengan komposisi 24% pasir, 32% debu, 44% liat serta memiliki pH 5.2 (H2O), 3.26% C, 0.29% N, 46 ppm P2O5 (Olsen). Sebelum digunakan, tanah dikering anginkan kemudian diayak. Setelah itu, tanah disterilisasi dengan metode
steam selama 9 jam.
Penyiapan Bibit Melon
8
Penanaman
Bibit melon ditanam di dalam polibag yang berisi 10 kg media tanam. Media tanam untuk kontrol berupa tanah steril sebanyak 10 kg. Media tanam untuk perlakuan pemupukan dengan NPK terdiri atas tanah, pupuk kandang, kompos, dan sekam padi dengan perbandingan volume 1:1:1:3 yang dicampur secara merata. Media tanam untuk inokulasi CMA terdiri atas tanah dengan inokulum CMA 10% (b/b), sedangkan media tanam untuk inokulasi Azospirillum
sp. terdiri atas tanah dan 2 g gambut inokulum Azospirillum sp. Selanjutnya, media tanam untuk inokulasi CMA + Azospirillum sp. terdiri atas tanah, 10% inokulum CMA (b/b), dan 2 g gambut inokulum Azospirillum sp.
Pemeliharaan Tanaman
Pemeliharaan tanaman meliputi penyiraman, pemasangan ajir, dan pemupukan. Penyiraman dilakukan setiap hari dengan menggunakan aquades. Pemasangan ajir dilakukan agar tanaman dapat tumbuh merambat dan tidak mudah roboh. Pemupukan hanya diberikan untuk perlakuan pemupukan dengan NPK berupa 5 g NPK 16:16:16 per polibag pada awal penanaman dan pupuk susulan yang diberikan beberapa kali dengan waktu pemupukan, jenis, dan dosis pupuk tertera pada Tabel 1.
Tabel 1 Jadwal pemberian pupuk susulan untuk perlakuan pemupukan NPK Jenis pupuk Waktu penyerbukan sendiri karena kurangnya serangga polinator, sehingga perlu dilakukan penyerbukan buatan. Waktu penyerbukan adalah pagi hari sebelum pukul 10.00 karena bunga betina sedang mekar penuh pada waktu ini.
Analisis Pertumbuhan Tanaman Melon
Parameter pertumbuhan tanaman yang diamati pada fase vegetatif, yaitu tinggi tanaman yang diukur setiap minggu, sedangkan panjang akar, jumlah akar lateral, bobot basah dan bobot kering akar, jumlah daun, luas daun total, diameter batang, bobot basah dan bobot kering tajuk diukur pada umur 25 hari setelah tanam (HST) saat tanaman telah menghasilkan bunga.
9
Analisis Kandungan Nitrogen, Fosfor, dan Karbon Daun Melon
Kadar nitrogen, fosfor, dan karbon daun melon diukur pada umur 25 HST. Kandungan nitrogen daun melon diukur dengan metode Kjeldahl. Kandungan fosfor daun melon diukur dengan metode spektrofotometer. Kandungan karbon daun melon diukur dengan metode Walkley & Black.
Analisis Kualitas Buah Melon
Kualitas buah melon yang meliputi bobot buah, diameter buah, kemanisan buah, aroma, tekstur, dan umur simpan buah pada suhu ruang, diamati pada saat panen (81-87 HST). Kemanisan buah melon diukur dengan brix refractometer. Aroma dan tekstur buah melon ditentukan secara organoleptik.
Uji organoleptik yang digunakan meliputi uji pembedaan (discriminative test) berupa uji skor (scoring test) untuk membandingkan aroma dan tekstur buah melon yang dihasilkan oleh setiap perlakuan (berdasarkan metode pengujian organoleptik dalam industri pangan) dengan melibatkan 10 orang panelis. Setiap panelis diminta untuk mengidentifikasi perbedaan aroma dan tekstur di antara sampel-sampel buah melon dengan memberikan nilai (skor) sesuai penilaian dengan mengisi kuesioner pada Lampiran 1 dan Lampiran 2.
Umur simpan buah melon pada suhu ruang ditentukan dengan mengamati perubahan warna kulit buah (hijau kekuningan menjadi kuning), aroma (sangat segar dan beraroma khas melon menjadi kurang segar dan beraroma agak tengik), dan tekstur kulit buah melon (sangat keras menjadi agak lunak).
Analisis Kolonisasi CMA pada Akar Tanaman Melon
Struktur infeksi cendawan diamati dengan pewarnaan akar menggunakan pewarna biru trypan (Phillips & Hayman 1970). Akar tanaman dipotong dan dibersihkan dari kotoran, direndam di dalam KOH 10% selama 24 jam, kemudian dibilas dengan aquades sebanyak 3 kali. Selanjutnya, akar direndam di dalam HCl 1% selama 6-12 jam dan diwarnai dengan biru trypan. Akar kemudian disimpan di dalam larutan gliserol 50%.
10
Analisis Kolonisasi Bakteri Azospirillum sp. pada Media Tanam
Kolonisasi bakteri Azospirillum sp. pada media tanam melon dari setiap perlakuan pada umur 25 HST dan umur panen ditentukan dengan menggunakan metode most probable number (MPN).
4
HASIL DAN PEMBAHASAN
Hasil
Pertumbuhan Tanaman Melon
Tinggi Tanaman Melon. Perbedaan tinggi tanaman melon terlihat pada umur 21 HST. Tinggi tanaman melon perlakuan NPK, CMA, Azospirillum sp., dan perlakuan CMA + Azospirillum sp. berbeda nyata dengan tinggi tanaman melon kontrol (p < 0.05). Tinggi tanaman melon perlakuan CMA + Azospirillum sp. berbeda nyata dengan tinggi tanaman melon perlakuan CMA (p < 0.05), tetapi tidak berbeda nyata dengan tinggi tanaman melon perlakuan Azospirillum sp. (p > 0.05). Tinggi tanaman melon perlakuan CMA berbeda nyata dengan tinggi tanaman melon perlakuan NPK (p < 0.05). Rata-rata tinggi tanaman melon kontrol, perlakuan NPK, CMA, Azospirillum sp., CMA + Azospirillum sp. umur 21 HST berturut-turut adalah 40.40 cm; 45.40 cm; 49 cm; 54 cm dan 54 cm (Gambar 1). Tinggi tanaman melon perlakuan NPK, CMA, Azospirillum sp., dan perlakuan CMA + Azospirillum sp. umur 25 HST berbeda nyata dengan tinggi tanaman melon kontrol (p < 0.05). Tinggi tanaman melon perlakuan CMA +
Azospirillum sp. berbeda nyata dengan tinggi tanaman melon perlakuan NPK (p <
0.05), tetapi tidak berbeda nyata dengan tinggi tanaman melon perlakuan
Azospirillum sp. (p > 0.05). Rata-rata tinggi tanaman melon kontrol, perlakuan NPK, CMA, Azospirillum sp., CMA + Azospirillum sp. umur 25 HST berturut-turut adalah 77.28 cm; 88.40 cm; 96.06 cm; 98.18 cm dan 98.58 cm (Gambar 1).
11
Panjang Akar Melon. Panjang akar tanaman melon perlakuan CMA +
Azospirillum sp. berbeda nyata dengan panjang akar tanaman melon kontrol,
perlakuan NPK, dan perlakuan CMA (p < 0.05), tetapi tidak berbeda nyata dengan panjang akar tanaman melon perlakuan Azospirillum sp. (p > 0.05). Panjang akar tanaman melon perlakuan CMA berbeda nyata dengan panjang akar tanaman melon kontrol (p < 0.05), tetapi tidak berbeda nyata dengan panjang akar tanaman melon perlakuan NPK (p > 0.05) (Tabel 2).
Tabel 2 Panjang akar tanaman melon kontrol, perlakuan NPK, CMA,
12
Tabel 4 Bobot basah dan bobot kering akar tanaman melon kontrol, perlakuan NPK, CMA, Azospirillum sp., CMA + Azospirillum sp.
Azospirillum sp. berbeda nyata dengan jumlah daun tanaman melon kontrol,
perlakuan NPK, CMA, dan perlakuan Azospirillum sp. (p < 0.05), tetapi jumlah daun tanaman melon perlakuan CMA dan perlakuan Azospirillum sp. tidak berbeda nyata dengan jumlah daun tanaman melon kontrol dan perlakuan NPK (p > 0.05) (Tabel 5). perlakuan NPK, CMA, dan perlakuan Azospirillum sp. (p < 0.05). Luas daun total tanaman melon perlakuan CMA dan perlakuan Azospirillum sp. berbeda nyata dengan luas daun total tanaman melon kontrol (p < 0.05), tetapi tidak berbeda nyata dengan luas daun total tanaman melon perlakuan NPK (p > 0.05) (Tabel 6). Tabel 6 Luas daun total tanaman melon kontrol, perlakuan NPK, CMA,
13 berbeda nyata dengan diameter batang tanaman melon perlakuan NPK (p > 0.05) (Tabel 7). kering tajuk tanaman melon perlakuan CMA dan perlakuan Azospirillum sp. tidak berbeda nyata dengan bobot basah dan bobot kering tajuk tanaman melon perlakuan NPK (p > 0.05) (Tabel 8).
Tabel 8 Bobot basah dan bobot kering tajuk tanaman melon kontrol,
14
Kualitas Buah Melon
Bobot Buah Melon. Bobot buah melon perlakuan CMA + Azospirillum sp. tidak berbeda nyata dengan bobot buah melon perlakuan CMA dan perlakuan
Azospirillum sp. (p > 0.05), tetapi berbeda nyata dengan bobot buah melon kontrol dan perlakuan NPK (p < 0.05) (Tabel 10).
Tabel 10 Bobot buah tanaman melon kontrol, perlakuan NPK, CMA,
Diameter Buah Melon. Diameter buah melon perlakuan CMA + Azospirillum sp. tidak berbeda nyata dengan diameter buah melon perlakuan CMA dan perlakuan
Azospirillum sp. (p > 0.05), tetapi berbeda nyata dengan diameter buah melon kontrol dan perlakuan NPK (p < 0.05) (Tabel 11).
Tabel 11 Diameter buah tanaman melon kontrol, perlakuan NPK, CMA,
Tingkat Kemanisan Buah Melon. Kemanisan buah melon perlakuan CMA,
Azospirillum sp., dan perlakuan CMA + Azospirillum sp. berbeda nyata dengan kemanisan buah melon kontrol (p < 0.05), tetapi tidak berbeda nyata dengan kemanisan buah melon perlakuan NPK (p > 0.05) (Tabel 12).
Tabel 12 Tingkat kemanisan buah tanaman melon kontrol, perlakuan NPK, CMA, Azospirillum sp., CMA + Azospirillum sp.
Perlakuan Kemanisan buah (0briks)
Kontrol 12.20b
Aroma Buah Melon. Berdasarkan hasil uji organoleptik, skor untuk aroma buah melon menunjukkan bahwa buah melon yang dihasilkan oleh perlakuan CMA +
Azospirillum sp. memiliki aroma yang lebih harum dari buah melon yang
15 (p < 0.05), tetapi aroma buah melon perlakuan CMA + Azospirillum sp. tidak berbeda nyata dengan aroma buah melon perlakuan CMA (p > 0.05) (Tabel 13). Tabel 13 Nilai uji organoleptik untuk aroma buah tanaman melon kontrol,
Tekstur Buah Melon. Berdasarkan hasil uji organoleptik, skor untuk tekstur buah melon menunjukkan bahwa buah melon perlakuan CMA + Azospirillum sp. memiliki tekstur yang tidak berbeda dengan tekstur buah melon perlakuan NPK, CMA dan perlakuan Azospirillum sp. (p > 0.05), tetapi berbeda dengan tekstur buah melon kontrol (p < 0.05) (Tabel 14).
Tabel 14 Nilai uji organoleptik untuk tekstur buah tanaman melon kontrol,
Umur Simpan Buah Melon pada Suhu Ruang. Umur simpan buah melon pada suhu ruang untuk buah yang dihasilkan oleh perlakuan CMA + Azospirillum sp. tidak berbeda nyata dengan umur simpan buah melon yang dihasilkan oleh perlakuan CMA dan perlakuan Azospirillum sp. (p > 0.05), tetapi berbeda nyata dengan umur simpan buah melon yang dihasilkan oleh tanaman kontrol dan perlakuan NPK (p < 0.05) (Tabel 15).
Tabel 15 Umur simpan buah tanaman melon kontrol, perlakuan NPK, CMA, Azospirillum sp., CMA + Azospirillum sp. pada suhu ruang
16
Kolonisasi CMA pada Akar Melon
Kolonisasi CMA hanya terjadi pada akar tanaman melon yang diinokulasikan dengan CMA. Akar tanaman melon yang terkolonisasi CMA dan yang tidak terkolonisasi dapat dilihat pada Gambar 2.
A B
Gambar 2 Akar tanaman melon yang terkolonisasi CMA (A) dan yang tidak terkolonisasi CMA (B); S = spora, HE = hifa eksternal
Kolonisasi CMA pada akar tanaman melon perlakuan CMA + Azospirillum
sp. lebih tinggi (p < 0.05) dibandingkan dengan kolonisasi CMA pada akar tanaman melon perlakuan CMA, baik saat tanaman berumur 25 HST maupun saat umur panen (Tabel 16).
Kolonisasi Bakteri Azospirillum sp. pada Media Tanam
Koloni bakteri Azospirillum sp. hanya ditemukan pada media tanam tanaman melon perlakuan Azospirillum sp.dan perlakuan CMA + Azospirillum sp., sedangkan pada media tanam tanaman melon kontrol, perlakuan NPK, dan perlakuan CMA tidak ditemukan adanya koloni bakteri Azospirillum sp, baik pada umur 25 HST maupun setelah panen. Kolonisasi bakteri Azospirillum sp. pada media tanam tanaman melon perlakuan CMA + Azospirillum sp. lebih tinggi dari kolonisasi bakteri Azospirillum sp. pada media tanam tanaman melon perlakuan
Azospirillum sp. (p < 0.05) (Tabel 17). S
HE
0.5 mm mm
17 Tabel 17 Kolonisasi bakteri Azospirillum sp. pada media tanam tanaman melon kontrol, perlakuan NPK, CMA, Azospirillum sp., CMA + Azospirillum sp.
Perlakuan
Kolonisasi bakteri Azospirillum sp. pada media tanam
CMA dan Azospirillum sp. menghasilkan laju pertumbuhan vegetatif yang berbeda saat diinokulasikan secara terpisah. Pengaruh CMA terhadap jumlah daun, luas daun total, diameter batang, bobot basah dan bobot kering tajuk, panjang akar dan jumlah akar lateral dalam penelitian ini sama dengan pemupukan NPK.
Azospirillum sp. berperan dalam meningkatkan pertumbuhan akar melon,
sedangkan pengaruh Azospirillum sp. terhadap jumlah daun, luas daun total, diameter batang, bobot basah dan bobot kering tajuk sama dengan pemupukan NPK. Peranan Azospirillum sp. dalam meningkatkan pertumbuhan akar disebabkan oleh bakteri ini menghasilkan hormon IAA (indole-3-acetic acid) yang merupakan salah satu hormon pertumbuhan tanaman (Kanchana et al. 2013). Hormon ini berperan dalam pembelahan sel, perpanjangan batang tanaman, serta meningkatkan jumlah akar lateral dan bulu-bulu akar (Srivastava 2002; Aloni et al. 2006; Ribaudo et al. 2006). Penelitian-penelitian sebelumnya menunjukkan bahwa CMA dan Azospirillum sp. dapat meningkatkan pertumbuhan tanaman. CMA dapat meningkatkan tinggi tanaman, jumlah daun, luas daun, diameter batang, bobot basah dan bobot kering tajuk, panjang akar, bobot basah dan bobot kering akar (Dasgan 2008; Ruíz-Sánchez et al. 2011; Tufenkci et al. 2012; Wahb-Allah et al. 2014). Bahkan, CMA diketahui dapat meningkatkan tinggi tanaman, panjang akar, diameter batang, bobot basah dan bobot kering tajuk, bobot basah dan bobot kering akar melon (Huang et al. 2011). Azospirillum sp. dapat meningkatkan tinggi tanaman, jumlah daun, luas daun total, bobot basah dan bobot kering tajuk, panjang akar, jumlah akar lateral, bobot basah dan bobot kering akar (Hadas & Okon 1987; Ribaudo et al. 2006; Barassi et al. 2007; Guru
et al. 2011; Ramakrishnan & Selvakumar 2012; Gendy et al. 2013).
18
terpisah (Guru et al. 2011). Selain itu, inokulasi CMA dan Azospirillum sp. secara bersamaan dalam penelitian ini juga dapat meningkatkan kandungan nitrogen, fosfor, dan karbon daun melon, sedangkan kandungan nitrogen, karbon, dan fosfor daun tanaman melon perlakuan CMA dan perlakuan Azospirillum sp. dalam penelitian ini sama dengan perlakuan NPK. Hal ini menunjukkan adanya hubungan yang sinergi antara CMA dan Azospirillum sp. Kesinergian antara dua mikroba ditunjukkan oleh adanya penyediaan nutrisi, penghilangan inhibitor, atau saling menstimulir melalui mekanisme fisiologi maupun biokimia (Bashan & Holguin 1997).
Hubungan sinergi antara CMA dan Azospirillum sp. juga dapat dilihat pada kolonisasi CMA dari akar melon saat dinokulasikan dengan CMA + Azospirillum
sp. yang lebih tinggi dibandingkan dengan kolonisasi CMA dari akar melon yang hanya diinokulasikan dengan CMA. Azospirillum sp. meningkatkan kolonisasi CMA pada akar melon, sehingga menyebabkan perlakuan CMA + Azospirillum sp. memiliki kolonisasi CMA yang lebih tinggi dibandingkan dengan perlakuan CMA, baik pada umur 25 HST maupun pada umur panen (81-87 HST). Inokulasi CMA
dan Azospirillum secara bersamaan juga diketahui menghasilkan persentase
kolonisasi CMA pada akar tomat dan padi yang lebih tinggi dibandingkan dengan inokulasi tunggal CMA (Guru et al. 2011; Ruíz-Sánchez et al. 2011). Hal ini disebabkan karena kemampuan Azospirillum sp. dalam meningkatkan jumlah akar lateral dan bulu-bulu akar (Aloni et al. 2006; Ribaudo et al. 2006), sehingga meningkatkan luas permukaan dan kepadatan akar yang dapat meningkatkan persentase kolonisasi CMA pada akar (Smith & Read 1997).
Kesinergian antara CMA dan Azospirillum sp. dalam penelitian ini juga terlihat pada jumlah koloni bakteri Azospirillum sp. yang lebih tinggi pada perlakuan CMA + Azospirillum sp. dibandingkan dengan perlakuan Azospirillum
sp. Bakteri Azospirillum sp. merupakan bakteri yang hidup di rhizosfer dengan memanfaatkan eksudat akar sebagai sumber karbonnya (Gafni et al. 1986). Kolonisasi CMA pada akar menyebabkan perubahan fisiologis akar tanaman yang menginduksi pelepasan eksudat akar (Scheffknecht et al. 2006), yang diduga dapat dimanfaatkan oleh Azospirillum sp. sebagai sumber karbon bagi pertumbuhannya.
19 mengimpor sejumlah besar fotosintat (Srivastava 2002). Nitrogen dan fosfor juga berperan dalam fotosintesis yang menghasilkan fotosintat yang akan ditranspor ke buah selama tahapan pembesaran sel. Hal inilah yang menyebabkan tanaman melon kontrol menghasilkan buah berukuran yang lebih kecil dengan tekstur yang sangat lunak dan memiliki kemanisan yang lebih rendah dibandingkan dengan buah melon yang dihasilkan oleh perlakuan NPK, perlakuan CMA, dan perlakuan
Azospirillum sp.
Meskipun buah melon yang dihasilkan oleh perlakuan CMA dan perlakuan
Azospirillum sp. memiliki tekstur dan tingkat kemanisan yang tidak berbeda
dengan buah melon yang dihasilkan oleh perlakuan NPK, bobot dan diameter buah melon yang dihasilkan oleh perlakuan CMA dan perlakuan Azospirillum sp. lebih besar dari buah melon yang dihasilkan oleh perlakuan NPK. Jumlah sel yang terbentuk pada tahapan pembelahan sel sebelum memasuki tahapan pertumbuhan atau pembesaran sel akan sangat menentukan ukuran buah. Auksin, sitokinin, dan giberalin merupakan hormon-hormon yang sangat berperan dalam tahapan ini karena dapat memacu pembelahan sel. Bahkan, sitokinin dapat meningkatkan aktivitas pembelahan sel menjadi maksimal, sehingga menghasilkan buah dengan ukuran yang lebih besar (Srivastava 2002). Kemampuan CMA dan Azospirillum
sp. untuk menghasilkan atau menginduksi dan meningkatkan produksi auksin, giberalin, dan sitokinin (Allen et al. 1980; Barea & Azcón-Aguilar 1982; Fulchieri et al. 1993; Kanchana et al. 2013) diduga yang menyebabkan CMA dan
Azospirillum sp. dapat menghasilkan buah melon dengan bobot dan diameter yang
lebih besar dari buah melon yang dihasilkan oleh perlakuan NPK sekalipun CMA
dan Azospirillum sp. memiliki serapan hara yang sama dengan perlakuan NPK.
Inokulasi CMA dan Azospirillum sp. pada tanaman tomat juga dapat meningkatkan bobot dan diameter buah (Dasgan 2008; Ramakrishnan & Selvakumar 2012).
Oleh karena CMA juga memperoleh sumber karbon dari fotosintat tanaman inangnya, maka CMA selalu akan meningkatkan laju fotosintesis tanaman inangnya (Smith et al. 2011), tetapi peningkatan laju fotosintesis tidak selamanya akan meningkatkan biomassa tanaman bermikoriza karena tidak semua fotosintat dikonversi untuk produksi biomassa tanaman (Wright et al. 1998b). Ada mekanisme pembagian fotosintat antara CMA dengan tanaman inangnya yang melibatkan berbagai enzim untuk meregulasi pembagian fotosintat, seperti enzim
invertase dan sucrosa synthase, sehingga ada keseimbangan karbon di antara CMA dan tanaman inangnya. Dengan demikian, tanaman inang tetap dapat ditunjang pertumbuhan dan perkembangannya (Wright et al. 1998a; Smith et al.
2011). Adanya mekanisme pembagian fotosintat ini yang menyebabkan CMA tetap mampu menunjang pertumbuhan dan perkembangan tanaman melon. Bahkan, CMA mampu menghasilkan buah melon dengan bobot dan diameter yang lebih besar.
20
akan meningkatkan kandungan glukosinolat (Falk et al. 2007). Tambahan senyawa glukosinolat dan polisakarida dari hasil metabolisme sulfur karena kandungan sulfur yang tinggi, diduga yang menyebabkan CMA tetap mampu menghasilkan buah melon dengan tingkat kemanisan yang sama dengan buah melon yang dihasilkan oleh perlakuan NPK dan perlakuan Azospirillum sp.
Buah melon yang dihasilkan oleh perlakuan CMA memiliki aroma yang lebih harum. Buah melon memiliki aroma khas karena mengandung berbagai senyawa volatil dari kelompok ester, asetat, alkohol, aldehid, dan senyawa sulfur (Beaulieu 2006). Inokulasi CMA pada tanaman strawberry juga dapat meningkatkan aroma buah strawberry (Fan et al. 2008). Kemampuan CMA untuk meningkatkan aroma buah, diduga karena tambahan senyawa volatil lain, yaitu
cyclohexenone yang menyebabkan aroma pada buah dan bunga. Cyclohexenone
dihasilkan saat tanaman membentuk strigolactone (Walter et al. 2010), yaitu suatu senyawa sesquiterpen yang berperan sebagai signal untuk bersimbiosis dengan CMA dan menginduksi perkembangan hifa CMA (Akiyama et al. 2005). Selain itu, peningkatan hara sulfur oleh CMA (Allen & Shachar-Hill 2009; Casieri et al.
2012) juga akan meningkatkan metabolisme sulfur yang dapat menghasilkan berbagai senyawa sulfur yang berperan dalam pembentukan aroma buah. Glukosinolat merupakan salah satu senyawa yang dihasilkan dari metabolisme sulfur yang juga merupakan salah satu senyawa flavour (Falk et al. 2007).
Buah melon yang dihasilkan oleh perlakuan CMA dan perlakuan
Azospirillum sp. memiliki umur simpan pada suhu ruang yang lebih lama
dibandingkan dengan buah melon yang dihasilkan oleh tanaman kontrol dan perlakuan NPK. Buah melon merupakan buah klimaterik, sehingga memiliki umur simpan yang terbatas. Setelah umur simpan ini dilewati, buah melon akan mengalami serangkaian perubahan fisiologis dan biokimia, antara lain perubahan warna buah, tekstur, aroma, dan rasa (Ezura & Owino 2008). Umur simpan buah klimaterik sangat dipengaruhi oleh produksi hormon etilen. CMA diketahui mampu menurunkan ACC (aminocyclopropane-1-carboxylate) yang merupakan prekusor etilen (Martínez-Medina et al. 2011a), sedangkan Azospirillum sp. diketahui dapat mengandung ACC deaminase yang mengubah etilen menjadi amonia dan α-ketobutirat (Glick et al. 1998), sehingga diduga bahwa CMA dan
Azospirillum sp. dapat menurunkan produksi hormon etilen yang menyebabkan
lebih lamanya umur simpan buah melon pada suhu ruang dibandingkan dengan umur simpan buah melon yang dihasilkan oleh pemupukan NPK.
21
5
SIMPULAN DAN SARAN
Simpulan
Inokulasi CMA dan Azospirillum sp. secara bersamaan dapat meningkatkan pertumbuhan tanaman melon, antara lain: tinggi tanaman, panjang akar, jumlah akar lateral, bobot basah dan bobot kering akar, jumlah daun, luas daun total, bobot basah dan bobot kering tajuk, serta meningkatkan kandungan nitrogen, fosfor, dan karbon daun melon, sedangkan inokulasi Azospirillum sp. dapat meningkatkan pertumbuhan akar tanaman melon. Untuk kualitas buah, baik CMA,
Azospirillum sp. maupun inokulasi CMA dan Azospirillum sp. secara bersamaan
dapat meningkatkan bobot buah, diameter buah, aroma, dan umur simpan buah melon pada suhu ruang.
Saran
Perlu adanya studi lebih lanjut untuk menguji keefektifan CMA dan
Azospirillum sp. dalam meningkatkan pertumbuhan tanaman melon dengan
melihat jenis CMA dan Azospirillum serta melibatkan beberapa varietas melon.
DAFTAR PUSTAKA
Akiyama K, Matsuzaki K, Hayashi H. 2005. Plant sesquiterpenes induce hyphal branching in arbuscular mycorrhizal fungi. Nature 435: 824-827.
Allen JW, Shachar-Hill Y. 2009. Sulfur transfer through an arbuscular mycorrhiza.
Plant Physiology 149: 549-560.
Allen MF, Moore TS, Christensen M. 1980. Phytohormone changes in Bouteloua
gracilis infected by vesicular-arbuscular mycorrhizae. I. cytokinin increases
in the host plant. Canadian Journal of Botany 58(3): 371-374.
Aloni R, Aloni E, Langhans M, Ullrich CI. 2006. Role of cytokinin and auxin in shaping root architecture: regulating vascular differentiation, lateral root initiation, root apical dominance and root gravitropism. Annals of Botany
97: 883-893.
Ames RN, Reid CPP, Porter LK, Cambardella C. 1983. Hyphal uptake and transport of nitrogen from two 15N-labelled sources by Glomus mosseae, a vesicular-arbuscular mycorrhizal fungus. New Phytologist 95: 381-396.
Ayoola OT, Adeniyan ON. 2006. Influence of poultry manure and NPK fertilizer on yield and yield components of crops under different cropping systems in south west Nigeria. African Journal of Biotechnology 5(15): 1386-1392. Ayoola OT, Makinde EA. 2007. Complementary organic and inorganic fertilizer
application: influence on growth and yield of cassava/maize/melon intercrop with a relayed cowpea. Australian Journal of Basic and Applied Sciences
22
Barassi CA, Sueldo RJ, Creus CM, Carrozzi LE, Casanovas EM, Pereyra MA. 2007. Azospirillum spp., a dynamic soil bacterium favourable to vegetable crop production. Dynamic Soil, Dynamic Plant 1(2): 68-82.
Barea JM, Azcón-Aguilar C. 1982. Production of plant growth-regulating substances by the vesicular-arbuscular mycorrhizal fungus Glomus mosseae.
Applied and Environmental Microbiology 43(4): 810-813.
Barker AV, Pilbeam DJ. 2007. Handbook of Plant Nutrition. USA: CRC Press. Bashan Y, Holguin G. 1997. Azospirillum-plant relationships: environmental and
physiological advances (1990-1996). Canadian Journal of Microbiology 43: 103-121.
Beaulieu JC. 2006. Volatile changes in cantaloupe during growth, maturation, and in stored fresh-cuts prepared from fruit harvested at various maturities.
Journal of the American Society for Horticultural Science 131(1): 127-139.
Bolan NS. 1991. A critical review on the role of mycorrhizal fungi in the uptake of phosphorus by plants. Plant and Soil 134(2): 189-207.
Brundrett M, Bougher N, Dell B, Grove T, Malajczuk N. 1996. Working with
Mycorrhizas in Forestry and Agriculture. Canberra, Australia: ACIAR
Monograph.
Budiastuti S, Purnomo D, Sulistyo TD, Rahardjo SP, Darsono L, Pardjo YV. 2012. The enhancement of melon fruit quality by application of the fertilizer and gibberellin. Journal of Agricultural Science and Technology B 2: 455-460. Cáceres EAR. 1982. Improved medium for isolation of Azospirillum spp. Applied
and Environmental Microbiology 44(4): 990-991.
Casieri L, Gallardo K, Wipf D. 2012. Transcriptional response of Medicago truncatula sulphate transporters to arbuscular mycorrhizal symbiosis with and without sulphur stress. Planta 235(6): 1431-1447.
Cruz AF, de Oliveira-Soares WR, Blum LEB. 2014. Impact of the arbuscular mycorrhizal fungi and bacteria on biocontrol of white root rot in fruit seedlings. Jornal of Plant Physiology & Pathology 2(1): 1-5.
Dasgan HY, Kusvuran S, Ortas I. 2008. Responses of soilless grown tomato plants to arbuscular mycorrhizal fungal (Glomus fasciculatum) colonization in re-cycling and open systems. African Journal of Biotechnology 7(20): 3606-3613.
Dodd JC, Burton CC, Burns RG, Jeffries P. 1987. Phosphatase activity associated with the roots and the rhizosphere of plants infected with vesicular-arbuscular mycorrhizal fungi. New Phytologist 107: 163-172.
Ezura H, Owino WO. 2008. Melon, an alternative model plant for elucidating fruit ripening. Plant Science 175: 121-129.
Falk KL, Tokuhisa JG, Gershenzon J. 2007. The effect of sulfur nutrition on plant glucosinolate content: physiology and molecular mechanisms. Plant Biology
9: 573-581.
Fan Y, Luan Y, An L, Yu K. 2008. Arbuscular mycorrhizae formed by
Penicillium pinophilum improve the growth, nutrient uptake and
photosynthesis of strawberry with two inoculum-types. Biotechnology
Letters 30: 1489-1494.
23 Fulchieri M, Lucangeli C, Bottini R. 1993. Inoculation with A. lipoferum affects growth and gibberellin status of corn seedlings roots. Plant and Cell Physiology 134: 1305-1309.
Gafni R, Okon Y, Kapulnik Y. 1986. Adsorption of Azospirillum brasilense to corn roots. Soil Biology & Biochemistry 8(1): 69-75.
Gendy ASH, Said-Al Ahl HAH, Mahmoud AA, Mohamed HFY. 2013. Effect of nitrogen sources, bio-fertilizers and their interaction on the growth, seed yield and chemical composition of guar plants. Life Science Journal 10(3): 389-402.
Giovannetti M, Mosse B. 1980. An evaluation of techniques for measuring vesicular arbuscular mycorrhizal infection in roots. New Phytologist 84: 489-500.
Glick BR, Penrose DM, Li J. 1998. A model for the lowering of plant ethylene concentrations by plant growth-promoting bacteria. Journal of Theoretical Biology 190: 63-68.
Guru V, Tholkappian P, Viswanathan K. 2011. Influence of arbuscular mycorrhizal fungi and Azospirillum co-inoculation on the growth characteristics, nutritional content and yield of tomato crops grown in South India. Indian Journal of Fundamental and Applied Life Sciences 1(4): 84-92. Guzmán-Loza C, Farías-Larios J, López-Aguirre JG. 2000. Evaluation of two
commercial formulations of mycorrhizal fungi for honeydew melon
(Cucumis melo L.) seedlings production. HortScience 35(3): 430-431.
Hadas R, Okon Y. 1987. Effect of Azospirillum brasilense inoculation on root morphology and respiration in tomato seedlings. Biology and Fertility of Soils 5(3): 241-247.
Huang Z, Zou Z, He C, He Z, Zhang Z, Li J. 2011. Physiological and photosynthetic responses of melon (Cucumis melo L.) seedlings to three
Glomus species under water deficit. Plant and Soil 339: 391-399.
Jeffries P, Gianinazzi S, Perotto S, Turnau K, Barea J. 2003. The contribution of arbuscular mycorrhizal fungi in sustainable maintenance of plant health and soil fertility. Biology and Fertility of Soils 37: 1-16.
Kanchana D, Jayanthi M, Kanchana D, Saranraj P, Sujitha D. 2013. Evaluation of plant growth promoting substance production by Azospirillum sp. isolated from rhizosphere of chilli (Capsicum annuum L.). International Journal of
Microbiological Research 4(3): 300-304.
Leigh J, Hodge A, Fitter AH. 2009. Arbuscular mycorrhizal fungi can transfer substantial amounts of nitrogen to their host plant from organic material.
New Phytologist 181: 199-207.
Lenin M, Selvakumar G, Thamizhiniyan P, Rajendiran R. 2010. Growth and biochemical changes of vegetable seedlings induced by arbuscular mycorrhizal fungus. Journal of Experimental Sciences 1(4): 27-31.
Mantelin S, Touraine B. 2004. Plant growth-promoting bacteria and nitrate availability: impacts on root development and nitrate uptake. Journal of
Experimental Botany 55(394): 27-34.
24
Martínez-Medina A, Roldán A, Pascual JA. 2011b. Interaction between arbuscular mycorrhizal fungi and Trichoderma harzianum under conventional and low input fertilization field condition in melon crops: growth response and fusarium wilt biocontrol. Applied Soil Ecology 47: 98-105.
Miransari M. 2011. Interaction between arbuscular mycorrhizal fungi and soil bacteria. AppliedMicrobiology and Biotechnology 89: 917-930.
Nkansah GO, Kanton RAL, Ametefe C, Quaye EB, Mawuli A. 2012. Agronomic performance of eight sweet melon cultivars in three ecological zones of Ghana. Journal of Agronomy: 1-7.
Ortas I. 2012. The effect of mycorrhizal fungal inoculation on plant yield, nutrient uptake and inoculation effectiveness under long-term field conditions. Field
Crops Research 125: 35-48.
Phillips JM, Hayman DS. 1970. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Transactions of the British Mycological Society 55: 158-161.
Porras-Soriano A, Soriano-Martín ML, Porras-Piedra A, Azcón R. 2009. Arbuscular mycorrhizal fungi increased growth, nutrient uptake and tolerance to salinity in olive trees under nursery conditions. Journal of Plant
Physiology 166: 1350-1359.
Prihatman K. 2000. Melon (Cucumis melo L.). Tentang budidaya pertanian [Internet]. Jakarta (ID): Menteri Negara Riset dan Teknologi. hlm 1-19; [diunduh 2014 Juni 26]. Tersedia pada: http://www.ristek.go.id.
Ramakrishnan K, Selvakumar G. 2012. Effect of biofertilizers on enhancement of growth and yield on tomato (Lycopersicum esculentum Mill.). International
Journal of Research in Botany 2(4): 20-23.
Ribaudo CM, Krumpholz EM, Cassán FD, Bottini R, Cantore ML, Curá JA. 2006.
Azospirillum sp. promotes root hair development in tomato plants through a
mechanism that involves ethylene. Journal of Plant Growth Regulation 24: 175-185.
Ruíz-Sánchez M, Armada E, Mu˜noz Y, de Salamone IEG, Aroca R, Ruíz-Lozano JM, Azcón R. 2011. Azospirillum and arbuscular mycorrhizal colonization enhance rice growth and physiological traits under well-watered and drought conditions. Journal of Plant Physiology 168: 1031-1037.
Scheffknecht S, Mammerler R, Steinkellner S, Vierheilig H. 2006. Root exudates of mycorrhizal tomato plants exhibit a different effect on microconidia germination of Fusarium oxysporum f. sp. lycopersici than root exudates from non-mycorrhizal tomato plants. Mycorrhiza 16: 365-370.
Sensoy S, Bicer S, Unsal H. 2013. Arbuscular mycorrhizal fungi affect seedling growth of melon hybrid cultivars. International Journal of Agriculture &
Biology 15: 392-394.
Smith SE, Jakobsen I, Grønlund M, Smith FA. 2011. Roles of arbuscular mycorrhizas in plant phosphorus nutrition: interactions between pathways of phosphorus uptake in arbuscular mycorrhizal roots have important implications for understanding and manipulating plant phosphorus acquisition. Plant Physiology 156: 1050-1057.
25 Srivastava LM. 2002. Plant Growth and Development, Hormone and Enviroment.
San Diego, California, USA: Academic Press.
Srivastava NK, Srivastava DK, Singh P. 2012. A preliminary survey of the vesicular arbuscular mycorrhizal status of vegetable and fruit yielding plants in Eastern U.P. Indian Journal of Land & Sciences 1(2): 79-82.
Taiz L, Zeiger E. 2010. Plant Physiology. Ed ke-5. Sunderland, Massachusetts, USA: Sinauer Associates, Inc.
Tufenkci S, Demir S, Sensoy S, Unsal H, Demirer E, Erdinc C, Bicer S, Ekincialp A. 2012. The effects of arbuscular mycorrhizal fungi on the seedling growth of four hybrid cucumber (Cucumis sativus L.) cultivars. Turkish Journal of Agriculture & Forestry 36: 317-327.
Wahb-Allah M, Abdel-Razzak H, Alsadon A, Ibrahim A. 2014. Growth, yield, fruit quality and water use efficiency of tomato under arbuscular mycorrhizal inoculation and irrigation level treatments. Life Science Journal
11(2): 109-117.
Walter MH, Floss DS, Strack D. 2010. Apocarotenoids: hormones, mycorrhizal metabolites and aroma volatiles. Planta 232: 1-17.
Wright DP, Read DJ, Scholes JD. 1998a. Mycorrhizal sink strength influences whole plant carbon balance of Trifolium repens L. Plant, Cell and
Environment 21: 881-891.
Wright DP, Scholes JD, Read DJ. 1998b. Effects of VA mycorrhizal colonization on photosynthesis and biomass production of Trifolium repens L. Plant,
27