LAMPIRAN 1
DATA HASIL PENELITIAN
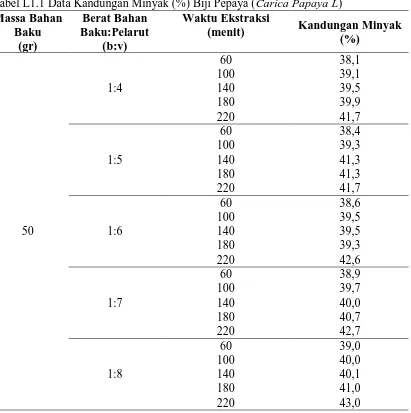
L1.1 DATA KANDUNGAN MINYAK (%) BIJI PEPAYA (Carica Papaya L)
Tabel L1.1 Data Kandungan Minyak (%) Biji Pepaya (Carica Papaya L) Massa Bahan Baku (gr) Berat Bahan Baku:Pelarut (b:v) Waktu Ekstraksi
(menit) Kandungan Minyak (%)
50
1:4
60 38,1
100 39,1
140 39,5
180 39,9
220 41,7
1:5
60 38,4
100 39,3
140 41,3
180 41,3
220 41,7
1:6
60 38,6
100 39,5
140 39,5
180 39,3
220 42,6
1:7
60 38,9
100 39,7
140 40,0
180 40,7
220 42,7
1:8
60 39,0
100 40,0
140 40,1
180 41,0
L1.2 DATA SPESIFIK GRAVITI (S.G) MINYAK BIJI PEPAYA (Carica
Papaya L)
Tabel L1.2 Data Spesifik Graviti (S.G) Minyak Biji Pepaya (Carica Papaya L) Massa Bahan Baku (gr) Berat Bahan Baku:Pelarut (b:v) Waktu Ekstraksi (menit) SPESIFIK GRAVITI (S.G) 50 1:4
60 0,8364
100 0,8434
140 0,8586
180 0,8364
220 0,8596
1:5
60 0,8505
100 0,8578
140 0,8939
180 0,8434
220 0,8566
1:6
60 0,8566
100 0,8596
140 0,8646
180 0,8626
220 0,8596
1:7
60 0,8566
100 0,8869
140 0,8404
180 0,8444
220 0,8444
1:8
60 0,8586
100 0,8505
140 0,8737
180 0,8525
L1.3 DATA DENSITAS MINYAK BIJI PEPAYA (Carica Papaya L)
Tabel L1.3 Data Densitas Minyak Biji Pepaya (Carica Papaya L) Massa Bahan Baku (gr) Berat Bahan Baku:Pelarut (b:v) Waktu Ekstraksi
(menit) DENSITAS
50
1:4
60 0,828
100 0,835
140 0,850
180 0,828
220 0,831
1:5
60 0,842
100 0,849
140 0,885
180 0,835
220 0,848
1:6
60 0,848
100 0,851
140 0,856
180 0,854
220 0,851
1:7
60 0,848
100 0,878
140 0,852
180 0,836
220 0,836
1:8
60 0,850
100 0,842
140 0,865
180 0,844
L1.4 DATA KADAR FREE FATTY ACID MINYAK BIJI PEPAYA (Carica
Papaya L)
Tabel L1.4 Data Kadar Free Fatty Acid Minyak Biji Pepaya (Carica Papaya L) Massa Bahan Baku (gr) Berat Bahan Baku:Pelarut (b:v) Waktu Ekstraksi (menit) KADAR FREE FATTY ACID (FFA) 50 1:4
60 5,6421
100 5,7432
140 5,4455
180 5,5000
220 5.6560
1:5
60 5,6425
100 5,7434
140 5,4453
180 5,5002
220 5.6561
1:6
60 5,6421
100 5,7432
140 5,4455
180 5,5003
220 5.6563
1:7
60 5,6424
100 5,7433
140 5,4450
180 5,5005
220 5.6560
1:8
60 5,6423
100 5,7430
140 5,4452
180 5,5001
L1.5 DATA HASIL ANALIASA BILANGAN IODINE MINYAK BIJI PEPAYA (Carica Papaya L)
Tabel L1.5 Data Hasil Analiasa Bilangan Iodine Minyak Biji Pepaya (Carica
Papaya L)
Run Waktu Ekstraksi (menit)
Perbandingan Biji Pepaya:Pelarut (w/v)
Bilangan Iodine Hasil Analisa (mg/gr)
5 220 1:4 16,03
10 220 1:5 12,15
15 220 1:6 15,62
20 220 1:7 16,91
Densitas air = W1 – W0 V0
(26,1 – 16,2) gram 10 mL
LAMPIRAN 2
CONTOH PERHITUNGAN
L2.1 CONTOH PERHITUNGAN KANDUNGAN (%) MINYAK BIJI PEPAYA (Carica Papaya L.)
Massa Sampel Biji pepaya : 50 gram Volume Minyak yang diekstrak : 25 mL
Densitas minyak : 0,851 gram/cm3
Kandungan Minyak (%) =
x 100%
= 25 x 0,851
50
x
100= 43%
L2.2 CONTOH PERHITUNGAN SPESIFIK GRAVITI (S.G) MINYAK BIJI PEPAYA (Carica Papaya L.)
Pengukuran Densitas Air:
Berat Piknometer Kosong = 16,62 gram Berat Piknometer + Air = 26,1 gram
Volume Air = 10 mL
=
= 0,99 gram/mL = 0,99 gram/cm3
Pengukuran Densitas Minyak Biji pepaya:
Densitas minyak = W1– W0 V0
(23,7-15,56) gram 10 mL
Spesifik Graviti (S.V) = DensitasmMinyak Densitas Air 0,828 gram/cm3 0,99 gram/cm3
%FFA =
=
= 0,828 gram/mL = 0,828 gram/cm3
Pengukuran Spesifik Graviti:
Densitas Air = 0,99 gram/cm3
Densitas Minyak = 0,828 gram/cm3
=
= 0,8393
L2.3 CONTOH PERHITUNGAN KADAR FREE FATTY ACID MINYAK BIJI PEPAYA (Carica Papaya L.)
Volume NaOH = 4 mL
N (Molaritas NaOH) = 0,1 M
W (Berat sampel) = 2 gram
=
= 5,6401 %
L2.4 CONTOH PERHITUNGAN BILANGAN IODINE MINYAK BIJI PEPAYA (Carica Papaya L.)
V1 (Volume Titrasi Blanko) = 21,2 mL V2 (Volume Natrium Thiosulfat) = 17,3 mL C (Normalitas Natrium Thiosulfat) = 0,1795 N
4 x N x 282 W
x 100 % 1,2 x 0,1 x 282
1000 x 2
Iodine value = 12.69 C (V1-V2)
m
Iodine value =
12.69 x 0,1795(21,2-17,3) 0,4168
Iodine value = 16,91 mg/gram
Peroxide value = (S-B) x N x 1000
W
Peroxide value = (tres-0,05) x 0,1795 x 1000
0,1041
Peroxide value = 0 meq/kg
M (Berat sampel) = 0,4535 gram
L2.5 CONTOH PERHITUNGAN BILANGAN PEROKSIDA MINYAK BIJI PEPAYA (Carica Papaya L.)
(a) (b) (c)
(a) (b)
LAMPIRAN 3
FOTO HASIL PENELITIAN
L3.1 Foto Persiapan Bahan Baku Biji Pepaya
Gambar L3.1 (a) Biji Pepaya kering matahari dan Biji Pepaya basah; (b) Serbuk Biji Pepaya; (c) Sampel Biji Pepaya ukuran 50 mesh, 50 gram
L3. 2 Foto Perlakuan Ekstraksi Biji Pepaya
L3.3 Foto Ekstrak Minyak Biji Pepaya
Gambar L3.3 Ekstrak Minyak Biji Pepaya
L3.4 Foto Analisa Kadar Free Fatty Acid Ekstrak Minyak Biji Pepaya
(a) (b)
L3.5 Foto Analisa Densitas Dan Spesifik Graffiti (SG) Ekstrak Minyak Biji Pepaya
Gambar L3.5 Analisa Densitas Dan Spesifik Graffiti (SG) Ekstrak Minyak Biji Pepaya
L3.6 FOTO ANALISA BILANGAN IODINE
(a) (b) L3.7 FOTO ANALISA BILANGAN PEROKSIDA
LAMPIRAN 4
HASIL KROMATOGRAM ANALISIS GC/MS (Gas
Chromatography Mass Spectrometry)
L4.1 HASIL KROMATOGRAM ANALISA GC-MS PADA 1:8, 220 MENIT
L4.2 HASIL KROMATOGRAM ANALISA GC-MS PADA 1:4, 220 MENIT
L4.3 HASIL KROMATOGRAM ANALISA GC-MS PADA 1:5, 220 MENIT
L4.4 HASIL KROMATOGRAM ANALISA GC-MS PADA 1:6, 220 MENIT
L4.5 HASIL KROMATOGRAM ANALISA GC-MS PADA 1:7, 220 MENIT
DAFTAR PUSTAKA
[1] Abdalla, Rehab Salih Mahmoud, Alsheikh AlGilani Albasheer, Abdel Rahim Mohamed El Hussein and Elrasheed Ahmed Gadkariem. 2012. Physico-Chemical
Characteristic of Date Seed Oil Grown in Sudan. American Journal of Applied
Science 9 (7): 993-999.
[2] Akpabio, U. D. 2012. Evaluation of Proximate Composition, Mineral Element
and Anti-nutrient in Almond (Terminalia catappa) Seeds. Advances in Applied
Science Research, 3(4):2247-2252 .
[3] Banat, F, Pal, P, Jwaied, N , Al-Rabadi, A. 2013, Extraction of Olive Oil from Olive Cake using Soxhlet Apparatus, American Journal of Oil and Chemical Technologies; Volume 1, Issue 4, pp 2326-6570
[4] Castro Luque de M.D, F. Priego-Capote. 2010.”Soxhlet Extraction Versus Accelerated Solvent Extraction”. Comprehensive Sampling and Sample Preparation,
vol: 1217, pp: 2383–2389
[5] Couper R James; W. Roy Penney; James R. Fair; Stanley M. Walas. 2012.”Chemical Process Equipment”. Third Edition, 487-528. McGraw-Hill Book Company. New York.
[6] Danlami, Jibrin Mohammed, Agus Arsad, Muhammad Abbas Ahmad Zaini. 2014. Characterization and Process Optimization of Castor Oil (Ricinus communis
L.) Extracted by the Soxhlet Method Using Polar and Non-Polar Solvents. Journal of
The Taiwan Institute of Chemical Engineers, 2014.10.012
[7] Dasari Swaroopa Rani and Vaibhav V Goud. 2013.”Comparative Extraction of
Castor seed Oil Using Polar and Non polar Solvents”. International Journal of Current Engineering and Technology, Special Issue1. ISSN: 2277-4106; India
[8] DOW 2002. n-Butyl Ester. Trademark of The Dow Chemical Company. Danbury, Connecticut 06817 U.S.A.
[9] DOW 2014. n-Butyl Ester. Trademark of The Dow Chemical Company. Danbury, Connecticut 06817 U.S.A.
[10] Duduyemi, Oladejo, Adebanjo S.A and Oluoti Kehinde. 2013. Extraction and
Determination of Physico-Chemical Properties of Watermelon Seed Oil (Citrullus lanatus L) for Relevant Uses. International Journal of Scientific & Technology
Research, Volume 2, Issues 8, Page: 66-68.
[12] Engdahl Löfström Elin -, Emma Aneheim, Christian Ekberg, Mark Foreman, and Gunnar Skarnemark. 2010.” Diluent effects in solvent extraction”. Industrial
Materials Recycling1 and Nuclear Chemistry, SE-41296 Gothenburg, Sweden. [13] Food and Drug Administration (2012). Guidance for Industry Q3C — Tables and List. U.S.A Department of Health and Human Services Food and Drug
Administration Center for Drug Evaluation and Research (CDER) Center for Biologics Evaluation and Research (CBER). Revision 2 McGraw-Hill Book Company. New York.
[14] Food-Science And Techniques.,1981. Food-Science And Techniques. Report of the scientific committee for food on extraction solvents. Eleventh Seris McGraw-Hill Book Company. New York.
[15] Gafar, M. K., A. U. Itodo, A. Warra and L. Abdullahi. 2012. Extraction and
Physicochemical Determination of Garlic (Allium sativum L) Oil. International
Journal of Food and Nutrition Science, Volume I, No. 2, Page 4-7.
[16] Gerd Brunner.2014.”Hydrothermal And Supercritical Water Process”. Hydrothermal and Supercritical Water Processes, 323-360. McGraw-Hill Book Company. New York.
[17] Hamidu, Abubakar Ahmed, BA Aliyu, Edmond Moses. 2011. Extraction,
Proximate Analysis and Elemental Composition of Guna (Citrillus Vulgaris).
Research Journal of Pharmaceutical, Biological and Chemical. Volume 2, Issue 4, Page No. 1047.
[18] I.S Afolabi, and Ofobrukweta, K. 2011.” Physicochemical and nutritional
qualities of Carica papaya seed products”. Journal of Medicinal Plants Research Vol. Vol. 5(14), pp. 3113-3117.
[19] Kittiphoom, S. and Sutasinee, S. 2013. Mango seed Kernel Oil and Its
Physicochemical Properties. International Journal Food Research Journal 20(3):
1145:1149.
[20] Kyari, M. Z. 2008. Extraction and Characterization of Seed Oil. International Agrophysics, 2008, 22, 139-142.
[21] Kumar Popuri Ashok, and Pagala Bangaraiah. 2013.”Extraction Of Curcumin From Turmeric Root”. International Journal Of Innovative Research And Studies.
Vol: 2 (issu 5), pp: 290-299
[22] Krishna K L, M Paridhavi, and Jagruti A Patel. 2008.”Review on nutritional, medicinal and pharmacological properties of Papaya (Carica papaya Linn.). Natural
[23] Lee Wei-Ju, Min-Hsiung Lee, and Nan-Wei Su. 2011.”Characteristics of
papaya seed oils obtained by extrusion–expelling processes”. J Sci Food Agric; 91: 2348–2354.
[24] Malacrida Roberta Cassia., Kimura Mieko.,dan Jorge Neuza. 2010. “Characterization of a high oleic oil extracted from papaya (Carica papaya L.) seeds”. Department of Food Engineering and Technology, São Paulo State University – UNESP. Vol: 31(4), pp : 929-934,
[25] Milind Parle and Gurditta. 2011.”Basketful Benefits Of Papaya”. International Research Journal Of Pharmacy, vol 2(7), pp : 6-12
[26] Masoudkazemi and Abolfazle Dadkhah. 2012. Antioxidant Activity of Date Seed
Oils of Fifteen Varieties from Iran. Oriental Journal of Chemistry, Vol. 28, No (3):
1201-1205.
[27] Moldoveanu, Serban and David, Victor. 2015. Modern Sample Preparation for
Chromatoghraphy: Chapter 6 Solvent Extraction. Elsevier; New York.
[28] Nayak, B. S. and K. N. Patel. 2010. Physicochemical Characterization of Seed
and Seed Oil of Jatropha curca L., Collected from Bardoli (South Gujarat). Sains
Malaysiana 39(6)(2010): 951-955.
[29] Perry, R.H., Green, D,. 2008. “Chemical Engineering HandBook”. 8thEd.
McGraw-Hill Book Company. New York.
[30] Richardson J F, Backhurst J R, and Harker J H. 2002.” Particle Technology and Separation Processes”. Volume 2 Fifth Edition, University of Wales Swansea. Butterworth Heinemann; New York.
[31] Samarama Shadi, Hamed Mirhosseinia, Chin Ping Tana, Hasanah Mohd Ghazali. 2014. “Ultrasound-assisted extraction and solvent extraction of papaya seedoil: Crystallization and thermal behavior, saturation degree, color andoxidative stability”. Industrial Crops and Products 52, 702– 708.
[32] Syed H.M., Kunte S.P., Jadhav B.A., dan Salver R.V. 2012.“Extraction End Charactization Of Papaya Seed Oil”. International Journal Of Applied, Physical And Bio-Chemistry Research Vol.2, pp: 33-43.
[33] Todd, David B. 2014. Chapter 11: Solvent Extraction. Fermentation and Biochemical Engineering Handbook, first edition, Elsevier B. V. All rights reserved; Oxford, United Kingdom.
[34] Turk, Michael. 2014. Supercritical Fluid Science and Technology, Volume 6,
Particle with Supercritical Fluids: Chapter 6: Extraction Process. Institute for
[35] Walas, Stanley M., 2005, “Chemical Proses Equipment”, Departement of
Chemical and Petroleum Engineering, University of Kansas, USA.
[36] Wang, Lijun and Weller, Curtis L. 2006. Recent advances in Extraction of
Nutraceuticals from Plants. Trends in Food Science & Technology 17 (2006)
300-312.
[37] Wilfred, S., J. Adubofour and J. H. Oldham. 2010. Optimum Conditions for
Expression of Oil from Allanblackia floribunda Seeds and Assessing the Quality and Stability of Pressed and Solvent Extracted Oil. African Journal of Food Science, Vol.
4(9), pp. 563-570.
[38] Zhou Kaibing, Hui Wang, Wenli Mei, Xiaona Li, Ying Luo, and Haofu Dai. 2011. “Antioxidant Activity of Papaya Seed Extracts”. Molecules,vol: 16, pp: 6179-6192.
[39] Zygler A, M Słomińska, and J Namieśnik. 2012.”Soxhlet Extraction and New Developments Such as Soxtec”.Comprehensive Sampling and Sample Preparation, Vol: 2, pp:n 65-82.
[40] Besbes, S., C. Blecker, C. Deroanne, G. Lognay, N. E. Drira, H. Attia. 2004.
Quality Characteristics and Oxidative Stability of Date Seed Oil During Storage.
Food Sci Tech Int. Vol.10, No.5:333-338.
[41] Lieber, Mary Ann. 1987. Final Report on the Safety Assessment of Oleic Acid,
Lauric Acid, Palmitic Acid, Myristic Acid, and Stearic Acid. Journal of the American
College of Toxicology Vol. 6, No.3.
[42] Abdalla, Ibrahim Hassan., M. Khaddor, A. Boussab, D. El Garrouj and B. Souhial. Physical Chemical Characteristics of Olive Oils from Cooperatives for
Olive Growers in the North of Morocco. International Journal of Basic & Applied
Sciences, Vol:14 No:02.
[43 ] Miller, Dr. Matt. Plant & Food Research. New Zealand.
[44] Semb, Thea Norveel. Analitycal Methods for Determination of the Oxidative
Status in Oils. Norwegian University of Science and Technology.
[45] Al Badr, Nawal-A, Shaista Arzoo, Zubaida Abdel Nabi Bakeet. 2014.
Characteristics and Fatty Acid Composition of Commonly Consumed Cooking Oil Marketed Locally in Riyadh-City. International Journal of Biosciencies Vol.4, No.9,
p. 227-238.
[46] Al-Shahib, Walid and Marshall, Richard J. 2003. The Fruit of the date palm: its
possible use as the best food for the future?. International Journal of Food Sciences
[47] Aluyor, E.O, P. Aluyor and C.E Ozigagu. 2009. Effect of Refining on the Quality and Composition of Groundnut Oil. African Journal of Food Science Vol. 3(8), pp: 201-205.
[48] B.A. Adejum0., Alakowe, A.T and Obi, D.E. 2013. Effect of Heat Treatment on
the Characteristics and Oil Yield of Moringa Oleifera Seeds. The International
Journal of Engineering and Science, Volume 2, Issue 01, Pages:232-239.
[49] Siddique, B. M., Ahmad, A., Ibrahim, M. H., Hena, S., Rafatullah, M. and Mohd Omar, A. K. “Physicochemical Properties of Blends of Palm Olein with Other Vegetable Oils”. Journal of Grasas Y Aceites 61 (4): 423-429. 2010.
[50] Herchi, Wahid, Habib Kallel, Sadok Boukhchina. “Physicochemical Properties and Antioxidant Activity of Tunisian Date Palm (Phoenix dactylifera L.) oils as Affected by Different Extraction Method”. Food Sciences and Technology,
34(3): 464-470. 2014.
[51] Wildan, A, D. Ingrid A., I. Hartati, Widayat. “Oprimasi Pengambilan Minyak dari Limbah Padat Biji Karet dengan Metode Sokhletasi”. Momentum, Vol. 8, No. 2:
52-56. 2012.
.[52] Zafar, Fahmina., Syed Marghob Ashraff dan Sharif Ahmad. “Self-Cured Polymers from Non-Drying Oil”. Chemistry & Chemical Technology, Vol. 2, No.4.
2008.
[53] Amira, P. Olaniyi, O.O. Babalola and Oyediran A. Mary. “Physicochemical Properties of Palm Kernel Oil”. Current Research Journal of Biological Sciences
6(5): 205-207. 2014.
[54] El-Kheir, Murwan K. Sabah., AbdelSalam A. Alamin, H. N. Sulafa and A. K. Sabir Ali. “Composition and Quality of Six Refined Edible Oils in Khartoum State, Sudan”. ARPN Journal of Science and Technology, Vol.2, No.3. 2012.
BAB III
METODE PENELITIAN
3.1 BAHAN DAN PERALATAN 3.1.1 Bahan Penelitian
1. Biji Buah Pepaya
2. n-Butyl-Asetat (C6H12O2) 3. Kalium Hidroksida (KOH) 4. Phenolphthalein (C20H14O4) 5. Asam Klorida (HCl)
6. Klorofom (CHCl3)
7. Asam Asetat (CH3COOH)
8. Kalium Iodida (KI) 9. Indikator Starch
10.Natrium Thiosulfat (Na2S2O3) 11.Aquadest (H2O)
12.Reagent Dam (C9H27F2Si1S1N3) 13.Natrium Hidroksida (NaOH) 14.Etanol (C2H5OH)
15.Karbon Tetraklorida (CCl4)
3.1.2 Peralatan
3.1.2.1 Peralatan Penelitian
1. Beaker Glass
2. Gelas Ukur
3. Erlenmeyer
4. Pipet Tetes
5. Oven
6. Ball Mill
9. Freezer
10.Corong gelas 11.Timbangan elektrik 12.Statif dan klem 13.Batang pengaduk 3.1.2.2 Peralatan Analisa
1. Erlenmeyer 2. Corong gelas 3. Gelas ukur 4. Pipet tetes 5. Buret
6. Statif dan klem 7. Water bath
3.1.2.3 Peralatan Utama
1. Kondensor : berfungsi sebagai pendingin, dan juga untuk mempercepat proses pengembunan.
2. Timbal : berfungsi sebagai wadah untuk sampel yang ingin diambil zatnya. 3. Pipa F : berfungsi sebagai jalannya uap, bagi pelarut yang menguap dari proses
penguapan.
4. Bypass sidearm merupakan bagian dari seperangkat alat ekstraktor Soxhlet yang berfungsi sebagai penghubung labu pemanas dengan thimble yang tembus langsung ke atas dengan kondensor, sehingga uap air dapat naik dari labu pemanas menuju kondensor.
5. Sifon : berfungsi sebagai perhitungan siklus, bila pada sifon larutannya penuh kemudian jatuh ke labu alas bulat maka hal ini dinamakan 1 siklus
3.2 Rancangan Penelitian Tabel 3.1 Rancangan Penelitian
Run Waktu Ekstaksi (menit)
Bahan:Pelarut b:v
1 60 1:4
2 100 1:5
3 140 1:6
4 180 1:7
5 220 1:8
6 60 1:5
7 100 1:6
8 140 1:7
9 180 1:8
10 220 1:4
11 60 1:6
12 100 1:7
13 140 1:8
14 180 1:4
15 220 1:5
16 60 1:7
17 100 1:8
18 140 1:4
19 180 1:5
20 220 1:6
21 60 1:8
22 100 1:4
23 140 1:5
24 180 1:6
25 220 1:7
3.3 Prosedur Penelitian
3.3.1 Prosedur Pembuatan Serbuk Biji Pepaya 1. Sampel dicuci sebelum dilakukan pengeringan
2. Sampel biji pepaya dikeringkan dalam oven 45 0C selama 12 jam.
3. Setelah dikeringkan, sampel dihaluskan mengunakan ball mill bola beasar [26]
3.3.2. Prosedur Ekstraksi Minyak Biji Pepaya
Ekstraksi minyak biji pepaya dilakukan dalam peralatan soxhlet menggunakan pelarut n-butil asetat (titik didih 126 0C) dengan variasi bahan:pelarut 1:4, 1:5, 1:6, 1:7, dan 1:8 [26], selama 60 menit, 100 menit, 140 menit, 180 menit, dan 220 menit dengan massa sampel 50 gram.
Prosedur ekstraksi minyak biji papaya dilakukan dengan langkah-langkah sebagai berikut :
1. Sampel yang telah halus dimasukkan sebanyak 50 gram di dalam suatu thimble yang terdapat di tengah bagian dari peralatan soxhlet.
2. Pelarut n-butil asetat digunakan untuk proses ekstraksi dimasukkan ke dalam labu alas bulat [27] dengan variasi bahan:pelarut (1:4, 1:5, 1:6, 1:7, dan 1:8). 3. Minyak biji pepaya diekstraksi dengan peralatan soxhlet selama (60 menit, 100
menit, 140 menit, 180 menit, dan 220)
4. Pelarut n-butil asetat didistilasi dari labu alas bulat dengan menggunakan hot
plate [27]. Ekstrak minyak disaring dengan kertas saring Whatman No. 1 untuk
menghilangkan partikel-partikel asing [28].
5. Labu alas bulat yang mengandung ekstrak minyak dikeringkan pada 30-400C selama 30 menit [17].
6. Pelarut dipulihkan dari campuran minyak dengan cara evaporasi di bawah temperatur titik didih pada 120 0C [15] )
7. Ekstrak minyak disimpan di dalam freezer untuk selanjutnya dianalisa [15]
3.3.3 Prosedur Analisis
3.3.3.1 Prosedur Penentuan Kandungan Minyak (%)
Prosedur penentuan kandungan minyak (%) dilakukan dengan langkah-langkah sebagai berikut [15]
1. Berat sampel ditimbang sebanyak 50 gram, setelah itu dilakukan ekstraksi sehingga mendapatkan minyak yang diinginkan
2. Minyak yang telah didapatkan selanjutnya di pulihkan melalui destilasi pada hot
(3.1)
Densitas air = W1– W0 V0
(3.2) 3. Minyak yang telah dipulihkan melalui destilasi pada hot plate dimasukkan ke
dalam silinder pengukuran.
4. Silinder pengukuran kemudian ditempatkan pada water bath selama 2-3 jam untuk proses evaporasi pelarut yang sempurna.
5. Volume minyak dicatat.
6. Kandungan minyak dihitung dengan persamaan:
Kandungan Minyak (%) =
x 100%
3.3.3.2 Prosedur Penentuan Spesific Gravity
Prosedur penentuan spesific gravity dilakukan dengan langkah-langkah sebagai berikut [15]:
1. Berat silinder ditimbang untuk pengukuran yang akan digunakan 2. Berat silinder ditimbang pengukuran + air
3. volume air yang digunakan diukur 4. Diperoleh densitas air dengan persamaan:
Dimana: W1 = berat silinder pengukuran + air W0 = berat silinder pengukuran V0 = volume air yang digunakan
5. Berat silinder ditimbang untuk pengukuran yang akan digunakan 6. Berat silinder ditimbang untuk pengukuran + minyak
Densitas minyak = W1 – W0 V0
(3.3)
Densitas minyak yandigunakan Densitas air
(3.4) Dimana: W1 = berat silinder pengukuran + minyak
W0 = berat silinder pengukuran V0 = volume minyak yang digunakan
9. Setelah densitas air dan densitas minyak diketahui, spesific gravity dapat dihitng dengan persamaan:
Sehingga spesific gravity =
3.3.3.3 Prosedur Penentuan Bilangan Peroksida
Bilangan peroksida adalah indikasi dari kestabilan minyak [19], memiliki suatu sifat yang penting dalam penentuan ketengikan minyak [17]. Pada umumnya, bilangan peroksida harus lebih kecil dari 10 mg/g minyak dalam minyak segar. Minyak dengan bilangan peroksida yang tinggi tidak stabil dan dengan mudah menjadi tengik [19], sedangkan minyak dengan bilangan peroksida yang rendah mengindikasikan bahwa minyak dapat disimpan pada periode waktu yang sangat lama [15].
Prosedur penentuan bilangan peroksida dilakukan dengan langkah-langkah sebagai berikut:
1. Dua gram ekstrak minyak dicampurkan ke dalam 22 mL campuran dari 12 mL klorofom dan 10 ml asam asetat pada labu [15].
2. Satu gram kalium iodida ditambahkan ke campuran di dalam labu [20] 3. Campuran dipanaskan selama 1 menit [20].
4. Air distilat 30 mL ditambahkan ke dalam campuran [15]
5. Campuran yang panas dituangkan ke dalam labu lain yang mengandung 20 mL dari 5 % kalium iodida [20].
6. Na2SO3 0.1 M diitrasi sampai warna kuning hampir hilang [20]
Peroxide value = (S-B) x N x 1000
W 9. Bilangan peroksida dihitung dengan persamaan:
Dimana : S = volume titran dari sampel (ml) B = volume titran untuk blanko (ml) N = molaritas larutan Na2SO3 1000 = unit konversi (g/kg)
W = berat sampel minyak
3.3.3.4 Prosedur Penentuan Bilangan Iodin (I.V.)
Bilangan iodin (I.V.) dari lemak dan minyak adalah sifat yang penting untuk menentukan derajat kejenuhan. Minyak diklasifikasikan ke dalam tiga kelompok berdasarkan I.V., minyak diklasifikasikan sebagai non-drying jika I.V. lebih kecil dari 100, semi-drying jika I.V. berada diantara 100 dan 130, atau sebagai drying jika I.V. berada diantara 130-200 [37].
Prosedur penentuan bilangan iodin dilakukan dengan langkah-langkah sebagai berikut [20]:
1. 0.4 gram sampel minyak ditimbang
2. 20 ml karbon tetraklorida ditambahkan untuk melarutkan sampel minyak. 3. 25 mL reagent Dam ditambahkan ke dalam labu menggunakan pipet yang aman 4. Suatu stopper dimasukkan dan kandungan di dalam labu diaduk.
5. Labu ditempatkan di tempat yang gelap selama 2 jam 30 menit.
6. Larutan 20 mL dari 10% kalium iodida dan 125 mL air ditambahkan dengan menggunakan silinder pengukuran.
7. Campuran dititrasi dengan 0.1 M larutan natrium thiosulfat hingga warna kuning hampir menghilang.
8. Beberapa tetes 1 % indikator starch ditambahkan
9. Titrasi dilakukan secara kontinu dengan menambahkan tetesan thiosulfat hingga warna biru menghilang setelah pengadukan.
10. Dilakukan titrasi blanko
11. Dihitung bilangan iodin dengan persamaan:
Iodine value = 12.69 C (V1-V2)
m
Dimana : C = konsentrasi natrium thiosulfat yang digunakan
V1 = volume natrium thiosulfat yang digunakan untuk titrasi blanko V2 = volume natrium thiosulfat yang digunakan untuk penentuan m = berat sampel
3.3.3.5 Prosedur Penentuan Kadar Asam Lemak Bebas (Free Fatty Acid)
Prosedur penentuan asam lemak bebas (free fatty acid) dilakukan dengan langkah-langkah sebagai berikut [15]:
1. Sampel minyak sebanyak 2 gram ditimbang.
2. Minyak yang telah ditimbang, dimasukkan ke dalam erlenmeyer 250 mL.
3. Etanol 100 mL ditambahkan, diikuti dengan penambahan 2 mL indikator
phenolpthalein
4. Campuran diaduk dan dititrasi dengan 0,1 M NaOH sambil terus diaduk hingga titik akhir dicapai, yang ditandai dengan warna pink selama 30 detik.
5. Kadar asam lemak bebas dihitung dengan persamaan:
x100 W
VxNx282 %FFA
Dimana: %FFA = kadar asam lemak bebas (g/100g) V = volume NaOH (mL)
N = molaritas NaOH
282 = berat molekul asam oleat W = berat sampel minyak
3.3.3.6 Prosedur Penentuan Asam Lemak dengan Gas Chromatography-Mass (GC-MS)
Prosedur penentuan asam lemak dengan Gas Chromatography-Mass (GS-MS)langkah-langkah sebagai berikut [1]:
1. Suhu kolom dijaga konstan pada 500C selama 5 menit
2. Peralatan diprogram pada 70C/menit sampai 3000C selama 5 menit
(3.6)
3. Gas Helium dialirkan dengan laju alir 1,0 mL/menit
4. Injektor dan detektor diatur pada suhu 2500C, alur perpindahan pada 2800C 5. Sampel yang tersaring diinjeksikan pada rasio split 1:50
6. Beberapa asam lemak metil ester pada minyak dalam biji discan dengan No. 397: 155(34), 143(57), 111(52), 87(74), 83(44), 74(100), 55(50), 43(36)
3.4 FLOWCHART PENELITIAN
3.4.1 Flowchart Pembuatan Serbuk Biji Pepaya
Sampel biji pepaya dikeringkan dalam oven 450C selama 12 jam
Setelah benar-benar kering, sampel di haluskan menggunakan ball mill bola besar
Sampel diayak dengan menggunakan ayakan 50
Mesh hingga diperoleh serbuk biji pepaya
[image:31.595.153.473.255.591.2]Selesai
Pelarut n-butil asetat didistilasi dari labu alas bulat dengan menggunakan
suatu peralatan panas umum laboratorium yaitu hot plate
3.4.2 Flowchart Prosedur Ekstraksi Minyak Biji Pepaya
Mulai
Dirangkai peralatan ekstraksi sokhlet
Sampel yang telah halus dimasukkan sebanyak 50 gram di dalam suatu thimble yang terdapat di
tengah bagian dari peralatan sokhlet.
Pelarut etil asetat dimasukkan ke dalam labu alas bulat dengan bahan:pelarut (1:4)
Ekstrak minyak disaringdengan kertas saring whatman no. 1 untuk menghilangkan partikulat
Minyak biji pepaya diekstraksi dengan peralatan sokhlet selama 60 menit
Estrak minyak disimpan ke dalam freezer untuk selanjutnya dianalisa
Labu alas bulat yang mengandung ekstrak minyak dikeringkan pada 30-400C selama 30 menit Pelarut dipulihkan dari campuran minyak dengan cara
evaporasi di bawah temperatur titik didih pada 1200C
Tidak
Gambar 3.3 Flowchart Prosedur Ekstraksi Minyak Biji pepaya Selesai
Apakah masih ada variasi lain?
Ya
Tidak
[image:34.595.130.512.105.598.2]3.4.3 Flowchart Prosedur Penentuan Kandungan Minyak (%)
Gambar 3.4 Flowchart Prosedur Penentuan Kandungan Minyak (%) Selesai
Minyak yang telah didapatkan selanjutnya di pulihkan melalui destilasi pada hot plate
Berat sampel ditimbang sebanyak 30 gram, setelah itu dilakukan ekstraksi sehingga mendapatkan minyak yang diinginkan
Mulai
Minyak yang telah dipulihkan melalui destilasi pada hot plate dimasukkan ke dalam silinder pengukuran.
Volume minyak dicatat
Apakah ada ekstrak minyak yang lain?
Ya Silinder pengukuran kemudian ditempatkan pada
water bath selama 2-3 jam untuk proses evaporasi pelarut yang sempurna.
Tidak
[image:35.595.177.537.103.664.2]3.4.4 Flowchart Prosedur Penentuan Spesific Gravity
Gambar 3.5 Flowchart Prosedur Penentuan Spesific Gravity Mulai
Ditimbang berat silinder pengukuran + air Ditimbang berat silinder pengukuran yang
akan digunakan
Diukur volume air yang digunakan
Selesai
Densitas air diperoleh dengan persamaan (3.2)
Apakah ada ekstrak minyak yang lain?
Ya Ditimbang berat silinder pengukuran
yang akan digunakan
Ditimbang berat silinder pengukuran + minyak
Diukur volume minyak yang digunakan
Densitas minyak diperoleh dengan persamaan (3.3)
Setelah densitas air dan densitas minyak diketahui, spesific gravity dapat dihitng dengan
Tidak
3.4.5 Flowchart Prosedur Penentuan Bilangan Peroksida
\
Selesai Mulai
Campuran dipanaskan selama 1 menit 2 gram ekstrak minyak dicampurkan ke dalam 22 mL campuran dari 12 mL klorofom dan 10
ml asam asetat pada labu
1 gram kalium iodida ditambahkan ke campuran di dalam labu
Air distilat 30 mL ditambahkan ke dalam campuran
Campuran yang panas dituangkan ke dalam labu lain yang mengandung 20 mL
dari 5 % kalium iodida
Indikator starch 0.5 mL segera ditambahkan dan titrasi dilanjutkan sampai
warna biru menghilang
Tidak
Tidak
Ya
[image:37.595.174.537.79.361.2]Tidak
Gambar 3.6 Flowchart Prosedur Penentuan Bilangan Peroksida Apakah ada ekstrak
minyak yang lain? A
Dilakukan titrasi blanko
Bilangan peroksida dihitung dengan persamaan (3.5)
Selesai
3.4.6 Flowchart Prosedur Penentuan Bilangan Iodin
\
Mulai
0.4 gram sampel minyak ditimbang
25 mL reagent Dam ditambahkan ke dalam labu menggunakan pipet yang aman 20 ml karbon tetraklorida ditambahkan
untuk melarutkan sampel minyak.
Larutan 20 mL dari 10% kalium iodida dan 125 mL air ditambahkan dengan menggunakan silinder pengukuran.
Campuran dititrasi dengan 0.1 M larutan natrium thiosulfat hingga warna kuning hampir
menghilang.
Ditambahkan beberapa tetes 1 % indikator starch.
Suatu stopper dimasukkan dan kandungan di dalam labu diaduk
A
Tidak Tidak
Ya
[image:39.595.128.549.84.523.2]Ya Tidak Tidak
Gambar 3.7 Flowchart Prosedur Penentuan Bilangan Iodin Apakah ada ekstrak
minyak yang lain? Dilakukan titrasi blanko
Dihitung bilangan iodin dengan persamaan (3.6)
Selesai
B A
Dilakukan titrasi secara kontinu dengan menambahkan tetesan
Tidak
[image:40.595.171.539.141.633.2]3.4.8 Prosedur Penentuan Asam Lemak dengan Gas Chromatography-Mass (GC-MS)
Gambar 3.9 Flowchart Prosedur Penentuan Asam Lemak dengan Gas Chromatography-Mass (GC-MS)
Peralatan diprogram pada 70C/menit sampai
3000C selama 5 menit
Suhu kolom dijaga konstan pada 500C
Selesai Apakah ada ekstrak
minyak yang lain?
Ya Mulai
Gas Helium dialirkan dengan laju alir 1,0 mL/menit
Injektor dan detektor diatur pada suhu
2500C, alur perpindahan pada 2800C
Sampel yang tersaring diinjeksikan pada rasio split 1:50
Beberapa asam lemak metil ester pada minyak dalam biji discan dengan No. 397: 155(34), 143(57), 111(52), 87(74), 83(44),
Intens
it
y
BAB IV
HASIL DAN PEMBAHASAN
4.1 ANALISIS KUALITATIF
4.1.1 Analisis Komposisi Asam Lemak Minyak Biji Pepaya
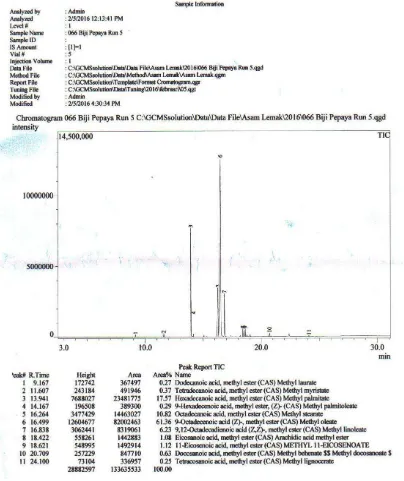
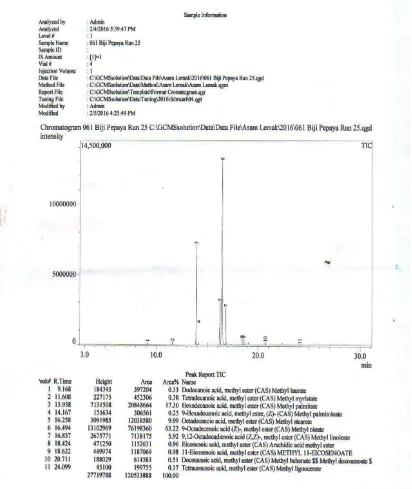
[image:41.595.129.526.290.588.2]Analisis GC-MS (Gas Chromatography Mass Spectrometry) bertujuan untuk mengidentifikasi gugus fungsi dari struktur kimia dalam suatu senyawa, Kromatogram hasil GC-MS ditunjukan pada Gambar 4.1 dan komposisi asam lemak minyak biji pepaya di tunjukan pada Tabel 4.1
Gambar 4.1 Diagram Hasil Kromatogam GC-MS Minyak Biji Pepaya pada Perbandingan 1:7 dan Waktu Ekstrakasi 220 menit
Tabel 4.1 Komposisi Asam Lemak Minyak Biji Pepaya pada Perbandingan 1:7 dan Waktu Ekstraksi 220 Menit
Peak R. Time Area % Nama IUPAC Asam Lemak
1 9,168 0,33 Asam dodekanoat Asam laurat 2 11,608 0,38 Asam tetradekanoat Asam miristat 3 13,938 17,30 Asam heksadekanoat Asam palmitat 4 14,167 0,25 Asam 9- heksadekanoat Asam palmitolit 5 16,258 9,99 Asam oktadekanoat Asam stearat 6 16,494 63,22 Asam 9-Oktadekenoat Asam oleat 7 16, 837 5,92 Asam 9,12-Oktadekadienoat Asam linoleat 8 18,424 0,96 Asam Eikosenoat Asam aristat 9 18,622 0,98 Asam 11-Eikosenoat Asam 11-eikosenoat 10 20,711 0,51 Asam dekasanoat Asam beheneat 11 20,099 0,17 Asam tetrasanoat Asam lignoserat
100,00
[image:42.595.115.526.374.539.2]Rangkuman komposisi asam lemak minyak biji pepaya untuk waktu estraksi 220 menit dan beberapa perbandingan ditunjukan pada Tabel 4.2
Tabel 4.2 Komposisi Asam Lemak Minyak Biji Pepaya pada Perbandingan 1:4, 1:5, 1:6, 1:7, dan 1:8 Untuk Waktu Ekstraksi 220 Menit
Asam Lemak 1:7
220 menit 1:6 220 menit 1:5 220 menit 1:4 220 menit 1:8 220 menit
As laurat 0,33 0.39 1,08 0,15 0,27
As miristat 0,38 0,46 0,70 0,35 0,37
As palmitat 17,30 17,48 17,12 17,36 17,57 As palmitoleat 0,25 0,30 0,28 0,38 0,29 As stearat 9,99 11,28 10,32 11,23 10,82
As oleat 63,22 62,31 61,98 60,29 61,36
As linoleat 5,92 5,33 5,76 6,83 6,36
As aristat 0,96 1,01 1,00 1,17 1,08
As 11-eikosenoat 0,98 0.98 1,04 1,09 1,12
As beheneat 0,51 0,46 0,52 0,86 0,63
As lignoserat 0,17 0,16 0,21 0,28 0,25
Total 100,00 100,0 100,0 100,0 100,0
Tabel 4.3 Asam Lemak Jenuh Dan Tak Jenuh Biji Pepaya
Komponen Asam Lemak 1:7
220 menit 1:6 220 menit 1:5 220 menit 1:4 220 menit 1:8 220 menit Asam Lemak Jenuh
As laurat 0,33 0.39 1,08 0,15 0,27 As miristat 0,38 0,46 0,70 0,35 0,37 As palmitat 17,30 17,48 17,12 17,36 17,57 As stearat 9,99 11,28 10,32 11,23 10,82 As aristat 0,96 1,01 1,00 1,17 1,08 As beheneat 0,51 0,46 0,52 0,86 0,63 As lignoserat 0,17 0,16 0,21 0,28 0,25 Asam
Lemak Tak Jenuh
As palmitoleat 0,25 0,30 0,28 0,38 0,29 As oleat 63,22 62,31 61,98 60,29 61,36 As linoleat 5,92 5,33 5,76 6,83 6,36 As
[image:42.595.108.531.580.755.2]Dari tabel 4.3 komposisi asam lemak minyak biji pepaya yaitu asam oleat tertinggi di antara asam lemak tak jenuh lainnya, sementara asam palmitat tertinggi diantara asam lemak jenuh lainnya di setiap perbandingan biji pepaya:pelarut (w/v) dan waktu ekstraksi(menit). Persentase asam oleat tertinggi diperoleh pada perbandingan biji pepaya:pelarut 1:7 dengan waktu ekstraksi 220 menit yaitu 63,2% diikuti persentase asam oleat 62,13% pada perbandingan biji pepaya:pelarut 1:6 dengan waktu ekstraksi 220 menit (run 25), sedangkan palmitat 17,57% pada perbandingan biji papaya:pelarut 1:8 dengan waktu ekstraksi 220 menit. Kecendrungan yang sama juga di tunjukan pada run-run lainnya.
Hasil yang diperoleh dari penelitian ini sesuai dengan penelitian terdahulu, dimana komposisi meristat (C14-0) 0,24%, palmitat (C16-0) 13,5%, palmitoleat (C16-1) 0,21%, stearat (C18-0) 4,5%, oleat (C18-1) 72,52%, linoleat (C18-2) 2,90%, linoleanat (C18-3) 0,23%, Arakidonat (C20-0) 0,39%, Eikosenoat (C20-1) 0,28% [32]. Asam oleat yang didapat pada minyak biji pepaya dalam penelitian ini lebih rendah jika dibandingkan dengan penelitian yang menggunakan pelarut petroleum ether pada kondisi oprasi 40-60 0C selama 6 jam yang menemukan persentase asam oleat sebesar 71,30% pada biji pepaya [24].
Pada umumnya komposisi asam lemak minyak biji pepaya dapat dipengaruhi oleh perbedaan varietas, kondisi, dan kondisi alam [40]. Asam oleat, asam laurat, asam palmitat, asam miristat dan asam stearat digunakan dalam makanan sebagai
reagent dalam pembuatan penambah kualitas makanan jika seseuai dengan kondisi
4.2 ANALISIS KUANTITATIF
4.2.1 Analisis Kandungan Minyak (%)
4.2.1.1 Pengaruh Waktu Ekstraksi (menit) Terhadap Kandungan Minyak (%) untuk Perbandingan Biji Pepaya Terhadap Pelarut (w/v)
[image:44.595.149.511.257.475.2]Waktu ekstraksi merupakan salah satu variabel yang sangat berpengaruh terhadap kandungan minyak dari biji pepaya yang dihasilkan. Untuk mengamati pengaruh waktu ekstraksi terhadap kandungan minyak yang diperoleh dilakukan variasi terhadap waktu ekstraksi. Hasil ekstraksi ditunjukkan pada Gambar 4.1
Gambar 4.2 Pengaruh Waktu Ekstraksi (menit) terhadap Kandungan Minyak (%) untuk Berbagai Perbandingan Biji Pepaya terhadap Pelarut (w/v)
Gambar 4.2 menunjukkan pada saat perbandingan pelarut terhadap biji pepaya yang tetap dengan peningkatan waktu ekstraksi menyebabkan kandungan minyak meningkat. Hal ini dapat dijelaskan bahwa untuk mendapatkan kandungan minyak yang lebih banyak, diperlukan waktu ekstraksi yang lebih lama pula agar terjadi waktu kontak yang lama antara biji pepaya dengan pelarut yang memberikan kesempatan biji pepaya untuk kontak dengan pelarut sesemakin besar sehingga kandungan minyak dapat diekstrak secara maksimum. Pada waktu ekstraksi yang tetap dengan peningkatan perbandingan pelarut terhadap biji pepaya menyebabkan kandungan minyak meningkat. Hal ini dapat dijelaskan bahwa pelarut harus banyak tersedia selama proses ekstraksi agar dapat memaksimalkan kandungan minyak yang
35 36 37 38 39 40 41 42 43 44
0 60 120 180 240
k an d u n gan m in yak ( % ) t (menit) BP:Pelarut = 1:4
kejenuhan. Untuk waktu ekstraksi 60, 100, 140, 180 dan 220 menit mengalami peningkatan untuk setiap variasi perbandingan biji pepaya terhadap pelarut (w/v) yaitu 1:4, 1:5, 1:7, dan 1:8. Namun pada perbandingan biji pepaya terhadap pelarut (w/v) 1:6 mengalami penurunan yaitu pada menit ke 180 sebesar 39,3%.
Semakin lama waktu ekstraksi maka kandungan minyak yang diperoleh juga sesemakin tinggi. Namun jika kondisi kesetimbangan telah tercapai maka penambahan waktu ekstraksi tidak akan menaikkan kandungan minyak pepaya [7]. Penurunan hasil kandungan minyak biji pepaya yang diperoleh kemungkinan dapat disebabkan oleh beberapa faktor antara lain, selama proses ekstraksi berlangsung pelarut akan terus mengalami siklus penguapan dan pengembunan, siklus yang terjadi pada proses ekstraksi di setiap jamnya sebanyak 10-12 siklus/jam [49].
Pada titik tertentu akan tercapai suatu kesetimbangan dimana laju difusi solut dari permukaan padatan ke pelarut akan sama besar dengan laju difusi solut dari pelarut ke padatan atau terjadi kejenuhan sehingga pelarut yang teruapkan tidak murni lagi dan menyebabkan zat yang ingin diekstrak akan ikut teruapkan dan kembali ke bagian thimble, akan menempel pada kapas sehingga hal ini menyebabkan kandungan minyak akan berkurang [4]. Pada penelitian ini mengalami siklus maksimal terjadi pada menit ke 220 yaitu sebanyak 48 siklus.
37 38 39 40 41 42 43
0 1 2 3 4 5 6 7 8
k and un gan m in yak ( % )
Biji Pepaya:Pelarut (W:V)
t = 60 menit t = 100 menit t = 140 menit t = 180 menit t = 220 menit
4.2.1.2 Pengaruh Perbandingan Biji Pepaya Terhadap Pelarut (w/v) Terhadap Kandungan Minyak (%) Untuk Berbagai Waktu Ekstraksi (menit)
[image:46.595.140.501.242.453.2]Perbandingan padatan terhadap pelarut adalah parameter penting pada proses ekstraksi minyak. Semakin besar perbandingan antara bahan baku dan jumlah pelarut akan meningkatkan kandungan minyak yang dihasilkan seperti yang dapat dilihat pada Gambar 4.3. Kandungan minyak terbesar diperoleh pada perbandingan biji pepaya terhadap pelarut (w/v) 1:8 dengan lama proses ekstraksi 220 menit.
Gambar 4.3 Pengaruh Perbandingan Biji Pepaya terhadap Pelarut (w/v) terhadap Kandungan Minyak untuk Berbagai Waktu Ekstraksi (menit)
Gambar 4.3 menunjukan bahwa terjadi fluktuasi kandungan minyak terhadap perbandingan biji pepaya:pelarut untuk waktu ekstraksi 140 menit, dimana terjadi penurunan kandungan minyak dari 41,3% pada perbandingan biji pepaya:pelarut 1:5, sampai 39,5% pada perbandingan biji pepaya terhadap pelarut 1:6 dan selanjutnya mengalami penaikan menjadi 41% untuk perbandingan biji pepaya terhadap pelarut 1:7 dan 1:8. Begitu juga dengan waktu ekstraksi 180 menit, dimana terjadi penurunan kandungan minyak dari 41,3% pada perbandingan biji pepaya:pelarut 1:5, sampai 39,3% pada perbandingan biji pepaya terhadap pelarut 1:6 dan selanjutnya mengalami penaikan menjadi 41% untuk perbandingan biji pepaya terhadap pelarut 1:7 dan 1:8. Hal tersebut menunjukkan bahwa pada proses ekstraksi selama 140 dan 180 menit untuk perbandingan biji pepaya terhadap pelarut 1:6 dapat disebabkan
oleh beberapa faktor antara lain, selama proses ekstraksi berlangsung pelarut akan terus mengalami siklus penguapan dan pengembunan.
Pada penelitian ini digunakan sejumlah massa sampel biji pepaya yang konstan sebanyak 50 gram untuk semua perbandingan biji pepaya terhadap pelarut (w/v) dan waktu ekstraksi (menit). Maka perbandingan jumlah pelarut dan bahan baku akan meningkatkan kandungan minyak secara signifikan [29]. Jika rasio terlalu kecil maka pelarut tidak dapat mengekstrak bahan secara keseluruhan. Sedangkan rasio yang terlalu besar dapat meningkatkan biaya. Sehingga perlu dipilih rasio yang sesuai sehingga hasil yang diperoleh maksimum.
Siklus yang terjadi pada proses ekstraksi di setiap jamnya sebanyak 10-12 siklus/jam [49]. Selain itu penuruan kandungan minyak pada kondisi tersebut disebabkan tekanan dari pelarut tidak maksimal sehingga proses plasmolisis tidak dapat terjadi secara maksimal pula yang akan mengurangi ekstrak minyak yang diperoleh. Semakin tinggi suhu ekstraksi, semakin tinggi tekanan yang diberikan pelarut terhadap biji pepaya sehingga diperlukan rangkaian peralatan yang tepat. Rangkaian peralatan yang tidak tepat akan mengurangi kandungan minyak yang diekstrak. Hal ini disebabkan tekanan pada rangkaian akan keluar menuju tekanan udara disekitar dan juga terjadi penurunan suhu dari suhu rangkaian peralatan ke suhu ruang sekitar rangkaian peralatan yang akan menurunkan kemampuan mengekstrak minyak biji pepaya [46].
4.1.2 Analisis Bilangan Peroksida
peroksida yang diperoleh dalam penelitian ini juga lebih rendah jika dibandingkan dengan penelitian terdahulu yang mendapatkan bilangan peroksida sebesar 5,37 meq/kgminyak dengan kondisi operasi waktu ekstraksi 6 jam dan menggunakan petroleum eter sebagai pelarut [24]. Tinggi rendahnya bilangan peroksida ini kemungkinan disebabkan oleh proses oksidasi pada saat proses ekstraksi atau penyimpanan. Reaksi pembentukan peroksida pada minyak diakibatkan oleh reaksi oksidasi oleh oksigen dengan sejumlah asam lemak tak jenuh (khususnya
polyunsaturated) dan mengindikasikan bahwa minyak biji pepaya dapat disimpan
dalam waktu yang lama dan stabil karena tidak mudah menjadi tengik.
Pada umumnya bilangan peroksida yang rendah menunjukkan kualitas minyak yang lebih baik. Analisis bilangan peroksida adalah cara yang baik untuk menentukan sejumlah produk yang mengalami proses oksidasi primer di dalam minyak segar [42]. Bilangan peroksida ditunjukkan dengan milliequivalen peroksida per kilogram sampel [43]. Bilangan peroksida minyak juga akan meningkat setelah terkena cahaya dan udara. Sejumlah logam berat juga akan mempengaruhi secara positif dalam peningkatan bilangan peroksida [50].
4.1.3 Analisis Bilangan Iodin
[image:48.595.120.495.651.756.2]Bilangan iodin adalah suatu pengukuran dari derajat kerelatifan dari minyak tak jenuh. Bilangan iodin yang tinggi, menghasilkan tingkat ketakjenuhan semakin tinggi dan meningkatkan kepekaan terhadap oksidasi [45]. Perlu diketahui bahwa, bilangan iodin bukan merupakan suatu pengukuran kualitas melainkan adalah sebuah indikator komposisi minyak [43]. Dalam penelitian ini analisis bilangan iodin dilakukan pada sampel minyak biji pepaya yaitu pada waktu ekstraksi 220 menit untuk variasi perbandingan biji pepaya terhadap pelarut (w/v) yang dapat dilihat pada Tabel 4.5.
Tabel 4.5 Analisis Bilangan Iodin Ekstraksi Biji Pepaya (Carica Pepaya L) Waktu Ekstraksi
(menit)
Perbandingan Biji Pepaya:Pelarut (w/v)
Bilangan Iodin (mg/gr)
220 1:4 16,03
220 1:5 12,15
Dari hasil analisis bilangan iodin didapatkan bilangan iodin yang tertinggi pada perbandingan biji pepaya:pelarut sebesar 1:7 dengan waktu ekstraksi 220 menit sebesar 16,91 mg/gram; Sedangkan bilangan iodin yang terendah didapatkan pada perbandingan biji pepaya:pelarut sebesar 1:5 dengan waktu ekstraksi 220 menit sebesar 12,15 mg/gram. Hasil yang diperoleh ini lebih rendah jika dibandingkan dengan nilai bilangan iodin yang dispesifikasikan oleh FAO/WHO untuk edible oil yaitu berkisar 80-106 [49].
Bilangan iodin pada penelitian ini juga lebih kecil jika dibandingkan dengan hasil penelitian yang terdahulu memperoleh hasil analisis bilangan iodin sebesar 65,50 [32] dan 79,05 [24]. Nilai bilangan iodin yang rendah menunjukan tingkat ketakjenuhan sesemakin rendah. Ini berarti bahwa minyak mengandung asam lemak tak jenuh yang rendah. Hal ini tidak sesuai dengan analisis kualitatif yang diperoleh yang ditunjukan pada Tabel 4.3 dan 4.4. Dari kedua tabel tersebu diketahui kandungan asam lemak tak jenuh lebih tinggi dibanding dengan kandungan asam lemak jenuh.
Bilangan iodin yang rendah pada metode sokletasi disebabkan terjadinya proses oksidasi pada saat pemanasan, sehingga oksigen akan terikat pada ikatan rangkap asam lemak tidak jenuh. Proses tersebut mengakibatkan ketidakjenuhan minyak berkurang karena ikatan rangkap pada asam lemak menjadi ikatan tunggal sehingga bilangan iodinnya sesemakin berkurang [52].
Jika dilihat dari nilai bilangan iodin yang diperoleh yaitu sebesar 16,91 mg/gram minyak biji pepaya pada penelitian ini termasuk minyak yang non-drying, karena nilai yang diperoleh lebih kecil dari 100 [37]. Minyak non-drying tidak dapat digunakan untuk industri cat, industri pernis dan industi pelapisan permukaan [37]. Minyak non-drying dapat digunakan sebagai self-cured polymer yang telah diaplikasikan pada penelitian terdahulu dengan menggunakan minyak Pongamia
glabra yang memiliki bilangan iodin lebih kecil 100 yakni 87 mg/gram minyak [53].
4.1.4 Analisis Spesific Gravity (SG)
Spesific gravity (SG) adalah perbandingan antara densitas campuran terhadap
pepaya didapatkan spesific gravity sebesar 0,8939 pada kodisi operasi dengan perbandingan biji pepaya:pelarut sebesar 1:5 dan waktu ekstraksi 140 menit. Nilai yang didapatkan lebih rendah dibandingkan dengan peraturan yang diberikan oleh FAO/WHO untuk edible oil yang berkisar 0,9-1,16 [47]. Hal ini disebabkan minyak biji pepaya yang diperoleh tidak dilakukan proses penyulingan lebih lanjut sehingga terjadi proses perekatan material (gumming). Berat minyak akan berpengaruh setelah dilakukan proses penyulingan. Spesific gravity yang diperoleh dari proses penyulingan minyak yang berbeda dengan berat molekul masing-masing akan dipengaruhi oleh proses penyulingan yang dilakukan [47].
4.1.5 Analisis Kadar Asam Lemak Bebas (Free Fatty Acid)
Sejumlah kadar asam lemak bebas yang diperkirakan melalui penentuan kuantitas alkali yang harus ditambahkan pada lemak untuk menjadikannya mendekati netral [48]. Kadar asam lemak bebas menentukan banyaknya gliserida di dalam minyak yang telah terdekomposisi oleh aktivitas enzim lipase. Dekomposisi ini dipengaruhi oleh pencahayaan dan pemanasan, sehingga ketengikan biasanya ditandai dengan pembentukan asam lemak bebas [48].
4.3 SIFAT FISIKA-KIMIA MINYAK BIJI PEPAYA
[image:51.595.111.533.186.283.2]Setelah dilakukan analisis kuantitatif dan kualitatif didaopatkan sifat fisika-kimia dari minyak biji pepaya yang dapat dilihat pada Tabel 4.6
Tabel 4.6 Sifat Kimia Minyak Biji Pepaya (Carica Pepaya L.) Parameter Minyak Biji Pepaya
(Carica Pepaya L.)
Standar untuk Edible
Oil
Free Fatty Acid (FFA) 5,6410 0,5 [40]
Spesific gravity (S.G) (250C) 0,8939 0,9-1,16 [48]
Bilangan Peroksida (meq/kg minyak) ND 10 [45]
Bilangan Iodine (g/100 g) 12,15-16,91 80-106 [48]
Tabel 4.7 Parameter Edible Oil
Parameter Standar Edible Oil
Bilangan Peroksida (meq/kg minyak) 10 [45]
Bilangan Iodin (g/mg) 80-109 [48]
Spesific gravity (SG) 0,9-1,16 [48]
Kadar Asam Lemak Bebas (%) 0,5-1% [40]
Refractive Index (200C) 1,457 [40]
Total Fenol (mg/g) 220 [40]
Bilangan Keasaman 1 % [40]
BAB V
KESIMPULAN DAN SARAN
5.1 KESIMPULAN
Kesimpulan yang dapat diambil dari penelitian yang telah dilakukan adalah: 1. Pelarut n-butil asetat sangat efektif digunakan sebagai pelarut dalam proses
ekstraksi dengan metode sokhletasi karena mampu mengekstrak minyak biji pepaya dengan baik.
2. Kandungan minyak tertinggi yang dihasilkan dari ekstraksi minyak biji pepaya pada penelitian ini adalah pada waktu ekstraksi 220 menit dengan perbandingan biji pepaya:pelarut 1:8 sebesar 43%.
3. Kadar asam lemak bebas yang terkandung di dalam minyak biji pepaya sebesar 5,6401%. Spesific gravity yang diperoleh pada minyak biji pepaya sebesar 0,8364.
4. Nilai bilangan peroksida tidak diterdeteksi pada minyak biji pepaya. Nilai bilangan iodin yang diperoleh pada minyak biji pepaya sebsear 16,91mg/gram. 5. Dari hasil analisa dengan menggunakan Gas Chromatography Mass
Spectrometry (GC/MS) didapatkan asam lemak tak jenuh dan asam lemak
jenuh. Komponen asam lemak yang tertinggi itu ialah oleat sebeser 63,26 % dan di ikuti oleh palmitat sebesar 17,57%.
5.2 SARAN
Adapun saran yang dapat diberikan adalah :
1. Perlu dilakukan perlakuan lebih lanjut seperti proses pemurnian yang dapat dilakukan dengan proses esterifikasi.
2. Melakukan analisa lain untuk mengetahui sifat-sifat minyak biji pepaya yang sesuai standard minyak yang edible.
3. Melakukan variasi suhu ekstraksi dan massa sampel untuk mengetahui suhu dan massa sampel terbaik.
BAB II
TINJAUAN PUSTAKA
2.1 PEPAYA
[image:54.595.216.419.382.551.2]Pepaya merupakan tanaman asli daerah teropis, buah pepaya pertama kali ditemukan di Southern Mexico dan seluruh Andes di Amerika Selatan oleh Cristoper Colombus. Pada pertengahan abat ke-17 buah pepaya mulai dipasarkan di Hawaii. Pepaya merupakan tanaman berakar tunggal dengan tinggi 20-30 ft, pada batang pohon papaya terdapat lubang atau luka bekas dahan yang telah gugur, pohon pepaya memiliki daun yang lebar hingga (2 ½) kaki dan buah yang berwana hijau hingga coklat dengan diameter 8 inci [25], tanaman ini dapat tumbuh di berbagai tempat. Klasifikasi pepaya (Carica Papaya L) dapat dilihat pada Tabel 2.1
Tabel 2.1 Klasifikasi Pepaya (Carica Papaya L) [25] Domain Flowering plant
Kingdom Plantae
Subkingdom Tracheobionta
Klass Magnoliopsida
Subklass Dilleniidae
Divisi Magnoliophyta
Superdivisi Spermatophyta
Filum Steptophyta
Order Brassicales
Famili Caricaceae
Genus Carica
Nama Botanical Carica Papaya Linn
Gambar 2.1 Produksi Pepaya Global [11] 2.1.1 Susunan Kimia Pepaya
Pada biji pepaya terdapat sebuah senyawa yang dihaluskan diyakini mampu melawan cacing parasit di usus, yaitu benzyl isothiocynate, telah terbukti memiliki efek pada kontraksi pembuluh darah menggunakan arteri karotis dalam model in vitro [31]. Serta memiliki berbagai khasiat yang mampu melancarkan pencernaan. Pepaya mengandung berbagai jenis enzim, vitamin serta asma lemak dan juga berbagai zat-zat kimia lainnya pada berbagai bagian pepaya, seperti pada buah, daun, bunga, biji, akar, dan kulit. Buah pepaya memiliki kandungan 30,1% minyak, 28,1% protein, 19,1% serat, 25,6% karbohidrat, 7,3% kandungan air, dan 8,2% abu [22].
Asia 52.55%
Afrika 13.16% Amerika
Selatan 23.09% Amerika
Utara 0.14%
Amerika Tengah
9.56%
Karibia 1.38%
Table 2.2 Komposisi Kimia Buah Pepaya [32]
Komposisi Kimia Nilai (%) Air
Protein Minyak Abu Serat
Total korbon
[image:56.595.173.465.105.218.2]7,3 28,1 30,1 8,2 19,1 25,6
Tabel 2.3 Komposisi Kimia Berbagai Bagian Pepaya [22] Bagian Kandungan zat-zat kimia
Buah Protein, lemak, serat, karbohidrat, mineral: kalsium, fosfor, zat besi, vitamin C, tiamin, riboflavin, niasin, dan karoten, asam amino, asam sitrat dan malat (buah hijau), senyawa volatil: linalool, benzylisothiocyanate, cis dan trans-2.6-dimetil-3,6-epoksi-7-okten-2-ol, Alkaloid, carpaine, benzyl-D-glukosida, 2-pentiletil-D-glukosida, 4-hidroksi-fenil-2-etil-D-glukosida dan empat isomer malonated benzil-D-glukosida.
Benih Asam lemak, protein kasar, serat kasar, minyak pepaya,
Carpaine, benzylisothiocyanate, benzylglucosinolate,
glucotropacolin, benzylthiourea, hentriacontane, -sitosterol, caricin dan myrosin enzimmyrosin.
Akar Carposide dan enzyme myrosin.
Daun Alkaloid carpain, pseudocarpain dan dehydrocarpaine I dan II, kolin, carposide, vitamin C dan E.
Kulit sitosterol, glukosa, fruktosa, sukrosa, galaktosa dan xylitol. Getah
Enzim proteolitik, papain dan chemopapain,
glutamine cyclotransferase, chymopapains A, B dan
Tabel 2.4 Kandungan Gizi dalam 100 gr Buah Pepaya [22]
Koposisi Kimia Pepaya Matang Pepaya Muda
Protein Lemak Mineral Serat Karbohidrat Energi Total Karoten Beta carotene 0,6 g 0,1 g 0,5 g 0,8 g 7,2 g 32kcal 2,740µm 888 µm 0,7 g 0,2 g 0,5 g 0,9 g 5,7 g 27 kcal 0 0
Biji pepaya memiliki kandungan protein serta lemak yang tinggi. Ini merupakan daya tarik ekonomis untuk ektraksi minyak skala industri terutama dibandingkan dengan tanaman biji konvensional yang menghasilkan minyak seperti jagung dan kedelai. Kandungan lemak yang begitu tinggi itu terdapat pada biji pepaya, dengan komposisi meristat (C14-0) 0,24%, palmitat (C16-0) 13,5%, palmitolet (C16-1) 0,21%, stearat (C18-0) 4,5%, oleat (C18-1) 72,52%, linoleat (C18-2) 2,90%, linoleanat (C18-3) 0,23%, arakidonat (C20-0) 0,39%, eikosenoat (C20-1) 0,28% [32]
Table 2.5 Komposisi Asam Lemak/Minyak Biji Pepaya [24]
Asam Lemak Nilai (%)
Miristat (C14: 0) Palmitat (C16: 0) Palmitolet (C16: 1) Margarin (C17: 0) Stearat (C18: 0) Oleat (C18: 1 n-9) Linoleat (C18: 2 n-6) Linolenat (C18: 3 n-3) Arakidonat (C20: 0) Eikosenoat (C20: 1)
[image:57.595.174.464.521.691.2]2.2 EKSTRAKSI
Salah satu cara pengambilan minyak yang terkandung dalam biji pepaya adalah dengan cara ekstraksi. Ekstraksi merupakan salah satu metode pemisahan berdasarkan perbedaan kelarutan. Secara umum ekstraksi dapat didefinisikan sebagai proses pemisahan zat dari suatu padatan ataupun cairan dengan menambahankan pelarut tertentu untuk mengeluarkan komponen campuran dari zat padat atau zat cair tersebut, proses ekstraksi dalam konteks ini adalah pemisahan senyawa dari substrat. Dalam banyak kasus, ekstraksi adalah proses fisik, dimana senyawa dilarutkan dalam pelarut dan kemudian dipisahkan dari pelarut sebagai produk. Tetapi ada juga kasus dimana pelarut tidak hanya secara fisik berinteraksi dengan substrat, tetapi bereaksi dengan memecah ikatan antara substrat dan senyawa atau bereaksi dengan senyawa itu sendiri [35].
Komponen yang dipindahkan dari zat padat ke dalam pelarut disebut “solute” sedangkan padatan yang tidak terlarut dalam pelarut disebut “inert” proses tersebut akan menjadi sempurna jika solut dipisahkan dari pelarutnya, misalnya dengan cara distilasi/penguapan [16].
Leaching adalah pemisahan fraksi larut dalam bentuk solusi dari fase padat
yang biasanya bersifat permeabel. leaching umumnya melibatkan pelarut yang selektif dengan atau tanpa difusi. Metode yang digunakan untuk leaching biasanya ditentukan oleh jumlah konstituen yang akan dilarutkan, distribusi konstituen dalam padatan, sifat padatan dan ukuran partike. Mekanisme proses leaching pada umumnya ialah zat terlarut ditransfer dari larutan ke permukaan padatan kemudian berdifusi kedalam padatan, pelarut yang berada didalam padatan akan larut oleh zat terlarut kemudian terdifusi menjadi campuran solut-solven ke permukaan padatan dan ditransfer keluar/ kedalam larutan zat terlarut [29].
– ………(2.1)
dimana:
A adalah luas antarmuka padat-cair,
b adalah ketebalan efektif dari film cairan yang mengelilingi partikel, c adalah konsentrasi zat terlarut dalam sebagian besar solusi pada waktu t, cs adalah konsentrasi larutan jenuh dalam kontak dengan partikel,
M adalah massa zat terlarut ditransfer dalam waktu t, dan k adalah koefisien difusi
Pada umumnya kecepatan transfer solven ke permukaan terjadi sangat cepat dan berlangsung pada saat terjadi kontak antara solut dan solvent. Sedangkan kecepatan difusi campuran solute-solvent ke permukaan solid merupakan tahapan yang mengontrol dalam keseluruhan proses leaching. Kecepatan difusi campuran
solut-solvent ke permukaan solid tergantung dari beberapa faktor yaitu suhu, luas
permukaan partikel, pelarut (solvent), perbandingan solut-solvent, proses pencampuran atau pengadukan dan lama pengadukan. Faktor-faktor yang mempengaruhi laju ekstraksi, yaitu: ukuran partikel, pelarut, suhu, dan pengadukan dari fluida (campuran pelarut, solut, dan padatan) [30].
2.3. FAKTOR-FAKTOR YANG MEMPENGARUHI EKSTRAKSI
Pemilihan peralatan untuk proses ekstraksi dipengaruhi beberapa faktor-faktor. Dengan demikian, jika difusi zat terlarut melalui struktur berpori dari padatan sisa adalah faktor pengendali, materi harus ukuran kecil sehingga proses difusi zat terlarut sangat mudah. Di sisi lain, jika difusi zat terlarut dari permukaan partikel sebagian besar adalah faktor pengendali, pengadukan cairan yang diperlukan, ukuran partikel, temperatur ekstraksi, jumlah pelarut, serta waktu ekstraksi [32].
Pada prinsipnya ekstraksi adalah melarutkan dan menarik senyawa dengan menggunakan pelarut yang tepat. Ada tiga tahapan proses pada waktu ekstraksi yaitu:
1. Penetrasi pelarut kedalam pori padatan
3. Difusi bahan yang terekstraksi ke luar padatan
Proses di atas diharapkan terjadinya kesetimbangan antara zat terlarut dan pelarut. Kecepatan untuk mencapai kesetimbangan umumnya tergantung pada suhu, ukuran partikel, dan gerakan partikel. Prinsip yang utama adalah yang berkaitan dengan kelarutan, yaitu senyawa polar lebih mudah larut dalam pelarut polar dan senyawa nonpolar akan mudah larut dalam pelarut nonpolar [25].
2.3.1 Ukuran Partikel
Ukuran partikel mempengaruhi laju ekstraksi dalam beberapa cara. Semakin besar area permukaan antara padat dan cair, oleh karena itu semakin tinggi tingkat transfer material, maka semakin kecil jarak terlarut yang berdifusi dalam padatan. Di sisi lain, permukaan mungkin tidak begitu efektif digunakan jika sirkulasi cairan terhambat dan pemisahan partikel dari cairan berdrainase terhadap residu padatan. Diharapkan kisaran ukuran partikel harus kecil sehingga setiap partikel membutuhkan waktu yang sama untuk ekstraksi [30].
Secara umum, penurunan ukuran partikel berbannding lurus dengan kenaikan laju ekstraksi. Pemeningkat perpindahan massa dengan diameter partikel yang lebih kecil, dan panjang jalur transportasi senyawa dalam substrat padat dipersingkat jika senyawa tidak hanya terdifusi di permukaan, tetapi juga hadir dalam padat substrat [16].
2.3.2 Suhu Ekstraksi
Temperatur yang lebih tinggi (viskositas pelarut lebih rendah, kelarutan solute lebih besar) pada umumnya menguntungkan unjuk kerja ekstraksi. Namun, temperatur ekstraksi tidak boleh melebihi titik didih pelarut karena akan menyebabkan pelarut menguap. Biasanya temperatur ekstraksi yang paling baik adalah sedikit di bawah titik didih pelarut [16].
Kelarutan bahan yang diekstraksi akan meningkat dengan suhu untuk memberikan tingkat yang lebih tinggi dari ekstraksi, koefisien difusi meningkat dengan kenaikan suhu dan ini juga akan meningkatkan laju ekstraksi [30]. Dalam beberapa kasus, batas atas temperatur ditentukan oleh pertimbangan sekunder, seperti kebutuhan untuk menghindari aksi enzim selama ekstraksi gula.
2.3.3 Pelarut
Pada proses ekstraksi pelarut bertujuan untuk mengekstrak zat terlarut dari satu fase cair yang lain. Hal ini dapat dilakukan untuk memisahkan dua zat terlarut yang berbeda untuk memurnikan fasa cairan dari kontaminasi. Sebuah sistem ekstraksi pelarut mengandung dua fasa cair yang bercampur, satu fase rafinat dan satu cair organik, pengencer, dan satu atau lebih zat terlarut. Selain itu, sistem ekstraksi di sebagian besar satu atau lebih ekstraktan ditambahkan ke pengencer untuk meningkatkan ekstraksi dan pemisahan. Kadang-kadang pengubah fase digunakan untuk mencegah pembentukan tahap ketiga mengganggu [12].
Jenis pelarut merupakan faktor penting dalam ekstraksi minyak dari biji pepaya. Hal-hal yang perlu diperhatikan dalam pemilihan pelarut adalah selektivitas, kemampuan mengekstrak, toksisitas, kemudahan untuk diuapkan, dan harga pelarut. Sejumlah solvent yang digunakan dalam ekstraksi adalah faktor lain yang dipertimbangkan. Pemilihan solvent pengekstrak harus berdasarkan sifat alami dari sampel. Selain itu, efisiensi ekstraksi dan matriks yang tak larut, pemilihan ini harus mempertimbangkan aspek-aspek lain. Solvent harus lebih banyak daripada jumlah sampel. Volume solvent yang rendah terkadang berguna untuk menghasilkan konsentrasi yang lebih tinggi dalam penganalisaan [27]
Ada beberapa faktor spesifik yang dipertimbangkan dalam pemilihan solvent yang meliputi:
Kemampuan untuk menghilangkan dan konsentrat solute dari komponen Lainnya [33].
2. Ketersediaan
Solvent harus tersedia selama proses ekstraksi [33].
3. Kemampuan melarut dalam umpan
Diperlukannya pemulihan solvent dari rafinat atau penyegaran kembali solvent yang digunakan [33].
4. Perbedaan Densitas
Perbedaan densitas yang terlalu rendah antara fasa-fasa akan menghasilkan masalah dalam pemisahan. Perbedaan densitas yang terlalu tinggi dapat menyulitkan untuk menentukan proses ekstraksi yang terbaik yang diinginkan [33]. Dengan meningkatnya densitas, laju ekstraksi akan meningkat pada suhu yang konstan. Hasil ekstraksi akan berbeda untuk densitas yang sama pada suhu yang berbeda [33].
5. Sifat Fisik
Solvent yang terlalu kental akan menghalangi perpindahan massa dan
kapasitasnya. Tegangan permukaan yang terlalu rendah akan mendorong kearah masalah