BAB 2
TINJAUAN PUSTAKA
2.1 Darah
Darah merupakan bagian dari tubuh yang jumlahnya 60-80% dari berat badan, dangan viskositas darah 4,5 kali lebih besar dari pada air. Darah merupakan jaringan yang berbentuk cairan, terdiri dari dua bagian yaitu plasma darah dan sel darah. Plasma darah mengandung fibrinogen. Oleh karena darah pada saat mengambil sampel darah, darah dicampur dengan antikoagulan untuk mencegah terjadinya pembekuan darah. (Buku ajar Penyakit Dalam FK UI, 2006)
2.2. Hemostasis
Untuk dapat memahami thrombosis, pemahaman tentang dasar hemostasis sangatlah penting. Hemostasis berasal dari kata haima (darah) dan stasis (berhenti), proses kompleks yang berlangsung terus menerus dan mencegah kehilangan darah secara spotan, serta menghentikan pendarahan akibat kerusakan sistem pembuluh darah. (Buku ajar Penyakit Dalam FK UI, 2006)
Pada keadaan normal darah berada dalam sistem peredaran darah, dalam bentuk cairan. Keadaan ini dimungkinkan oleh faktor hemostasis yang terdiri dari:
darah. Dimulai dengan vasokontriksi pembuluh darah dan pembentukan trombosit plak menutup luka dan menghentikan perdarahan.
b. Hemostasis sekunder, terdiri dari faktor pembekuan dan anti pembekuan.
Hemostasis sekunder dimulai dengan aktivasi koagulasi melalui jalur ekstrinsik dan intrinsik. Migrasi dan proliferasi sel terjadi pada jaringan yang rusak untuk penyembuhan luka
c. Hemostasis tersier, yaitu sistem fibrinolisis akan diaktifkan dan menyebabkan lisis dari fibrin dan endotel menjadi utuh. (Buku ajar Penyakit Dalam FK UI, 2006)
2.2.1. Faktor-Faktor Pembekuan
Pembagian faktor-faktor pembekuan adalah sebagai berikut:
Faktor I : disebut fibrinogen, adalah suatu glikoprotein dengan berat
molekul 330.000 dalton, tersusun atas 3 pasang rantai polipeptida. Kadar fibrinogen meningkat pada keadaan yang memerlukan hemostasis dan pada keadaan nonspesifik, misalnya inflamasi, kehamilan, dan penyakit autoimun. Faktor II : Disebut dengan prothrombin, dibentuk di hati dan
memerlukan vitamin K. Faktor ini merupakan prekusor enzim proteolitik tromion dan mungkin asselerator konversi prothrombin lain.
Faktor III : Merupakan tromboplastin, jaringan yang berupa lipoprotein
Faktor IV : Merupakan ion kalsium yang diperlukan untuk mengaktifkan
prothrombin dan pembentukan fibrin
Faktor V : Dikenal sebagai proasselerin atau faktor labil, protein ini
dibentuk oleh hati dan kadarnya menurun pada penyakit hati. Faktor ini merupakan faktor plasma yang mempercepat perubahan prothrombin menjadi thrombin.
Faktor VII : Merupakan asselerator konversi prothrombin serum, dibuat di
hati dan memerlukan vitamin K dalam pembentukannya. Faktor ini merupakan faktor serum yang mempercepat perubahan prothrombin.
Faktor VIII : Dikenal sebagai faktor antihemofili, tidak dibentuk di hati.
Merupakan faktor plasma yang berkaitan dengan faktor III trombosit dan faktor chrismas (IX), mengaktifkan prothrombin.
Faktor IX : Disebut dengan faktor chrismas, dibuat di hati memerlukan
vitamin K. Merupakan faktor serum yang berkaitan dengan faktor III trombosit dan VII AHG mengaktifkan prothrombin.
Faktor X :Disebut dengan faktor stuart-power, dibuat di hati dan
memerlukan vitamin K. Merupakan kunci dari semua jalur aktivasi faktor-faktor pembekuan.
Faktor XI : Sebagai antisenden tromboplastin plasma, dibentuk di hati
Faktor XII : Disebut faktor Hageman. Merupakan faktor plasma
mengaktifkan PTA (faktor XII)
Faktor XIII : Merupakan faktor untuk menstabilkan fibrin, diproduksi di
hati maupun megakariosit. Faktor ini menumbulkan bekuan fibrin yang lebih kuat yang tidak larut dalam urea. (Buku ajar Penyakit Dalam FK UI, 2006)
2.2.2 Pembentukan Fibrin
Pembentukan F.IXa, pengaktifan lewat jalur intrinsik. Diawali dengan pengaktifan F.XII (faktor Hageman) oleh fosfolipid, kolagen subendotel dan kalikrein.F.XIIa akan mengubah F.XI menjadi F.Xia hal ini semakin cepat dengan high molecular-weight kininogen. F.Xia bersama dengan kalsium akan mengubah F.IX menjadi Faktor IXa. F.IXa merupakan enzim yang berfungsi dalam pembentukan F.Xa. (Buku ajar Penyakit Dalam FK UI, 2006)
Pembentukan F.Xa lewat jalur intriksik membutuhkan lima komponen substrat (F.X), enzim (F.IXa), kofaktor (F.VIII:C), permukaan (faktor trombosit), ion kalsium. Faktor jaringan dan inhibitor jalur faktor jaringan (Tissue FactorPathway Inhibitor, TFPI) pembentukan F.Xa lewat jalur ekstrinsik melibatkan faktorjaringan, F.VII, ion kalsium dan TFPI. Faktor jaringan bisa berasal sel endotel, sistem monosit/makrofag, maupun sel ganas. Faktor jaringan akan terbentuk bila terjadi injuri atau rangsangan misalnya induksi sitokin (IL-1α, TNFα), pengaktifan komplemen, terutama C5a,
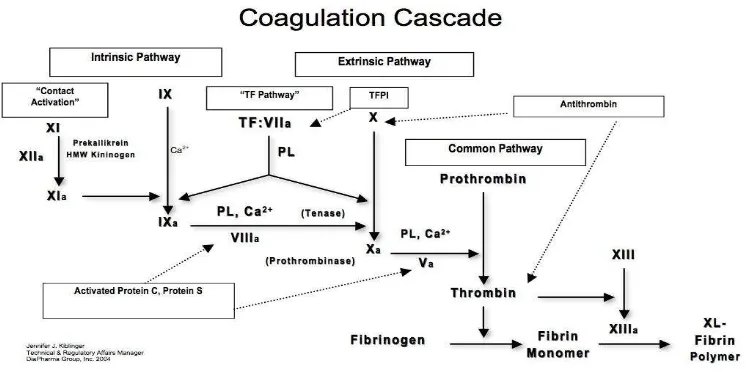
liposakarida dan kompleks imun dalam sirkulasi. Faktor jaringan diaktifkan atau dilepas untuk mengaktifkan faktor VII menjadi F.VIIa membentuk kompleks dengan F.VII bersama ion kalsium. komplek TF/F.VIIa mampu mengaktifkan baik F.X maupun F.IX menjadi F.Xa dan F.IXa. sebagai tambahan F.Xa dapat mengubah kompleks TF/F.VII menjadi TF/VIIa, sehingga meningkatkan potensi pembentukan F.IX dan F.X,tampak pada gmbar 1 dan 2. (Buku ajar Penyakit Dalam FK UI, 2006; Yuan liu et al,2011)
2.2.3 Pembentukan Thrombin
pada beberapa faktor yang tergantung vitamin K (faktor II, VII, IX,X) faktor-faktor ini disintesis dalam parenkim sel hepar, tampak pada gambar 2.1 (Buku ajar Penyakit Dalam FK UI, 2006)
Gambar 2.1. Kaskade Koagulasi. (Buku ajar Penyakit Dalam FK UI, 2006)
2.2.4. Thrombosis
Patogenesis Thrombosis
Patogenesis thrombosis arteri dan vena berbeda. Selain dari faktor aliran darah, faktor resiko, dan pembuluh darah sendiri turut berperan. Oleh karenanya patogenesa masing-masing akan dibahas tersendiri. Misalnya akibat perbedaan aliran darah, pada pembentukan thrombus vena tidak dibutuhkan faktor von Willebrand sebaliknya pada thrombus arteri, gambar 2.2. (Buku ajar Penyakit Dalam FK UI, 2006).
Gambar 2.2. Agregasi Trombosit. (Buku ajar Penyakit Dalam FK UI, 2006)
Thrombosis terjadi bila terjadi gangguan keseimbangan antara yang merangsang thrombosis dan yang mencegah thrombosis.
a. Thrombosis Arteri
Faktor yang merangsang atau faktor resiko thrombosis, yaitu: Endotel pembuluh darah yang tidak utuh
Defisiensi Antipembekuan.
Defisiensi faktor pembekuan akan menyebabkan darah cenderung
mengalami thrombosis yang disebut trombofilia. Klirens Faktor Pembekuan Aktif Berkurang Sistem Fibrinolisis Berkurang.\
Stagnasi
Faktor-faktor lain yang berperan dalam thrombosis arteri yaitu : arterothrombosis, dimana faktor resiko arterothrombosis dapat digolongkan sebagai:
Umum yaitu umur dan obesitas
Genetik, jenis kelamin dan Penyakit Ibu dan Anak
Gaya hidup, rokok, diet dan kurang olahraga
Inflamasi, CRP dan ligan CD 40, IL-6 meningkat, faktor protrombotik dan
fibrinogen meningkat.
Kondisi sistemik, hipertensi, hiperlipidemia, homosisteinemia, estrogen,
diabetes, trombofilia, sindrom hiperviskositas, sindrom leukositosis, dan polisitemia.
Faktor lokal, pola aliran darah, diameter pembuluh darah, struktur dinding arteri
dan persentase stenosis arteri. (Buku ajar Penyakit Dalam FK UI, 2006) b. Thrombosis Vena
atau yang terganggu. Sering dimulai sebagai deposit kecil pada sinus vena besar di betis pada puncak kantong vena baik di vena dalam betis maupun dipaha atau pada vena yang langsung terkena trauma. Pembentukan, perluasan dan pelarutan thrombus vena dan emboli paru mencerminkan suatu ketidakseimbangan antara yang menstimulasi thrombosis dan yang mencegah thrombosis. Virchow lebih dari satu abad yang lalu telah mengemukakan faktor yang berperan pada thrombosis vena yang terkenal dengan Triad Virchow, yaitu, koagulasi darah, stagnasi, dan kerusakan pembuluh darah (Buku ajar Penyakit Dalam FK UI, 2006, Andrew, D Blann, et al,2011)
Koagulasi darah.
Aktivitas koagulasi melalui jalur intrinsik dapat terjadi karena kontak F.XII dengan kolagen pada subendotelium pembuluh darah yang rusak. Aktivitas melalui jalur intrinsik jaringan yang rusak masuk aliran darah mengaktifkan F.VII baik jalur intrinsik maupun jalur ekstrinsik akhirnya akan terbentuk fibrin. Pada penyakit kanker F.X dapat langsung diaktifkan oleh sistein yang dikeluarkan sel kanker(Buku ajar Penyakit Dalam FK UI, 2006)
Stagnasi
Stagnasi merupakan predisposisi thrombosis karena :
Mencegah faktor koagulasi aktif dilarutkan oleh darah yang tidak aktif. Mencegah klirens faktor koagulasi aktif
Stagnasi dapat diakibatkan oleh immobilitas, obstruksi vena, dilatasi vena dan meningkatnya viskositas darah. Immobilitas dapat disebabkan oleh stroke, atau berbaring yang lama. Obstruksi dapat terjadi karena kompresi dari luar atau sekunder karena thrombosis vena sebelumnya. Viskositas darah meningkat karena polisitemia, disproteinemia dan fibrinogen yang meningkat. Vasodilatasi vena terjadi pada orang tua yang berbaring lama, kehamilan dan estrogen yang tinggi. (Buku ajar Penyakit Dalam FK UI, 2006)
Pembuluh Darah Rusak
2.3. Kanker Paru
Kejadian kanker paru didunia cukup sering, insidensi kejadian kanker paru mencapai 1,2 juta kasus baru atau senilai 12,3% dari seluruh kanker didunia, mortalitasnya juga mencapai 1,1 juta jiwa atau 17,8% dari total seluruh kematian didunia. meningkatnya insidensi ini berkaitan dengan kebiasaan merokok dan/atau paparan karsinogen dari faktor lingkungan maupun dari paparan tempat kerja. (PDPI, Kanker paru, 2011)
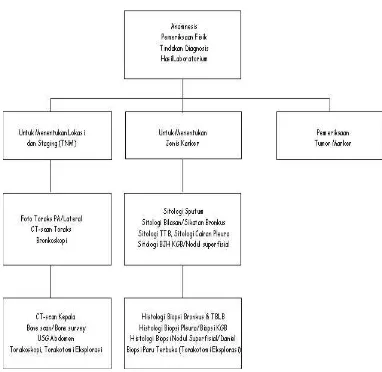
Kanker paru adalah salah satu jenis penyakit paru yang memerlukan penanganan dan tindakan yang cepat dan terarah. Kanker paru dalam arti luas adalah semua penyakit. keganasan di paru, mencakup keganasan yang berasal dari paru sendiri maupun keganasan dari luar paru (metastasis tumor di paru). Dalam pedoman penatalaksanaan ini yang dimaksud dengan kanker paru ialah kanker paru primer, yakni tumor ganas yang berasal dari epitel bronkus atau karsinoma bronkus (bronchogenic carcinoma). Alur pendiagnosaan kanker paru ditunjukkan pada gambar 2.3. (PDPI, Kanker paru, 2011)
2.3.1. Jenis Histologis
Untuk menentukan jenis histologis, secara lebih rinci dipakai klasifikasi histologis menurut WHO tahun 1999:
1. Karsinoma skuamosa (karsinoma epidermoid) 2. Karsinoma sel kecil (small cell carcinoma) 3. Adenokarsinoma (adenocarcinoma)
Gambar 2.3. Alur Pendiagnosaan Kanker Paru. (PDPI, Kanker paru, 2011)
Karsinoma sel skuamosa merupakan tipe histologi kanker paru yang paling sering pada laki-laki. Insidensinya pada laki-laki menurun sejak awal tahun 1980-an, berbeda dengan adenokarsinoma, insidensinya semakin meningkat sampai tahun 1990-an. Pada pertengahan tahun 1990-an adenokarsinoma menjadi tipe histologi kanker paru yang paling banyak pada laki-laki di Amerika Serikat. Di negara-negara barat lainnya, karsinoma sel skuamosa masih menjadi tipe yang paling banyak pada laki-laki. Pada perempuan, adenokarsinoma menjadi tipe yang paling sering (± 1/3 kasus), demikian juga insidensinya semakin meningkat.Adenokarsinoma terutama banyak ditemukan pada perempuan-perempuan Asia (72% dari kasus kanker di Jepang, 65% di Korea, 61% di Cina Singapura). (PDPI, Kanker paru, 2011)
Perbedaan tipe histologi tersebut sangat dipengaruhi oleh perubahan kebiasaan merokok secara epidemi.
Karsinoma Sel Skuamosa
Adenokarsinoma
Adenokarsinoma adalah suatu tumor epitel ganas dengan diferensiasi glandular atau produksi mukus, menunjukkan bentuk pertumbuhan asinar, papiler, bronkioloalveolar, atau solid dengan mukus, atau campuran dari bentuk-bentuk tersebut. Adenokarsinoma biasanya berada di perifer. (PDPI, Kanker paru, 2011)
Karsinoma sel besar
Karsinoma sel besar adalah kanker paru jenis karsinoma bukan sel kecil yang tidak berdiferensiasi, yang tidak menunjukkan gambaran karsinoma sel kecil dan glandular atau diferensiasi skuamosa.Jenis tumor ini berkisar 15% dari kanker paru, heterogen Karsinoma sel besar sebelumnya disebut karsinoma anaplastik sel besar dan karsinoma sel besar tidak berdiferensiasi. (PDPI, Kanker paru, 2011)
Karsinoma sel kecil
2.3.2. Stadium Kanker Paru
Penderajatan Internasional Kanker Paru Berdasarkan Sistem TNM
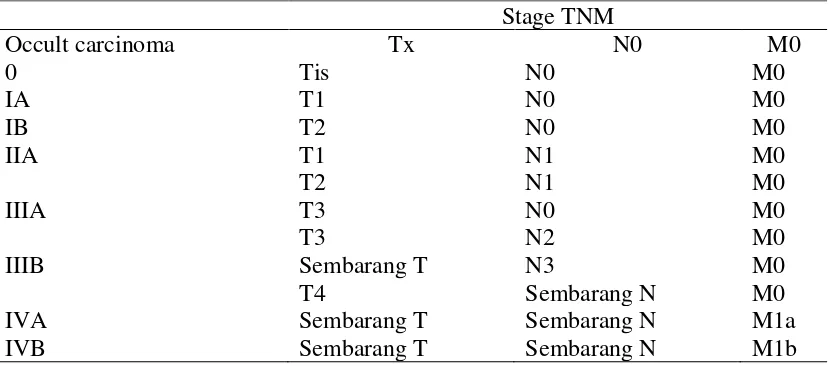
Tabel 2.1. Kategori TNM Untuk Kanker Paru. (PDPI, Kanker paru, 2011) Stage TNM
Occult carcinoma Tx N0 M0
0 Tis N0 M0
IA T1 N0 M0
IB T2 N0 M0
IIA T1 N1 M0
T2 N1 M0
IIIA T3 N0 M0
T3 N2 M0
IIIB Sembarang T N3 M0
T4 Sembarang N M0
IVA Sembarang T Sembarang N M1a
IVB Sembarang T Sembarang N M1b
T Tumor Primer
To :Tidak ada bukti ada tumor primer.Tumor primer sulit dinilai, atau tumor primer terbukti dari penemuan sel tumor ganas pada sekret bronkopulmoner tetapi tidak tampak secara radilogis atau bronkoskopik.
Tx :Tumor primer sulit dinilai, atau tumor primer terbukti dari penemuan sel tumor ganas pada sekret bronkopulmoner tetapi tidak tampak secara radilogis atau bronkoskopik.
Tis :Karsinoma in situ
ke bronkus utama). Tumor supervisial sebarang ukuran dengan komponen invasif terbatas pada dinding bronkus yang meluas ke proksimal bronkus utama. Dimana
T1a, ≤ 2 cm
T1b, > 2 cm tetapi ≤ 3 cm
T2 :Setiap tumor dengan ukuran atau perluasan sebagai berikut : Garis tengah terbesar lebih dari 3 cm
Mengenai bronkus utama sejauh 2 cm atau lebih distal dari karina
mengenai pleura visceral
Berhubungan dengan atelektasis atau pneumonitis obstruktif yang meluas
ke daerahhilus, tetapi belum mengenai seluruh paru. Bila berdasarkan ukuran tumor,
T2a, >3cm tetapi ≤ 5 cm, dan
T2b, >5 cm tetapi ≤ 7cm.
T4 :Tumor sebarang ukuran yang mengenai mediastinum atau jantung, pembuluh besar, trakea,esofagus, korpus vertebra, karina, tumor yang disertai satelittumor nodul ipsilateral pada lobus yang sama dengan tumor primer. N Kelenjar getah bening regional (KGB)
Nx :Kelenjar getah bening tak dapat dinilai
No :Tak terbukti keterlibatan kelenjar getah bening
N1 :Metastasis pada kelenjar getah bening peribronkial dan/atau hilus ipsilateral, termasuk perluasantumor secara langsung
N2 :Metastasis pada kelenjar getah bening mediatinum ipsilateral dan/atau KGB subkarina
N3 :Metastasis pada hilus atau mediastinum kontralateral atau KGB skalenus / supraklavila ipsilateral /kontralateral
M Metastasis (anak sebar) jauh. Mx :Metastasis tak dapat dinilai Mo :Tak ditemukan metastasis jauh
M1a :Nodul kontralateral, tumor dengan nodul pleura atau efusi Pleura maligna, dan efusi pericard.
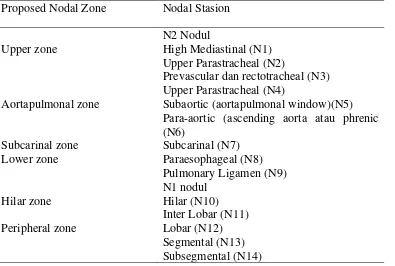
Tabel 2.2. Pembagian Nodul Station Berdasarkan Nodul Zone. (PDPI, Kanker paru, 2011; IASLC/ATS/ERS, 2011
Proposed Nodal Zone Nodal Stasion
Upper zone Para-aortic (ascending aorta atau phrenic (N6)
Tabel 2.3. Penderajatan Performa Status Kanker Paru. ( PDPI, Kanker paru, 2011) Nilai Skala
Karnofsky
Nilai Skala
WHO Keterangan
90-100 0 Aktivitas Normal
70-80 1 Ada keluhan tetapi masih aktif dan dapat mengurus diri sendiri
50-60 2 Cukup aktif, namun kadang membutuhkan bantuan 30-40 3 Kurang aktif, membutuhkan perawatan
10-20 4 Tidak dapat meninggalkan tempat tidur, perlu rawatan di rumah sakit
2.3.3. Tatalaksana Kanker Paru
Pengobatan kanker paru adalah combined modality therapy (multi-modaliti terapi). Kenyataanya pada saat pemilihan terapi, sering bukan hanya diharapkan pada jenis histologis, derajat dan tampilan penderita saja tetapi juga kondisi non-medisseperti fasiliti yang dimilikirumah sakit dan ekonomi penderita juga merupakan faktor yang amat menentukan. ( PDPI, Kanker paru, 2011)
1. Pembedahan 2. Radioterapi 3. Kemoterapi 4. Imunoterapi 5. Hormonoterapi 6. Terapi Gen
2.3.3.1. Kemoterapi
Prinsip pemilihan jenis antikanker dan pemberian sebuah regimen kemoterapi adalah: 1. Platinum based therapy ( sisplatin atau karboplatin)
2. Respons obyektif satu obat antikanker s 15% 3. Toksisiti obat tidak melebihi grade 3 skala WHO
4. harus dihentikan atau diganti bila setelah pemberian 2 sikius pada penilaian terjadi tumor progresif( PDPI, Kanker paru, 2011)
Regimen untuk KPKBSK adalah :
1. Platinum based therapy ( sisplatin atau karboplatin). 2. PE (sisplatin atau karboplatin + etoposid).
3. Paklitaksel + sisplatin atau karboplatin. 4. Gemsitabin + sisplatin atau karboplatin.
5. Dosetaksel + sisplatin atau karboplatin. ( PDPI, Kanker paru, 2011) Syarat standar yang harus dipenuhi sebelum kemoterapi
1. Tampilan > 70-80, pada penderita dengan PS < 70 atau usia lanjut, dapat
diberikan obat antikankerdengan regimen tertentu dan/atau jadual tertentu. 2. Hb > 10 g%, pada penderita anemia ringan tanpa perdarahan akut, meski Hb <
10 g% tidak pertu, tranfusi darah segera, cukup diberi terapi sesuai dengan penyebab anemia.
6. Fungsi ginjal baik (creatinin clearance lebih dari 70 ml/menit). ( PDPI, Kanker paru, 2011)
Dosis obat anti-kanker dapat dihitung berdasarkan ketentuan farmakologik masing masing. Ada yangmenggunakan rumus antara lain, mg/kg BB, mg/luas permukaan tubuh (BSA), atau obat yangmenggunakan rumusan AUC (area under the curve) yang menggunakan CCT untuk rumusnya.Luas permukaan tubuh (BSA) diukur dengan menggunakan parameter tinggi badan dan berat badan, laludihitung dengan menggunakan rumus atau alat pengukur khusus (nomogram yang berbentuk mistar). ( PDPI, Kanker paru, 2011)
Untuk obat anti-kanker yang mengunakan AUC (misal AUC 5), maka dosis dihitung denganmenggunakan rumus atau nnenggunakan nomogram.Dosis (mg) = (target AUC) x (GFR + 25) Nilai GFR atau gromenular filtration rate dihitung dari kadarkreatinin dan ureum darah penderita. ( PDPI, Kanker paru, 2011)
Evaluasi dilakukan terhadap:
Respons subyektif yaitu penurunan keluhan awal
Respons semisubyektif yaitu perbaikan tampilan, bertambahnya berat badan Respons obyektif
Respons obyektif dibagi atas 4 golongan dengan ketentuan:
1. Respons komplit (complete response , CR) : bila pada evaluasi tumor hilang 100% dan keadan inimenetap lebih dari 4 minggu.
2. Respons sebagian (partial response, PR) : bila pengurangan ukuran tumor > 50% tetapi < 100%.
3. Menetap {stable disease, SD) : bila ukuran tumor tidak berubahatau mengecil
> 25% tetapi < 50%.
4. Tumor progresif (progresive disease, PD) : bila terjadi petambahan ukuran
tumor > 25% atau muncul tumor/lesi baru di paru atau di tempat lain. (PDPI, Kanker paru, 2011)
2.4. Thrombosis Pada Kanker
Dilaporkan dalam perkembangan penyakitnya 15% pasien kanker akan mengalami trombo-emboli vena (VTE), angka ini menjadi 30-50% pada otopsi postmortem. Sebaliknya 20% pasien dengan DVT atau emboli paru kemudian hari didiagnosa menjadi kanker. Diawali oleh laporan Armand Trousseau (1865), yang menegakkan hubungan kanker dengan VTE yang dikenal dengan sindrom “Trousseau” sekarang lebih diketahui bahwa kanker sendiri dapat meningkatkan
resiko kejadian thrombosis sampai empat kali dan kemoterapi sebanyak 6 kali. (Buku ajar Penyakit Dalam FK UI, 2006; Annie Young et al, 2012)
populasi umum. Banyak faktor dapat meningkatkan faktor trombotik , termasuk faktor resiko umum pasien seperti, immobilitas pasien, umur tua dan operasi, juga faktor spesifik pasien seperti stadium tumor yang berat dan obat kemoterapi. (Annie Young et al, 2012)
Kelainan/keabnormalan dari satu atau beberapa test koagulasi sering terjadi pada pasien kanker, walaupun tanpa adanya manifestasi thrombosis maupun pendarahan. Hasil dari test laboratorium menunjukkan adanya proses pembentukan fibrin, fibrinolisis secara parallel berhubungan dengan perkembangan keganasan, dan peningkatan metastase. Terutama, dapat mendeteksi perubahan yang sedikit pada faktor faktor koagulasi. Sebagai hasil dari aktifitas koagulasi, nilai produk fibrin degradasi (D-dimer) meningkat secara signifikan pada pasien dengan keganasan dibandingkan dengan pasien sehat, nilai ini akan semakin tinggi pada keadaan dimana ukuran tumor yang besar dan adanya penetrasi ke dinding dada. (A. FALANGA et al, 2013; Slavica Kvolik, 2010)
Gerald dkk, melaporkan banyak terjadi keabnormalan pembekuan darah pada pasien dengan adenokarsinoma dan squamus sel karsinoma. (Gerald A. Soff, 2013) Pada studi Ebru Unsal dkk menemukan D-dimer meningkat pada pasien dengan tanda-tanda metastase jauh, dimana hal ini tidak berhubungan dengan jenis histopatologi dari kanker. (Ebru Unsal et al, 2003)
2.4.1. Patogenesis Dan Patofisiologi
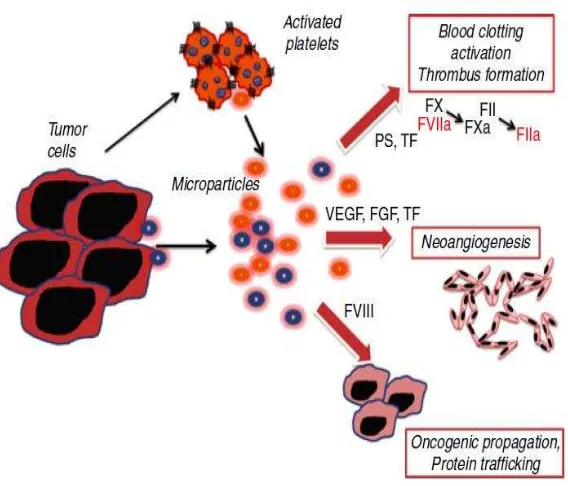
Terjadinya thrombosis pada keganasan mencakup proses kompleks yang terutama disebabkan aktivitas prokoagulan sel kanker (prokoagulanactivity/PCA) yang kemudian akan merupakan interaksi antara:
Aktivitas prokoagulan dengan diproduksinya jaringan (tissue factor/TF) dan “cancer procoagulan” (CP)/” tumor associated mucin oleh sel tumor.
Sitokin yang dikeluarkan oleh sel kanker ( INF-α, TNFβ dan VEGF) Dampak pada proses fibrinolisis
Perubahan pembuluh darah/disfungsi endotel
Interaksi antara sel pasien/ host (teraktivasinya: monosit, makrofag, trombosit,
Sel kanker yang utuh mampu melepaskan vesikel plasma membran kedalam
sirkulasi darah dan meningkatkan pembentukkan bekuan darah. (A. FALANGA et al, 2013; Slavica Kvolik, 2010)
Phatogenesis ketidakseimbangan sistem koagulasi pada kanker cukup kompleks dan meliputi banyak faktor baik klinikal dan biologi.
Faktor Klinikal
Temuan penting lainnya yaitu peningkatan pada munculnya procoagulant tissue faktor (TF) dan/atau phosphatydilserine (PS) dan pelepasan MP setelah terapi yang disebabkan oleh kemoterapi yang berbeda. (A. FALANGA et al, 2013)
Tabel 2.4. Mekanisme Klinis Dan Unsur-Unsurnya. (A. FALANGA et al, 2013)
Faktor Pasien Faktor Kanker Faktor Terapi Umur Tua
Diluar faktor klinikal, mekanisme biologis juga memegang peranan penting dalam patogenesa dari perubahan hemostasis pada kanker. Sel kanker dapat mengaktifkan sistem hemostasis melalui pengekspresian dari protein prokoagulan, pengeluaran lipid prokoagulan, pelepasan sitokin inflamasi dan MP dan perlengketan ke vaskular. Tumor prokoagulan yang paling dikenal adalah TF (tumor faktor), tampak pada gambar 2.4. (A. FALANGA et al, 2013)
ektraselular sehingga mempromosikan invasi tumor dan metastasis. Heparanase juga dapat berinteraksi dengan TF pathway inhibitor (TFPI) dari sel permukaan, menyebabkan disosiasi dari TFPI dari sel membran endothelial dan sel tumor yang meningkatkan aktivasi sel TF permukaan. (A. FALANGA et al, 2013; Paolo Prandoni et al, 2005)
Prokoagulan tumor lain adalah prokoagulan kanker (CP), tidak seperti TF, aktivasi F.X secara bebas dari F.VII. CP terdeteksi dari beberapa sel tumor, dan dalam jaringan amnion chorion tetapi tidak pada sel normal. TF secara aktif di lepaskan oleh sel tumor oleh kerja TF yang disangga MP (membrane plasma). PS diekspresikan pada MP permukaan, anionic phospolipid ini akan memfasilitasi pertemuan tenase dan kompleks prothrombinase, yang mempromosikan terjadinya koagulasi. Hal ini akan lebih lanjut di tingkatkan seiring dengan pengekspresian dari TF (tampak pada gambar 8). Normlanya MP terdapat pada level yang rendah, biasanya berasal dari platelet (>80%). Peningkatan MP terjadi pada stadium IV dibandingkan dengan stadium I, II dan III pada kanker lambung, menunjukkan akurasi diagnostk yang tinggi pada metastase. (A. FALANGA et al, 2013, Paolo Prandoni et al, 2005)
Lebih jauh, sel tumor mengeluarkan berbagai larutan proinflamasi (misal tumor nekrosis faktor α (TNF-α) dan interleukin-1β (IL-1β) dan proangiogenik (vascular
ini menginduksikan pengekspresian TF, menstimulasi produksi PAI-1, menurunkan regulasi dari trombomodulin dan mempromosikan perlengketan sel-sel. Kapasitas sel tumor dalam mengikuti endotel pembuluh darah berhubungan dengan lokalisasi dari aktivasi pembekuan darah dan pembentukan thrombin, tampak pada gambar 2.5. (A. FALANGA et al, 2013)
Gambar 2.4. Interaksi Tumor Dengan Sistem Hemostasis. (A. FALANGA et al, 2013)
Patofisiologi terjadinya thrombosis pada kanker yang masih tetap relevan diterangkan dengan „Triad Virchow‟ yang sejak 1826 menyatakan kejadian
1. Gangguan aliran darah, yang dalam hal ini karena imobilisasi bed rest atau
adanya kompresi pembuluh darah oleh massa tumor: kondisi ini akan memperlambat atau bahkan menghambat aliran darah, yang selanjutnya akan menurunkan clearance faktor faktor pembekuan yang teraktivasi, menimbulkan hipoksia sel endotel, trauma pembuluh darah.
2. Trauma dan gangguan fungsi pembuluh darah, akibatnya adanya invasi sel
tumor atau kemoterapi. Hal ini dikaitkan dengan menurunya trombomodulin, prostasiklin dan aneksin II, yang ketiganya bersifat sebagai antikoagulan dan antiagregasi baik langsubg maupun tidak langsung.
3. Terjadinya perubahan pada komponen pembekuan darah yang menyebabkan kondisi hiperkoagulasi, terjadi melalui langsung faktorXa oleh CP yang hanya diekspresikan oleh sel tumor dan foetal (suatu sistein protease dengan BM 68 kDa) atau melalui TF (suatu glikoprotein transmembran dengan BM 47 kDa) selain diekskresikan sel kanker juga oleh sebagian besar sel normal seperti sel monosit, endotel, sel jaringan ikan dan lainnya. Ekskresi TF di “up regulated” oleh sitokin yang kemudian mengaktivasi faktorVII dan
Peningkatan apoptosis pada endotel sel kanker selama kemoterapi adalah faktor prokoagulasi yang kuat, mempercepat aktifasi platelet,dan perlengketan mikrotrombosis pada jaringan tumor. Aktifasi koagulasi intertumoral dan oklusi mikrovaskular terjadi pada agen kemoterapi dengan cisplatin based kemoterapi. (Slavica Kvolik, 2010).
Kemoterapi. Meningkatkan resiko TE melalui tiga mekanisme :
a. Kerusakan akut dinding pembuluh darah ( misal: bleomisin, carmusin, vinka alkaloid).
b. Non akut pada endotel ( misal doksorubisin).
c. Menurunkan kadar antikoagulan alamiah seperti CMF menurunkan protein C dan S, L-asparaginase menurunkan AT III. (Buku ajar Penyakit Dalam FK UI, 2006)
2.5. Tumor Marker
Lebih lanjut level serum dari marker yang ideal sebaiknya: a) meningkat secara patologis pada munculnya sel keganasan, b) tidak meningkat juga tidak terdapat tanda tanda keganasan, c) berhubungan dengan sisa tumor dan penyebaran/metastase tumor, d) berubah dengan hubungannya dengan evolusi klinis, yang merefleksikan status penyakit, e) mengatisipasi perubahan klinis, contoh dapat mengindikasikan munculnya tumor relaps sebelum munculnya efek klinis. (A. A. Ponomaryova et al, 2011)
Tumor marker tidak hanya signifikan dalam mengenal biologi tumor tetapi juga berguna bagi klinisi dalam menatalaksana pasien dengan tumor paru. Pada lingkungan onkologi, pengunaan tumor marker berguna dalam menentukan diagnosa dan klasifikasi patologi dari tumor, penilaian berkala dari tumor marker juga berguna dalam menilai respos dari terapi kanker paru, dalam menilai perjalanan spontan dari penyakit dan dalam pengawasan akan rekurensi dari tumor itu sendiri.
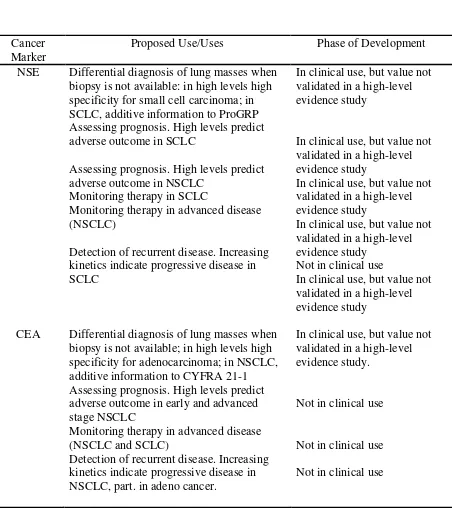
Tabel 2.5. Kegunaan Dan Potensi Kegunaan Tumor Marker Pada Kanker Paru. (Petra Stieber et al, 2006)
Cancer Marker
Proposed Use/Uses Phase of Development
NSE
CEA
Differential diagnosis of lung masses when biopsy is not available: in high levels high specificity for small cell carcinoma; in SCLC, additive information to ProGRP Assessing prognosis. High levels predict adverse outcome in SCLC
Assessing prognosis. High levels predict adverse outcome in NSCLC
Monitoring therapy in SCLC
Monitoring therapy in advanced disease (NSCLC)
Detection of recurrent disease. Increasing kinetics indicate progressive disease in SCLC
Differential diagnosis of lung masses when biopsy is not available; in high levels high specificity for adenocarcinoma; in NSCLC, additive information to CYFRA 21-1 Assessing prognosis. High levels predict adverse outcome in early and advanced stage NSCLC
Monitoring therapy in advanced disease (NSCLC and SCLC)
Detection of recurrent disease. Increasing kinetics indicate progressive disease in NSCLC, part. in adeno cancer.
In clinical use, but value not validated in a high-level evidence study
In clinical use, but value not validated in a high-level evidence study
In clinical use, but value not validated in a high-level evidence study
In clinical use, but value not validated in a high-level evidence study
Not in clinical use
In clinical use, but value not validated in a high-level evidence study
In clinical use, but value not validated in a high-level evidence study.
Not in clinical use
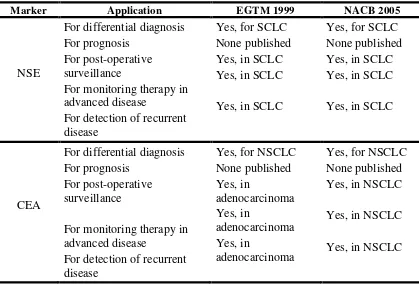
Tabel 2.6. Rekomendasi Pengunaan Tumor Marker Pada Kanker Paru. (Petra Stieber et al, 2006)
Marker Application EGTM 1999 NACB 2005
NSE Cyfra 21-1 Differential diagnosis of lung masses when
biopsy is not available: in high levels high specificity for squamous cell carcinoma; best marker for NSCLC
Assessing prognosis. High levels predict adverse outcome in early and advanced NSCLC
Assessing prognosis. High levels predict adverse outcome in SCLC
Monitoring therapy in advanced disease (NSCLC)
Early prediction of therapy response in advanced disease (NSCLC)
Detection of recurrent disease. Increasing kinetics indicate progressive disease in NSCLC, part in squamous cell cancer.
In clinical use, but value not validated in a high-level evidence study. Recommended for clinical use
Not in clinical use
In clinical use, but value not validated in a high-level evidence study.
Not in clinical use yet,
undergoing further validation
CYFRA
Tabel 2.7. Rekomendasi Penggunaan Tumor Marker Berdasarkan Histology Dari Tumor Dan Aplikasinya. (Petra Stieber et al, 2006)
Histology Before therapy Post-therapy follow-up
Unknown In advanced disease: using the leading marker
CYFRA 21-1 and/or CEA CYFRA 21-1 and/or CEA CYFRA 21-1 and/or CEA NSE
2.6. Peran Tumor Marker Dalam Deteksi Awal Kanker Paru
meningkat pada adenocarcinoma, skuamus sel karsinoma dan KPKBSK. (P.P. Mumbarkar et al, 2006)
Dalam hal diagnostik, tumor marker dipertimbangkan dalam hal diagosa banding dan jenis sel kanker, terutama pada kanker paru yang tidak diketahui asalnya. Terutama pada populasi tanpa kanker atau overlap dengan patologi jenis sel jinak, tingginya CEA, Cyfra 21-1, NSE meningkatkan kecurigaan kita terhadap keganasan. Dari profil tumor marker, tumor marker yang paling meningkat memberikan kemungkinan jenis histologi yang berbeda, seperti CEA pada adenocarcinoma, Cyfra 21-1 dan SCC meningkat pada kanker paru jenis sel skuamus, Cyfra 21- dan NSE pada kanker paru jenis sel bukan sel kecil, NSE dan ProGRP pada kanker paru sel kecil. Tetapi walau nilai yang normal atau meningkat sedikit dari tumor marker tidak mengeksklusikan penyakit tumor dan progresivitasnya. Berdasarkan keterbatasan ini. Penilaian tumor marker pada diagnosa awal mungkin berguna dengan beberapa alasan berikut:
Pola pelepasan tumor marker berdasarkan histologi tumor dan dapat
mengungkap kombinasi dari beberapa komponen histologi.
Tumor marker diekspresikan dan dilepaskan pada diagnosis awal menjadi
marker yang sesuai untuk follow-up monitoring
Cyfra 21-1, CEA, NSE, adalah faktor prognostik bebas dari KPKBSK, sama
Tingkat dan penurunan yang luas dari marker postoperative (post
pembedahan) memberikan informasi yang berguna dalam menilai tumor yang tersisa dan keefektifan dari terapi.
Pada semua tipe KPKBSK termasuk kanker paru jenis sel skuamus, sensitivitas diagnostik paling tinggi dilaporkan oleh Cyfra 21-1. Jika CEA >10 μg/L dan CA125 >100 U/mL, menunjukkan adenocarcinoma dan kanker paru jenis sel bukan sel kecil. Berdasarkan sensitivitas diagnostik tambahan dari CEA dan Cyfra 21-1, kombinasi keduanya berguna dalam diagnostik KPKBSK. (Petra Stieber et al, 2006: P.P. Mumbarkar et al, 2006)
2.6.1. Peran Tumor Marker Dalam Diagnostik
diagnostik yang potensial pada pasien. (Petra Stieber et al, 2006: D. Ferrigno et al,1994)
Dari semua tumor marker yang mengevaluasi KPKBSK, Cyfra 21-1 menjadi marker yang memiliki nilai prognostik pada pasien ini, baik pasien dengan stadium awal yang operatif maupun pasien dengan stadium lanjut. (D. Ferrigno et al,1994; Kostas D.Hatzakis et al,2002)
Perawatan post operatif, efekasi kontrol terapi dan pendeteksian rekurensi penyakit adalah indikasi pemeriksaan tumor marker dalam menentukan kanker paru.Perawatan post bedah, kecepatan dan kelengkapan penurunan nilai dari tumor marker yang menunjukkan outcome lebih lanjut dari pasien. Setelah peningkatan jangka pendek yang segera setelah terapi intervensi, berdasarkan pelepasan marker yang berasal dari kerusakan post operatif dan dari jaringan tumor, penurunan marker ini tergantung waktu paruh marker biologi (half life) dan sel tumor sisa. Pada disfungsi ginjal dan renal dapat memperpanjang waktu paruh dari tumor marker, lamanya klirens marker dan/atau stabilnya nilai tumor marker mengindikasikan adanya sisa tumor sel dan memprediksikan rekurensi tumor. (Petra Stieber et al, 2006; Bo jin et al, 2010)
sensitivitas 52% dan spesifisitas 100%, tetapi korelasi terhadap remisi cukup rendah. Perubahan awal Cyfra 21-1 setelah kemoterapi siklus pertama telah dilaporkan memiliki nilai prediktif yang baik. (Petra Stieber et al, 2006; Bo jin et al, 2010)
Tumor marker sebelum dan sesudah kemoterapi dapat menolong klinisi dalam mengevaluasi respon klinis, pemilihan terapi lanjutan dan prognosis penyakit, terutama pada pasien yang sulit dinilai melalui radiologi. Meningkatnya nilai tumor marker mengindikasikan progresifnya penyakit dan sebagai terapi lanjutan ,regimen kemoterapi harus diganti. (Petra Stieber et al, 2006; Bo jin et al, 2010)
2.6.2. Deteksi dari rekurensi penyakit
Pada pengawasan post terapi keadaan tumor marker adalah indikator yang sensitif pada rekurensi penyakit, dimana nilai marker ini di bandingkan dengan gambaran x-ray. Pada KPKBSK, Cyfra 21-1 memberikan sensitivitas 79% yang lebih lanjut meningkat menjadi 100% pada pasien post operasi level Cyfra 21-1 >3.3 μg/L waktu paruh antara 2 sampai 5 bulan. (Petra Stieber et al, 2006, Ljiljana Vasic,2007))
2.6.3. Pertimbangan atas kegunaan tumor marker:
Tumor marker tunggal, seperti Cyfra 21-1, CEA, NSE sebaiknya tidak
digunakan dalam keperluan skrining baik pada populasi yang tanpa gejala atau pada populasi resiko tinggi ( misalnya pada perokok)
Berdasarkan pada jenis histology, penentuan Cyfra 21-1, CEA, NSE berguna
yang diperoleh sebelum operasi, pada penilaian dari tumor marker ini cukup penting menentukan jenis mana yang paling meningkat
Mem follow-up asimptomatik pasien setelah terapi awal dari kanker paru cukup
kontroversial. Serial tumor marker dapat membantu dalam menilai keberhasilan pengangkatan tumor dan menunjukkan tanda-tanda rekurensi.
CEA dan Cyfra 21-1 dapat dihitung selama terapi sistemik pada KPKBSK dan
NSE pada KPKSK dalam menilai respon terapi dan menilai progresivitas penyakit. Walau penelitian yang lebih lanjut masih diperlukan
Perhatian yang hati-hati terhadap sampel yang diperiksa sangat diperlukan.
Karena setiap tumor marker memiliki perlakuan yang berbeda-beda sebelum pemeriksaan.
Pemeriksaan serial sebaiknya dilakukan dan dengan alat tes yang sama, dimana hasil ini dapat dijadikan laporan laboratorium yang baik pada rekam medis pasien. (Dangfang yu et al, 2013; Bo jin et al, 2010)
2.6.4. Interpretasi Tumor Marker
Cyfra 21-1, fragment dari citokeratin 19, nilai normal <3,3ng/mL, meningkat
pada beberapa penyakit akut dan kronis dan juga pada efusi pleura (<7ng/mL), dan penyakit hati.
Implikasi klinik : utuk menilai keganasan epiteal, mesitelioma, lymphoma dan sarkoma
Neuron Spesific Enolase (NSE), gamma dimer dari enolase enzim, nilai
normal <25mg, meningkat pada penyakit hati dan paru, pendarahan cerebral Implikasi klinik : untuk menilai KPKSK, tumor carcinoid, neuro blastoma, wilms tumor.
Carcino Embryonic antigen (CEA), salah satu jenis glycoprotein, nilai normal
<5ng/mL, meningkat pada 5 % perokok, beberapa tumor jinak (<15ng/mL) Implikasi klinik : untuk menilai keganasan epiteal pada keganasan pada saluran cerna dan paru. (Petra Stieber et al, 2006; Bo jin et al, 2010)
2.7. Hubungan Faal Hemostasus dan Tumor Marker pada Kemoterapi
Kebanyakan agen kemoterapi akan menyebabkan ketidakseimbangan aktifitas koagulasi oleh karena agen kemoterapi yang menginduksikan kerusakan endotelial sel kanker dan menurunkan sintesis faktor-faktor koagulasi pada hati dan juga adanya disfungsi dari platelet. (Slavica Kvolik, 2010)
mikrovaskular terjadi pada agen kemoterapi dengan cisplatin based kemoterapi. (Slavica Kvolik, 2010). Disebutkan juga peningkatan dari nilai faal hemostasis berhubungan dengan keadaan kanker paru yang telah lanjut.
Pada pengawasan post terapi keadaan tumor marker adalah indikator yang sensitif pada rekurensi penyakit, dimana nilai marker ini di bandingkan dengan gambaran x-ray. Ketika mengamati efekasi kemoterapi dan radioterapi dengan tumor marker, penurunan sebagian sering berkorelasi dengan respon terapi dimana peningkatan atau penurunan berhubungan dengan progresivitas penyakit Cyfra 21-1 menjadi marker yang memiliki nilai prognostik pada pasien ini, baik pasien dengan stadium awal yang operatif maupun pasien dengan stadium lanjut
Belum ada penelitian yang mengambarkan secara nyata hubungan antara kedua nilai variabel tersebut diatas. Wakaupun demikian dari data diatas dimana pada keadaan penyakit yang sudah lanjut didapati nilai faal hemostasis dan tumor marker meningkat sehingga dimungkinkan adanya hubungan antara kedua variabel tersebut dalam hal prognostik pasien setelah kemoterapi
2.8. Pemeriksaan Penyaring Untuk Fungsi Hemostasis Dan Tumor Marker
Kelainan hemostasis dengan pendarahan abnormal dapat merupakan: kelainan pembuluh darah, trombositopenia, dan kelainan koagulasi. Sejumlah pemeriksaan sederhana dapat dikerjakan untuk menilai fungsi trombosit, pembuluh darah, serta komponen koagulasi dalam hemostasis. (Pedoman Interpretasi Data Klinik, 2011)
prothrombin time, PT) activated partial thromboplastin time (aPTT), agregasi trombosit. (Pedoman Interpretasi Data Klinik, 2011)
Pemeriksaan penyaring sistem koagulasi. Pemeriksaan penyaring meliputi penilaian jalur intrinsik dan ekstrinsik dari sistem koagulasi dan perubahan dari fibrinogen menjadi fibrin.
Trombosit (platelet),Trombosit adalah elemen terkecil dalam pembuluh darah.
Trombosit diaktivasi setelah kontak dengan permukaan dinding endotelia. Trombosit terbentuk dalam sumsum tulang. Masa hidup trombosit sekitar 7,5 hari. Sebesar 2/3 dari seluruh trombosit terdapat disirkulasi dan 1/3 nya terdapat di limfa.
Waktu prothrombin (PT) mengukur faktor.VII,X,V, prothrombin dan
aPTT mengukur faktor.VIII, IX,XI dan XII, selain faktor.V,X, prothrombin
dan fibrinogen. Nilai normal aPTT antara 30-40 detik.Perpanjangan dari PT dan aPTT yang disebabkan karena defisiensi faktorkoagulasi dapat dikoreksi dengan penambahan plasma normal kedalam plasma yang diperiksa. Apabila tidak dapat dikoreksi atau hanya sebagian terkoreksi, dicurigai kemungkinan adanya inhibitor koagulan.
Waktu thrombin (thrombin time, TT) cukup sensitif untuk menilai defisiensi
fibrinogen atau adanya hambatan terhadap thrombin. Nilai normal antara 14-16 detik.
D-dimer adalah degradasi terkecil dari produk yang dihasilkan dari aktivasi
proteolitik plasmin, dan indicator sensitif pada aktivitas fibrinolitik. (Berna Komurcuoglu et al,2011: Pedoman Interpretasi Data Klinik, 2011)
2.8.1. Interpretasi Faal Hemostasis
Thrombosis, Nilai normal : 170 – 380. 103/mm3 SI : 170 – 380. 109/L
Implikasi klinik:
o Trombositosis berhubungan dengan kanker, splenektomi, polisitemia vera trauma, sirosis, myelogeneus, stres dan arthritis reumatoid. o Trombositopenia berhubungan dengan idiopatik trombositopenia
o Obat seperti heparin, kinin, antineoplastik, penisilin, asam valproat dapat menyebabkan trombositopenia.
o Penurunan trombosit di bawah 20.000 berkaitan dengan perdarahan spontan dalam jangka waktu yang lama, peningkatan waktu perdarahan petekia/ekimosis.
o Asam valproat menurunkan jumlah platelet tergantung dosis.
o Aspirin dan AINS lebih mempengaruhi fungsi platelet daripada jumlah platelet.
Waktu prothrombin (PT), Nilai normal: 10 – 15 detik (dapat bervariasi
secara bermakna antar laboratorium) Implikasi klinik:
o Nilai meningkat pada defisiensi faktor tromboplastin ekstrinsik, defi siensi vit.K, DIC (disseminated intravascular coagulation), hemorrhragia pada bayi baru lahir, penyakit hati, obstruksi bilier, absorpsi lemak yang buruk, lupus, intoksikasi salisilat. Obat yang perlu diwaspadai: antikoagulan (warfarin, heparin)
Nilai menurun apabila konsumsi vit.K meningkat. (aPTT (activated Partial
Thromboplastin Time)Nilai normal : 21 – 45 detik (dapat bervariasi antar laboratorium)
o Meningkat pada penyakit von Willebrand, hemofilia, penyakit hati, defisiensi vitamin K, DIC. Obat yang perlu diwaspadai: heparin, streptokinase, urokinase, warfarin)
o Menurun pada DIC sangat awal, hemorrhagia akut, kanker meluas (kecuali mengenai hati)
Waktu Thrombin (Thrombin Time/TT),Nilai normal : dalam rentang 3
detik dari nilai kontrol (nilai kontrol: 16-24 detik), bervariasi antar laboratorium.
Implikasi klinik:
Meningkat pada DIC, fibrinolisis, hipofibrinogenemia, multiple
mieloma,uremia, penyakit hati yang parah. Obat yang perlu diwaspadai: heparin, low-molecular-weight heparin/LMWH, urokinase, streptokinase,asparaginase. 60% kasus DIC menunjukkan TT meningkat. PemeriksaanTT kurang sensitif dan spesifik untuk DIC dibandingkan pemeriksaan lain Menurun pada hiperfibrinogenemia, hematokrit >55%. D – Dimer, Nilai normal: Negatif atau < 0,5 mcg /mL atau < 0,5 mg/L
SIPeningkatan palsu: pada kondisi titer reumatoid faktor yang tinggi, adanyatumor marker (penanda) CA-125, terapi estrogen dan kehamilan normal.
2.9. Kerangka Teori
Menilai tanda koagulasi darah dan kemungkinan terapi tumor yang kurang efektif atau rekurensi tumor Hiperkoagulasi terjadi pada pasien
kanker paru. Dimana Platelet, PT, aPTT, TT dan D-dimer mengalami peningkatan.
Bila Platelet, PT, aPTT, TT dan D-dimer t dapat digunakan dalam penilaian hipokoagulasi yang biasanya diikuti perbaikan klinis pada pasien post hiperkoagulasi.
2.10. Kerangka Konsep
(Post Kemoterapi) Penilaian RECIST
Penilaian Klinis Pasien Pemilihan terapi