TINJAUAN PUSTAKA
Ubi Jalar Ungu (Ipomoea batatas L. Poir)
Ubi jalar ungu merupakan salah satu jenis ubi jalar yang banyak di temui di Indonesia selain yang berwarna putih, kuning, dan merah. Ubi jalar ungu jenis Ipomoea batatas L. Poir memiliki warna ungu yang cukup pekat pada daging umbinya, sehingga banyak menarik perhatian. Warna ungu pada ubi jalar disebabkan oleh adanya pigmen ungu antosianin yang menyebar dari bagian kulit sampai dengan daging ubinya. Konsentrasi antosianin inilah yang menyebabkan beberapa jenis ubi ungu mempunyai gradasi warna ungu yang berbeda (Ginting, dkk., 2011).
Dalam budidaya dan usaha pertanian, ubi jalar tergolong tanaman palawija. Tanaman ini membentuk umbi di dalam tanah. Umbi itulah yang menjadi produk utamanya. Menurut Juanda dan Cahyono (2000), tanaman ubi jalar dapat diklasifikasikan sebagai berikut:
Divisio : Spermatophyta (tumbuhan berbiji) Subdivisio : Angiospermae (berbiji tertutup)
Kelas : Dicotyledoneae (berbiji belah atau berkeping dua) Ordo : Convolvulales
Famili : Convolvulaceae (kangkung-kangkungan)
Genus : Ipomoea
Adapun gambar ubi jalar ungu dapat dilihat pada Gambar 1.
Gambar 1. Ubi jalar ungu
Keragaman sifat tanaman ubi jalar dapat dibedakan berdasarkan penampilan fisik dan usia tanam. Berdasarkan tekstur daging umbi, ubi jalar dapat dibedakan dalam dua golongan, yaitu umbi berdaging lunak karena banyak mengandung air dan umbi berdaging keras karena banyak mengandung pati. Ubi jalar juga dibedakan satu sama lain berdasarkan warna kulit, warna daging, bentuk daun dan warna batang (Sarwono, 2005).
Ayamurasaki dan Yamagawamurasaki adalah dua varietas ubi jalar berwarna ungu asal Jepang yang telah diusahakan secara komersial di beberapa daerah di Jawa Timur dengan potensi hasil 15-20 ton/ha. Beberapa varietas lokal juga memiliki daging umbi berwarna ungu, hanya intensitas keunguannya masih di bawah kedua varietas tersebut (Ginting, dkk., 2011).
Kandungan Gizi Ubi Jalar
kadar protein dan lemaknya relatif rendah, sehingga konsumsinya perlu yang telah dimasak jumlahnya meningkat bila dibandingkan dengan jumlah gula pada ubi jalar mentah (Sulistiyo, 2006).
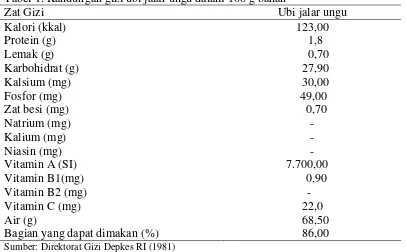
Ubi jalar kaya akan serat, mineral, vitamin dan antioksidan seperti asam fenolat, antosianin, tokoferol dan betakaroten. Selain bekerja sebagai antioksidan, senyawa karotenoid dan fenolat juga menjadikan ubi jalar menjadi menarik dengan warna krem, kuning, oranye dan ungu. Ubi jalar ungu mengandung 0,4-0,6 mg antosianin/g berat segar (Antarlina, 1993). Kandungan gizi ubi jalar ungu dapat dilihat pada Tabel 1.
Tabel 1. Kandungan gizi ubi jalar ungu dalam 100 g bahan
Kandungan protein kasar ubi jalar berkisar dari 3-7 % berat kering. Protein pada ubi jalar terdistribusi secara merata pada umbinya. Tetapi secara umum asam amino mempunyai jumlah yang cukup banyak. Asam amino essensial ubi jalar adalah lisin, metionin, sistein dan treonin (Sulistiyo, 2006). Lemak merupakan komponen yang sangat kecil dalam ubi jalar dengan kandungan sebesar 0,29-2,7 % berat kering. Asam linoleat merupakan asam lemak terbanyak diikuti dengan asam palmitat, linolenat, dan stearat (Kadarisman dan Sulaeman, 1993).
Ubi jalar ungu memiliki rasa yang manis mengandung antosianin yang berfungsi sebagai antioksidan, antimutagenik, hepatoprotektif, antihipertensi dan antihiperglisemik (Suda, dkk., 2003). Kandungan antosianin pada ubi jalar ungu lebih tinggi daripada ubi jalar yang berwarna putih, kuning, dan jingga. Di antara ubi jalar ungu, kultivar Ayamurasaki dan Murasakimasari merupakan sumber pigmen antosianin dengan produksi dan kestabilan warna yang tinggi (Suardi, 2005).
Pengeringan Ubi Jalar
Pengeringan adalah salah satu cara yang dilakukan untuk tujuan mengurangi kadar air bahan pangan sehingga diperoleh hasil akhir yang kering dan menambah masa simpan bahan pangan. Air dari dalam bahan pangan akan menguap akibat terjadinya proses pindah panas dan pindah masa. Pengeringan ini dapat dilakukan dengan alat pengering atau pengeringan secara alami dengan memanfaatkan sinar matahari secara langsung. Pemilihan metode pengeringan yang paling baik harus dengan memperhatikan segi kualitas, ekonomi serta karakteristik produk yang akan dihasilkan sehingga diinginkan oleh konsumen (Koswara, 2009a).
Tepung Ubi Jalar Ungu
Tepung ubi jalar merupakan produk ubi jalar setengah jadi yang dapat digunakan sebagai bahan baku dalam industri makanan dan juga mempunyai daya simpan yang lebih lama. Tepung ubi jalar dibuat dari sawut atau chips kering dengan cara digiling dan diayak (Richana, 2012). Menurut Murtiningsih dan Suyanti (2011), mengolah ubi jalar ungu menjadi tepung merupakan salah satu cara untuk penyimpanan dan pengawetan ubi jalar ungu. Ubi jalar ungu dalam bentuk tepung juga akan mempermudah pemanfaatannya sebagai bahan baku industri pangan.
Masalah utama yang dihadapi dalam pembuatan tepung ubi jalar ungu yaitu reaksi pencoklatan enzimatis. Warna ubi jalar ungu akan menjadi kusam yang disebabkan oleh enzim fenolase. Untuk menghambat reaksi pencoklatan enzimatik, maka ubi ungu perlu dikukus untuk merusak struktur enzim fenolase tersebut. Dengan rusaknya struktur enzim fenolase tersebut, maka reaksi pencoklatan enzimatis pada ubi ungu dapat dihambat (Richana, 2012).
Dalam proses pembuatan tepung, hal yang paling penting adalah proses pengeringan. Pengeringan ini berfungsi untuk menguapkan air dari dalam bahan pangan sehingga umur simpan bahan pangan dapat lebih lama. Secara umum, sebelum dilakukan proses pengeringan maka ubi jalar terlebih dahulu diberikan larutan natrium metabisulfit untuk mencegah proses pencoklatan pada irisan ubi (Koswara, 2009b).Ubi ungu yang telah dijadikan tepung ubi ungu memiliki warna ungu yang lebih cerah.
Namun, belum ada standar mutu nasional untuk produk tepung ubi jalar di Indonesia. Berdasarkan hasil-hasil penelitian yang ada (baik di dalam maupun luar negeri) dan standar yang ditetapkan oleh perusahaan eksportir, maka rekomendasi penetapan persyaratan standar mutu tepung ubi jalar di Indonesia dapat dilihat pada Tabel 2.
Tabel 2. Rekomendasi penetapan persyaratan standar mutu tepung ubi jalar
Parameter Tepung ubi jalar
Penggunaan tepung ubi jalar dalam pembuatan produk pangan sudah banyak dilakukan di Indonesia. Beberapa penelitian yang telah banyak dilakukan yang menggunakan tepung ubi jalar sebagai substitusi tepung terigu dalam pembuatan beberapa produk patiseri dan bakery (Moehyi, 1992).
Karakteristik Fisik Kimia Tepung Ubi Jalar
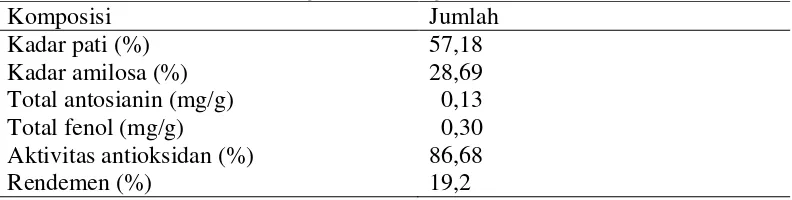
selama ± 1 jam. Hal ini dilakukan untuk mencegah adanya kontak antara bahan dengan udara, yang dapat menyebabkan terjadinya reaksi pencoklatan (Widowati, 2009). Komposisi kimia tepung ubi jalar dapat dilihat pada Tabel 3. Tabel 3. Komposisi kimia tepung ubi jalar ungu
Komposisi Jumlah
Reaksi pencoklatan biasa terjadi pada buah atau sayuran yang mengalami perlakuan mekanis yang dapat menyebabkan perubahan fisik, flavour, dan gizi. Pada umumnya reaksi pencoklatan dibagi menjadi dua yaitu pencoklatan enzimatis dan pencoklatan non-enzimatis. Reaksi pencoklatan enzimatis banyak terjadi pada buah dan sayuran terutama jika terjadi dekstrusi jaringan. Reaksi pencoklatan non-enzimatis terjadi pada pengolahan bahan pangan yang menggunakan panas dan selama penyimpanan bahan pangan (Koeswara 1991). Pencoklatan non-enzimatis terdiri dari reaksi maillard, reaksi karamelisasi, dan reaksi pencoklatan akibat oksidasi vitamin C (Winarno 1993).
udara akan menyebabkan pencoklatan. Hal tersebut dikarenakan senyawa fenol teroksidasi secara enzimatis menjadi o-kuinon yang secara cepat mengalami polimerisasi membentuk pigmen coklat (melanin).
Tingkat reaksi pencoklatan enzimatis semakin tinggi jika konsentrasi fenolik (subtrat polifenol oksidase) pada buah dan sayuran tinggi dan konsentrasi asam askorbat yang rendah (Bauernfeind dan Pinkert 1990). Menurut Winarno (2002), banyak sekali senyawa fenolik yang dapat bertindak sebagai subtrat dalam reaksi pencoklatan enzimatis pada buah dan sayuran. Senyawa-senyawa fenolik tersebut diantaranya adalah katekin dan turunannya, seperti tirosin, asam kafeat, asam klorogenat, dan leukoantosianin.
Pada umumnya reaksi oksidasi fenol dikatalisis oleh enzim kresolase dan katekolase. Kresolase mengkatalis oksidasi monofenol (tirosin dan kresol) dengan mengubah gugus hidroksil pada posisi ortonya sehingga menjadi orto difenol. Katekolase menghilangkan dua atom hidrogen pada orto-difenol membentuk ortoquinon (Park dan Luh, 1985).
Menurut Eskin, dkk., (1991), katekolase mengkatalisis reaksi oksidasi ortodifenol menjadi orto-quinon, orto-quinon dengan orto-difenol akan terhidroksilasi membentuk trihidroksi benzena kemudian trihidroksi benzena bereaksi dengan orto-quinon membentuk hidroksi quinon yang akhirnya berpolimerisasi membentuk warna merah kemudian coklat. Pembentukan senyawa melanin dari orto-quinon berlangsung secara spontan dan tidak bergantung pada adanya enzim atau oksigen.
oksigen, ion logam, pH, dan suhu (Lisinska dan Leszczynski 1989). Reaksi pencoklatan enzimatis dapat dikontrol oleh inaktivasi enzim polifenol oksidase, pengeluaran oksigen, modifikasi komponen fenolik, penambahan agen pereduksi, interaksi dengan logam tembaga, mereduksi atau menjerat senyawa quinon,
bahkan memindahkan produk akhir dari reaksi pencoklatan (Shahidi dan Naczk 1995).
Enzim polifenol oksidase dapat diinaktivasi dengan perlakuan panas dengan suhu 90 oC. Metode lain untuk memperlambat reaksi pencoklatan enzimatis adalah dengan menurunkan pH jaringan lebih kecil daripada pH optimum enzim polifenol oksidase yang berkisar antara 4-7. Asam yang dapat ditambahkan untuk menurunkan pH adalah asam sitrat, malat, askorbat, dan asam fosfat (Shahidi dan Naczk 1995).
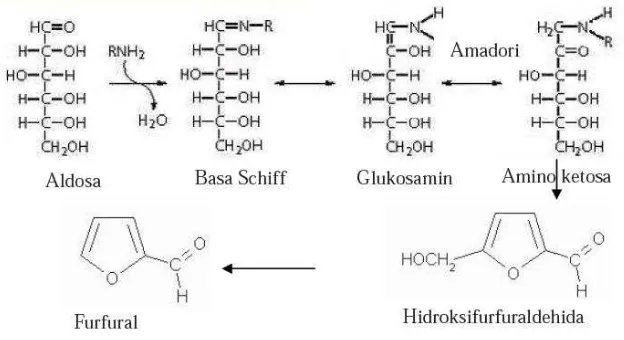
Mekanisme reaksi pencoklatan non-enzimatis berlangsung sangat kompleks dan dalam reaksi ini tidak diperlukan oksigen untuk memulai prosesnya tetapi harus ada senyawa amino. Pembentukan warna coklat yang diakibatkan oleh reaksi gula dengan asam amino dimulai dengan pembentukan basa schiff’s, dimana senyawa ini bersifat labil yang selanjutnya akan mengalami siklisasi membentuk senyawa glikosilamine (N-substituted glycosylamine). Selanjutnya senyawa ini mengalami isomerisasi dan mengalami penyusunan amadori, serta mengalami berbagai perubahan komplek sehingga dihasilkan senyawa melanoidin yang merupakan pigmen yang berwarna coklat. Menurut Winarno (2002), reaksi maillard berlangsung melalui beberapa tahapan sebagai berikut:
- Suatu aldosa bereaksi bolak balik dengan asam amino atau dengan gugus amino dari protein sehingga menjadi amino ketosa.
- Dehidrasi dari hasil reaksi amadori membentuk turunan-turunan furfuraldehid, misalnya heksosa diperoleh hidroksimetil furfural.
- Proses dehidrasi selanjutnya menghasilkan hasil antara metal L-dikarbonil yang diikuti penguraian menghasilkan reduktor-reduktor dan L-dikarboksil seperti metilglioksal, asetol dan diasetil.
Gambar 2. Tahapan reaksi maillard (Winarno 2002)
Cara-cara yang dapat dilakukan untuk mencegah pencoklatan enzimatis menurut Apandi (1984) adalah:
- Aplikasi panas, panas yang bisa diaplikasikan berupa proses blanching, yaitu suatu bagian pengolahan pangan dengan menggunakan uap atau air panas. - Aplikasi SO2 dan sulfit, natrium metabisulfit dan natrium bisulfit sebagai
inhibitor fenolase yang kuat.
- Pencegahan kontak dengan oksigen, cara yang biasa digunakan adalah merendam bahan yang sudah dikupas kedalam air sebelum dimasak sehingga tidak terjadi kontak langsung dengan udara.
- Aplikasi asam, asam yang biasa digunakan adalah asam yang biasa terdapat dalam jaringan tanaman seperti asam askorbat, sitrat dan malat.
Natrium Metabisulfit (Na2S2O5)
dapat menghambat pertumbuhan bakteri, kapang dan khamir (Chichester and Tanner, 1975).
Penggunaan SO2 tidak diizinkan dalam makanan yang mengandung tiamin dalam jumlah yang besar, karena vitamin ini dirusak oleh SO2. Konsentrasi maksimum SO2 yang diizinkan di Amerika Serikat 350 ppm. SO2 dipakai juga secara luas dalam buah kering, yang konsentrasinya dapat mencapai 2000 ppm. Pemakaian lain ialah dalam sayur kering dan produk kentang kering (deMan, 1997). Batas maksimum penggunaan SO2 dalam makanan yang dikeringkan, di Amerika Serikat telah ditetapkan oleh Food Drug Administration, yaitu antara 2000-3000 ppm.
Sulfit digunakan dalam bentuk gas SO2, garam Na atau K-sulfit, bisulfit dan metabisulfit. Bentuk efektifnya sebagai pengawet adalah asam sulfit yang tidak terdisosiasi dan terutama terbentuk pada pH di bawah 3. Selain sebagai pengawet, sulfit dapat berinteraksi dengan gugus karbonil. Hasil reaksi itu akan mengikat melanoidin sehingga mencegah timbulnya warna cokelat. Sulfur dioksida juga dapat berfungsi sebagai antioksidan (Syarief dan Irawati, 1988).
Molekul sulfit lebih mudah menembus dinding sel mikroba bereaksi dengan asetaldehid membentuk senyawa yang tidak dapat difermentasi oleh enzim mikroba, mereduksi ikatan disulfit enzim, dan bereaksi dengan keton membentuk
hidroksi sulfonat yang dapat menghambat mekanisme pernapasan (Winarno, 1993). Banyaknya SO2 yang ditambahkan ke makanan mempunyai
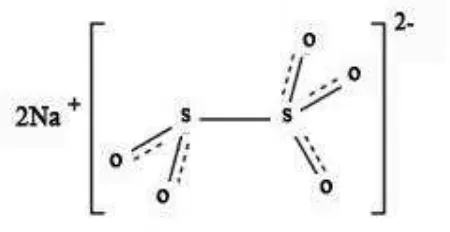
SO2 bersifat atsiri dan mudah hilang ke atmosfer, konsentrasi residu akan jauh lebih rendah daripada jumlah yang dipakai semula (deMan, 1997). Jumlah penyerapan dan penahanan (residu) SO2 dalam bahan yang dikeringkan dipengaruhi oleh varietas, kemasakan dan ukuran bahan, konsentrasi SO2 yang digunakan, waktu sulfuring, suhu, kecepatan aliran udara dan kelembaban udara selama pengeringan serta keadaan penyimpanan (Susanto dan Saneto, 1994). Berikut ini merupakan rumus bangun dari natrium metabisulfit dapat dilihat pada Gambar 3. dibawah ini:
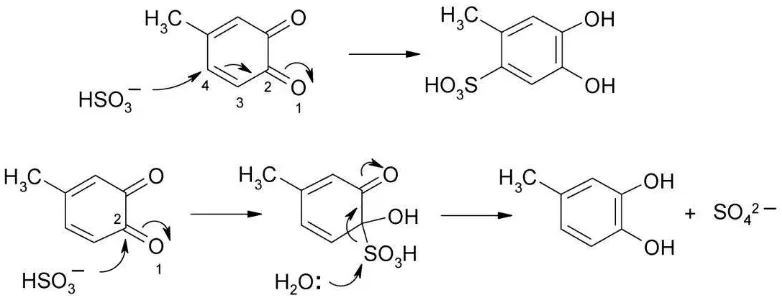
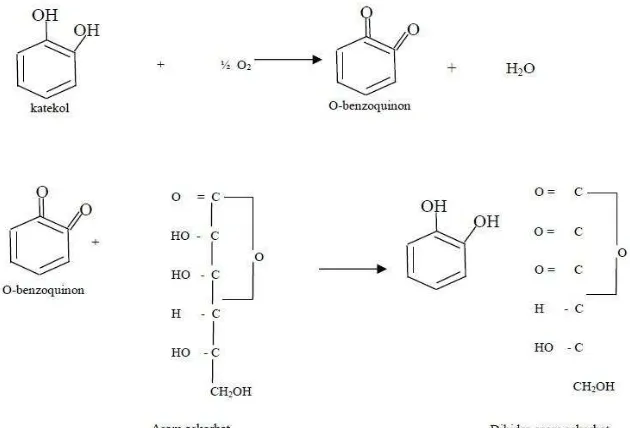
Terbentuknya reaksi pencoklatan diakibatkan karena reaksi oksidasi dengan udara karena pengaruh enzim pencoklatan yang terdapat dalam bahan pangan. Pencoklatan enzimatis adalah reaksi antara oksigen dan senyawa fenol yang dikatalis oleh polifenol oksidase. Untuk menghindarinya, setelah buah dikupas dan diiris hendaknya direndam dalam larutan sodium metabisulfit 0,3 % selama lebih kurang satu jam (Widowati, 2009). Reaksi pencoklatan dapat dicegah dengan penambahan sulfit sebelum bahan dikeringkan dapat dilihat pada Gambar 4.
Gambar 4. Reaksi sulfit dalam mencegah pencoklatan (Danilewicz, dkk., 2008) Gas SO2 (sulfur dioksida) dapat diberikan dalam bentuk sulfit, bisulfit, atau metabisulfit, selain bersifat sebagai zat pemucat, sulfit juga dapat mengurangi jumlah mikroba, menginaktifkan enzim yang dapat menyebabkan browning enzimatik, mencegah reaksi browning non-enzimatik, serta bekerja sebagai agen pereduksi (Winarno, 1993).
Natrium metabisulfit (Na2S2O5) merupakan inhibitor yang kuat untuk mencegah terjadinya browning, pertumbuhan bakteri, dan sebagai antioksidan.
Penambahan natrium metabisulfit harus sesuai standar yang diterapkan BPOM No 36 2013 yaitu tidak melebihi 200 mg-1gr/kg untuk produk pangan.
mengawetkan bahan pangan kering akan cenderung mengakibatkan kadar air rendah pada bahan tersebut.
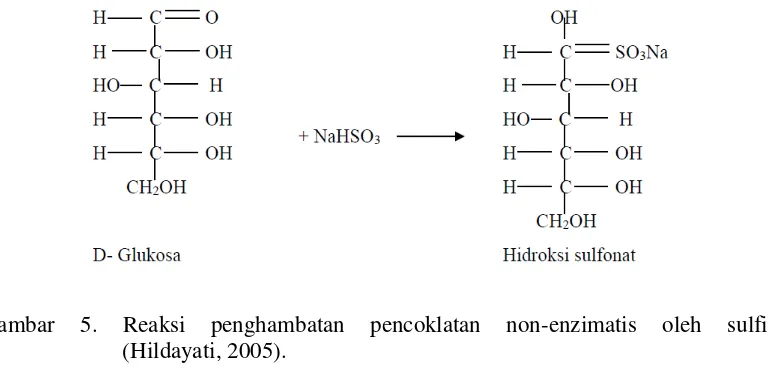
Senyawa sulfit dapat menghambat reaksi pencoklatan enzimatis, karena adanya hambatan terhadap enzim fenolase sangat tinggi dan bersifat irreversibel, sehingga tidak memungkinkan terjadinya regenerasi fenolase (Eskin dkk., 1991). Menurut Braverman (1990), mekanisme penghambatan reaksi pencoklatan non-enzimatis oleh senyawa sulfit adalah reaksi antara bisulfit dengan gugus aldehid dari gula sehingga gugus aldehid tersebut tidak mempunyai kesempatan untuk bereaksi dengan asam amino.
Dengan demikian sulfit mencegah konversi D-glukosa menjadi 5-hidroksi-metil-2-furfural (HMF). Senyawa ini merupakan senyawa antara yang akan bereaksi dengan gugus amino dari protein atau asam amino membentuk pigmen coklat melanoidin. Penambahan natrium metabisulfit selain sebagai pengawet juga dapat mencegah reaksi pencoklatan dengan cara berinteraksi dengan gugus karbonil, dimana hasil reaksi tersebut dapat mengikat melanoidin sehingga mencegah terbentuknya warna coklat. Reaksi penghambatan pencoklatan non-enzimatis oleh sulfit dapat dilihat pada Gambar 5.
Natrium Klorida (NaCl)
Natrium klorida adalah garam yang secara fisik berupa benda padatan berwarna putih berbentuk kristal yang merupakan kumpulan senyawa dengan bagian terbesar Natrium klorida (>80 %) serta senyawa lainnya seperti magnesium klorida, magnesium sulfat, kalsium klorida, dan lain-lain. Garam mempunyai sifat atau karakteristik higroskopis yang berarti mudah menyerap air, bulk density (tingkat kepadatan) sebesar 0,8 - 0,9 dan titik lebur pada tingkat suhu 801 oC (Burhanuddin, 2001).
Perendaman umbi dengan menggunakan natrium klorida (NaCI) berperan dalam menghambat aktivitas enzim yang dapat menimbulkan reaksi pencoklatan. Penggunaan NaCI ini merupakan alternatif lain untuk memanfaatkan pencegah pencoklatan selain sulfit. NaCI merupakan suatu bentuk kristal berwama putih. NaCI bersifat larut dalam air dan dalam air terpecah menjadi ion Cl- dan Na+. Ion Na+ akan diikat oleh asam tanat membentuk natrium tanat yang larut dalam air, sehingga kandungan tanin dalam bahan akan berkurang dan reaksi pencoklatan dapat dicegah (Suprapto, 2006).
air terurai menjadi ion-ion Na+dan Cl-. Ion-ion tersebut bersifat magnet. Ion Na+ menarik ion-ion yang bermuatan negatif dan ion Cl- menarik ion-ion yang bermuatan positif.
Asam Askorbat
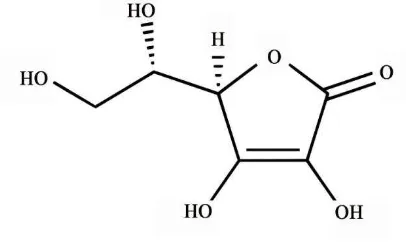
Asam askorbat atau vitamin C adalah jenis asam larut air, tidak berflavor, dan tidak bersifat korosif terhadap logam. Rumus bangun asam askorbat dapat dilihat pada Gambar 6.
Gambar 6. Rumus bangun asam askorbat (2-oxo-L-treo-hexon-1,4-lakton- 2,3-enediol) (Wikipedia, 2012)
Asam askorbat lebih efektif dalam menghambat aktivitas enzim polifenol oksidase jika dibandingkan dengan asam sitrat dan asam malat. Asam askorbat tidak berflavor sehingga tidak mengganggu produk akhir yang dihasilkan, selain itu tidak bersifat korosif terhadap logam serta diketahui dengan baik merupakan vitamin C (Eskin, dkk., 1971). Asam askorbat sangat sensitif terhadap suhu, kadar garam, gula, dan rasio antara asam dehidroaskorbat dan asam askorbat, asam askorbat juga labil terhadap cahaya, basa dan oksidasi.
molekul air. Asam 2,3 diketoglukonat akan membentuk furfural dengan melepaskan CO2. Selanjutnya akan membentuk pigmen yang berwarna coklat (Morsy, 1991).
Asam askorbat merupakan senyawa pengkelat yang bekerja dengan cara mengikat logam yang ada di dalam umbi sehingga logam tersebut terjerat membentuk logam yang tidak dapat terionisasi dan tidak dapat berperan aktif dalam reaksi dengan substrat fenol sehingga senyawa ini mencegah pembentukan warna gelap. Ion Cu+ dan Fe3+ terbukti dapat mengaktifkan enzim polifenol oksidase (Mazza and Qi, 1991).
Perlakuan asam adalah metode yang sering digunakan secara luas dalam mencegah reaksi pencoklatan enzimatis, karena prosesnya yang dapat menurunkan pH sehingga dapat menurunkan aktivitas enzim polifenol oksidase. pH optimum enzim polifenol oksidase berkisar antara 4-8 dan di bawah pH 3 tidak ada aktivitas enzim polifenol oksidase, jenis asam yang biasa digunakan sebagai penghambat aktivitas enzim polifenol oksidase antara lain asam askorbat, asam malat, asam sitrat, dan asam fosfat (Eskin, dkk., 1971).
Dalam reaksi pencoklatan enzimatis, asam askorbat berperan sebagai antioksidan yang menghabiskan oksigen pada permukaan. Selain itu secara langsung dengan mereduksi o-quinon kembali menjadi o-difenol, bereaksi dengan quinon-quinon pada komponen yang mengalami perubahan warna dan menekan kerja enzim (Zawitowski, dkk., 1991). Secara tidak langsung asam askorbat mereduksi ion logam Cu2+ menjadi Cu+, asam askorbat termasuk sebagai pereduktor logam yang kuat.
Asam askorbat mereduksi o-quinon dengan 2 gugus hidroksilnya (pada C2 dan C3), sehingga o-quinon yang dapat berperan sebagai oksidator yang baik, asam askorbat sebagai pereduksi mengakibatkan reaksi oksidasi-reduksi berlangsung relatif cepat. Reaksi ini mencegah terbentuknya polimer o-quinon. Oksigen dapat mengoksidasi vitamin C menghasilkan asam dehidroaskorbat dan hidrogen peroksida. Oksigen yang telah bereaksi dengan vitamin C mencegah oksidasi o-difenol. Dengan tidak terbentuknya o-quinon sebagai hasil oksidasi berarti pencoklatan dapat dicegah (Schuler, 1990).
Menurut Eskin dkk., 1971 penghambat reaksi pencoklatan yang efektif adalah asam askorbat. Asam askorbat juga sebagai antioksidan dan mampu mereduksi o-quinon menjadi o-dihidroksi fenol alami. Reaksi yang terjadi adalah sebagai berikut:
o-difenol + ½ O → o-quinon + H2O
o-quinon + asam askorbat → o-difenol + asam dehidroaskorbat Asam askorbat + ½ O2 → asam dehidroaskorbat + H2O
asam askorbat (Fennema, 1996). Reduksi o-quinon menjadi o-difenol dan oksidasi asam askorbat menjadi dehidro asam askorbat dapat dilihat pada Gambar 7.
Gambar 7. Reduksi o-quinon menjadi o-difenol dan oksidasi asam askorbat menjadi dehidro asam askorbat (Eskin, 1991)
Mekanisme kerja asam askorbat tidak menghambat secara langsung seperti halnya sulfit, melainkan melalui mereduksi quinon yang terbentuk menjadi substrat polifenol semula. Proses ini disertai dengan penurunan aktivitas enzim, oleh karena itu dikenal juga sebagai reaksi inaktivasi (Desrosier, 1988). Asam askorbat memiliki aktivitas tinggi sebagi inhibitor proses browning enzimatis karena kemampuannya mereduksi quinon kembali menjadi senyawa fenol sebelum mengalami reaksi lebih lanjut menjadi pigmen. Bahan-bahan yang dapat digunakan untuk mencegah reaksi pencoklatan adalah cystein, glutathion, sulfonamides, asam sulfat, sodium sulfat, sodium klorida, asam hidoklorik, sodium bisulfit dan asam askorbat.
memperlambat reaksi pencoklatan. Perendaman dalam larutan asam askorbat berfungsi untuk mencegah reaksi pencoklatan enzimatis. Hal ini disebabkan protein akan terdenaturasi pada kondisi asam (pH rendah), sehingga enzim menjadi inaktif. Asam askorbat termasuk kelompok antioksidan oksigen scavenger karena kemampuannya untuk mengikat oksigen sehingga tidak mendukung reaksi oksidasi.
Penelitian Sebelumnya
Penelitian Widiyowati (2007), menghasilkan kadar natrium bisulfit yang digunakan sebagai larutan perendam irisan ubi jalar kuning mempengaruhi kadar protein dan vitamin C pada tepung ubi jalar kuning yang dihasilkan. Makin tinggi kadar natrium bisulfit dalam larutan perendam dapat menghambat penurunan kadar protein dan vitamin C dari tepung yang dihasilkan. Lama perendaman irisan ubi jalar kuning memberikan pengaruh yang berbeda terhadap kadar protein dan kadar vitamin C. Makin lama perendaman maka penurunan kadar protein makin dapat ditekan, sebaliknya menghasilkan efek kehilangan vitamin C yang semakin besar. Penggunaan larutan perendaman dengan kadar natrium bisulfit sebesar 0,3 % dan lama perendaman 10 menit merupakan metode terbaik karena dapat mempertahankan kadar protein hingga 50 % dari kadar protein ubi jalar kuning segar.
turun. Besarnya konsentrasi natrium metabisulfit (Na2S2O5) tidak berpengaruh terhadap kadar lemak, kadar protein dan daya serap air. Lama waktu perendaman berpengaruh dalam meningkatkan kelarutan dan daya dispersi serta menurunkan kadar abu, lemak, serat kasar dan β-karoten. Lama waktu perendaman tidak berpengaruh terhadap daya serap air dan kadar protein. Peningkatan lama waktu perendaman akan menurunkan kadar abu, lemak, serat kasar dan β-karoten, tetapi akan meningkatkan kelarutan dan daya dispersinya. Perlakuan pendahuluan berupa blanching berpengaruh dalam mempertahankan kadar lemak, kadar
β-karoten dan daya serap air. Perlakuan blanching dan perendaman dalam natrium metabisulfit (Na2S2O5) dapat mempertahankan warna tepung labu kuning (Cucurbita moschata), tetapi tidak memberikan pengaruh yang berbeda nyata terhadap kadar protein tepung labu kuning.
Penelitian Suprapto (2006), menunjukkan perlakuan penghilangan getah menggunakan larutan garam ternyata memberikan hasil yang lebih baik dibandingkan dengan penghilangan getah dengan perlakuan perebusan (blanching). Dengan perendaman pada larutan garam memudahkan pengupasan, daging buah pisang masih tetap segar, tidak keriput. Hasil uji terhadap tepung pisang perlakuan perendaman dalam larutan garam memberikan hasil rendemen yang lebih tinggi, warna tepung lebih putih, dan nilai vitamin C lebih tinggi.