BAHAN DAN METODA
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Maret 2016 – Oktober 2016 di Laboratorium Analisa Kimia Bahan Pangan dan Laboratorium Mikrobiologi Program Studi Ilmu dan Teknologi Pangan, Fakultas Pertanian Universitas Sumatera Utara, Medan.
Bahan Penelitian
Bahan penelitian yang digunakan adalah ubi jalar ungu dengan tingkat kematangan yang optimal dengan ciri berwarna ungu pekat. Bahan lain yang digunakan adalah air. Bahan kimia yang digunakan dalam penelitian ini adalah sodium metabisulfit (Na2S2O5) 0,5 %, heksan, H2SO4, NaOH, K2SO4, etanol 95 %,
akuades, petroleum eter, aseton, kloroform, KOH, Na2SO4, alkohol, DNS
(Dinitrosalisilat), indikator fenolftalein, eter, asam asetat, CuSO4, glukosa standar,
dan phenol.
Alat Penelitian
no. 2, dan no. 41, kromameter Konica Minolta (tipe CR-400, Jepang), spektrofotometer UV (Genesys 20), tanur Carbolite Furnaces (tipe EML 11/2), dan oven Memmert (tipe BMV 30).
Metode Penelitian
Penelitian ini dilakukan dengan menggunakan Rancangan Acak Lengkap (RAL) yang terdiri dari dua faktor, yaitu :
Faktor I : Metode perlakuan awal (pre-treatment) (P). terdiri dari 4 taraf, yaitu : P1 = Ubi utuh yang tidak dikupas dan diiris
P2 = Ubi utuh yang dikupas dan diiris
P3 = Ubi utuh yang tidak dikupas, diiris + perendaman sodium
metabisulfit 0,5 % selama 30 menit
P4 = Ubi utuh yang dikupas, diiris + perendaman sodium
metabisulfit 0,5% selama 30 menit
Faktor II : Suhu pengeringan (T), terdiri dari 4 taraf, yaitu : T1 = 50˚ C
T2 = 55˚ C
T3 = 60˚ C
T4 = 65˚ C
Model Rancangan
Penelitian ini dilakukan dengan Rancangan Acak Lengkap (RAL) faktorial dengan model :
ijk= µ + αi+ βj + (αβ)ij + εijk
Dimana :
ijk : Hasil pengamatan dari faktor P pada taraf ke-i dan faktor T pada taraf ke-j
dengan ulangan ke-k µ : Efek nilai tengah
αi : Efek dari faktor P pada taraf ke-i
βj : Efek dari faktor T pada taraf ke-j
(αβ)ij : Efek interaksi faktor P pada taraf ke-i dan faktor T pada taraf ke-j
εijk : Efek galat dari faktor P pada taraf ke-i dan faktor T pada taraf ke-j dalam
ulangan ke-k
Apabila diperoleh hasil yang berbeda nyata dan sangat nyata maka uji dilanjutkan dengan uji beda rataan, menggunakan uji Least Significant Range (LSR).
Pembuatan Tepung Ubi Jalar Ungu
sodium metabisulfit 0,5% selama 30 menit, setelah itu ditiriskan dan dicuci dengan air. Bagian ke IV umbi dikupas, diiris dengan ketebalan 2 mm, direndam dalam larutan sodium metabisulfit 0,5% selama 30 menit kemudian ditiriskan dan dicuci dengan air.
Masing-masing kelompok umbi jalar dibagi lagi menjadi 4 bagian dan disusun di atas loyang, untuk selanjutnya dikeringkan dengan suhu pengeringan sesuai perlakuan yaitu suhu 50˚C, 55˚C, 60˚C dan 65˚C selama 24 jam. Setelah irisan ubi jalar ungu kering dikeluarkan dari oven dan didinginkan pada suhu ruang. Setelah dingin dilakukan penggilingan ubi jalar ungu sampai halus, diayak dengan ayakan 80 mesh, sehingga diperoleh tepung ubi jalar dan dikemas di dalam plastik dalam keadaan tertutup rapat. Tahap pembuatan tepung ubi jalar ungu dapat dilihat pada Gambar 3.
Pengamatan dan Metode Pengukuran Data
Pengamatan dan pengukuran data dilakukan dengan cara analisis terhadap mutu fisik, kimia, dan fungsional tepung ubi jalar oranye. Mutu fisik tepung ubi jalar oranye yang diamati yaitu pengujian warna (Hutchings, 1999), densitas kamba (Okaka dan Potter, 1977), uji organoleptik warna dan aroma (Soekarto, 1985), serta indeks pencoklatan (Youn dan Choi, 1996). Mutu kimia tepung ubi jalar oranye yang diamati, yaitu kadar air (AOAC, 1995). Pengujian sifat fungsional tepung meliputi daya serap air dan minyak (Sathe dan Salunkhe, 1981), swelling power (Leach, dkk., 1959), kelarutan atau solubility (Anderson, 1982), dan baking expansion (Demiate, dkk., 2000).
dilanjutkan dengan uji LSR. Pemilihan perlakuan terbaik didapatkan dengan mempertimbangkan nilai organoleptik aroma, organoleptik warna, indeks pencoklatan, swelling power, dan baking expansion dengan menggunakan metode indeks efektivitas (deGarmo, dkk., 1984).
Masing -masing parameter diberikan bobot variabel (BV) dengan angka 0 – 1. Besar bobot ditentukan berdasarkan tingkat kepentingan parameter. Semakin tinggi tingkat kepentingan maka semakin tinggi nilai bobot variabel yang diberikan. Bobot normal (BN) setiap parameter ditentukan dengan cara membagi BV dengan jumlah semua bobot variabel. Nilai efektivitas (Ne) diperoleh dengan rumus:
Ne =
Nilai Perlakuan (NP) - Nilai Terburuk (NBr)Nilai Terbaik (NBk) - Nilai Teburuk (NBr)
Nilai hasil dari masing-masing parameter ditentukan dari hasil perkalian antara nilai efektivitas (Ne) dengan bobot normal (BN). Nilai hasil dari tiap parameter dijumlahkan untuk mengetahui total nilai hasil. Total Nh yang tertinggi
menunjukkan hasil perlakuan terbaik.
Tepung ubi jalar dengan mutu terbaik selanjutnya dianalisis kadar
β-karoten (Apriyantono, dkk., 1989), kadar abu (Sudarmadji, dkk., 1989), kadar protein (metode Kjedahl, AOAC, 2005), kadar lemak (AOAC, 1995), kadar serat kasar (AOAC, 1995), kadar pati dengan metode hidrolisis asam (Apriyantono, dkk., 1989), amilosa dan amilopektin (SNI-6128-2008), gula reduksi (Apriyantono, dkk., 1989), total gula (Apriyantono, dkk., 1989), derajat
Gambar 3. Skema pembuatan tepung ubi jalar ungu Analisis
Didinginkan pada suhu ruang
Mutu Fisik Warna
Warna diukur menggunakan alat chromameter Minolta (tipe CR 200, Jepang). Sampel diletakkan pada wadah yang telah tersedia, kemudian ditekan tombol start dan akan diperoleh nilai L, a, dan b dari sampel dengan kisaran 0 (hitam) sampai ± 100 (putih). Notasi “a “ menyatakan warna kromatik campuran merah-hijau dengan nilai “+a” (positif) dari 0 sampai + 100 untuk warna merah dan nilai “–a “ (negatif) dari 0 sampai – 80 untuk warna hijau. Notasi “b”
menyatakan warna kromatik campuran biru-kuning dengan nilai nilai “+b” (positif) dari 0 sampai + 70 untuk warna kuning dan nilai “–b “ (negatif) dari 0 sampai – 80 untuk warna biru. Sedangkan L menyatakan ketajaman warna. Semakin tinggi ketajaman warna, semakin tinggi nilai L. Selanjutnya dari nilai a dan b dapat dihitung oHue menggunakan rumus Hutchings (1999), sebagai berikut:
o
Hue = tan-1 . Jika hasil yang diperoleh: 18o– 54o maka produk berwarna red (R)
54o– 90o maka produk berwarna yellow red (YR) 90o– 126o maka produk berwarna yellow (Y)
126o– 162o maka produk berwarna yellow green (YG) 162o– 198o maka produk berwarna green (G)
198o– 234o maka produk berwarna blue green (BG) 234o– 270o maka produk berwarna blue (B)
342o– 18o maka produk berwarna red purple (RP)
Densitas kamba
Densitas kamba ditentukan dengan menggunakan metode seperti yang dilakukan Okaka dan Potter (1977). Sampel sebanyak 20 g dimasukkan ke dalam gelas ukur 100 ml sambil ditepuk-tepuk 20-30 kali dengan menggunakan jari agar memadat, kemudian volume sampel dicatat. Densitas kamba dihitung sebagai berikut :
Densitas Kamba (g/ml) = Volume sampel (ml)Berat sampel (g)
Uji Organoleptik Warna dan Aroma
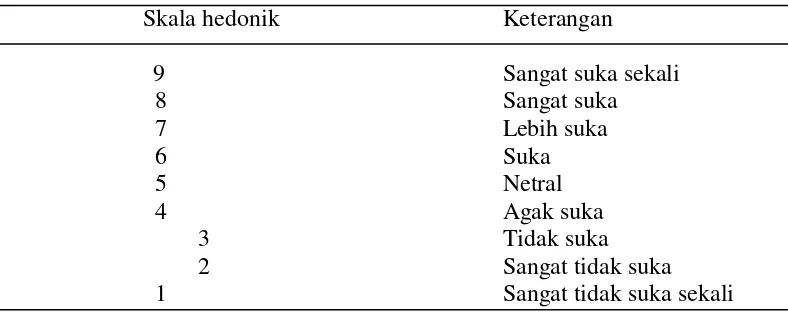
Penentuan uji organoleptik warna dengan uji hedonik Soekarto (1985). Sampel tepung ubi jalar yang telah diberi kode secara acak, diuji oleh 20 panelis. Skala hedonik disajikan pada Tabel 4. Format uji organoleptik di sajik pada Lampiran 1.
Tabel 4. Skala nilai hedonik warna dan aroma
Skala hedonik Keterangan
9 Sangat suka sekali
8 Sangat suka
7 Lebih suka
6 Suka
5 Netral
4 Agak suka
3 Tidak suka
2 Sangat tidak suka
Indeks pencoklatan
Indeks pencoklatan ditentukan dengan menggunakan metode seperti yang dilakukan Youn dan Chai (1996). 1 g tepung ubi jalar diekstraksi dengan air 40 ml air distilata dan 10 ml larutan asam trikloroasetat 10% dalam sebuah beaker glass. Ekstrak disaring dengan corong Buchner menggunakan kertas Whatman No.2, kemudian filtrat dibiarkan selama 2 jam pada suhu ruang. Kemudian diukur larutan indeks pencoklatan dengan spektrofotometer pada panjang gelombang 420 nm.
Mutu Kimia Kadar Air
Kadar air ditentukan dengan menggunakan metode seperti yang dilakukan AOAC (1995). Sampel sebanyak 5,5 g dimasukkan ke dalam cawan alumunium yang telah dikeringkan selama satu jam pada suhu 105°C dan telah diketahaui beratnya. Sampel tersebut dipanaskan pada suhu 105°C selama tiga jam, kemudian didinginkan dalam desikator sampai dingin kemudian ditimbang. Pemanasan dan pendinginan dilakukan berulang sampai diperoleh berat sampel konstan.
Kadar Air ( ) = Berat sampel awal - berat sampel akhirBerat sampel awal x 100
Penentuan Analisis Kadar Antosianin Metode pH Diferensial
Penentuan analisis kadar antosianin metode pH diferensial dengan menggunakan metode seperti yang dilakukan Ticoalu dkk (2016).
Untuk membuat buffer pH 1 digunakam KCl sebanyak 1.86 g dicampur dengan 980 mL aquades dan diatur hingga mencapai pH 1 dengan menggunakan HCl pekat. Selanjutnya larutan dipindahkan ke dalam labu ukur 1 L dan ditambahkan akuades sampai tanda batas.
Pembuatan Buffer pH 4.50
Untuk buffer pH 4.50 digunakan CH3CO2Na.3H2O sebanyak 54.43 g
dicampur dengan 950 mL aquades. Kemudian pH diukur dan diatur dengan HCl pekat hingga diperoleh larutan dengan pH 4.50. Selanjutnya larutan dipindahkan ke dalam labu ukur 1 L dan diencerkan dengan akuades sampai volume 1 L.
Pengukuran dan Perhitungan Konsentrasi Antosianin Total
Faktor pengenceran yang tepat untuk sampel harus ditentukan terlebih dahulu dengan cara melarutkan sampel dengan larutan penyangga KCl pH 1 hingga diperoleh absorbansi kurang dari 1.20 pada panjang gelombang 530 nm. Selanjutnya diukur absorbansi akuades pada panjang gelombang yang akan digunakan (530 dan 700 nm) untuk mencari titik nol. Panjang gelombang 530 adalah panjang gelombang maksimum untuk sianidin-3-glukosida, sedangkan panjang gelombang 700 nm untuk mengoreksi endapan yang masih terdapat pada sampel. Jika sampel benar-benar jernih maka absorbansi pada panjang gelombang 700 nm adalah 0.
menit sebelum diukur. Absorbansi dari setiap larutan pada panjang gelombang 530 dan 700 nm diukur dengan akuades sebagai blanko.
Absorbansi (A) dari sampel yang telah di larutkan ditentukan dengan rumus
Kandungan pigmen antosianin pada sampel dihitung dengan rumus : A = [(A530-A700) Ph 1,0 – (A530-A700)Ph 4,5].
Kandungan pigmen antosianin pada sampel dihitung dengan rumus: Kadar antosianin ( ) = A x Faktor Pengencer x BM x 1000 x berat sampel
Keterangan :
A = pH 1(OD Panjang gelombang maks.- OD panjang gelombang 700 nm) – pH 4,5 (OD Panjang gelombang maks.- OD panjang gelombang 700 nm) BM = Berat molekul Antosianin yang dinyatakan dalam cyanidin 3 glukosidase
(449,2 gr/mol)
= Koefisien absorbsivitas ( 26900 L/mol ) yang dinyatakan sebagai cyanidin 3 glukoside
Panjang gelombang maks= serapan warna paling tinggi pada sampel ( 520 nm ) Panjang gelombang 700 nm = serapan warna antosianin yg dinyatakan sebagai
cyanidin 3 glukoside
Mutu Fungsional
Daya serap air dan minyak
dicatat dan volume air dapat dihitung dengan asumsi berat jenis air 1 g/ml sedangkan minyak 0,8888 g/ml.
Sampel+Air/Minyak (g) DSA/DSM (g/g) =
Berat sampel (g) Keterangan : DSA : daya serap air
DSM : daya serap minyak
Swelling power
Swelling power ditentukan dengan menggunakan metode seperti yang dilakukan Leach dkk (1959). Ditimbang sampel sebanyak 1 g lalu ditambahkan 10 ml akuades dan dipanaskan pada suhu 90 oC selama 30 menit sambil diaduk. Selanjutnya campuran disentrifugasiselama 30 menit dengan kecepatan 2200 rpm untuk memisahkan antara padatan dengan cairannya. Selanjutnya dibuang airnya lalu ditimbang berat supernatan. Swelling power dihitung dengan rumus :
( ) = Berat sampel keringBerat pasta
Kelarutan (Solubility)
kemudian dikeringkn pada oven suhu 105 °C hingga beratnya konstan lalu berat padatan supernatan kering ditimbang.
Kelarutan air( ) = Berat padatan supernatan keringBerat sampel awal
Baking expansion
Pengujian baking expansionmengacu pada prosedur Demiate, dkk., (2000). Sebanyak 8 g pati ditambah 13,3 ml aquades, lalu digelatinisasikan. Adonan lalu dioven pada suhu 200 °C selama 25 menit. Hasil panggangan kemudian didinginkan, ditimbang, kemudian dilapisi permukaannya dengan pencelupan dalam parafin. Volume hasil panggangan ditentukan dengan mencelupkan sampel dalam gelas ukur 250 ml yang berisi air, hingga seluruh bagian terendam dan peningkatan volume tercatat.
(ml/g) = massa hasil pangganganPeningkatan volume
Pengujian Perlakuan Terbaik Kadar protein
Pengujian kadar protein dengan menggunakan metode KjeIdahl mengacu pada prosedur AOAC, (2005). Sampel sebanyak 0,1-0,5 g yang telah yang telah dihaluskan dimasukkan ke dalam labu kjedhal selanjutnya ditambahkan dengan 2 ml H2SO4 pekat, 40 mg HgO dan 1,9 mg K2SO4sample dididihkan selama 1-1,5
kondensor , sebelumnya ditambahkan ke dalamnya 2-4 tetes indikator (campuran metil merah 0,02% dalam alkohol dan metil biru 0,02% dalam alkohol dengan perbandingan 2:1). Ujung tabung kondensor harus terendam dalam labu larutan HBO3, kemudian dilakukan destilasi hingga sekitar 125 ml destilat dalam labu
erlenmeyer . ujung kondensor kemudian dibilas dengan sedikit air destilat dan ditampung dalam erlenmeyer lalu dititrasi dengan HCl 0,02 N hingga terjadi perubahan warna. Penetapan blanko dilakukan dengan cara yang sama.
Kadar Protein ( ) = (A - B) x N Cl x 14 x 6,25Berat sampel x 100
A = ml titrasi sampel B = ml titrasi blanko N = Normalitas
14 = Berat atom nitrogen 6,25 = Faktor konversi
Kadar Lemak (AOAC, 1995)
desikator. Labu beserta lemaknya ditimbang dengan berat labu yang telah diketahui sebelumnya.
Kadar Lemak ( ) = Berat sampelBerat lemak x 100
Kadar Abu
Pengujian kadar abu mengacu pada prosedur Sudarmadji, dkk., (1989). Sampel yang telah dikeringkan hingga berat konstan selanjutnya sampel ditimbang sebanyak 5 g. Sampel dimasukkan kedalam cawan porselen yang telah diketahui berat awalnya dan dibakar selama 1 jam dalam tanur dengan suhu 100 °C, 2 jam dengan suhu 300 °C kemudian dengan suhu 500 °C selama 2 jam. Cawan porselen didinginkan kemudian dikeluarkan dari tanur dan dimasukkan ke dalam desikator selama 15 menit kemudian ditimbang. Dihitung cawan dengan sample yang telah diabukan. Kadar abu diperoleh dengan rumus sebagai berikut.
Kadar Abu ( ) = Bobot sampel awal (g)Bobot abu (g) x 100
Kadar Serat Kasar
Kadar serat ditentukan dengan menggunakan metode AOAC (1995). Sampel sebanyak 2 g dimasukan ke dalam labu erlenmeyer 300 ml kemudian ditambahkan 50 ml H2SO4 0,325 N, dihidrolisis selama 30 menit pada suhu
H2SO4 0,325 N, kemudian akuades mendidih dan yang terakhir dicuci dengan
alkohol 95%. Kertas saring yang telah dicuci selanjutnya dikeringkan dalam oven bersuhu 105 oC selama satu jam, pengeringan dilakukan hingga berat konstan.
Berat kertas saring akhir (g) – berat kertas awal (g) Kadar serat kasar (%) = x100
berat sampel awal (g)
Kadar Pati
Pengujian kadar pati dengan menggunakan metode hidrolisis asam yang mengacu pada prosedur Apriyantono, dkk., (1989). Pereaksi DNS dibuat dengan cara melarutkan 10,6 g asam 3,5-dinitrosalisilat dan 19,8 g NaOH ke dalam 1416 ml air dan ditambahkan ke dalam larutan tersebut 106 g NaK-tartarat, 7,6 ml fenol (cairkan pada suhu 50°C) dan 8,3 g Na-metabisulfit, dicampur merata. Pereaksi DNS distandarisasi dengan cara dititrasi 3 ml pereaksi DNS dengan HCl 0,1 N dan indikator fenolftalein. HCl 0,1 N yang dibutuhkan 5-6 ml, jika kurang dari itu ditambahkan 2 g NaOH untuk setiap kekurangan 0,1 ml HCL 0,1 N.
Setelah itu dilakukan persiapan sampel dengan cara ditimbang pati sebanyak 2 g yang telah dihaluskan dimasukkan ke dalam beaker glass 250 ml, selanjutnya ditambahkan 50 ml alkohol 80 % dan diaduk selama 1 jam. Suspensi tersebut disaring dengan kertas saring dan dicuci dengan air sampai volume filtrat 250 ml. Filtrat ini mengandung karbohidrat yang terlarut dan dibuang.
Kemudian erlenmeyer ditutup dengan penangas balik dan dipanaskan di atas penangas air sampai mendidih selama 2,5 jam pada suhu 100°C. Residu dibiarkan dingin dan dinetralkan dengan larutan NaOH 45% hingga ± pH 7 dan diencerkan sampai volume 500 ml. Campuran disaring kembali dengan kertas saring, setelah itu ditentukan kadar gula yang dinyatakan sebagai glukosa dari filtrat yang diperoleh.
Penetapan kurva standar menggunakan larutan glukosa standar dengan konsentrasi 0,05-0,25 mg/ml dilakukan dengan cara menimbang 0,05 g glukosa, kemudian dimasukkan ke dalam labu ukur 100 ml dan ditambahkan akuades sampai tanda tera lalu diaduk menggunakan magnetik stirer selma 15 menit. Selanjutnya larutan induk glukosa dibuat dengan konsentrasi 0,05 mg, 0,1 mg, 0,15 mg, 0,2 mg dan 0,25 mg. Lalu dibaca absorbansinya di spektrofotometer pada panjang gelombang 550. Kurva standar glukosa di sajik pada Lampiran 2.
Setelah itu campuran tersebut dikocok atau dihomogenkan. Masing-masing dari campuran tersebut diambil 1 ml dan ditambahkan 3 ml DNS kemudian dikocok dan dipanaskan selama 5 menit dan didiamkan selama 30 menit. Selanjutnya intensitas warna yang terbentuk diukur absorbansinya menggunakan spektrofotometer pada panjang gelombang 550 nm. Kurva standar dibuat dengan memplot konsentrasi glukosa terhadap absorbansinya. Kadar pati dihitung dengan menggunakan rumus sebagai berikut.
Kadar Amilosa dan Amilopektin
Kadar amilosa dan amilopektin ditentukan dengan menggunakan metode seperti yang dilakukan Apriyantono dkk (1989). Sampel ditimbang sebanyak 0,1 g lalu dimasukkan ke dalam tabung reaksi. Selanjutnya sampel ditambahkan 1 ml etanol 95% dan 9 ml NaOH 1 N. Campuran tersebut dipanaskan dalam air mendidih selama 10 menit hingga semua terlarut kemudian didinginkan. Selanjutnya campuran tersebut dipindahkan ke dalam labu takar 100 ml dan ditambahkan akuades sampai tanda tera.
Kemudian campuran tersebut dipipet 5 ml larutan ke dalam labu takar 100 ml dan tambahkan 1 ml asam asetat 1 N, 2 ml larutan iod dan akuades hingga tanda tera. Lalu dikocok dan didiamkan selama 20 menit. Kemudian diukur absorbansinya dengan menggunakan panjang gelombang 625 nm. Konsentrasi kandungan amilosa ditentukan dengan menggunakan kurva standar, melalui persamaan linier yang diperoleh.
Penetapan kurva standar amilosa dilakukan dengan cara menimbang 40 mg amilosa murni (amilosa kentang), kemudian dimasukkan ke dalam tabung reaksi lalu ditambahkan 1 ml etanol 95% dan 9 ml NaOH 1 N. Campuran tersebut dipanaskan ke dalam air mendidih selama 10 menit sampai semua bahan terlarut, kemudian didinginkan.
0,8 ml, 1 ml serta masing-masing 2 ml larutan iod. Kemudian ditambahkan akuades sampai tanda tera.
Larutan campuran dihomogenkan dengan menggunakan magnetik stirer lalu dibiarkan selama 20 menit, diukur absorbansinya dengan spektrofotometer pada panjang gelombang 625 nm yaitu hubungan panjang gelombang yang memberikan absorbansi maksimum untuk warna biru.
Kadar amilosa ( ) = Konsentrasi amilosa (mg/ml) x FP x 0,001 Berat sampel (g) x 100 Kadar amilopektin ( ) = 100 - Kadar amilosa
Total gula
Pengujian total gula mengacu pada prosedur Apriyantono, dkk., (1989). Terlebih dahulu dilakukan persiapan sampel dengan cara bahan ditimbang sebanyak 5 g, ditambahkan 20 ml alkohol 80% dan aduk 1 jam. Larutan disaring dengan kertas saring dan dicuci dengan aquades sampai volume filtrat 200 ml. Larutan dipanaskan di waterbath hingga tidak berbau etanol lagi (volume air berkurang ±50 ml). Larutan dimasukkan ke dalam labu ukur 100 ml dan ditambahkan akuades hingga tanda tera. Selanjutnya dilakukan pengenceran dengan mengambil 1 ml sampel lalu diencerkan dengan 9 ml akuades lalu diambil lagi 1 ml dan diencerkan kembali dengan 14 ml akuades kemudian diaduk.
mg, 40 mg, 50 mg dan 60 mg. Lalu dibaca absorbansinya di spektrofotometer pada panjang gelombang 490. Kurva satndar glukosa di sajik pada Lampiran 2.
Setelah persiapan sampel selesai, diukur total gula dengan cara diambil 1 ml sampel, ditambahkan 0,5 ml larutan fenol 5 %, dikocok kemudian ditambahkan dengan cepat 2,5 ml larutan asam sulfat pekat dengan cara menuangkan secara tegak lurus ke permukaan larutan. Dibiarkan selama 10 menit, dikocok. Diukur absorbansinya pada 490 nm. Dibuat kurva standar. Kemudian ditentukan total gula sampel (dinyatakan sebagai % glukosa) dengan perhitungan sebagai berikut :
Total ula ( ) = Konsentrasi sampel x FP Berat sampel (g) x 1000 100
Gula pereduksi
Pengujian gula pereduksi mengacu pada prosedurApriyantono, dkk., (1989). Terlebih dahulu pereaksi DNS dibuat dengan cara melarutkan 10,6 g asam 3,5-dinitrosalisilat dan 19,8 g NaOH ke dalam 1416 ml air. Selanjutnya ke dalam larutan tersebut ditambahkan 106 g NaK-tartarat. 7,6 ml fenol (cairkan pada suhu 50 °C) dan 8,3 g Na-metabisulfit, dicampur merata. Larutan distandarisasi dengan cara dititrasi 3 ml pereaksi DNS dengan HCL 0,1 N dan indikator fenolftalein. Dibutuhkan 5-6 ml HCL 0,1 N, jika kurang dari itu ditambahkan 2 g NaOH untuk setiap kekurangan 0,1 ml HCL 0,1 N.
Dimasukkan ke dalam labu ukur 50 ml dan ditambahkan akuades hingga tanda tera. Setelah persiapan sampel selesai diukur gula pereduksi dengan cara diambil 1 ml sampel dan dimasukkan ke dalam tabung reaksi bertutup, ditambahkan 3 ml pereaksi DNS. Ditempatkan dalam air mendidih selama 5 menit. Dibiarkan dingin sampai suhu ruang. Diencerkan sampel bila perlu sampai dapat terukur pada kisaran 20- 80% pada panjang gelombang 550 nm. Digunakan air sebagai blanko. Dibuat kurva standar.
Penetapan kurva standar menggunakan larutan glukosa standar dengan konsentrasi 0,01-0,25 mg/ml dilakukan dengan cara menimbang 0,05 g glukosa, kemudian dimasukkan ke dalam labu ukur 100 ml. Ditambahkan akuades sampai tanda tera dan diaduk dengan menggunakan magnetik stirer. Selanjutnya masing-masing dibuat konsentasi sampel 10 µg, 20 µg, 30 µg, 40 µ g, 50 µg dan 60 µgke dalam tabung reaksi. Setelah itu campuran tersebut dikocok atau dihomogenkan. Masing-masing dari campuran tersebut diambil 1 ml dan ditambahkan 3 ml DNS kemudian dikocok dan dipanaskan selama 5 menit. Didiamkan selama 30 menit. Selanjutnya intensitas warna yang terbentuk diukur absorbansinya menggunakan spektrofotometer pada panjang gelombang 550 nm. Kurva standar dibuat dengan memplot konsentrasi glukosa terhadap absorbansinya.
ula reduksi( ) = Konsentrasi sampel x FP Berat sampel (g) x 1000
Kadar vitamin C
Pengujian derajat polimerisasi menggunakan metode kolorimetri yang mengacu pada prosedurApriyantono, dkk., (1989).
Larutan Dye dibuat dengan menimbang 100 mg 2,6-diklorofenol indofenol dan84 mg Sodium Bikarbonat, dilarutkan dalam aquadesdan diterakan hingga 100 ml. Larutan dipipet 25 ml dan ditera pada labu ukur 500 ml.
Pembuatan kurva standar vitamin C
Vitamin C ditimbang 100 mg dan ditambahkan dengan H2C2O4 6% hingga
tera pada labu 100 ml lalu diencerkan 4 ml larutan tersebut hingga volume 100 ml dengan H2C2O4 6%. Dipipet masing-masing 1 ml, 2 ml, 2,5 ml, 3ml, dan 4 ml
lalu larutan standar ditera dengan H2C2O4 6% hingga 5 ml. Larutan dye
ditambahkan dengan cepat sebanyak 10 ml ke dalam larutan standar, dikocok lebih kurang 10 detik lalu dibaca absorbansinya pada λ = 518 nm. Data konsentrasi standar diinterpretasikan dengan absorbansi dan diperoleh persamaan dengan nilai regresi 0,9≤R2≤1. Kurva standar asam askorbat untuk penetuan
vitamin C dapat dilihat pada Lampiran 3.
Penentuan kadar vitamin C tepung ubi jalar ungu
Sampel sebanyak 5 g, ditambahakan H2C2O4 6% dan disaring hingga
volume 100 ml. Filtrat diambil 5 ml, dimasukan dalam tabung reaksi, ditambahkan 10 ml larutan dye dengan cepat, dikocok sekitar 10 detik dan dibaca absorbansinya pada λ = 518 nm menggunakan spektrofotometer. Nilai absorbansi
dimasukan ke dalam persamaan kurva standar sehingga diperoleh konsentrasi asam askorbat yang kemudian dihitung melalui persamaan sebagai berikut.
HASIL DAN PEMBAHASAN
Pengaruh Metode Perlakuan Awal dan Suhu Pengeringan Terhadap Karakteristik Fisik Tepung Ubi Jalar Ungu
Karakteristik fisik tepung ubi ungu yang diamati meliputi pengujian warna (°Hue), densitas kamba, organoleptik warna, aroma dan indeks pencoklatan. Pengaruh metode perlakuan awal dan suhu pengeringan terhadap mutu fisik dapat dilihat pada Tabel 5 dan Tabel 6.
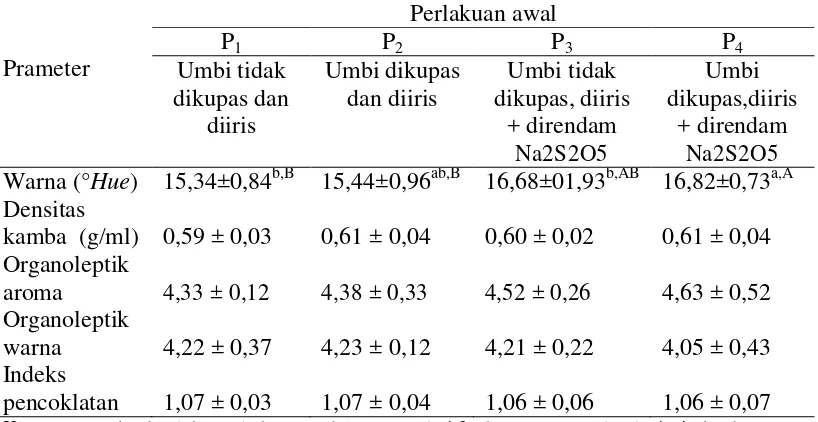
Tabel 5. Pengaruh metode perlakuan awal terhadap karakteristik fisik tepung ubi jalar ungu yang diamati Warna (°Hue) 15,34±0,84b,B 15,44±0,96ab,B 16,68±01,93b,AB 16,82±0,73a,A Densitas Keterangan : Angka dalam tabel merupakan rataan dari 3 ulangan, ± standar deviasi. Angka yang
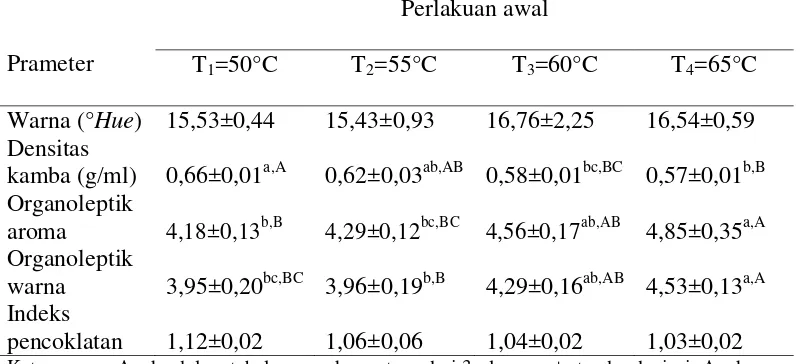
Tabel 6. Pengaruh suhu pengeringan terhadap karakteristik fisik tepung ubi jalar ungu yang diamati
Prameter
Perlakuan awal
T1=50°C T2=55°C T3=60°C T4=65°C
Warna (°Hue) 15,53±0,44 15,43±0,93 16,76±2,25 16,54±0,59 Densitas
kamba (g/ml) 0,66±0,01a,A 0,62±0,03ab,AB 0,58±0,01bc,BC 0,57±0,01b,B Organoleptik
aroma 4,18±0,13b,B 4,29±0,12bc,BC 4,56±0,17ab,AB 4,85±0,35a,A Organoleptik
warna 3,95±0,20bc,BC 3,96±0,19b,B 4,29±0,16ab,AB 4,53±0,13a,A Indeks
pencoklatan 1,12±0,02 1,06±0,06 1,04±0,02 1,03±0,02 Keterangan : Angka dalam tabel merupakan rataan dari 3 ulangan, ± standar deviasi. Angka yang
diikuti dengan huruf yang berbeda dalam satu baris menunjukkan berbeda nyata (P<0,05) (huruf kecil) dan berbeda sangat nyata (P<0,01) (huruf besar) dengan uji LSR
Warna (°Hue)
Tabel 5 menunjukkan metode perlakuan awal memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap warna (°Hue). Tabel 6 menunjukkan suhu pengeringan memberikan pengaruh berbeda tidak nyata (P>0,05) terhadap warna tepung. Hasil sidik ragam pada Lampiran 4 menunjukkan bahwa interaksi antara metode perlakuan awal dan suhu pengeringan memberikan pengaruh yang berbeda tidak nyata (P>0,05) terhadap warna tepung. Hubungan metode perlakuan awal dengan nilai warna tepung ubi ungu dapat dilihat pada Gambar 4.
Gambar 4 menunjukkan bahwa metode perlakuan awal memberikan pengaruh terhadap nilai °Hue tepung ubi ungu, di mana perlakuan ubi yang dikupas dan direndam sodium metabisulfit menghasilkan warna paling cerah. Hal ini disebabkan oleh fungsi sulfit yang dapat menghambat reaksi pencoklatan yang dikatalis enzim fenolase dan dapat memblokir reaksi pembentukan senyawa 5
(Fenema, 1996). Tepung dengan umbi yang diberi perlakuan dikupas dan direndam sodium metabisulfit memiliki warna cenderung lebih ungu dibandingkan dengan ubi yang dikupas dan tidak direndam oleh sodium metabisulfit tepung umbi yang memiliki warna ungu kemerahan. Perendaman dalam sodium metabisulfit pada ubi ungu sebelum proses pengeringan dapat mencegah pencoklatan (Widowati, 2005). Gugus sulfit pada natrium metabisulfit dapat menghambat sistem enzim fenolase secara langsung atau mereduksi hasil oksidasi menjadi bentuk fenolat sebelumnya, sehingga dapat mengurangi pencoklatan (Purwanto, dkk., 2013). Menurut Purwanto, dkk., (2013) penggunaan sodium metabisulfit pada proses pengeringan pada dasarnya mempertahankan warna, cita rasa dan stabilitas bahan pada penyimpanan.
Densitas kamba
Tabel 5 menunjukkan metode perlakuan awal memberikan pengaruh yang berbeda tidak nyata (P>0,05) terhadap densitas kamba tepung. Tabel 6 menunjukkan bahwa suhu pengeringan memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap densitas kamba tepung. Hasil sidik ragam pada Lampiran 6 menunjukkan interaksi antara metode perlakuan awal dan suhu pengeringan memberikan pengaruh yang berbeda tidak nyata (P>0,05) terhadap densitas kamba tepung. Hubungan suhu pengeringan dengan nilai densitas kamba tepung ubi ungu dapat dilihat pada Gambar 5.
Gambar 5. Hubungan suhu pengeringan dengan nilai densitas kamba tepung ubi ungu.
Gambar 5 menunjukkan bahwa densitas kamba tertinggi diperoleh pada suhu 50°C dan terendah pada suhu 65°C. Hal ini dikarenakan kadar air pada perlakuan 50°C lebih tinggi dibandingkan perlakuan 65°C. Menurut Prabowo (2010), bahan dengan kadar air yang tinggi menyebabkan berat dari bahan yang diukur lebih besar dalam volume wadah yang sama. Tingginya kadar air menyebabkan partikel tepung menjadi lebih berat sehingga volume pada rongga
partikel menjadi lebih kecil karena partikel yang terbentuk semakin besar dan menyebabkan nilai densitas kamba semakin meningkat.
Nilai organoleptik aroma
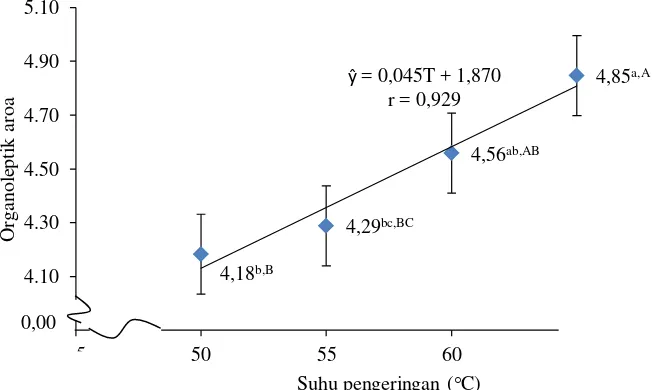
Tabel 5 menunjukkan bahwa metode perlakuan awal memberikan pengaruh berbeda tidak nyata (P>0,05) terhadap nilai organoleptik aroma tepung. Tabel 6 menunjukkan bahwa suhu pengeringan memberikan pengaruh yang berbeda sangat nyata (P<0,01) terhadap nilai organoleptik aroma tepung. Hasil analisis ragam pada Lampiran 8 menunjukkan bahwa interaksi antara metode perlakuan awal dan suhu pengeringan memberikan pengaruh yang berbeda tidak nyata (P>0,05) terhadap nilai organoleptik aroma tepung ubi ungu. Hubungan suhu pengeringan dengan nilai organoleptik aroma tepung ubi ungu dapat dilihat pada Gambar 6.
Gambar 6. Hubungan suhu pengeringan dengan nilai organoleptik aroma tepung ubi ungu
Gambar 6 menunjukkan bahwa peningkatan suhu pengeringan memberikan pengaruh terhadap nilai organoleptik aroma tepung ubi ungu, di
mana suhu yang paling tinggi memberikan nilai paling disukai dibandingkan suhu yang paling rendah. Muchtadi (1997) menyatakan selama proses pengeringan juga dapat terjadi perubahan warna, tekstur, aroma, dan lain-lain. Meskipun perubahan-perubahan tersebut dapat dibatasi seminimal mungkin dengan cara memberikan perlakuan pendahuluan terhadap bahan yang akan dikeringkan.
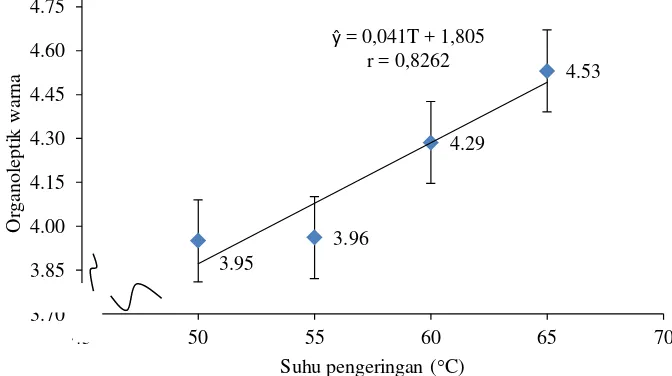
Nilai organoleptik warna
Tabel 5 menunjukkan bahwa metode perlakuan awal memberikan pengaruh berbeda tidak nyata (P>0,05) terhadap nilai organoleptik warna tepung. Tabel 6 menunjukkan bahwa suhu pengeringan memberikan pengaruh yang berbeda sangat nyata (P<0,01) terhadap nilai organoleptik warna tepung. Hasil analisis ragam pada Lampiran 10 menunjukkan bahwa interaksi antara metode perlakuan awal dan suhu pengeringan memberikan pengaruh yang berbeda tidak nyata (P>0,05) terhadap nilai organoleptik aroma tepung. Hubungan suhu pengeringan dengan nilai organoleptik warna tepung ubi ungu dapat dilihat pada Gambar 7.
suhu yang tinggi disebabkan terjadinya dekomposisi antosianin dari bentuk aglikon menjadi kalkon (tidak berwarna).
Gambar 7. Hubungan suhu pengeringan dengan nilai organoleptik warna tepung ubi ungu
Indeks pencoklatan
Tabel 5 dan Tabel 6 menunjukkan bahwa metode perlakuan awal dan suhu pengeringan memberikan pengaruh yang berbeda tidak nyata (P>0,05) terhadap tepung. Hasil analisis ragam pada Lampiran 12 menunjukkan interaksi antara metode perlakuan awal dan suhu pengeringan memberikan pengaruh yang berbeda tidak nyata (P>0,05) terhadap indeks pencoklatan tepung ubi jalar ungu.
Pengaruh Metode Perlakuan Awal dan Suhu Pengeringan Terhadap Karakteristik Kimia Tepung Ubi Jalar Ungu
Karakteristik kimia tepung ubi ungu yang diamati meliputi kadar air (%), dan antosianin. Pengaruh metode perlakuan awal dan suhu pengeringan terhadap karateristik kimia tepung ubi ungu dapat dilihat pada Tabel 7 dan Tabel 8.
Tabel 7. Pengaruh metode perlakuan awal terhadap karakteristik kimia tepung ubi
10,24±2,09a,A 9,68±1,52ab,AB 9,66±1,49ab,B 8,68±1,97b,B Antosianin
(ppm)
196,21±18,84c,C 199,54±12,86c,C 246,63±10,15b,B 278,31±10,15a,A Keterangan : Angka dalam tabel merupakan rataan dari 3 ulangan, ± standar deviasi. Angka yang
diikuti dengan huruf yang berbeda dalam satu baris menunjukkan berbeda nyata (P<0,05) (huruf kecil) dan berbeda sangat nyata (P<0,01) (huruf besar) dengan uji LSR
Tabel 8. Pengaruh suhu pengeringan terhadap karakteristik kimia tepung ubi jalar ungu yang diamati Keterangan : Angka dalam tabel merupakan rataan dari 3 ulangan, ± standar deviasi. Angka yang
diikuti dengan huruf yang berbeda dalam satu baris menunjukkan berbeda nyata (P<0,05) (huruf kecil) dan berbeda sangat nyata (P<0,01) (huruf besar) dengan uji LSR
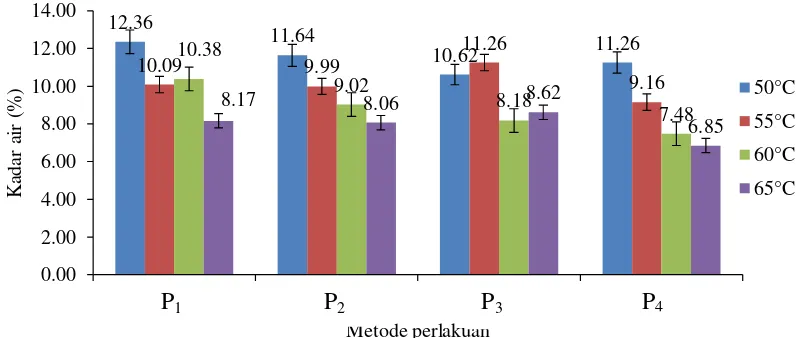
Kadar air
perlakuan awal dan suhu pengeringan dengan nilai kadar air tepung ubi ungu dapat dilihat pada Gambar 8.
Gambar 8. Hubungan interaksi metode perlakuan awal dan suhu pengeringan dengan kadar air tepung ubi jalar
Gambar 8 menunjukkan bahwa ubi yang dikupas dan direndam sodium metabisulft memberikan hasil kadar air paling rendah. Adanya penambahan sodium metabisulfit yang digunakan maka semakin rendah kadar air tepung ubi ungu. Menurut Rahman (2007) proses sulfitasi dapat menyebabkan jaringan pada bahan menjadi berlubang-lubang sehingga akan mempercepat proses pengeringan dan dengan pengeringan yang cepat tersebut maka kadar air pada bahan pun akan cepat teruapkan. Menurut standar SNI 3751-2009, kadar air untuk tepung terigu maksimal 14,5% (b/b), tepung singkong maksimal 12% (b/b), tepung beras 13% (b/b), dan tepung jagung 10% (b/b). Apabila dibandingkan dengan standar kadar air tepung-tepung tersebut, kadar air pada tepung ubi ungu ini masih berada dalam kisaran standar SNI.
P3: Umbi yang tidak dikupas , diiris + sodium metabisulfit 0,5%
P4 : Umbi yang dikupas, diiris + sodium metabisulfit 0,5% P2
Proses pengeringan pada pembuatan tepung ubi ungu bertujuan untuk menurunkan jumlah air yang terkandung di dalamnya. Kadar air merupakan salah satu parameter yang cukup penting pada produk tepung karena berkaitan dengan mutu. Semakin rendah kadar airnya maka produk tepung tersebut semakin baik mutunya karena dapat memperkecil media untuk timbulnya mikroba yang dapat menurunkan mutu produk tepung. Suhu pengeringan dan perendaman sodium metabisulfit berpengaruh pada proses penepungan ubi ungu. Semakin besar suhu yang digunakan maka kadar air yang dihasilkan semakin kecil. Nilai kadar air yang tinggi disebabkan oleh suhu pengeringan yang rendah karena proses penguapan yang relatif rendah. Hal ini sesuai dengan pendapat Desrosier (1988), bahwa semakin tinggi suhu udara pengeringan, semakin besar panas yang dibawa udara sehingga semakin banyak jumlah air yang diuapkan dari permukaan bahan yang dikeringkan.
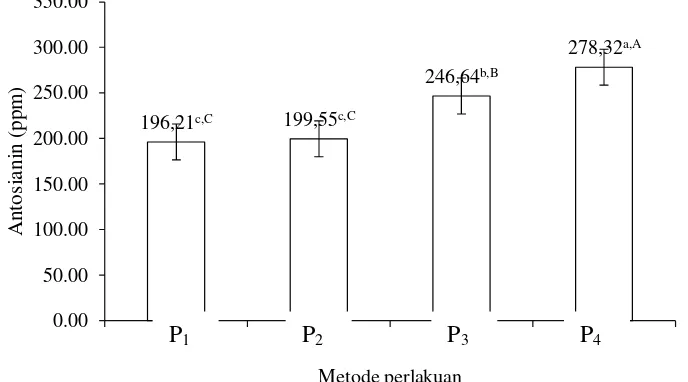
Kadar antosianin
Keterangan :
P1= Ubi tidak dikupas dan diiris
P2= Ubi dikupas dan diiris
P3= Ubi tidak dikupas lalu diiris +direndam Na2S2O5
P4= Ubi dikupas lalu diiris +direndam Na2S2O5
Gambar 9. Hubungan metode perlakuan awal dengan nilai kadar antosianin tepung
Pengaruh Metode Perlakuan Awal dan Suhu Pengeringan Terhadap Karakteristik Fungsional Tepung Ubi Jalar Ungu
Karakteristik fungsional tepung ubi ungu yang diamati meliputi pengujian daya serap air, daya serap minyak, swelling power, kelarutan, dan baking expansion. Pengaruh metode perlakuan awal dan suhu pengeringan terhadap fungsional dapat dilihat pada Tabel 9 dan Tabel 10.
Tabel 9. Pengaruh metode perlakuan awal terhadap mutu fungsional tepung ubi jalar ungu yang diamati Keterangan : Angka dalam tabel merupakan rataan dari 3 ulangan, ± standar deviasi.
Tabel 10. Pengaruh suhu pengeringan terhadap karakteristik fungsional tepung ubi jalar ungu yang diamati Keterangan : Angka dalam tabel merupakan rataan dari 3 ulangan, ± standar deviasi.
Daya serap air
menunjukkan bahwa metode perlakuan awal dan suhu pengeringan memberikan pengaruh yang berbeda tidak nyata (P>0,05) terhadap tepung ubi ungu. Hasil analisis ragam pada Lampiran 17 menunjukkan interaksi antara metode perlakuan awal dan suhu pengeringan memberikan pengaruh yang berbeda tidak nyata (P>0,05) terhadap daya serap air tepung.
Daya serap minyak
Nilai daya serap minyak tepung ubi ungu dengan metode perlakuan awal dan jenis suhu pengeringan dapat dilihat pada Tabel 9 dan 10. Hasil analisis ragam menunjukkan bahwa metode perlakuan awal dan suhu pengeringan memberikan pengaruh yang berbeda tidak nyata (P>0,05) terhadap tepung ubi ungu. Hasil analisis ragam pada Lampiran 18 menunjukkan interaksi antara metode perlakuan awal dan suhu pengeringan memberikan pengaruh yang berbeda tidak nyata (P>0,05) terhadap daya serap minyak tepung.
Swelling power
Kelarutan
Nilai kelarutan tepung ubi ungu dengan metode perlakuan awal dan suhu pengeringan dapat dilihat pada Tabel 9 dan 10. Hasil analisis ragam menunjukkan bahwa metode perlakuan awal dan suhu pengeringan memberikan pengaruh yang berbeda tidak nyata (P>0,05) terhadap tepung ubi ungu. Hasil analisis ragam pada Lampiran 20 menunjukkan interaksi antara metode perlakuan awal dan suhu pengeringan memberikan pengaruh yang berbeda tidak nyata (P>0,05) terhadap kelarutan tepung.
Baking expansion
Nilai baking expansion dengan metode perlakuan awal dan suhu pengeringan dapat dilihat pada Tabel 9 dan 10. Hasil analisis ragam menunjukkan bahwa metode perlakuan awal dan suhu pengeringan memberikan pengaruh berbeda tidak nyata (P>0,05) terhadap nilai baking expansion tepung. Hasil analisis ragam pada Lampiran 21 menunjukkan bahwa interaksi antara metode perlakuan awal dan suhu pengeringan memberikan pengaruh yang berbeda tidak nyata (P>0,05) terhadap nilai baking expansion tepung.
Pemilihan Perlakuan Awal (Pre-treatment) dan Suhu Pengeringan yang Menghasilkan Tepung Ubi Jalar Ungu dengan Mutu Fisik, Kimia, dan Fungsional Terbaik
(deGarmo, dkk., 1984) yang dapat dilihat pada Lampiran 22. Perhitungan menggunakan metode deGarmo memberikan hasil nilai rata hubungan nilai bobot dan nilai perlakuan terbesar yang merupakan perlakuan terbaik. Hasil analisis perlakuan terbaik dengan metode deGarmo dipilih berdasarkan nilai hasil paling tinggi.
Dari parameter yang telah disebutkan di atas diperoleh perlakuan terbaik yaitu tepung ubi jalar ungu dengan perlakuan awal dikupas dan perendaman sodium metabisulfit (Na2S2O5) 0,5 % pada suhu pengeringan 65°C. Selanjutnya
dilakukan pengujian perlakuan terbaik, meliputi kadar protein, kadar lemak, kadar abu, kadar serat, kadar pati, kadar amilosa, kadar amilopektin, total gula, gula pereduksi, total fenolik, dan kadar vitamin C. Mutu kimia tepung ubi jalar ungu dari hasil perlakuan terbaik dapat dilihat pada Tabel 11.
Tabel 11. Karakteristik kimia tepung ubi jalar dari hasil perlakuan terbaik
Komposisi Perlakuan terbaik
Kadar protein (%) 4,71±0,36
Kadar lemak (%) 0,43±0,01
Kadar abu (%) 2,07±0,40
Kadar serat kasar (%) 3,60±0,88
Kadar pati (%) 61,57±3,40
Kadar amilosa (%) 21,7±2,41
Kadar amilopektin (%) 39,8±2,41
Total gula (%) 7,86±0,17
Gula pereduksi (%) 1,72±0,02
Kadar vitamin C (mg/100 g) 53,20±3,85
Kadar lemak tepung ubi jalar ungu terbaik, yaitu 0,43 %. Purwanto (2013) menyatakan bahwa adanya perendaman sodium metabisulfit terhadap bahan lebih berperan dalam menginaktifkan enzim pencoklatan sehingga tidak sampai berdampak pada perubahan kadar lemak pada produk yang dihasikan.
Kadar abu tepung ubi jalar ungu terbaik, yaitu 2,07 %. Sudarmadji, dkk., (2003) menyatakan bahwa adanya perendaman sodium metabisulfit terhadap bahan dapat meningkatkan nilai kadar abu pada bahan karena sodium metabisulfit terdapat mineral Na dan S. kadar abu suatu bahan pangan menunjukkan kandungan mineral bahan pangan tersebut (Nollet, 1996).
Kadar serat tepung ubi jalar ungu terbaik, yaitu 3,60 %. Murni, dkk., (2008) menyatakan bahwa dengan adanya perendaman sodium metabisulfit dan makin lama waktu perendaman, maka makin besar terjadinya reaksi dengan mikroorganisme yang dapat menghidrolisis dinding sel tanaman dengan bantuan enzim hemiselulosa menjadi monomer gula dan asam asetat. Suprapto (2004) penurunan serat kasar diduga disebabkan oleh dinding sel dari ubi jalar larut dalam air selama proses pengolahan dan pengeringan juga menyebabkan turunnya kadar serat kasar ubi jalar, karena struktur gel pektin dan hemiselulosa rusak oleh pemanasan pada saat pengeringan.
Kadar amilosa tepung ubi jalar ungu terbaik, yaitu 21,7 % dan kadar amilopektin tepung ubi jalar ungu terbaik adalah 78,3 %. Ovrisadinita, dkk., (2016) menyatakan bahwa amilosa mempunyai kemampuan untuk membentuk ikatan hidrogen yang lebih besar daripada amilopektin. Semakin tinggi kadar amilosa, maka nilai pengembangan akan semakin tinggi.
Total gula tepung ubi jalar ungu terbaik, yaitu 7,86 dan gula pereduksi tepung ubi jalar ungu terbaik adalah 1,72 %. Kandungan gula yang tinggi pada ubi jalar dapat menyebabkan reaksi pencoklatan pada saat pengolahan, perlakuan pendahuluan perendaman sodium metabisulfit dapat mengatasi pencoklatan yang terjadi (Honestin, 2007). Adanya penambahan sodium metabisulfit membuat kadar gula pereduksi akan semakin kecil dalam bahan yang menyebabkan lambatnya proses pencoklatan (Nurfitasari, dkk., 2015).
KESIMPULAN DAN SARAN
Kesimpulan
Dari hasil penelitian pengaruh metode perlakuan awal dan suhu pengeringan terhadap karakteristik fisikokimia dan fungsional tepung ubi jalar ungu, maka dapat diambil kesimpulan sebagai berikut :
1. Metode perlakuan awal memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap karakteristik kimia (kadar air) dan memberikan pengaruh berbeda tidak nyata (P>0,05) terhadap karakteristik fisik (densitas kamba,organoleptik aroma, warna, dan indeks pencoklatan) serta karakteristik fungsional (daya serap air dan minyak, swelling power, kelarutan (solubility), dan baking expansion).
2. Suhu pengeringan memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap karakteristik fisik (densitas kamba, organoleptik aroma dan organoleptik warna) dan karakteristik kimia (antosinianin) dan pengaruh berbeda tidak nyata (P>0,05) terhadap karakteristik fisik (warna °Hue , dan indeks pencoklatan), serta karakteristik fungsional (daya serap air dan minyak, swelling power, kelarutan, baking expansion).
4. Berdasarkan hasil pengujian organoleptik aroma, organoleptik warna, indeks pencoklatan, swelling power, dan baking expansion diperoleh hasil tepung ubi jalar ungu terbaik adalah tepung dengan perlakuan dikupas dan direndam dengan sodium metabisulfit (Na2S2O5) 0,5 % kemudian dikeringkan dengan
suhu 65 oC.
Saran
1. Perlu dilakukan penelitian aplikasi tepung ubi jalar ungu dengan perlakuan pengupasan dan perendaman dalam sodium metabisulfit (Na2S2O5) 0,5 %
kemudian dikeringkan dengan suhu 65 oC. Sebagai bahan substitusi perubahan produk berbahan dasar ungu.