LAPORAN PRAKTIKUM KIMIA ORGANIK
Judul : Identifikasi Gugus Fungsional Senyawa Organik
Tujuan Percobaan : 1. Mempelajari teknik pengukuran fisik untuk mengidentifikasi suatu senyawa organik.
2. Uji kimia untuk mengidentifikasi gugus fungsional senyawa organik.
Pendahuluan
Senyawa kimia mempunyai sifat fisik dan kimia yang berbeda antara senyawa satu dengan yang lainnya. Sifat fisik dan kimia bisa dilihat dari gugus fungsi yang menempel pada senyawa. Gugus fungsi adalah kelompok atom dengan pola ikatan tertentu yang bisa digunakan sebagai penanda. Gugus fungsi tersebut antara lain alkane, alkena, alkuna, alkohol, alkanon, aldehida, ester, dan lain-lain (Sjaifullah,2008:6).
Masing – masing gugus fungsi tersebut memiliki ciri khusus karena ikatan yang dibentuk tidak sama satu dengan yang lain. Alkohol memiliki gugus fungsi –OH, sedangkan alkena memiliki ikatan hidrokarbon dengan dua ikatan rangkap.
Terdapat beberapa gugus fungsi selain alkohol dan alkena,, misalnya gugus karbonil. Gugus karbonil mengandung gugus asil yaitu R-C=O yang terikat pada residu lain. Gugus asil pada keton dan aldehid terikat pada atom C dan H yang tidak dapat menstabilisasi muatan negative sehingga tidak dapat berperan sebagai gugus pergi dalam reaksi substitusi (Nuriman, 2007). Gugus fungsi dapat diidentifikasi dengan mereaksikan sampel dengan reagen tertentu. Alkohol dapat diidentifikasi dengan metode Lucas, yaitu sampel uji ditambahkan dengan reagen Lucas dan diamati perubahan yang terjadi. Metode tes kromat dilakukan dengna menambahkan sedikit aseton dan asam kromat, kemudian diamati perubahan yang terjadi. Metode iodoform dengan menambahkan sedikit NaOH, sedangkan metode tes Feri klorida dengan menambahkan beberapa feri klorida. Metode reaksi dengan Na2CO3 dan NaHCO3
dengan menambahkan zat tersebut ke dalam sampel yang akan diidentifikasi (Dewi, 2013). Hidrokarbon dapat diidentifikasi dengan beberapa uji, yaitu uji bromin dan uji Baeyer. Uji bromin bertujuan untuk mengetahui pengaruh cahaya dalam mempercepat terjadinya reaksi
hidrokarbon. Hasil positif uji bromin apabila gas HBr berwarna coklat sampai kuning terbentuk. Sifat gas ini bersifat asam dan beracun. Uji Baeyer dilakukan untuk menunjukkan kereaktifan hidrokarbon alifatik, alisiklik, dan aromatik terhadap oksidator KMnO4 yang
merupakan katalis. Hasil positif uji Baeyer ditandai dengan adanya perubahan pada larutan yang tidak berwarna hingga menjadi endapan hitam (Andrian, 2012).
Alkohol dan hidrokarbon memiliki reagen spesifik untuk menguji gugus fungsi. Setiap gugus fungsi memiliki reaksi yang spesifik dengan reagen tertentu sehingga dapat digunakan untuk mengidentifikasi suatu senyawa. Percobaan ini akan mempelajari bagaimana cara mengidentifikasi suatu senyawa organik.
Prinsip Kerja
Prinsip kerja yang digunakan adalah mengidentifikasi senyawa organik berdasarkan gugus fungsi yang menandakan sifat fisik dan kimia suatu senyawa tersebut.
Alat 1. Labu ukur 10mL 2. Tabung reaksi 3. Pemanas listrik 4. Pipet tetes 5. Gelas ukur 50mL 6. Termometer 0-110 7. Penangas air 8. Beaker glass 500mL Bahan
1. Larutan 5% Br2 dalam n-oktanol atau CH2Cl2
2. Toluena 3. Etanol 4. Aseton 5. Heksena 6. Sikloheksena 7. Bensaldehida 8. Fenol 9. Methanol
10. 1-propanol 11. 2-butanol 12. Butiraldehida 13. Asetofenon 14. ,n-oktanol 15. Klorobensena 16. asetil klorida 17. bensilklorida 18. t-butil bromide 19. larutan 1% Br2 20. larutan FeCl3 5% 21. larutan 2% KmnO4 22. larutan 5% Br2 dalam CH2Cl2
23. 5% Br2 dalam oktanol atau CH2Cl2 atau 1% dalam air
24. larutan 15% NaI dalam aseton 25. 2% AgNO3 dalam etanol 95% 26. 5 gram CrO3 dalam 15 ml air
27. 5 ml H2SO4 pekat
28. 2,4-dinitofenilhidrasin 29. dietilen glikol atau DMF 30. HCl pekat,
31. larutan 5% AgNO3
32. larutan 5% NaOH 33. larutan NH3 encer
34. Fehling A: 34,64 g CuSO4.5H2O dalam 500 mL larutan
35. Fehling B: 65 g NaOH dan 173 g KNa tartarat dalam 500 mL larutan. Prosedur Kerja
1. Uji kimia ketidakjenuhan a. Reaksi dengan brom
Reagen : 5% Br2 dalam oktanol atau CH2Cl2 atau 1% dalam air
1. Dimasukkan 4 tetes heksena atau sampel lainnya yang disediakan, misalnya toluena, aseton, etanol, bensaldehida ke dalam tabbung reaksi bersih dan kering.
2. Ditambahkan 2mL n-oktanol.
3. Dikocok campuran tersebut perlahan – lahan dan ditambahkan tetes demi tetes larutan brom sampai tidak terjadi perubahan warna.
4. Dicatat jumlah tetes tiap sampel. b. Oksidasi dengan KMnO4
Reagen : larutan 2% KMnO4
1. Dilarutkan 4 tetes heksena atau sampel lainnya yang disediakan, misalnya toluena, aseton, etanol, bensaldehida ke dalam sedikit mungkin aseton atau air di dalam tabung reaksi kering dan bersih.
2. Ditambahkan tetes demi tetes larutan KMnO4 sampai terjadi endapan hitam
(atau larutan menjadi keruh). 3. Dicatat jumlah tetes tiap sampel. 2. Uji adanya halogen
a. Reagen : 2% AgNO3 dalam etanol 95,5%
1. Dimasukkan 3 tetes klorobensena atau sampel lainnya yang disediakan, misalnya n-butil klorida, kloroform, bensil klorida, bensoil klorida, t-butil bromida di dalam tabung reaksi kering dan bersih.
2. Ditambahkan 2mL reagen AgNO3.
3. Didiamkan selama beberapa menit.
4. Dimasukkan tabung reaksi ke dalam penangas air (50-60oC) 5. Dicatat waktu yang diperlukan untuk terjadinya endapan. 3. Uji adanya OH alkohol
a. Reagen : Asam Kromat
1. Dimasukkan 4 tetes sampel metanol, etanol, 2-butanol, metil klorida, 1 tetes aseton dan 1 tetes larutan asam kromat ke dalam tabung reksi yang bersih dan kering.
2. Dikocok campuran tersebut.
3. Diamati perubahan yang terjadi, jika positif larutan akan berubah warna dari kuning ke biru kehijauan atau terbentuk endapan.
4. Uji aldehida dan keton
a. Reagen : 2-4 dinitrofenilhidrazin, dietil glikol atau DMF, HCl pekat
1. Dimasukkan 2 tetes sampel (aseton, bensaldehida, butiraldehida, asetofenon), 2mL etanol 95% dan 1 mL larutan fenilhidrazin.
2. Dilakukan pengocokan kuat-kuat.
3. Dipanaskan dengan pembakar spirtus apabila terbentuk endapan.
4. Diamati perubahan yang terjadi (tes positif akan terbentuk endapan kuning – merah).
b. Tes Fehling
Reagen : Fehling A : 34,64 g CuSO4.5H2O dalam 500 mL
Fehling B : 65 g NaOH dan 173 g KNa tartarat dalam 500 mL larutan 1. Dimasukkan 1 mL sampel, 1 mL reagen fehling A dan B ke dalam tabung
reaksi.
2. Dipanaskan tabung reaksi di dalam penangas air mendidih selama 5 menit. 3. Diamati dan dicatat perubahan yang terjadi pada sampel aldehida dan keton. c. Tes Tollen
Reagen : larutan 5% AgNO3, larutan 5% NaOH, larutan NH3 encer (pengenceran 10 kali ammonia pekat).
1. Dimasukkan sampel, 1mL larutan 5% AgNO3, 1mL larutan 5% NaOH, dan 5 tetes ammonia ke dalam tabung reaksi yang bersih.
2. Dipanaskan tabung reaksi di dalam penangas air mendidih selama 5 menit. 3. Diamati dan dicatat perubahan yang terjadi pada sampel aldehida dan keton. 5. Uji Fenol
1. Dimaukkan 2 tetes sampel dan 1 tetes FeCl3 ke dalam tabung reaksi yang bersih dan kering.
2. Dilakukan pengocokan kuat – kuat.
3. Diamati dan dicatat perubahan yang terjadi pada sampel (hasil positifnya adalah perubahan warna dari orange kehijauan akan pudar terhadap waktu).
Data
1. Uji kimia ketidakjenuhan a. Reaksi dengan bromin
Senyawa Sebelum Ditambah Br2 Jumlah
tetes Toluena Tidak berwarna Terbentuk 2 fasa 6 tetes Aseton Tidak berwarna Tidak terjadi
perubahan
40 tetes Etanol Tidak berwarna Tidak terjadi
perubahan
40 tetes Benzaldehida Tidak berwarna Terbentuk 2 fasa 15 tetes
b. Oksidasi dengan KMnO4
Senyawa Sebelum Ditambah KMnO4 Jumlah
tetes Toluena Tidak berwarna Endapan hitam 1 tetes Aseton Tidak berwarna Endapan hitam 6 tetes Etanol Tidak berwarna Endapan hitam 1 tetes Benzaldehida Tidak berwarna Endapan hitam 2 tetes
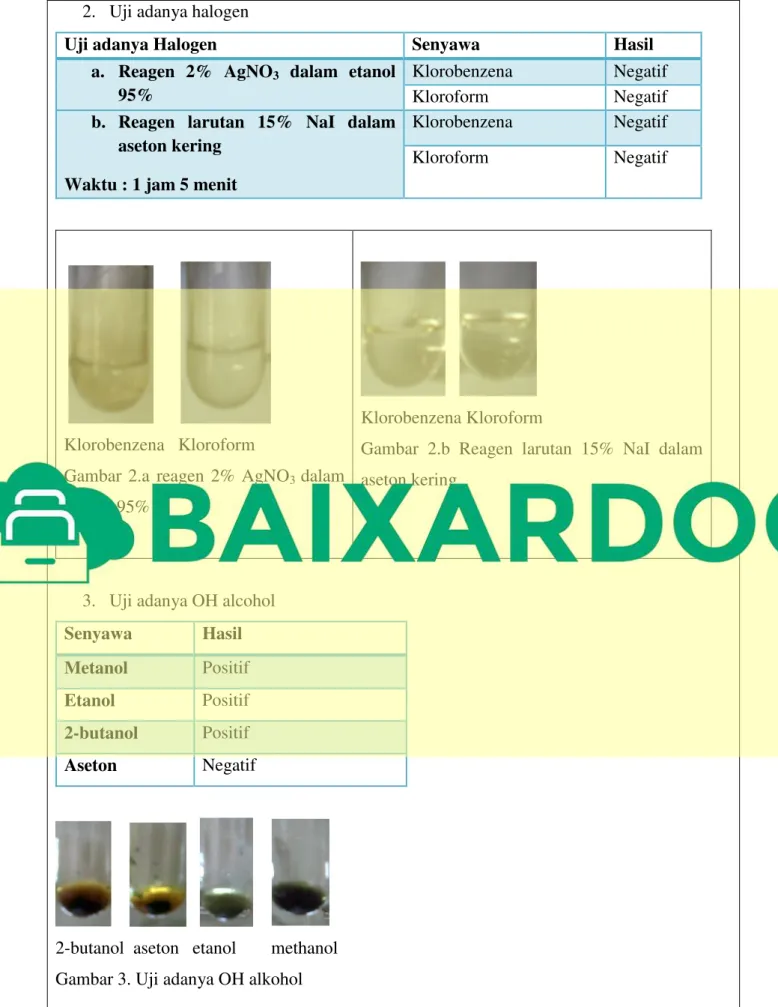
2. Uji adanya halogen
a. Reagen 2% AgNO3 dalam etanol 95%
Senyawa Penambahan Reagen
Pemanasan
Klorobenzena Terbentuk 2 fasa Terbentuk 2 fasa, berwarna coklat bening
Kloroform Terbentuk 2 fasa 1 fase , berwarna putih keabu-abuan
b. Reagen larutan 15% NaI dalam aseton kering Waktu : 1 jam 5 menit
Senyawa Penambahan Reagen
Pemanasan
Klorobenzena Terbentuk 2 fasa Terbentuk 1 fasa, berwarna coklat bening
Kloroform Terbentuk 2 fasa 1 fase , berwarna putih keabu-abuan
3. Uji adanya OH Alkohol
Senyawa Sebelum Pemanasan Metanol Tidak berwarna Hijau pekat
Etanol Tidak berwarna Endapan hijau kehitaman, larutan berwarna hijau
2-butanol Tidak berwarna Endapan hitam, larutan kecoklatan keruh
Aseton Tidak berwarna Endapan biru tua, larutan kuning kecoklatan bening
4. Uji Aldehida a.
Senyawa Sebelum Pemanasan Aseton Tidak berwarna Kuning +++ Benzaldehida Tidak berwarna Kuning ++ Asetoferon Tidak berwarna Kuning +
b. Tes Fehling
Senyawa Sebelum Ditambah Fehling A dan B Pemanasan Aseton Tidak berwarna Biru Biru +++ Benzaldehida Tidak berwarna
Biru Terdapat 2 fase, berwarna biru +
Asetoferon Tidak berwarna
Biru Terdapat 2 fase, berwarna biru ++
c. Tes Tollen
Senyawa Sebelum Penambahan Pemanasan selama 5 menit AgNO3 NaOH Aseton Tidak berwarna Larutan keruh Terdapat endapan coklat
Terdapat endapan abu-abu Benzaldehida Tidak berwarna Larutan keruh Terdapat endapan coklat
Terdapat endapan abu-abu Asetoferon Tidak berwarna Larutan keruh Terdapat endapan coklat
Terdapat endapan abu-abu
5. Uji fenol
Senyawa Sebelum Penambahan FeCl3 dan pengocokan
2-butanol Tidak berwarna Kuning fenol Tidak berwarna Orange 2-propanol Tidak berwarna Orange
Hasil
1. Uji kimia ketidakjenuhan
Uji Kimia Ketidakjenuhan Senyawa Hasil a. Reaksi dengan brom Toluena Negatif
Aseton Negatif Etanol Negatif Benzaldehida Negatif b. Oksidasi dengan KMnO4 Toluena Negatif Aseton Negatif Etanol Negatif Benzaldehida Positif
Aseton Benzaldehida Etanol Toluena Gambar 1.a reaksi dengan bromide
Aseton Benzaldehida Etanol Toluena Gambar 1.b oksidasi dengan KMnO4
2. Uji adanya halogen
Uji adanya Halogen Senyawa Hasil
a. Reagen 2% AgNO3 dalam etanol
95%
Klorobenzena Negatif
Kloroform Negatif
b. Reagen larutan 15% NaI dalam aseton kering
Waktu : 1 jam 5 menit
Klorobenzena Negatif
Kloroform Negatif
Klorobenzena Kloroform
Gambar 2.a reagen 2% AgNO3 dalam
etanol 95%
Klorobenzena Kloroform
Gambar 2.b Reagen larutan 15% NaI dalam aseton kering
3. Uji adanya OH alcohol Senyawa Hasil Metanol Positif Etanol Positif 2-butanol Positif Aseton Negatif
2-butanol aseton etanol methanol Gambar 3. Uji adanya OH alkohol
4. Uji aldehida dan keton
Uji aldehid dan keton Senyawa Hasil
a. Reagen : 2-4 dinitrofenilhidrazin, dietil glikol atau DMF, HCl pekat
Aseton Positif
Benzaldehida Positif
Asetofenon Positif
b. Tes fehling Aseton Negatif
Benzaldehida Negatif, harusnya
positif
Asetofenon Negatif
c. Tes tollen Aseton Positif, harusnya
negatif
Benzaldehida Positif
Asetofenon Positif, harusnya
negatif
Asetofenon Aseton Benzaldehida Gambar 4.a Reagen : 2-4 dinitrofenilhidrazin
Asetofenon Aseton Benzaldehida Gambar 4.b Tes Fehling