LAPORAN PRAKTIKUM KIMIA ORGANIK Judul : Identifikasi gugus fungsional senyawa organik
TujuanPercobaan :
1. Mempelajari teknik pengukuran fisik untuk mengidentifikasi suatu senyawa organik 2. Uji kimia untuk mengidentifikasi gugus fungsional senyawa organik
Pendahuluan
Analisis kualitatif dari senyawa organik yaitu identifikasi gugus fungsionalnya. Senyawa organik yang diketahui gugus fungsionalnya dapat diketahui pula golongannya karena setiap golongan senyawa organik mempunyai sifat tertentu bergantung pada gugus fungsi yang dimilikinya. Senyawa organik yang memiliki gugus fungsi yang sama secara umum memiliki sifat yang sama. Gugus fungsi merupakan letak kereaktifan kimia dalam molekul yang timbul dari ikatan phi atau dari perbedaan keelektronegatifan antara atom yang berikatan, jadi ikatan rangkap dua dan ikatan rangkap tiga merupakan gugus fungsi. Analisis kualitatif ini menggunakan pereaksi kimia yang dapat bereaksi secara selektif dengan gugus fungsional senyawa organik. Hasil reaksinya diharapkan menghasilkan perubahan yang dapat dengan mudah diamati seperti terbentuknya endapan, perubahan warna, dihasilkannya gas dan lain sebagainya (Matsjeh, 1986).
Gugus fungsi adalah kedudukan kereaktifan kimia dalam molekul satu kelompok senyawa dengan gugus fungsi tertentu menunjukkan gejala reaksi yang sama. Kesamaan tersebut dapat digunakan untuk mengelompokkan senyawa (Fessenden, 1986).
Contoh gugus fungsi sebagai berikut:
No. Struktur gugus Rumus umum Nama IUPAC / Trivial Nama gugus
1. -OH R OH Alkanol / Alkohol Hidroksil
2. -O- R O R Alkoksi alkana Eter
3. -COH
CH R
O Alkanal / Aldehid Aldehid
4. -COR
C R
R
O Alkanon/ Keton Karbonil
5. -COOH C O R OH Asam alkanoat/ Karboksilat Karboksil 6. -COOR C O R OR
Alkil alkanoat Ester
7. -NH2 R NH2 Amina Amin
(Purba, 1994).
Senyawa dengan gugus fungsi yang sama cenderung mengalami reaksi kimia yang sama. Contohnya beberapa senyawa yang mengandung gugus hidroksil (-OH) dinamakan golongan senyawa alkohol dan senyawa tersebut mengalami reaksi yang sama. Gugus alkil dinyatakan dengan R yang hanya mengandung karbon sp3 dan alkohol dapat dinyatakan sebagai ROH. Reaksi-reaksi yang dapat terjadi pada alkohol antara lain reaksi substitusi, reaksi eliminasi, reaksi oksidasi dan esterifikasi. Alkohol yang memiliki rantai hidrokarbon yang semakin panjang maka kelarutan alkohol tersebut semakin rendah. Gugus hidroksil yang banyak dapat memperbesar kelarutan suatu senyawa dalam air (Fessenden, 1986).
Banyak senyawa organik mempunyai gugus fungsi lebih dari satu, khususnya senyawa organik seperti alkaloid, terpenoid dan flavonoid. Gugus fungsi adalah gugus yang memberikan karakteristik kepada senyawa organik, oleh karena itu jika suatu molekul memiliki dua gugus fungsi berlainan dengan jarak yang berjauhan, maka senyawa itu akan mempunyai sifat-sifat atau karakteristik dari masing-masing gugus fungsi, namun apabila letak kedua gugus fungsi tersebut berdekatan maka gugus fungsi itu akan saling berinteraksi sehingga akan memberikan sifat-sifat khusus pada senyawa yang bersangkutan yaitu akan memiliki sifat hasil gabungan dari kedua gugus yang diikatnya (Matsjeh, 1986).
Prinsip Kerja
Prinsip kerja percobaan ini adalah melakukan analisa kualitatif untuk mengidentifikasi senyawa atau zat organik yang belum diketahui yaitu dengan mengidentifikasi zat tersebut dengan melihat dan menentukan sifat fisik, tes kualitatif unsur dan identifikasi gugus fungsional. Senyawa organik yang telah diketahui gugus fungsionalnya kemudian dikelompokkan berdasarkan gugus fungsinya yang menjadi gambaran dari sifat fisik dan sifat kimia senyawa organik tersebut.
Alat
Erlenmeyer 100 mL, gelas ukur 10 mL, tabung reaksi, pemanas listrik, pipet tetes, beaker glass 150 mL.
Bahan
Larutan 5% Br2 dalam n-oktanol atau CH2Cl2 atau 1% dalam air, toluena, eanol aseton, heksena, siklo heksena, benzaldehida, fenol, metanol, 1-propanol, 2-butanol, butiraldehida, asetofenon, klorobenzena, asetil klorida, benzilklorida, t-butilbromida, larutan 1% Br2, larutan FeCl3 5%, larutan KMnO4 2%, larutan 15% NaI dalam aseton, 2% AgNO3 dalam etanol 95%, larutan asam kromat, 2,4-dinitrofenilhidrasin, dietilen glikol atau DMF, HCl pekat, larutan 5% AgNO3, larutan 5% NaOH, larutan NH3 encer, fehling A, fehling B.
Prosedur Kerja
1. Uji kimia ketidakjenuhan
Reagen: 5% Br2 dalam oktanol atau CH2Cl2 atau 1% dalam air. a. Reaksi dengan brom
Dimasukkan 4 tetes heksana atau sampel lainnya yang disediakan ke dalam tabung reaksi bersih dan kering serta ditambahkan 2 mL n-oktanol. Dikocok campuran perlahan-lahan dan ditambahkan tetes demi tetes larutan brom sampai terjadi perubahan.
b. Oksidasi dengan KMnO4 Reagen: larutan 2% KMnO4
Dilarutkan 4 tetes heksana atau sampel lainnya yang disediakan,misalnya toluena, aseton, etanol, benzaldehida ke dalam sesedikit mungkin aseton atau air di dalam tabung reaksi kering dan bersih. Ditambahkan tetes demi tetes larutan KMnO4 sampai terjadi endapan hitam dan dicatat jumlah tetesnya.
2. Uji adanya halogen
a. Reagen: 2% AgNO3 dalam etanol 95%
Dimasukkan 3 tetes klorobenzena atau sampel lainnya yang disediakan, misalnya n-butil klorida, kloroform, benzilklorida, t-butil bromida dalam tabung kering dan bersih dan ditambahakan 2 mL reagen AgNO3. Didiamkan beberapa menit, bila tidak terjadi endapan dimasukkan tabung reaksi ke dalam penangas air (50-60°C). Dicatat waktu yang diperlukan untuk terjadinya endapan untuk setiap sampel.
Ditambahkan 3 tetes klorobenzena atau sample lainnya yang disediakan, misalnya n-butil klorida, kloroform, bensil klorida, bensoil klorida, t-butil bromida ke dalam 2 mL reagen NaI di dalam tabung reaksi kering dan bersih, dikocok campuran dalam tabung reaksi dan dibiarkan sekitar 3 menit. Dimasukkan tabung reaksi dalam penangas air pada suhu 50°C bila tidak terjadi perubahan dan dicatat waktu yang diperlukan untuk terbentuknya endapan. 3. Uji adanya OH alkohol
a. Dimasukkan 4 tetes sampel yang disediakan, yaitu metanol, etanol, 2-butanol, metil klorida, 1 tetes aseton, dan 1 tetes larutan asam kromat ke dalam tabung reaksi yang bersih dan kering. Dikocok campuran dan diamati perubahan yang terjadi. Tes positif jika terjadi perubahan warna dari kuning ke biru kehijauan atau terbentuk endapan.
4. Uji Aldehida dan Keton a. Reagen: 2,4-dinitofenilhidrazin
Dimasukkan 2 tetes sampel (aseton, benzaldehida, butiraldehida, asetofenon, atau yang lain), 2 mL etanol 95 %, dan 1 mL larutan fenilhidrazin ke dalam tabung reaksi. Dikocok kuat-kuat. Dipanaskan campuran dengan pembakar spiritus, bila tidak terbentuk endapan. Tes positif jika terbentuk endapan kunig-merah, catatlah perubahan warna terhadap sampel aldehida dan keton.
b. Tes Fehling
Reagen: Fehling A dan Fehling B
Dimasukkan 1 mL sample (aseton, benzaldehida, butiraldehida, asetofenon, atau yang lain), 1 mL reagen Fehling A dan 1 mL reagen Fehling B ke dalam tabung reaksi. Dipanaskan tabung reaksi di dalam penangas air mendidih selama sekitar 5 menit, diamati dan dicatat perubahan yang terjadi pada sampel aldehida dan keton.
c. Tes Tollen
Reagen: larutan 5% AgNO3, larutan 5% NaOH, larutan NH3 encer (pengenceran 10 kali ammonia pekat).
Dimasukkan 1 mL sampel, misalnya aseton, bensaldehida, butiraldehida, asetofenon, atau yang lain, 1 mL larutan 5% AgNO3 dan 1 mL larutan 5% NaOH dan 5 tetes ammonia ke dalam tabung reaksi bersih. Dipanaskan tabung reaksi di dalam penangas air mendidih selama sekitar 5 menit, diamati dan dicatat perubahan yang terjadi pada sampel aldehida dan keton.
Dimasukkan 2 tetes sampel, misalnya 2-butanol, fenol, 1-propanol, 1 ml etanol 95 %, dan 1 tetes larutan FeCl3 5 % ke dalam tabung reaksi yang bersih dan kering . Kemudian dikocok kuat-kuat, diamati dan dicatat terjadinya perubahan berwarna yang terjadi pada setiap sampel. Perubahan warna dari orange ke kehijauan akan pudar terhadap perubahan waktu.
Waktu yang diperlukan untuk percobaan
Uji kimia ketidakjenuhan : 20 menit
Uji adanya halogen : 25 menit
Uji adanya alkohol : 20 menit
Uji adanya aldehida dan keton : 35 menit
Uji fenol : 20 menit
Data Percobaan
1. Uji kimia ketidakjenuhan A.Reaksi dengan Brom
No. Sampel Pengamatan Jumlah tetesan
Sebelum Sesudah
1. Toluena Tidak berwarna Orange (2 fasa) 5
2. Aseton Tidak berwarna Kuning 5
3. Etanol Tidak berwarna Kuning 5
4. Benzaldehida Tidak berwarna Orange (2 fasa) 5
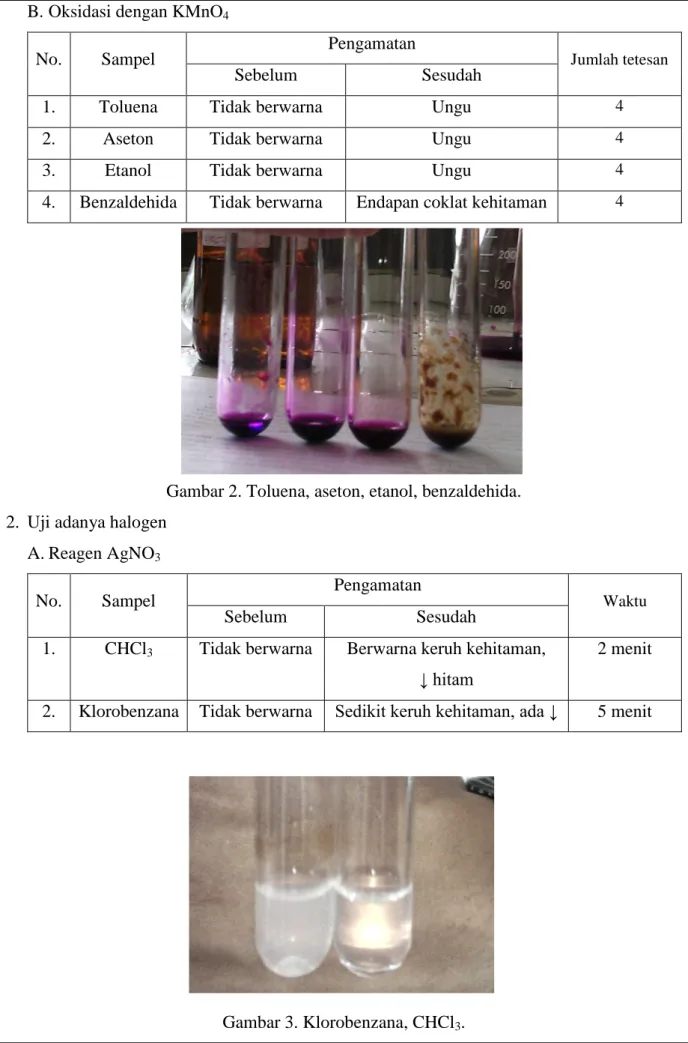
B. Oksidasi dengan KMnO4
No. Sampel Pengamatan Jumlah tetesan
Sebelum Sesudah
1. Toluena Tidak berwarna Ungu 4
2. Aseton Tidak berwarna Ungu 4
3. Etanol Tidak berwarna Ungu 4
4. Benzaldehida Tidak berwarna Endapan coklat kehitaman 4
Gambar 2. Toluena, aseton, etanol, benzaldehida. 2. Uji adanya halogen
A.Reagen AgNO3
No. Sampel Pengamatan Waktu
Sebelum Sesudah
1. CHCl3 Tidak berwarna Berwarna keruh kehitaman, ↓ hitam
2 menit
2. Klorobenzana Tidak berwarna Sedikit keruh kehitaman, ada ↓ 5 menit
B. Reagen NaI
No. Sampel Pengamatan
Sebelum Sesudah
1. CHCl3 Tidak berwarna Tidak berwarna, ↓ gel
2. Klorobenzana Tidak berwarna Tidak berwarna
Gambar 4. Klorobenzana, CHCl3. 3. Uji adanya alkohol
A.Reaksi dengan asam kromat( CrO3)
No. Sampel Pengamatan
Sebelum Sesudah
1. Metanol Tidak berwarna Hijau kehitaman
2. Etanol Tidak berwarna Hijau lumut + ↓
3. 2-butanol Tidak berwarna Kuning kecoklatan + ↓
4. Aseton Tidak berwarna Coklat + ↓
4. Uji aldehida dan keton
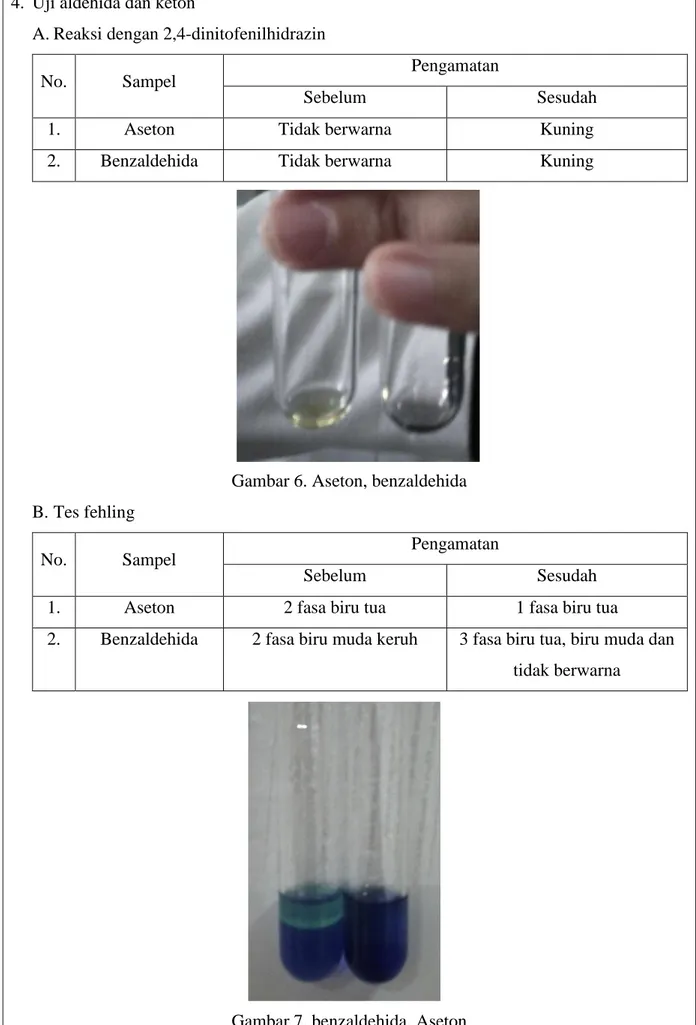
A.Reaksi dengan 2,4-dinitofenilhidrazin
No. Sampel Pengamatan
Sebelum Sesudah
1. Aseton Tidak berwarna Kuning
2. Benzaldehida Tidak berwarna Kuning
Gambar 6. Aseton, benzaldehida B. Tes fehling
No. Sampel Pengamatan
Sebelum Sesudah
1. Aseton 2 fasa biru tua 1 fasa biru tua
2. Benzaldehida 2 fasa biru muda keruh 3 fasa biru tua, biru muda dan tidak berwarna
C.Tes tollens
No. Sampel Pengamatan
Sebelum Sesudah
1. Benzaldehida Tidak berwarna 3 fasa
2. Asetofenon Krem bening 3 fasa= gel (keruh), cairan (keruh), endapan (coklat)
3. Aseton Tidak berwarna 3 fasa
Gambar 8. benzaldehida, asetofenon, aseton. 5. Uji fenol
No. Sampel Pengamatan
Sebelum Sesudah
1. 2-butanol Tidak berwarna Kuning
2. 1-propanol Tidak berwarna Kuning
3. Fenol Tidak berwarna Kuning
Hasil
1. Uji kimia ketidakjenuhan
a. Reaksi dengan brom
Sampel + brom (+/-) Aseton - Etanol - Benzaldehida - Toluena -
b. Oksidasi dengan KMnO4
Sampel + brom (+/-) Aseton - Etanol - Benzaldehida + Toluena -
2. Uji adanya halogen
Sampel + AgNO3 (+/-) + NaI (+/-) Klorobenzena + - Kloroform + +
3. Uji adanya alkohol Sampel
+ Aseton, Asam Kromat pekat
(+/-)
Metanol +
2-butanol +
Aseton -
4. Uji aldehida dan keton
Sampel + etanol, fenilhidrazin (+/-) Tes Fehling (+/-) Tes Tollens (+/-) Aseton + - - Benzaldehida + - + Asetofenon - 5. Uji fenol
Sampel + Etanol, FeCl3 (+/-)
2-butanol -
Fenol +
1-propanol -
Pembahasan Hasil
Senyawa organik adalah senyawa yang banyak mengandung unsur karbon dan unsur lainnya seperti hidrogen, oksigen, nitrogen, belerang, dan fosfor dalam jumlah sedikit. Contoh senyawa organik adalah senyawa hidrokarbon yang dapat dikelompokkan menjadi hidrokarbon jenuh dan hidrokarbon tak jenuh. Hidrokarbon jenuh adalah hidrokarbon yang memiliki ikatan C yang mengikat H dan C dengan rantai tunggal. Hidrokarbon tidak jenuh adalah hidrokarbon yang memiliki ikatan C yang mengikat H dan C dengan ikatan rangkap baik rangkap 2 maupun rangkap 3.
1. Uji kimia ketidakjenuhan
Percobaan pertama yang dilakukan yaitu uji kimia ketidakjenuhan. Sampel yang digunakan adalah aseton, toluena, etanol, benzaldehida, sedangkan reagennya menggunakan brom dalam n-oktanol dan KMnO4. Perlakuan pertama yaitu semua sampel ditambahkan dengan reagen brom dalam n-oktanol. Brom yang direaksikan dengan hidrokarbon tak jenuh akan menghasilkan reaksi adisi yaitu pemutusan ikatan rangkap 2 (=C=C=) atau rangkap 3 (-C≡C-) antar atom C menjadi ikatan tunggal antar atom C (-C-C-) atau senyawa hirokarbon jenuh. Brom yang direaksikan dengan hidrokarbon jenuh atau karbon-karbon dengan ikatan
tunggal tidak akan terjadi reaksi karena sifat alkana yang kurang reaktif terhadap sebagian besar pereaksi. Brom yang direaksikan dengan senyawa karbon tak jenuh akan menyebabkan warna berubah yang semula berwarna coklat menjadi memudar, hal ini dikarenakan konsentrasi Br2 yang berkurang karena digunakan untuk mengadisi senyawa karbon tak jenuh tersebut.
Aseton dan etanol tidak bereaksi dengan brom yang ditandai dengan warna larutan yang tidak berubah yang semula berwarna kuning. Aseton memiliki ikatan rangkap antara C dan O sedangkan ikatan rangkap yang dapat diadisi oleh brom adalah ikatan rangkap antara C dan C. Etanol dengan gugus fungsi –OH tidak memiliki ikatan rangkap 2 sehingga tidak dapat bereaksi dengan brom. Toluena dan benzaldehida memiliki ikatan rangkap 2 dalam cincinnya akan tetapi brom tidak dapat mengadisi ikatan rangkap tersebut karena brom tidak pada keadaan asam. Toluena dan benzaldehida dapat diadisi oleh brom dalam keadaan asam misalnya dalam bentuk FeBr3. Toluena dan benzaldehida yang ditambahkan brom terbentuk 2 fasa yaitu berwarna orange dan tidak berwarna. Toluena dan Benzaldehida termasuk ke dalam aromatik yang memiliki kestabilan lebih tinggi daripada alkena, dimana pada aromatik memiliki ikatan pi yang terkonjugasi sempurna serta sulit untuk membentuk muatan (+) dan (-) dan menyebabkan tidak dapat diadisi.
Reagen kedua yang digunakan adalah KMnO4. Larutan KMnO4 berwarna ungu. KMnO4 digunakan sebagai larutan penguji karena merupakan agen pengoksidasi yang mampu mengoksidasi ikatan rangkap karbon–karbon yang terindikasi dengan adanya perubahan warna larutan. Aseton, etanol dan toluena yang ditambahkan dengan KMnO4, warna larutan menjadi ungu. Hal ini sesuai dengan teori, dimana keton sangat sulit untuk dioksidasi dibandingkan dengan aldehida sehingga untuk terjadi reaksi oksidasi antara aseton dan KMnO4 sebagai oksidator dibutuhkan waktu yang cukup lama dan katalis untuk mempercepat reaksinya. Toluena termasuk ke dalam senyawa aromatik. Senyawa aromatik terutama benzena sangat sulit untuk dioksidasi sehingga toluena ketika ditambahkan dengan oksidator KMnO4 tidak terjadi reaksi. Sedangkan pada benzaldehida reaksi yang dihasilkan adalah reaksi positif sebab warna ungu dari KMnO4 berubah menjadi coklat dan terdapat endapan coklat kehitaman yang muncul akibat terbentuknya MnO2. Benzaldehida terdapat gugus benzena dan aldehid dimana gugus aldehid ini sangat mudah untuk dioksidasi walaupun dengan oksidator lemah seperti KMnO4. Sehingga pada benzaldehida hanya gugus aldehidnya saja yang mengalami oksidasi. Reaksinya sebagai berikut :
CHO
benzaldehyde
KMnO4 COOH
benzoic acid 2. Uji adanya Halogen
Percobaan ini menggunakan sampel yaitu klorobenzena dan klorofom, sedangkan reagen yang digunakan yaitu AgNO3 dan NaI. Klorobenzena yang ditambahkan dengan AgNO3 menghasilkan endapan setelah dipanaskan selama 5 menit dan larutan menjadi sedikit keruh. Kloroform yang ditambahkan AgNO3 juga akan menghasilkan endapan setelah dipanaskan dengan waktu 2 menit dan larutan menjadi keruh. AgNO3 adalah senyawa ionik.. Ion nitrat (NO3) yang terbentuk akan mensubtitusi atom halogen dan menghasilkan endapan AgCl karena Cl- yang merupakan gugus pergi yang baik akan mudah tersubtitusi dengan NO3- dan akan menghasilkan endapan AgCl.
Klorobensena Cl
+
AgNO3 chlorobenzene O N O O+
AgClphenyl nitrate endapan putih
Pereaksi yang kedua adalah NaI. Kloroform yang ditambahkan NaI setelah dipanaskan selama 4 menit, campurannya tidak berwarna dan terdapat endapan berbentuk gel, sedangkan pada klorobenzena dengan perlakuan yang sama tidak terjadi perubahan yaitu warna larutan tetap tidak berwarna dan tidak menghasilkan endapan. Seharusnya pada klorobenzena juga menghasilkan endapan, hal ini dikarenakan waktu pemanasan yang kurang lama sehingga endapan tidak terbentuk. Endapan yang terbentuk mengindikasikan adanya halogen yaitu Cl.
CHCl3
+
NaI ClCl
I
+
Na Cl3. Uji adanya alkohol
Bahan yang digunakan adalah metanol, etanol, aseton dan 2-butanol dan reagennya adalah asam kromat. Reaksi positif terjadi jika terbentuknya endapan berwarna hijau. Asam kromat dapat menyebabkan alkohol primer teroksidasi menjadi asam karboksilat. Bilangan oksidasi Cr+6 (berwarna merah kecoklatan) akan tereduksi menjadi Cr+3 (berwarna hijau). Adapun alkohol sekunder akan teroksidasi menjadi keton oleh asam kromat dan alkohol tersier tidak dapat teroksidasi menjadi keton oleh asam kromat.
Methanol dan etanol yang direaksikan dengan kromat menghasilkan endapan berwarna hijau kehitaman, hal ini sesuai dengan teori yang ada yaitu bahwa methanol dan etanol mengandung gugus hidroksil. Sedangkan 2-butanol yang direaksikan dengan kromat menghasilkan larutan berwarna kuning kecoklatan dan terdapat endapan kehijauan. Dan pada aseton terbentuk larutan berwarna coklat disertai endapan. aseton tidak memilki gugus hidroksil tapi memiliki gugus karbonil, tetapi disini terjadi reaksi antara aseton dan kromat. Jadi yang merupakan senyawa yang mengandung gugus hidroksil adalah methanol, etanol dan 2-butanol. Reaksi yang terjadi sbagai berikut :
Metanol C H3 OH methanol
+
H2CrO4+
H2SO4 OH O formic acid+
2Cr2(SO4)3+
13H2O etanol OH C H3+
H2CrO4+
H2SO4 OH O C H3+
2Cr2(SO4)3+
13H2O ethanol acetic acid 2-butanol C H3 CH3 OH butan-2-ol+
H2CrO4+
H2SO4+
2Cr 2(SO4)3+
13H2O C H3 OH O 1-hydroxypropan-2-one4. Uji aldehida dan keton
a. Reagen : 2,4-dinitrofenilhidrazin
Uji aldehid dan keton yang pertama menggunakan reagen 2,4-dinitrofenilhidrazin dan sampel aseton dan benzaldehida. Menurut Fessenden (1986) semua senyawa aldehid dan keton akan menghasilkan endapan dengan pereaksi 2,4-dinitrofenilhidrazin. Reaksi ini umum digunakan untuk mengetahui adanya gugus aldehid dan keton. Reaksi positif ditamdai dengan larutan yang berwarna kuning , merah atau jingga. Benzaldehida dan aseton yang ditambahkan reagen 2,4-dinitrofenilhidrazin akan menghasilkan larutan berwarna kuning, hal ini menunjukkan terjadinya reaksi positif pada kedua sampel yang sesuai dengan teori bahwa benzaldehida dan aseton termasuk aldehid dan keton. Reaksi yang terjadi adalah sebagai berikut:
C H3 CH3 O propan-2-one
+
O2N NH NO2 NH2 (2,4-dinitrophenyl)hydrazine O2N NH NO2 N CH3 CH3 O H2+
1-(2,4-dinitrophenyl)-2-(propan-2-ylidene)hydrazine CHO benzaldehyde+
O2N NH NO2 NH2 (2,4-dinitrophenyl)hydrazine O H2+
O2N NO2 NH N (1E)-1-benzylidene-2-(2,4-dinitrophenyl)hydrazine b. Tes fehlingUji kedua menggunakan fehling yang mengidentifikasi adanya gugus keton dan gugus aldehida berdasarkan tingkat oksidasinya. Aseton yang ditambahkan dengan reagen fehling tidak mengalami perubahan warna yaitu berwarna biru tua atau pekat. Hasil ini menunjukkan uji negatif. Hal ini sesuai dengan teori karena aseton yang merupakan keton yang memiliki karbon karbonil yang sangat terlindungi dan pada gugus karbonil tidak mengikat atom H untuk dioksidasi sehingga tidak dapat bereaksi dengan fehling. Sedangkan benzaldehida yang ditambahkan fehling tidak dapat bereaksi. Larutan yang mengandung gugus aldehid akan menghasilkan endapan merah karena aldehid mampu mereduksi ion tembaga(II) menjadi tembaga(I) oksida. Bensaldehida seharusnya dapat bereaksi karena merupakan golongan dari gugus aldehid namun karena adanya kesalahan praktikan seperti kurang telitinya dalam praktikum, benzaldehid tidak dapat bereaksi. Reaksi yang seharusnya terjadi adalah:
CHO benzaldehyde
+
5OH-+
2Cu2+ O -O+
Cu2O+
3H2O benzoic acid c. Uji tollensAldehid dan keton keduanya mempunyai gugus fungsi yang sama yakni karbonil (C=O). Oleh karena itu, keduanya menjalani reaksi-reaksi yang sama. Biasanya aldehid bereaksi lebih cepat dari keton terhadap suatu pereaksi yang sama. Hal ini disebabkan adanya karbon karbonil dari aldehid yang lebih kurang terlindungi dibandingkan dengan karbon
karbonil pada keton. Begitu pula aldehid lebih mudah mengalami oksidasi daripada keton. Uji tollens juga mengidentifikasi aldehid dan keton berdasarkan tingkat oksidasinya. Reaksi positif teridentifikasi jika dihasilkan adanya cermin perak. Gugus aktif pada pereaksi tollens adalah Ag2O yang bila tereduksi akan menghasilkan endapan perak. Endapan perak akan menempel pada tabung reaksi yang akan menjadi cermin perak. Benzaldehida ditambahkan 1 mL AgNO3, 1 mL NaOH dan 5 tetes NH3, reaksi ini menunjukkan hasil positif karena terbentuknya endapan cermin perak. Reaksi tersebut menunjukkan larutan ion perak nitrat beramoniak direduksi oleh aldehida menjadi perak, sedangkan aldehid dioksidasi menjadi asamnya dimana perak tersebut mengendap berupa padatan hitam. Reaksinya sebagai berikut : CHO benzaldehyde
+
2[Ag(NO3)2]++
OH- O O NH3++
2Ag [(phenylcarbonyl)oxy]ammoniumKetiga sampel pada reaksi menghasilkan endapan dan terbentuknya campuran dengan 3 fasa. Pada asetofenon lapisan atas berbentuk gel, lapisan tengah cairan agak keruh dan yang paling bawah adalah endapan. Reagen tollens yang ditambahkan dengan aseton menghasilkan endapan putih keabu-abuan setelah dipanaskan. Hasil ini sesuai dengan teori yang menyatakan bahwa aseton yang merupakan golongan keton tidak dapat bereaksi dengan reagen tollens. Senyawa keton (aseton dan asetofenon) yang direaksikan seharusnya tidak terjadi perubahan pada larutan karena keton tidak dapat dioksidasi oleh reagen ini.
5. Uji fenol
Uji fenol ini menggunakan 3 sampel yaitu 2-butanol, 1 propanol dan fenol. 1 mL etanol ditambahkan ke 3 sampel tidak mengalami reaksi dan dapat dilihat dari tidak adanya perubahan warna larutan. Hal ini dikarenakan antara sampel dan reagen sama-sama memiliki gugus fungsi yang sama yaitu OH. FeCl3 kemudian ditambahkan ke masing-masing tabung reaksi sebanyak 1 tetes. FeCl3 sebagai larutan penguji bertujuan untuk menguji keberadaan gugus hidroksil yang terikat pada suatu karbon tak jenuh. Indikasi reaksi positif pada percobaan ini adalah terbentuknya larutan berwarna hijau, orange kemerahan, biru atau ungu. 1-propanol dan 2-butanol yang ditambahkan FeCl3 menjadi berwarna kuning bening yang menunjukkan reaksi negatif. Hal ini terjadi karena rantai alkil pada 1-propanol dan 2-butanol sangat sederhana sehingga penampakannya sangat kecil, selain itu 1-propanol merupakan alcohol primer yang kurang reaktif terhadap FeCl3. Ion Fe3+ yang terdapat pada FeCl3 tidak
mampu mensubstitusi gugus –OH yang ada pada rantai 1-propanol yang terikat dengan atom C.
Pada sampel fenol larutan berwarna kuning tua hampir mendekati orange dan lebih kuning dari 1-propanol dan 2-butanol, menunjukkan bahwa reaksi positif. Reaksi tersebut menunjukkan bahwa fenol mengandung gugus –OH yang terikat pada suatu karbon tak jenuh yang dapat bereaksi dengan FeCl3 membentuk senyawa kompleks. Reaksi antara fenol dan FeCl3 sebagai berikut:
OH phenol
+
FeCl3 Fe O 63-+
3H Cl+
3H+ KesimpulanKesimpulan yang dapat diambil dari beberapa percobaan adalah
1. Identifikasi suatu senyawa organik dapat dilakukan dengan menggunakan beberapa pereaksi khusus yang dapat dengan mudah mengidentifikasi suatu senyawa yang ditandai dengan perubahan warna, terbentuknya endapan dan lain-lain.
2. Penentuan gugus fungsional
a. Aseton dan etanol tidak dapat bereaksi dengan Br2 dan termasuk hidrokarbon jenuh, begitu juga dengan toluena dan benzaldehida, namun pada keadaan asam dapat bereaksi dengan Br2. Benzaldehida juga dapat bereaksi dengan KMnO4 dengan membentuk endapan hitam.
b. CHCl3 dan klorobenzena dapat diidentifikasi mengandung halogen Cl dengan reagen AgNO3 tetapi dengan reagen NaI hanya kloroform yang dapat diidentifikasi.
c. Etanol, metanol, dan 2-butanol merupakan senyawa turunan alkohol yaitu mengandung gugus OH diidentifikasi saat bereaksi dengan asam kromat akan menimbulkan warna hijau.
d. Aseton dapat diidentifikasi dengan reagen 2,4-dinitrofenilhidrazin. Benzaldehida dapat diidentifikasi dengan 2,4-dinitrofenilhidrazin dan uji tollens.
e. 2-butanol dan 1-propanol tidak terjadi perubahan ketika bereaksi dengan FeCl3 karena tidak mengandung gugus fenol. Fenol dapat bereaksi dengan FeCl dan diidentifikasi mengandung gugus fenol.
Saran
Untuk praktikum selanjutnya agar alat dan bahan diperlengkap sehingga praktikum dapat berjalan lebih cepat dan lancar serta data yang didapat lebih banyak dan dengan pembanding yang lebih banyak juga. sehingga praktikan akan lebih mengerti lagi. Untuk air kran hendaknya mengalir dengan lancar dan tidak mati karena digunakan untuk membilas alat yang akan digunakan lagi.
Referensi
Fessenden Ralph, J., dan Joan, S. Fesenden. 1982. Kimia Organik Edisi Ketiga Jilid I. Jakarta : Erlangga.
Matsjeh, Sabirin. 1986. Kimia Organik II. Jakarta: Gramedia. Purba, Michael. 2004. Kimia. Jakarta: Erlangga.
Tim Penyusun. 2014. Petunjuk Praktikum Kimia Organik. Jember: Universitas Jember.
Nama Praktikan