A. TINJUAN PUSTAKA
BAB II LANDASAN TEORI
1. SISTEM IMUN NEONATUS
Saat ini penelitian menunjukkan bahwa barrier pertahanan di permukaan terutama di saluran cerna dan kulit diketahui membentuk respon imun baik secara lokal dan sistemik dan bersifat tissue-spesific melalui sinyal terkait mikrobiota komensal (Dutzan et al, 2017). Sistem imun mamalia dipengaruhi oleh paparan mikroba komensal pada awal kehidupannya (Olzak et al, 2012). Menurut Anderson et al (2012) sistem pertahanan di mukosa terutama di intestinum manusia disusun oleh beberapa lapisan meliputi barier ekosistem mikrobiota komensal, barier kimiawi, barier fisik dan barier imunologis.
a. Barier ekosistem mikrobiota
Barier ekosistem mikrobiota tersusun atas koloni mikrobiota komensal yang melindungi sistem imun dengan menghambat pertumbuhan bakteri yang bersifat patogen, berinteraksi dengan sel epitel, mempengaruhi proliferasi sel, mempengaruhi metabolisme dan homeostasis sistem imun.
Mikrobiota komensal juga mensekresi anti mikroba dan menstimulasi produksi musin yang keduanya diperlukan sebagai barier kimiawi. Pemetaan mikrobioma dalam beberapa dekade terakhir yang terutama menunjukkan bahwa tubuh manusia merupakan ekosistem mikrobiota dan sel tubuh yang harus dijaga keseimbangannya.
Ketidak seimbangan mikrobiota yang disebut disbiosis diketahui berkaitan dengan disregulasi mekanisme fisiologis yang menjaga homeostasis sistem imun dan sistem organ yang lain yang dapat bermanifestasi sebagai berbagai penyakit bukan hanya penyakit infeksi akan tetapi juga penyakit lain seperti inflammatory bowel disease (IBD), asma, alergi, diabetes mellitus (DM), kanker kolorektal dll (Levy et al, 2017). Perubahan keseimbangan ekosistem mikrobiota (disbiosis) akan menyebabkan fungsi pertahanan tubuh terganggu. Menurut penyebabnya terdapat 3 macam disbiosis yaitu:
9
commit to user
1) Jumlah patobion yang meningkat
Patobion adalah bagian dari mikroba komensal yang mempunyai potensi menyebabkan gangguan pada tubuh host. Salah satu contoh populasi Enterobacteria di dalam intestenum tenue. Pertumbuhan yang berlebihan dari Enterobacteria akan memicu inflamasi pada ekosistem intestinum. Stecher et al (2010) membuktikan peningkatannya dijumpai pada para penderita inflammatory bowel disease (IBD) dan pada tikus model IBD (Levy et al,2017).
2) Kehilangan mikrobiota komensal
Kehilangan mikrobiota komensal atau berkurangnya mikroba komensal telah dikaitkan dengan beberapa jenis penyakit seperti autis dan infeksi. Hsiao et al (2013) membuktikan bahwa pemberian Lactobacillus reuteri pada tikus model dan pemberian Bacterioides fragilis pada ibu mampu mengurangi derajat keparahan penyakit. Pemberian mikroba komensal yang hilang juga dapat mengobati penyakit infeksi. Hal ini dibuktikan oleh penelitian Buffie et al (2015) pemberian Clostridium scindens pada intestinum yang terinfeksi Clostridium difficile (Levy et al,2017).
3) Berkurangnya diversitas mikrobioma
Menurut Yatsunenko et al (2012) diversitas mikrobiota meningkat pesat pada usia satu tahun. Menurut Cotillard et al (2013) diversitas mikrobiota sangat dipengaruhi oleh diet. Bahkan menurut Le Chatelier et al (2013) diversitas mikrobiota yang menurun akan menyebabkan banyak gangguan metabolik dan dikaitkan dengan komposisi diet yang abnormal.
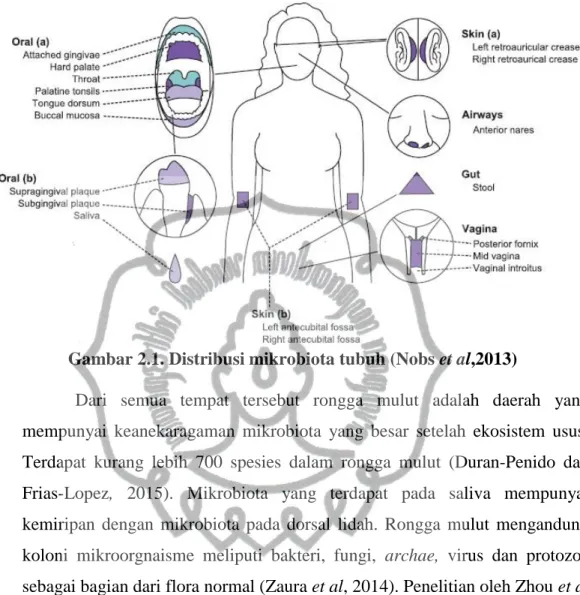
Berkurangnya diversitas mikrobiota juga dipengaruhi oleh biomolekul yang diproduksi oleh tubuh (Levy et al,2017; Nobs et al, 2013).Tubuh manusia merupakan ekositem mikrobiota, distribusi mikrobiota di seluruh tubuh manusia adalah sebagai berikut:
Gambar 2.1. Distribusi mikrobiota tubuh (Nobs et al,2013)
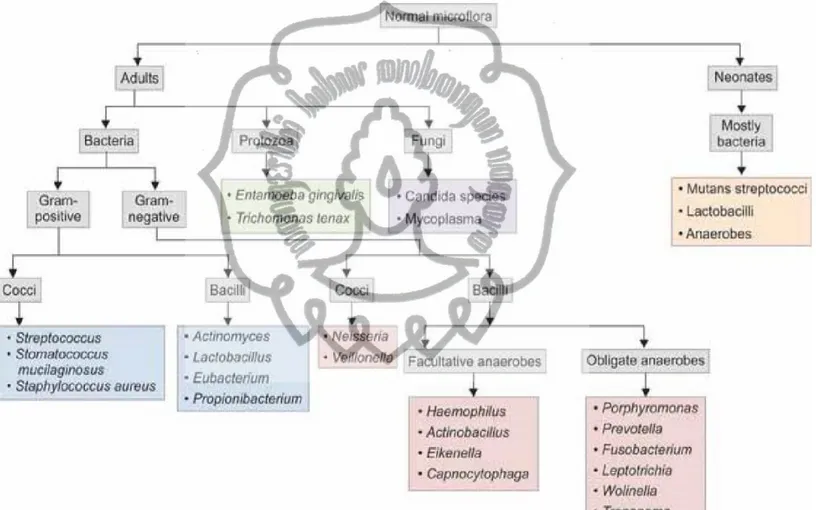
Dari semua tempat tersebut rongga mulut adalah daerah yang mempunyai keanekaragaman mikrobiota yang besar setelah ekosistem usus.
Terdapat kurang lebih 700 spesies dalam rongga mulut (Duran-Penido dan Frias-Lopez, 2015). Mikrobiota yang terdapat pada saliva mempunyai kemiripan dengan mikrobiota pada dorsal lidah. Rongga mulut mengandung koloni mikroorgnaisme meliputi bakteri, fungi, archae, virus dan protozoa sebagai bagian dari flora normal (Zaura et al, 2014). Penelitian oleh Zhou et al (2013) pada 200 responden yang mempunyai oral higiene yang baik menunjukkan terdapat 185-355 genera bakteri dan mencakup 13-19 phyla.
Sampel diambil dari 9 tempat di dalam mulut meliputi mukosa buccal, palatum durum, keratinized gingiva, tonsila palatina, saliva, dan plak sub- dan supragingiva, tenggorokan dan dorsal lidah Bakteri yang dominan di mukosa buccal, palatum durum, gingiva, tenggorokan dan dorsal lidah adalah Streptococcus. Saliva mengandung beberapa bakteri yang dominan meliputi Prevotella, Streptococcus, Tannerella Veillonella, Fusobacterium, Porphyromonas dan Neisseria (Zaura et al, 2014).
commit to user
Mikrobiota ini menghasilkan biomolekul yang mempunyai banyak fungsi, sehingga apabila terjadi gangguan keseimbangan akan menyebabkan penyakit. Perubahan pada mikrobiota ini dapat menyebakan penyakit karies, periodontitis, tonsilitis dan bahkan penyakit sistemik (Duran-Penido and Frias- Lopez, 2015). Perubahan mikrobiota ini dapat disebabkan oleh jenis mikrobiota yang dominan dan produknya yang mempengaruhi mikrobiota lain, dan interaksinya dengan sel manusia. Selain itu biomolekul yang diproduksi tubuh manusia sendiri juga akan mempengaruhi komposisi mikrobiota. Terdapat banyak faktor mempengaruhi keragaman mikrobiota tubuh manusia antara lain umur, daerah geografis, diet ibu dan bayi, metode pemberian makanan bayi termasuk budaya perawatan bayi, pemberian ASI, gaya hidup, paparan antibiotik, biomolekul tubuh dan lain-lain (Levy et al, 2017; Miyoshi et al, 2017)
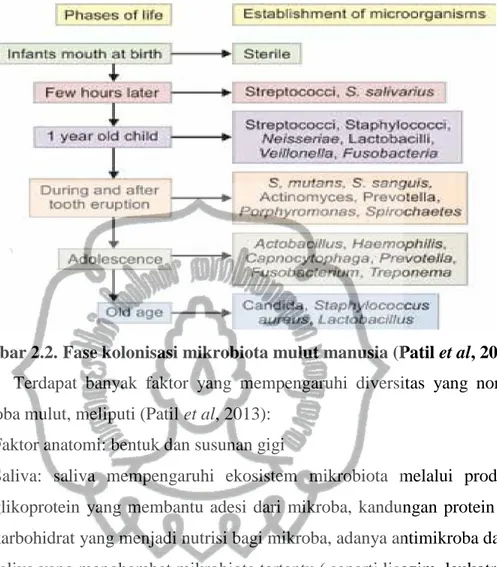
Diversitas oral mikrobiota neonatus berbeda dengan oral mikrobiota orang dewasa. Pada saat lahir mulut neonatus awalnya steril dan saat lahir mulut akan akan terpapar oleh mikrobiota komensal. Kolonisasi mikroba dalam mulut neonatus terjadi segera setelah lahir. Organisme yang segera terkolonisasi pada mulut neonatus adalah Streptococcus salivarius. Lactobacillus tidak didapatkan pada saat neonatus. Setelah satu tahun kemudian populasi didominasi oleh bakteri aerob seperti Streptococcus,Neisseria, Veillonella, Lactobacillus dan Actinomyces. Biodiversitas meningkat dengan adanya erupsi gigi pertama yang akan menyebabkan permukaan mukosa non shedding dikolonisasi oleh mikrobiota. Puncaknya kolonisasi bakteri terjadi setelah gigi mengalami erupsi secara sempurna. Ketika manusia menua dan gigi mulai tanggal maka populasi microbiota akan kembali seperti ketika masa kanak-kanak yang giginya belum mengalami erupsi (Patil et al, 2013). Berikut ini adalah fase kolonisasi mikrobiota pada mulut manusia:
Gambar 2.2. Fase kolonisasi mikrobiota mulut manusia (Patil et al, 2013) Terdapat banyak faktor yang mempengaruhi diversitas yang normal mikroba mulut, meliputi (Patil et al, 2013):
i) Faktor anatomi: bentuk dan susunan gigi
ii) Saliva: saliva mempengaruhi ekosistem mikrobiota melalui produksi glikoprotein yang membantu adesi dari mikroba, kandungan protein dan karbohidrat yang menjadi nutrisi bagi mikroba, adanya antimikroba dalam saliva yang menghambat mikrobiota tertentu ( seperti lisozim, leukotrien , IgA, histatin dan salivary leukocytes inhibitor (SLPI)) dan melalui kemampuannya membuffer pH.
iii) Faktor mikroba: terdapat persaingan antar mikroba yang melibatkan mekanisme kompetisi reseptor. Beberapa mikroba akan memproduksi protein yang bersifat mengahmbat adesi mikroba lain atau bersifat toksik terhadap mikrobiota yang lain. Seperti Streptococcus salivarius yang memproduksi enocin yang akan bersifat toksik terhadap Streptococcus pyrogenes. Beberapa bakteri memproduksi metabolit yang mempengaruhi pH. Dan metabolit-metabolit bakteri ini akan menjadi nutrisi dan mempengaruhi bakteri yang lain. Selain itu bakteri mempunyai sifat ko- agregrasi dengan spesies yang lain.
commit to user
iv) Gingival crevical fluid (GFC): cairan di periodontal ini akan menyapu mikroba keluar dari area periodontal, selain itu cairan ini juga mengandung nutrisi bagi mikrobiota di crevical gigi, menjaga pH gigi, seperti halnya saliva cairan ini juga mengandung IgA dan sel imunitas seperti neutrofil yang berperan sebagai fagositosis.
v) Faktor lain: pH yang dipengaruhi saliva dan diet karbohidrat, potensial oksidasi -reduksi, antibiotik, diet yang mengandung karbohidrat yang terfermentasi adalah komponen diet yang meningkatkan bakteri tahan asam seperti Lactobacillus, faktor iatrogenik( seperti scalling ,penggunaan kawat), variasi diurnal (diversitas tertinggi saat bangun tidur), obat-obatan seperti obat yang mengurangi aliran saliva dan ekstraksi gigi yang akan menurunkan Streptococcus mutant dan S.sunguinis.
Ekosistem mikrobiota yang mengalami disbiosis dapat menyebabkan berbagai macam penyakit melalui peningkatan metabolit trimethylamin N- oxide (TMAO), peningkatan 4- ethylphenylsulphate (4-EPS), penurunan short chain fatty acids (SCFA), penurunan asam empedu dan ligan aryl hydrocarbon receptor (AHR-ligand). Selain itu juga melalui mekanisme imunologis. Disbiosis juga akan menganggu perkembangan, maturitas dan organisasi organ limfoid mukosa. Menurut Randall dan Mebius (2014) peran mikrobiota dalam perkembangan organ limfoid mukosa ternyata sebagian besar sangat tergantung pada kolonisasi mikrobiota dan beberapa sinyal terpenting yang terutama berkaitan dengan retinoic acid dan beberapa sinyal yang melibatkan peran sel dendritik, sel stroma dan sel limfosit. Selain itu mikrobiota komensal akan mempengaruhi homeostasis sistem imun baik innate dan adaptif.
b. Barier Kimiawi
Barier kimawi tersusun atas biomolekul yang diproduksi baik oleh tubuh maupun oleh bakteri asam lambung, protease, musin dan peptida anti mikroba patogen (Anderson et al, 2012). Sekresi asam lambung, protease dan peptida anti mikrobiota patogen pada neonatus belum berkembang sempurna.
(Levy et al, 2017). Lapisan mukus yang menutupi saluran cerna bayi baru lahir sangat berbeda dengan manusia dewasa , dan berpengaruh terhadap diversitas mikrobiota dan peningkatan risiko terjadinya infeksi (Anderson et al, 2012;
Miyoshi et al, 2017). Peranan mikrobiota komensal terhadap kesehatan manusia selain oleh diversitasnya juga dipengaruhi oleh biomolekul yang diproduksinya. Berikut ini tabel yang menunjukkan biomolekul yang diproduksi oleh mkrobiota yang mempengaruhi fungsi tubuh:
Tabel 2.1. Biomolekul yang diproduksi oleh mikrobiota rongga mulut (Nobbs et al, 2015)
Kandungan biomolekul
Mikrobiota yang memproduksi
Efek
Acyl-homoserine lactones (AHLs)
Pseudomonas Membunuh filamen hifa C.albicans, kemoatraktan neutrofil, menstimulasi fagosit, meremodeling sel epitel
Muropeptida S.pneumonia Memicu C.albican mengalami transisi hifa, memicu produksi IFN Ɣ dan IL-17
iE.DAP P.gingivalis Mengaktifkan NOD,
menstimulasi produksi TNFα, IL- 6, CCL2, IL8 dan defensin Farnesol C.albicans Menghambat filamentasi
C.albicans, meningkatkan TLR2 epitel, meningkatkan IL-6 dan produksi HBD
Indole Fusobacterium,
T.denticola
Meningkatkan apoptosis, mendown regulasi IL-8 dan meningkatkan IL-10 Hidrogen
peroksida
Streptococcus, Lactobacillus
Membunuh mikroorganisme patogen, memicu stress oksidatif di bakteri dan fungi,memicu filamentasi C.albican
Oxylipin C.albicans Meningkatkan migrasi neutrofil, mempengaruhi integritas mukosa Kandungan
neuroaktif
Lactobacillus Anti inflamasi
Butyrate P.gingivalis Reaktifasi HIV-1, mennyebabkan
berhentinya siklus sel fibroblas
commit to user
Tabel 2.1. menunjukkan bahwa mikrobiota rongga mulut dapat mempengaruhi sitem imun dan bekerja secara simbiosis mutualisme dengan manusia. Selain biomolekul yang diprodsuki mikrobiota tubuh manusia pun memproduksi biomolekul yang mempengaruhi diversitas mikrobiota. Berikut ini biomolekul tubuh yang dapat mempengaruhi diversitas mikrobiota:
Tabel 2.2. Biomolekul tubuh yang mempengaruhi mikrobiota (Nobbs et al, 2015)
Biomolekul tubuh
Efek
Estradiol Meningkatkan pertumbuhan C. Albican, menghambat respon DCs dan respon Sel TH17.
Katekolamin Menstimulasi Actinomyces, Campilobacter dan menghambat P.gingivalis
Hidrogen peroksida Membunuh mikroorganisme patogen, memicu stress oksidatif di bakteri dan fungi,memicu filamentasi C.albican
Peptida antimikroba Menghambat mikroba patogen
Tabel 2.2. menunjukkan hormon estradiol cenderung menghambat respon DCs dan respon Th17, sedangkan hidrogen peroksida akan membunuh mikrobiota patogen.
c. Barier fisik
Barier fisik pada neonatus dibentuk oleh sel-sel epitel (keratinosit pada palatum dan mukosa mulut, sel kuboid bersilia pada saluran nafas, sel kolumner pada usus dll), sel-sel microfold dipermukaan mucosa- associated lymphoid tissue (MALT) (Anderson et al, 2012). Rongga mulut bayi dilapisi oleh mukosa berepitel skuamus kompleks yang tersusun oleh sel-sel keratinosit, dan mengandung air liur/kelenjar saliva, enzim- enzim pencernaaan dan organ-organ limfoid cincin waldeyer, nasopharingeal associated limfoid tissue (NALT) , dan salivary duct associated lymphoid tissue/ (SDALT). Mukosa gastrointestinal dilapisi oleh selapis sel epitel kolumner yang sebagian besar mengandung sel goblet. Organ limfoid mulut ini merupakan bagian dari MALT. Mucosa- associated lymphoid tissue (MALT) ini juga terdapat pada lamina propia sepanjang saluran pencernaan commit to user
Mukosa di rongga mulut dan saluran cerna bagian atas dilapisi oleh epitel skuamus kompleks yang terususun oleh keratinosit. Keratinosit adalah sel yang bersifat imunokompeten oleh karena dapat memproduksi sitokin.
Keratinosit yang teraktifasi akan mempengaruhi migrasi sel- sel imun ke epidermis dengan mengekspresikan intercellular adhesion molecul- 1 (ICAM- 1). Selain itu dalam epidermis juga dapat dijumpai adanya sel APC yang disebut sel Langerhans (Salmon et al, 1994). Selain keratinosit sel epitel mukosa usus dan saluran nafas dilapisi oleh sel kolumner selapis yang juga mempunyai kemampuan memproduksi sitokin pada kondisi teraktifasi Stadynk (2002), seperti halnya keratinosit.
c. Barier imunologis.
Barier imunologis dibentuk oleh sIgA, sel-sel fagosit dan APC, sel limfosit di perifer, sistem organ limfoid perifer seperti di mukosa dan organ limfoid sentral (Anderson et al, 2012). Barrier imunologis secara garis besar terbagi atas sistem imun innate dan adaptif, dimana keduanya saling terkait dan bekerjasama.
Perkembangan sistem imun dimulai pada masa awal terbentuknya embrio. Diawali oleh perkembangan hepar janin dan diikuti oleh hematopoietic stem cell progenitors (HSCs) pada sunsum tulang. Limfosit T berasal dari proses hematopoiesis dan bakal organ limfoid di perifer. Sistem hematoopoesis terjadi di hati (fetal) dan sumsum tulang, hanya sebagian kecil subset sel hematopoesis berada pada sirkulasi darah. Sel Progenitor pluripoten akan membelah dan berdifferensiasi menjadi mieloid dan limfoid. Sel Mieloid sebagai prekusor sel eritrosit, trombosit, granulosit dan monosit. Sel progenitor limfoid akan menjadi limfosit B yang mengalami maturasi melalui sunsum tulang, melalui timus menjadi limfosit T dan sel NK (Natural Killer).
Sebagian besar maturitas sel T di seluruh tubuh terjadi di timus, sedangkan sel B terjadi di sunsum tulang (Abbas et al, 2012).
Fase maturitas sel T dimulai sejak masa janin. Kelenjar timus merupakan tempat untuk maturasi sel T. Sel T CD4+ dan CD8+ matur
commit to user
dijumpai di perifer segera setelah lahir (Simon et al, 2015). Kelenjar ini mengalami involusi seiring dengan berjalannya umur , setelah pubertas kelenjar tersebut tidak terdeteksi. Maturasi sel T yang terus berlangsung pada masa dewasa akan meningkatkan cadangan limfosit memori. Sel T memori dapat bertahan sampai lebih dari 20 tahun (pada manusia). Sel T akan menurun secara individual dengan bertambahnya umur (Abbas et al, 2012).
Sel progenitor yang berasal dari fetal liver dan sumsum tulang masuk ke sirkulasi darah, menembus endotel post vena post capiler ke corticomedullare junction kelenjar timus (daerah peralihan antara korteks dan medulla). Pada manusia limfosit imatur terdeteksi pada timus setelah usia kehamilan 7- 8 minggu. Sel T didalam kelenjar timus disebut timosit. Setelah 7 minggu pada masa gestasi sel T progenitor mengekspresikan reseptor CD34 dan bermigrasi ke timus, selanjutnya berdiferensiasi menjadi subset yang matur dengan reseptornya seperti CD4, CD8 dan reseptor sel T sel αβ (TCRs). Sebagian kecil dari sel T progenitor didalam hepar janin ini mempunyai reseptor TCRs γ/δ pada usia 6–8 minggu kehamilan, dan tidak bermigrasi ke timus untuk maturasi. (Abbas et al, 2012).
Timosit yang belum matang terletak pada sinus subkapsul (diluar korteks) kelenjar timus. Di dalam timus sel T akan mengalami proses maturasi dan seleksi. Proses maturasi progenitor limfosit pada kelenjar timus dan sumsum tulang melibatkan gen yang mengatur reseptor spesifik pada membran sel. Terdapat 2 subset sel T yang mengekspresikan protein reseptor sel T (TCRs) γ/δ dan α/β. Pada tikus yang terekspresi pertama kali adalah γδ TCR, 3-4 hari setelah sel T berada di timus. αβ TCR terekspresi 2-3 hari berikutnya. Pada manusia, timus pada janin γδ TCR terekspresi mulai usia kehamilan 9 minggu diikuti ekspresi αβ TCR pada minggu ke 10. Sel yang mengekspresikan TCRs γ/δ di dalam hepar janin tidak bermigrasi ke timus untuk maturasi. Meskipun demikian sel ini berperan penting dalam pertahanan bakteri pada fase awal kehidupan janin. Penelitian pada tikus menunjukkan
bahwa sel TCR-γ/δ cells menstimulasi sel DCs memproduksi sitokin dan kemokin yang dapat mengaktifasi sel imun adaptif (Abbas et al, 2012).
Limfosit T α/β bermigrasi ke timus melalui beberapa fase perkembangan yang menghasilkan timosit TCR+ yang terkait dengan liniage CD4 atau CD8 dan berperan penting dalam pengenalan antigen dan aktifasi sel T. Sel T jenis ini akan keluar dari timus pertama kali dalam bentuk fenotip dan fungsi yang imatur disebut sel T recent thymic emigrants (RTEs).
Karakteristik sel TCD4+RTEs nenonatus tikus condong pada karakteristik Th2 yang mengkespresikan IL-4, IL-5, dan IL-13. Manusia pada periode neonatus diketahui darah tali pusatnya kaya dengan sel T RTEs yang dapat berproliferasi setelah dipicu dengan IL-7 tanpa keterkaitan dengan TCR. Pada neonatus regulasi melalui jalur reseptor IL-7Rα mengalami down regulasi dibandingkan dengan pada RTEs dewasa, sedangkan jalur aktifasi melalui pSTAT5 setelah terpapar IL-7 mengalami up regulasi lebih tinggi. Sitokin seperti IL-7 menginduksi proliferasi limfosit T di timus. Sitokin IL-7 diproduksi oleh kelenjar timus dan membantu pergerakan sel T dari timus (Randall dan Mebius, 2014).
Saat migrasi timosit dari korteks ke medulla , sel T mengalami seleksi positif dan negatif. Sel yang sukses pada proses seleksi , menjadi matur pada bentuk CD4+ atau CD8+ . Limfosit selanjutnya terdistribusi , 2% di darah, 10% di sunsum tulang, dan 65% berada di limpa dan organ limfoid sekunder Limfosit intra mukosa saluran cerna dan pernafasan adalah 15% dari total limfosit yang ada pada tubuh manusia (5x1011). Sistem imun neonatus selanjutnya akan mengalami maturasi pada 3 bulan pertama kehidupannya (Abbas et al, 2012).
Limfosit di mukosa berasal dari timus dan sunsum tulang, dan ada yang berasal dari innate lymphoid cells (ILCs). Innate lymphoid cells (ILCs) merupakan turunan dari progenitor limfoid pada umumnya dan berasal dari turunan hepar fetus. Sel ini mempunyai karakteristik yang menyerupai sel-sel imun alamiah (innate immunity) sehingga disebut innate lymphoid cells
(ILCs). commit to user
Sel –sel ini mengekspresikan lebih sedikit antigen reseptor, akan tetapi berperan penting dalam homeostasis sistem imun. Innate lymphoid cells ( ILCs) dan Lti merupakan sel yang berperan penting dalam perkembangan organ limfoid pada masa pre natal. Pada tikus RORγt+ ILCs terutama berada di lamina propia intestinum, dan diperlukan dalam perkembangan dari struktur folikel limfoid seperti cryptopatches dan isolated lymphoid follicles.
Dari isolated lymphoid follicles inilah selanjutnya terjadi produksi IgA yang pada prosesnya sangat tergantung dengan sel T ( Randal and Mebius, 2014).
Perkembangan ILCs tidak tergantung rekombinasi reseptor antigen dan seleksi klonal, akan tetapi pada lymphoid cell growth factors interleukin-7 (IL- 7) dan thymic stromal lymphopoietin (TSLP). Sel ILCs ini saat ini terbagi menjadi 3 kelompok sel meliputi:
i) Sel yang perkembangannya tergantung pada reseptor inti retinoic acid receptor-related orphan receptor-γt (RORγt) yaitu sel lymphoid tissue inducer (LTi) cells (atau sel ILC17) dan sel yang mengekspresikan penanda natural killer (NK) cell markers (seperti NKp46) yang disebut ILC22. Sel ILC22 berperan penting dalam produksi peptida anti mikroba, dan ILC2 mempunyai karakteristik seperti Th2.
ii) Sel yang tidak mengekspresikan RORγt akan tetapi perkembangannya tergantung pada RORα, disebut ILCs tipe 2.
iii) Sel ILC 1 adalah sel tipe sel yang memproduksi sitokin seperti Th1interferon-γ (IFNγ) dan juga sel NK.
Limfosit di mukosa terdistribusi di intra epitel dan di lamina propia.
Limfosit intra epitel menurut asalnya dibagi menjadi 2, yaitu natural intra ephitelial lymphocytes (natural IELs) dan induced IELs (Cheroutre et al, 2011). Natural IELs berasal dari sel T yang mengalami maturasi di timus dan sejak lahir sudah berada di intra epitel, sedangkan induced IELs yang berada di mukosa berasal dari limfosit naif yang teraktivasi dan mempunyai karakteristik limfosit efektor dan limfosit memori (Brandztaeg, 2007;
Cheroutre et al, 2011). Sel limfosit di mukosa ini membentuk struktur sistem imun di perifer yang terkumpul dalam organ lmfoid perifer.
Sistem imun perifer berkembang dengan mekanisme dan waktu yang bervariasi. Perkembangan dan maturasi sel limfoid progenitor di mukosa diatur oleh banyak faktor meliputi sitokin, sel stroma, faktor transkripsi dan komponen matriks ekstraseluler. Limfonodi berkapsul muncul sejak masa embriogenesis dan terus mengalami maturitas dan organisasi berlanjut sesudah lahir, demikian pula Peyer’s patches. Berbeda dengan limfonodi, Peyer’s patches menurut beberapa literatur disebutkan masih berkembang hingga masa kelahiran karena paparan limfotoksin dan sitokin sel B. Mucosa associated lymphoid tissue(MALT) yang lain (colonic patches,NALT, TALT) berkembang setelah lahir. Menurut beberapa literatur jaringan limfoid ektopik (BALT, gastric MALT), Cryptopaches, FLTs dan milky spots omentum mulai berkembang setelah lahir. Maturasi sempurna dari semua jaringan ini tergantung pada keberadaan mikrobiota komensal (Randall dan Mebius, 2014).
Beberapa literatur menjelaskan jaringan limfoid ektopik seperti BALT hanya dapat berkembang bila ada infeksi atau inflamasi (Randall dan Mebius,2014). Sebagian besar MALT, semua jaringan limfoid ektopik dan FLTs maturitas dan organogenesisnya dipengaruhi oleh paparan mikrobiota komensal dan antigen (Nagatake (2009); Fukuyama et al (2002)). Menurut Rennert et al (1996) limfonodi mesenterika mulai terbentuk pada masa embrionik pada hari ke 9–10, limfonodi brachial pada hari ke-13, limfonodi aksila pada hari ke-15, limfonodi inguinal hari ke-16, and limfonodi popliteal pada hari ke-17 (Randall dan Mebius, 2014).
Sistem imun dimukosa tersusun atas sel-sel imun intra epitel dan di lamina propia, serta organ limfoid mukosa. Menurut Randall dan Mebius (2014) ada 4 tipe organ limfoid yang melindungi mukosa meliputi limfonodi berkapsul, mucose associated lymphoid tissue (MALT) yang secara langsung berhubungan dengan jaringan mukosa, fat-associated lymphoid tissues, dan
commit to user
jaringan limfoid tersier ektopik. Randall dan Mebius (2014) menjelaskan bahwa setiap tipe organ ini mempunyai ciri khas struktur, perkembangan dan fungsi yang spesifik dalam mengatur sistem pertahanan mukosa sesuai areanya. Berikut ini adalah macam-macam organ limfoid di mukosa:
i) Limfonodi berkapsul
Limfonodi berkapsul mempunyai struktur yang serupa walau daerahnya berbeda, berbentuk seperti kacang yang mempunyai pembuluh limfe aferen dan eferen. Struktur limfonodi ini mengumpulkan antigen dan sel penyaji antigen/ antigen presenting cells (APC) melalui pembuluh limfe aferen. Selanjutnya aliran limfe akan diteruskan melalui sinus subkapsul yang berada di atas korteks. Di dalam sinus ini aliran limfe akan disaring melalui makrofag dan DCs yang melapisi sinus, selanjutnya akan diteruskan ke zona sel T yang berada di dalam pusat korteks. Folikel sel B berada di batas area korteks. Limfosit masuk ke dalam limfonodi melalui venula yang disebut high endothelial venules (HEVs) yang berada zona sel T dan di sekeliling folikel B. Limfosit ini akan keluar dari limfonodi melalui jaras-jaras medulla sehingga mencapai pembuluh limfe eferen, dan akan beredar secara sistemik ke pembuluh darah dan area efektornya (Randall dan Mebius,2014).
ii) . Mucosa associated limfoid tissue MALT)
Mucosa associated limfoid tissue (MALT) mempunyai struktur yang sangat berbeda dengan limfonodi berkapsul. Struktur MALT tidak berkapsul, tertanam langsung dalam lapisan sub mukosa organ dan tidak mempunyai pembuluh limfe. Di area nasofaring dapat dijumpai nasopharingeal associated lymphoid tissue (NALT), dan di kulit skin associated lymphoid tissue (SALT) (Randall dan Mebius (2014)). Pada usus halus dan kolon, folikel limfoid terusun atas isolated lymphoid follicles ( ILFs) dan cryptopatches. Area ini dalam usus halus disebut dengan Peyer’s patches), sedangkan di kolon disebut colonic patches.
Berbeda dengan MALT yang lain pada Peyer’s dan colonic patches dapat pula ditemukan pembuluh limfe eferen (Randall and Mebius, 2014).
Antigen dikumpulkan di MALT tidak melalui pembuluh limfe akan tetapi melalui permukaan mukosa yang dilapisi lapisan epitel khusus yang membentuk bangunan seperti kubah disebut follicle-associated epithelium (FAE). Dalam lapisan epitel ini terdapat sel epitel spesifik yang disebut sel microfold (M cells). Dendritic cells (DCs) berada di bawah kubah epitel ini. Sel dendritik juga berada dalam kantung basolateral dari sel M. Folikel sel B mengisi area kubah dan zona T berada di samping folikel B atau diantara folikel. Setiap bakal MALT seperti halnya NALT tersusun atas venula yang disebut high endothelial venulas (HEVs). Venula dari organ limfoid mukosa berada di sekeliling folikel dan zona T (Randall dan Mebius, 2014).
iii) Fat-associated lymphoid tissues (FLTs)
Fat-associated lymphoid tissues (FLTs) mempunyai struktur yang berbeda dari limfonodi dan jaringan limfoid klasik dalam mukosa. Struktur FLTs tidak berkapsul dan tidak berada secara langsung di bawah mukosa, akan tertapi tertanam pada jaringan adiposa. Dalam mesenterium FLTs ini membentuk kelompok yang disebut fat-associated lymphoid clusters (FALCs). Pada omentum FLTs ini disebut sebagai milky spots. Moro et al menjelaskan bahwa antigen dan sel dari usus akan dibawa melalui aliran limfe ke FALCs, selain itu juga ada mekanisme lain menurut Randall dan Mebius (2014) yaitu melalui paparan langsung antigen ke dalam rongga peritonum yang melewati fenestrasi lapisan mesotel. Proses ini juga terjadi pada milky spots dari omentum milky spots ini merupakan struktur yang didominasi oleh kelompok sentral besar sel B, yang menurut Rangel- Moreno et al (2010) terlihat hanya mengandung sedikit sel dendritik folikel/ follicular DC (FDC)( Randall dan Mebius (2014)). Area ini tidak memperlihatkan gambaran folikel B yang tegas. Selain itu zona T dalam milky spot juga terbatas pada sekeliling area sel B. Rangel-Moreno et al
commit to user
(2010) seperti dikutip oleh Randall dan Mebius (2014) menjelaskan bahwa venula HEVs ditemukan disekeliling milky spots berbeda dengan HEVs pada Peyer’s patches dan limfonodi mesenterika. High endothelial venulas (HEVs) disekeliling milky spots mengekspresikan adressin limfonodi perifer, sedangkan HEVs pada Peyer’s patches dan limfonodi mesenterika mengekspresikan mucosal addressin cell adhesion molecule. Struktur FALCs tidak teratur akan tetapi baik FALCs maupun milky spots keduanya di dominasi oleh sel B (Randall dan Mebius (2014).
iv) Folikel limfoid ektopik
Folikel limfoid ektopik berkembang tidak seperti jaringan limfoid yang lain. Jaringan limfoid yang lain sudah tumbuh dari bakal organ yang sejak awal berkembang secara independen tanpa tergantung paparan antigen atau kolonisasi mikrobiota. Folikel limfoid ektopik terbentuk setelah lahir sebagai respon terhadap infeksi dan inflamasi. Folikel limfoid ektopik ini meliputi bronchus-associated lymphoid tissue (BALT) dan gastric-associated lymphoid tissue (GALT). Randall dan Mebius (2014) menjelaskan bahwa struktur histologi folikel limfoid ektopik ini menyerupai jaringan limfoid konvensional. Bronchus-associated lymphoid tissue (BALT) mempunyai folikel sel B luas yang terletak ditengah, zona sel T terpisah, sel stroma spesifik, venula HEVs dan pembuluh limfe. Pada beberapa kasus didapatkan variasi dimana BALT menyerupai Peyer patches dan NALT, mengandung kubah epitel dan sel M. Bronchus-associated lymphoid tissue (BALT) juga dapat dijumpai di daerah perivaskuler paru yang jarang dijumpai kubah epitel. Variasi yang lain adalah struktur BALT yang mengandung folikel sel B dan sentrum germinativum akan tetapi zona T-nya lebih jarang terlihat. Variasi struktur jaringan limfoid ektopik secara garis besar meliputi gambaran yang mempunyai kelompok sel B yang lebih jarang hingga struktur multi folikel yang banyak. Tidak seperti ILFs yang berkembang dari cryptopatches yang lokasinya tertentu, jaringan limfoid ektopik berkembang pada lokasi-
lokasi yang bervariasi dari prekusor yang belum diketahui secara jelas (Randall and Mebius, 2014).
Mekanisme perkembangan organ limfoid mukosa terjadi melalui beberapa jalur mekanisme, meliputi:
i) Mekanisme utama: peranan Ltis
Menurut Honda et al (2001) organ limfoid dalam perkembangannya membutuhkan interaksi resiprokal antara berbagai sel inisiator atau inducer (disebut lymphoid tissue inducer (LTi cells)) dengan jaringan penyokong limfoid atau sel stroma. Sel Lti atau disebut juga innate lymphoid cells (ILCs) perkembangannya dalam beberapa literatur, membutuhkan faktor transkripsi RAR-related orphan receptor γt (RORγt) dan Id2. Selain itu LTis juga mengekpresikan CXC-chemokine receptor 5 (CXCR-5), CCR-7, reseptor untuk CXC-chemokine ligand-13 (CXCL13) dan CCL19/CCL21.
Sel LTis dalam peranannya mengatur perkembangan organ limfoid mengekspresikan limfotoksin yang diperlukan untuk mengaktifkan jalur sinyal nuclear factor-κB( NfkB) pada sel lymphoid tissue organizer yang mengekspresikan reseptor limfotoksin lymphotoxin β. Ikatan limfotoksin dengan reseptor ini akan menyebabkan peningkatan ekspresi kemokin homeostatis dan sitokin meliputi CXCL-13, CCL-19, CCL-21, interleukin- 7 (IL-7), dan receptor activator of NF-κB ligand (RANK), yang akan menarik dan mendukung fungsi pertahanan hidup sel Ltis (Randall dan Mebius, 2014).
Menurut Link et al(2007) sel lymphoid tissue organizer berdiferensiasi menjadi beberapa tipe sel stroma meliputi sel fibroblastik retikuler dalam dan follicular dendritic cells (FDCs). Sel-sel penyokong ini membentuk kerangka jaringan limfoid dan membentuk kompartemen anatomis dan dendritic cells (DCs). Terbentuknya jaringan limfoid ini akan menyebabkan limfotoksin seterusnya diekpresikan oleh limfosit adaptif terutama sel B. Jaringan limfoid mukosa secara individual
commit to user
terbentuk dengan mekanisme yang sama, akan tetapi masing-masing mempunyai karakteristik yang unik. (Randall dan Mebius, 2014)).
ii) Mekanisme melalui peranan ILC-1 dan ILC-2 dan limfotoksin B Semua limfonodi dan sebagian besar MALT kecuali NALT perkembangannya pada masa embrio sangat membutuhkan sinyal limfotoksin dan Id2 dari lymphoid tissue inisiator or inducer cells/ LTi cells. Nasopharingeal lymphoid tissue (NALT) mempunyai keunikan dimana ia tidak tergantung pada LTis akan tertapi tergantung Id2 dan sitokin IL-5 dan 13 yang diekpresikan oleh ILC tipe 1 dan 2. Sebagian besar mekanime perkembangan jaringan limfoid sangat tergantung dari peran limfotoksin yang akan memicu ekpsresi kemokin homestasis seperti CXCL- 13 (Ansel et al, 2000). Jaringan limfoid sub mukosa seperti Peyer’s patches, ILFs, dan NALT juga mengekspresikan kemokin yang lain seperti CCL-20 dan CCL-9 (Zhao et al, 2003). Kemokin ini akan menyebabkan migrasi populasi DCs dan sel B ke area sub epitel kubah. Rangel-Moreno et al (2005) menyebutkan bahwa ekspresi CCL-20 pada epitel kubah ini membutuhkan sinyal dari limfotoksin (Randall dan Mebius 2014).
Keberadaan kemokin ini sangat penting untuk maturasi yang memadai dari ILFs dari cryopatches (McDonald et al, 2007) dan Ebisawa et al (2011). Sel LTi juga mengekpresikan CCR-6 ( Lugering et al,2010), akan tetapi menurut beberapa literatur ((Baptista et al, 2013), Bouskra et al (2004) dan Harmsen et al (2005)) kemokin ini tidak berperan penting dalam pembentukan cryptopatch. Pembentukan ILFs di usus halus sangat tergantung pada ekpresi CCL20 dan CXCL13, akan tetapi pada kolon tidak (Baptista et al, 2013;Bouskra et al, 2004). Perbedaan ini juga terdapat pada usus dan saluran nafas. Penelitian pada tikus yang mengalami defisiensi CCR6 tetap dapat membentuk NALT (Randall dan Mebius, 2014).
iii) Mekanisme bergantung mikrobiota dan antigen
Round dan Mazmanian (2009) menjelaskan bahwa dalam perkembangannya di masa embriogenesis sebagian besar jaringan limfoid
mukosa berkembang dalam lingkungan yang steril, akan tetapi maturitas dan fungsinya mencapai kesempurnaan terjadi setelah lahir dan sangat tergantung pada mikrobiota komensal dan antigen (Randall dan Mebius, 2014). Saat ini diketahui bahwa ternyata pada masa janin masih dalam rahim terjadi paparan mikrobiome mulut melalui plasenta (Zaura et al, 2014). Beberapa penelitian pada tikus germ free yang direview oleh Randall dan Mebius (2014), membuktikan bahwa pada kondisi steril NALT , TALT dan crytopatches tetap terbentuk, akan tetapi belum mengalami maturasi membentuk ILFs (Nagatake et al, 2009; Honda et al,2001; dan Baptista et al, 2013). Paparan mikrobiota akan menimbulkan kolonisasi pada cryptophaches dan akumulasi sel B di sub epitel yang memicu transformasi menjadi ILFs (Randall dan Mebius (2014). Peran penting mikrobiota dalam hal ini antara usus halus dan kolon menurut Bouskra et al (2008) dan Baptista et al (2013) mempunyai perbedaan, dimana trasnformasi ini pada kolon lebih tergantung pada sinyal dari Myc88, oleh karena kolon merupakan organ yang mempunyai komunitas mikrobiota komensal yang lebih banyak (Randall dan Mebius, 2014). Paparan mikrobiota dan antigen selain memicu perkembangan organ limfoid, juga memicu maturasi dan diferensiasi sel M baik pada usus halus, kolon maupun pada NALT dan TALT. Sel M yang matur sangat penting dalam proses pengenalan dan penyajian antigen.
2. IMUNOMODULASI SISTEM IMUN NEONATUS
a. Konektifitas anatomis sistem imun di mukosa dengan sistemik
Pertahanan di permukaan tubuh seperti di mukosa mempunyai peranan penting dalam maturitas sistem imun neonatus secara keseluruhan. Mukosa adalah jaringan yang merupakan bagian dari sistem imun yang terluas yang bila dibentangkan meliputi kurang lebih 300-400m2 (Brandztaeg,2003).
Selain itu mukosa merupakan area port de entre dari berbagai macam antigen baik dari lingkungan maupun dari makanan. Pada neonatus intergitas epitel
commit to user
mukosa belum sempurna sehingga permeabilitasnya pun meningkat (Anderson et al, 2012).
Permukaan mukosa di mulut mendapatkan inervasi salah satunya dari N.Vagus. Serabut N. Vagus di area ini mempunyai fungsi sensoris, motorik dan sekretorik yang akan mempengaruhi saluran cerna. Selain itu rongga mulut merupakan area induktif dari sistem imun yang mempunyai efektor yang luas. Struktur di area palatum mole dan durum mempunyai area-area tertentu seperti HEVs dan sel microfold ( Mcells) di dalam peyer patches yang merupakan lokasi induktif (Kiyono dan Fukuyama, 2004).
Kiyono dan Fukuyama (2004) menyatakan stimulasi sistem imun pada mukosa dapat mempengaruhi sistem imun sistemik secara independen, walaupun secara anatomi terpisah. Kiyono et al (2008) menjelaskan bahwa konektifitas fungsional ini didapatkan dengan induksi seperangkat reseptor mukosa spesifik selama interaksi DCs dengan limfosit T dan B, contohnya imunisasi oral dan nasal dapat menstimulasi respon sel T dan sel B pada jaringan mukosa yang jauh seperti pada usus dan saluran urogenital.
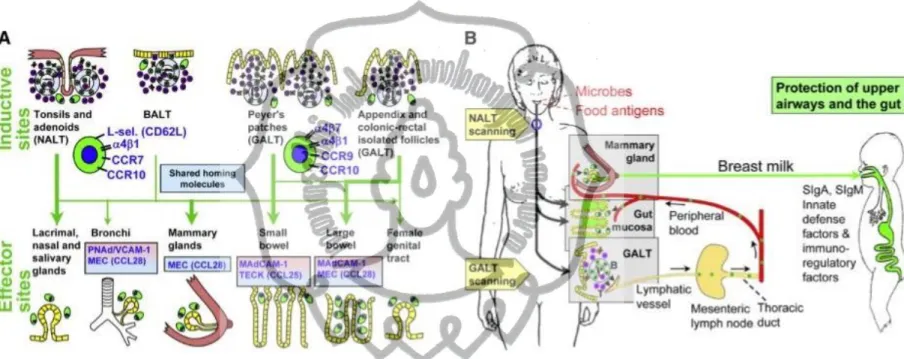
Kiyono dan Fukuyama (2004) menyebutkan bahwa stimulasi NALT dapat menginduksi bukan hanya pada mukosa tapi juga pertahanan spesifik secara sistemik. Nasopharingeal associated limfoid tissue (NALT) pada tikus berasal dari NALT- associated high endothelial venules (HEVs) yang berkembang pada usia 1 minggu setelah lahir, dan baru membentuk struktur lonceng yang sempurna setelah usia 5-8 minggu. Perkembangannya menjadi organ limfoid berbentuk seperti lonceng ini membutuhkan pemicu dari lingkungan baik antigen maupun mitogen. Perkembangannya diketahui dapat dipercepat oleh pemberian adjuvan seperti toksin kolera intra nasal (Kiyono dan Fukuyama, 2004). Berikut ini adalah gambaran skematik distribusi area induktif dan efektor pada seluruh mukosa tubuh.
Gambar 2.3. Area induktif dan efektor di mukosa (Brandtzaeg, 2010).
Berdasarkan gambar 2.3. dapat diketahui bahwa masing-masing area induktif mempunyai efektor yang berbeda- beda. Dalam gambar di atas dapat dilihat bahwa area NALT mempunyai jangkauan efektor yang paling luas mencakup kelenjar lakrimal, nasal, usus halus dan usus besar, saluran nafas, sistem genitourinarius, dan kelenjar mammae.
29
commit to user
Kiyono dan Fukuyama menyebutkan bahwa pada tikus NALT ditemukan pada kedua sisi saluran nasofaring, di dorsal dari kartilago palatum mole. Pada manusia ini dianalogikan dengan cincin Waldeyer. Pada manusia struktur seperti ini juga ditemukan pada mukosa nasal, terutama pada konka medial dari anak yang berusia kurang dari 2 tahun. Struktur NALT terdiri atas follicle associated epithelium (FAE), high endothelial venules (HEVs), area yang kaya dengan sel B dan sel T, antigen presenting cells (APCs) mencakup DCs dan makrofag, dan sel M . Paparan antigen pada NALT akan memicu baik respon protektif maupun toleransi. Baik NALT maupun GALT saat ini menjadi fokus area induktif penting dalam pengembangan metode vaksinasi intramukosa baik pada bayi baru lahir maupun pada usia yang lebih dewasa (Kiyono dan Fukuyama, 2004).
Efektifitas suatu stimulasi intra mukosa salah satunya dipengaruhi oleh pemilihan lokasi induktif yang tepat. Nasofaringeal lymphoid associated tissue (NALT) yang mencakup area cincin waldeyer merupakan area induktif yang mempunyai area efektor yang luas. Saat ini banyak penelitian vaksin intra mukosa yang menggunakan area sebagai area induktifnya (Kiyono dan Fukuyama, 2004)..
b. Respon imun seluler neonatus di mukosa
Respon imun limfosit di mukosa di awali dari paparan antigen di area induktif yang akan dikenali, diproses oleh sel epitel, sel Langerhans, sel dendritik dalam epitel, dan sel makrofag di lamina propia. Mekanisme pengenalan antigen dan penyajiannya selanjutnya dapat dirangkum dalam beberapa mekanisme antara lain:
1) Transitosis melalui sel epitel yang utuh dan sel M.
Sel M ini adalah sel yang mempunyai kantung basolateral yang berada di epitel area kubah ILFs, yang bila terpapar mikroba dan antigen akan terjadi transitosis mikroba dan antigen yang memicu pengeluaran sitokin seperti IL- 17 dan kemokin seperti CCR6 dan CCX3 yang
menyebabkan akumulasi sel B yang mengekspresikan reseptor CCR6 dan DCs yang mengekspresikan CCX3R. Proses transitosis yang diperantarai ikatan mikroba dan antigen dengan reseptor glikoprotein, uromodulin dan anexin pada sel M ini akan menyebabkan akumulasi sel DCs dan sel B subepitel area kubah ILFs. Sel DCs yang bermigrasi adalah sel DCs yang mengekspresikan CD103+ dan CD11bhi yang keduanya akan memicu sinyal paradoks. Protein CD103+ akan memicu sinyal toleransi, sedangkan CD11bhi memicu sinyal pro inflamasi. Kedua jenis sel ini juga akan bermigrasi ke lokasi anatomis masing-masing sesuai fungsinya (Varol et al, 2009;
Ballesteros-Tato, 2010; Geurtsvan Kessel, 2008) dalam Randal dan Mebius, 2014), dan proses ini tergantung pada jenis antigen, rute paparan dan derajat inflamasinya (Pabst dan Bernhardt (2010) dalam Randal dan Mebius, 2014).
2) Mekanisme melalui pengenalan oleh DCs
Selain melalui mekanisme transitosis sel M, mikrobiota dan antigen juga dapat diproses secara langsung oleh DCs yang mempunyai dendrit- dendrit penangkap antigen. Sel DCs ini membutuhkan CCX3R1 untuk memfungsikan dendritnya ke lumen. Dengan pengenalan antigen oleh sel DCs ini maka proses penyajian antigen dapat berlanjut hingga ke limfonodi regional dan FLTs tergantung jenis, rute dan derajat inflamasinya. Sel dendritik (DCs) merupakan sel penjembatan antara sistem imun alamiah/
innate dengan sistem imun adaptif melalui interaksinya dengan antigen.
Proses penyajian antigen oleh MHC klas II ini memegang peran penting dalam mengawali dan mengkatifkan sistem adaptif, melalui pengenalan molekul ini oleh limfosit T. Setelah DCs sel mengenali antigen, dalam hitungan jam DCs akan mempresentasikan antigen kepada sel T dan mengaktifasi sel T CD4+ naif menjadi sel Tsitotoksik CD8+ sel Th17 dan Treg(Poli, 2015; Bhaumik dan Basu., 2017).
commit to user
3) Mekanisme pengenalan melalui goblet cell-associated antigen passages (GAPs)
Mukosa saluran cerna dan saluran nafas yang bergoblet mampu memproses antigen yang berukuran kecil dan membawanya kepada DCs, terutama DCs yang mengekspresikan CD 103+ untuk memicu respon toleransi (McDole et al, 2012),.
4) Mekanisme transportasi antigen melalui pembuluh limfe aferen dan sel APC
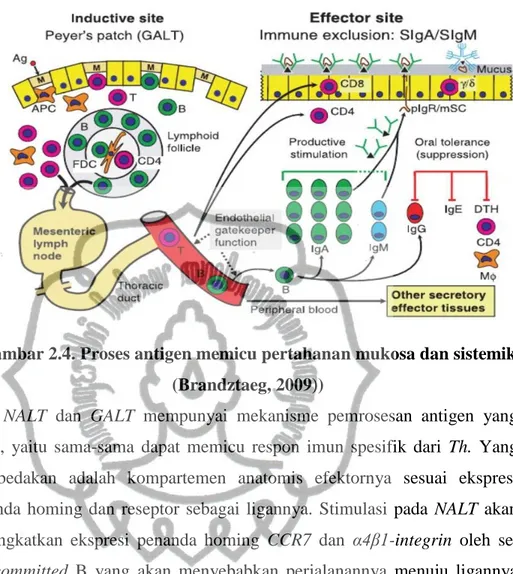
Mekanisme ini terutama terjadi pada perkembangan jaringan limfoid ektopik dan FTLs. Adanya inflamasi dan infeksi yang menyebabkan barier mukosa rusak dapat memicu pembentukan jaringan limfoid ektopik seperti BALT dan gastric MALT. Selain itu melalui mekanisme ini maka di dalam omentum dan peritoneum dapat terbentuk FTLs. Sel penyaji antigen/antigen precenting cells (APC) seperti DCs, dan makrofag jaringan sangat berperan penting dalam proses ini, akan tetapi mekanisme pasti perkembangan FTLs terutama hingga saat ini masih belum diketahui (Randall dan Mebius, 2014). Berikut ini mekanisme up take antigen dan perjalanannya menuju area efektornya secara skematik:
Gambar 2.4. Proses antigen memicu pertahanan mukosa dan sistemik (Brandztaeg, 2009))
NALT dan GALT mempunyai mekanisme pemrosesan antigen yang mirip, yaitu sama-sama dapat memicu respon imun spesifik dari Th. Yang membedakan adalah kompartemen anatomis efektornya sesuai ekspresi penanda homing dan reseptor sebagai ligannya. Stimulasi pada NALT akan meningkatkan ekspresi penanda homing CCR7 dan α4β1-integrin oleh sel IgA-committed B yang akan menyebabkan perjalanannya menuju ligannya yaitu CCL28 dan VCAM1 di tempat efektornya (Kiyono dan Fukuyama,2004).
Gambar di atas menunjukkan bagaimana perjalanan DCs mukosa mempresentasikan Ag pad sel T dalam jaringan limfoid, sel-sel yang dapat mepresentasikan antigen selain sel DCS (sel M) dan mekanisme uptake antigen (baik melalui endositosis, ikatan dengan reseptor, maupun DCs). Yang selanjutnya akan diikuti oleh presentasi antigen kepada sel limfosit B dan T di lamina propia, di folikel limfoid dan sel T yang bermigrasi dari HEVs.
Reseptor sel T memakai protein dimerik lintas membran sebagai reseptor khusus untuk bergabung dengan bagian antigen (fragmen) pada celah glikoprotein yang disandi oleh gen major histocompatibility complex (MHC).
commit to user
Sel T akan mengenali komplek yang dibentuk oleh peptida dan MHC kelas II melalui reseptor di permukaan Tcell receptor (TCR), yang diikuti oleh pembentukan sinyal-sinyal komunikasi yang berupa sitokin yang akan mengaktifkan sel limfosit disekitarnya maupun sel limfosit B dan sel Natural killer. Aktivasi TCR akan menyebabkan terjadinya peningkatan Ca++intrasel dan mengaktifkan calcineurin yaitu fosfatase yang mengeluarkan fosfat dari nuclear factor actifated Tcells (NF-AT). Defosforilasi menyebabkan NF-AT masuk ke dalam nukleus dan membantu faktor transkripsi asesoris, yaitu AP- 1 dan terikat dengan promoter dari kira-kira 100 gen yang mengaktifasi sel T (Poli, 2015; Bhaumik dan Basu, 2017). Selain melalui proses yang diperantarai DCs antigen juga dapat dipresentasikan oleh limfosit B dan sel epitel kepada limfosit T intra epitel dan sub epitel. Terdapat beberapa subset sel limfosit memori B dan T yang berada di sekitar sel M yang mempunyai kemampuan mengenali antigen yang keberadaannya sangat tergantung pada kolonisasi mikroflora komensal. Stimulasi sel B dapat terjadi melalui beberapa mekanisme antara lain melalui interaksi reseptor sel B (BCR) dengan mikroba yang bersifat superantigen atau melalui interaksinya dengan mikroba yang bersifat tergantung sel T (type 1 antigen depedent T cells ) dan mitogen seperti gula, lipid dan asam nukleat. Respon humoral pada neonatus juga terbatas, terutama dalam kemampuannya memproduksi antibodi. Hal ini menunjukkan adanya keterbatasan respon sel plasma di ektra folikuler dan turunan germinal center (GC). Penyebabnya adalah keterbatasan kemampuan aktifasi melalui jalur BCR, ekpresi kostimulator sel T yang rendah dan maturasi lambat dari sel B pada zona marginal. Selain itu sel stroma sunsum tulang juga mempunyai kemampuan terbatas dalam memproduksi faktor survival seperti A proliferation inducing ligand (APRIL) yang meningkatkan kemampuan hidup sel B post GC (Gervasi dan Horton, 2015).
Di mukosa interaksi DCs, sel epitel dan sel B dengan ILC dan limfosit naif CD4+ yang berada di lamina propia atau limfosit yang berasal dari high endotelial venules (HEV), akan menyebabkan aktivasi sel limfosit Tnaif CD4+
dan ILCS/Ltis. Sel-sel ini selanjutnya akan mengalami diferensiasi menjadi beberapa subset sel Thelper (Th) seperti limfosit Th1 CD4+, limfosit Th2 CD4+, limfosit Tfh. Setelah teraktifasi Th1 CD4+ akan berdiferensiasi menjadi NK, limfosit Th17, limfosit Th22 , Limfosit Treg , limfosit T sitotoksik CD8+ dan limfosit memori. Karakteristik subset sel T helper (Th) secara umum baik di mukosa dan di darah didefinisikan melalui ekspresi pola molekul efektornya (sitokin dan kemokinnya), molekul permukaan sel dan regulator transkripsinya( Bhaumik dan Basu, 2017).
Pada neonatus tanpa adanya stimulasi terdapat kecenderungan diferensiasi yang lebih dominan pada diferensiasi Th2. Sel Th2 adalah subset sel Th yang berperan dalam pertahanan terhadap patogen yang besar seperti cacing dan terlibat dalam respon alergi. Diferensiasinya tergantung pada faktor transkripsi GATA3 dan mengekspresikan IL-4, IL-5, IL-6 dan IL-13. Produksi IL-4 merupakan faktor utama dalam perkembangan Th2. Secara instrinsik sel TCD4+ pada neonatus mempunyai karakteristik yang berbeda. Perbedaan ini terjadi karena adanya hipometilasi pada lokus Th2 atau hipermetilasi pada lokus IFN-ℽ , selain itu pada sitoplasma TCD4+ neonatus juga dijumpai adanya penyimpanan isoform IL-4 dan ekpresi reseptor heteromerik IL4Rα dan IL13-Rα. Karakteristik sel TCD4+ pada neonatus yang demikian menyebabkan usia hidupnya lebih pendek daripada usia hidup limfosit T CD4+dewasa. Oleh karenanya kunci dari perkembangan sistem humoral pada neonatus salah satunya adalah melalui respon T folikuler helper. Di intestinum juga demikian, sehingga saat ini salah satu target pengembangan vaksin saat ini diarahkan untuk pengembangan adjuvan yang memperbaiki respon T folikuler helper (Tfh) pada neonatus. Salah satu jalur sinyal yang mengalami down regulasi pada neoatus adalah jalur aktifasi sel NK. (Gervasi dan Horton, 2015). Paparan mikroba komensal pada awal kehidupan bayi sangat diperlukan untuk mengaktivasi sel NK, dan hal ini akan sangat mempengaruhi sistem imun anak sampai dengan dewasa ( Olzak et al, 2012).
commit to user
Aktivasi sel NK akan meningkatkan kemampuan sitolitik dengan mensekresikan sitokin Th1 IFN-γ yang lebih banyak. Natural killer (NK) sel pada bayi baru lahir lebih tinggi jumlahnya daripada orang dewasa, akan tetapi mempunyai kecenderungan lebih mudah disupresi daripada sel NK orang dewasa. Sel NK akan secara cepat diaktivasi melalui interaksi sel ke sel dengan kontak langsung dengan DCs, monosit/makrofag dan sitokin. Populasi sel NK matur sesuai fungsinya ada 2 subset yaitu sel NK CD56tinggi+CD16- dan CD56+rendah CD16+. Sel NK CD56+ tinggi CD16- yang mempunyai kemampuan mensekresi sitokin yang tinggi, dengan kemampuan sitotoksik yang rendah dan mempunyai kecenderungan melakukan homming ke dalam limfonodi. Subset sel NK CD56+rendah CD16+bersifat sitotoksik tinggi dan ditemukan pada jaringan yang mengalami inflamasi (Gervasi and Horton, 2016; Olzak et al, 2012).
Respon Th1 mengekspresikan faktor transkripsi T-bet dan terlibat terutama dalam respon terhadap patogen intraseluler. Sel Th1 memproduksi IFNγ. Adanya IFNγ bersama dengan IL-12, diperlukan dalam diferensiasi sel limfosit Th1 menjadi T CD8+. Adanya stimulasi pada jalur sinyal seperti IL- 12 akan menyebabkan respon seluler neonatus cenderung pada Th1.
Keberadaan IL-12 dan IFN tipe 1 akan memicu terjadinya proliferasi yang tinggi yang menyebabkan fase ekspansi dari perkembangan limfosit T.
Selanjutnya mekanisme regulasi terjadi melalui perantaraan TGF-β dan karena kadar tinggi IFN akan memicu kematian sel. Regulasi kematian sel pada mekanisme ini diperankan oleh beberapa faktor seperti reseptor kematian di permukaan sel (reseptor Fas, CD-95, apoptosis antigen 1 (Apo-1), dan anggota superfamily reseptor TNF-6 (Fortner et al, 2017).
Pada saat terjadi respon imun terhadap rangsang antigen, limfosit akan berproliferasi cepat dengan kecepatan doubling time 7 jam, karenanya harus ada mekanisme check point untuk memastikan hanya limfosit yang dibutuhkan yang dibiarkan bertahan hidup. Check point awal adalah
memastikan hanya yang bersifat patogen spesifik yang hidup, dengan adanya ekspresi ko-stimulasi (CD-28 untuk Sel T, dan komplek CD-19/CD-21 dan CD-40 untuk sel B). Faktor kostimulasi ini akan memicu sekresi protein anti apoptosis seperti Bcl-xL dan peningkatan produksi sitokin yang meningkatkan kemampuan hidup seperti IL-2 dan IL-4. Bila faktor kostimulasi tidak mencukupi atau tidak ada maka limfosit tidak akan teraktifasi sempurna atau mati. Pada fase akhir aktifasinya beberapa hari setelah aktifasi TCR maka limfosit akan lebih sensitif terhadap kematian terkait Fas. Ikatan dengan Fas bisa mengaktifkan kemampuan survival atau sebaliknya tergantung pada faktor kostimulasi. Kematian karena ini juga dapat dihambat oleh pemberian IL-2, TNF dan IFN tipe 1. Pada fase akhir respon imun akan tetap ada sel yang bertahan hidup menjadi sel memori (Patarroyo dan Vargas, 2013). Hal ini akan berpengaruh besar pada profil limfosit dan cadangan total limfosit pada neonatus.
Cadangan total limfosit pada manusia dewasa relatif tetap meskipun terjadi influx dari sel baru dan replikasi dari sel yang sudah ada sebelumnya.
Subset limfosit yang jumlahnya relatif konstan meliputi sub populasi timosit dan sel progenitor B, sel T CD4+ naif atau CD8+ perifer, sel memori T CD4+ atau CD8+, sel B matur atau sel B folikuler, sel T γδ, dan sel NK. Hal ini menunjukkan adanya mekanisme homeostasis yang mengatur jumlah limfosit (Abbas et al, 2012).
Pengaturan jumlah limfosit terjadi bukan melalui mekanisme kontrol produksi dari stem cells, berbeda dengan sel lain seperti eritrosit. Jumlah limfosit akan dijaga stabil setelah produksi awal melalui mekanisme apoptosis, survival dan proliferasi homestasis.Jika jumlah limfosit rendah proliferasi hoemostasis akan diaktifkan dari cadangan perifer. Bila jumlahnya terlalu tinggi maka limfosit yang berlebihan akan mati. Jumlah sel T dipelihara tetap konstan selama hidup melalui proliferasi homeostasis yang harus seimbang dengan kematian sel. Jalur apoptosis pada sistem imun secara umum dibagi menjadi 2 yaitu kematian karena hilangnya sinyal survival ekstrinsik
commit to user
(disebut kematian karena diabaikan) dan kematian yang diawali oleh ikatan reseptor dengan sinyal transduksi (kematian terprogram). Kematian karena diabaikan terjadi melalui mekanisme fisiologis yang memicu disfungsi mitokondria. Sel yang diabaikan akan mengalami atrofi dan deplesi ATP, serta gagal untuk tumbuh oleh karena terjadi ganguan pada metabolisme glukosa, dan perningkatan ROS. Bila sel terus menerus tidak mendapatkan sinyal maka membran mitokondria rusak dan terjadi pengeluaran molekul pro apoptosis seperti sitokrom C, apoptosis inducing factor (AIF) endonuklease G, dll ke dalam sitoplasma. Sitokrom C akan mengaktifasi caspase dan memicu cascade apoptosis. Diketahui bahwa protein anti apoptosis Bcl-2 dapat menghambat jalur kematian ini, akan tetapi tidak dapat mencegah atrofi sel (Patarroyo dan Vargas, 2013).
Boyman et al (2007) menunjukkan bahwa penambahan beberapa sitokin seperti pada lajur kanan kepada sel T akan memberikan pengaruh positif ataupun negatif menyerupai stimulasi secara alamiah. Beberapa penelitian lain mendukung Boyman et al. Pengaruh sitokin terhadap proliferasi ditunjukkan pada gambar di bawah ini:
B
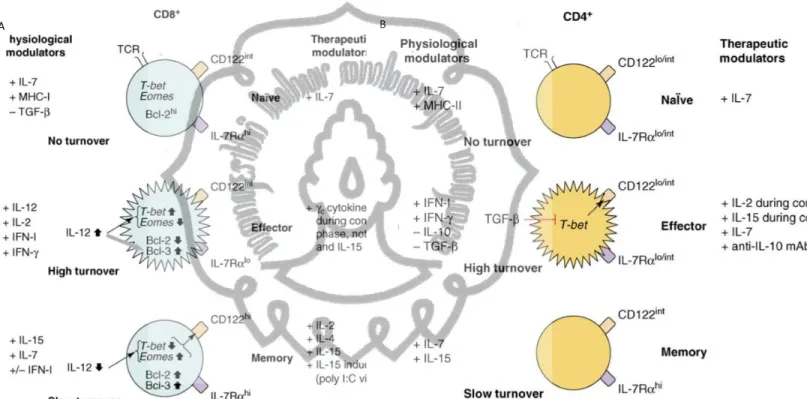
Gambar 2.5. Peranan sitokin pada mekanisme homeostasis proliferasi limfosit T CD8+ dan CD4+ (Boyman et al,2007)
Gambar 2.5 menunjukkan pengaruh sitokin dalam mekanisme homeostasis sel CD8+ dan CD4+. Gambar A menunjukkan homeostasis proliferasi sel T CD8+ naif pada kondisi fisiologis yang tergantung terutama pada sinyal dalam
A
39
commit to user
kadar rendah yang dipancarkan setelah paparan IL-7 dan major histocompatibility complex class I molecules (MHC-I). Sinyal ini akan membuat sel bertahan hidup dalam jangka yang lebih panjang dengan sedikit atau tanpa berproliferasi. Kemampuan bertahan hidup ini terjadi melalui kemampuan memproduksi protein anti apoptosis Bcl-2 yang tinggi. Selain itu sel CD8+ naif juga mendapatkan sinyal penghambat apoptosis dari jalur TGF- β. Ketika sel CD8+ naif menjadi teraktifasi oleh antigen melalui sinyal 1 dan ditambah dengan kostimulasi sinyal 2, dibutuhkan sinyal 3 melalui IL-12 atau IFN-I dan IFN-γ, agar terjadi ekspansi yang efisien, terbentuk fungsi efektor dan formasi subsekuen sel memori. Produksi IL-12 yang tinggi selama fase ini akan memicu up-regulasi T-bet dan down-regulasi oeomesodermin (Eomes), serta up-regulasi protein anti apoptosis Bcl-3, sedangkan level Bcl-
2 dan IL-7Ra menurun setelah terjadi papapran antigen pada TCR. Selanjutnya proses ekspansi yang cepat ini, akan diikuti dengan fase kontraksi yang ditandai oleh kematian sebagian besar sel T efektor melalui mekanisme apoptosis, hasilnya hanya ada sekitar 5–10% sel yang bertahan sebagai sel T memori CD8+ yang bersifat long-lived. (c) Interleukin-7 (IL-7) dan IL-15 memberi sinyal pada sel memori sehingga terjadi proliferasi sel yang lambat, sedangkan keberadaan IFN pada kadar tinggi akan memicu apoptosis.
Gambar B menunjukkan mekanisme homeostasis pada limfosit CD4+. Sel CD4+ naif pada kondisi fisiologis mendapatkan sinyal melalui kontak dengan IL-7 dan molekul MHC- II yang pada level stimulasi yang rendah tidak akan memicu proliferasi akan tetapi membuat sel bertahan hidup dalam jangka waktu yang lama. Pada kondisi ini sel CD4+ mendapatkan sinyal inhibisi dari TGF-β. Ketika sel CD4+ naif diaktifkan antigen maka akan terjadi down- regulasi IL-7Ra dan memicu proliferasi tinggi. Ekspansi sel T CD4+ dalam kondisi ini ditingkatkan oleh adanya IFN-I dan IFN-γ, dan dihambat oleh keberadaan IL-10 atau IL-2. Seperti halnya sel CD8+ setelah fase kontraksi ini secara subsekuen 90-95% sel efektor CD4+ akan mati dan sejumlah kecil sel yang bertahan adalah sel
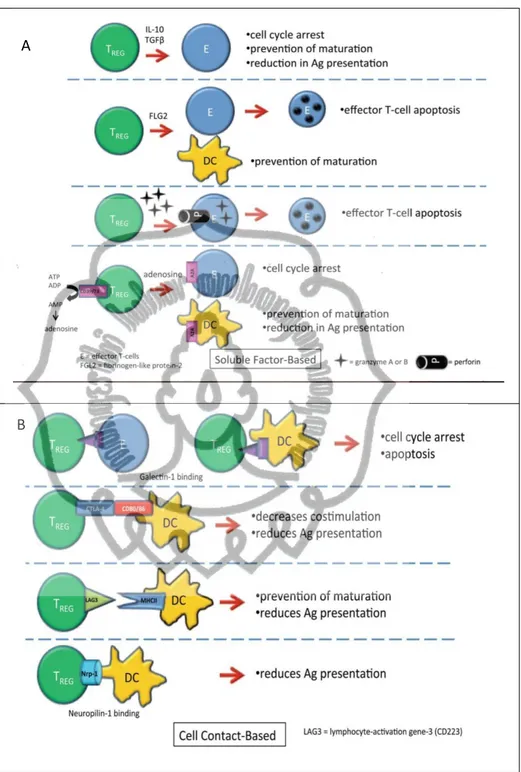
memori yang bersifat long lived. Turn over sel memori selanjutnya tergantung pada IL-7 dan IL-15 yang akan menyebabkan sel dalam kondisi turnover rendah dan bertahan hidup yang ditandai oleh level ekspresi CD122 int/hi dan IL-7Ra. Sebagian besar sel ini bersifat tidak tergantung MHC-II. Pada fase terbentuknya CD4+ memori, TGF-β berperan sebagai inhibisi bagi ekpresi CD122 yang diinduksi oleh antigen spesifik. Tumor growth factor-β(TGF-β) ini dikeluarkan oleh sel Treg. Sel Treg mensupresi sel efektor dan sel DCs melalui sekresi faktor terlarut meliputi IL-10, TGFβ, fibrinogen-like protein- 2 (FLG-2), granzyme A atau B, perforin, dan adenosine. Berikut ini gambar yang menjelaskan peran Treg dalam proses homeostasis sel Tefektor:
Gambar 2.6.A menunjukkan jalur sinyal dan efek supresi sel Treg terhadap sel T efektor dan DCs. Selain melalui faktor yang disekresikan sel Treg dapat mensupresi sel T efektor dan DCs melalui kontak langsung sel ke sel, yaitu melalui ikatan galectin-1, ikatan CTLA-4 pada CD80/86, ikatan lymphocyte activation gene-3 (LAG-3) pada molekul MHCII dan ikatan neuropilin-1. Gambar 2.6.B menunjukkan ligan, reseptor dan efek supresinya pada sel efektor dan DCs (Peterson, 2012).
commit to user
Gambar 2.6. Mekanisme inhibisi Treg terhadap proliferasi dan apoptosis sel T efektor dan sel dendritik (Peterson, 2012)
Adanya TGF-β bersama dengan IL-6 dan IL-21 secara spesifik akan mengarahkan perkembangan sel T naif menjadi Th17, sedangkan IL-2 diketahui memicu sel T naif yang sudah di-treatment dengan TGF-β
B A
berdifernsiasi menjadi sel Treg Foxp3+. Sel Treg mengekspresikan CD4, CD25,dan forkhead box P3 (Foxp3), mempunyai fungsi dalam proses maintenance imunologis dalam toleransi diri sendiri dan menghambat respon imun. Sel ini juga berperan menekan efek anti tumor dan respon terhadap vaksinasi. Sebagian besar sel Treg berkembang dari liniage sel T di Timus, akan tetapi di mukosa pada kondisi seperti adanya transforming growth factor- β (TGF-β) atau adanya tumor dan infeksi sel ini dapat diaktifasi dari prekusor sel Th di perifer. Sel Treg dijumpai banyak pada darah tali pusat manusia yaitu sekitar 12% dari populasi sel T CD4+ dan di limfonodi neonatus mencakup sekitar 8%. Sel Treg janin manusia berasal dari T naif yang terutama mendapat rangsangan antigen maternal melalui plasenta. sel Tnaif CD4+CD8−Foxp3− yang belum berdiferensiasi pada nenoatus diketahui memiliki mekanisme default yang menyebabkan sel menjadi Treg CD4+Foxp3+ setelah mendapatkan stimulasi melalui ikatan dengan perantara TCR. Sel Tnaif CD4+CD8−Foxp3− yang belum berdiferensiasi pada nenoatus diketahui memiliki mekanisme default yang menyebabkan sel menjadi Treg CD4+Foxp3+ setelah mendapatkan stimulasi melalui ikatan dengan perantara TCR. Beberapa penelitian memperkirakan mekanisme ini terjadi karena adanya sel Treg CD4+CD25+Foxp3+ maternal yang berperan penting dalam mengontrol aloreaktifitas maternal terhadap perkembangan janin dan toleransi sentral selama masa perkembangan timus janin. Sel Treg selanjutnya diklasifikasikan menjadi 2 tipe meliputi natural Treg (nTreg) dan induced/adaptive-Treg (iTreg). Sel iTreg dibagi lagi menjadi 2 yaitu Treg tipe 1 dan Th3Treg (Peterson, 2012). Natural Treg berasal dari sel T timus yang mengekspresikan CD4+CD25+FOXP3+. Sel ini muncul dalam timus selama awal perkembangan janin (usia kehamilan 14 minggu). Pada masa perkembangannya sel ini bersifat resisten terhadap delesi timus. Natural Treg ini berdiferensiasi dari timosit yang mengekspresikan TCRs yang afinitasnya terhadap kompleks MHC dan antigen diri meningkat. Natural Treg ini dapat menekan beberapa tipe sel meliputi sel dendritik, monosit/makrofag, sel T
commit to user
CD4+, sel TCD8+, sel NKT, sel NK, sel B, sel mast, basofil, eosinofil dan osteoblas. Faktor transkripsi FOXP3 diperlukan dalam diferensiasi timosit menjadi Treg. Lim et al (2006) menemukan nTreg juga mengkespresikan marker sel T teraktifasi (fenotip memori CD45RO ketika teraktifasi ; CD45RB ketika berada pada fase istirahat; CD25 baik saat teraktifasi dan istirahat;
molekul adesi CD62L, CD44 dan Integrin a4b7 ; cytotoxic T lymphocyteassociated protein-4 (CTLA-4); molekul kostimulasi CD28, reseptor kemokin (CCR7, CXCR4, CCR9); glucocorticoid-induced TNFRrelated protein (GITR), OX40 (CD134), dan folate receptor-4(FR4 pada tikus). Perkembangan, fungsi dan homeostasis nTreg membutuhkan IL- 2, dimana CD25 adalah rantai alfa yang mempunyai afinitas yang tinggi terhadap IL2R (Peterson, 2012).
Adaptive/induced Treg terdiri atas sel Treg tipe 1 (Tr1) dan sel Th3Treg.
Sel Tr1 baik pada manusia dan tikus mensekresikan IL-10 dan TGFβ dalam kadar yang tinggi. Selain itu juga mensekresikan IL-2, IL-5 dan IFNγ dalam kadar rendah. Perkembangan Tr1 membutuhkan faktor pertumbuhan yaitu IL- 15, yang dapat meningkatkan proliferasi tanpa melalui aktifasi TCR. Sel ini merupakan bagian dari populasi sel CD4+ yang bersifat anergi dan dapat berproliferasi dengan tingkat proliferasi yang rendah ketika teraktifasi antigen spesifik. Sekresi IL-10 akan menyebabkan efek menurunkan tingkat proliferasi sel. Marker yang spesifik untuk mendeteksi sel Tr1 belum diketahui, akan tetapi dengan marker repressor of GATA-3 (ROG) identifikasi sel Tr1 dapat dilakukan walau marker ini tidak spesifik terhadap populasi sel Tr1. Sel Th3 mensekresikan TGF-β, IL-10 dan FOXP3 (Beissert et al, 2006).
Sel Th3 ini berasal dari sel T CD4 naif yang diinduksi oleh TGFβ. Sel Th3 ini berperanan penting dalam toleransi oral dari antigen asing dan mencegah reaksi autoimun. Sulit membedakan Th3 dan nTreg karena tidak ada marker yang spesifik.