TESIS
PENURUNAN JUMLAH LEUKOSIT SEBAGAI
PREDIKTOR PERBAIKAN KLINIS PENDERITA
STROKE HEMORAGIK SELAMA PERAWATAN
DI RUMAH SAKIT UMUM PUSAT SANGLAH
DENPASAR
SAKTIVI HARKITASARI
PROGRAM PASCASARJANA
UNIVERSITAS UDAYANA
TESIS
PENURUNAN JUMLAH LEUKOSIT SEBAGAI
PREDIKTOR PERBAIKAN KLINIS PENDERITA
STROKE HEMORAGIK SELAMA PERAWATAN
DI RUMAH SAKIT UMUM PUSAT SANGLAH
DENPASAR
SAKTIVI HARKITASARI NIM: 1014068205
PROGRAM MAGISTER
PROGRAM STUDI ILMU BIOMEDIK
PROGRAM PASCASARJANA
UNIVERSITAS UDAYANA
DENPASAR
PENURUNAN JUMLAH LEUKOSIT SEBAGAI
PREDIKTOR PERBAIKAN KLINIS PENDERITA
STROKE HEMORAGIK SELAMA PERAWATAN
DI RUMAH SAKIT UMUM PUSAT SANGLAH
DENPASAR
Tesis untuk Memperoleh Gelar Magister Pada Program Magister, Program Studi Biomedik,
Program Pascasarjana Universitas Udayana
SAKTIVI HARKITASARI NIM: 1014068205
PROGRAM MAGISTER
PROGRAM STUDI ILMU BIOMEDIK
PROGRAM PASCASARJANA
UNIVERSITAS UDAYANA
DENPASAR
Lembar Pengesahan
TESIS INI TELAH DISETUJUI PADA TANGGAL 15 April 2015
Pembimbing I, Pembimbing II,
dr. Anak Agung Bagus Ngurah Nuartha, Sp.S(K) Dr. dr. Thomas Eko Purwata, Sp.S(K) NIP. 19540114 198012 1 001 NIP. 19540420 198211 1 001
Mengetahui,
Ketua Program Studi Ilmu Biomedik Direktur
Program Pascasarjana Program Pascasarjana
Universitas Udayana Universitas Udayana
Tesis ini Telah Diuji pada Tanggal 14 April 2015
Panitia Penguji Tesis Berdasarkan SK Rektor
Universitas Udayana, No: 985/UN14.4/HK/2015, Tanggal 1 April 2015
Ketua : dr. Anak Agung Bagus Ngurah Nuartha, Sp.S(K) Sekretaris : Dr. dr. Thomas Eko Purwata, Sp.S(K)
Anggota :
UCAPAN TERIMA KASIH
Puji syukur penulis panjatkan kehadapan Tuhan Yang Maha Esa, atas berkat, karunia dan tuntunan-Nya sehingga penulis dapat menyelesaikan tesis ini.
Pada kesempatan ini perkenankan penulis mengucapkan terima kasih dan penghargaan yang sebesar-besarnya kepada dr. A.A.B.N. Nuartha, Sp.S(K) selaku pembimbing I dan kepada Dr. dr. Thomas Eko Purwata, Sp.S(K) selaku pembimbing II yang dengan penuh kesabaran dan perhatian telah memberikan dorongan semangat, bimbingan dan saran selama penulis mengikuti Program Pendidikan Dokter Spesialis Saraf, khususnya dalam hal menyelesaikan tesis ini.
Ucapan terima kasih juga ditujukan kepada Rektor Universitas Udayana, Prof. Dr. dr. I Ketut Suastika, Sp.PD-KEMD dan mantan Rektor Universitas Udayana, Prof. Dr. dr. I Made Bakta, Sp.PD-KHOM, atas kesempatan dan fasilitas yang diberikan kepada penulis untuk mengikuti dan menyelesaikan Program Pendidikan Dokter Spesialis Saraf di Universitas Udayana mulai tahun 2011.
Ucapan terima kasih juga ditujukan kepada Direktur Program Pascasarjana Universitas Udayana, Prof. Dr. dr. A.A. Raka Sudewi, Sp.S(K), atas kesempatan dan dorongan yang diberikan kepada penulis selama menempuh pendidikan di Pascasarjana Universitas Udayana.
kesempatan yang diberikan kepada penulis untuk menempuh pendidikan di Pasca Sarjana Universitas Udayana.
Pada kesempatan yang baik ini, penulis juga menyampaikan rasa terima kasih kepada Direktur Utama Rumah Sakit Sanglah Denpasar dr. A.A. Saraswati, M.Kes dan mantan Direktur Utama RSUP Sanglah dr. Wayan Sutarga, MPHM atas ijin yang diberikan kepada penulis dalam mengikuti Program Pendidikan Dokter Spesialis Saraf.
Penulis juga mengucapkan terima kasih yang sebesar-besarnya kepada Dr.dr. D.P.G. Purwa Samatra, Sp.S(K), Dr. dr. A.A.A. Putri Laksmidewi, Sp.S(K), dr. I.G.N. Purna Putra, Sp.S(K) dan dr. I Putu Eka Widyadharma, MSc., Sp.S(K) sebagai penguji pada tesis ini atas semua masukan dan bimbingan dengan penuh kesabaran dan perhatian telah memberi dorongan semangat, saran dan koreksi kepada penulis untuk menyelesaikan tesis ini.
Terima kasih kepada dr. A.A.B.N. Nuartha, Sp.S(K) selaku ketua Bagian/SMF Ilmu Penyakit Saraf Fakultas Kedokteran Universitas Udayana atas kesempatan yang diberikan untuk menyelesaikan Program Pendidikan Dokter Spesialis Saraf. Terima kasih kepada Dr. dr. D.P.G. Purwa Samatra, Sp.S(K), selaku mantan ketua Bagian/SMF Ilmu Penyakit Saraf FK-UNUD/RSUP Sanglah atas kesempatan yang diberikan untuk menyelesaikan Program Pendidikan Dokter Spesialis Saraf.
Laksmidewi, Sp.S(K) selaku Plt. Ketua Program Studi Neurologi, dr. I.B. Kusuma Putra, Sp.S selaku sekretaris Program Studi Neurologi, Prof. Dr. dr. A.A. Raka Sudewi, Sp.S(K), Dr. dr. D.P.G. Purwa Samatra, Sp.S(K), Dr. dr. Thomas Eko Purwata, Sp.S(K), dr. A.A.B.N. Nuartha, Sp.S(K), dr. I Wayan Kondra, Sp.S(K), dr. I.G.N. Budiarsa, Sp.S, dr. I.G.N. Purna Putra, Sp.S(K), Dr. dr. Anna Marita Gelgel Sinardja, Sp.S(K), dr. A.A.A. Meidiary, Sp.S, dr. I Komang Arimbawa, Sp.S, dr. Desak Ketut Indrasari Utami, Sp.S, dr. I Putu Eka Widyadharma, MSc., Sp.S(K), dr. Kt. Widyastuti, Sp.S, dr. Ni Made Susilawathi, Sp.S, dr. Kumara Tini, Sp.S, FINS, dr. I.A. Sri Indrayani, Sp.S, dr. Ni Putu Witari, Sp.S, dr. I.A Sri Wijayanti, M.Biomed, Sp.S, dr. Sri Yenni Trisnawati, M.Biomed, Sp.S, dr. I.G.A.M Riantarini, Sp.S dan dr. I Wayan Widyantara, M.Biomed, Sp.S yang dengan kerelaan hati dan dukungannya yang tulus memberikan masukan dan dorongan bagi penulis dalam menyelesaikan tesis ini.
Radiologi atas masukan mengenai ilmu radiologi. Terima kasih kepada dr. I Wayan Gede Artawan Eka Putra, M.Epid atas bimbingan dan konsultasi analisis statistik.
Ucapan terima kasih yang tulus juga penulis sampaikan kepada seluruh rekan-rekan PPDS-I Neurologi FK UNUD, terutama bagi sahabat-sahabatku dr. I Made Rai Yogi Nala Nuratna, dr. Ni Nyoman Ayu Susilawati, dr. Luh Kadek Trisna Lestari, dr. I Ketut Catur Wipradnyana dan dr. Yuliana Monika Imelda Wea Ora Adja atas segala dukungan dan perhatian yang tulus bagi penulis. Bagi para tenaga Sekretariat di Bagian/SMF Ilmu Penyakit Saraf Fakultas Kedokteran Universitas Udayana Ibu Ni Putu Oka Swardani, Bapak Wayan Shika Priantha, Ibu Kadek Pebriyanti, SE., Ibu Kadek Ari Ardhiani, Amd.Akun., Ibu Wayan Ayu Sukyartini, SE. dan Bapak I Gusti Ngurah Sukerta penulis menghaturkan terima kasih yang sebesar-besarnya atas segala dukungan dan bantuannya. Ucapan terima kasih juga penulis sampaikan kepada dr. Yoanes Gondowardaja, M.Biomed, Sp.S, dr. Agus Antara, dr. Oktavianus Darmawan dan dr. Gracia Meliana Tanoyo yang telah memberikan bantuan, masukan dan dorongan bagi penulis dalam menyelesaikan tesis ini.
bisa bersemangat menyelesaikan pendidikan ini. Ucapan terima kasih penulis ucapkan kepada bapak mertua Prof. Dr. I Dewa Gede Atmadja, SH, MS. dan ibu mertua A.A. Rai Wartini, SH atas segala dukungan dan doanya.
Akhirnya penulis mengucapkan terima kasih yang sebesar-besarnya dari lubuk hati yang paling dalam kepada suami tercinta dr. Cokorda Agung Wahyu Purnamasidhi dan anakku terkasih Cokorda Agung Iswari Mahestuti Purnamasidhi yang dengan penuh pengertian, kerelaan dan pengorbanan telah bersama-sama mendukung dalam menyelesaikan pendidikan ini. Untuk pihak-pihak yang belum dapat penulis sebutkan satu persatu, penulis ucapkan terima kasih yang sebesar-besarnya.
Semoga Tuhan Yang Maha Esa selalu melimpahkan karunia-Nya kepada semua pihak yang telah membantu pelaksanaan dan penyelesaian tesis ini.
Denpasar, April 2015
ABSTRAK
PENURUNAN JUMLAH LEUKOSIT SEBAGAI PREDIKTOR PERBAIKAN KLINIS PENDERITA STROKE HEMORAGIK SELAMA
PERAWATAN DI RUMAH SAKIT UMUM PUSAT SANGLAH DENPASAR
Prognosis penderita stroke hemoragik dipengaruhi oleh banyak faktor, salah satunya adalah jumlah leukosit. Berbagai penelitian menyatakan bahwa peningkatan jumlah leukosit sebagai prediktor perburukan klinis dan kematian pada penderita stroke hemoragik, tetapi sampai saat ini masih belum jelas apakah penurunan jumlah leukosit setelah terjadi leukositosis dapat sebagai prediktor perbaikan klinis penderita stroke hemoragik.
Penelitian ini menggunakan rancangan kohort prospektif. Subjek penelitian adalah penderita stroke hemoragik dengan awitan datang ≤24 jam dengan leukositosis saat masuk rumah sakit yang dirawat di Sanglah Denpasar. Kelompok yang mengalami penurunan jumlah leukosit dibandingkan dengan kelompok yang tidak mengalami peningkatan atau tanpa perubahan jumlah leukosit. Penilaian luaran klinis menggunakan perubahan skor NIHSS yang dinilai pada hari ketujuh.
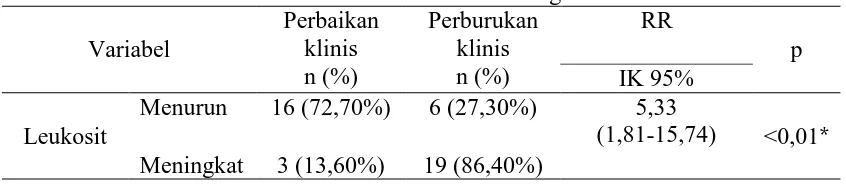
Total sebanyak 44 subjek dimasukkan dalam penelitian, 19 subjek meunjukkan perbaikan skor NIHSS. Penurunan jumlah leukosit memiliki hubungan yang signifikan dengan perbaikan klinis (RR=5,33; IK95%: 1,81-15,74; p<0,01). Hanya penurunan jumlah leukosit memiliki hubungan yang independent dengan perbaikan skor NIHSS.
Hasil penelitian menunjukkan bahwa pada penderita stroke hemorgaik dengan leukositosis, penurunan jumlah leukosit dapat menjadi prediktor perbaikan klinis selama perawatan di Rumah Sakit Umum Pusat Sanglah Denpasar yang diukur dengan skala NIHSS.
ABSTRACT
LEUCOCYTE COUNT REDUCTION AS A PREDICTOR FOR BETTER CLINICAL OUTCOME IN HEMORRHAGIC STROKE PATIENTS DURING HOSPITALIZATION IN SANGLAH HOSPITAL DENPASAR
The prognosis of hemorrhagic stroke patients is associated with many factors, leucocyte count is one of them. Many studies indicated that elevated leucocyte count is a predictor for bad clinical outcome amd death in patients with hemorrhagic stroke, however, there is remain unclear whether leucocyte reduction after leucocytosis could be a predictor for better clinical outcome of patients with hemorrhagic stroke.
This is a prospective cohort study. Subject were hemorrhagic stroke patients who were arrival time ≤24 hours onset with leucocytosis admitted in Sanglah hospital Denpasar. Group with leucocyte count reduction were compared with group leucocyte count elevation or without changing. Clinical outcome were measured with NIHSS score changing at day 7.
A total of 44 subjects were recruited, 19 of them had better NIHSS score. Leucocyte count reduction was significantly associated with better clinical outcome (RR=5,33; CI95%: 1,81-15,74; p<0,01). Leucocyte count reduction was the only independently associated with better NIHSS score.
This study indicated that in hemorrhagic stroke patients with leucocytosis, leucocyte count reduction could be a predictor for better clinical outcome during hospitalization in Sanglah Hospital Denpasar measured with NIHSS.
DAFTAR ISI
DAFTAR SINGKATAN ... xviii
DAFTAR LAMPIRAN ... xx
2.5.1 Proses Inflamasi setelah Perdarahan Otak ... 12
2.5.2 Peran Leukosit pada Proses Inflamasi setelah Perdarahan Otak .. 26
2.6 Peran Leukosit pada Luaran Stroke Hemoragik ... 33
BAB III KERANGKA BERPIKIR, KONSEP DAN HIPOTESIS PENELITIAN .... 42
4.4.3 Sampling Frame ... 48
4.5.1 Klasifikasi Variabel ... 52
4.5.2 Definisi Operasional Variabel ... 53
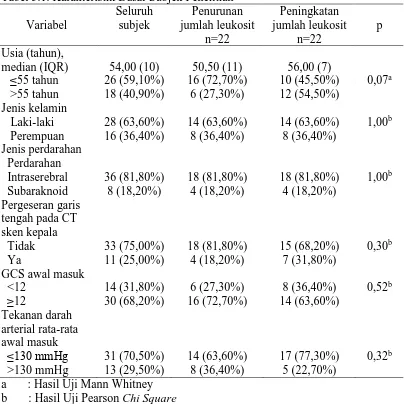
5.1 Karakteristik Subjek Penelitian ... 70
5.2 Analisis Bivariat Penurunan Jumlah Leukosit sebagai Prediktor Perbaikan Klinis Penderita Stroke Hemoragik ... 74
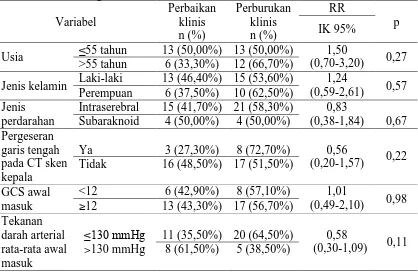
5.3 Analisis Bivariat terhadap Faktor-faktor Lain yang Mempengaruhi Perbaikan Klinis Penderita Stroke Hemoragik ... 75
6.1.4 Pergeseran Garis Tengah pada CT Sken Kepala ... 83
6.1.5 Glasgow Coma Scale Awal Masuk ... 84
6.1.6 Tekanan Darah Arterial Rata-rata Awal Masuk ... 85
6.2 Analisis Bivariat ... 87
BAB VII SIMPULAN DAN SARAN ... 107
7.1 Simpulan ... 107
7.2 Saran ... 107
DAFTAR PUSTAKA ... . 108
DAFTAR TABEL
Halaman 2.1 Beberapa Penelitian yang Menghubungkan Leukosit Darah
Perifer dengan Luaran Penderita dengan Stroke Hemoragik ... 37 5.1 Karakteristik Dasar Subjek Penelitian ... 71 5.2 Analisis Bivariat Penurunan Jumlah Leukosit sebagai Prediktor
Perbaikan Klinis Penderita Stroke Hemoragik ... 75 5.3 Analisis Bivariat Usia, Jenis Kelamin, Jenis Perdarahan, Pergeseran
Garis Tengah pada CT Sken Kepala, GCS Awal Masuk dan Tekanan Darah Arterial Rata-rata Awal Masuk dengan Perbaikan Klinis
DAFTAR GAMBAR
Halaman
2.1 Mekanisme Eliminasi Bekuan Darah pada Stroke Hemoragik ... 21
3.1 Kerangka Berpikir... 42
3.2 Kerangka Konsep ... 45
4.1 Bagan Rancangan Penelitian ... 47
DAFTAR SINGKATAN
AHA = American Heart Association ARA = American Rheumatism Association ATP = adenosine triphosphate
AVM = arteriovenous malformations CAP = cationic antimicrobial protein CD = cluster of differentiation COX = cyclooxygenase
CRP = c-reactive protein CT = Computed tomography DNA = deoxyribonucleic acid
EDTA = ethylene diamine tetra-acetic acid FIM = Functional Independence Measure GCS = Glasgow Coma Scale
HDL = High Density Lipoprotein
HMG CoA = 3-hydroxy-3-methylglutaryl-coenzyme A
HO = heme oxygenase
Hp = haptoglobin
Hx = hemopexin
ICAM = intercellular adhesion molecules IK = interval kepercayaan
IL = interleukin
LDL = Low Density Lipoprotein LED = Laju Endap Darah
LFA = lymphocyte function-associated antigen MAC = macrophage antigen
MIP = macrophage inflammatory protein mRNA = messenger ribonucleic acid
NCHS = National Center for Health Statistics
NF-KB = nuclear factor kappa-light-chain-enhancer of activated B cells NIHSS = National Institutes of Health Stroke Scale
NMDA = n-methyl-d-aspartate NO = nitric oxide
NOS = nitrous oxide systems
Nrf = nuclear factor erythroid 2–related factor NSAID = nonsteroidal anti-inflammatory drugs NXY =alpha-phenyl n-tertiary-butyl nitrone PMN = polymorphonuclear
PPAR = peroxisome proliferator-activated receptors ROS = reactive oxygen species
RR = risiko relatif
SIRS = systemic inflammatory response syndrome SKRT = Survei Kesehatan Rumah Tangga
SSP = sistem saraf pusat TG = trigliserida
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Ethical Clearance ... 119
Lampiran 2. Surat Ijin Penelitian ... 120
Lampiran 3. Amandemen Judul Penelitian ... 121
Lampiran 4. Informed Consent ... 122
Lampiran 5. Formulir Persetujuan ... 124
Lampiran 6. Lembar Pengumpulan Data ... 125
Lampiran 7. Worksheet National Institute of Health Stroke Scale (NIHSS) 131
BAB I PENDAHULUAN
1.1 Latar Belakang
Stroke adalah penyakit multifaktorial yaitu adanya beberapa penyebab terjadinya penyakit ini diantaranya faktor genetik, faktor lingkungan dengan tinggi polutan, kerentanan host, faktor idiopatik seperti hipertensi dan diabetes melitus dan faktor pola hidup yang tidak sehat seperti makanan tinggi lemak jenuh dan kalori serta kurang serat, kurang aktivitas, stres yang tinggi. Stroke memiliki manifestasi klinis dari ringan sampai berat sehingga menjadi penyebab utama kecacatan dan kematian di negara-negara berkembang. Angka kejadian stroke khususnya stroke hemoragik makin meningkat dari tahun ke tahun.
Berdasarkan data World Health Organization (WHO), setiap tahun terdapat 15 juta orang di seluruh dunia menderita stroke. Menurut American Heart
Association (AHA), di Amerika Serikat diperkirakan terdapat 3 juta penderita
stroke pertahun dengan 500.000 kasus baru (Minino et al., 2010; Jauch et al., 2013). Insiden stroke di Indonesia berdasarkan hasil Riskesdas 2013 menunjukkan insiden stroke meningkat dari 8,3 per 1000 penduduk pada tahun 2007 menjadi 12,1 per 1000 penduduk pada tahun 2013. Daerah yang memiliki prevalensi stroke tertinggi adalah Nanggroe Aceh Darussalam yaitu 16,6 per 1.000 penduduk dan yang terendah adalah Papua yaitu 3,8 per 1.000 penduduk (Departemen Kesehatan Republik Indonesia, 2013).
Stroke membutuhkan biaya perawatan yang cukup besar. Sebuah studi oleh Russel et al. (2006) pada 13.000 penderita stroke perdarahan di seluruh dunia, lama rawat rata-rata 9,6 hari dengan biaya rawat 17.442 dolar. Menurut Misbach dan Ali (2000), di Indonesia biaya perawatan penderita stroke lebih dari 25 juta rupiah tiap tahun. Pasca stroke kira-kira 30% penderita akan mengalami gangguan fungsi kognitif dalam 3 bulan khususnya fungsi eksekutif, juga dilaporkan perubahan personalitas atau gangguan psikiatri seperti depresi sebesar 30%.
Angka kematian penderita stroke di Amerika Serikat masih cukup tinggi yaitu 50-100 per 100.000 penderita pertahun. Berdasarkan data National Center of
Health Statistics (NCHS), stroke merupakan penyebab kematian tertinggi
keempat di Amerika Serikat setelah penyakit jantung, kanker dan penyakit saluran pernafasan bawah sejak tahun 2008 (Minino et al., 2010; Jauch et al., 2013). Mortalitas seluruh pasien stroke sebesar 22%, dimana 38,3% terjadi akibat perdarahan serebri dan 28,9% akibat stroke iskemik (Misbach dan Ali, 2000).
Secara garis besar stroke dibagi menjadi stroke iskemik dan stroke hemoragik (Mohr et al., 2010). Stroke hemoragik spontan mencangkup 10% dari semua stroke di negara maju dan 20% di negara berkembang dengan tingkat mortalitas dalam satu bulan mencapai masing-masing 25-35% dan 30-48% (Nasution, 2007).
mortalitas hingga kini masih belum jelas. Oleh karena angka morbiditas dan mortalitas serta beban biaya dari stroke khususnya perdarahan cukup tinggi maka diperlukan prediktor-prediktor untuk menentukan luaran penyakit. Salah satu prediktor yang dapat digunakan untuk menilai luaran stroke adalah jumlah leukosit. Hampir seluruh klinisi memeriksa kondisi hematologi menggunakan darah lengkap dimana salah satu komponen yang diperiksa yaitu jumlah leukosit. Pemeriksaan ini dianggap murah, mudah dan dapat digunakan untuk mewakili kondisi hematologi penderita. Penelitian terdahulu yang dilakukan oleh Liera et
al. (2004), Di Napoli et al. (2011) dan Agnihotri et al. (2011) menemukan
hubungan yang signifikan antara peningkatan jumlah leukosit darah perifer dengan prognosis dan peningkatan morbiditas serta mortalitas penderita stroke hemoragik, tetapi hingga saat ini belum jelas apakah penurunan jumlah leukosit setelah terjadinya leukositosis dapat memprediksi prognosis penderita stroke hemoragik. Penelitian ini bertujuan untuk mengetahui penurunan jumlah leukosit menjadi prediktor perbaikan klinis penderita stroke hemoragik selama perawatan.
1.2 Rumusan Masalah
Apakah penurunan jumlah leukosit pada penderita stroke hemoragik dengan leukositosis dapat menjadi prediktor perbaikan klinis selama perawatan di Rumah Sakit Umum Pusat Sanglah Denpasar yang diukur dengan National
1.3 Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui penurunan leukosit sebagai prediktor perbaikan klinis pada penderita stroke hemoragik selama perawatan di Rumah Sakit Umum Pusat Sanglah Denpasar yang diukur dengan NIHSS.
1.4 Manfaat Penelitian
1. Manfaat akademis: melengkapi kepustakaan yang ada mengenai stroke hemoragik, khususnya tentang pengaruh leukositosis terhadap perbaikan klinis sehingga berkontribusi terhadap kemajuan dalam ilmu kedokteran.
2. Manfaat praktis:
BAB II
KAJIAN PUSTAKA
2.1 Definisi
Stroke adalah sindrom klinis yang timbulnya mendadak, progresif cepat, berupa defisit neurologis fokal dan/atau global, yang berlangsung 24 jam atau lebih atau langsung menimbulkan kematian, dan semata-mata disebabkan oleh gangguan peredaran darah otak non traumatik (Mansjoer, 2000). Definisi stroke menurut WHO yaitu suatu sindrom klinis yang berkembang cepat akibat gangguan otak fokal atau global dengan gejala-gejala yang berlangsung selama 24 jam atau lebih dan dapat menyebabkan kematian tanpa adanya penyebab lain yang jelas selain vaskuler (Israr, 2008).
Stroke hemoragik terdapat dua jenis yaitu perdarahan intraserebral dan perdarahan subaraknoid. Perdarahan intraserebral menurut Rincon dan Mayer pada tahun 2012 merupakan perdarahan otak yang spontan atau non traumatik yaitu ekstravasasi akut darah ke jaringan otak, sering meluas ke ventrikel dan jarang ke subaraknoid. Sedangkan menurut Sacco et al. pada tahun 2013, perdarahan intraserebral adalah kumpulan darah fokal dalam parenkim atau intraventrikular, dimana tidak disebabkan oleh trauma, termasuk perdarahan dalam parenkim setelah infark serebri. Perdarahan subaraknoid adalah perdarahan dalam spasium subaraknoid, yaitu ruangan antara membran araknoid dan pia
mater dari otak dan medula spinalis.
2.2 Epidemiologi
Berdasarkan data WHO, setiap tahunnya terdapat 15 juta orang di seluruh dunia menderita stroke. Berdasarkan data NCHS, stroke merupakan penyebab kematian tertinggi keempat di Amerika Serikat setelah penyakit jantung, kanker dan penyakit saluran pernafasan bawah sejak tahun 2008 (Minino et al., 2010; Jauch et al., 2013). Menurut AHA, diperkirakan terjadi 3 juta penderita stroke pertahun dan 500.000 penderita stroke baru yang terjadi pertahun. Sedangkan angka kematian penderita stroke di Amerika Serikat adalah 50-100 per 100.000 penderita pertahun. Angka kematian tersebut mulai menurun sejak awal tahun 1900, dimana angka kematian sesudah tahun 1969 menurun hingga 5% pertahun (Japardi, 2002). Di Indonesia prevalensi stroke mencapai angka 8,3 per 1.000 penduduk. Daerah yang memiliki prevalensi stroke tertinggi adalah Nanggroe Aceh Darussalam yaitu 16,6 per 1.000 penduduk dan yang terendah adalah Papua yaitu 3,8 per 1.000 penduduk (Departemen Kesehatan Republik Indonesia, 2013). Insiden stroke mencapai 0.5 per 1000 pada usia 40 tahun, dan meningkat menjadi 70 per 1000 pada usia 70 tahun. Angka kematian stroke mencapai 20% pada 3 hari pertama dan 25% pada tahun pertama. Secara umum, stroke diklasifikasikan menjadi stroke iskemik (80% kasus stroke) yang terdiri dari emboli intrakranial (25%) dan trombosis intrakranial (75%), serta stroke hemoragik (20% kasus stroke) yang terdiri dari perdarahan intraserebral dan perdarahan subaraknoid (Misbach dan Soertidewi, 2011).
Benua Asia memiliki angka kejadian stroke hemoragik terbesar di seluruh dunia. Angka kejadian stroke hemoragik bervariasi pada rentang usia 18-95 tahun (Misbach and Ali, 2001). Paling banyak berjenis kelamin laki-laki dan usia lebih dari 55 tahun dengan peningkatan angka kejadian dua kali lipat seiring dengan peningkatan dekade hingga usia 80 tahun. Stroke hemoragik juga sering terjadi pada usia kurang dari 40 tahun. Stroke hemoragik lobaris pada usia ini sering disebabkan oleh malformasi arteri vena. Stroke hemoragik paling sering disebabkan oleh hipertensi. Ras Afrika dan Amerika memiliki angka kejadian hipertensi paling besar (Liebeskind, 2013). Stroke hemoragik merupakan salah satu penyebab mortalitas, morbiditas dan disabilitas tertinggi di Amerika Serikat dan dunia. Sekitar 70.000 orang di Amerika Serikat mengalami kematian atau menderita disabilitas berat akibat stroke hemoragik spontan setiap tahun. Sekitar 10 – 30% dari kasus stroke yang dirawat inap merupakan stroke hemoragik. Setiap tahun stroke hemoragik mempunyai angka kejadian 12-15 per 100,000 penduduk Amerika. American Heart Association mengestimasi terdapat 610.000 kasus stroke baru di Amerika Serikat dan 185.000 kasus stroke rekuren. Banyak kasus stroke hemoragik membutuhkan perawatan jangka panjang, hanya 20% penderita yang dapat hidup secara independen, sedangkan 40% kasus meninggal dalam 30 hari dan sekitar separuhnya akan meninggal dalam 48 jam. Sebanyak 80% kasus stroke hemoragik spontan dimana kerusakan diakibatkan pecahnya pembuluh darah arteri akibat hipertensi kronis atau angiopati amiloid (Haynes et
al., 2012; Rincon dan Mayer, 2013). Stroke hemoragik spontan mencangkup 10%
mortalitas dalam satu bulan mencapai masing-masing 25-35% dan 30-48%. Data stroke di 12 rumah sakit di Medan tahun 2001 terdapat 1263 kasus stroke yang dirawat terdiri dari 821 stroke iskemik dan 442 stroke hemoragik, dimana meninggal 201 orang (15,91%) terdiri dari 98 (11,93%) stroke iskemik dan 103 (23,30%) stroke hemoragik (Nasution, 2007).
2.3 Penyebab
Kebanyakan kasus dari stroke hemoragik spontan atau non traumatik disebabkan oleh aterosklerosis dan hipertensi primer yang merusak dinding pembuluh darah dan proses angiopati seperti angiopati amyloid serebri dan penyakit Moyamoya (Wang, 2010; Rincon dan Mayer, 2012). Selain itu, stroke hemoragik spontan ini juga dapat disebabkan oleh disfungsi autoregulasi dengan aliran darah otak yang berlebihan (reperfusion injury) dan transformasi hemoragik), ruptur aneurisma atau arteriovenous malformation (AVM), perubahan hemostasis (penggunaan trombolisis, anti agregasi platelet, antikoagulan, bleeding diathesis), nekrosis hemoragik (tumor, infeksi) dan obstruksi aliran vena seperti pada trombosis vena serebri (Misbach, 1999; Liebeskind, 2013).
arteriola walaupun tanpa adanya hipertensi kronik. Lokasi tersering terjadi stroke hemoragik adalah pada subkortikal, batang otak dan serebelum (Caplan, 2009). Selain hipertensi, faktor risiko lainnya seperti penggunaan alkohol, kadar kolesterol serum kurang dari 4,1 mmol per liter, penggunaan antiagregasi platelet atau antikoagulan, anemia aplastik, angiopati amyloid serebral dan faktor genetik seperti mutasi gen yang mengkode subunit α dari faktor XII juga telah dilaporkan
(Qureshi et al., 2009; Mohr et al., 2010).
Stroke hemoragik sering menyebabkan kematian atau disabilitas mayor dibandingkan dengan stroke iskemik walaupun insidensinya lebih rendah dibandingkan stroke iskemik. Hal ini mungkin diakibatkan oleh efek massa dan edema otak yang menyertai dapat menekan jaringan otak disekitarnya sehingga terjadi disfungsi otak yang berat dan peningkatan tekanan intrakranial sehingga menimbulkan herniasi otak yang berakibat fatal (Ropper dan Brown, 2005; Warlow et al., 2008).
2.4 Faktor Risiko
kontrol meneliti tentang penggunaan non steroid anti-inflammatory drugs (NSAID) dengan risiko terjadinya stroke hemoragik (Misbach, 1999; Qureshi et
al., 2009; Rincon dan Mayer, 2012).
2.5 Patofisiologi Stroke Hemoragik
Stroke hemoragik termasuk perdarahan otak yang disebabkan oleh pecahnya pembuluh darah pada parenkim otak. Berdasarkan penyebabnya, perdarahan otak dibedakan menjadi 2 yaitu primer dan sekunder. Penyebab primer yaitu tidak berhubungan dengan lesi kongenital dan dapatan. Sedangkan penyebab sekunder yang berhubungan dengan lesi kongenital dan dapatan. Penyebab primer terjadi pada 78 – 88% dari kasus dan disebabkan oleh pecahnya secara spontan dari arteri kecil atau arteriol yang rusak oleh karena hipertensi, arteriolosklerosis dan angiopati amyloid. Penyebab sekunder disebabkan oleh karena gangguan koagulopati, tumor otak, aneurisma, anomali struktur pembuluh darah, atau pengobatan trombolisis dari stroke iskemik (Wang dan Doré, 2007; Agnihotri et
al., 2011; Yabluchanskiy, 2012).
hemoragik, akumulasi debris non-fatty, hialinisasi dari tunika intima terutama pada bifurkasio dan bagian distal dari pembuluh darah. Kondisi patologis ini dapat terjadi pada arteri penetrans di seluruh otak termasuk arteri lentikulostriata, talamoperforata, cabang paramedian dari arteri basilaris, arteri serebelaris superior dan arteri serebelaris anterior inferior. Angiopati amyloid serebri terjadi akibat protein amyloid yang terdeposit dalam pembuluh darah ukuran kecil hingga sedang dalam tunika media dan adventitia. Angiopati amiloid serebri mempunyai predileksi pada pembuluh darah leptomeningeal yang penetrasi di korteks serebri dimana akan berkembang menjadi perubahan fibrinoid seperti pada hipertensi kronis. Struktur otak yang paling sering terjadi perdarahan yaitu talamus dan ganglia basalis sebesar 40-50%, regio lobar sebesar 20-50%, talamus sebesar 10-15%, pons sebesar 5-12%, serebelum sebesar 5-10% dan lokasi batang otak yang lain yaitu sebesar 1-5% (Liebeskind, 2013).
perdarahan akibat dari perdarahan persisten dan/atau perdarahan ulang akibat dari pecahnya sebuah arteriola (Rincon dan Mayer, 2012).
Pemahaman yang lebih baik mengenai patogenesis dari stroke perdarahan yang menginduksi kerusakan sel neuron akan membantu dalam meningkatkan hasil luaran perawatan penderita stroke hemoragik (Aronowski dan Hall, 2005). Perkembangan kaskade degenerasi akibat adanya perdarahan yang berkontribusi terhadap kerusakan otak meliputi 3 tahap tergantung pada waktu terjadinya, yaitu proses inflamasi, lisis eritrosit dan produksi trombin sesuai dengan kaskade koagulasi. Ketiga proses ini menyebabkan kerusakan dari sawar darah otak sehingga berakibat edema otak dan kematian dari sel parenkim. Proses ini kemudian diikuti oleh apoptosis dan nekrosis neuronal (Ziai, 2013). Mekanisme inflamasi berperan dalam proses perdarahan otak yang menginduksi kerusakan otak (Aronowski dan Hall, 2005).
2.5.1 Proses Inflamasi setelah Perdarahan Otak
umur, dan volume ventrikel, proses yang lain yang berkembang yang menyebabkan kerusakan sekunder seperti efek sitotoksik dari bekuan darah, hipermetabolisme, proses eksitotoksik, spreading depression, dan stres oksidatif serta inflamasi. Kelima proses ini akan menyebabkan kerusakan yang ireversibel pada jaringan neurovaskuler, jaringan substansia alba dan grisea otak yang akan diikuti oleh kerusakan sawar darah otak dan diakhiri oleh pembengkakan otak dengan makin banyaknya jaringan otak yang mati. Adanya proses inflamasi itu sendiri dapat memberikan efek buruk ataupun baik, dimana pelepasan sejumlah mediator inflamasi sebagai respon terhadap kerusakan sel akan menyebabkan kerusakan sekunder bagi jaringan saraf disekitarnya, selain itu keterlibatan beberapa sel inflamasi seperti mikroglia dan makrofag akan memiliki peran vital pada proses pembersihan jaringan yang rusak serta bekuan darah itu sendiri yang juga merupakan sumber dari proses inflamasi (Loftspring et al., 2009; Aronowski dan Zhao, 2011).
Peranan dari inflamasi pada patofisiologi stroke hemoragik telah banyak dikenal. Proses inflamasi pada stroke hemoragik termasuk jenis aseptik. Respon inflamasi teraktivasi akibat adanya darah yang masuk dalam parenkim otak dengan infiltrasi leukosit perifer, aktivasi mikroglia dan pelepasan sitokin (Agnihotri et al., 2011; Yabluchanskiy, 2012). Secara garis besar mekanisme ini melibatkan komponen seluler dan berbagai komponen darah seperti leukosit, eritrosit, mikroglia/makrofag, astrosit, sel mast, protein plasma dan komponen molekuler seperti sitokin, kemokin, prostaglandin, aktivasi komplemen, reactive
erythroid 2-related factor 2, heme oxygenase, besi, cyclo-oxygenase-2 (COX-2)
dan protease (Wang dan Doré, 2007; Wang, 2010; Agnihotri et al., 2011; Yabluchanskiy, 2012; Ziai, 2013). Menurut Wang dan Doré pada tahun 2007 dan Yabluchanskiy pada tahun 2012, studi dengan menggunakan analisis microarray terhadap deoxyribo nucleic acid (DNA) menunjukkan bahwa setelah perdarahan, beberapa kadar gen proinflamasi akan meningkat seperti faktor transkripsi, heat
shock protein, sitokin, kemokin, protease ekstraseluler, dan adhesion molecules.
Nuclear factor kappa-light-chain-enhancer of activated B cells (NF-KB) akan
melakukan regulasi terhadap tumor necrosis factor-α (TNF-α), Interleukin-1β
(IL-1β), nitrit oxide synthase (NOS), dan intercellular adhesion molecule-1
(ICAM-1).
yang diduga menjadi mediator pada kerusakan sekunder pasca perdarahan. Mikroglia yang merupakan kurang lebih 12% dari sel pada parenkim otak adalah sel pertahanan otak alamiah yang pertama kali teraktivasi, kemudian setelah teraktivasi sel ini akan berubah bentuk menjadi fagositik yang menandakan sel ini telah aktif dan sel berikutnya adalah makrofag. Ketiga sel ini selanjutnya akan melepaskan beberapa sitokin, kemokin, dan molekul sistim imun lainnya (Wang dan Doré, 2007; Agnihotri et al., 2011; Yabluchanskiy, 2012).
Efek sitotoksik bekuan darah dan stres oksidatif merupakan mediator dari kematian sel setelah perdarahan otak. Setelah proses stroke hemoragik, beberapa komponen bekuan darah akan keluar dari pembuluh darah yang pecah (terutama pada awalnya adalah eritrosit dan protein plasma) dan kerusakan yang ditimbulkan berhubungan dengan kelainan pada tingkat molekuler, seperti asam nukleat, komponen matriks ekstraseluler, protein, mediator lemak, adenosine
triphosphat (ATP) dan asam urat akan dilepaskan oleh jaringan nekrotik, dan
radikal bebas dari Hb yang dikenal dengan mekanisme Fenton-type (Aronowski dan Zhao, 2011).
Salah satu yang berperan dalam proses inflamasi setelah terjadi perdarahan otak adalah sitokin. Sitokin adalah glikoprotein utama yang memiliki peran penting pada proses sinyal antar sel dan juga memiliki hubungan dengan inflamasi, aktivasi imun serta diferensiasi dan kematian sel. Sitokin timbul sebagai reaksi primer terhadap stimulasi dari luar dan tidak ada pada hemostasis yang normal. Sebagai konsekuensi langsung ketidakseimbangan ion dan akumulasi kalsium bebas yang timbul akibat lesi perdarahan otak, maka dilepaskan asam amino bebas dan proinflamasi lain hasil metabolism lemak. Hal ini dipercaya akan meningkatkan, menimbulkan dan melepaskan kaskade sitokin proinflamasi. Sitokin diproduksi oleh banyak tipe sel seperti mikroglia, astrosit, neuron, endotel, leukosit dan sumber utama terutama dari sel mikroglia atau makrofag. Bukti-bukti dari penelitian juga mengatakan adanya peningkatan dari sitokin pada darah perifer setelah perdarahan otak. Setelah proses ini, permeabilitas sawar darah otak akan meningkat termasuk terhadap sitokin. Hal ini disebabkan sitokin merupakan protein dengan berat molekul kecil yang mempunyai berbagai aktifitas biologis dan aktif pada konsentrasi kecil. Fagositik perifer mononuklear, limfosit T, natural killer cell, sel leukosit
produksi dari sitokin yang lain, namun pada kenyataannya diantara sitokin juga mampu menginduksi diantara mereka sendiri seperti antara IL-1β dan TNFα.
Tumor Necrosis Factor-α adalah sitokin pleotrofik yang akan dilepas oleh beberapa sel seperti sel neuron, sel astrosit, mikroglia teraktivasi atau makrofag serta leukosit. Pada kaskade pro inflamasi yang pertama kali dikeluarkan adalah IL-1 dan TNFα, dimana sitokin ini yang kemudian merangsang dikeluarkannya sitokin proinflamasi yang lainnya seperti IL-6 dan IL-8, aktivasi dan infiltrasi dari leukosit dan memproduksi sitokin anti inflamasi termasuk IL-4 dan IL-10 yang mungkin merupakan negatif feedback dari kaskade ini. Tumor Necrosis Factor-α juga akan menimbulkan aktivitas biologi lainnya seperti produksi protein fase akut dan meningkatkan permeabilitas vaskular. Interleukin-1 terdapat pada 2 bentuk yaitu IL-1α dan IL-1β yang akan bekerja pada 2 reseptor tipe 1 dan 2 dan akan diregulasi oleh antagonis reseptor IL-1 endogen. Sitokin ini menyebabkan apoptosis sel SSP (Sistem Saraf Pusat), diferensiasi dan proliferasi seperti pengaruh akibat infiltrasi oleh leukosit. Melalui studi dengan menggunakan teknik
Affymetrix microarrays didapatkan peningkatan kadar IL-1, TNF-α, IL-6, IL-8,
macrophage inflammatory protein-1a (MIP-1a) dan ekspresi reseptor TNF terjadi
setelah perdarahan otak. Ekspresi dari IL-1β, MIP-1a dan ekspresi reseptor TNF
akan meningkat dalam 24 jam setelah perdarahan otak. Hasil yang sama pula didapatkan pada penelitian lain yang menyebutkan dalam 16 jam pertama. Sitokin IL-1 dan TNF-α dikatakan akan membuka pintu yang terbentuk oleh sawar darah otak dan akan mengakibatkan edema vasogenik. Ekspresi TNF-α meningkat pada
Konsentrasi IL-1β mulai muncul setelah 1 -3 jam dan maksimal pada 12 jam, akan tetap ada sampai 5 hari. Konsentrasi TNF-α mulai muncul setelah 3- 6 jam dan maksimal pada 12 jam, akan tetap ada sampai 5 hari. Pada beberapa studi juga ditemukan bahwa TNF-α dan IL-6 yang terdeteksi pada 12 – 24 jam setelah perdarahan berkontribusi pada pembentukan edema dan perluasan dari perdarahan itu sendiri. Konsentrasi IL-6 meningkat secara signifikan pada hari pertama dan cenderung akan menurun setelahnya. Peningkatan IL-6 sampai hari ketujuh berhubungan dengan volume perdarahan, efek masa yang ditimbulkan dan derajat keparahan dari kerusakan otak yang terjadi dimana adanya penurunan kesadaran yang dihitung dengan menggunakan skor Glasgow Coma Scale (GCS) dan peningkatan angka kematian (Wang dan Doré, 2007; Agnihotri et al., 2011; Yabluchanskiy, 2012). Bukti lain juga menunjukkan bahwa sitokin merupakan komponen kunci pada aktivasi dan pengerahan leukosit di SSP. Sitokin IL-1, TNF-α, IL-6 dan IL-8 telah diketahui mengaktivasi leukosit dan meningkatkan adhesi pada leukosit Cluster of Differentiation-18 (CD-18), sel endotel dan astrosit melalui ICAM-1 (Caplan, 2009; Nai-Wen Tsai et al., 2010).
dengan downregulation dari sitokin proinflamasi, dan upregulation dari sitokin anti-inflamasi. Selain memproduksi sitokin, makrofag juga menghasilkan protease seperti cathepsin yang berkontribusi terhadap perbaikan jaringan (Yabluchanskiy, 2012). Mikroglia didapatkan kurang lebih sekitar 5 – 20% dari jumlah sel glia yang ada pada parenkim otak. Setelah terjadi kerusakan otak, mikroglia akan teraktivasi dan berubah bentuk seperti pembesaran badan sel, perubahan bentuk menjadi batang, sferis atau ameboid, penonjolan prosesus, upregulation dari beberapa enzim dan protein serta perubahan sifat menjadi lebih fagositik, lebih mudah bermigrasi dan respon proliferasi. Fungsi utama dari mikroglia adalah untuk membersihkan perdarahan yang terjadi, namun selain itu mikroglia juga melepaskan faktor toksik seperti sitokin, kemokin, ROS, protease, COX-2, prostaglandin, Nitric Oxide (NO) dan Heme Oxidase-1 (HO-1) dan metabolitnya serta MMPs sehingga mikroglia/makrofag juga turut berperan pada kerusakan seluler pasca perdarahan. Selain itu, mikroglia juga memproduksi TNF-α. Kondisi
downregulation dari ekspresi TNF-α berhubungan dengan pengurangan volume
mikroglia terjadi dalam beberapa menit setelah perdarahan akan berkembang dalam 1 – 2 jam setelah perdarahan otak dan tetap dominan pada hari pertama, mencapai puncak pada hari ketiga sampai tujuh dan akan bertahan hingga tiga sampai empat minggu (Wang dan Doré, 2007; Agnihotri et al., 2011; Yabluchanskiy,
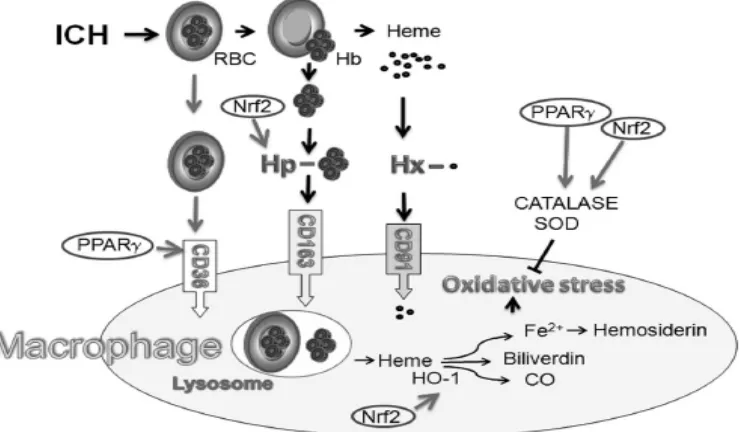
Gambar 2.1 Mekanisme Eliminasi Bekuan Darah pada Stroke Hemoragik (Aronowski dan Zhao, 2011)
dalam melakukan proses oksidasi kemudian dipecah menjadi hemosiderin, biliverdin, dan karbon monoksida. Hal terpenting selanjutnya adalah pembentukan
peroxisome proliferator-activated receptors (PPARγ) dan nuclear factor erythroid 2–related factor (Nrf2) karena selain meningkatkan ekspresi reseptor
CD-36 dan CD-163 juga akan meningkatkan produksi protein antioksidan katalase atau super oxide dismutase (SOD) yang akan menekan proses stres oksidatif pada makrofag (Aronowski dan Zhao, 2011 ).
inflamasi dengan mengekspresikan MMPs setelah terjadi perdarahan otak. Influks kalsium dapat mengaktifkan astrosit sehingga menginduksi pelepasan
gliotransmiter seperti glutamat, ATP, TNF-α dan D-serin yang dapat memodulasi
eksitabilitas neuronal, aktivitas sinaps dan plastisitas. Astrosit juga dapat menginduksi proses inflamasi dengan memodulasi ekspresi mediator-mediator inflamasi dan produksi ROS oleh mikroglia (Wang dan Doré, 2007; Agnihotri et
al., 2011; Yabluchanskiy, 2012; Ziai, 2013).
Matrix metalloproteinases adalah termasuk kelompok zinc-dependent
endopeptidase yang dapat melakukan degradasi pada berbagai komponen
termasuk matriks ekstraseluler. Pada vertebrata ditemukan sekitar 24 jenis subtipe dari MMPs dan yang teridentifikasi pada manusia saat ini sekitar 23 jenis. Matrix
metalloproteinases ini dikelompokkan menjadi 4 kelompok enzim antara lain
kolagenase, stromelisin, gelatinase dan membran type metalloproteinase. Matrix
metalloproteinases secara normal berlokasi dalam sitosol pada kondisi sel aktif
maupun inaktif. Matrix metalloproteinases akan dihancurkan oleh protease pada kondisi patologis. Ekspresi MMPs pada otak yang normal sangat rendah, tetapi banyak yang akan diproduksi dan teraktivasi terhadap respon kerusakan otak.
Matrix metalloproteinases memiliki peran penting pada keadaan jaringan yang
akan menyebabkan edema serebri pada perdarahan otak. Pada perdarahan sering didapatkan peningkatan MMPs 2,3,9 dan 12. Aktivasi dari MMPs 2 dan 9 didapatkan setelah 16 - 24 jam paska perdarahan. Matrix metalloproteinase (MMP) 9 dapat teraktivasi lebih awal yaitu 12 jam. Matrix metalloproteinase 12 akan dapat ditemukan sampai hari ketujuh dan puncaknya sekitar 80 kali lipat dari normal. Matrix metalloproteinase 12 berlokasi dalam mikroglia/makrofag yang teraktivasi di sekitar perdarahan. Setelah MMP 9 teraktivasi pada sel neuron akan mengaktivasi astrosit di sekeliling perdarahan. Level ekspresi MMP 9, subunit NF-KB dan MIP-2 akan meningkat 2 – 5 hari setelah perdarahan. Fakta yang menarik lainnya adalah ekspresi MMPs 2 dan 9 yang distimulasi oleh peptide Aβ-
amyloid dan merupakan penyebab perdarahan spontan oleh karena terbentuknya
angiopati amyloid. Peningkatan MMP 9 memiliki peran penting pada pembentukan edema di sekitar perdarahan, perluasan perdarahan, nekrosis, kerusakan sawar darah otak dan penurunan fungsi neurologis pada fase akut dan berkaitan dengan mortalitas (Wang dan Doré, 2007; Yabluchanskiy, 2012).
Pada patogenesis stroke hemoragik juga melibatkan proses stress oksidatif, dimana hal ini dibuktikan melalui serangkaian percobaan dengan menggunakan anti radikal bebas seperti dimetiltiourea, α-phenyl-N-tertiary-butyl nitrone,
sulfonyl derivative of α-phenyl-N-tertiary-butyl nitrone (NXY-059) atau
deferoxamine, dan selain itu melalui percobaan juga dibuktikan keterlibatan
nicotinamide adenine dinucleotide phosphate (NADPH) oksidase yang
ROS akan dilepaskan oleh neutrofil, endotelium vaskular, dan mikroglia yang teraktivasi serta makrofag. Pembentukan ROS pada proses normal metabolisme oksidatif tidak dapat dihindari, namun bila terbentuk dalam jumlah banyak akan memiliki fungsi yang letal. Reactive Oxygent Species dengan kadar yang cukup banyak berkontribusi pada perburukan perdarahan. Segera setelah perdarahan, jaringan ekstraseluler akan terpapar oleh hemoglobin dan produk turunannya. Zat besi dan bahan yang mengandung zat besi seperti hemoglobin akan mengkatalisis produksi hidroksil radikal dan peroksidase lipid yang akan membuat sel neuron terpapar oleh banyak stres oksidatif. Kadar stres oksidatif yang tinggi dapat terdeteksi oleh banyaknya pembentukan protein karbonil yang terbentuk dan ditemukan segera dalam hitungan menit setelah perdarahan (Wang dan Doré, 2007; Yabluchanskiy, 2012).
dikonversi menjadi bilirubin oleh biliverdin reduktase. Bilirubin yang tidak terkonjugasi dapat dideteksi pada perdarahan dalam 8 – 12 jam. Perdarahan otak menyebabkan deposisi besi dan kadar besi yang berlebihan dalam otak dapat mengakibatkan peroksidasi lipid dan formasi radikal bebas sehingga merusak neuron. Proses hemolisis dan toksisitas yang dimediasi oleh heme atau besi terjadi 2 – 3 hari setelah perdarahan otak. Pemecahan hemoglobin, akumulasi besi dan peningkatan konsentrasi HO mengakibatkan kerusakan otak lebih lanjut, edema otak, infiltrasi neutrofil dan kematian neuronal sehingga memperburuk luaran klinis neurologis. Hal ini juga sering dikaitkan dengan volume perdarahan dan edema otak (Wang dan Doré, 2007; Ziai, 2013).
2.5.2. Peran Leukosit pada Proses Inflamasi setelah Perdarahan Otak
Masuknya leukosit ke otak yang mengalami perdarahan dimulai dengan adhesi pada endotel dan sampai di jaringan otak. Migrasi leukosit dari darah ke otak dimulai dengan interaksi leukosit-endotel dengan rolling yang diperantarai oleh P-selektin dan E-selektin pada permukaan endotel dan L-selektin pada leukosit. Sejak aktivasi ini leukosit melekat pada tepi endotel melalui reseptor glikoprotein dinding leukosit (disebut CD-18 atau β2-integrin) dan ligand dari
endotel, ICAM-1. Membran leukosit yang terdiri dari glikoprotein kompleks yang bertanggung jawab terhadap perlekatan ini disebut CD-18 (β2-integrin).
Kompleks ini terdiri dari 3 heterodimers, ketiganya mempunyai unit beta yang sama (seringkali disebut CD-18) dan yang membedakan satu dengan yang lainnya adalah subunit α. Tiga subunit α ini dinamakan lymphocyte function associated
antigen atau LFA-1 (CD-11a, ada pada semua leukosit), Macrophage-1 Antigen
atau MAC-1 11b, ada pada kebanyakan PMN dan monosit) dan P150
(CD-11c, ada pada neutrofil dan monosit). Reseptor yang sesuai untuk CD-18 integrin
complex adalah golongan molekul adhesi seperti ICAM. Intracelullar Adhesion
Molecule-1 secara luas terdapat pada banyak sel dan berikatan dengan LFA-1 dan
langsung terlibat dalam patogenesis dan perluasan dari perdarahan otak. Leukosit melepaskan enzim hidrolisis, lemak peroksidase dan pelepasan radikal bebas (Caplan, 2009 ; Nai-Wen Tsai et al., 2010) .
Leukosit muncul setelah terjadi pelepasan sitokin pada area perdarahan yang merangsang leukosit yang berada di marginal pool dan leukosit matur di sumsum tulang memasuki sirkulasi. Jenis leukosit yang dikerahkan pada peradangan akut ini adalah neutrofil. Leukosit itu sendiri dapat menimbulkan lesi yang lebih luas pada daerah perdarahan otak dengan cara infiltrasi ke neuron kemudian melepaskan enzim hidrolisis, pelepasan radikal bebas dan peroksidase lemak (Nai-Wen Tsai et al., 2010).
Leukosit yang melakukan infiltrasi dipercaya memiliki peranan pada stroke hemoragik yang menginduksi kerusakan otak sekunder. Sebuah penelitian praklinis pada tikus dengan perdarahan otak menunjukkan bahwa pada pemeriksaan histopatologis terdapat infiltrasi dari leukosit di sekitar perdarahan (Wang dan Doré, 2007). Setelah terjadi perdarahan otak, leukosit dilepaskan dalam sirkulasi serta jaringan dan memerlukan waktu beberapa jam. Jenis leukosit yang dikerahkan pada proses peradangan akut adalah sel PMN yaitu neutrofil yang mengadakan infiltrasi dan predominan di sekitar perdarahan yang dimulai kurang dari 1 hari yaitu 3 – 6 jam dan meningkat dalam 12 – 24 jam, kemudian dominasi ini akan digantikan dengan monosit dalam 24 – 48 jam. Neutrofil mencapai puncaknya pada 2 – 3 hari dan menghilang pada 4 – 7 hari (Nguyen et
al., 2007; Joice et al., 2009; Ziai, 2013). Neutrofil dapat melekat dan bermigrasi
menginduksi respon astrosit dan mikroglia/makrofag yang terjadi setelah perdarahan otak (Emre et al., 2011). Sekali mereka masuk ke dalam daerah otak
yang mengalami perdarahan, leukosit akan mati oleh apoptosis dalam dua hari (Savill dan Haslett, 2001). Kemudian proses inflamasi ini didominasi oleh monosit pada hari ketiga dan jumlahnya mulai menurun pada hari kelima. Leukosit yang mati ini dapat menambah beratnya kerusakan otak dengan menstimulasi mikroglia atau makrofag untuk mensekresi faktor toksik proinflamasi (Wang 2010). Selain leukosit, dalam waktu 4 jam setelah terjadi perdarahan otak ditemukan TNF-α disekeliling dari perdarahan. Tumor Necrosis Factor-α memediasi peningkatan jumlah dan sekaligus apoptosis dari sel PMN.
Tumor Necrosis Factor-α diproduksi oleh makrofag. Selain TNF-α, berbagai
antibodi yang diproduksi oleh tubuh juga ikut berperan dalam lama hidup sel PMN (Wang dan Doré, 2007; Yabluchanskiy, 2012).
bermigrasi ke jaringan dan melakukan ekstravasasi segera akan dilepaskan granula-granula dari neutrofil. Granula-granula ini meliputi kolagenase, elastase dan mieloperoksidase yang dapat menyebabkan kerusakan langsung pada neuron dan astrosit dan berkontribusi terhadap luaran buruk setelah terjadi perdarahan otak. Neutrophil-derived serine proteases juga meregulasi respon imun lewat aktivasi dan pelepasan sitokin, termasuk IL-8, IL-6, TNF-α dan IL-1β yang
berkontribusi terhadap kerusakan lebih lanjut. Neutrofil memiliki peranan dalam akumulasi monosit pada lokasi terjadinya perdarahan, kerusakan atau infeksi otak. Ketika neutrofil berikatan dengan permukaan endotel, isi dari granula sekretori akan dilepaskan meliputi protein antimikrobial kationik dari 37 kd cationic
antimicrobial protein (CAP37)/azurocidin and proteinase 3 yang akan
menyebabkan aktivasi sel endotel, peningkatan ekspresi molekul adhesi seluler dan peningkatan adhesi monosit. Neutrofil juga berkontribusi dalam kemotaktik monosit dengan melepaskan LL-37 dan cathepsin G dan mempercepat sel endotel untuk melepaskan protein kemoatraktan monosit-1. Deplesi neutrofil menyebabkan pengurangan infiltrasi monosit setelah perdarahan otak. Akan tetapi, hilangnya respon monosit belum jelas dapat memperbaiki luaran fungsional. Monosit berkontribusi terhadap kerusakan otak akut dengan melepaskan sitokin proinflamasi dan kemokin. Monosit juga berkontribusi untuk perbaikan melalui fungsi fagositosis dari sel darah merah dan debris seluler (Sansing et al., 2011).
dari influks protrombin dalam beberapa jam setelah perdarahan otak. Perubahan ini dimediasi oleh faktor Xa pada kaskade koagulasi. Trombin kemudian mengubah fibrinogen menjadi fibrin yang sangat penting untuk membatasi ukuran perdarahan. Sebuah penelitian in vitro menyatakan bahwa trombin pada konsentrasi rendah bersifat neuroprotektif sedangkan dalam konsentrasi tinggi dapat membunuh neuron dan astrosit. Trombin menginduksi reseptor proteinase teraktivasi pada mikroglia/makrofag. Aktivasi dari sel ini melalui keterlibatan mitogen protein kinase teraktivasi yang memperbanyak produksi beberapa mediator-mediator inflamasi termasuk TNF-α, IL-1β dan NO sehingga
berkontribusi terhadap kerusakan neuron dan edema. Aktivasi trombin dan reseptor proteinase teraktivasi akan meningkat dimulai dalam 3 jam dan mencapai puncaknya dalam 2 hari setelah perdarahan otak (Ziai, 2013).
2.6 Peran Leukosit pada Luaran Stroke Hemoragik
Pengertian leukosit adalah kelompok sel-sel darah putih berinti yang terdiri dari granulosit dan non granulosit (limfosit dan monosit). Sedangkan granulsit dibedakan menjadi tiga jenis, yaitu neutrofil, eosinofil dan basofil. Fungsi leukosit dalam garis besarnya dibagi menjadi dua, yaitu fungsi defensif dan reparatif. Fungsi defensif adalah fungsi mempertahankan tubuh terhadap benda-benda asing termasuk kuman-kuman penyebab penyakit infeksi. Leukosit yang memegang peranan dalam hal ini adalah monosit yang memfagosit benda asing yang berukuran besar (makrofag), neutrofil yang memfagosit benda-benda asing yang berukuran kecil (mikrofag), limfosit yang membentuk antibodi, disamping plasma sel. Sedangkan fungsi reparatif adalah fungsi yang memperbaiki atau mencegah terjadinya kerusakan, terutama kerusakan vaskuler. Leukosit yang memegang peranan utama dalam hal ini adalah basofil yang menghasilkan heparin. Adanya heparin ini, pembentukan trombus pembuluh darah dapat dicegah. Adapun fungsi eosinofil belum diketahui secara pasti dan jumlahnya akan meningkat pada keadaan alergi dan infeksi parasit seperti cacing (Baratawidjaja, 2006).
kebutuhannya meningkat, maka granulosit akan dilepas. Keadaan normal, granulosit yang bersirkulasi didalam seluruh aliran darah kira-kira tiga kali daripada jumlah granulosit yang disimpan dalam sumsum tulang. Jumlah ini sesuai dengan persediaan granulosit selama enam hari (Guyton dan Hall, 1997).
Leukosit berperan baik pada proses inflamasi akut maupun kronik. Jenis leukosit yang berperan dalam hal ini adalah neutrofil sehingga jumlahnya meningkat pada fase akut. Neutrofil yang sudah dikerahkan di jaringan akan diaktifkan dan melepas produk-produk yang toksik. Proses inflamasi akan berjalan sampai antigen dapat disingkirkan. Hal tersebut pada umumnya terjadi cepat berupa inflamasi akut yang berlangsung beberapa jam sampai hari. Bila inflamasi terkontrol, neutrofil tidak dikerahkan lagi dan berdegenerasi. Bila penyebab inflamasi tidak dapat disingkirkan atau terjadi pajanan berulang-ulang dengan antigen, akan terjadi inflamasi kronik yang dapat merusak jaringan dan kehilangan fungsi. Selanjutnya dikerahkan sel mononuklear seperti monosit, makrofag, limfosit dan sel plasma yang memberikan gambaran patologik dari inflamasi kronik (Baratawidjaja, 2006).
dapat dianalisis dan penilaian mortalitas dan luaran fungsional setelah stroke hemoragik telah dapat ditentukan (Agnihotri et al., 2011).
independen berhubungan dengan kasus fatalitas dalam 30 hari pada penderita yang dirawat di ruang gawat darurat dalam 12 jam setelah onset gejala. Jumlah monosit absolut dapat digunakan sebagai biopetanda pada stroke hemoragik, dan dapat digunakan sebagai alat untuk menentukan prognosis.
Tabel 2.1. Beberapa Penelitian yang Menghubungkan Leukosit Darah Perifer dengan Luaran Penderita dengan Stroke Hemoragik.
No. Peneliti Judul Tahun Hasil
1. Liera R, Davalos A, Silva Y, Gil-Peralta A, Tejada J, Garcia M,
other indicators of ICH severity
4. Shruti Agnihotri, Alexandra Czap, Ilene
2011 Greater changes in leukocyte count
Arthur Pancioli, MD George Shaw, PhD
bakteri yang berat juga dapat sebagai penyebab lekopenia. Sedangkan leukositosis dapat disebabkan oleh suatu kondisi seperti anemia, merokok, infeksi khususnya oleh bakteri baik akut maupun kronis, penyakit inflamasi seperti artritis rematoid atau alergi, leukemia, stres mental atau psikis, keganasan, hiperstimulasi sumsum tulang (hemolisis kronik, penyembuhan dari supresi sumsum tulang), pasca
slenectomy, kerusakan jaringan seperti pada luka bakar serta obat-obatan seperti
agonis beta adrenergik, kortikosteroid, epinefrin, granulocyte colony stimulating
factor, heparin, litium (Rose dan Berliner, 2007).
Penelitian yang dilakukan oleh Hatta dkk. pada tahun 2010 menunjukkan bahwa rerata hitung leukosit pada stroke hemoragik lebih tinggi dibandingkan stroke iskemik. Volume perdarahan juga dikaitkan dengan derajat leukositosis pada perdarahan intraserebral hipertensif. Semakin tinggi volume lesi maka semakin tinggi pula jumlah leukosit. Leukositosis pada penderita perdarahan intraserebral hipertensif ini selain disebabkan karena respon inflamasi lokal dalam otak juga karena respon stres tubuh (Hatta dkk., 2010).
BAB III
KERANGKA BERPIKIR, KONSEP DAN HIPOTESIS PENELITIAN
3.1 Kerangka Berpikir
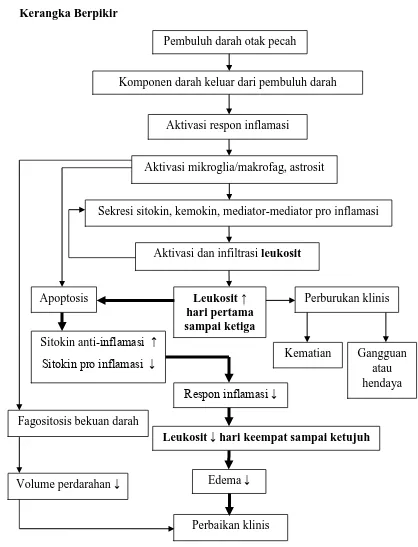
Gambar 3.1 Kerangka berpikir
Pembuluh darah otak pecah
Komponen darah keluar dari pembuluh darah
Aktivasi respon inflamasi
Aktivasi mikroglia/makrofag, astrosit
Sekresi sitokin, kemokin, mediator-mediator pro inflamasi
Aktivasi dan infiltrasi leukosit
Apoptosis
Fagositosis bekuan darah
Leukosit ↑ hari pertama sampai ketiga
Perbaikan klinis Sitokin anti-inflamasi ↑
Sitokin pro inflamasi ↓
Volume perdarahan ↓
Respon inflamasi ↓
Leukosit ↓ hari keempat sampai ketujuh Perburukan klinis
Kematian Gangguan atau hendaya
42
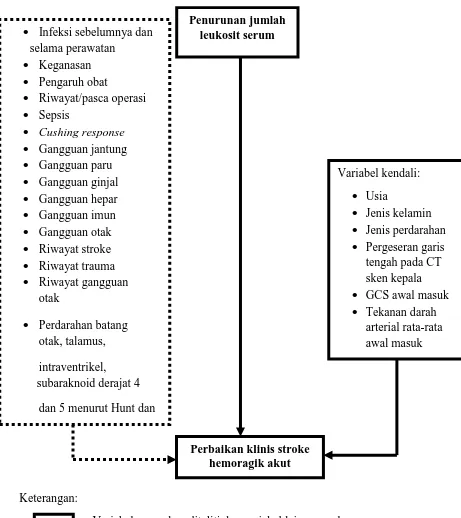
3.2 Kerangka Konsep
Berdasarkan rumusan masalah dan kajian pustaka maka disusunlah konsep penelitian sebagai berikut:
1. Penurunan respon inflamasi merupakan salah satu faktor yang berkontribusi terhadap perbaikan klinis stroke hemoragik akut. Penanda inflamasi yang digunakan adalah leukosit.
2. Faktor – faktor lain yang dapat menyebabkan perubahan jumlah leukosit diluar penyakit stroke seperti Infeksi sebelumnya dan selama perawatan, keganasan, pengaruh obat, riwayat atau pasca operasi, sepsis, cushing
response, gangguan jantung, paru, ginjal, hepar, imun, otak, riwayat
stroke, trauma dan gangguan otak, perdarahan batang otak, talamus, intraventrikel dan subaraknoid derajat 4 dan 5 menurut pembagian Hunt dan Hess serta hidrosefalus merupakan faktor-faktor yang dieksklusi pada penelitian ini.
Keterangan:
: Variabel yang akan diteliti dan variabel lain yang akan ditampilkan pada karakteristik data
: Variabel perancu yang akan dieksklusi pada tahap rancangan penelitian
Gambar 3.2 Kerangka konsep
Variabel kendali:
• Usia
• Jenis kelamin
• Jenis perdarahan
• Pergeseran garis
3.3 Hipotesis Penelitian
BAB IV
METODE PENELITIAN
4.1 Rancangan Penelitian
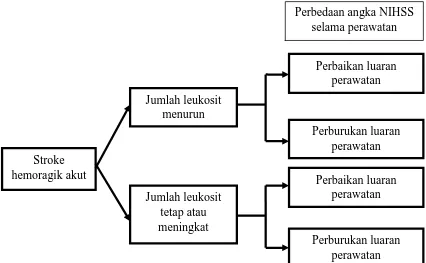
Penelitian ini dilakukan untuk mengetahui prognosis penyakit yaitu kemungkinan luaran dalam perjalanan klinik suatu penyakit. Penelitian ini merupakan penelitian observasional analitik kohort prospektif untuk mengetahui korelasi antara penurunan jumlah leukosit dengan perbaikan klinis pada penderita stroke hemoragik dengan melihat dua macam kelompok subjek yang mengalami penurunan jumlah leukosit dan yang leukosit tetap atau meningkat.
Gambar 4.1 Bagan Rancangan Penelitian Stroke
hemoragik akut
Jumlah leukosit menurun
Jumlah leukosit tetap atau meningkat
Perbedaan angka NIHSS selama perawatan
Perbaikan luaran perawatan
Perburukan luaran perawatan
47
Perbaikan luaran perawatan
4.2 Lokasi dan Waktu Penelitian
Penelitian dilakukan di ruang perawatan RSUP Sanglah Denpasar, mulai dari bulan Desember 2014 sampai dengan Februari 2015.
4.3 Ruang Lingkup Penelitian
Penelitian ini berada dalam ruang lingkup Ilmu Penyakit Saraf khususnya subdivisi neurovaskular.
4.4 Penentuan Sumber Data 4.4.1 Populasi Target
Populasi target adalah semua penderita stroke hemoragik akut. 4.4.2 Populasi Terjangkau
Populasi terjangkau adalah penderita stroke hemoragik akut yang menjalani perawatan di Rumah Sakit Umum Pusat Sanglah Denpasar.
4.4.3 Sampling Frame
4.4.4 Kriteria Subjek 4.4.4.1 Kriteria Inklusi
Adapun kriteria inklusi pada penelitian ini yaitu:
1. Penderita bersedia menjadi subjek penelitian atau keluarga yang mewakili menyetujui dengan menandatangani surat persetujuan kesediaan bahwa penderita ikut dalam penelitian sebagai sampel
2. Menderita stroke hemoragik akut ≤ 24 jam
3. Usia penderita 18-60 tahun
4. Penderita dengan GCS > 8 saat awal masuk 5. Penderita mengalami leukositosis
6. Penderita pada CT sken kepala saat awal masuk menunjukkan volume perdarahan intraserebral supratentorial < 30 mililiter (ml) dan perdarahan serebelum diameter < 3 sentimeter (cm) serta perdarahan subaraknoid derajat 1 sampai 3 menurut pembagian Hunt dan Hess.
4.4.4.2 Kriteria Eksklusi
Adapun kriteria eksklusi pada penelitian ini yaitu:
1. Penderita yang pada anamnesis dijumpai infeksi atau inflamasi akut atau kronis selama dan sebelum menderita stroke
2. Penderita yang sedang mengalami penyakit autoimun seperti SLE dan penyakit defisiensi sistem imun seperti Acquired Immunodeficiency
Syndrome (AIDS)
4. Penderita stroke yang menderita penyakit organ lain seperti jantung, hepar, limpa, ginjal, tulang dan paru
5. Penderita mengalami keganasan
6. Penderita dengan infeksi otak, trauma kepala dan penderita stroke yang menjalani operasi bedah saraf atau tindakan pembedahan lainnya
7. Penderita mengalami sepsis
8. Penderita dengan perdarahan di batang otak, talamus, intraventrikel, subaraknoid derajat 4 dan 5 menurut pembagian Hunt dan Hess dan hidrosefalus pada CT sken kepala.
9. Penderita mengalami cushing response
10.Penderita yang sedang mengalami gangguan otak lain
4.4.5 Besaran Sampel
Besaran sampel pada penelitian ini dihitung dengan rumus untuk jenis penelitian analitik dengan skala pengukuran komparatif dengan variabel kategorik tidak berpasangan (Colton, 1974 cit. Dahlan, 2013):
Keterangan:
n : besar sampel
Zα : deviat baku alfa Zβ : deviat baku beta
P1 : proporsi pada kelompok yang nilainya merupakan judgement peneliti
P2 : proporsi pada kelompok yang sudah diketahui nilainya P1 – P2 : selisih proporsi minimal yang dianggap bermakna P : proporsi total = (P1 + P2)/2
Q : 1 - P
Kesalahan tipe I ditetapkan sebesar 5%, hipotesis satu arah, sehingga Zα = 1,96 Kesalahan tipe II ditetapkan sebesar 20%, maka Zβ = 0,84
Selisih proporsi minimal yang dianggap bermakna (P1 – P2) = 0,27 (Agnihotri et
al., 2011)
Proporsi perbaikan klinis pada kelompok yang jumlah leukositnya tetap atau meningkat (P2) = 70% = 0,7 (Agnihotri et al.,2011)
Q2 = 1 – 0,7 = 0,3
P1 = P2 + 0,27 = 0,7 + 0,27 = 0,97 Q1 = 1 – P1 = 1 – 0,97 = 0,03
P = (P1 + P2)/2 = (0,97 + 0,7)/2 = 0,84 Q = 1 – P = 1 – 0,835 = 0,17
Dengan dimasukkan nilai-nilai di atas pada rumus diperoleh:
2
= 21,08 dibulatkan menjadi 22
Dengan demikian, besar sampel minimal masing-masing kelompok adalah 22 4.4.6 Teknik Pengambilan Sampel
Subjek penelitian diambil dari populasi sasaran dan populasi terjangkau. Sampel diambil secara berturut-turut dengan menggunakan metode sampling non random jenis konsekutif dari penderita stroke hemoragik akut yang memenuhi kriteria penelitian sampai batas waktu tertentu.
4.5 Variabel Penelitian 4.5.1 Klasifikasi Variabel
Variabel dalam penelitian ini adalah:
1. Variabel bebas: jumlah leukosit dalam darah, berskala kategorik 2. Variabel tergantung: luaran perawatan stroke, berskala kategorik
3. Variabel kendali: usia, jenis kelamin, jenis perdarahan, pergeseran garis tengah pada CT sken kepala, GCS awal masuk, tekanan darah arterial rata-rata awal masuk
4. Variabel perancu: kondisi lain yang dapat mempengaruhi penurunan leukosit dalam darah yaitu Infeksi sebelumnya dan selama perawatan, keganasan, pengaruh obat, riwayat atau pasca operasi, sepsis, cushing
response, gangguan jantung, paru, ginjal, hepar, imun, otak, riwayat
4.5.2 Definisi Operasional Variabel
1. Stroke hemoragik adalah defisit neurologis fokal yang timbul secara mendadak berlangsung lebih atau kurang dari 24 jam yang disertai dengan kematian akibat pecahnya pembuluh darah di intrakranial dan tidak disebabkan oleh trauma kepala baik perdarahan intraserebral, subaraknoid, maupun intraventrikel. Diagnosis stroke ditegakkan sesuai pemeriksaan klinis neurologis yang ditemukan dan dikonfirmasi secara pasti sesuai standar baku emas dengan menggunakan computed tomography (CT) sken kepala dijumpai gambaran hiperdensitas (Israr, 2008). Penentuan stroke hemoragik dilakukan oleh seorang spesialis radiologi.
2. Fase akut stroke hemoragik adalah waktu antara awitan awal mula serangan stroke yang berlangsung sampai 7 hari selama perawatan di rumah sakit (Sacco et al., 2013).
pada hari keempat, kemudian dilakukan perbandingan antara nilai yang pertama dan kedua (Hoffbrand dan Petit, 2000). Data berskala kategorik berupa penurunan dan peningkatan jumlah leukosit.
4. Luaran stroke adalah kondisi saat perawatan hari ketujuh setelah serangan stroke, yang dinilai dengan angka NIHSS. Angka NIHSS terbagi menjadi lima kelompok yaitu nilai 0 pada normal, nilai 1-4 pada stroke ringan, nilai 5-15 pada stroke sedang, 16-20 pada stroke sedang-berat, nilai 21-42 pada stroke berat. Penghitungan NIHSS sebanyak dua kali. Pertama saat penderita masuk di Instalasi Rawat Darurat dan yang kedua saat perawatan stroke hemoragik pada hari ketujuh, kemudian dilakukan perbandingan antara nilai yang pertama dan kedua. Perbaikan luaranapabila didapatkan penurunan nilai NIHSS antara awal dan akhir sebesar kurang dari dan sama dengan dua poin. Sedangkan perburukan luaran apabila didapatkan nilai NIHSS antara awal dan akhir tetap atau meningkat lebih dari dan sama dengan dua poin atau didapatkan kematian selama perawatan (Jensen dan Lyden, 2006; Cheung et al., 2008; DeGraba et al., 2010; Boone et al., 2012). Data berskala kategorik berupa perbaikan dan perburukan klinis. 5. Usia ditentukan dari tanggal, bulan dan tahun lahir serta jenis kelamin
berdasarkan kartu tanda penduduk (KTP) atau keterangan keluarga sesuai rekam medis. Data berskala kategorik yang dibagi menjadi dua kelompok yaitu usia ≤55 tahun dan >55 tahun serta jenis kelamin laki-laki dan
6. Volume perdarahan didapatkan dari hasil penghitungan pada CT sken kepala. Garis ukur dipilih pada potongan perdarahan yang paling luas. Rumus yang digunakan yaitu (Godoy et al., 2010):
Keterangan:
p : panjang, dalam cm pada skala CT sken kepala ditentukan dari diameter terlebar pada potongan dengan perdarahan terluas
l : lebar, dalam cm pada skala CT sken kepala ditentukan dengan menarik garis tegak lurus dengan p
t : jumlah potongan yang tampak darah pada CT sken kepala
Volume perdarahan yang dimasukkan dalam analisis data adalah kurang dari 30 ml (Godoy et al., 2010). Volume perdarahan ditentukan oleh seorang spesialis radiologi.
derajat 3 kesadaran menurun dengan defisit fokal neurologi ringan, derajat 4 stupor, hemiparesis sedang sampai berat, awal deserebrasi dan derajar 5 koma dalam, deserebrasi (Israr, 2008; Mohr et al., 2010). Jenis perdarahan ditentukan oleh seorang spesialis radiologi. Data berskala kategorik yaitu perdarahan intraserebral dan subaraknoid.
8. Pergeseran garis tengah pada CT sken kepala ditentukan dengan mengukur pergeseran septum pelusidum melewati garis tengah dimana garis ini ditarik dari anterior ke posterior dari falx serebri pada tingkat ventrikel lateralis dan ventrikel ketiga. Hal ini ditentukan oleh seorang spesialis radiologi (Godoy et al., 2010). Bila penderita menunjukkan pergeseran garis tengah dikatakan ya dan bila tidak menunjukkan pergeseran garis tengah dikatakan tidak. Data berskala kategorik.
9. Glasgow coma scale adalah skala pengukuran tingkat kesadaran secara
mengerang diberikan nilai 2 dan penderita yang tidak ada respon bicara diberikan nilai 1. Interpretasi pemeriksaan komponen motorik yaitu penderita dapat mengikuti perintah verbal pemeriksa diberikan nilai 6, penderita dapat melokalisasi rangsangan nyeri diberikan nilai 5, penderita dapat menapis rangsangan nyeri diberikan nilai 4, penderita menunjukkan posisi dekortikasi bila diberikan rangsangan nyeri bernilai 3, penderita yang menunjukkan posisi deserebrasi bila diberikan rangsangan nyeri bernilai 2 dan penderita yang tidak menunjukkan respon motorik saat diberikan rangsangan nyeri bernilai 1. Rangsangan nyeri dilakukan pada penekanan daerah supraorbita, sternum dan pangkal kuku jari. Nilai dari ketiga komponen tersebut dijumlahkan untuk mendapatkan skor total GCS. Skor total GCS 15 dikatakan kompos mentis, penurunan kesadaran dengan skor GCS 12-14 dikatakan penurunan GCS ringan, 9-11 dikatakan penurunan GCS sedang, 3-7 dikatakan penurunan GCS berat dengan skor 3 dikatakan koma (Posner et al., 2007; Godoy et al., 2010). Penelitian ini mengeksklusi penderita dengan GCS awal masuk ≤8. Data berskala kategorik, subjek penelitian dibagi menjadi dua yaitu GCS <12 dan ≥12.
10.Tekanan darah arterial rata-rata didapatkan dari rumus (Zhang et al., 2009):
Keterangan: