i
SINTESIS 2-(4ꞌ-HIDROKSIBENZILIDENA)-SIKLOHEKSANA-1,3-DION DARI SIKLOHEKSANA-1,3-DION DAN 4-HIDROKSIBENZALDEHIDA
DENGAN KATALIS ASAM KLORIDA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Cynthia Listiyani Santoso NIM : 088114045
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
Special thanks kepada Tuhan Yesus, atas kesempatan,
pengalaman, pembelajaran, manfaat positif yang boleh saya
terima selama menjalani skripsi.
Special thanks untuk papa, mama tercinta, yang selalu
mendukung, mendoakan.
Special thanks untuk adikku yang aku sayang.
Special thanks untuk opa, omaku tersayang, yang selalu
mendukung, mendoakan.
Dan untuk diriku sendiri atas semua perjuanganku dan kerja
kerasku.
Selalu teringat pesan opa : Jangan pernah takut
melakukan sesuatu sebelum kita mencobanya.
Percayalah selalu bahwa rencana-Nya selalu indah
vi PRAKATA
Puji syukur kepada Tuhan YME atas berkat dan rahmat-Nya serta
kasih-Nya yang memberikan kekuatan, semangat bagi penulis sehingga penulis dapat
menyelesaikan skripsi yang berjudul “Sintesis 2-(4ꞌ
-hidroksibenzilidena)-sikloheksana-1,3-dion dari Sikloheksana-1,3-dion dan 4-hidroksibenzaldehida
dengan Katalis Asam Klorida”dengan baik. Skripsi ini disusun untuk memenuhi
salah satu syarat dalam memperoleh gelar Sarjana Strata Satu (S1) Program Studi
Farmasi (S.Farm.) di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Dengan tersusunnya skripsi ini, penulis ingin mengucapkan terima kasih
kepada:
1. Ipang Djunarko, M.Sc., Apt., selaku Dekan Fakultas Farmasi, Universitas
Sanata Dharma Yogyakarta.
2. C.M. Ratna Rini Nastiti, M.Pharm., Apt., selaku Ketua Program Studi
Fakultas Farmasi.
3. Jeffry Julianus, M.Si., selaku dosen pembimbing yang telah memberikan
bimbingan, pengarahan, dan ilmu kepada penulis sekaligus sebagai dosen
penguji atas segala masukan (pendapat), kritik dan sarannya.
4. Dra. M. M. Yetty Tjandrawati, M. Si. selaku dosen penguji atas segala
masukan, kritik dan sarannya.
5. Dr. Pudjono, SU., Apt. selaku dosen penguji atas segala pengarahan, masukan,
vii
6. Rini Dwi Astuti, M. Sc., Apt., selaku kepala laboratorium Fakultas Farmasi,
atas ijin yang diberikan kepada penulis untuk melakukan penelitian di
laboratorium Fakultas Farmasi.
7. Staf Laboratorium Kimia Organik (Suparlan), Kimia Analisis (Kunto), Kimia
Analisis Instrumental (Bimo) dan Farmakognosi-Fitokimia (Wagiran)
Fakultas Farmasi Universitas Sanata Dharma yang telah menemani dan
membantu penulis selama melakukan penelitian.
8. Christian Halim yang selalu bersedia menemani penulis dalam suka maupun
duka, menemani dan membantu penulis selama melakukan penelitian, tanpa
lelah selalu memberikan dukungan dan semangat kepada penulis, masukan
(pendapat), kritik, saran yang membangun kepada penulis dalam menghadapi
setiap persoalan yang dialami penulis dan dalam bertindak menyikapi
beberapa hal.
9. Laurensius Widi Andikha Putra, Margareth Henrika Silow, Elya Findawati
yang menemani selama praktikum, atas diskusi dan masukannya.
10. Semua pihak yang tidak dapat disebutkan satu per satu oleh penulis.
Penulis menyadari bahwa banyak kesalahan dan kekurangan dalam
penulisan skripsi ini, mengingat keterbatasan kemampuan dan ilmu pengetahuan
penulis. Untuk itu penulis mengharapkan saran dan kritik yang membangun dari
semua pihak agar penulisan skripsi ini menjadi lebih baik lagi. Akhir kata, semoga
skripsi ini dapat berguna bagi pembaca.
Penulis
ix DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS ... v
PRAKATA ... vi
PERNYATAAN KEASLIAN KARYA ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xvi
INTISARI ... xvii
ABSTRACT ... xviii
BAB I. PENGANTAR ... 1
A.LATAR BELAKANG ... 1
1. Permasalahan ... 6
2. Keaslian Penelitian ... 6
3. Manfaat Penelitian ... 7
x
BAB II. PENELAHAAN PUSTAKA ... 8
A.Senyawa Kurkumin sebagai Senyawa Penuntun ... 8
B.Sintesis 2-(4ꞌ-hidroksibenzilidena)-sikloheksana-1,3-dion ... 10
C.Analisis Pendahuluan ... 12
1. Pemeriksaan Organoleptis ... 12
2. Pemeriksaan Kelarutan ... 13
D.Pemurnian dan Pemeriksaan Kemurnian Senyawa Hasil Sintesis ... 14
1. Rekristalisasi ... 14
2. Pemeriksaan Titik Lebur ... 15
3. Kromatografi Lapis Tipis (KLT) ... 16
4. Gas Chromatography (GC) ... 17
E. Elusidasi Struktur ... 18
1. Spektrofotometri Inframerah (IR) ... 18
2. Spektrometri Massa ... 19
F. Landasan Teori ... 21
G.Hipotesis ... 22
BAB III. METODE PENELITIAN ... 23
A.Jenis dan Rancangan Penelitian ... 23
B.Definisi Operasional ... 23
C.Bahan Penelitian ... 24
D.Alat Penelitian ... 24
xi
1. Sintesis 2-(4ꞌ-hidroksibenzilidena)-sikloheksana-
1,3-dion ... 24
2. Analisis Senyawa Hasil Sintesis ... 25
3. Elusidasi Struktur Senyawa Hasil Sintesis ... 27
F. Analisis Hasil ... 28
1. Perhitungan Rendemen ... 28
2. Analisis Pendahuluan ... 28
3. Pemeriksaan Kemurnian Senyawa Hasil Sintesis ... 28
4. Elusidasi Struktur ... 28
BAB IV. HASIL DAN PEMBAHASAN ... 29
BAB V. KESIMPULAN DAN SARAN ... 54
A. Kesimpulan ... 54
B. Saran ... 54
DAFTAR PUSTAKA ... 55
LAMPIRAN ... 59
xii
DAFTAR TABEL
Tabel I. Istilah Kelarutan menurut Farmakope Indonesia IV ... 14
Tabel II. Data organoleptis senyawa hasil sintesis dan dengan starting material ... 34
Tabel III. Data kelarutan senyawa hasil sintesis dan starting material ... 35
Tabel IV. Nilai Rfhasil kromatogram senyawa hasil sintesis ... 37
Tabel V. Nilai Rfhasil kromatogram senyawa hasil sintesis ... 38
Tabel VI. Nilai Rfhasil kromatogram senyawa hasil sintesis ... 39
Tabel VII. Data jarak lebur senyawa hasil sintesis dan starting material ... 40
Tabel VIII. Interpretasi spektra inframerah senyawa hasil sintesis ... 42
xiii
DAFTAR GAMBAR
Gambar 1. Struktur senyawa 2-benzilidena-sikloheksana-1,3-dion ... 2
Gambar 2. Struktur senyawa 2-(4ꞌ-hidroksibenzilidena)- sikloheksana-1,3-dion ... 3
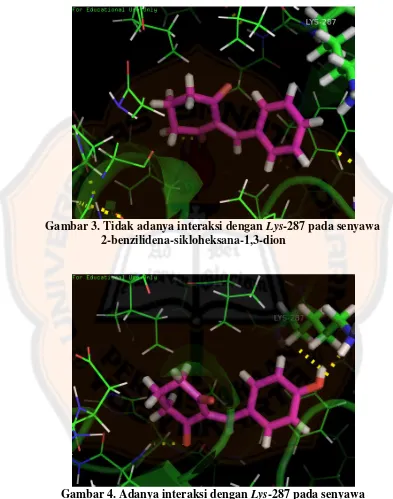
Gambar 3. Tidak adanya interaksi dengan Lys-287 pada senyawa 2-benzilidena-sikloheksana-1,3-dion ... 4
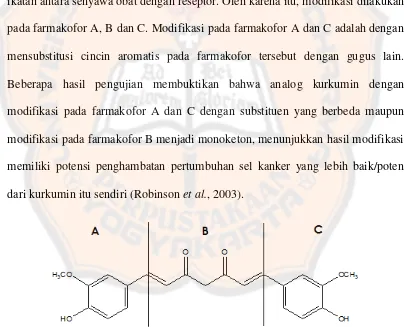
Gambar 4. Adanya interaksi dengan Lys-287 pada senyawa 2-(4ꞌ-hidroksibenzilidena)-sikloheksana-1,3-dion ... 4
Gambar 5. Tiga gugus farmakofor pada kurkumin ... 8
Gambar 6. Struktur senyawa 2-benzilidena- sikloheksana-1,3-dion ... 9
Gambar 7. Struktur senyawa 2-(4ꞌ-hidroksibenzilidena)- 1,3- sikloheksanadion ... 9
Gambar 8. Mekanisme penangkapan radikal bebas ... 10
Gambar 9. Resonansi radikal bebas fenol ... 10
Gambar 10. Struktur senyawa sikloheksana-1,3-dion ... 11
Gambar 11. Struktur senyawa 4-hidroksibenzaldehid ... 11
Gambar 12. Spektra Massa ... 20
Gambar 13. Reaksi umum sintesis 2-(4ꞌ-hidroksibenzilidena)- sikloheksana-1,3-dion dengan katalis HCl ... 21
Gambar 14. Mekanisme penangkapan radikal bebas ... 30
Gambar 15. Resonansi radikal bebas fenol ... 30
xiv
Gambar 17. Gugus keton dan hidrogen alfa (α) pada senyawa
sikloheksana-1,3-dion ... 31
Gambar 18. Mekanisme reaksi sintesis senyawa 2-(4ꞌ-hidroksibenzilidena)- sikloheksana-1,3-dion ... 33
Gambar 19. Kromatogram senyawa hasil sintesis pada fase gerak etil asetat : heksana (2:3) ... 37
Gambar 20. Kromatogram senyawa hasil sintesis pada fase gerak etil asetat : heksana (3:2) ... 38
Gambar 21. Kromatogram senyawa hasil sintesis pada fase gerak etil asetat : heksana (1:4) ... 39
Gambar 22. Spektra Infra merah senyawa hasil sintesis ... 41
Gambar 23. Spektra Infra merah senyawa sikloheksana-1,3-dion ... 43
Gambar 24. Spektra Infra merah senyawa 4-hidroksibenzaldehid ... 43
Gambar 25. Kromatogram Gas Chromatography senyawa hasil sintesis ... 45
Gambar 26. Spektra massa senyawa hasil sintesis pada waktu retensi 3,694 menit ... 45
Gambar 27. Spektra massasenyawa hasil sintesis pada waktu retensi 7,397 menit ... 45
Gambar 28. Usulan mekanisme fragmentasi ion molekul ... 48
Gambar 29. Usulan mekanisme fragmentasi ion molekul ... 49
xv
Gambar 31. Struktur senyawa hasil sintesis (senyawa 4-(4ꞌ-
hidroksibenzilidena)-2-(3-oksosikloheks-1-enil)-
sikloheksana-1,3-dion) ... 52
Gambar 32. Mekanisme reaksi hasil sintesis (senyawa 4-(4ꞌ-
hidroksibenzilidena)-2-(3-oksosikloheks-1-enil)-
sikloheksana-1,3-dion) ... 53
xvi
DAFTAR LAMPIRAN
Lampiran 1. Perhitungan senyawa sintesisdan rendemen ... 59
Lampiran 2 . Kromatogram KLT senyawa hasil sintesis dan
perhitungan Rf ... 61
Lampiran 3. Perhitungan kepolaran fase gerak KLT dan
Log P senyawa hasil sintesis ... 67
Lampiran 4 . Spektra IR senyawa hasil sintesis ... 68
Lampiran 5. Spektra IR senyawa sikloheksana-1,3-dion dan
interpretasi gugusnya ... 69
Lampiran 6. Spektra IR senyawa 4-hidroksibenzaldehid dan
interpretasi gugusnya ... 70
Lampiran 7. Kromatogram GC senyawa hasil sintesis ... 71
Lampiran 8. Spektra massa senyawa hasil sintesis ... 72
Lampiran 9. Perhitungan muatan C karbonil pada 4-hidroksibenzaldehida
xvii INTISARI
Senyawa 2-(4ꞌ-hidroksibenzilidena)-sikloheksana-1,3-dion diharapkan dapat disintesis dari starting material sikloheksana-1,3-dion 0,336 gram (3 mmol) dan 4-hidroksibenzaldehida 0,366 gram (3 mmol) dengan katalis asam klorida berdasarkan reaksi kondensasi aldol silang. Analisis yang dilakukan terhadap senyawa hasil sintesis meliputi: pemeriksaan organoleptis, pemeriksaan kelarutan, pemeriksaaan titik lebur, uji Kromatografi Lapis Tipis (KLT), uji Gas Chromatography (GC), elusidasi struktur dengan spektrofotometri inframerah (IR), spektrometri massa, dan perhitungan rendemen.
Senyawa hasil sintesis berupa serbuk kristal, berwarna kuning muda, tidak berbau, larut dalam kloroform, agak larut dalam etanol, etil asetat, heksana, dan tidak larut dalam aquadest dan eter, memiliki jarak lebur 299,3-299,60C dan rendemen 24,5%. Hasil uji KLT dengan fase diam silika gel GF254 dan fase gerak
etil asetat : heksana (1:4) diperoleh bercak tunggal dengan Rf 0,24. Kromatogram
GC menunjukkan senyawa memiliki kemurnian 97,9%. Hasil spektra IR dan MS menunjukkan senyawa hasil sintesis adalah 4-(4ꞌ -hidroksibenzilidena)-2-(3-oksosikloheks-1-enil)-sikloheksana-1,3-dion.
xviii ABSTRACT
The compound 2-(4ꞌ-hydroxybenzylidene)-cyclohexane-1,3-dione is hopely could be synthesized from the starting material cyclohexane-1,3-dione 0.336 g (3 mmol) and 4-hydroxybenzaldehyde 0.366 g (3 mmol) with hydrochloric acid catalyst based on cross-aldol condensation reaction. The analysis conducted on the compounds synthesized include: examination organoleptis, examination solubility, melting point checks, Thin Layer Chromatography tests (TLC), Gas Chromatography test (GC), structure elucidation by infrared spectrophotometry (IR), mass spectrometry, and calculation of yield.
Compounds synthesized in the form of crystalline powder, pale yellow, odorless, soluble in chloroform, slightly soluble in ethanol, ethyl acetate, hexane, and insoluble in distilled water and ether, has a melting point range from 299.3 to 299.60C and the yield obtained 24.516%. Test results of TLC with silica gel GF254
stationary phase and mobile phase ethyl acetate: hexane (1:4) obtained single spots at Rf 0.24. The GC chromatogram showed the compound has a purity of
97.9%. The results of IR and MS spectra showed compounds synthesized is 4-(4ꞌ -hydroxybenzylidene)-2-(3-oxocyclohex-1-enyl)-cyclohexane-1,3-dione.
1 BAB I PENGANTAR
A. Latar Belakang
Angiogenesis adalah suatu peristiwa pembentukan pembuluh darah baru
di dalam jaringan yang sedang tumbuh. Pembentukan pembuluh darah baru yang
tidak terkontrol ini akibat adanya penyediaan darah terhadap jaringan yang sedang
tumbuh tersebut sehingga dapat menyebabkan tumor. Salah satu faktor yang dapat
meningkatkan pertumbuhan pembuluh darah baru adalah Vascular Endothelial
Growth Factor (VEGF).
Pembentukan pembuluh darah baru ini dapat diinhibisi dengan senyawa
kurkumin. Namun, dari penelitian yang telah ada sebelumnya menunjukkan
bahwa modifikasi struktur kurkumin menjadi analog kurkumin menghasilkan efek
farmakologis yang lebih baik dibandingkan dengan kurkumin. Oleh karena itu,
senyawa analog kurkumin lebih banyak digunakan sebagai inhibitor angiogenesis
(Mosley, Dennis, James, 2007).
Senyawa analog kurkumin yang memiliki aktivitas sebagai inhibitor
angiogenesis yaitu senyawa 2-benzilidena-sikloheksana-1,3-dion telah berhasil
disintesis dan diketahui memiliki aktivitas sebagai inhibitor angiogenesis
(Istyastono, 2006).
Senyawa analog kurkumin lain yang dapat dikembangkan yang juga
memiliki aktivitas sebagai inhibitor angiogenesis yaitu senyawa 2-(4ꞌ
struktur dari analog kurkumin yaitu 2-benzilidena-sikloheksana-1,3-dion dengan
penambahan gugus hidroksi pada cincin benzennya. Gugus hidroksi memiliki
aktivitas menghambat pertumbuhan sel kanker (Husniati, 2008). Pertumbuhan sel
kanker disebabkan adanya mutasi pada gen-gen (Putsztai, Lewis, Yap, 1996).
Mutasi pada gen-gen diakibatkan oleh adanya radikal bebas di dalam tubuh
sehingga proliferasi sel menjadi tidak normal (berlebihan). Modifikasi dengan
penambahan gugus hidroksi pada senyawa 2-(4ꞌ
-hidroksibenzilidena)-sikloheksana-1,3-dion diharapkan dapat menghambat pertumbuhan sel kanker
dengan cara menangkap radikal bebas di dalam tubuh, sebab jika radikal bebas
dapat ditangkap oleh gugus hidroksi dari senyawa 2-(4ꞌ
-hidroksibenzilidena)-sikloheksana-1,3-dion, proses mutasi pada gen-gen dapat dihentikan sehingga
proliferasi sel yang tidak normal (berlebihan) tidak terjadi, maka pertumbuhan sel
kanker dapat dihambat.
Mekanisme penangkapan radikal bebas oleh gugus hidroksi dari senyawa
2-(4ꞌ-hidroksibenzilidena)-sikloheksana-1,3-dion yaitu menangkap radikal bebas
hidroksi dengan cara melepaskan radikal hidrogen, dimana akan terjadi
kondensasi antara radikal hidrogen dengan radikal hidroksi sehingga membentuk
molekul air, sedangkan radikal fenol sendiri akan terstabilkan oleh resonansi pada
cincin benzennya (Hart, 1987).
O
O
HO
O
O
Gambar 2. Struktur senyawa 2-(4ꞌ-hidroksibenzilidena)- sikloheksana-1,3-dion
Untuk dapat menghambat pertumbuhan sel kanker, senyawa obat harus
memiliki interaksi penting dengan asam amino pada Vascular Endothelial Growth
Factor Receptor-2 (VEGFR2). Interaksi penting tersebut adalah interaksi dengan
asam amino Lys-287 (Apweiler, Cathy, Ioannis, 2002). Selain itu, juga perlu
dilihat harga ΔG, dimana ΔG merupakan energi bebas Gibbs (kkal/mol) yang
menunjukkan kestabilan interaksi (ikatan) ligan dengan reseptor pada binding site.
Semakin besar harga ΔG maka semakin stabil ikatan ligan dengan reseptor. Harga
ΔG ligan fisetin (sebagai ligan pembanding) sebesar -10,3504 kkal/mol.
Senyawa 2-benzilidena-sikloheksana-1,3-dion yang telah diketahui
memiliki aktivitas sebagai inhibitor angiogenesis pada VEGFR2 memiliki ΔG
sebesar -10,2916 kkal/mol, tetapi tidak memiliki interaksi dengan asam amino
Lys-287, sedangkan senyawa 2-(4ꞌ-hidroksibenzilidena)-sikloheksana-1,3-dion
memiliki ΔG sebesar -10,6139 kkal/mol dan memiliki interaksi dengan asam
amino Lys-287 pada gugus hidroksi. Hal ini berarti senyawa 2-(4ꞌ
-hidroksibenzilidena)-sikloheksana-1,3-dion lebih stabil dibandingkan dengan
senyawa 2-benzilidena-sikloheksana-1,3-dion dan dengan adanya penambahan
gugus hidroksi dapat meningkatkan aktivitasnya sebagai inhibitor angiogenesis
interaksi tersebut merupakan interaksi penting pada Vascular Endothelial Growth
Factor Receptor-2 (VEGFR2).
Gambar 3. Tidak adanya interaksi dengan Lys-287 pada senyawa 2-benzilidena-sikloheksana-1,3-dion
Senyawa modifikasi merupakan senyawa karbonil α,β-tak jenuh.
Senyawa karbonil α,β-tak jenuh dapat diperoleh melalui reaksi kondensasi aldol
silang yang melibatkan adisi nukleofilik suatu enol keton ke suatu aldehid yang
melepaskan sebuah molekul air. Berdasarkan analisis tersebut, senyawa 2-(4ꞌ
-hidroksibenzilidena)-sikloheksana-1,3-dion dapat disintesis melalui reaksi
kondensasi aldol silang dengan mereaksikan sikloheksana-1,3-dion dan
4-hidroksibenzaldehida dengan menggunakan katalis asam klorida, dimana senyawa
sikloheksana-1,3-dion yang memiliki hidrogen alfa (α) dapat membentuk enol
keton yang berfungsi sebagai nukleofilik yang akan menyerang atom C karbonil
pada senyawa 4-hidroksibenzaldehida sehingga menghasilkan senyawa 2-(4ꞌ
-hidroksibenzilidena)-sikloheksana-1,3-dion dan melepaskan molekul air.
Katalis dalam suatu sintesis diperlukan untuk mempercepat suatu reaksi
dengan menurunkan energi aktivasinya. Katalis yang digunakan pada sintesis
2-(4ꞌ-hidroksibenzilidena)-sikloheksana-1,3-dion yaitu katalis asam klorida yang
merupakan asam kuat. Katalis ini akan membuat atom oksigen pada gugus
karbonil sikloheksana-1,3-dion terprotonasi dan melepaskan hidrogen alfa (α)
sehingga membentuk enol netral, maka kondensasi aldol silang antara aldehid
dengan senyawa yang memiliki hidrogen alfa (α) dapat terjadi.
Pada penelitian ini tidak digunakan katalis basa kuat seperti NaOH untuk
menghindari hidroksi fenolik pada senyawa 4-hidroksibenzaldehida yang bersifat
asam menjadi O- (ion fenoksida). Hidroksi fenolik bersifat lebih asam daripada H
alfa (α) pada senyawa sikloheksana-1,3-dion, sehingga katalis basa kuat (NaOH)
membentuk ion fenoksida daripada bereaksi dengan H alfa (α) pada senyawa
sikloheksana-1,3-dion dalam pembentukan ion enolat. Hal ini mengakibatkan O
-(ion fenoksida) bersifat lebih nukleofil daripada ion enolat. Oleh karena itu, ion
fenoksida yang terbentuk akan bereaksi dengan C karbonil sikloheksana-1,3-dion
yang bersifat elektrofil. Maka pada penelitian ini digunakan katalis HCl dimana
H+ dari HCl ini diharapkan akan memprotonasi atom oksigen pada
sikloheksana-1,3-dion sehingga dapat terbentuk enol yang kemudian akan bereaksi dengan
4-hidroksibenzaldehida membentuk senyawa target 2-(4ꞌ
-hidroksibenzilidena)-sikloheksana-1,3-dion.
1. Permasalahan
Apakah senyawa 2-(4ꞌ-hidroksibenzilidena)-sikloheksana-1,3-dion dapat
disintesis dari sikloheksana-1,3-dion dan 4-hidroksibenzaldehida dengan katalis
asam klorida?
2. Keaslian Penelitian
Penelitian sejenis yang pernah dilakukan yaitu sintesis senyawa
berpotensi sebagai inhibitor angiogenesis : 2-benzilidena-sikloheksana-1,3-dion
(Istyastono, 2006), sintesis senyawa 2-(4ꞌ-klorobenzilidena)-sikloheksanadion dari
sikloheksana-1,3-dion dan 4-klorobenzaldehid dengan katalis kalium hidroksida
(Christy, 2011), sintesis senyawa 2-(4ꞌ
-hidroksibenzilidena)-sikloheksana-1,3-dion dari sikloheksana-1,3--hidroksibenzilidena)-sikloheksana-1,3-dion dan 4-hidroksibenzaldehid dengan katalis kalium
3. Manfaat Penelitian
a. Manfaat teoritis yang dapat diperoleh yaitu mendapat informasi mengenai
sintesis senyawa 2-(4ꞌ-hidroksibenzilidena)-sikloheksana-1,3-dion dari
sikloheksana-1,3-dion dan 4-hidroksibenzaldehida dengan katalis asam
klorida.
b. Manfaat metodologis yang dapat diperoleh yaitu mendapat pengetahuan
mengenai cara sintesis senyawa 2-(4ꞌ
-hidroksibenzilidena)-sikloheksana-1,3-dion dari sikloheksana--hidroksibenzilidena)-sikloheksana-1,3-dion dan 4-hidroksibenzaldehida dengan
katalis asam klorida dengan reaksi kondensasi aldol silang.
c. Manfaat praktis yang dapat diperoleh yaitu mendapat informasi mengenai
adanya modifikasi dan pengembangan senyawa analog dari kurkumin yang
dapat meningkatkan efek farmakologisnya.
B. Tujuan Penelitian
Penelitian ini bertujuan untuk mensintesis senyawa 2-(4ꞌ
-hidroksibenzilidena)-sikloheksana-1,3-dion dari sikloheksana-1,3-dion dan
8 BAB II
PENELAAHAN PUSTAKA
A. Senyawa Kurkumin sebagai Senyawa Penuntun
Senyawa kurkumin sebagai senyawa penuntun memiliki tiga gugus
farmakofor yang dibagi menjadi farmakofor A, B dan C. Farmakofor bagian A
dan C merupakan gugus aromatik dan farmakofor B adalah ikatan dien-dion. Dua
gugus aromatik baik secara simetris maupun tidak simetris menentukan posisi
ikatan antara senyawa obat dengan reseptor. Oleh karena itu, modifikasi dilakukan
pada farmakofor A, B dan C. Modifikasi pada farmakofor A dan C adalah dengan
mensubstitusi cincin aromatis pada farmakofor tersebut dengan gugus lain.
Beberapa hasil pengujian membuktikan bahwa analog kurkumin dengan
modifikasi pada farmakofor A dan C dengan substituen yang berbeda maupun
modifikasi pada farmakofor B menjadi monoketon, menunjukkan hasil modifikasi
memiliki potensi penghambatan pertumbuhan sel kanker yang lebih baik/poten
dari kurkumin itu sendiri (Robinson et al., 2003).
Robinson et al. (2003) telah membuktikan bahwa perubahan gugus β
-diketon pada struktur kurkumin menjadi ikatan α,β-tak jenuh monoketon
membuat senyawa analog kurkumin memiliki aktivitas sebagai penghambat sel
kanker yang aktivitasnya lebih baik daripada senyawa kurkumin itu sendiri.
Analog kurkumin merupakan hasil modifikasi struktur kurkumin pada
bagian farmakofor A, B, dan C. Senyawa analog tersebut adalah
2-benzilidena-sikloheksana-1,3-dion yang dimodifikasi dengan penambahan gugus hidroksi
pada cincin benzennya menjadi senyawa 2-(4ꞌ
-hidroksibenzilidena)-sikloheksana-1,3-dion.
O
O
Gambar 6. Struktur senyawa 2-benzilidena-sikloheksana-1,3-dion
HO
O
O
Gambar 7. Struktur senyawa 2-(4ꞌ-hidroksibenzilidena)- sikloheksana-1,3-dion
Senyawa α,β-tak jenuh berperan penting memberikan efek sebagai
antikanker dan dengan gugus hidroksi pada posisi para di cincin fenil sebagai
penangkap radikal bebas yang juga berperan penting untuk antikanker. Dengan
adanya 2 gugus tersebut diharapkan senyawa 2-(4ꞌ
Gugus hidroksi memiliki aktivitas menghambat pertumbuhan sel kanker
maupun mikroba (Husniati, 2008). Pertumbuhan sel kanker dapat dihambat
dengan adanya penangkapan radikal bebas oleh gugus hidroksi. Gugus hidroksi
ini dapat menangkap radikal bebas hidroksi dengan cara melepaskan radikal
hidrogen, dimana akan terjadi kondensasi antara radikal hidrogen dengan radikal
hidroksi sehingga membentuk molekul air. Sedangkan radikal fenol sendiri akan
terstabilkan oleh resonansi pada cincin benzennya (Hart, 1987).
O H RO O ROH
Gambar 8. Mekanisme penangkapan radikal bebas (Fessenden and Fessenden, 1986)
O O O O
Gambar 9. Resonansi radikal bebas fenol (Fessenden and Fessenden, 1986)
B. Sintesis 2-(4ꞌ-hidroksibenzilidena)-sikloheksana-1,3-dion
Senyawa 2-(4ꞌ-hidroksibenzilidena)-sikloheksana-1,3-dion dapat
disintesis dari starting material sikloheksana-1,3-dion dan 4-hidroksibenzaldehida
dengan katalis HCl berdasarkan reaksi kondensasi aldol silang. Senyawa
sikloheksana-1,3-dion merupakan senyawa karbonil golongan keton yang
memiliki hidrogen alfa (α). Sedangkan senyawa 4-hidroksibenzaldehida
merupakan suatu aldehid aromatis dengan substituen gugus hidroksi. Senyawa
karbonil dengan hidrogen alfa (α) dapat membentuk enol, maka kondensasi aldol
terjadi. Reaksi kondensasi aldol silang melibatkan adisi nukleofilik suatu enol
keton ke suatu aldehid sehingga produk yang dihasilkan yaitu melepaskan sebuah
molekul air dan membentuk karbonil α,β-tak jenuh (Fessenden and Fessenden,
1994).
O
O H
H
Gambar 10. Struktur senyawa sikloheksana-1,3-dion
HO
O
O
Gambar 11. Struktur senyawa 4-hidroksibenzaldehid
Katalis yang digunakan dalam sintesis 2-(4ꞌ
-hidroksibenzilidena)-sikloheksana-1,3-dion adalah katalis asam klorida. Dalam suasana asam, atom
oksigen pada gugus karbonil pada sikloheksana-1,3-dion akan terprotonasi dan
membentuk intermediet kation dimana dapat melepaskan H alfa (α) untuk
menghasilkan sebuah enol netral (McMurry, 2004). Enol keton ini yang berfungsi
sebagai nukleofilik. Pembentukan enol akan meningkatkan nukleofilisitas pada C
alfa (α) sikloheksana-1,3-dion dan akan menyerang atom C karbonil pada
senyawa 4-hidroksibenzaldehida sehingga menghasilkan senyawa 2-(4ꞌ
Pada penelitian ini tidak digunakan katalis basa kuat seperti NaOH untuk
menghindari hidroksi fenolik pada senyawa 4-hidroksibenzaldehida yang bersifat
asam menjadi O- (ion fenoksida). Hidroksi fenolik bersifat lebih asam daripada H
alfa (α) pada senyawa sikloheksana-1,3-dion, sehingga katalis basa kuat (NaOH)
akan lebih bereaksi dengan hidroksi fenolik pada senyawa 4-hidroksibenzaldehida
membentuk ion fenoksida daripada bereaksi dengan H alfa (α) pada senyawa
sikloheksana-1,3-dion dalam pembentukan ion enolat. Hal ini mengakibatkan O-
(ion fenoksida) bersifat lebih nukleofil daripada ion enolat. Oleh karena itu, ion
fenoksida yang terbentuk akan bereaksi dengan C karbonil sikloheksana-1,3-dion
yang bersifat elektrofil. Maka pada penelitian ini digunakan katalis HCl dimana
H+ dari HCl ini diharapkan akan memprotonasi atom oksigen pada
siklo-heksana-1,3-dion sehingga dapat terbentuk enol yang kemudian akan bereaksi dengan
4-hidroksibenzaldehida membentuk senyawa target 2-(4ꞌ
-hidroksibenzilidena)-sikloheksana-1,3-dion.
C. Analisis Pendahuluan
Analisis pendahuluan merupakan analisis untuk mengetahui karakteristik
dari senyawa hasil reaksi. Analisis pendahuluan yang dilakukan antara lain yaitu:
1. Pemeriksaan Organoleptis
Uji organoleptis merupakan uji yang paling sederhana dan memuat
informasi mengenai suatu zat yang secara umum meliputi bentuk, warna, dan bau.
kuat sebagai syarat baku. Akan tetapi, pemeriksaan ini dapat membantu dalam
penilaian pendahuluan suatu zat yang bersangkutan (Dirjen POM RI, 1995).
Pemeriksaan organoleptis ini berguna sebagai acuan awal untuk
menyatakan bahwa senyawa hasil sintesis sudah terbentuk. Dari pemeriksaan
organoleptis dapat diketahui perbedaan senyawa hasil sintesis dengan starting
material berdasarkan karakteristik fisikanya (bentuk, warna, bau).
2. Pemeriksaan Kelarutan
Kelarutan bukanlah merupakan suatu standar atau uji kemurnian dari
suatu zat yang bersangkutan, melainkan sebagai suatu informasi dari zat
bersangkutan itu sendiri (Dirjen POM RI, 1995).
Tujuan dari pemeriksaan kelarutan adalah untuk mengetahui sifat fisika
dari suatu zat (padat). Pemeriksaan kelarutan zat padat dalam cairan dilakukan
dengan cara melarutkan zat hingga larutan tepat jenuh pada suhu terkontrol.
Dalam setiap pemeriksaan kelarutan, kemurnian zat yang diperiksa dan pelarutnya
harus terjamin dengan baik, karena adanya sedikit pengotor saja akan
mempengaruhi hasil (Jenkins, Knevel, and Diganggi, 1965).
Menurut Farmakope Indonesia IV, karakteristik kelarutan dibagi menjadi
Tabel I. Istilah kelarutan menurut Farmakope Indonesia IV
Istilah Kelarutan Jumlah bagian pelarut yang digunakan untuk melarutkan 1 bagian zat (gram)
Sangat mudah larut Kurang dari 1 Mudah larut 1 sampai 10 Larut 10 sampai 30 Agak sukar larut 30 sampai 100 Sukar larut 100 sampai 1000 Sangat sukar larut 1000 sampai 10.000 Praktis tidak larut Lebih dari 10.000
(Dirjen POM RI, 1995).
D. Pemurnian dan Pemeriksaan Kemurnian Senyawa Hasil Sintesis 1. Rekristalisasi
Maksud dari rekristalisasi adalah proses memurnikan zat padat dengan
cara mengkristalkan kembali dengan pelarut yang sesuai dari cairan pelarut atau
campuran cairan pelarut. Tujuan yang paling utama dari rekristalisasi adalah
mengkristalkan kembali dalam bentuk kristal yang baik, bukan dalam bentuk
endapan halus yang dapat menarik kotoran, karena luas permukaannya yang besar
(Samhoedi, 1975).
Proses rekristalisasi melibatkan pemurnian suatu zat padat dengan cara
melarutkan zat padat tersebut, mengurangi volume larutannya dengan pemanasan
maka pelarut akan menguap sehingga larutan mencapai titik lewat jenuh,
pendinginan larutan maka kelarutan berkurang secara cepat dan senyawa mulai
mengendap menjadi bentuk kristal (Bresnick, 1996).
Agar proses rekristalisasi dapat berjalan dengan baik, setidaknya kotoran
harus dapat larut dalam pelarut untuk rekristalisasi agar kotoran tidak ikut
Solvent (pelarut) yang baik untuk rekristalisasi yaitu :
a. Dapat melarutkan senyawa dalam jumlah yang banyak pada suhu tinggi dan
dalam jumlah sedikit pada suhu rendah.
b. Harus dapat melarutkan kotoran dengan segera pada suhu rendah atau sama
sekali tidak dapat melarutkan atau hanya dapat sedikit melarutkan.
c. Dapat menghasilkan bentuk kristal yang baik dari senyawa yang dimurnikan
serta dapat mudah dipisahkan dari bahan utama (mempunyai titik didih yang
relatif rendah).
d. Pelarut dengan cara bagaimanapun tidak boleh bereaksi dengan senyawa yang
akan direkristalisasi (Samhoedi, 1975).
2. Pemeriksaaan Titik Lebur
Titik lebur suatu zat dalam bentuk kristal adalah temperatur, dimana zat
padat mulai berubah menjadi cairan di bawah tekanan satu atmosfer (Samhoedi,
1975). Jika suhu dinaikkan, molekul senyawa akan menyerap energi, sehingga
bila energi yang diserap cukup besar maka akan terjadi vibrasi dan rotasi dari
molekul tersebut. Bila suhu tetap dinaikkan terus, molekul akan rusak dan
berubah bentuk menjadi cairan (Bradstatter, 1971).
Pemeriksaan titik lebur memberikan informasi mengenai kemurnian dari
suatu produk sintesis. Suatu senyawa hasil sintesis dikatakan murni apabila jarak
leburnya tidak lebih dari 20C. Rentangan lebih besar dari 20C dapat dikatakan
3. Kromatografi Lapis Tipis (KLT)
Kromatografi lapis tipis terdiri dari 2 fase yaitu fase diam dan fase gerak
yang memiliki polaritas yang berbeda. Fase diam yang sering digunakan yaitu
silika gel GF254, sedangkan fase geraknya berupa campuran pelarut dengan
perbandingan tertentu. Fase gerak akan bergerak naik bersama senyawa yang akan
di analisis karena gaya kapiler. Selama proses elusi diperoleh jarak rambat
senyawa pada fase diam (Rf) yang merupakan cerminan polaritas senyawa
(Bresnick, 1996). Sistem yang paling sederhana adalah menggunakan 2 pelarut
organik, karena dapat dengan mudah mengatur daya elusi campuran kedua pelarut
ini agar diperoleh pemisahan yang optimal (Rohman, 2009).
Metode ini merupakan teknik analisis secara kualitatif yang bertujuan
untuk mengetahui apakah senyawa hasil sintesis telah terbentuk atau belum
(Gasparic and Churacek, 1978). Senyawa hasil sintesis ditotolkan pada plat KLT
silika gel GF254 dan dielusi bersama starting material (sebagai pembanding) yaitu
sikloheksana-1,3-dion dan 4-hidroksibenzaldehida. Jika hasil elusi menunjukkan
adanya perbedaan nilai Rf antara senyawa hasil sintesis dengan starting
materialnya, maka dapat dikatakan senyawa hasil sintesis telah terbentuk.
Untuk mengidentifikasi bercak lebih lanjut dapat dilakukan dengan
menempatkan plat KLT di bawah sinar UV pada panjang gelombang 254 nm
4. Gas Chromatography (GC)
Kromatografi gas merupakan metode yang dinamis untuk pemisahan dan
deteksi senyawa-senyawa organik yang mudah menguap dan senyawa-senyawa
gas anorganik dalam suatu campuran. Prinsip dasar kromatografi gas melibatkan
volatilisasi atau penguapan sampel dengan inlet injektor, pemisahan
komponen-komponen dalam campuran, dan deteksi tiap komponen-komponen dengan detektor (Rohman,
2009).
Kromatografi menggunakan gas sebagai gas pembawa/fase geraknya.
Fase gerak disebut juga dengan gas pembawa karena tujuan awalnya membawa
solut ke kolom, karenanya gas pembawa tidak berpengaruh pada selektifitas
(Gandjar, 2007). Syarat gas pembawa yaitu: tidak reaktif; murni karena jika tidak
murni akan berpengaruh pada detektor; dan dapat disimpan dalam tangki tekanan
tinggi. Beberapa gas pembawa yang digunakan yaitu hidrogen, helium, nitrogen,
argon, argon + metana 5%, dan karbon dioksida. Stationery state atau fase
diamnya biasanya liquid nonvolatil yang dilapisi di bagian dalam kolom (Gritter,
1991).
Di dalam kromatografi gas terdapat kolom, dimana kolom merupakan
tempat terjadinya proses pemisahan karena di dalamnya terdapat fase diam. Ada
tiga jenis kolom dalam kromatografi gas yaitu: kolom kemas (packing column),
kolom kapiler (capillary column), dan kolom preparatif (preparative column).
Dari ketiga jenis kolom yang ada, kolom kapiler yang paling banyak digunakan
karena kolom kapiler dapat memberikan efisiensi yang tinggi (harga jumlah pelat
dapat bersifat nonpolar, polar. Fase diam nonpolar yang paling banyak digunakan
adalah metil polisiloksan dan fenil 5%-metilpolisiloksan 95%. Fase diam polar
yang paling banyak digunakan adalah polietilen glikol (Rohman, 2009).
Pemisahan tercapai dengan partisi sampel antara fase gerak berupa gas
dan fase diam berupa cairan dengan titik didih tinggi (tidak mudah menguap).
Keuntungan dari kromatografi gas, yaitu memiliki kolom yang panjang sehingga
dapat dihasilkan efisiensi pemisahan yang lebih tinggi; gas dan uap memiliki
viskositas yang rendah, demikian juga kesetimbangan partisi antara gas dan cairan
berlangsung cepat, sehingga analisis relatif cepat dan sensivitasnya tinggi; fase
gerak dibandingkan sebagian besar fase cair tidak bersifat reaktif terhadap fase
diam dan zat-zat terlarut (Khopkar, 1990).
E. Elusidasi Struktur
Dalam pengidentifikasian suatu senyawa hasil sintesis diperlukan
elusidasi struktur yang berguna untuk mengetahui dengan lebih benar mengenai
struktur senyawanya. Elusidasi struktur dilakukan dengan menggunakan data dari:
1. Spektrofotometri Inframerah (IR)
Spektrofotometri inframerah sangat berguna untuk mendapatkan
informasi kualitatif dari molekul. Tetapi molekul harus memiliki sifat tertentu
agar dapat diabsorpsi. Tidak semua molekul dapat diabsorpsi pada daerah IR.
Molekul harus melalui perubahan dalam momen dipolnya agar dapat diabsorpsi
Metode ini digunakan untuk mengetahui gugus-gugus fungsional yang
terdapat dalam senyawa. Semua ikatan memiliki frekuensi khas yang membuat
ikatan mengulur (stretch) atau menekuk (bend). Bila frekuensi energi
elektromagnetik inframerah yang dilewatkan pada suatu molekul sama dengan
frekuensi mengulur (stretch) atau menekuknya (bend) ikatan maka energi itu akan
diserap. Serapan inilah yang akan direkam oleh suatu spektrometer IR (Bresnick,
1996).
Daerah radiasi spektrofotometri inframerah berkisar pada bilangan
gelombang 12800 – 10 cm-1 atau panjang gelombang 0,78 – 1000 µm. Radiasi IR
terbagi dalam tiga daerah, yaitu daerah IR dekat (12800 – 4000 cm-1 atau 0,78 –
2,5 µm), daerah IR tengah (4000 – 200 cm-1 atau 2,5 – 50 µm), daerah IR jauh
(200 – 10 cm-1 atau 50 – 1000 µm). Daerah yang sering digunakan untuk berbagai
keperluan praktis adalah 4000 – 690 cm-1 atau 2,5 – 1,5 µm (Khopkar, 1990).
2. Spektrometri Massa
Spektrometri massa merupakan suatu instrumen yang dapat menyeleksi
molekul-molekul gas bermuatan berdasarkan massa atau beratnya. Spektra massa
dapat diperoleh dengan mengubah senyawa suatu sampel menjadi ion-ion yang
bergerak cepat yang dipisahkan berdasarkan perbandingan massa terhadap muatan
(m/e) (Khopkar, 1990).
Metode ini merupakan teknik analisis yang menyediakan informasi
senyawa organik dan anorganik dan struktur kimianya, sehingga dapat diperoleh
bobot molekulnya (Pradyot, 1995).
Prinsip dasarnya yaitu senyawa dalam keadaan gas atau uap jika berada
dalam arus listrik tegangan tinggi dapat melepaskan elektron (e-) menjadi kation.
Kation ini dapat dipercepat dan dibiaskan oleh medan magnet dan/atau medan
listrik, dan pembiasan ini akan tergantung pada massa, muatan, dan kecepatan
kation tersebut (Panji, 2012).
Spektra massa digambarkan dengan grafik batangan. Setiap peak dalam
spektra menyatakan suatu fragmen molekul. Fragmen-fragmen disusun
sedemikian rupa sehingga peak-peak ditata menurut kenaikan m/e dari kiri ke
kanan dalam spektra. Intensitas peak sebanding dengan kelimpahan relatif
fragmen-fragmen, yang tergantung pada stabilitas relatifnya. Peak tertinggi dalam
suatu spektra disebut peak dasar dengan nilai intensitas sebesar 100%; peak-peak
yang lebih kecil memiliki nilai intensitas sebesar 20%, 30% (relatif terhadap peak
dasar). Kadang-kadang peak dasar ini disebabkan oleh ion molekul, tetapi sering
berasal dari suatu fragmen yang lebih kecil (Fessenden and Fessenden, 1994).
F. Landasan Teori
Reaksi kondensasi aldol silang adalah reaksi antara suatu aldehid dengan
suatu senyawa karbonil yang memiliki hidrogen alfa (α). Senyawa karbonil
dengan hidrogen alfa (α) dapat membentuk enol, maka kondensasi aldol silang
antara aldehid dengan senyawa yang memiliki hidrogen alfa (α) dapat terjadi.
Dalam bentuk umum, reaksi kondensasi aldol silang melibatkan adisi nukleofilik
suatu enol keton ke suatu aldehid sehingga produk yang dihasilkan akan
melepaskan sebuah molekul air dan membentuk karbonil α,β-tak jenuh.
Senyawa sikloheksana-1,3-dion merupakan senyawa karbonil golongan
keton yang memiliki hidrogen alfa (α), sedangkan senyawa 4
-hidroksibenzaldehida merupakan suatu aldehid aromatis dengan substituen gugus
hidroksi. Sikloheksana-1,3-dion yang mempunyai hidrogen alfa (α) tersebut dapat
membentuk enol keton yang berfungsi sebagai nukleofilik yang akan menyerang
atom C karbonil yang bersifat elektrofil pada senyawa 4-hidroksibenzaldehida
sehingga menghasilkan senyawa 2-(4ꞌ-hidroksibenzilidena)-sikloheksana-1,3-dion
dan melepaskan molekul air. Gambar 13. Reaksi umum sintesis 2-(4ꞌ-hidroksibenzilidena)-
Pada penelitian ini digunakan katalis HCl dimana H+ dari HCl ini
diharapkan akan memprotonasi atom oksigen pada sikloheksana-1,3-dion
sehingga dapat terbentuk enol yang kemudian akan bereaksi dengan
4-hidroksibenzaldehida membentuk senyawa target 2-(4ꞌ
-hidroksibenzilidena)-sikloheksana-1,3-dion.
G. Hipotesis
2-(4ꞌ-hidroksibenzilidena)-sikloheksana-1,3-dion dapat disintesis dari
sikloheksana-1,3-dion dan 4-hidroksibenzaldehida dengan katalis asam klorida
23 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Jenis dan rancangan penelitian ini termasuk dalam noneksperimental
deskriptif. Pada penelitian ini tidak ada perlakuan terhadap subjek uji dan hanya
pemaparan fenomena yang terjadi tanpa adanya suatu hubungan sebab akibat.
B. Definisi Operasional
1. Starting Material adalah bahan kimia (zat) yang digunakan untuk penelitian
yang berfungsi sebagai reaktan dalam suatu reaksi kimia. Starting material
yang digunakan dalam penelitian ini adalah sikloheksana-1,3-dion dan
4-hidroksibenzaldehida.
2. Katalis adalah suatu senyawa yang digunakan dalam reaksi kimia yang
berfungsi mempercepat suatu reaksi kimia dengan menurunkan energi
aktivasinya. Katalis yang digunakan dalam penelitian ini adalah asam klorida.
3. Molekul target adalah molekul yang menjadi target dan diharapkan terbentuk
dari suatu sintesis. Senyawa yang diharapkan terbentuk adalah senyawa 2-(4ꞌ
C. Bahan Penelitian
Sikloheksana-1,3-dion (p.a., Nacalai), 4-hidroksibenzaldehida (p.a.,
Aldrich), asam klorida 32% b/v (teknis), etanol (p.a., Merck), aquadest
(Laboratorium Kimia Organik Farmasi Universitas Sanata Dharma), etil asetat
(p.a., Merck), heksana (p.a., Merck), kloroform (p.a., Merck), eter (p.a., Merck).
D. Alat Penelitian
Neraca analitik (Denver Instrument), mortir dan stamper, seperangkat
alat gelas, kertas saring, cawan porselen, pengering (Memmert Oven Model 400),
dropple plate, mikropipet, plat KLT (plat silika GF254), lampu UV 254 nm,
Melting Point System (Mettler Tuledo MP70), kromatografi gas-spektrometer
massa (Shimadzu QP 2010S), spektrometer IR (IR Shimadzu Prestige-21).
E. Prosedur Penelitian
1. Sintesis 2-(4ꞌ-hidroksibenzilidena)-sikloheksana-1,3-dion
a. Pembuatan larutan HCl 3,2 %
Asam klorida 32% sebanyak 1 mL dilarutkan dalam etanol. Larutan
dimasukkan ke dalam labu ukur 10 mL, kemudian ditambahkan etanol
b. Sintesis 2-(4ꞌ-hidroksibenzilidena)-sikloheksana-1,3-dion
Etanol sebanyak 6 mL dimasukkan ke dalam motir, kemudian tambah
serbuk 4-hidroksibenzaldehida sebanyak 0,366 gram (3 mmol). Campuran
tersebut diaduk dengan stamper sampai homogen. Kemudian tambah katalis
HCl 3,2% sebanyak 6 mL secara tetes per tetes sambil diaduk-aduk dengan
stamper sampai homogen. Serbuk sikloheksana-1,3-dion sebanyak 0,336
gram (3 mmol) ditambahkan sedikit demi sedikit sambil diaduk hingga
homogen. Senyawa hasil sintesis dimasukkan ke dalam Bekker glass.
Larutan senyawa hasil sintesis didiamkan selama 2 malam agar proses
pembentukan kristal optimal. Padatan yang telah terbentuk disaring
menggunakan kertas saring. Serbuk senyawa hasil sintesis dikeringkan di
dalam oven pada suhu 600C selama 1 jam dan dihitung rendemennya.
2. Analisis Senyawa Hasil Sintesis
a. Pemeriksaan organoleptis
Senyawa hasil sintesis diamati dari sifat fisikanya yaitu bentuk, warna, dan
bau dan dibandingkan dengan starting material yang digunakan.
b. Pemeriksaan kelarutan
Senyawa hasil sintesis sebanyak 10 mg dimasukkan ke dalam tabung reaksi,
kemudian ditambahkan aquadest tetes demi tetes, amati kelarutannya.
Lakukan prosedur dengan cara yang sama menggunakan pelarut yang
berbeda yaitu etil asetat, etanol, kloroform, heksana, dan eter. Bandingkan
c. Pemeriksaan titik lebur
Kristal hasil sintesis (sedikit saja) dimasukkan ke dalam capillary tubes,
kemudian dimasukkan ke dalam Mettler Tuledo MP70 (alat pengukur titik
lebur). Amati peleburan kristalnya dengan membaca grafik titik lebur dan
catat suhunya sewaktu pertama kali melebur hingga seluruh kristalnya
melebur.
d. Kromatografi Lapis Tipis
Starting material dan senyawa hasil sintesis dilarutkan dengan etanol.
Masing-masing senyawa diambil 0,5 µL dengan menggunakan mikropipet,
kemudian ditotolkan pada plat KLT silika gel GF254 (packing) yang sudah
diaktifkan pada suhu 1050C selama 30 menit. Elusi dilakukan dengan
menggunakan fase gerak etil asetat : heksana (2:3), etil asetat : heksana (3:2)
dan etil asetat : heksana (1:4) dengan jarak rambat 15 cm.
e. Gas Chromatography
Pemeriksaan kemurnian senyawa hasil sintesis digunakan kromatografi gas
dengan kondisi alat: suhu injektor 1000C, jenis kolom Rastek Rxi--5MS,
panjang kolom 30 meter, suhu kolom diprogram 1000C, gas pembawa
helium, tekanan 22,0 kPa, kecepatan alir fase gerak 0,3 mL/menit, dan
detektor ionisasi nyala. Cuplikan senyawa hasil sintesis dilarutkan dalam
kloroform kemudian diinjeksikan ke dalam injektor kromatografi gas.
Aliran gas dari gas pengangkut helium akan membawa cuplikan yang sudah
dimethylpolysiloxane. Selanjutnya cuplikan diukur oleh detektor, hasil akhir
diperoleh kromatogram.
3. Elusidasi Struktur Senyawa Hasil Sintesis
a. Spektofotometri inframerah
Senyawa hasil sintesis sebanyak kurang lebih 0,5-1 mg dicampur dengan
KBr kurang lebih 10 mg secara homogen, dikempa dan dibuat tablet.
Cahaya inframerah dari sumber dilewatkan melalui cuplikan, kemudian
dipecah menjadi frekuensi-frekuensi individu dalam monokromator.
Intensitas relatif dari frekuensi individu diukur oleh detektor hingga
diperoleh spektra inframerah dari senyawa yang bersangkutan. Bilangan
gelombang yang digunakan yaitu 300-4000nm.
b. Spektrometri massa
Uap cuplikan senyawa hasil sintesis yang keluar dari kolom kromatografi
gas dialirkan ke dalam ruang pengion pada spektrometer massa untuk
ditembak dengan seberkas elektron hingga terfragmentasi. Jenis pengionan
yang digunakan yaitu EI (Electron Impact) sebesar 70 Ev.
Fragmen-fragmen akan melewati plat yang akan mempercepat ion sehingga ion dapat
terdorong masuk ke dalam tabung analisator. Di dalam tabung analisator,
partikel-partikel akan dibelokkan dalam medan magnet sehingga
menimbulkan arus pada kolektor yang sebanding kelimpahan relatif setiap
fragmennya. Kelimpahan relatif setiap fragmen akan dicatat dan
F. Analisis Hasil 1. Perhitungan Rendemen
Perhitungan rendemen dilakukan dengan menimbang senyawa hasil
sintesis, kemudian membandingkan berat senyawa hasil sintesis dengan berat
senyawa hasil sintesis secara teoritis lalu dikalikan 100%. Perhitungan rendemen
ini dilakukan setelah diperoleh kristal murni hasil sintesis.
2. Analisis Pendahuluan
Analisis pendahuluan senyawa hasil sintesis berdasarkan pada data
pemeriksaan organoleptis dan pemeriksaan kelarutan.
3. Pemeriksaan Kemurnian Senyawa Hasil Sintesis
Pemeriksaan kemurnian senyawa hasil sintesis berdasarkan pada data
kromatografi lapis tipis, pemeriksaan titik lebur, dan gas chromatography.
4. Elusidasi Struktur
Elusidasi struktur senyawa hasil sintesis berdasarkan data
29 BAB IV
HASIL DAN PEMBAHASAN
A. Sintesis 2-(4ꞌ-hidroksibenzilidena)-sikloheksana-1,3-dion
Sintesis 2-(4ꞌ-hidroksibenzilidena)-sikloheksana-1,3-dion dilakukan
dengan cara mereaksikan sikloheksana-1,3-dion dan 4-hidroksibenzaldehida
dengan katalis asam klorida berdasarkan reaksi kondensasi aldol silang. Sintesis
dilakukan dengan mereaksikan 4-hidroksibenzaldehida dengan katalis asam
klorida terlebih dahulu, kemudian ditambah dengan sikloheksana-1,3-dion.
Senyawa sikloheksana-1,3-dion merupakan suatu senyawa karbonil
golongan keton yang memiliki hidrogen alfa (α) yang dapat membentuk enol dan
senyawa 4-hidroksibenzaldehida merupakan senyawa aldehid aromatis dengan
substituen gugus hidroksi, dimana kedua senyawa tersebut dapat bereaksi melalui
reaksi kondensasi aldol silang membentuk senyawa 2-(4ꞌ
-hidroksibenzilidena)-sikloheksana-1,3-dion.
Adanya substituen gugus hidroksi pada cincin benzen dari senyawa 2-(4ꞌ
-hidroksibenzilidena)-sikloheksana-1,3-dion dapat menghambat pertumbuhan sel
kanker dengan cara menangkap radikal bebas di dalam tubuh. Mekanisme
penangkapan radikal bebas oleh gugus hidroksi dari senyawa 2-(4ꞌ
-hidroksibenzilidena)-sikloheksana-1,3-dion yaitu menangkap radikal bebas
hidroksi dengan cara melepaskan radikal hidrogen, dimana akan terjadi
molekul air, sedangkan radikal fenol sendiri akan terstabilkan oleh resonansi pada
cincin benzennya (Hart, 1987).
O H RO O ROH
Gambar 14. Mekanisme penangkapan radikal bebas
O O O O
Gambar 15. Resonansi radikal bebas fenol
Radikal fenol yang telah terstabilkan tetap dalam bentuk radikal bebas,
dimana radikal bebas tetap dapat memiliki risiko jika berada di dalam tubuh,
sehingga ada kemungkinan elektron yang tidak berpasangan dalam senyawa
radikal memiliki kecenderungan untuk mencari pasangan dengan cara menarik
atau menyerang elektron dari senyawa lain, hal ini mengakibatkan terbentuknya
senyawa radikal baru yang berbahaya. Untuk dapat membuat radikal fenol
menjadi tidak reaktif dengan cara ditambahkan halangan sterik pada cincin
benzena dan planar, sehingga radikal fenol ini dapat terperangkap.
O O O O
Pada senyawa sikloheksana-1,3-dion hidrogen alfa (α) yang lebih reaktif
adalah hidrogen alfa (α) yang berada di antara 2 gugus keton, karena adanya
induksi elektron oleh oksigen menyebabkan C karbonil kekurangan elektron,
sehingga H alfa (α) akan mudah lepas sehingga enol akan mudah terbentuk.
O
O
H H
H H
H H
Gambar 17. Gugus keton dan hidrogen alfa (α) pada senyawa sikloheksana-1,3-dion
Hidrogen alfa (α) yang bersifat asam pada senyawa
sikloheksana-1,3-dion dengan adanya katalis HCl akan membuat atom oksigen pada gugus karbonil
sikloheksana-1,3-dion terprotonasi dan membentuk C karbonil bermuatan positif,
maka H alfa (α) dapat terlepas untuk menghasilkan sebuah enol. Dengan
terbentuknya enol tersebut, nukleofilisitas C alfa (α) dari senyawa sikloheksana
-1,3-dion akan meningkat sehingga akan menyerang atom C karbonil pada
senyawa 4-hidroksibenzaldehida yang bermuatan positif. Penyerangan gugus
karbonil pada senyawa 4-hidroksibenzaldehida oleh enolsikloheksana-1,3-dion ini
akan menghasilkan suatu senyawa β-hidroksi-karbonil yang merupakan senyawa
antara dan kemudian mengalami pelepasan molekul air (dehidrasi) sehingga
terbentuk senyawa 2-(4ꞌ-hidroksibenzilidena)-sikloheksana-1,3-dion.
H α H α
Katalis yang digunakan dalam sintesis 2-(4ꞌ
-hidroksibenzilidena)-sikloheksana-1,3-dion adalah katalis asam klorida. Dalam suasana asam, oksigen
pada gugus karbonil pada sikloheksana-1,3-dion akan terprotonasi sehingga dapat
membentuk enol keton yang berfungsi sebagai nukleofilik. Dalam penelitian ini
tidak digunakan asam lain seperti H2SO4 karena untuk menghindari terjadinya
reaksi oksidasi dari 4-hidroksibenzaldehid.
Pada penelitian ini tidak digunakan katalis basa kuat seperti NaOH untuk
menghindari hidroksi fenolik pada senyawa 4-hidroksibenzaldehida yang bersifat
asam menjadi O- (ion fenoksida). Hidroksi fenolik bersifat lebih asam daripada H
alfa (α) pada senyawa sikloheksana-1,3-dion, sehingga katalis basa kuat (NaOH)
akan lebih bereaksi dengan hidroksi fenolik pada senyawa 4-hidroksibenzaldehida
membentuk ion fenoksida daripada bereaksi dengan H alfa (α) pada senyawa
sikloheksana-1,3-dion dalam pembentukan ion enolat. Hal ini mengakibatkan O
-(ion fenoksida) bersifat lebih nukleofil daripada ion enolat. Oleh karena itu, ion
fenoksida yang terbentuk akan bereaksi dengan C karbonil sikloheksana-1,3-dion
yang bersifat elektrofil. Maka pada penelitian ini digunakan katalis HCl dimana
H+ dari HCl ini diharapkan akan memprotonasi atom oksigen pada
siklo-heksana-1,3-dion sehingga dapat terbentuk enol yang kemudian akan bereaksi dengan
4-hidroksibenzaldehida membentuk senyawa target 2-(4ꞌ
O
Gambar 18. Mekanisme reaksi sintesis senyawa 2-(4ꞌ-hidroksibenzilidena- sikloheksana-1,3-dion
Dalam pelaksanaan sintesis dilakukan dengan melarutkan
4-hidroksibenzaldehid terlebih dahulu dengan etanol di dalam mortir dan stamper,
aduk dan gerus agar homogen, kemudian ditambahkan katalis HCl secara tetes
bentuk serbuk ditambahkan sedikit demi sedikit sambil tetap diaduk. Tujuan
urutan pencampuran tersebut adalah untuk mencegah terjadinya self condensation
senyawa sikloheksana-1,3-dion yang mendorong terbentuknya produk samping
yang tidak diharapkan.
Setelah itu, campuran hasil sintesis didiamkan selama 2 malam, agar
proses pembentukan kristal optimal. Selama pendiaman 2 malam, terbentuk
kristal berwarna kuning muda. Selanjutnya kristal yang telah diperoleh disaring,
dikeringkan, ditimbang.
B. Analisis Pendahuluan 1. Pemeriksaan organoleptis
Hasil pemeriksaan organoleptis meliputi bentuk, warna dan bau senyawa
hasil sintesis dibandingkan dengan starting material, yaitu sikloheksana-1,3-dion
dan 4-hidroksibenzaldehid ditunjukkan pada tabel II.
Tabel II. Data organoleptis senyawa hasil sintesis dan dengan starting material
Pemeriksaan Senyawa hasil sintesis
Sikloheksana-1,3-dion 4-hidroksibenzaldehid
Bentuk
Warna Kuning muda Putih Putih
Bau Tidak berbau Berbau khas Berbau khas
Dari hasil pemeriksaan organoleptis di atas, dapat disimpulkan bahwa
senyawa hasil sintesis sudah memiliki profil organoleptis yang berbeda dengan
starting materialnya.
Pada penelitian dengan menggunakan katalis kalium hidroksida diperoleh
hasil uji organoleptis senyawa 2-(4ꞌ-hidroksi-benzilidena)-sikloheksana-1,3-dion
memiliki bentuk berupa serbuk, warna kuning kecoklatan dan berbau khas
(menyengat) (Setiawati, 2012).
2. Pemeriksaan kelarutan
Tujuan dilakukannya pemeriksaan kelarutan senyawa hasil sintesis
adalah untuk mengetahui kelarutan senyawa hasil sintesis dalam pelarut polar dan
nonpolar dan juga berfungsi sebagai acuan dalam pemilihan pelarut dalam
pemeriksaan dengan metode Kromatografi Lapis Tipis dan dengan instrument
Gas Chromatography-Mass Spectroscopy (GC-MS).
Hasil pemeriksaan kelarutan senyawa hasil sintesis dan starting material
ditunjukkan pada tabel III.
Tabel III. Data kelarutan senyawa hasil sintesis dan starting material Pelarut Senyawa hasil
sintesis
Sikloheksana-1,3-dion 4-hidroksibenzaldehid
Aquadest Praktis tidak larut
Larut Agak larut
Etil asetat Agak larut Larut Larut Etanol Agak larut Larut Larut Kloroform Mudah larut Larut Larut Heksana Agak larut Tidak larut Tidak larut Eter Tidak larut Agak larut Larut
Dari hasil pemeriksaan kelarutan tersebut, dapat disimpulkan bahwa
hasil tersebut, terlihat bahwa senyawa hasil sintesis lebih mudah larut dalam
pelarut yang bersifat nonpolar seperti kloroform, karena senyawa hasil sintesis
memiliki banyak atom karbon, dimana semakin banyak atom karbon pada suatu
senyawa maka senyawa tersebut akan semakin bersifat nonpolar.
Pada penelitian dengan menggunakan katalis kalium hidroksida diperoleh
hasil uji kelarutan senyawa 2-(4ꞌ-hidroksi-benzilidena)-sikloheksana-1,3-dion
yaitu praktis tidak larut dalam pelarut aquadest dan heksana, sangat sukar larut
dalam pelarut kloroform, mudah larut dalam pelarut metanol, etanol dan etil asetat
(Setiawati, 2012).
3. Pemeriksaan senyawa hasil sintesis dengan kromatografi lapis tipis (KLT)
Uji dengan kromatografi lapis tipis (KLT) bertujuan untuk mengetahui
apakah senyawa hasil sintesis telah terbentuk atau belum. Senyawa hasil sintesis
ditotolkan pada plat KLT silika gel GF254 dan dielusi bersama starting material
(sebagai pembanding) yaitu sikloheksana-1,3-dion dan 4-hidroksibenzaldehida
dengan menggunakan fase gerak etil asetat : heksana (2:3), etil asetat : heksana
(3:2), dan etil asetat : heksana (1:4). Parameter yang digunakan dalam pengujian
dengan menggunakan KLT adalah nilai Rf untuk masing-masing senyawa pada
pelarut yang sama dan bercak yang dihasilkan dari elusi sistem KLT. Jika hasil
elusi menunjukkan adanya perbedaan nilai Rf antara senyawa hasil sintesis dengan
starting materialnya, maka dapat dikatakan senyawa hasil sintesis telah terbentuk.
Pada penelitian dengan menggunakan katalis kalium hidroksida dengan
senyawa 2-(4ꞌ-hidroksi-benzilidena)-sikloheksana-1,3-dion. Replikasi I diperoleh
nilai Rf sebesar 0,033; 0,073; 0,113; 0,153. Replikasi II diperoleh nilai Rf sebesar
0,027; 0,067; 0,113; 0,153. Replikasi III diperoleh nilai Rf sebesar 0,027; 0,067;
0,113; 0,153 (Setiawati, 2012).
Dari penelitian diperoleh data sebagai berikut:
Gambar 19. Kromatogram senyawa hasil sintesis pada fase gerak etil asetat : heksana (2:3)
Keterangan:
Fase diam : silika gel GF254 Jarak elusi : 15 cm
Fase gerak : etil asetat : heksana (2:3) Deteksi UV 254 nm
Tabel IV. Nilai Rf kromatogram senyawa hasil sintesis
Bercak Senyawa Rf
A Sikloheksana-1,3-dion 0,19 B 4-hidroksibenzaldehid 0,37 C Replikasi I hasil sintesis (2-(4ꞌ
-hidroksibenzilidena)-sikloheksana-1,3-dion)
0,09
D Replikasi II hasil sintesis (2-(4ꞌ -hidroksibenzilidena)-sikloheksana-1,3-dion)
0,09
E Replikasi III hasil sintesis (2-(4ꞌ -hidroksibenzilidena)-sikloheksana-1,3-dion)
Gambar 20. Kromatogram senyawa hasil sintesis pada fase gerak etil asetat : heksana (3:2)
Keterangan:
Fase diam : silika gel GF254 Jarak elusi : 15 cm
Fase gerak : etil asetat : heksana (3:2) Deteksi UV 254 nm
Tabel V. Nilai Rf kromatogram senyawa hasil sintesis
Bercak Senyawa Rf
A Sikloheksana-1,3-dion 0,08 B 4-hidroksibenzaldehid 0,17 C Replikasi I hasil sintesis (2-(4ꞌ
-hidroksibenzilidena)-sikloheksana-1,3-dion)
0,02
D Replikasi II hasil sintesis (2-(4ꞌ -hidroksibenzilidena)-sikloheksana-1,3-dion)
0,02
E Replikasi III hasil sintesis (2-(4ꞌ -hidroksibenzilidena)-sikloheksana-1,3-dion)
Gambar 21. Kromatogram senyawa hasil sintesis pada fase gerak etil asetat : heksana (1:4)
Keterangan:
Fase diam : silika gel GF254 Jarak elusi : 15 cm
Fase gerak : etil asetat : heksana (3:2) Deteksi UV 254 nm
Tabel VI. Nilai Rf kromatogram senyawa hasil sintesis
Bercak Senyawa Rf
A Sikloheksana-1,3-dion 0,12 B 4-hidroksibenzaldehid 0,53 C Replikasi I hasil sintesis (2-(4ꞌ
-hidroksibenzilidena)-sikloheksana-1,3-dion)
0,24
D Replikasi II hasil sintesis (2-(4ꞌ -hidroksibenzilidena)-sikloheksana-1,3-dion)
0,24
E Replikasi III hasil sintesis (2-(4ꞌ -hidroksibenzilidena)-sikloheksana-1,3-dion)
0,25
Berdasarkan kromatogram-kromatogram tersebut dapat dilihat bahwa
masing-masing totolan senyawa menghasilkan bercak tunggal setelah dielusi
dengan sistem KLT. Pada cahaya visual, bercak senyawa hasil sintesis dan
starting material tidak tampak, tetapi setelah diamati di bawah sinar UV 254 nm,
hasil elusi menunjukkan adanya perbedaan nilai Rf antara senyawa hasil sintesis
dengan starting materialnya, maka dapat disimpulkan bahwa senyawa hasil
sintesis berbeda dengan starting materialnya, untuk memperkuat kesimpulan ini
maka perlu dibuktikan lebih lanjut dengan uji selanjutnya.
4. Uji jarak lebur senyawa hasil sintesis
Pengujian jarak lebur dilakukan terhadap senyawa hasil sintesis. Hasil
pengujian jarak lebur diperoleh jarak lebur senyawa hasil sintesis dan starting
material ditunjukkan pada tabel VII.
Tabel VII. Data jarak lebur senyawa hasil sintesis dan starting material
Senyawa Jarak Lebur
Sikloheksana-1,3-dion 1050C 4-hidroksibenzaldehid 1160C Replikasi I hasil sintesis 301,1-301,40C Replikasi II hasil sintesis 299,3-299,60C Replikasi III hasil sintesis 300,2-300,40C
Dari hasil uji jarak lebur tersebut menunjukkan bahwa senyawa hasil
sintesis merupakan senyawa murni, karena jarak lebur kurang dari 20C. Pengujian
jarak lebur ini dapat digunakan untuk menarik kesimpulan sementara bahwa
senyawa hasil sintesis sudah bukan merupakan starting materialnya yaitu
sikloheksana-1,3-dion dan 4-hidroksibenzaldehid. Hal ini terlihat dari jarak lebur
sikloheksana-1,3-dion yaitu 1050C dan 4-hidroksibenzaldehid yaitu 1160C. Jarak
lebur senyawa hasil sintesis lebih besar dari starting materialnya karena adanya
penambahan ukuran molekul senyawa hasil sintesis menjadi lebih besar
Pada penelitian dengan menggunakan katalis kalium hidroksida diperoleh
jarak lebur senyawa 2-(4ꞌ-hidroksi-benzilidena)-sikloheksana-1,3-dion sebesar
158–170˚C. Jarak lebur sebesar 12˚C menunjukkan bahwa senyawa tersebut
belum murni (Setiawati, 2012).
C. Elusidasi Struktur Senyawa Hasil Sintesis
1. Pengujian Senyawa Hasil Sintesis dengan Spektrofotometri Infra Merah
Spektrofotometri inframerah digunakan untuk mengetahui gugus-gugus
fungsional yang terdapat dalam senyawa. Spektra IR senyawa hasil sintesis
ditunjukkan pada gambar dibawah ini (Gambar 22).
Gambar 22. Spektra Infra merah senyawa hasil sintesis (Pelet KBr)
Spektra IR yang diperoleh pada gambar diatas menunjukkan adanya pita
representatif yang menunjukkan gugus-gugus fungsi yang terdapat pada struktur
senyawa hasil sintesis. Gugus aromatik yang terdapat pada senyawa hasil sintesis
ditunjukkan dengan adanya serapan dari ikatan C-C pada bilangan gelombang
3024,38 cm-1. Gugus aromatik yang tersubstitusi para ditunjukkan dengan adanya
serapan pada bilangan gelombang 833,25 cm-1. Gugus karbonil yang terdapat
pada senyawa hasil sintesis ditunjukkan dengan adanya serapan dari ikatan C═O
yang terkonjugasi dengan alkena atau gugus fenil pada bilangan gelombang
1651,07 cm-1 (serapan bertumpuk dengan serapan dari ikatan alkena). Gugus
sikloheksana ditunjukkan pada bilangan gelombang 1450,47 cm-1. Gugus OH
(alkohol atau fenol) pada senyawa hasil sintesis yang ditunjukkan dengan adanya
serapan pada bilangan gelombang 3379,29 cm-1. Interpretasi yang terakhir yaitu
adanya ikatan C═C alkena pada bilangan gelombang 1651,07 cm-1 (Sitorus, 2009).
Tabel VIII. Interpretasi spektra inframerah senyawa hasil sintesis Gugus fungsional Bilangan gelombang
(cm-1)
Intensitas
Ikatan C-C aromatik 1512,19 Kuat, tajam Ikatan C-H aromatik 3024,38 Medium, tajam Gugus aromatik tersubstitusi para 833,25 Kuat, tajam Gugus karbonil(C═O) 1651,07 Kuat, tajam Gugus sikloheksana 1450,47 Kuat, tajam Gugus OH (alkohol atau fenol) 3379,29 Kuat dan melebar
Ikatan C═C (alkena) 1651,07 Kuat, tajam
Berikut adalah gambar spektra IR starting material dan tabel interpretasi
yang dapat menunjukkan adanya perbedaan antara senyawa hasil sintesis dengan
starting material.
Pada penelitian dengan menggunakan katalis kalium hidroksida diperoleh
senyawa 2-(4ꞌ-hidroksi-benzilidena)-sikloheksana-1,3-dion memiliki spektra IR
yaitu gugus karbonil (C=O) dengan intensitas medium, tajam pada bilangan
gelombang 1611,17 cm-1, ikatan alkena (C=C) dengan intensitas medium pada
intensitas medium pada bilangan gelombang 2950,50 cm-1, gugus OH (fenol)
dengan intensitas kuat, melebar pada bilangan gelombang 3424,16 cm-1, dan
ikatan pada alkohol (C–O) dengan intensitas medium, tajam pada bilangan
gelombang 1173,90 cm-1 (Setiawati, 2012).
Gambar 23. Spektra Infra merah senyawa sikloheksana-1,3-dion (Kinugasa, Tanabe, Tamura, 2009a)
Pada spektra IR sikloheksana-1,3-dion terlihat adanya gugus
sikloheksana pada bilangan gelombang 1460 cm-1.