SINTESIS SENYAWA 2-(4'-HIDROKSIBENZILIDENA)
SIKLOHEKSANA-1,3-DION DARI SIKLOHEKSANA-1,3-DION DAN 4-HIDROKSIBENZALDEHID DENGAN KATALIS KALIUM
HIDROKSIDA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm)
Program Studi Farmasi
Diajukan oleh: Melly Indah Setiawati
NIM : 08 8114 092
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
SIKLOHEKSANA-1,3-DION DARI SIKLOHEKSANA-1,3-DION DAN 4-HIDROKSIBENZALDEHID DENGAN KATALIS KALIUM
HIDROKSIDA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm)
Program Studi Farmasi
Diajukan oleh: Melly Indah Setiawati
NIM : 08 8114 092
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
Persetujuan Pembimbing
SINTESIS SENYAWA 2-(4'-HIDROKSIBENZILIDENA)
SIKLOHEKSANA-1,3-DION DARI SIKLOHEKSANA-1,3-DION DAN 4-HIDROKSIBENZALDEHID DENGAN KATALIS KALIUM
HIDROKSIDA
Skripsi yang diajukan oleh: Melly Indah Setiawati
NIM : 088114092
telah disetujui oleh
Pembimbing
iii
Pengesahan Skripsi Berjudul
SINTESIS SENYAWA 2-(4'-HIDROKSIBENZILIDENA)
SIKLOHEKSANA-1,3-DION DARI SIKLOHEKSANA-1,3-DION DAN
4-HIDROKSIBENZALDEHID DENGAN KATALIS KALIUM
HIDROKSIDA
Oleh:
Melly Indah Setiawati
NIM : 088114092
Dipertahankan di hadapan Panitia Penguji Skripsi
Fakultas Farmasi
Universitas Sanata Dharma
Pada Tanggal : 26 Januari 2012
Panitia penguji :
1. Jeffry Julianus, S. Farm, M. Si.
2. Dra. M. M. Yetty Tjandrawati, M. Si.
iv
HALAMAN PERSEMBAHAN
Kerjakan bagian kita dengan setia dan lihatlah,
Tuhan akan mengerjakan bagian-Nya dengan
sempurna
Karya ini kupersembahkan kepada :
Mama & Papa
tercinta yang selalu mendoakan dan mendukung aku;
Fang
2, adikku tersayang dengan segala kecerewetannya;
segenap keluarga besar Tjioe & Liem;
Teman
2dan almamaterku
iv
HALAMAN PERSEMBAHAN
Kerjakan bagian kita dengan setia dan lihatlah,
Tuhan akan mengerjakan bagian-Nya dengan
sempurna
Karya ini kupersembahkan kepada :
Mama & Papa
tercinta yang selalu mendoakan dan mendukung aku;
Fang
2, adikku tersayang dengan segala kecerewetannya;
segenap keluarga besar Tjioe & Liem;
Teman
2dan almamaterku
iv
HALAMAN PERSEMBAHAN
Kerjakan bagian kita dengan setia dan lihatlah,
Tuhan akan mengerjakan bagian-Nya dengan
sempurna
Karya ini kupersembahkan kepada :
Mama & Papa
tercinta yang selalu mendoakan dan mendukung aku;
Fang
2, adikku tersayang dengan segala kecerewetannya;
segenap keluarga besar Tjioe & Liem;
v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma:
Nama : Melly Indah Setiawati
Nomor mahasiswa : 08 8114 092
Demi perkembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan
Universitas Sanata Dharma karya ilmiah saya yang berjudul:
SINTESIS SENYAWA 2-(4'-HIDROKSIBENZILIDENA)
SIKLOHEKSANA-1,3-DION DARI SIKLOHEKSANA-1,3-DION DAN
4-HIDROKSIBENZALDEHID DENGAN KATALIS KALIUM
HIDROKSIDA
Beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan
kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan,
mengalihkan dalam bentuk media lain, mengelolanya dalam bentuk pangkalan
data, mendistribusikan secara terbatas, dan mempublikasikannya di internet atau
media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya
ataupun memberi royalti kepada saya selama tetap mencantumkan nama saya
sebagai penulis.
Demikian pernyataan ini yang saya buat dengan sebenarnya.
Dibuat di Yogyakarta
Pada tanggal: 19 Januari 2012
Yang menyatakan
vi
PRAKATA
Puji syukur kepada Tuhan Yang Maha Esa atas limpahan kasih dan
rahmat-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul
“SINTESIS SENYAWA 2-(4'-HIDROKSIBENZILIDENA)
SIKLOHEKSANA-1,3-DION DARI SIKLOHEKSANA-1,3-DION DAN
4-HIDROKSIBENZALDEHID DENGAN KATALIS KALIUM
HIDROKSIDA”. Skripsi ini disusun dalam rangka memenuhi salah satu syarat
untuk memperoleh gelar Sarjana Farmasi (S. Farm) di Fakultas Farmasi
Universitas Sanata Dharma Yogyakarta.
Selama proses penelitian dan penyusunan skripsi ini, penulis
mendapatkan bantuan dari berbagai pihak. Oleh karena itu, penulis mengucapkan
terima kasih kepada:
1. Ipang Djunarko, M. Sc., Apt., selaku Dekan Fakultas Farmasi Universitas
Sanata Dharma.
2. Jeffry Julianus, M. Si., selaku dosen pembimbing atas kesediaannya dalam
memberikan arahan, dukungan, dan saran dalam penelitian serta penyusunan
skripsi ini.
3. Dra. M. M. Yetty Tjandrawati, M. Si., selaku dosen penguji atas masukan
kritik dan saran selama proses penelitian.
4. Prof. Dr. Sri Noegrohati, Apt., selaku dosen penguji atas masukan kritik dan
vii
yang diberikan kepada penulis dalam penggunaan laboratorium.
6. Bu Christine dan Bu Phebe, atas masukan kritik dan saran dalam penyusunan
proposal.
7. Mas Parlan, Mas Kunto, Mas Bimo, Mas Wagiran, dan segenap laboran
Fakultas Farmasi yang telah membantu selama proses pengerjaan penelitian
di laboratorium.
8. Staf Laboratorium Instrumentasi Terpadu Fakultas Farmasi Universitas Islam
Indonesia Yogyakarta.
9. Ko Fandri, Mbak Anin, Ko Ardi, atas bantuan dan dukungan selama proses
penelitian dan penyusunan skripsi ini.
10. Cynthia, atas kerjasamanya selama proses pengerjaan di laboratorium.
11. Kenny, atas doa, dukungan semangat, perjuangan dan kerjasama, serta
persahabatan selama ini.
12. Bapak dan Ibu Gatot, atas doa dan semangat yang diberikan kepada penulis.
13. Thok2, atas perjuangan dan kerjasamanya dalam berbagai kesempatan.
14. Arum, Edward, Filbert, dan Pandu, atas doa dan semangat yang diberikan
serta kesediaanya menjadi tempat bercerita.
15. Teman-teman FST 2008, atas kebersamaannya selama kuliah dan praktikum.
16. Semua pihak yang tidak dapat penulis sebutkan satu per satu, yang telah
viii
Akhir kata, penulis menyadari bahwa masih banyak kekurangan dalam
penyusunan skripsi ini mengingat keterbatasan dan kemampuan penulis. Oleh
karena itu, penulis mengharapkan kritik dan saran yang membangunn dari semua
pihak. Semoga skripsi inii dapat memberikan manfaat bagi pembaca dan
mendukung perkembangan ilmu pengetahuan.
ix
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini
tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan
dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Apabila dikemudian hari ditemukan indikasi plagiarism dalam naskah
ini, maka saya bersedia menanggung segala sanksi sesuai peraturan
perundang-undangan yang berlaku.
Yogyakarta, 11 Januari 2012
Penulis,
x
DAFTAR ISI
Halaman
HALAMAN JUDUL... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN... iii
HALAMAN PERSEMBAHAN ... iv
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS ...v
PRAKATA... vi
PERNYATAAN KEASLIAN KARYA ... ix
DAFTAR ISI...x
DAFTAR TABEL...xv
DAFTAR GAMBAR ... xvi
DAFTAR LAMPIRAN ... xvii
INTISARI... xviii
ABSTRACT... xix
BAB I PENDAHULUAN ...1
A. Latar Belakang ...1
1. Permasalahan...6
2. Keaslian Penelitian...6
3. Manfaat Penelitian ...6
xi
A. Senyawa Enon dan Dienon Aromatis ...8
B. Sintesis Senyawa 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion...9
C. Analisis Pendahuluan...12
1. Pemeriksaan Organoleptis...12
2. Pemeriksaan Kelarutan...12
D. Rekristalisasi ...14
E. Pemeriksaan Kemurnian Senyawa Hasil Sintesis...15
1. Pemeriksaan Titik Lebur ...15
2. Kromatografi Lapis Tipis (KLT) ...15
3. Gas Chromatography-Mass Spectroscopy (GC-MS)...17
F. Elusidasi Struktur...18
1. Spektrofotometri Inframerah (IR) ...18
2. Spektroskopi massa...19
G. Landasan Teori...20
H. Hipotesis ...21
BAB III METODE PENELITIAN...22
A. Jenis dan Rancangan Penelitian ...22
B. Definisi Operasional ...22
C. Bahan Penelitian ...23
xii
E. Tata Cara Penelitian ...24
1. Sintesis 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion ...24
2. Kristalisasi...24
3. Analisis Senyawa Hasil Sintesis ...25
4. Elusidasi Struktur Senyawa Hasil Sintesis...26
F. Analisis Hasil ...27
1. Perhitungan Rendemen ...27
2. Analisis Pendahuluan ...27
3. Pemeriksaan Kemurnian Senyawa Hasil Sintesis ...28
4. Elusidasi Struktur ...28
BAB IV HASIL DAN PEMBAHASAN ...29
A. Sintesis Senyawa 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion...29
B. Analisis Pendahuluan...34
1. Pemeriksaan Organoleptis...34
2. Pemeriksaan Kelarutan...35
3. Pemeriksaan Titik Lebur ...37
4. Pemeriksaan Kemurnian dengan Kromatografi Lapis Tipis (KLT) ...38
5. Kromatografi Gas...40
C. Elusidasi Struktur Senyawa Hasil Sintesis ...41
1. Pengujian Senyawa Hasil Sintesis dengan Spektroskopi Massa...41
xiii
A. Kesimpulan ...52
B. Saran ...52
DAFTAR PUSTAKA ...53
LAMPIRAN ...55
xiv
DAFTAR TABEL
Halaman
Tabel I. Parameter Kelarutan Menurut Farmakope Indonesia IV ...13
Tabel II. Hasil Pemeriksaan Organoleptis Senyawa Hasil Sintesis dan Starting Material-nya...35
Tabel III. Hasil Pemeriksaan Kelarutan Senyawa Hasil Sintesis dan Starting Material-nya...36
Tabel IV. Titik Lebur Senyawa Hasil Sintesis dan Starting Material-nya ...37
Tabel V. Nilai Rf Senyawa Hasil Sintesis dan Starting Material...39
Tabel VI. Interpretasi Spektra Inframerah dari Senyawa Hasil Sintesis ...47
xv
Halaman
Gambar 1. Struktur Senyawa 2-Benzilidensikloheksana-1,3-dion...2
Gambar 2. Struktur Senyawa
2-(4'-Hidroksibenzilidena)Sikloheksana-1,3-dion ...3
Gambar 3. Interaksi Senyawa
2-(4'-Hidroksibenzilidena)Sikloheksana-1,3-dion dengan Protein MetAP Terjadi Pada Asam Amino
Histidin 331 dan 382...4
Gambar 4. Reaksi Umum Sintesis Senyawa 2-(4'-Hidroksibenzilidena)
Sikloheksana-1,3-dion dengan katalis KOH...20
Gambar 5. Struktur Sikloheksana-1,3-dion yang Memiliki Dua Gugus
Keton dan Enam Hidrogen Alpha...29
Gambar 6. Mekanisme Reaksi Sintesis Senyawa 2-(4'-Hidroksibenzilidena)
Sikloheksana-1,3-dion ...32
Gambar 7. Pembentukan Garam dari Senyawa Hasil Sintesis ...34
Gambar 8. Kromatogram KLT dengan Fase Gerak n-Heksan : Etil Asetat (3:2)
dimana A (Sikloheksana-1,3-dion), B (4-hidroksibenzaldehid),
C (Senyawa Hasil Sintesis)...38
Gambar 9. Kromatogram Pemeriksaan KLT Hasil Replikasi Senyawa
Hasil Sintesis...40
Gambar 10. Kromatogram GC dari Senyawa Hasil Sintesis ...40
Gambar 11. Spektra Massa Senyawa Hasil Sintesis Pada Peak Nomor 12
xvi
Gambar 12. Usulan Mekanisme Fragmentasi Pada Senyawa
2-(4'-Hidroksibenzilidena)Sikloheksana-1,3-dion...43
Gambar 13. Spektra Massa Senyawa Hasil Sintesis Pada Peak Nomor 25 dengan Waktu Retensi 16,296 Menit...44
Gambar 14. Struktur Molekul Target yang Belum Mengalami Dehidrasi ...45
Gambar 15. Usulan Mekanisme Fragmentasi Pada Senyawa Target yang Belum Mengalami Dehidrasi (Senyawa Antara) ...45
Gambar 16. Spektra Inframerah dari Senyawa Hasil Sintesis dengan KBr Pelet...46
Gambar 17. Gugus Karbonil Pada Senyawa Hasil Sintesis Dapat Mengalami Resonansi dengan Ikatan Rangkap Pada Alkena ...47
Gambar 18. Spektra Inframerah Senyawa Sikloheksana-1,3-dion dengan KBr Pelet...48
Gambar 19. Perbedaan Gugus Karbonil Pada 4-Hidroksibenzaldehid (A) dan Senyawa Hasil Sintesis (B) ...49
Gambar 20. Resonansi Pada Senyawa 4-Hidroksibenzaldehid ...50
Gambar 21. Spektra Inframerah Senyawa 4-Hidroksibenzaldehid dengan KBr Pelet...50
Gambar 22. Rangkaian Alat Refluks Selama 5 Jam...57
Gambar 23. Pengontrolan Suhu Selama Proses Refluks (90-95˚C) ...57
xvii
Halaman
Lampiran 1. Data Penimbangan Bahan dan Perhitungan Berat Senyawa
Hasil Sintesis secara Teoritis ...55
Lampiran 2. Data Penimbangan Crude Product dan Perkiraan Rendemen ...56
Lampiran 3. Dokumentasi Proses Sintesis ...57
Lampiran 4. Perhitungan Kepolaran Fase Gerak...58
Lampiran 5. Perhitungan Nilai Rf Senyawan Hasil Sintesis ...59
Lampiran 6. Perhitungan Nilai Rf Hasil Replikasi...60
Lampiran 7. Kondisi Alat Kromatografi Gas–Spektrometer Massa ...61
Lampiran 8. Kromatogram GC Senyawa Hasil Sintesis ...62
Lampiran 9. Spektra Massa Senyawa Target ...63
Lampiran 10. Spektra Massa Senyawa Antara (Senyawa Target yang Belum Terdehidrasi)...64
Lampiran 11. Spektra Infrared Senyawa Hasil Sintesis dengan KBr Pelet ...65
Lampiran 12. Spektra Inframerah Sikloheksana-1,3-dion dengan KBr Pelet ...66
xviii
INTISARI
Senyawa turunan kurkumin dalam bentuk enon dan dienon aromatis memiliki aktivitas sebagai inhibitor angiogenesis. Salah satunya adalah senyawa 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion yang berdasarkan pengujian secara komputasi memiliki interaksi yang lebih baik terhadap protein MetAP2. Oleh karena itu, senyawa 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion layak disintesis.
Sintesis 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion dilakukan dengan mereaksikan sikloheksana-1,3-dion sebanyak 3 mmol dan 4-hidroksibenzaldehid sebanyak 3 mmol dengan katalis kalium hidroksida berdasarkan reaksi kondensasi aldol silang. Senyawa hasil sintesis dianalisis dengan uji organoleptis, kelarutan, titik lebur, KLT dengan fase diam silika gel GF254 dan fase gerak n-heksan : etil asetat (3:2), kromatografi gas, serta elusidasi
struktur dengan spektrofotometri inframerah dan spektroskopi massa.
Senyawa hasil sintesis berupa serbuk kuning berbau khas dengan rendemen sebesar 1,374%; 1,428%; dan 1,545%, mudah larut dalam metanol, etanol, dan etil asetat; sangat sukar larut dalam kloroform; praktis tidak larut dalam air dan n-heksan. Hasil uji KLT menunjukkan adanya senyawa baru dengan Rf 0,030; 0,073; 0,113; dan 0,153. Uji kemurnian dengan kromatografi gas
menunjukkan kemurnian senyawa hasil sintesis sebesar 5,66% dengan titik lebur 158–170˚C. Hasil elusidasi struktur dengan spektroskopi massa dan inframerah menujukkan bahwa senyawa hasil sintesis adalah 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion.
Kata kunci : 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion, inhibitor
xix
The curcumin derivates in the form of enone and dienone aromatic have an activity as angiogenesis inhibitor. One of them is 2-(4'-hydroxybenzilidene) cyclohexane-1,3-dione. Based on the computational test, it has better interaction with MetAP2 protein. That’s why 2-(4'-hydroxybenzilidene)cyclohexane-1,3-dione is proper to be synthesized.
The synthesis of 2-(4'-hydroxybenzilidene)cyclohexane-1,3-dione are carried out by reacting 3 mmol of cyclohexane-1,3-dione and 3 mmol of 4-hydroxybenzaldehyde with potassium hydroxide as catalyst based on cross-aldole condensation. The product result was analyzed by organoleptic, solubility, melting point, TLC with silica gel GF254 as stationary phase and n-hexane : ethyl acetate (3:2) as mobile phase, and also structure elucidation with infrared spectroscopy and mass spectroscopy tests.
The product resulting from the reaction was yellow powder with specific smell. Its yield value were 1.374%; 1.428%; and 1.545%. It’s easily soluble in methanol, ethanol, and ethyl acetate; very difficult soluble in chloroform; practically insoluble in water and n-hexane. The TLC result showed the new products at Rf 0.030; 0.073; 0.113; and 0.153. The purity test by gas chromatography showed 5.66% purity. The melting point was 158–170˚C. The structure elucidation by infrared spectroscopy and mass spectroscopy showed that the compound synthesized is 2-(4'-hydroxybenzilidene)cyclohexane-1,3-dione.
1 BAB I PENGANTAR
A. Latar Belakang
Angiogenesismerupakan proses pembentukan pembuluh darah baru pada jaringan yang sedang tumbuh. Pada kondisi normal, proses ini sangat penting
peranannya untuk memproduksi sel, membantu pengembangan dan penyembuhan
luka. Namun, angiogenesis juga berperan penting dalam pertumbuhan dan metatesis suatu tumor. Pada tumor, terjadi pembentukan pembuluh darah baru
yang tidak terkontrol akibat adanya penyediaan darah pada jaringan yang sedang
tumbuh tersebut. Oleh sebab itu, prosesangiogenesisdalam tubuh perlu dihambat. Angiogenesis dipengaruhi oleh ekspresi berlebih dari Vascular Endothelial Growth Factor (VEGF) dan protein Methionine Aminopeptidase 2 (MetAP2). VEGF merupakan protein yang diproduksi oleh sel-sel tubuh untuk
merangsang pembentukan pembuluh darah baru sedangkan MetAP2 merupakan
suatu protein golonganMethionyl Aminopeptidaseyang mengikat dua atom kobalt atau mangan. Faktor lain yang dapat memicu pertumbuhan tumor adalah
terjadinya kerusakan sel akibat radikal bebas dalam tubuh sehingga proliferasi sel
menjadi tidak normal (Anonim, 2004). Senyawa inhibitorangiogenesisyang akan dikembangkan, idealnya dapat berperan sebagai antiangiogenesis dan juga menangkap radikal bebas.
Menurut penelitian yang telah dilakukan, diketahui bahwa proses
aromatik dan dienon aromatik. Senyawa yang diduga memiliki aktivitas sebagai
inhibitor angiogenesis adalah senyawa 2-benzilidensikloheksana-1,3-dion (Istyastono, Yuniarti, dan Jumina, 2009) dan senyawa
2-(4'-klorobenzilidena)sikloheksana-1,3-dion (Christy, 2010). Pada dasarnya senyawa
2-benzilidensikloheksana-1,3-dion dan
2-(4'-klorobenzilidena)sikloheksana-1,3-dion dapat berfungsi sebagai inhibitor angiogenesiskarena memiliki atom C-beta (β) yang bermuatan positif akibat pengaruh dari adanya gugusan karbonil (C=O).
Kedua senyawa yang telah disintesis sebelumnya hanya bekerja dengan
menekan ekspresi dari VEGF melalui struktur α,β-unsaturated carbonil, belum dapat menghambat pertumbuhan tumor yang disebabkan oleh adanya aktivitas
radikal dalam tubuh. Dengan dimodifikasi menjadi senyawa
2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion diharapkan dapat meningkatkan
fungsinya sebagai inhibitor angiogenesis. Adanya penambahan gugus hidroksil pada posisi para akan dapat menangkap radikal bebas sehingga mencegah kerusakan sel. Gugusan hidroksil tersebut juga diharapkan dapat meningkatkan
interaksi polar senyawa 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion dengan
reseptorMethionine Aminopeptidase 2karena semakin banyak interaksi yang bisa dibentuk dengan reseptor, maka senyawa tersebut akan memiliki aktivitas yang
lebih baik.
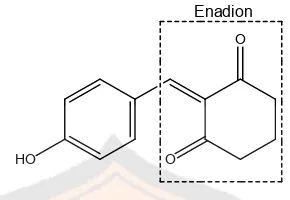
O
O
Enadion
O
O
Enadion
HO
Gambar 2. Struktur senyawa 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion
Interaksi yang dihasilkan antara senyawa 2-(4'-hidroksibenzilidena)
sikloheksana-1,3-dion dengan reseptor di dalam tubuh dapat diperkirakan secara
komputasi. Perkiraan aktivitas senyawa
2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion telah dilakukan terhadap reseptor Methionine Aminopeptidase 2 (MetAP2) secara kimia komputasi. Obat-obat antikanker golongan
antiangiogenesis (fumagilin dan ovalicin) telah diketahui memiliki aktivitas terhadap protein MetAP2 melalui ikatan ireversibel terhadap situs aktifnya
(Anonim, 2011b). Oleh karena itu, pembuktian secara kimia komputasi terhadap
aktivitas senyawa 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion dilakukan
terhadap protein MetAP2.
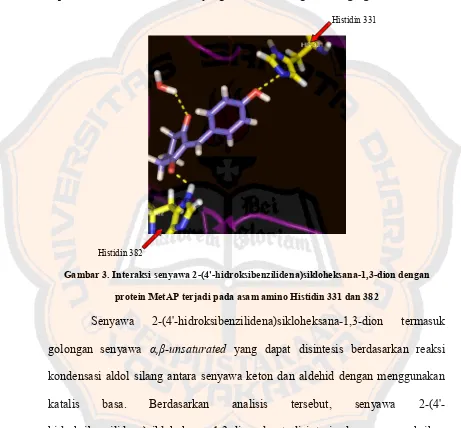
Hasil perkiraan aktivitas senyawa 2-(4'-hidroksibenzilidena)
sikloheksana-1,3-dion terhadap protein MetAP2 menunjukkan hasil bahwa
senyawa 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion memberikan nilai energi
bebas ikatan (ΔG) sebesar -10,3051 kcal/mol. Hasil tersebut lebih baik jika
dibandingkan dengan dua senyawa lain yang telah disintesis, yaitu senyawa
2-benzilidensikloheksana-1,3-dion yang memiliki nilai ΔG sebesar -9,89605
kcal/mol dan senyawa 2-(4'-klorobenzilidena)sikloheksana-1,3-dion yang nilai
ΔG-nya adalah sebesar -9,86689 kcal/mol. ΔG dapat digunakan untuk
besar nilai ΔG yang diperoleh (semakin negatif), semakin besar pula interaksi
senyawa dengan protein MetAP2. Berdasarkan data tersebut maka senyawa
2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion layak untuk disintesis karena
diperkirakan memiliki aktivitas yang lebih baik sebagaiantiangiogenesis. Histidin 331
Histidin 382
Gambar 3. Interaksi senyawa 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion dengan
protein MetAP terjadi pada asam amino Histidin 331 dan 382
Senyawa 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion termasuk
golongan senyawa α,β-unsaturated yang dapat disintesis berdasarkan reaksi kondensasi aldol silang antara senyawa keton dan aldehid dengan menggunakan
katalis basa. Berdasarkan analisis tersebut, senyawa
2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion dapat disintesis dengan mereaksikan
sikloheksana-1,3-dion (keton yang mempunyai hidrogen alpha) dan 4-hidroksibenzaldehid (aldehid yang tidak memiliki hidrogen alpha) dengan katalis basa kalium hidroksida (KOH).
besar nilai ΔG yang diperoleh (semakin negatif), semakin besar pula interaksi
senyawa dengan protein MetAP2. Berdasarkan data tersebut maka senyawa
2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion layak untuk disintesis karena
diperkirakan memiliki aktivitas yang lebih baik sebagaiantiangiogenesis. Histidin 331
Histidin 382
Gambar 3. Interaksi senyawa 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion dengan
protein MetAP terjadi pada asam amino Histidin 331 dan 382
Senyawa 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion termasuk
golongan senyawa α,β-unsaturated yang dapat disintesis berdasarkan reaksi kondensasi aldol silang antara senyawa keton dan aldehid dengan menggunakan
katalis basa. Berdasarkan analisis tersebut, senyawa
2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion dapat disintesis dengan mereaksikan
sikloheksana-1,3-dion (keton yang mempunyai hidrogen alpha) dan 4-hidroksibenzaldehid (aldehid yang tidak memiliki hidrogen alpha) dengan katalis basa kalium hidroksida (KOH).
besar nilai ΔG yang diperoleh (semakin negatif), semakin besar pula interaksi
senyawa dengan protein MetAP2. Berdasarkan data tersebut maka senyawa
2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion layak untuk disintesis karena
diperkirakan memiliki aktivitas yang lebih baik sebagaiantiangiogenesis. Histidin 331
Histidin 382
Gambar 3. Interaksi senyawa 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion dengan
protein MetAP terjadi pada asam amino Histidin 331 dan 382
Senyawa 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion termasuk
golongan senyawa α,β-unsaturated yang dapat disintesis berdasarkan reaksi kondensasi aldol silang antara senyawa keton dan aldehid dengan menggunakan
katalis basa. Berdasarkan analisis tersebut, senyawa
2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion dapat disintesis dengan mereaksikan
Dalam melakukan sintesis diperlukan katalis dimana katalis berfungsi
untuk menurunkan energi aktifasi reaksi sehingga dapat mempersingkat jalannya
suatu reaksi. Katalis yang digunakan dalam sintesis
2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion adalah kalium hiroksida (KOH) yang
merupakan basa kuat. Katalis basa akan menarik hidrogen alpha (α) dari 1,3-dion sehingga membentuk intermediet ion enolat
sikloheksana-1,3-dion yang lebih reaktif. Ion enolat tersebut akan berfungsi sebagai nukleofil
yang akan menyerang atom C karbonil dari 4-hidroksibenzaldehid yang bersifat
elektrofil. Dalam reaksi ini katalis yang digunakan adalah basa kuat sehingga akan
mempermudah pembentukan ion enolat (hidrogen alphaakan lebih mudah lepas). KOH merupakan basa yang lebih kuat dibandingkan litium hidroksida (LiOH)
atau natrium hidroksida (NaOH). Kekuatan basa ini dipengaruhi oleh beberapa
sifat fisik dari unsurnya, semakin mudah suatu senyawa tersebut membentuk ion,
semakin kuat basanya. KOH akan lebih mudah terion (menghasilkan ion OH-) dibandingkan LiOH atau NaOH. Semakin kuat sifat basa yang digunakan, maka
pembentukan ion enolat juga akan berjalan lebih cepat. Dengan demikian, reaksi
kondensasi aldol silang dapat terjadi dengan lebih cepat dan rendemen yang
1. Permasalahan
Apakah senyawa 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion
dapat disintesis dari sikloheksana-1,3-dion dan 4-hidroksibenzaldehid dengan
menggunakan katalis kalium hidroksida?
2. Keaslian penelitian
Sejauh penelusuran yang telah dilakukan peneliti, sintesis senyawa
2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion dari sikloheksana-1,3-dion dan
4-hidroksibenzaldehid dengan menggunakan katalis kalium hidroksida
berdasarkan reaksi kondensasi aldol silang belum pernah dilakukan. Senyawa
sejenis yang pernah disintesis adalah senyawa
2-benzilidensikloheksana-1,3-dion menggunakan katalis natrium hidroksida (Istyastono, Yuniarti, dan
Jumina, 2009) dan senyawa 2-(4'-klorobenzilidena)sikloheksana-1,3-dion
dengan katalis kalium hidroksida (Christy, 2010).
3. Manfaat penelitian a. Manfaat teoritis
Memberikan informasi mengenai sintesis senyawa
2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion dari sikloheksana-1,3-dion dan
4-hidroksibenzaldehid dengan menggunakan katalis kalium hidroksida
b. Manfaat metodologi
Memberikan pengetahuan mengenai tata cara sintesis senyawa
2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion menggunakan katalis kalium
hidroksida berdasarkan reaksi kondensasi aldol silang.
c. Manfaat praktis
Memberikan informasi mengenai adanya modifikasi senyawa analog
kurkumin yang berpotensi sebagai inhibitor angiogenesis.
B. Tujuan Penelitian
Penelitian ini dilakukan dengan tujuan untuk membuktikan bahwa
senyawa 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion dapat disintesis dari
sikloheksana-1,3-dion dan 4-hiroksibenzaldehid dengan menggunakan katalis
8
PENELAAHAN PUSTAKA
A. Senyawa Enon dan Dienon Aromatis
Struktur senyawa enon dan dienon aromatis dikembangkan berdasarkan
struktur kurkumin yang telah diuji memiliki aktifitas sebagai senyawa inhibitor
angiogenesis. Salah satu senyawa analog kurkumin yang telah dilaporkan
memiliki aktivitas inhibitor angiogenesis adalah Pentagamavunon-1 (PGV-1)
melalui penekanan ekspresi dari VEGF. Struktur yang bertanggung jawab
terhadap aktivitas senyawa sebagai inhibitor angigenesis, yaitu pada
α,β-unsaturated carbonil yang merupakan suatu enon aromatis (Istyastono, Yuniarti,
dan Jumina, 2009).
Berdasarkan penelitian in vitro yang dilakukan Robinson et al., (2003)
senyawa golongan enon aromatis telah dilaporkan aktif sebagai inhibitor
angiogenesis dengan penghambatan sebesar 89,1-98,2% untuk konsentrasi
3µg/mL dan 96,9-98,1% untuk konsentrasi 6 µg/mL. Sedangkan senyawa
golongan dienon aromatis memberikan penghambatan sebesar 87,1-96,6% untuk
konsentrasi 3 µg/mL dan 90,4-97,7% untuk konsentrasi 6 µg/mL.
Senyawa jenis enon aromatis yang telah disintesis adalah
2-benzilidenasikloheksana-1,3-dion. Senyawa tersebut merupakan senyawa enadion
siklik aromatik yang paling sederhana. Oleh karena itu, struktur tersebut dapat
digunakan sebagai senyawa penuntun untuk mengembangkan senyawa inhibitor
pengembangan yang telah dilakukan berdasarkan senyawa
2-benzilidenasikloheksana-1,3-dion adalah senyawa 2-(4'-klorobenzilidena
)sikloheksana-1,3-dion dimana senyawa tersebut dimodifikasi dengan
menambahkan gugusan kloro pada posisi para cincin benzena. Adanya gugusan
kloro tersebut akan menarik elektron pada cicin benzenanya sehingga atom C
pada posisibeta(β) akan lebih positif. C-betayang lebih positif diperkirakan akan
meningkatkan aktivitas senyawa terhadap penekanan ekspresi dari VEGF
(Christy, 2010).
B. Sintesis Senyawa 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion
Senyawa 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion dapat disintesis
menggunakan starting material sikloheksana-1,3-dion dan 4-hidroksibenzaldehid
dengan katalis basa seperti kalium hidroksida (KOH). Sikloheksana-1,3-dion atau
dihidroresorsinol yang mempunyai rumus molekul C6H8O2 adalah senyawa yang
berbentuk kristal dengan berat molekul 112,12 g/mol dan titik lebur 105˚C.
Senyawa tersebut larut dalam air, aseton, kloroform, dan benzena panas. Namun,
tidak larut dalam eter, petroleum eter, dan karbondioksida (Budavari, O’Neil,
Smith, dan Heckelmann, 1989). Sedangkan 4-klorobenzaldehid adalah senyawa
berbentuk serbuk berwarna orange sampai coklat terang dengan bau khas.
Senyawa dengan rumus molekul C7H6O2 ini memiliki kelarutan sebesar 1,3 g/L,
titik leburnya 116˚C, titik didih 310˚C, densitas 1,143 g/cm3, dan pKa 7,72
Pada suatu reaksi perlu adanya katalis karena katalis merupakan suatu
senyawa yang mengakibatkan reaksi lebih cepat mencapai kesetimbangan (Cotton
and Wilkinson, 1989). Dalam suatu reaksi organik ada beberapa mekanisme kerja
katalis, yaitu meningkatkan kemampuan suatu elektrofil untuk diserang oleh
nukleofil dan meningkatkan reaktifitas dari suatu nukleofil. Selain itu, katalis juga
dapat meningkatkan kemampuan gugus pergi untuk lepas atau meninggalkan
senyawanya (Bruice, 1998). Salah satu katalis yang sering digunakan dalam
sintesis organik adalah suatu nukleofil (katalis basa) atau suatu elektrofil (katalis
asam). Pada sintesis 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion digunakan
katalis berupa nukleofil, yaitu kalium hidroksida. Kalium hidroksida dengan
rumus molekul KOH merupakan suatu basa kuat dengan berat molekul 56,11
g/mol, massa berbentuk batang, pellet, atau bongkahan, putih, sangat mudah
meleleh basah. Senyawa tersebut larut dalam satu bagian air, 3 bagian etanol, dan
sangat mudah larut dalam etanol mutlak P mendidih (Dirjen POM RI, 1979).
Kekuatan basa dari KOH yang lebih kuat dari LiOH dan NaOH dipengaruhi oleh
beberapa sifat fisik dari unsurnya, seperti jari-jari atom dan keelektronegatifan.
Atom K memiliki jari-jari atom yang lebih besar dibanding Li atau Na, sedangkan
keelektronegatifannya lebih kecil. Jari-jari atom yang lebih besar menyebabkan
ikatan pada KOH lebih lemah sehingga mudah putus dan keelektronegatifan yang
kecil akan menyebabkan atom K mudah membentuk ion positif (bersifat
elektropositif). Semakin mudah suatu senyawa tersebut membentuk ion, semakin
kuat basanya. KOH akan lebih mudah terion (menghasilkan ion OH-)
katalis, maka pembentukan ion enolat juga akan berjalan lebih cepat (Fessenden
and Fessenden, 1982).
Reaksi yang menjadi dasar dari sintesis senyawa
2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion adalah reaksi kondensasi aldol silang,
yaitu reaksi antara suatu senyawa aldehid yang tidak memiliki hidrogen alpha(α)
dengan senyawa keton atau senyawa aldehid yang memiliki hidrogen alpha (α).
Prinsip reaksi kondensasi adalah penggabungan dua molekul atau lebih menjadi
satu molekul yang lebih besar, dengan atau tanpa hilangnya suatu molekul kecil.
Suatu reaksi kondensasi aldol merupakan reaksi adisi yang tidak melepaskan
suatu molekul kecil menghasilkan suatu senyawa β-hydroxy carbonil. Senyawa
β-hydroxy carbonil tersebut mudah mengalami dehidrasi karena akan dihasilkan
suatu senyawa yang lebih stabil, yaitu senyawa yang mempunyai ikatan rangkap
dan berkonjugasi dengan gugus karbonilnya. Hasil dari dehidrasi tersebut akan
membentuk suatu senyawaα,β-unsaturated carbonil. Bila dehidrasi menghasilkan
suatu ikatan rangkap yang berkonjugasi dengan suatu cicin aromatik, reaksi
dehidrasi tersebut dapat berjalan secara spontan, bahkan juga dalam larutan basa
(Fessenden and Fessenden, 1986).
Dalam reaksi kondensasi, jika suatu aldehid atau keton yang memiliki
hidrogen alpha (α) diolah dengan suatu basa seperti KOH dalam air akan
terbentuk ion enolat yang dapat bereaksi pada gugus karbonil dari molekul
aldehid atau keton yang lain. Ion enolat bereaksi dengan suatu molekul yang lain
dengan cara mengadisi pada bagian atom karbonilnya untuk membentuk suatu ion
menghasilkan suatu produk aldol. Senyawa produk aldol tersebut kemudian masih
akan terdehidrasi untuk membentuk senyawa yang lebih stabil, yaitu senyawa
α,β-unsaturated carbonil(Fessenden and Fessenden, 1986).
Senyawa sikloheksana-1,3-dion dalam suasana basa akan mengalami
deprotonasi membentuk ion enolat yang bertindak sebagai nukleofil. Mekanisme
kerja katalis dalam reaksi ini adalah meningkatkan reaktifitas dari nukleofil
sikloheksana-1,3-dion pada posisi atom C alpha-nya yang kemudian akan
menyerang karbonil dari 4-hiroksibenzaldehid. Senyawa yang terbentuk akan
terdehidrasi dan menghasilkan senyawa
2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion.
C. Analisis Pendahuluan
Analisis pendahuluan dilakukan untuk mengetahui karakteristik dari
senyawa hasil sintesis, meliputi pemeriksaan organoletis dan kelarutannya.
1. Pemeriksaan organoleptis
Uji organoleptis adalah uji yang paling sederhana dan memuat
paparan mengenai sifat suatu zat secara umum meliputi wujud, warna, dan
bau. Pernyataan dalam uji ini tidak cukup kuat untuk menjadi syarat baku,
tetapi meskipun demikian secara tidak langsung dapat membantu penilaian
pendahuluan terhadap mutu zat yang bersangkutan (Dirjen POM RI, 1995).
2. Pemeriksaan kelarutan
Uji kelarutan dilakukan untuk mengetahui sifat fisik suatu zat.
zat padat tersebut hingga tepat jenuh pada suhu terkontrol. Hasilnya akan
dibandingkan dengan standar. Pada setiap pemeriksaan, kemurnian zat padat
dan pelarut harus terjamin karena sedikit pengotor dapat menyebabkan
terjadinya variasi hasil pemeriksaan (Jenkins, Knevel, and Digangi, 1965).
Kelarutan bukanlah standar uji kemurnian dari zat bersangkutan.
Maksud utamanya adalah sebagai informasi dalam penggunaan, pengolahan,
dan peracikkan suatu bahan (Dirjen POM RI, 1995).
Tabel I. Parameter kelarutan menurut Farmakope Indonesia IV
Parameter kelarutan
Jumlah bagian pelarut yang diperlukan untuk melarutkan 1 bagian zat
Sangat mudah larut Kurang dari 1
Mudah larut 1 sampai 10
Larut 10 sampai 30
Agak sukar larut 30 sampai 100 Sukar larut 100 sampai 1000 Sangat sukar larut 1000 sampai 10.000 Praktis tidak larut lebih dari 10.000
(Dirjen POM RI, 1995)
Kelarutan suatu zat dipengaruhi oleh polaritas dari pelarutnya. Nilai
polaritas diukur dari momen dipolnya. Pelarut polar dapat melarutkan zat yang
sifatnya polar juga atau zat yang bersifat ionik. Sedangkan pada pelarut
nonpolar, mekanisme pencampuran dengan senyawa nonpolar adalah melalui
interaksi dipol. Faktor lain yang mempengaruhi kelarutan suatu zat adalah
tetapan dielektrik, asosiasi, solvasi, tekanan dalam, dan reaksi asam-basa
D. Rekristalisasi
Langkah pemurnian padatan dengan cara rekristalisasi didasarkan pada
perbedaan kelarutan padatan tersebut di dalam pelarut atau campuran pelarut
(Anwar, Pranowo, dan Wahyuni, 1994). Rekristalisasi adalah proses pemurnian
zat yang dilakukan dengan cara melarutkan zat dalam keadaan panas dan
kemudian didinginkan. Dalam keadaan panas, maka kelarutan zat akan meningkat
dan ketika didinginkan kelarutannya akan berkurang secara drastis dan zat
tersebut akan mudah mengendap atau terbentuk kristal kembali. Agar proses
rekristalisasi berjalan dengan baik, pengotor harus memiliki kelarutan yang lebih
besar pada pelarut dibandingkan dengan zat yang diinginkan. Dengan demikian
saat zat yang diinginkan mulai diendapkan, pengotor yang sudah terlarut tidak
ikut mengkristal kembali (Bresnick, 2004).
Beberapa metode rekristalisasi yang digunakan sesuai dengan kondisi
atau sifat dari zat yang akan direkristalisasi, yaitu :
a. Rekristalisasi secara langsung dari campuran pelarut.
b. Rekristalisasi dengan asam dan basa.
c. Rekristalisasi secara presipitasi dengan pelarut kedua (Reksohadiprojo, 1996).
Pelarut yang digunakan untuk proses rekristalisasi juga memiliki syarat
tertentu agar hasilnya optimal. Syarat pelarut yang digunakan adalah :
a. Pada suhu tinggi dapat melarutkan dalam jumlah banyak, namun pada suhu
rendah hanya sedikit melarutkan.
c. Dapat menghasilkan bentuk kristal yang baik dari senyawa yang dimurnikan
serta mudah dipisahkan dari bahan utama (titik didih pelarut rendah).
d. Tidak boleh bereaksi dengan senyawa yang dimurnikan atau bersifat inert
(Reksohadiprojo, 1996).
E. Pemeriksaan Kemurnian Senyawa Hasil Sintesis
1. Pemeriksaan titik lebur
Titik lebur merupakan suhu dimana mulai terjadi perubahan fisika
dari bentuk padatan menjadi bentuk cair pada tekanan atmosfer. Jika suhu
dinaikkan, energi akan banyak terserap oleh molekul senyawa dan akan terjadi
vibrasi serta rotasi dari molekul. Jika suhu terus dinaikkan, maka molekulnya
akan rusak dan berubah menjadi bentuk cairan (Bradstatter, 1971).
Pemeriksaan ini merupakan aspek penting yang sering dilakukan
dalam sintesis suatu senyawa. Hal tersebut menjadi penting karena
pemeriksaan titik lebur dapat memberikan informasi kemurnian senyawa hasil
sintesis. Suatu senyawa dikatakan murni apabila jarak titik leburnya tidak
lebih dari 2˚C (MacKenzie, 1967).
2. Kromatografi Lapis Tipis (KLT)
Kromatografi merupakan suatu teknik pemisahan menggunakan dua
fase berbeda, fase diam (stationary phase) dan fase gerak (mobile phase).
Teknik kromatografi telah dikembangkan dan digunakan untuk memisahkan
sekaligus mengkuantifikasi berbagai komponen campuran (Rohman, 2007).
yang dilapisi dengan fase diam. Senyawa yang akan dianalisis akan ditotolkan
pada dasar lempeng dan dielusi dengan fase gerak. Totolan tersebut akan
bergerak naik oleh adanya gaya kapilaritas (Bresnick, 2004).
Apabila fase diamnya bersifat polar, maka senyawa yang bersifat
polar akan melekat lebih kuat pada lempeng dibandingkan senyawa yang
bersifat nonpolar. Hal tersebut terjadi akibat interaksi tarik-menarik antardipol
yang lebih kuat. Sedangkan senyawa nonpolar kurang melekat pada lempeng
fase diam yang polar sebab interaksinya lemah sehingga akan terelusi lebih
cepat. Berdasarkan hal tersebut, dapat disimpulkan bahwa jarak rambat dari
suatu senyawa pada lempengan dapat digunakan sebagai cerminan polaritas
suatu senyawa (Bresnick, 2004).
Kromatografi lapis tipis ini dapat digunakan untuk menguji
kemurnian suatu zat secara kualitatif dari campuran suatu senyawa.
Pembuktian tersebut terkait dengan ada tidaknya komponen yang dicari dan
apakah komponen tersebut murni atau tidak. Hal ini dilakukan dengan
membandingkan senyawa yang akan diidentifikasi dengan senyawa
standarnya. Apabila senyawa tersebut murni, maka akan memberikan bercak
tunggal pada berbagai fase gerak dengan berbagai tingkat kepolaran dan
mempunyai harga Rf yang sama dengan harga Rf senyawa standarnya
(Gasparic and Churacek, 1978).
Identifikasi bercak tidak berwarna pada lempeng KLT dapat
dilakukan dengan dua cara, yaitu melihat lempeng KLT (lempeng dengan fase
terjadi pemadaman pada bercak senyawa atau bisa dilakukan dengan
menggunakan pereaksi semprot sehingga totolan senyawa akan berwarna
(Bresnick, 2004).
3. Gas Chromatography-Mass Spectroscopy(GC-MS)
Kromatografi gas merupakan suatu metode pemisahan migrasi
deferensial dimana komponen-komponen cuplikan ditahan secara selektif oleh
fase diam, baik fase diam berupa padatan maupun cairan. Kromatografi gas
dapat digunakan untuk melakuan analisis kualitatif (menentukan sifat-sifat
dari suatu komponen dalam suatu campuran) dan analisis kuantitatif
(menentukan jumlah dari suatu komponen dalam campurannya). Pada
kromatografi gas ini fase gerak yang digunakan berupa gas yang bersifat inert
(Sastrohamidjojo, 2005).
Spektroskopi massa adalah salah satu metode analisis yang
digunakan untuk menentukan struktur molekul organik dan dapat memberikan
informasi bobot molekul dari suatu molekul organik berdasarkan
perbandingan m/z dari ion molekul (Williams and Fleming, 1997).
Metode kromatografi gas yang digabungkan dengan spektroskopi
massa memberikan keuntungan, yaitu akan terjadi pemisahan oleh
kromatografi gas terlebih dahulu yang dilanjutkan proses identifikasi dan
kuantifikasi oleh spektroskopi massa. Keuntungan dari metode ini adalah
dapat digunakan pada hampir semua jenis analit, batas deteksinya rendah, dan
memberikan informasi penting berupa spektra massa dari suatu senyawa
F. Elusidasi Struktur
Elusidasi struktur penting dilakukan sebab struktur dari senyawa hasil
sintesis belum diketahui secara jelas. Melalui elusidasi struktur ini, maka dapat
diketahui struktur yang sebenarnya dari senyawa hasil sintesis, apakah senyawa
hasil adalah senyawa yang diharapkan terbentuk atau bukan. Elusidasi struktur
yang dilakukan meliputi :
1. Spektrofotometri inframerah (IR)
Spektra inframerah merupakan gambaran dari pita absorbs yang khas
dari gugus fungsional yang ada pada molekul organik. Gugus-gugus
fungsional tersebut akan mengalami vibrasi karena adanya energi. Spektra
yang dihasilkan bisa digunakan untuk analisis kualitatif untuk mengetahui ada
tidaknya suatu gugus fungsional tertentu. Pembacaan spektra inframerah ini
biasa dilakukan pada daerah bilangan gelombang 650-4000 cm-1
(Sastrohamidjojo, 2001).
Semua ikatan kimia memiliki frekuensi vibrasi yang berbeda/khas
yang dapat menghasilkan ikatan mengulir (stretch) atau menekuk (blend).
Apabila frekuensi energi elektromagnetik inframerah yang dilewatkan pada
suatu molekul sama dengan frekuensi mengulir atau menekuknya ikatan, maka
energi tersebut yang akan diserap dan direkam oleh detektor. Hasilnya
dilaporkan dalam bentuk pita serapan pada bilangan gelombang tertentu
2. Spektroskopi massa
Prinsip dari spektroskopi massa adalah terjadinya tabrakan antara
sebuah molekul organik dengan elektron berenergi tinggi yang menyebabkan
lepasnya sebuah elektron dari molekul tersebut dan membentuk ion positif
organik yang tidak stabil. Ion positif tersebut akan pecah menjadi
fragmen-fragmen yang lebih kecil lagi. Hanya fragmen-fragmen bermuatan positif yang akan
terdeteksi sedangkan ion yang bermuatan negatif akan diserap oleh dinding
tabung vakum. Hasilnya akan berupa spektra massa yang merupakan gambar
antara kelimpahan relatif lawan perbandingan massa/muatan (m/z). Pemisahan
ion-ion berdasarkan perbandingan massa terhadap muatan, dimana muatan ion
pada umumnya adalah satu sehingga diketahui massa dari ion-ion tersebut
(Williams and Fleming, 1997). Metode yang paling sering digunakan dalam
spektroskopi massa adalah electron impact-mass spectroscopy (EI-MS). Pada
metode ini, molekul organik akan ditumbuk oleh elektron dengan energy 70ev
yang mengakibatkan hilangnya suatu radikal kation (M∙+) (Silverstein dan
Webster, 1998).
Pecahnya suatu molekul menjadi fragmen-fragmen tergantung dari
kerangka karbon dan gugus-gugus fungsional yang terdapat dalam suatu
molekul. Oleh karena itu, massa fragmen dan kelimpahannya akan dapat
memberikan petunjuk mengenai struktur molekul senyawa yang diidentifikasi.
Spektra massa yang dihasilkan juga memberikan informasi mengenai bobot
G. Landasan Teori
Reaksi kondensasi aldol silang adalah reaksi antara suatu senyawa
aldehid yang tidak memiliki hidrogen alpha (α) dengan suatu senyawa aldehid
atau keton yang memiliki hidrogen alpha (α) dalam suasana basa. Prinsip
reaksinya adalah penggabungan dua molekul atau lebih menjadi satu molekul
yang lebih besar, dengan atau tanpa hilangnya suatu molekul kecil. Hasilnya
adalah suatu senyawa karbonil β-hydroxy carbonil yang selanjutnya akan
mengalami reaksi dehidrasi untuk membentuk molekul yang lebih stabil, yaitu
senyawa α,β-unsaturated carbonil. Sikloheksana-1,3-dion merupakan senyawa
keton dengan hidrogen alpha (α) jika direaksikan dengan basa kalium hidroksida
(KOH) akan menghasilkan suatu ion enolat yang lebih reaktif (sebagai nukleofil).
Ion enolat tersebut yang akan menyerang atom C karbonil pada
4-hidroksibenzaldehid yang bermuatan positif. 4-4-hidroksibenzaldehid merupakan
senyawa aldehid yang tidak memiliki hidrogen alpha (α), berfungsi sebagai
elektrofil. Produk akhir dari reaksi tersebut adalah suatu senyawa golongan
α,β-unsaturated carbonil, yaitu senyawa
2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion.
Gambar 4. Reaksi umum sintesis senyawa 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion dengan katalis KOH
Reaksi sintesis senyawa 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion
hidrogen alpha (α) pada sikloheksana-1,3-dion akan berjalan lebih cepat, maka
proses pembentukkan ion enolat juga akan berjalan lebih cepat. Dengan demikian,
rendemen dari senyawa hasil sintesis akan lebih banyak.
H. Hipotesis
Senyawa 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion dapat disintesis
dari senyawa sikloheksana-1,3-dion dan 4-hidroksibenzadehid menggunakan
22
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk dalam penelitian non-eksperimental deskriptif
non-analitik karena tidak ada perlakuan pada subjek uji dan hanya dipaparkan
fenomena yang terjadi yang tidak terdapat hubungan sebab akibat.
B. Definisi Operasional
1. Starting material
Starting material adalah bahan awal yang digunakan dalam
penelitian. Starting material yang digunakan dalam penelitian ini adalah
sikloheksana-1,3-dion dan 4-hidroksibenzaldehid.
2. Katalis
Katalis adalah senyawa yang digunakan dalam reaksi untuk
meningkatkan laju reaksi kimia. Penelitian ini menggunakan katalis kalium
hidroksida.
3. Senyawa hasil sintesis
Senyawa hasil sintesis merupakan senyawa target yang diharapkan
terbentuk dari hasil reaksi. Senyawa target dalam penelitian ini adalah
4. Rendemen senyawa hasil sintesis
Rendemen senyawa hasil sintesis adalah perbandingan jumlah
senyawa yang diperoleh dari hasil sintesis dengan jumlah senyawa hasil secara
teoritis yang dapat dihitung berdasarkan jumlah starting material yang
digunakan. Rendemen dalam penelitian ini adalah rendemen senyawa
2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion yang dihitung berdasarkan
perbandingan hasil sintesis dengan hasil perhitungan secara teoritis.
C. Bahan Penelitian
Sikloheksana-1,3-dion (p.a., Nacalai), 4-hidroksibenzaldehid (p.a.,
Sigma), kalium hidroksida (p.a., Merck), aquades (Laboratorium Kimia Organik
Universitas Sanata Dharma), etanol (p.a., Merck), metanol (p.a., Merck),
kloroform (p.a., Merck), etil asetat (p.a., Merck), n-heksan (p.a., Merck), silika
gel GF254(Merck).
D. Alat Penelitian
Neraca analitik (Mextler PM 100), pemanas listrik (Herdolph MR 2002),
thermophan (Electrothermal 9100), seperangkat alat gelas, statif, klem,
termometer, chamberkaca, seperangkat alat reflux (labu alas bulat dan pendingin
Alihn), baskom, kertas saring, waterbath, mikropipet, lampu UV254 nm,
spektrometer IR (IR Shimadzu Prestige-21), kromatografi gas-spektrometer massa
E. Tata Cara Penelitian
1. Sintesis 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion
a. Pembuatan larutan kalium hirdoksida (KOH) 2% b/v
Kalium hidroksida (KOH) sebanyak 0,200 gram dilarutkan dalam
sedikit aquades, kemudian dimasukkan ke dalam labu takar 10 mL dan
ditambah dengan aquades hingga batas tanda.
b. Pembuatan larutan sikloheksana-1,3-dion
Sikloheksana-1,3-dion sebanyak 3,0 mmol (0,336 gram)
dimasukkan dalam labu alas bulat (LAB) 100 mL dan dilarutkan dengan 9
mL larutan kalium hidroksida (KOH) 2% b/v.
c. Pembuatan larutan 4-hidroksibenzaldehid
4-hidroksibenzaldehid sebanyak 3,0 mmol (0,366 gram)
dimasukkan dalambekker glass50 mL, dilarutkan dengan 30 mL aquades.
d. Sintesis senyawa 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion
Larutan 4-hidroksibenzaldehid ditambahkan ke dalam larutan
sikloheksana-1,3-dion dalam labu alas bulat. Campuran tersebut direflux
selama 5 jam pada suhu 90 – 95˚C. Larutan senyawa hasil sintesis
dimasukkan dalambeker glass100 mL.
2. Kristalisasi
Larutan hasil sintesis ditambah dengan HCl 2N sebanyak 5 mL dan
digojok hingga homogen. Padatan yang terbentuk disaring dan kemudian
ditambahkan. Serbuk yang diperoleh dikeringkan dalam desikator selama 2
hari. Setelah kering, serbuk ditimbang dan dihitung rendemennya.
3. Analisis senyawa hasil sintesis
a. Pemeriksaan organoleptis
Senyawa hasil sintesis diamati sifat-sifat fisiknya, meliputi
bentuk, warna, dan bau, dibandingkan dengan starting material yang
digunakan.
b. Pemeriksaan kelarutan
Senyawa hasil sintesis sebanyak 10 mg dimasukkan dalam tabung
reaksi dan ditambahkan dengan aquades tetes demi tetes, kemudian
diamati kelarutannya. Dilakukan prosedur yang sama untuk pelarut yang
lain seperti metanol, etanol, kloroform, etil asetat, dan n-heksan.
Selanjutnya dibandingkan dengan kelarutan starting material-nya, yaitu
sikloheksana-1,3-dion dan 4-hidroksibenzaldehid.
c. Pemeriksaan titik lebur
Sejumlah kecil senyawa hasil sintesis dimasukkan dalam
electrothermal capillary tubes, kemudian dimasukkan dalam alat pengukur
titik lebur (thermophan). Peleburan kristal yang terjadi diamati dan dicatat
suhu pertama kali kristal melebur hingga seluruh kristalnya melebur.
d. Kromatografi Lapis Tipis (KLT)
Senyawa hasil sintesis dan starting material masing-masing
dilarutkan dalam etanol. Masing-masing senyawa tersebut ditotolkan
yang telah diaktifkan pada suhu 100˚C selama 30 menit. Setelah totolan
kering, dielusi dengan fase gerak n-heksan : etil asetat (3:2) dan
dikembangkan dengan jarak rambat 10 cm.
e. Gas Chromatography(GC)
Pemeriksaan kemurnian senyawa hasil sintesis dilakukan dengan
kromatografi gas yang dikondisikan : suhu injektor 300˚C, jenis kolom
Rtx-5MS dengan panjang 30 meter, suhu kolom 100-300˚C, gas pembawa
helium, tekanan 22 kPa, kecepatan alir fase gerak 0,5 mL/menit, detektor
ionisasi nyala. Cuplikan senyawa hasil sintesis dilarutkan dalam kloroform
dan diinjeksikan pada injektor kromatografi gas. Aliran gas helium akan
membawa cuplikan yang telah diuapkan masuk ke dalam kolom Rtx-5MS
yang dilapisi dengan fase diam dimethylpolycyloxane (berwujud cair).
Cuplikan tersebut akan terukur oleh detektor dan dilaporkan hasilnya
berupa suatu kromatogram.
4. Elusidasi struktur senyawa hasil sintesis
a. Spektrofotometri inframerah
Senyawa hasil sintesis sebanyak lebih kurang 0,5–1 mg dicampur
dengan KBr lebih kurang 10 mg, kemudian dikempa dan dibuat tablet.
Cahaya inframerah dari sumber dilewatkan melalui cuplikan, kemudian
dipecah menjadi frekuensi-frekuensi individunya dalam monokromator.
Intensitas relatif dari frekuensi individu yang dihasilkan akan terukur oleh
detektor dan dibaca dalam bentuk spektra inframerah senyawa
b. Spektrometri massa
Uap cuplikan senyawa hasil sintesis yang telah keluar dari kolom
kromatgrafi gas dialirkan dalam kamar pengion pada spektrometer massa
dan ditembak dengan seberkas elektron hingga terfragmentasi. Jenis
pengionan yang digunakan adalah EI (Electron Impact) 70 eV.
Fragmen-fragmen yang terbentuk akan melewati lempeng mempercepat ion dan
didorong menuju tabung analisator, dimana partikel-partikel akan
dibelokkan pada medan magnet dan menimbulkan arus pada kolektor yang
nilainya sebanding dengan keliimpahan relatif tiap fragmennya. Hasilnya
akan keluar berupa spektra massa dari senyawa yang bersangkutan.
F. Analisis Hasil
1. Perhitungan rendemen
Senyawa hasil sintesis ditimbang, kemudian dibandingkan beratnya
dengan berat senyawa secara teoritis dan kemudian dikalikan 100%.
Perhitungan rendemen tersebut dilakukan pada kristal yang telah murni dan
kering.
% = ℎ 100%
2. Analisis pendahuluan
Analisis pendahuluan senyawa hasil sintesis dilakukan berdasarkan
3. Pemeriksaan kemurnian senyawa hasil sintesis
Pemeriksaan kemurnian senyawa hasil sintesis dilakukan berdasarkan
uji titik lebur, uji kromatografi lapis tipis dan uji kromatografi gas.
4. Elusidasi struktur
Elusidasi struktur senyawa hasil sintesis dilakukan berdasarkan data
29
BAB IV
HASIL DAN PEMBAHASAN
A. Sintesis Senyawa 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion
Sintesis senyawa 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion
dilakukan dengan mereaksikan starting material sikloheksana-1,3-dion dan
4-hidroksibenzaldehid dalam pelarut aquades dengan katalis kalium hidroksida
(KOH) berdasarkan prinsip reaksi kondensasi aldol silang. Sikloheksana-1,3-dion
merupakan suatu senyawa yang memiliki dua gugus keton dengan enam hidrogen
alpha sedangkan 4-hidroksibenzaldehid adalah suatu aldehida yang tidak
memiliki hidrogen alpha dengan gugus –OH tersubstitusi pada posisi para dari
gugus aldehidnya. Kedua senyawa tersebut memungkinkan untuk bereaksi
melalui reaksi kondensasi aldol silang menghasilkan senyawa
2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion. Reaksi tersebut dapat berjalan sebab
reaksi kondensasi aldol silang adalah reaksi antara suatu senyawa karbonil yang
memiliki hidrogen alpha dalam hal ini adalah senyawa sikloheksana-1,3-dion
dengan suatu senyawa karbonil lain yang tidak memiliki hidrogen alpha dalam
hal ini adalah senyawa 4-hidroksi benzaldehid dengan katalis basa (KOH).
Keenam hidrogen alpha pada sikloheksana-1,3-dion bersifat asam
sehingga dengan adanya suatu basa, atom karbon alpha pada
sikloheksana-1,3-dion akan dapat melepaskan atom hidrogennya dan membentuk karbon yang
bermuatan negatif, yaitu karbanion. Keasaman paling tinggi dimiliki oleh
hidrogenalphayang diapit oleh dua gugus keton sehingga atom hidrogen tersebut
akan lebih mudah dilepaskan dengan bantuan katalis basa KOH. Akan tetapi,
halangan sterik pada hidrogen alpha tersebut cukup besar karena adanya dua
gugusan keton yang mengapitnya. Oleh sebab itu, pada penelitian ini dipilih
penggunaan katalis basa kuat, yaitu kalium hidroksida (KOH) untuk dapat
mengambil hidrogen alpha tersebut. Sikloheksana-1,3-dion yang bermuatan
negatif akan bertindak sebagai nukleofil dalam reaksi sintesis ini.
Proses pembentukan ion enolat dari sikloheksana-1,3-dion diawali
dengan penyerangan oleh ion hidroksi yang berasal dari katalis KOH yang telah
mengalami ionisasi menjadi ion kalium (K+) dan ion hidroksi (OH-). Ion hidroksi
tersebut akan menyerang dan mengambil hidrogen alpha pada
1,3-dion membentuk ion enolat. Dua gugus keton yang terdapat pada
sikloheksana-1,3-dion akan mampu menstabilkan karbanion yang terbentuk melalui mekanisme
resonansi.
Senyawa 4-hidroksibenzaldehid merupakan senyawa yang bermuatan
parsial positif pada atom C karbonilnya. Muatan parsial positif tersebut muncul
karena adanya efek induksi dari atom oksigen yang bersifat elektronegatif
sehingga elektron akan lebih tertarik ke atom oksigen (atom O bermuatan parsial
menyebabkan ion enolat dari sikloheksana-1,3-dion menyerang atom C karbonil
dari 4-hidroksibenzaldehid. Dengan demikian 4-hidroksibenzaldehid berfungsi
sebagai elektrofil dalam reaksi sintesis ini.
Pada proses sintesis senyawa
2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion katalis KOH dibuat dengan konsentrasi 2% b/v. Dipilih aquades sebagai
pelarut karena KOH paling mudah larut dalam aquades. Katalis KOH yang
digunakan dibuat dalam konsentrasi rendah (encer) dengan tujuan untuk
menghindari terjadinya reaksi Cannizaro, yaitu reaksi oksidasi-reduksi yang
terjadi pada 4-hidroksibenzaldehid karena tidak memiliki hidrogenalpha.
Tahap pertama dari sintesis
2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion adalah dengan pembentukan ion enolat dari sikloheksana-1,3-2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion, yaitu
dengan melarutkan serbuk sikloheksana-1,3-dion dalam 9 mL KOH 2% b/v.
Volume 9 mL KOH telah dihitung berdasarkan persamaan mol reaksi karena
katalis KOH yang ditambahkan tidak boleh berlebih. Jika penambahan katalis
berlebih, akan memicu terjadinya reaksi Cannizaro.
Tahapan selanjutnya adalah pencampuran larutan 4-hidroksibenzaldehid
ke dalam larutan sikloheksana-1,3-dion. Pada pencampuran tersebut akan terjadi
penyerangan ion enolat dari sikloheksana-1,3-dion pada gugus karbonil dari
4-hidroksibenzaldehid menghasilkan suatu senyawa beta hidroksi karbonil yang
merupakan senyawa antara dan kemudian akan mengalami pelepasan molekul air
(dehidrasi) jika dipanaskan. Hasil dari dehidrasi tersebut adalah senyawa
Gambar 6. Mekanisme reaksi sintesis senyawa 2-(4'-hidroksibenzilidena) sikloheksana-1,3-dion
Pada pencampuran sikloheksana-1,3-dion dan 4-hidroksibenzaldehid,
pencampuran harus dilakukan segera setelah serbuk sikloheksana-1,3-dion larut
dalam KOH. Hal tersebut dilakukan untuk mencegah terjadinyaself condensation
pada sikloheksana-1,3-dion. Self condensation pada sikloheksana-1,3-dion bisa
terjadi karena sikloheksana-1,3-dion juga memiliki gugus karbonil yang
bermuatan parsial positif sehingga dapat diserang oleh ion enolat yang merupakan
suatu nukleofil.
Setelah sikloheksana-1,3-dion dan 4-hidroksibenzaldehid dicampur,
maka sistem tersebut akan direfluks selama 5 jam dengan suhu 90 – 95˚C. Pada
proses refluks, uap dari starting material yang direaksikan akan terkondensasi
mempertahankan kondisi sistem termodinamika sehingga reaksi dapat berjalan
dengan sempura. Adanya pemanasan juga bertujuan untuk mempermudah proses
dehidrasi produk antara (senyawa betahidroksi karbonil) menjadi senyawa
2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion karena pada suhu tinggi, reaksi akan
lebih mudah terjadi. Pada penelitian ini digunakan aquades sebagai pelarut karena
aquades dapat melarutkan kedua starting material. Selain itu, aquades cenderung
netral untuk tidak bereaksi dengan gugusan karbonil.
Dari proses refluks selama 5 jam, diperoleh cairan bening berwarna
kuning pekat dengan pH sekitar 7-9. Untuk memperoleh senyawa hasil sintesis
dalam bentuk serbuknya, maka dilakukan kristaliasi dengan menambahkan HCl
2N. Proses kristalisasi dilakukan dengan pengasaman karena adanya pembentukan
garam dari senyawa hasil sintesis akibat keberadaan KOH dalam larutan (Gambar
7). Penambahan HCl 2N menghasilkan larutan yang asam pada sekitar pH 1.
Dalam suasana asam, maka akan terjadi pendesakan oleh ion H+ dari asam
terhadap garam yang terbentuk sehingga struktur senyawa hasil sintesis akan
kembali ke bentuk awalnya. Pengasaman dilakukan untuk mengubah garam
kalium-4-((2,6-dioksosikloheksilidena)metal)fenolat menjadi bentuk asamnya
kembali sehingga dapat mengendap karena jika masih dalam bentuk garamnya,
senyawa hasil sintesis akan terlarut dalam air. Endapan berupa serbuk yang
terbentuk kemudian disaring dengan kertas saring dan dicuci dengan aquades
untuk menghilangkan sisa asam dari HCl yang ditambahkan. Setelah itu,
dikeringkan dalam desikator selama 2 hari. Pengeringan selama 2 hari adalah
Gambar 7. Pembentukan garam dari senyawa hasil sintesis
Perhitungan rendemen hasil sintesis (crude product) dilakukan
berdasarkan serbuk hasil sintesis yang telah dikeringkan dalam desikator selama 2
hari. Hasil perhitungan menunjukkan bahwa jumlah senyawa yang dihasilkan dari
3 kali replikasi adalah 0,159g; 0,163g; dan 0,178g dengan rendemen crude
product masing-masing adalah 24,27%; 25,23%; dan 27,26%. Rendemen hasil
sintesis yang diperoleh relatif kecil. Dari hasil sintesis tersebut perlu dilakukan
analisis lebih lanjut untuk mengetahui apakah serbuk yang didapat merupakan
serbuk dari senyawa 2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion atau bukan.
B. Analisis Pendahuluan
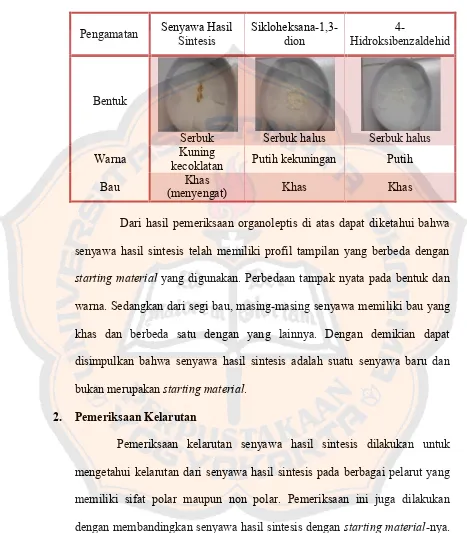
1. Pemeriksaan Organoleptis
Pemeriksaan organoleptis dilakukan berdasarkan tampilan dari
serbuk senyawa hasil sintesis. Pemeriksaan ini bertujuan untuk mengetahui
sifat fisik dari senyawa hasil sintesis. Pemeriksaan yang dilakukan meliputi
bentuk, warna, dan bau. Uji ini dilakukan dengan membandingkan senyawa
Tabel II. Hasil pemeriksaan organoleptis senyawa hasil sintesis dan
Serbuk Serbuk halus Serbuk halus
Warna Kuning
kecoklatan Putih kekuningan Putih
Bau Khas
(menyengat) Khas Khas
Dari hasil pemeriksaan organoleptis di atas dapat diketahui bahwa
senyawa hasil sintesis telah memiliki profil tampilan yang berbeda dengan
starting material yang digunakan. Perbedaan tampak nyata pada bentuk dan
warna. Sedangkan dari segi bau, masing-masing senyawa memiliki bau yang
khas dan berbeda satu dengan yang lainnya. Dengan demikian dapat
disimpulkan bahwa senyawa hasil sintesis adalah suatu senyawa baru dan
bukan merupakanstarting material.
2. Pemeriksaan Kelarutan
Pemeriksaan kelarutan senyawa hasil sintesis dilakukan untuk
mengetahui kelarutan dari senyawa hasil sintesis pada berbagai pelarut yang
memiliki sifat polar maupun non polar. Pemeriksaan ini juga dilakukan
dengan membandingkan senyawa hasil sintesis dengan starting material-nya.
Hasil dari pengujian ini dapat digunakan sebagai acuan dalam memilih
pelarut yang akan digunakan pada pengujian dengan kromatografi
Pada pemeriksaan kelarutan ini dilakukan dengan menggunakan
aquades, metanol, etanol, kloroform, etil asetat, dan n-heksan. Hasil dari
pemeriksaan kelarutan disajikan dalam tabel berikut:
Tabel III. Hasil pemeriksaan kelarutan senyawa hasil sintesis danstarting material-nya
Pelarut Senyawa Hasil
Aquades praktis tidak larut larut agak sukar larut
Metanol mudah larut mudah larut Larut
Etanol mudah larut mudah larut Larut
Kloroform sangat sukar larut larut agak sukar larut Etil asetat mudah larut mudah larut mudah larut
n-heksan praktis tidak larut praktis tidak larut praktis tidak larut
Pemeriksaan kelarutan dilakukan pada suhu kamar. Dari data hasil
pemeriksaan kelarutan tersebut, dapat diketahui bahwa senyawa hasil sintesis
memiliki profil kelarutan yang berbeda dengan starting material yang
digunakan. Senyawa hasil sintesis cenderung larut dalam pelarut yang kurang
polar (metanol, etanol, dan etil asetat), sedangkan dalam pelarut yang sifatnya
polar (aquades) dan non polar (n-heksan) justru tidak larut. Sifat senyawa
hasil sintesis yang cenderung kurang polar dipengaruhi oleh keberadaan
gugusan polar maupun non polar yang dimiliki. Walaupun sebagian besar
komponen penyusun dari senyawa
2-(4'-hidroksibenzilidena)sikloheksana-1,3-dion adalah kerangka karbon yang sifatnya cenderung non polar, namun
keberadaan gugus –OH fenolik dan dua gugus keton yang dimiliknya
mempengaruhi keseluruhan sifat dari senyawa hasil sintesis. Hasil
pemeriksaan kelarutan tersebut semakin memperkuat bahwa senyawa hasil