Tujuan Ranah Kompetensi Substansi Materi Implementasi dalam PBM(Hubungan dg KD)
C A P
1. Membentuk sikap positif terhadap kimia
dengan menyadari keteraturan dan keindahan
alam serta mengagungkan kebesaran Tuhan
Yang Maha Esa
2. Memupuk sikap ilmiah yaitu jujur, objektif,
terbuka, ulet, kritis, dan dapat bekerjasama
dengan orang lain
V
V
v
v
v
V
sikap positif
terhadap
kimia
dengan menyadari
keteraturan
dan
keindahan alam serta
mengagungkan
kebesaran Tuhan
Yang Maha Esa
sikap ilmiah yaitu
jujur,
objektif,
terbuka, ulet, kritis,
dan
dapat
bekerjasama dengan
orang lain
KD 1.2 (kelas X) 2.2 (kelas X) 3.1 (kelas XI) 4.1 (kelas XI) 1.1 (kelas XII) 2.2 (kelas XII) 3.2 (kelas XII) 3.4 (kelas XII)
eksperimen, dimana peserta didik melakukan
pengujian hipotesis dengan merancang
percobaan melalui pemasangan instrumen,
pengambilan, pengolahan dan penafsiran
data, serta menyampaikan hasil percobaan
secara lisan dan tertulis
4. Meningkatkan kesadaran tentang terapan
kimia yang dapat bermanfaat dan juga
merugikan bagi individu, masyarakat, dan
lingkungan serta menyadari pentingnya
mengelola dan melestarikan lingkungan
demi kesejahteraan masyarakat
5. Memahami konsep,prinsip, hukum, dan teori
kimia serta saling keterkaitannya dan
penerapannya untuk menyelesaikan masalah
dalam kehidupan sehari-hari dan teknologi.
V
V
V
V
V
V
ilmiah melalui percobaan
atau eksperimen, dimana
peserta didik melakukan
pengujian
hipotesis
dengan
merancang
percobaan
melalui
pemasangan instrumen,
pengambilan, pengolahan
dan penafsiran data, serta
menyampaikan hasil
percobaan secara lisan
dan tertulis
kesadaran
tentang
terapan kimia yang dapat
bermanfaat dan juga
merugikan bagi individu,
masyarakat,
dan
lingkungan
serta
menyadari pentingnya
mengelola
dan
melestarikan lingkungan
demi
kesejahteraan
masyarakat
konsep,prinsip, hukum,
dan teori kimia serta
saling keterkaitannya dan
penerapannya
untuk
menyelesaikan masalah
4.1 s/d 4.7 (kelas XI) 4.8 s/d 4.9 (kelas XI)
KD 3.2 (kelas X)
2.1 (kelas XII)
2.2 (kelas XII)
Mengetahui
Palembang, 12 Juli 2010
Kepala SMA Negeri 5 Palembang
Guru Mata Pelajaran
Drs. Agus Budiyanto, MM
1. Ernida yasin
NIP 19610801 199009 1 001
2. Dra. Hj. Agustina
Mata Pelajaran : Kimia Kelas : X
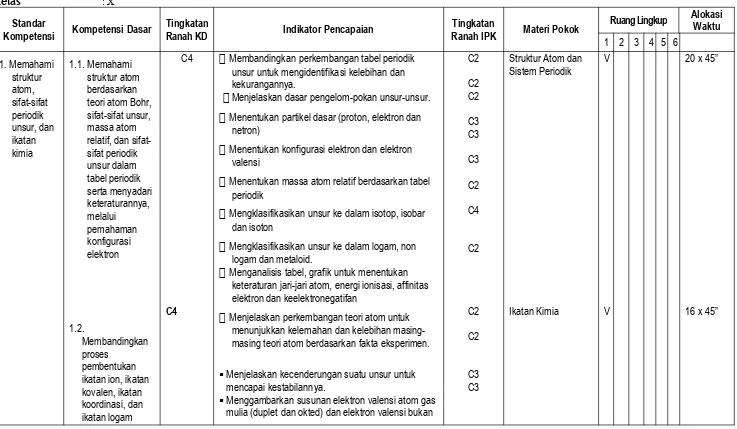
Standar
Kompetensi Kompetensi Dasar TingkatanRanah KD Indikator Pencapaian Ranah IPKTingkatan Materi Pokok
Ruang Lingkup AlokasiWaktu
1 2 3 4 5 6
1. Memahami struktur atom, sifat-sifat periodik unsur, dan ikatan kimia
1.1. Memahami struktur atom berdasarkan teori atom Bohr, sifat-sifat unsur, massa atom relatif, dan sifat-sifat periodik unsur dalam tabel periodik serta menyadari keteraturannya, melalui
pemahaman konfigurasi elektron
1.2.
Membandingkan proses
pembentukan ikatan ion, ikatan kovalen, ikatan koordinasi, dan ikatan logam
C4
C4
Membandingkan perkembangan tabel periodik
unsur untuk mengidentifikasi kelebihan dan kekurangannya.
Menjelaskan dasar pengelom-pokan unsur-unsur.
Menentukan partikel dasar (proton, elektron dan
netron)
Menentukan konfigurasi elektron dan elektron
valensi
Menentukan massa atom relatif berdasarkan tabel
periodik
Mengklasifikasikan unsur ke dalam isotop, isobar
dan isoton
Mengklasifikasikan unsur ke dalam logam, non
logam dan metaloid.
Menganalisis tabel, grafik untuk menentukan
keteraturan jari-jari atom, energi ionisasi, affinitas elektron dan keelektronegatifan
Menjelaskan perkembangan teori atom untuk
menunjukkan kelemahan dan kelebihan masing-masing teori atom berdasarkan fakta eksperimen.
Menjelaskan kecenderungan suatu unsur untuk mencapai kestabilannya.
Menggambarkan susunan elektron valensi atom gas mulia (duplet dan okted) dan elektron valensi bukan
C2
C2 C2
C3 C3
C3
C2
C4
C2
C2
C2
C3 C3
Struktur Atom dan Sistem Periodik
Ikatan Kimia
V
V
20 x 45”
1 2 3 4 5 6
2. Memahami hukum-hukum dasar kimia dan penerapan nya dalam perhitunga n kimia (stoikiomet ri)
serta
hubungannya dengan sifat fisika senyawa yang terbentuk
2.1.Mendeskripsika n tata nama senyawa anorganik dan organik sederhana serta persamaan reaksinya.
2.2. Membuktikan dan mengkomunikasikan
C4
gas mulia (struktur Lewis).
Menjelaskan proses terbentuknya ikatan ion.
Menjelaskan proses terbentuknya ikatan kovalen
tunggal, rangkap dua, dan rangkap tiga
Menjelaskan proses terbentuknya ikatan koordinasi
pada beberapa senyawa.
Menyelidiki kepolaran beberapa senyawa dan
hubungannya dengan keelektronegatifan melalui percobaan.
Mendeskripsikan proses pembentukan ikatan logam
dan hubungannya dengan sifat fisik logam.
Menghubungkan sifat fisis materi dengan jenis
ikatannya.
Menuliskan nama senyawa biner Menuliskan nama senyawa poliatomik Menuliskan nama senyawa organik sederhana Menyetarakan reaksi sederhana dengan diberikan
nama-nama zat yang terlibat dalam reaksi atau sebaliknya
Membuktikan Hukum Lavoisier melalui percobaan
C3
C4
C3
C4
C3 C3 C3 C4
Tata Nama
1 2 3 4 5 6
3. Memahami sifat-sifat larutan non-elektrolit dan elektrolit, serta reaksi oksidasi-redukasi
berlakunya hukum-hukum dasar kimia melalui percobaan serta menerapkan konsep mol dalam menyelesaikan perhitungan kimia.
3.1 Mengidentifikasi sifat larutan non-elektrolit dan elektrolit
berdasarkan data hasil percobaan.
3.2. Menjelaskan perkembangan konsep reaksi oksidasi- reduksi dan hubungannya dengan tata nama senyawa serta penerapannya.
C5
C5
C1
Membuktikan hukum Proust melalui percobaan
Menganalisis senyawa untuk membuktikan berlakunya hukum kelipatan perbandingan (hukum Dalton)
Menggunakan data percobaan untuk membuktikan hukum perbandingan volum (hukum Gay Lussac).
Menggunakan data percobaan untuk membuktikan hukum hukum Avogadro
Mengkonversikan jumlah mol dengan jumlah partikel, massa, dan volum zat.
Menentukan rumus empiris dan rumus molekul
Menentukan rumus air kristal
Menentukan kadar zat dalam suatu senyawa.
Menentukan pereaksi pembatas dalam suatu reaksi
Menentukan banyak zat pereaksi atau hasil reaks
Mengidentifikasi sifat-sifat larutan elektrolit dan non elektrolit melalui percobaan
Mengelompokkan larutan ke dalam larutan elektrolit dan non elektrolit berdasarkan sifat hantaran listriknya
Menjelaskan penyebab kemampuan larutan elektrolit menghantarkan arus listrik
Mendeskripsikan bahwa larutan elektrolit dapat berupa senyawa ion dan senyawa kovalen polar.
Membedakan konsep oksidasi reduksi ditinjau dari penggabungan dan pelepasan oksigen, pelepasan dan penerimaan elektron, serta peningkatan dan penurunan bilangan oksidasi.
Menentukan bilangan oksidasi atom unsur dalam senyawa atau ion.
Menentukan oksidator dan reduktor dalam reaksi redoks
Memberi nama senyawa menurut IUPAC
Mendeskripsikan konsep larutan elektrolit dan konsep redoks dalam memecahkan masalah lingkungan
C4 C4
C5 C4
C4
C5
C4
C4 C4 C4
C4, P2
C4
C2
C5
C2
C3
C3 C4
C3
Hukum Dasar Kimia
Larutan elektrolit dan nonelektrolit
Reaksi Reduksi Oksidasi
V
V
20 x 45”
6 x 45”
1 2 3 4 5 6
4. Memahami sifat-sifat senyawa organik atas dasar gugus fungsi dan senyawa makromolekul.
4.1 Mendeskripsikan kekhasan atom karbon dalam membentuk senyawa hidrokarbon
4.2 Menggolongkan senyawa hidrokarbon berdasarkan strukturnya dan hubungannya dengan sifat senyawa.
4.3 Menjelaskan proses
pembentukan dan teknik pemisahan fraksi-fraksi minyak bumi serta kegunaannya
C4
C2
C4
Mengidentifikasi unsur C, H, dan O dalam senyawa karbon melalui percobaan.
Mendeskripsikan kekhasan atom karbon dalam senyawa karbon
Membedakan atom C primer, sekunder, tertier dan kuarterner
Mengelompokkan senyawa hidrokarbon berdasarkan kejenuhan ikatan
Memberi nama senyawa alkana, alkena dan alkuna.
Menyimpulkan hubungan titik didih senyawa hidrokarbon dengan massa molekul relatifnya dan strukturnya.
Menentukan isomer struktur (kerangka, posisi, fungsi) atau isomer geometri (cis, trans)
Menuliskan reaksi sederhana pada senyawa alkana, alkena, dan alkuna (reaksi oksidasi, reaksi adisi, reaksi substitusi, dan reaksi eliminasi)
Mendeskripsikan proses pembentukan minyak bumi dan gas alam.
Menjelaskan komponen-komponen utama penyusun minyak bumi.
Menafsirkan bagan penyulingan bertingkat untuk menjelaskan dasar dan teknik pemisahan fraksi-fraksi minyak bumi.
Membedakan kualitas bensin berdasarkan bilangan oktannya.
Menganalisis dampak pembakaran bahan bakar terhadap lingkungan.
Mendeskripsikan kegunaan dan komposisi senyawa hidrokarbon dalam bidang pangan
Mendeskripsikan kegunaan dan komposisi senyawa hidrokarbon dalam bidang sandang dan papan.
Mendeskripsikan kegunaan dan komposisi senyawa hidrokarbon dalam bidang seni dan estetika.
C4
C4
C2
C2
C4 C4
C5
C4
C2
C2
C4
C2
C4
C3
C3
C3
Hidrokarbon dan
1 2 3 4 5 6
Mengetahui
Palembang, 12 Juli 2010
Kepala SMA Negeri 5 Palembang
Guru Mata Pelajaran
Drs. Agus Budiyanto, MM
1. Dra. Hj. Agustina
NIP 19610801 199009 1 001
NIP. 196008081987012001
2. Helmidiana, S.Pd
NIP. 197302112006042006
ANALISIS / PEMETAAN SK-KD
Mata Pelajaran : Kimia Kelas : XI IA
Standar
Kompetensi Kompetensi Dasar TingkatanRanah KD Indikator Pencapaian Ranah IPKTingkatan Materi Pokok
Ruang Lingkup AlokasiWaktu
1 2 3 4 5 6 1. Memahami
struktur atom untuk meramalka n sifat-sifat periodik
1.1 Menjelaskan teori atom Bohr dan mekanika kuantum untuk menuliskan konfigurasi elektron dan diagram orbital
C4
Menjelaskan teori atom mekanika kuantum.
Menentukan bilangan kuantum (kemungkinan elektron berada)
Menggambarkan bentuk-bentuk orbital.
Menjelaskan kulit dan sub kulit serta hubungannya dengan bilangan kuantum.
Menggunakan prinsip aufbau, aturan Hund dan azas larangan Pauli untuk menuliskan konfigurasi elektron dan
C3 C2
C3 C2
Teori atom Bohr dan mekanik kuantum.
Bilangan kuantum dan bentuk orbital.
Konfigurasi elektron (prinsip aufbau, aturan Hund dan
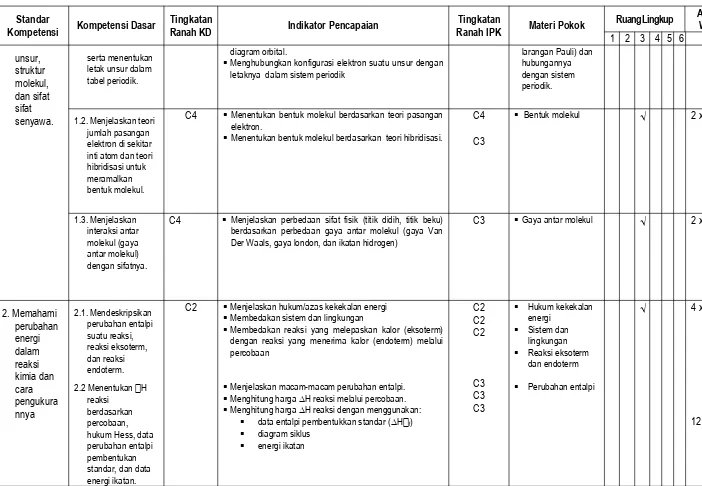
1 2 3 4 5 6 unsur,
struktur molekul, dan sifat sifat senyawa.
serta menentukan letak unsur dalam tabel periodik.
diagram orbital.
Menghubungkan konfigurasi elektron suatu unsur dengan letaknya dalam sistem periodik
larangan Pauli) dan hubungannya dengan sistem periodik.
1.2. Menjelaskan teori jumlah pasangan elektron di sekitar inti atom dan teori hibridisasi untuk meramalkan bentuk molekul.
C4 Menentukan bentuk molekul berdasarkan teori pasangan elektron.
Menentukan bentuk molekul berdasarkan teori hibridisasi.
C4
C3
Bentuk molekul √ 2 x 45’
1.3. Menjelaskan interaksi antar molekul (gaya antar molekul) dengan sifatnya.
C4 Menjelaskan perbedaan sifat fisik (titik didih, titik beku) berdasarkan perbedaan gaya antar molekul (gaya Van Der Waals, gaya london, dan ikatan hidrogen)
C3 Gaya antar molekul √ 2 x 45’
2. Memahami perubahan energi dalam reaksi kimia dan cara pengukura nnya
2.1. Mendeskripsikan perubahan entalpi suatu reaksi, reaksi eksoterm, dan reaksi endoterm. 2.2 Menentukan H
reaksi berdasarkan percobaan, hukum Hess, data perubahan entalpi pembentukan standar, dan data energi ikatan.
C2 Menjelaskan hukum/azas kekekalan energi
Membedakan sistem dan lingkungan
Membedakan reaksi yang melepaskan kalor (eksoterm) dengan reaksi yang menerima kalor (endoterm) melalui percobaan
Menjelaskan macam-macam perubahan entalpi.
Menghitung harga ∆H reaksi melalui percobaan.
Menghitung harga ∆H reaksi dengan menggunakan:
data entalpi pembentukkan standar (∆Hf)
diagram siklus
energi ikatan
C2 C2 C2
C3 C3 C3
Hukum kekekalan energi
Sistem dan lingkungan
Reaksi eksoterm dan endoterm
Perubahan entalpi
√ 4 x 45’
1 2 3 4 5 6
3. Memahami kinetika reaksi, kesetimbang an kimia, dan faktor-faktor yang mempengaru hinya, serta penerapanny a dalam kehidupan sehari-hari dan industri. 3.1 Mendeskripsikan pengertian laju reaksi dengan melakukan percobaan tentang faktor-faktor yang mempengaruhi laju reaksi.
C5 Menghitung konsentrasi larutan (molaritas larutan).
Menganalisis faktor-faktor yang mempengaruhi laju reaksi (konsentrasi, luas permukaan , suhu, dan katalis) melalui percobaan.
Menafsirkan grafik dari data percobaan tentang faktor-faktor yang mempengaruhi laju reaksi.
C2 C2
C2
Konsentrasi larutan (Kemolaran)
Faktor-faktor yang mempengaruhi laju reaksi
√ 4 x 45’
3.2. Memahami teori tumbukan
(tabrakan) untuk menjelaskan faktor-faktor penentu laju dan orde reaksi serta terapannya dalam kehidupan sehari-hari.
C3
Menjelaskan pengaruh konsentrasi, luas permukaan bidang sentuh, dan suhu terhadap laju reaksi berdasarkan teori tumbukan.
Membedakan diagram energi potensial dari reaksi kimia dengan menggunakan katalisator dan yang tidak menggunakan katalisator.
Menjelaskan pengertian, peranan katalisator dan energi pengaktifan dengan menggunakan diagram.
Menentukan orde dan waktu reaksi.
Menjelaskan peranan katalis dalam makhluk hidup dan industri. C2 C3 C3 C4 C2
Teori tumbukan
Orde reaksi
Peranan katalis dalam makhluk hidup dan industri. pada pergeseran kesetimbangan melalui percobaan
√ 10 x 45’
3.3. Menjelaskan kesetimbangan dan faktor-faktor yang mempengaruhi pergeseran arah kesetimbangan dengan melakukan percobaan.
C4 Menjelaskan kesetimbangan dinamis.
Menjelaskan kesetimbangan homogen dan heterogen.
Menjelaskan tetapan kesetimbangan.
Meramalkan arah pergeseran kesetimbangan dengan menggunakan azas Le Chatelier
Menganalisis pengaruh perubahan suhu, konsentrasi, tekanan, dan volum pada pergeseran kesetimbangan melalui percobaan C2 C2 C2 C3 C5 Kesetimbangan dinamiS
Faktor-faktor yang mempengaruhi arah pergeseran kesetimbangan.
1 2 3 4 5 6
3.4. Menentukan hubungan kuantitatif antara pereaksi dengan hasil reaksi dari suatu reaksi kesetimbangan.
C4 Menafsirkan data percobaan mengenai konsentrasi pereaksi dan hasil reaksi pada keadaan setimbang untuk menentukan derajat disosiasi dan tetapan kesetimbangan
Menghitung harga Kc berdasarkan konsentrasi zat dalam kesetimbangan
Menghitung harga Kp berdasarkan tekanan parsial gas pereaksi dan hasil reaksi pada keadaan setimbang
Menghitung harga Kc berdasarkan Kp atau sebaliknya.
C4
C4
C4
C4
Hubungan kuantitatif antara pereaksi dari reaksi kesetimbangan
√ 12 x 45’
3.5. Menjelaskan prinsip kesetimbangan dalam kehidupan sehari-hari dan industri
C2 Mengkaji kondisi optimum untuk memproduksi bahan-bahan kimia di industri yang didasarkan pada reaksi kesetimbangan melalui diskusi.
C2 Kesetimbangan dalam
industri √ 2 x 45’
4. Memahami sifat-sifat larutan asam-basa, metode pengukuran, dan terapannya.
4.1 Mendeskripsikan teori-teori asam basa dengan menentukan sifat larutan dan menghitung pH larutan.
C4 Menjelaskan pengertian asam dan basa menurut Arrhenius
Menjelaskan pengertian asam dan basa menurut Bronsted dan Lowry
Menuliskan persamaan reaksi asam dan basa menurut Bronsted dan Lowry dan menunjukkan pasangan asam dan basa konjugasinya
Menjelaskan pengertian asam dan basa menurut Lewis
C2 C2 C3 C2
Teori Asam Basa √ 20 x 45’
Mengidentifikasi sifat larutan asam dan basa dengan berbagai indikator
Memperkirakan pH suatu larutan elektrolit yang tidak dikenal berdasarkan hasil pengamatan trayek perubahan warna berbagai indikator asam dan basa.
Menjelaskan pengertian kekuatan asam dan menyimpulkan hasil pengukuran pH dari beberapa larutan asam dan basa yang konsentrasinya sama
Menghubungkan kekuatan asam atau basa dengan derajat pengionan ( α ) dan tetapan asam (Ka) atau
C4
C3
C3
C3
Sifat larutan asam dan basa.
Derajat Keasaman (pH)
Derajat ionisasi dan tetapan asam dan tetapan basa
1 2 3 4 5 6
tetapan basa (Kb)
Menghitung pH larutan asam atau basa yang diketahi konsentrasinya.
Menjelaskan penggunaan konsep pH dalam lingkungan.
C3
4.2 Menghitung banyaknya pereaksi dan hasil reaksi dalam larutan elektrolit dari hasil titrasi asam basa.
C4 Menentukan konsentrasi asam atau basa dengan titrasi
Menentukan kadar zat melalui titrasi.
Menentukan indikator yang tepat digunakan untuk titrasi asam dan basa
Menentukan kadar zat dari data hasil titrasi
Membuat grafik titrasi dari data hasil percobaan.
C3 C4 C4
C4 C4
Stoikiometri larutan
Titrasi asam dan basa
√ 8 x 45’
4.3 Mendeskripsikan sifat larutan penyangga dan peranan larutan penyangga dalam tubuh makhluk hidup.
C4 Menganalisis larutan penyangga dan bukan penyangga melalui percobaan.
Menghitung pH atau pOH larutan penyangga
Menghitung pH larutan penyangga dengan penambahan sedikit asam atau sedikit basa atau dengan pengenceran
Menjelaskan fungsi larutan penyangga dalam tubuh makhluk hidup
C4
C4 C4
C2
Larutan penyangga
pH larutan penyangga
Fungsi larutan penyangga
√ 10 x 45’
4.4 Menentukan jenis garam yang mengalami hidrolisis dalam air dan pH larutan garam tersebut
C4 Menentukan ciri-ciri beberapa jenis garam yang dapat terhidrolisis dalam air melalui percobaan
Menentukan sifat garam yang terhidrolisis dari persamaan reaksi ionisasi
Menghitung pH larutan garam yang terhidrolisis
C2
C2
C4
Hidrolisis garam
Sifat garam yang terhidrolisis
pH larutan garam yang terhidrolisis
√ 8 x 45’
4.5 Menggunakan kurva perubahan harga pH pada titrasi asam basa untuk
menjelaskan larutan penyangga dan hidrolisis
C4 Menganalisis grafik hasil titrasi asam kuat dan basa kuat, asam kuat dan basa lemah, asam lemah dan basa kuat untuk menjelaskan larutan penyangga dan hidrolisis.
C3 Grafik titrasi asam
1 2 3 4 5 6
4.6Memprediksi terbentuknya endapan dari suatu reaksi berdasarkan prinsip kelarutan dan hasil kali kelarutan.
C4 Menjelaskan kesetimbangan dalam larutan jenuh atau larutan garam yang sukar larut
Menghubungkan tetapan hasilkali kelarutan dengan tingkat kelarutan atau pengendapannya
Menuliskan ungkapan berbagai Ksp elektrolit yang sukar larut dalam air
Menghitung kelarutan suatu elektrolit yang sukar larut berdasarkan data harga Ksp atau sebaliknya
Menjelaskan pengaruh penambahan ion senama dalam larutan
Menentukan pH larutan dari harga Ksp-nya
Memperkirakan terbentuknya endapan berdasarkan harga Ksp
C2
C3
C3
C3
C4 C4 C4
Kelarutan dan Hasil
Kali Kelarutan √ 4 x 45’
5 .Menjelaskan sistem dan sifat koloid serta penerapanny a dalam kehidupan sehari-hari.
5.1. Membuat berbagai sistem koloid dengan bahan-bahan yang ada di sekitarnya.
C2 Menjelaskan proses pembuatan koloid melalui percobaan. C2 Pembuatan koloid
(cara kondensasi, dispersi, peptisasi)
√ 4 x 45’
5.2. Mengelompokkan sifat-sifat koloid dan penerapannya dalam kehidupan sehari-hari
C3 Mengklasifikasikan suspensi kasar, larutan sejati dan koloid berdasarkan data hasil pengamatan (effek Tyndall, homogen/heterogen, dan penyaringan)
Mengelompokkan jenis koloid berdasarkan fase terdispersi dan fase pendispersi
Mendeskripsikan sifat-sifat koloid (effek Tyndall, gerak Brown, dialisis, elektroforesis, emulsi, koagulasi)
Menjelaskan koloid liofob dan liofil
Mendeskripsikan peranan koloid di industri kosmetik, makanan, dan farmasi
C4
C2
C2
C2
C5
Sistem koloid
Sifat koloid
oPeranan koloid dalam kehidupan
√ 6 x 45’
Mengetahui
Palembang, 10 Juli 2010
ANALISIS / PEMETAAN SK-KD
Mata Pelajaran : KimiaKelas : XII Standar
Kompetensi Kompetensi Dasar TingkatanRanah KD Indikator Pencapaian Ranah IPKTingkatan Materi Pokok
Ruang Lingkup AlokasiWaktu
1 2 3 4 5 6
1.Menjelaskan sifat- sifat koligatif larutan non-elektrolit dan elektrolit
1.1 Menjelaskan penurunan tekanan uap, kenaikan titik didih, penurunan titik beku larutan, dan tekanan osmosis termasuk sifat koligatif larutan
1.2 Membandingkan antara sifat
C4
C4
Menghitung konsentrasi suatu larutan (kemolalan dan fraksi mol)
Menjelaskan pengertian sifat koligatif larutan non elektrolit (hukum Roulth) dan larutan elektrolit
Menjelaskan pengaruh zat terlarut yang sukar menguap terhadap tekanan uap pelarut
Menghitung tekanan uap larutan berdasarkan data percobaan
Mengamati penurunan titik beku suatu zat cair akibat penambahan zat terlarut melalui percobaan
Menghitung penurunan titik beku larutan elektrolit dan non elektrolit berdasarkan data percobaan
Mengamati kenaikan titik didih suatu zat cair akibat penambahan zat terlarut melalui percobaan
Menghitung kenaikan titik didih larutan elektrolit dan non elektrolit berdasarkan data percobaan
Menganalisis diagram PT untuk menafsirkan penurunan tekanan uap, penurunan titik beku dan kenaikan titik didih larutan
Menjelaskan pengertian osmosis dan tekanan osmosis serta terapannya
Menghitung tekanan osmosis larutan elektrolit dan non elektrolit
Menganalisis data percobaan untuk membandingkan sifat koligatif larutan elektrolit dan non elektrolit
C2
C1
C2
C3
C2
C3
C3
C4
C4
C3
C3
C4
Sifat Koligatif
1 2 3 4 5 6
2. Menerapkan konsep reaksi oksidasi-reduksi dan
elektrokimia dalam teknologi dan kehidupan sehari-hari
koligatif larutan non elektrolit dengan sifat koligatif larutan elektrolit yang konsentrasinya sama
berdasarkan data percobaan
2.1 Menerapkan konsep reaksi oksidasi-reduksi dalam sistem elektrokimia yang melibatkan energi listrik dan
kegunaannya dalam mencegah korosi dan dalam industri
2.2 Menjelaskan reaksi oksidasi-reduksi dalam sel elektrolisis
C3
C2
Menyetarakan reaksi redoks dengan cara setengah reaksi (ion elektron)
Menyetarakan reaksi redoks dengan cara perubahan bilangan oksidasi (PBO)
Menyimpulkan ciri-ciri reaksi redoks yang berlangsung secara spontan melalui percobaan
Menggambarkan susunan sel Volta atau sel Galvani dan menjelaskan fungsi tiap bagiannya
Menjelaskan bagaimana energi listrik dihasilkan dari reaksi redoks dalam sel Volta
Menuliskan lambang sel dan reaksi-reaksi yang terjadi pada sel Volta
Menghitung potensial sel berdasarkan data potensial standar
Menjelaskan prinsip kerja sel Volta yang banyak digunakan dalam kehidupan (baterai, aki dll)
Mengamati reaksi yang terjadi di anoda dan katoda pada reaksi elektrolisis melalui percobaan
Menuliskan reaksi yang terjadi di anoda dan katoda pada larutan atau cairan dengan elektroda aktif ataupun elektroda inert
Menjelaskan faktor-faktor yang mempengaruhi terjadinya korosi melalui percobaan
Menjelaskan beberapa cara untuk mencegah terjadinya korosi
C3
C3
C3
C2
C3
C2
C3
C2
C2
C3
C2
C2
Sel Elektrokimia
Elektrolisis
V
V
1 2 3 4 5 6
3. Memahami karakteristik unsur-unsur penting, kegunaan dan bahayanya, serta
terdapatnya di alam
2.3 Menerapkan hukum Faraday untuk elektrolisis larutan elektrolit
3.1.
Mengidentifikasikan kelimpahan unsur-unsur utama dan transisi di alam dan produk yang mengandung unsur tersebut.
3.2.Mendeskripsikan kecenderungan sifat fisik dan kimia unsur utama dan unsur transisi (titik didih, titik leleh, kekerasan, warna, kelarutan, kereaktifan, dan sifat khusus lainnya)
3.3.Menjelaskan manfaat, dampak dan proses pembuatan unsur-unsur dan
C3
C2
C2
C3
Menerapkan konsep hukum Faraday dalam perhitungan sel elektrolisis
Menuliskan reaksi elektrolisis pada penyepuhan dan pemurnian suatu logam
Mengidentifikasi keberadaan unsur-unsur yang ada di alam terutama di Indonesia (gas mulia, halogen, alkali, alkali tanah, aluminium, karbon, silikon, belerang, krom, tembaga, seng, besi, oksigen dan nitrogen)
Mengidentifikasi produk-produk yang mengandung zat tersebut
Mengidentifikasi sifat-sifat fisik unsur utama dan unsur transisi (titik didih, titik leleh, kekerasan, warna, kelarutan, dan sifat khusus lainnya)
Mengidentifikasi sifat-sifat kimia (kereaktifan, kelarutan) melalui percobaan
Mengidentifikasi daya pengoksidasi halogen dan daya pereduksi halida melalui percobaan
Mengidentifikasi reaksi nyala senyawa logam (terutama alkali dan alkali tanah) melalui percobaan
Mengidentifikasi keteraturan sifat fisik dan sifat kimia unsur-unsur periode ke tiga melalui percobaan
Menjelaskan cara menghilangkan kesadahan air melalui percobaan
Menjelaskan manfaat dan dampak unsur-unsur (seperti gas mulia, halogen, alkali, alkali tanah, aluminium, karbon, silikon, belerang, krom, tembaga, seng, besi, oksigen dan nitrogen) serta senyawanya dalam kehidupan sehari-hari dan industri.
C3
C3
C2
C2
C2
C2
C2
C2
C2
C2
C2
Hukum Faraday
Unsur-unsur Golongan Utama dan Transisi
Sifat Fisik dan Sifat Kimia Unsur
Manfaat Dan Dampak Unsur Dalam Kehidupan sehari-hari dan
V
V
V
1 2 3 4 5 6
4.Memahami senyawa organik dan reaksinya, benzena dan turunannya, dan
makromolekul.
senyawanya dalam kehidupan sehari-hari
3.4.Mendeskripsikan unsur-unsur radioaktif dari segi sifat-sifat fisik dan sifat-sifat kimia, kegunaan, dan bahayanya
4.1. Mendeskripsikan struktur, cara penulisan, tata nama, sifat, kegunaan, dan identifikasi senyawa karbon (halo alkana, alkanol, alkoksi alkana, alkanal, alkanon, alkanoat, dan alkil alkanoat)
4.2 Mendeskripsikan struktur, cara penulisan, tata nama, sifat, dan kegunaan benzena dan turunannya.
C2
C2
C2
Menjelaskan pembuatan unsur dan senyawanya di laboratorium dan industri (misalnya H2SO4, N2, Fe, Al,
NH3 dan O2)
Menentukan komposisi unsur dalam pupuk
Mendeskripsikan penemuan sinar radioaktif
Mengidentifikasi sifat-sifat sinar radioaktif
Menentukan pita kestabilan inti
Menuliskan persamaan reaksi inti
Mendeskripsikan kegunaan unsur-unsur radioaktif
Mendeskripsikan bahaya unsur-unsur radioaktif
Mengidentifikasi gugus fungsi senyawa karbon.
Menuliskan struktur dan nama senyawa karbon berdasarkan gugus fungsinya.
Menentukan isomer-isomer senyawa karbon.
Menjelaskan sifat fisik senyawa karbon.
Mendeskripsikan kegunaan senyawa karbon
Menuliskan struktur dan nama senyawa benzena dan turunannya.
Menjelaskan reaksi substitusi atom H pada cincin benzena
Menjelaskan pengertian ortho, meta dan para.
Mendeskripsikan sifat fisik dan sifat kimia benzen dan turunannya
Mendeskripsikan kegunaan dan bahaya senyawa benzena dan turunannya dalam kehidupan sehari-hari seperti fenol, anilin, butil hidroksi toluen (BHT), butil
C2
C3
C2 C2 C3 C3 C2 C2
C2 C2
C2 C2
C2
C2
C2 C2
C2
Industri
Radioaktif
Tata Nama Senyawa Karbon
Benzena dan turunannya
V
V
v
1 2 3 4 5 6
4.3 .Mendeskripsikan struktur, tata nama, penggolongan, sifat dan kegunaan makromolekul (polimer, karbohidrat, dan protein)
C3
hidroksi anisol (BHA), TNT, aspirin, dan zat warna (azo) dan lain-lain
Mengidentifikasi polimer alam dan polimer sintetik (karet, karbohidrat, protein, plastik)
Menjelaskan sifat fisik dan sifat kimia polimer
Menuliskan reaksi pembentukan polimer (adisi dan kondensasi) dari monomernya
Mendeskripsikan kegunaan polimer dan mewaspadai dampaknya terhadap lingkungan
Menggolongkan monosakharida menjadi aldosa dan ketosa.
Menjelaskan reaksi hidrolisis disakharida dan polisakharida dengan bantuan enzim.
Mengidentifikasi karbohidrat dengan reagen
Menuliskan rumus struktur asam amino esensial.
Menentukan gugus peptida pada protein
C2
C2 C4
C2
C3
C2
C2 C2 C2
Makromolekul v
Mengetahui
Palembang, 28 September 2010
ANALISIS SKL MATA PELAJARAN
Mata Pelajaran : .kimiaSKL Mapel TingkatanRanah Materi Pokok Penjabaran padaKD Ket.
1.Menganalisis strukutur atom ,sistim periodic unsure dan ika tan kimia untuk menentukan sifat-sifat unsure dan senyawa .
2.Menerapkan hokum-hukum dasar kimia untuk memecahkan masalah dalam perhitungan kimia .
3. Menjelaskan sifat-sifat larutan metode pengukuran dan Terapannya.
4.Memahami senyawa organic ,gugus fungsi dan reaksinya , Benzene dan turunannya ,makromolekul serta lemak.
5. Menentukan perubahan energi dalam reaksi kimia ,cara Pengukuran dan perhitungannya.
C3
C4
C2
C2
C2
Struktur atom , sistim periodic,ikatan kimia
Stoikiometri
Larutan,asam–basa,stoikiometri
larutan,penyangga,hidrolisis ,hasil kali kelarutan
Kimia karbon, gugus fungsi, benzene, makro molekul Dan lemak
Termokimia,
KD 1.1 KD 1.2 KD 1.1 KD 1.2
KD 2.1 KD 2.2 KD 2.3
KD 4.1 KD 4.2 KD 4.3 KD 4.4 KD 4.5 KD 4.6
KD 4.1 KD 4.2 KD 4.1 KD 4.2 KD 4.3 KD 4.4
KD 2.1 KD 2.2 KD 2.3
Kelas X Kelas X Kelas XI Kelas XI
Kelas X Kelas X Kelas X
Kelas XI Kelas XI Kelas XI Kelas XI Kelas XI Kelas XI
Kelas X Kelas X Kelas XII Kelas XII Kelas XII Kelas XII
6. Memahami kinetika reaksi ,kesetimbangan kimia ,dan factor yang mempengaruhinya ,serta penerapannya dalam ke hidupan sehari-hari dan industry.
7. Memahami reaksi oksidasi – reduksi dan sel elektrokimia serta penerapannya dalam teknologi dan kehidupan hari.
8.Memahami karakteristik unsure-unsur penting ,terdapat nya dialam ,pembuatan dan kegunaannya.
C4
C3
C2
Kenetika reaksi,kesetimbangan kimia
Reaksi redoks,sel elektrokimia
Kimia unsur
KD 3.1 KD 3.2 KD 3.3 KD 3.4 KD 3.5
KD 3.1 KD 2.1 KD 2.2 KD 2.3
KD 3.1 KD 3.2 KD 3.3 KD 3.4
Kelas XI Kelas XI Kelas XI Kelas XI Kelas XI
Kelas X Kelas XII Kelas XII Kelas XII
Kelas XII Kelas XII Kelas XII Kelas XII
Mengetahui
Palembang, 28 September 2010
Kepala SMA Negeri 5 Palembang
Guru Mata Pelajaran
Drs. Agus Budiyanto, MM