SINTESIS KITOSAN HIDROLISAT SECARA ENZIMATIS
MENGGUNAKAN ENZIM PAPAIN
Endang Susilowati
1,*, Maryani
2, Ashadi
3, Uswatun Hasanah
3 1Program Studi Pendidikan Kimia, FKIP, Universitas Sebelas Maret, Surakarta, Indonesia2Fakultas Kedokteran, Universitas Sebelas Maret, Surakarta, Indonesia
3Program Studi Pendidikan Kimia, FKIP, Universitas Sebelas Maret, Surakarta, Indonesia
email:endwati@yahoo.co.id
ABSTRAK
Kitosan hidrolisat merupakan hasil hidrolisis kitosan dengan berat molekul lebih kecil dari kitosan asalnya. Pada penelitian ini kitosan hidrolisat disintesis secara enzimatis menggunakan enzin papain pada suhu ruang. Karakterisasi kitosan hidrolisat meliputi derajad deasetilasi (DD) ditentukan berdasarkan spektra fourier transform infrared (FTIR) menggunakan baseline A, Berat molekul (BM) secara viskosimetri berdasarkan persamaan Mark Howink, kelarutan dengan spektrofotometer UV-Vis, kristalinitas menggunakan X-ray diffraction (XRD) dan sifat ketahanan termal dengan thermal gravimetric analysis (TGA). Hasil penelitian menunjukkan bahwa konsentrasi enzim berpengaruh terhadap BM tetapi tidak berpengaruh terhadap DD kitosan hidrolisat. Waktu hidrolisis enzimatis berpengaruh signifikan terhadap BM kitosan hidrolisat yang dihasilkan. Kitosan hidrolisat meningkat kelarutannya seiring dengan menurunnya berat molekul. Kitosan hidrolisat sedikit lebih bersifat kristalin dan memiliki ketahanan termal tidak berbeda dari kitosan asal.
Kata Kunci: Kitosan hidrolisat, enzim papain, berat molekul, derajad deasetilasi
PENDAHULUAN
Kitosan adalah nama lain dari β-(1,4)-2-amino-2-dioksi-D-glukosa, merupa-kan senyawa turunan dari kitin melalui proses deasetilasi dalam media basa kuat. Kitosan juga merupakan suatu polimer multifungsi karena mengandung tiga jenis gugus fungsi yaitu asam amino, gugus hidroksil primer dan sekunder. Adanya
gugus fungsi ini menyebabkan kitosan mempunyai reaktivitas kimia yang tinggi [1]. Sumber kitosan yang sangat potensial adalah kerangka luar crustaceae seperti kepiting, lobster, udang, dan sebagainya [2,3]. Kitosan bersifat biokompatibel, biodegradabel, tak beracun terhadap mammalia, menunjukkan sifat biologikal, fisiologikal, dan farmakologikal yang
SEMINAR NASIONAL KIMIA DAN PENDIDIKAN KIMIA VII
“Penguatan Profesi Bidang Kimia dan Pendidikan Kimia
Melalui Riset dan Evaluasi”
Program Studi Pendidikan Kimia Jurusan P.MIPA FKIP UNS
Surakarta, 18 April 2015
MAKALAH
menarik sehingga banyak dikaji dan diterapkan dalam bidang bahan pangan, kosmetik dan medis [4,5]
Kitosan hanya dapat dilarutkan padakisaran pH asam dan tidak dapat larut pada air dan alkali. Sehingga kitosan dengan berat molekul yang tinggi akan lebih sulit terserap secara in vivo. Oleh karena itu perlu dilakukan upaya untuk meningkatkan kelarutan kitosan. Kelarutan kitosan pada pH netral dan basa dapat ditingkatkan dengan cara menurunkan berat molekulnya. Kitosan dengan berat molekul 2-18 kDa dapat larut air pada kisaran pH yang netral [6].
Berat molekul kitosan dapat diturunkan dengan proses hidrolisis baik secara fisika, asam, maupun secara enzimatik. Hidrolisis dengan asam memiliki beberapa kekurangan yaitu rendemen produk yang rendah, dapat menyebabkan modifikasi pada produk yang tidak diharapkan serta limbahnya yang dapat mencemari lingkungan. Sedangkan hidrolisis secara enzimatik dapat mempertahankan sifat biologis aslinya dan menghasilkan rendemen yang lebih tinggi [7]. Hidrolisis secara enzimatik dapat dilakukan menggunakan enzim yang spesifik (kitosanase) dan non-spesifik seperti lisozim, selulase, lipase, amilase, papain, dan pektinase Penggunaan kitosanase masih memiliki keterbatasan yaitu sulit digunakan dalam skala besar dan mahal [8].
Enzim papain merupakan salah satu alternatif enzim non-spesifik yang menarik untuk digunakan mendegradasi polimer pada kitosan. Papain merupakan enzim sistein protease yang dapat diperoleh dari
isolasi penyadapan getah pepaya [9]. Getah pepaya (Carica papaya) mengandung sebanyak 10% papain, 45% kimopapain dan lisozim sebesar 20% [10]. Penggunaan papain untuk hidrolisis kitosan lebih ekonomis. Ketersedian papain lebih terjamin karena papain telah banyak digunakan sebagai pengempuk daging, pembuatan konsentrat protein, hidrolisat protein, dan berbagai industri lainnya.
Pada penelitin ini dilakukan dilakukan proses hidrolisis kitosan menggunakan enzim papain untuk mendapatkan kitosan dengan berat molekul yang lebih rendah yang selanjutnya disebut kitosan hidrolisat. Untuk mengetahui pengaruh variable yang terkait dengan proses hidrolisis mala dikaji pengaruh konsentrasi dan waktu hidrolisis terhadap berat molekul, derajad deasetilasi dan kelarutan kitosan hidrolisat yang dihasilkan.
METODE PENELITIAN
Alat dan bahan yang digunakan
Alat uang digunakan dalam penelitian adalah alat-alat gels, timbangan analitik, thermometer, pH meter, ayakan 100 mesh, viskosimeter Oswalt, spektrofotometer FTIR (Simadzu FTIR-8201 PC) , spektrofotometer UV-Vis (Shimadzu UV3150), X-ray diffraction (PW3 710) dan Thermal Gravimetry/ Differential
Thermal Analysis (TG /DTA) (perkin Elmer).
Bahan yang digunakan dalam penelitian ini antara lain adalah kitosan dengan berat molekul (BM) 1.077.919 Da dan rerajad deasetilasi (DD) 70,36 % disintesis dari limbah udang. Papain, natrium asetat (CH3COONa), asam asetat (CH3COOH), natrium hidroksida (NaOH)
dibeli dari Merck dan akuades (Sub Lab Kimia Lab Pusat UNS)
Pembuatan kitosan hidrolisat
Kitosan asal dilarutkan dalam buffer asetat (CH3COOH - CH3COONa, pH 4.5) sehingga konsentrasi kotosan 5.0 g/L. Enzim papain ditambahkan ke dalam larutan sehingga rasio papain/kitosan = 1:4, dan diinkubasi pada temperatur ruang dengan variasi waktu 1, 3, 5, 10, 15, 20, 25 dan 100 jam untuk waktu hidrolisis. Kemudian NaOH ditambahkan tetes demi tetes pada larutan sampai pH 8 dan diperoleh gel kitosan hidrolisat. Gel kemudian dicuci dengan air sampai netral dan kemudian disaring dan dikeringkan. Kitosan hidrolisat digerus dan disaring 100 mesh. Kitosan hidrolisat yang diperoleh dengan variasi waktu hidrolisis ini diberi kode KH1, KH3, KH5, KH19, KH15, KH20, KH25 dan KH100. Cara hidrolisis yang sama dilakukan dengan variasi rasio berat enzim papain terhadap kitosan yaitu 1:12, 1:10, 1:8, 1:4 dan 1:2 atau dalam prosentase (% enzim terhadap kitosan) adalah 8,33 %, 10 %; 12,5 %; 25 % dan 50 %. Sampel ini diberi kode A, B, KH-C, KH-D dan KH-E. Kitosan hidrolisat ini kemudian dikarakterisasi yang meliputi berat molekul, derajad deasetilasi, gugus fungsi, kelarutan, kristalinitas dan sifat termalnya.
Karakterisasi
Kelarutan ditentukan berdasar spektra UV-Vis diperoleh dari spektrofotometer Shimadzu UV3150 yang dioperasikan dalam mode transmitansi. Berat molekul kitosan hidrolisat diditentukan menggunakan metode
viskosimetri. Berat molekul dihitung melalui hubungan antara viskositas [η] dan berat molekul dalam persamaan Mark-Houwink. Derajat deasetilasi kitosan ditentukan dengan menggunakan metode spektroskopi inframerah. Derajat deasetilasi kitosan dapat dihitung dengan menggunakan base
line a yang diusulkan oleh Domzy dan
Robert [11]. Pengukuran metode difraksi sinar-X dilakukan dengan menggunakan sumber radiasi Cu Kα ( =1,54060 Ǻ) pada tegangan 40 kV dan arus 30 mA, logam filter nikel, scanning rate 5 /menit pada daerah 2θ 3-80°. Karakterisasi gugus fungsional dilakukan dengan spektrofotometer inframerah dengan metode pelet KBr. Pelet sampel diukur serapan inframerahnya pada bilangan gelombang 4000-400 cm-1. Karakter termal ditentukan menggunakan Thermal Gravimetry/Differential Thermal Analysis
(TG/DTA) (perkin Elmer) pada suhu 30 – 700 oC dengan kecepatan 10 oC / menit.
HASIL DAN PEMBAHASAN
Kitosan asal yang digunakan untuk pembuatan hidrolisat memiliki berat molekul sebesar 1.077.919,278 Da. Setelah dilakukan hidrolisis enzimatis, berat molekul kitosan asal menjadi semakin rendah seperti yang ditunjukkan pada Tabel 1 dan Tabel 2 yang kemudian ditunjukkan pada Gambar 1 dan 2. Penurunan berat molekul kitosan setelah hidrolisis enzimatis ini terjadi karena adanya pemutusan ikatan β-glikosidik pada rantai polimer kitosan menjadi lebih pendek dan berat molekul kitosan menjadi lebih rendah.
Tabel 1. BM Kitosan hidrolisat dengan variasi perbandingan massa enzim papain
No Sampel Enzim papain Berat Molekul (Da) 1 KH-A 8.33 % 261.822 2 KH-B 10 % 258.409 3 KH-C 12.5 % 256.420 4 KH-D 25 % 246.631 5 KH-E 50 % 243.658
Tabel 2. Berat molekul kitosan hidrolisat dengan variasi wakru hidrolisis
No Waktu (Jam) Sampel Berat Molekul (Da) 1 0 K 1.077.919 2 1 KH1 505.410 3 3 KH3 395.891 4 5 KH5 339.951 5 10 KH10 280.932 6 15 KH15 245.924 7 20 KH20 229.392 8 25 KH25 169.118 9 100 KH100 101.447
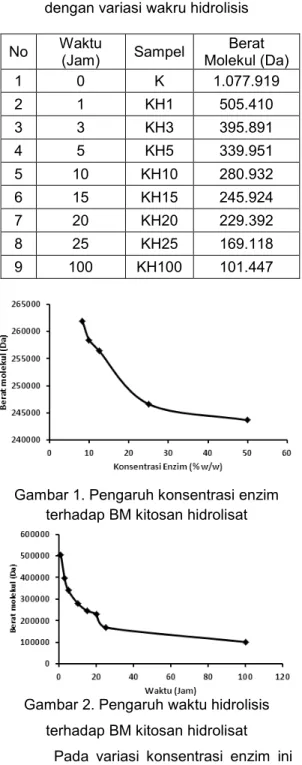
Gambar 1. Pengaruh konsentrasi enzim terhadap BM kitosan hidrolisat
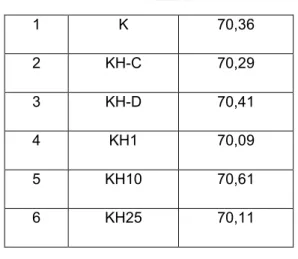
Gambar 2. Pengaruh waktu hidrolisis terhadap BM kitosan hidrolisat
Pada variasi konsentrasi enzim ini (Tabel 1), perbedaan perubahan berat molekul tidak terlalu signifikan (Gambar 1).
Kerja enzim pada hidrolisis enzimatis ini dipengaruhi oleh kosentrasi enzim dan substrat dalam reaksi. Besarnya konsentrasi enzim yang digunakan akan mempengaruhi banyaknya substrat yang ditransformasi. Dalam reaksi ini, dapat dikatakan bahwa semakin banyak enzim yang digunakan, maka akan semakin banyak ikatan glikosidik yang terputus. Penurunan berat molekul yang tidak terlalu signifikan dengan konsentrasi enzim yang semakin besar ini disebabkan enzim dihasilkan kembali ketika selesai reaksi.
Sedangkan pada variasi kedua, yaitu variasi waktu hidrolisis (Tabel 2) terjadi penurunan berat molekul yang bervariasi dimulai dari 1 jam hidrolisis sampai 100 jam hidrolisis. Perbandingan berat molekul kitosan. Berdasarkan perbandingan diatas, dapat dilihat bahwa semakin lama waktu hidrolisis maka berat molekul akan semakin kecil. Penuruan yang sangat tajam terjadi pada hidrolisis 1 jam, yaitu sebesar 572.508 Da. Kemudian bertambahnya waktu hidrolisis lebih lanjut menghasilkan penurunan berat molekul tidak terlalu besar seperti pada saat 1 jam pertama hidrolisis. Hal ini menunjukkan bahwa waktu hidrolisis enzimatis yang paling efektif adalah terjadi pada saat awal hidrolisis. Seperti pada penelitian Xie et al. [12] yang menunjukkan bahwa hidrolisis dilakukan selama 2 jam menunjukkan penurunan berat molekul yang lambat dibanding dengan awal reaksi. Hal ini dikarenakan adanya penurunan aktivitas enzim yang dapat menghambat reaksi pemutusan ikatan glikosidik pada kitosan, sehingga keadaan tersebut akan mempengaruhi reaksi hidrolisis enzimatis. Yang berperan dalam hidrolisis enzimatis
pada penelitian ini adalah enzim papain, sehingga dapat dikatakan juga bahwa enzim bekerja sangat efektif saat awal hidrolisis terjadi. Dari hasil penelitian ini maka diberikan saran untuk mendapatkan kitosan dengan berat molekul yang lebih rendah bisa dilakukan dengan cara hidrolisis berulang dengan waktu yang singkat. Kitosan dengan berat molekul yang rendah ini dapat diaplikasikan sebagai material menghambat pertumbuhan bakteri yang lebih efetktif [13, 14]. Kitosan berat molekul rendah (oligomer) juga di telah dilaporkan memiliki banyak aktivitas biologi seperti antimikroba, antikanker, antioksidan, dan efek imunostimulan yang tergantung pada sifat fisiko-kimianya [15]
Berdasarkan spektra FTIR maka nilai derajat deasetilasi dari kitosan hidrolisat dapat dilihat pada Tabel 3. Dari tabel 3 terlihat bahwa proses hidrolisis tidak mempengaruhi besarnya nilai DD. Hal ini berarti bahwa proses hidrolisis tidak mempengaruhi gugus asetil pada struktur kitosan. Hal ini menunjukkan bahwa tidak terdapat gugus asetil yang hilang setelah kitosan dihidrolisis. Pada prinsipnya, hidrolisis sendiri merupakan proses pemotongan ikatan β-glikosidik, sehingga akan terjadi pemotongan oligomer-oligomer kitosan dan bukan penghilangan gugus asetil dari kitosan. Berdasarkan analisis tersebut, menunjukkan bahwa kitosan hidrolisat memiliki gugus fungsional yang sama dengan kitosan asal.
Tabel 3. Pengaruh proses hidrolisis terhadap Derajad Deasetilasi (DD) kitosan
hidrolisat No Sampel DD (%) 1 K 70,36 2 KH-C 70,29 3 KH-D 70,41 4 KH1 70,09 5 KH10 70,61 6 KH25 70,11
Kelarutan Kitosan hidrolisat ditentukan berdasarkan nilai transmitasi dari spektrofotometer UV-Vis pada panjang gelombang 600 nm. Kitosan hidrolisat dikatakan larut sempurna jika memiliki transmitansi 100 %. Hasil pengamatan transmitasi untuk kitosan hidrolisat dalam variasi berat molekul dapat dilihat pada Tabel 4. Dari Tabel 4 terlihat bahwa kelarutan meningkat seiring dengan semakin rendahnya berat molekul kitosan. Kitosan awal dengan berat molekul tinggi bisa larut sempurna dalam larutan asam asetat 0,6 % (1.077.919,273 Da) sedangkan kitosan hidrolisat dengan berat molekul terendah (101.446,4841 Da) dapat larut sempurna dalam larutan asam asetat 0,2 % . Untuk mendapatkan kitosan hidrolisat yang larut air bisa dilakukan hidrolisis lanjut atau memodifikasi gugus samping dengan gugus yang lebih polar [16].
Tabel 4. Kelarutan kitosan hidrolisat dalam larutan asam asetat berdasar nilai transmitansi pada 600 nm NO Konsentrasi asam asetat (%) Transmitansi (%) K KH1 KH5 KH25 KH100 1 0,02 2,6 7,0 9,1 10,8 13,2 2 0,04 3,2 8,1 9,8 12,0 14,1 3 0,06 4,0 10,2 11,9 14,3 16,6 4 0,08 5,6 14,9 17,0 18,1 20,2 5 0,10 6,2 22,2 23,2 27,2 33,0 6 0.20 32,4 95,4 96,2 96,9 100,0 7 0.40 99,0 100,0 100,0 100,0 100,0 8 0.60 100,0 100,0 100,0 100,0 100,0 9 0.80 100,0 100,0 100,0 100,0 100,0 10 1,00 100,0 100,0 100,0 100,0 100,0
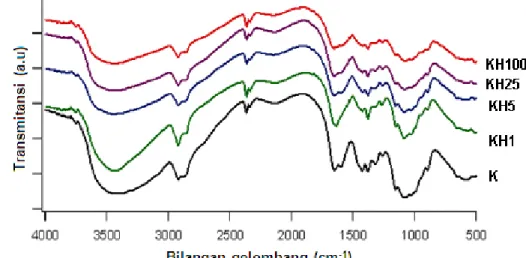
Analisis terhadap kitosan hidrolisat menggunakan spektrofotometer FTIR dengan hasil spektranya ditunjukkan pada Gambar 3. Dari Gambar 3 menunjukkan tidak adanya perbedaaan yang signifikan antara pita serapan kitosan asal dengan kitosan hidrolisat, karena memang kitosan hidrolisat memiliki gugus fungsi yang sama dengan kitosan asal. Melalui proses hidrolisis, kitosan hidrolisat hanya mengalami depolimerisasi atau pemutusan
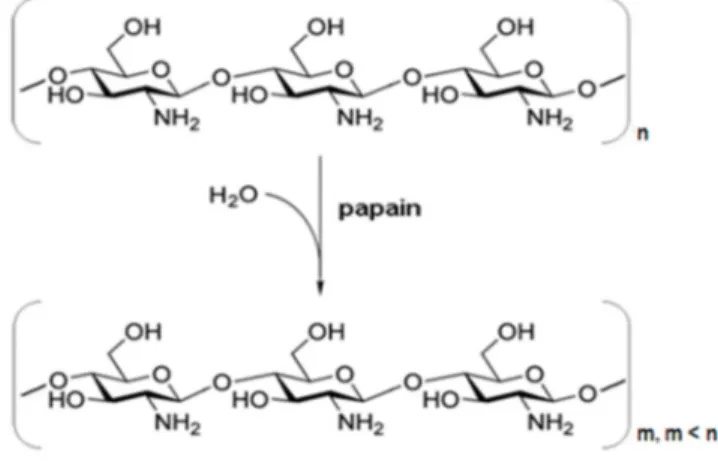
ikatan β-glikosidik, sehingga berat molekul yang dihasilkannya pun juga lebih rendah dibanding dengan kitosan asal. Gambar 4 menunjukkan bahwa kitosan asal. memiliki struktur yang sama dengan kitosan hidrolisat setelah proses hidrolisis. Yang membedakan pada kedua struktur kitosan tersebut adalah pada jumlah monomer pada kitosan. Kitosan hidrolisat memiliki jumlah oligomer yang lebih sedikit karena adanya pemutusan ikatan β-glikosidik.
Gambar 4. Reaksi Hidrolisis oleh Enzim Papain
Dari Gambar 4, dapat diidentifikasi gugus fungsi apa saja yang terdapat dalam kitosan dan kitosan hidrolisat. Spektra tersebut menunjukkan adanya pita serapan antara kitosan K, KH1, KH5, KH25 dan KH100 yang hampir sama, yaitu pada bilangan gelombang 3401,01 cm-1; 3441,01 cm-1; 3464,15 cm-1; dan 3417,86 cm-1. Serapan tersebut menunjukkan hasil vibrasi rentangan gugus –OH yang berikatan hidrogen. Serapan pada bilangan gelombang 2877,79 cm -1; 2877,79 cm -1; 2931,8 cm -1; dan 2854,6 cm-1 menunjukkan adanya gugus –CH dari alkana yang menunjukkan vibrasi ulur -CH2. Pada bilangan gelombang 1658,78 cm -1; 1658,78 cm -1; 1635,64 cm -1; dan 1635,64 cm-1 menunjukkan adanya gugus –C=O dari suatu amida. Sedangkan gugus fungsi –NH dari amina (-NH2) ditunjukkan oleh serapan bilangan gelombang pada 1594,06 cm -1; 1604,77 cm -1; 1604,77 cm-1; dan 1604,77 cm-1. Kemudian pita serapan 1080,14 cm -1; 1080,14 cm -1; 1080,14 cm-1; dan 1080,14 cm-1 menunjuk-kan adanya serapan oleh gugus fungsi -C-O.
Difraktogram kitosan dan kitosan hidrolisat dapat dilihat pada Gambar 5 yang menunjukkan bahwa terjadi peningkatan kristalinitas ketika terjadi proses hidrolisis kitosan. Munculnya puncak pada 2θ = 10,1o dan 20,1o merupakan karakter dari kitosan [17]. Kristainitas yang dihasilkan pada penelitian ini relatif tinggi untuk kitosan hidrolisat yang menunjukkan bahwa struktur kitosan hidrolisat lebih teratur dibandingkan dengan kitosan asal.
Gambar 5. Spektra difraksi XRD dari kitosan(K) dan kitosan hidrolisat (KH100)
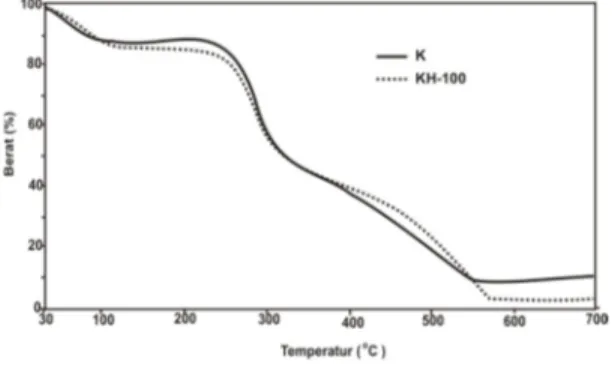
Analisis selanjutnya menggunakan termogravimetri seperti dilihat pada Gambar 6. Analisis ini dilakukan pada suhu antara 30 – 700 oC dengan kecepatan suhu
10 oC/menit.Pada termogram baik untuk sampel kitosan maupun kitosan hidrolisat terdapat tiga tahap utama penurunan berat. Penurunan berat pertama terjadi pada kisaran 30 – 110 oC yang mengindikasikan proses pelepasan air sebgai hasil penguapan. Pada proses ini terjadi penurunan berat sekitar 10 %. Penurunan berat kedua adalah sekitar 45 % yang terjadi pada suhu 110 – 370 oC yang berhubungan dengan pemutusan ikatan di luar cincin glukopiranosil yang menghasilkan senyawa volatile. Proses penurunan yang ketiga terjadi pada suhu 370 – 560 oC yang berkaitan dengan proses depolimerisasipembukaan cincin glukopiranosa dan reaksi pirolitik. Terjadi sedikit perbedaan sifat termal antara kitosa dan kitosan hidrolisat yaitu pada tahap ketiga dimana kitosan hidrolisat mengasilkan residu karbon yang lebih sedikit.
Gambar 6. Termogram TGA dari kitosan dan kitosan hidrolisat
KESIMPULAN
Hasil penelitian menunjukkan bahwa konsentrasi enzim pada rentang 8,33 sampai 50 % (w enzim/w kitosan) berpengaruh sedikit terhadap berat molekul tetapi tidak berpengaruh terhadap derajad deasetilasi (DD) kitosan hidrolisat. Waktu hidrolisis enzimatis
berpengaruh signifikan terhadap berat molekul (BM) kitosan hidrolisat yang dihasilkan. Kitosan hidrolisat meningkat kelarutannya seiring dengan menurunnya berat molekul dan semua produk kitosan hidrolisat dapat larut sempurna dalam larutan asam asetat 0,4 % (v/v). Berdasarkan analisis gugus fungsi, maka kitosan hidrolisat tidak berbeda secara signifikan dengan kitosan asal. Kitosan hidrolisat sedikit lebih bersifat kristalin dan memiliki ketahanan termal tidak berbeda dari kitosan asal.
DAFTAR PUSTAKA
[1] Chandy, T. and Sharma, C.P., 1990, Chitosan--as a biomaterial, Biomater. Artif. Cells Artif. Organs., 18(1):1-24.
[2] Du Y, Zhao Q, Dai S, Yang B. 2009. Preparation of water-soluble chitosan from shrimp shell and its antibacterial activity.
Innovative Food Sci Emerging Tech 10:
103-107.
[3] Khan, A.K., Peh, K.K. and Ch’ng H.S., 2002, Reporting degree of deacetilation values of chitosan: the influence of analytical methods, J. Pharm Pharmaceut
Sci., 5,3, 205-212.
[4] Kim, S.K. and Rajapakse, N., 2005, Enzymatic production and biological activities of chitosan oligosaccharides (COS): review. Carbohydr Polym 62: 357– 368.
[5] Kumar ABV, Tharanathan RN. 2004. Comparative study on depolymerization of chitosan by proteolytic enzymes. Carbohydr
Polym 58: 275–283.
[6] Kurita, K. 2006. Chitin and chitosan: functional bioploymers from marine
crustaceans. J Marine Biotechnol 8: 203-226.
[7] Li J, Du Y, Yang J, Feng T, Li A, Chen P. 2005. Preparation and characterisation of low molecular weight chitosan and chito-oligomers by a commercial enzyme. Polym
Degradation and Stability, 87: 441-448.
[8] Lin, S.B, Lin YC, Chen HH. 2009. Low molecular weight chitosan prepared with the aid of cellulase, lysozyme and chitinase: Characterisation and antibacterial activity.
Food Chem 116: 47–53.
[9] Muzzarelli R.A.A, Terbojevich, M, Muzzarelli, C., Francescangeli, O,. 2002. Chitosans depolymerized with the aid of papain and stabilized as glycosylamines.
Carbohydr Polym 50: 69–78.
[10] Qin, C., Du, Y., Xiao, L., Li, Z., and Gao, X., 2002, Enzymic Preparation of water-soluble chitosan and their antitumor activity,
International Journal of Biological
Macromolecules, 31: 111-117.
[11] Sashiwa, H., Kawasaki, N., Nakayama, A., Muraki, E., Yamamoto, N., and Aiba, S., 2002, Chemical modification of chitosan. 14:(1) Synthesis of water-soluble chitosan derivatives by simple acetylation,
Biomacromolecules, 3(5): 1126-8.
[12] Shahidi F, Arachchi JKV, Jeon YJ. 1999. Food application of chitin and chitosan.
Trends Food Sci Technol 10: 37-51
[13] Tajik, H., Moradi, M., Rohani, S. M. R., Erfani, A. M., and Jalali, F. S. S., 2008, Preparation of Chitosan from Brine Shrimp (Artemia urmiana) Cyst Shells and Effects of Different Chemical Processing Sequences on the Physicochemical and
Functional Properties of the Product, J.
Molec., 13: 1263-1274
[14] Tokura, S. and N. Nishi. 1995. Specification and Characterization of Chitin and Chitosan.Collection of Working Papers. 28. Universiti Kebangsaan Malaysia 8 : 67 – 78 [15] Warisno, 2003, Bududaya Pepaya,
Kanisius, Yogyakarta
[16] Winarno, F.G., 1986, Enzim Pangan, PT. Gramedia Pustaka Utama, Jakarta
[17] Xie, H., Jia, Z., Huang, J. and Zhang, C.,
2011. Preparation of Low Molecular Weight Chitosan by Complex Enzyme Hydrolysis. 2011. International Journal of Chemistry
Vol. 3 No. 2: 180-185
TANYA JAWAB
PENANYA : Sri Retno Dwi A. Pertanyaan :
a) Kitosan diambil dari kulit udang. Bagaimana preparasinya (dari kulit udang agar bisa menjadi kitosan)?
b) Enzim yang digunakan adalah papain. Dari mana papain tersebut?Apakah sudah diidentifikasi bahwa enzim tersebut merupakan enzim papain?
Jawaban :
a) Preparasinya lama dan sulit. Dari cangkang udang yang memiliki aroma kurang sedap tersebut dicuci terlebih dahulu. Lalu dijemur, dioven, dan diblender sehingga
menjadi serbuk. Kemudian dilakukan proses diproteinasi, dimineralisasi, dan diasetilasi. Untuk mendapatkan hasil yang lebih putih, bisa dilakukan proses dekolorisasi.
b) Enzim papain yang digunakan dalam penelitian ini merupakan enzim papain yang sudah ber-merk bukan buatan sendiri. Sebenarnya enzim papain berasal dari getah pepaya. Di masyarakat biasanya membungkus daging dengan daun pepaya sebelum dimasak agar dagingnya lebih empuk. Hal itu merupakan akibat dari enzim papain yang sedang bekerja pada daging. Dari situ bisa diidentifikasi bahwa enzim yang digunakan merupakan enzim papain.
PENANYA : Hamid Abdillah Pertanyaan :
a) Apa perbedaan papain pasaran dengan papain yang sudah ber-merk?
Jawaban :
a) Perbedaannya terletak pada derajat diasetilasi (DD) dan berat molekul.
PENANYA : Usman Pertanyaan :
a) Apa yang dimaksud dengan enzim nonspesifik?
Jawaban :
a) Dikatakan sebagai enzim nonspesifik karena enzim tersebut bisa bekerja pada berbagai substrat.