BAB II
TINJAUAN PUSTAKA
2.1 Tanaman Kakao
Kakao (Theobroma cacao L.) merupakan spesies penting famili Sterculiceae yang berasal dari daerah Amazon Amerika Selatan (Chat, 1953; Dinarti, 1991). Habitat asli tanaman kakao adalah hutan tropis dengan naungan pohon-pohon yang tinggi, curah hujan tinggi, suhu sepanjang tahun relatif sama, serta kelembaban tinggi yang relatif tetap.
Pada tahun 1528, coklat mulai diperkenalkan di wilayah Eropa oleh bangsa Spanyol dan mulai menyebar ke seluruh dunia sekitar abad ke-16 (Toussaint-Samat, 2009). Di Indonesia, kakao juga diperkenalkan oleh Spanyol pertama kali pada tahun 1560 di daerah Minahasa. Kakao mulai menyebar ke seluruh wilayah di Indonesia mulai akhir abad 18 dan menjadi komoditas perkebunan utama di Indonesia. Pada tahun 2012, Indonesia menjadi penghasil kakao terbesar kedua di dunia di bawah Pantai Gading dengan total produksi lebih dari 900 ribu ton (FAO, 2014).
2.1.1 Morfologi Kakao
disebut dengan dimorfisme. Cabang yang arah pertumbuhannya ke atas disebut cabang ortotrop, sedangkan cabang yang arah pertumbuhannya ke samping disebut cabang plagiotrop (Karmawati et al., 2010). Sistem perakaran tanaman kakao adalah akar tunggang dengan panjang dapat mencapai 8 meter ke arah samping dan 15 meter ke arah bawah (Backer & Bakhuizen van den Brink, 1963).
Daun kakao bersifat dimosfirme, yaitu daun pada cabang ortotrop memiliki tangkai daun yang panjang (sekitar 7,5 - 10 cm), sedangkan daun pada cabang plagiotrop memiliki tangkai daun yang pendek (sekitar 2,5 cm; Karmawati et al, 2010). Bentuk helai daun bulat memanjang (oblongus), ujung daun meruncing (acuminatus), dan pangkal daun runcing (acatus) (Backer & Bakhuizen van den Brink, 1963). Tanaman kakao memiliki permukaan daun licin dan mengkilap, sedangkan susunan tulang daun menyirip dan tulang daun menonjol kepermukaan bawah helai daun (van Steenis et al., 2008; Prawoto & Winarsih, 2010).
10.000 bunga, namun, hanya 30 – 60 bunga yang tumbuh dan berkembang menjadi buah yang masak (Backer & Bakhuizen van den Brink, 1963).
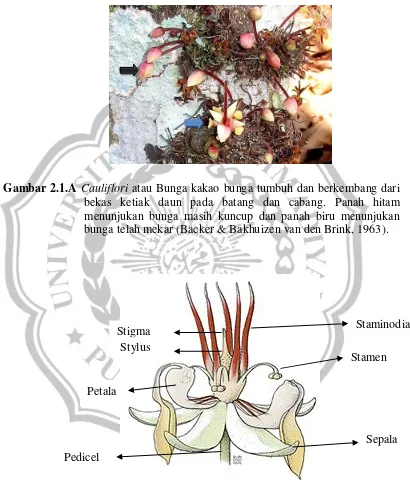
Gambar 2.1.A Cauliflori atau Bunga kakao bunga tumbuh dan berkembang dari bekas ketiak daun pada batang dan cabang. Panah hitam menunjukan bunga masih kuncup dan panah biru menunjukan bunga telah mekar (Backer & Bakhuizen van den Brink, 1963).
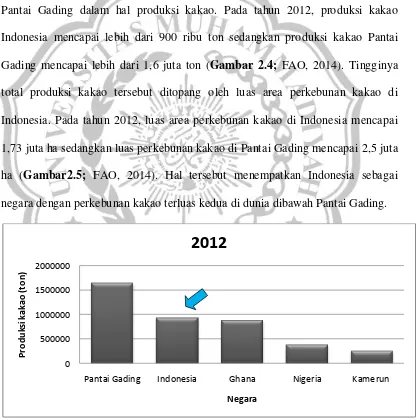
Gambar 2.1.B Diagram bunga yang telah mekar yang menunjukkan posisi staminodia, petala, dan bagian bunga yang lain (Susanto, 1994).
Staminodia
Sepala Stigma
Stylus
Petala
Pedicel
Buah kakao terdiri atas kulit buah (pod), arilus (pulp), dan biji. Kulit buah kakao terdiri dari tiga lapisan yaitu lapisan eksokarp, mesokarp, dan endokarp (Limbongan, 2012). Biji tersusun dalam lima baris mengelilingi poros buah dan memiliki jumlah yang beragam yaitu sekitar 20 – 50 butir per buah (Karmawati et al., 2010). Warna buah kakao beraneka ragam, namun pada dasarnya warna buah kakao ada dua macam yaitu buah muda berwarna hijau putih dan bila sudah matang warna berubah menjadi kuning, dan buah muda yang berwarna merah setelah buah matang warna berubah menjadi oranye (Susanto, 1994).
2.1.2 Kultivar Kakao
Terdapat tiga kultivar utama kakao yang sering dibudidayakan oleh petani yaitu criollo, forastero, dan trinitario (Susanto, 1994). Kultivar criollo (Gambar 2.2 A - D) memiliki ciri kulit buah tipis dan mudah diiris dengan 10 alur yang letaknya berselang-seling antara lima alur agak dalam dan lima alur dangkal. Ujung buah umumnya berbentuk tumpul dan sedikit bengkok. Setiap buah berisi 30 – 40 biji yang bentuknya agak bulat sampai bulat dengan endosperm yang berwarna putih. Kakao criollo memiliki pertumbuhan yang kurang kuat dengan kemampuan produksi yang relatif rendah (Susanto, 1994).
kultivar forastero memiliki citarasa yang kurang disukai dibandingkan dengan kultivar criollo (Susanto, 1994).
Kultivar trinitario (Gambar 2.2 I - L) adalah kakao hasil persilangan antara kakao criollo dengan forestero. Kakao kultivar ini memiliki sifat yang sangat heterogen dan beragam (Susanto, 1994).
Gambar 2.2.Tiga kultivar kakao di dunia, A - D. criollo E - H. forastero dan I - L trinitario (Susanto, 1994). Sumber gambar http://worldstandards.eu/chocolate%20-%20cacao.html
2.1.3 Manfaat Kakao
Bagian utama dari tanaman kakao yang banyak dimanfaatkan oleh petani adalah bagian buahnya. Kulit buah kakao dapat dimanfaatkan sebagai pakan ternak hewan ruminansia (Murni & Okrisandi, 2012), berpotensi menjadi sumber
G C
B
A E
D
F
H
I J
bioetanol, sumber zat pewarna, pupuk organik maupun bahan baku pembuatan kompos (Dachlan et al., 2009; Wulan, 2011). Biji kakao merupakan bagian terpenting dari buah kakao. Biji kakao dapat diolah menjadi cocoa liquor, cocoa butter dan bubuk coklat yang dapat diolah lebih lanjut menjadi beraneka ragam makanan dan minuman seperti ice cream, biskuit maupun cake (Gambar 2.3 B; Zairisman, 2006).
Gambar 2.3 A. Bubuk coklat. B - F Produk olahan biji coklat. Sumber dari http://ilmubakery2.blogspot.com/
2.2 Budidaya Kakao dan Permasalahan Kakao di Indonesia
2.2.1 Budidaya Kakao
Kakao (Theobroma cacao L.) merupakan salah satu komoditas andalan perkebunan yang memiliki peran penting bagi perekonomian Indonesia. Dalam
D
B A
E
C
hal penyedia lapangan pekerjaan, perkebunan kakao berhasil menyerap tenaga kerja sampai sekitar 900 ribu kepala keluarga pada tahun 2002 (Balitbang Pertanian Departemen Pertanian, 2005). Kakao juga penyumbang devisa terbesar ke tiga di sub sektor perkebunan setelah kelapa sawit dan karet dengan nilai sebesar US $ 1,2 milyard pada tahun 2010 (FAO, 2014).
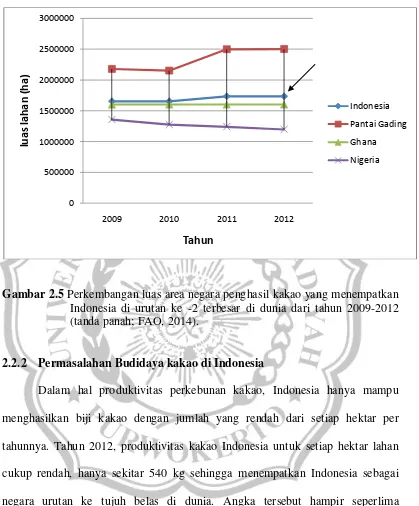
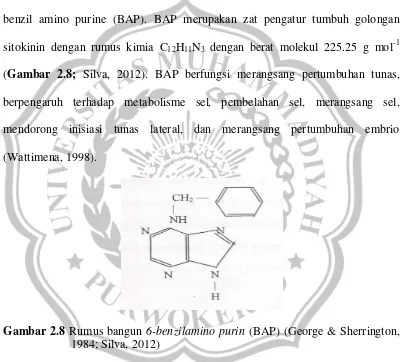
Dalam hal produksi, Indonesia menjadi negara terbesar kedua di bawah 1,73 juta ha sedangkan luas perkebunan kakao di Pantai Gading mencapai 2,5 juta ha (Gambar2.5; FAO, 2014). Hal tersebut menempatkan Indonesia sebagai negara dengan perkebunan kakao terluas kedua di dunia dibawah Pantai Gading.
Gambar 2.5 Perkembangan luas area negara penghasil kakao yang menempatkan Indonesia di urutan ke -2 terbesar di dunia dari tahun 2009-2012 (tanda panah; FAO, 2014).
2.2.2 Permasalahan Budidaya kakao di Indonesia
Dalam hal produktivitas perkebunan kakao, Indonesia hanya mampu menghasilkan biji kakao dengan jumlah yang rendah dari setiap hektar per tahunnya. Tahun 2012, produktivitas kakao Indonesia untuk setiap hektar lahan cukup rendah, hanya sekitar 540 kg sehingga menempatkan Indonesia sebagai negara urutan ke tujuh belas di dunia. Angka tersebut hampir seperlima produktivitas negara Guatemala dan Thailand yang mencapai lebih dari 2,6 ton per hektar per tahunnya (Gambar 1.1; FAO, 2014).
mengakibatkan menurunnya produktivitas kakao sekitar 0,2 – 0,3 kg per pohon per tahun (Taufik et al.,2010). Dengan kondisi tanaman kakao yang sudah tua tersebut maka harus segera dilakukan peremajaan dengan tujuan meningkatkan produktivitas tanaman kakao (Taufik et al., 2010). Faktor utama lainnya yang diduga menyebabkan rendahnya produktivitas kakao di Indonesia adalah kualitas bibit yang kurang baik (Goenadi, 2005). Oleh karena hal tersebut diperlukan upaya untuk memproduksi bibit kakao dalam jumlah yang massal dengan kualitas yang unggul.
2.2.3 Pembibitan Tanaman Kakao
Pada saat ini kebanyakan para petani memperoleh bibit kakao secara generatif atau melalui biji. Biji kakao yang dipanen dari tanaman kakao yang unggul dibersihkan dan dikeringkan sampai kadar air sekitar 40%. Biji yang kering selanjutnya dikecambahkan selama kurang lebih 12 hari. Benih yang telah dikecambahkan kemudian ditanam di lahan dengan pemeliharaan sekitar 4-5 bulan (Rahardjo, 2011).
kepalasari sehingga serbuk sari tidak mampu membuahi putik dari kuntum yang sama (Prawoto, 2008). Sebagai akibatnya keturunan yang diperoleh dari perbanyakan generatif akan bervariasi (Maximova et al., 2002).
Alternatif lain yang dapat digunakan untuk menghasilkan bibit yang seragam secara genetik adalah dengan cara perbanyakan bibit secara vegetatif seperti stek, cangkok, okulasi dan sambung pucuk (Gambar 2.6; Winarsih et al., 2003). Pembibitan kakao melalui stek dilakukan dengan cara memotong pucuk atau batang yang masih muda kemudian ditanam pada media tanam (Gambar 2.6; Siregaret al., 2010). Stek akan mulai muncul akar setelah tanaman berumur sekitar 3 minggu dan setelah berumur sekitar 6 bulan tanaman siap digunakan sebagai bibit (Rahardjo, 2010).
Gambar 2.6 Perbanyakan tanaman secara vegetatif dengan cara A. Stek B. Okulasi C. Sambung pucuk. Sumber gambar A dari http://yogas09.student.ipb.ac.id/perbanyakan-pembiakan-tanaman-plant-propagation/; sumber gambar B dan C dari http://biologiez.blogspot.com/2010/11/perbanyakan-tanaman.html
Pembibitan kakao melalui stek mampu menghasilkan bibit dengan sifat genetis yang sama dengan induk tanaman serta mampu menghasilkan buah yang lebih cepat dibandingkan dengan teknik pembibitan generatif (Siregar et al., 2010). Namun, tingkat keberhasilan pembibitan kakao menggunakan stek masih rendah (sekitar 27%; Abdoellah, 2008). Disamping itu teknik stek hanya mampu menghasilkan bibit yang terbatas serta dapat merusak tanaman induk (Rahardjo, 2010).
Perbanyakan vegetatif lainnya yang dapat digunakan dalam menghasilkan bibit kakao adalah melalui okulasi. Okulasi merupakan metode perbanyakan vegetatif dengan menempelkan mata tunas dari pohon kakao yang berkualitas ke batang bawah bibit, kemudian mengikat dengan plastik agar mata tunas tidak terlepas (Gambar 2.6; Rahardjo, 2010). Bibit okulasi siap tanam ke lahan setelah berumur 4 - 5 bulan. Teknik okulasi mempunyai tingkat keberhasilan tinggi (sekitar 90%; Rahardjo, 2010), bibit yang dihasilkan seragam dengan induknya (Siregar et al., 2010), namun jumlah bibit yang dihasilkan terbatas dan dapat mengakibatkan kerusakan pada tanaman induknya (Wahyudi et al., 2008).
2011), bibit yang dihasilkan seragam dan sama dengan induknya, namun jumlah bibit yang dihasilkan terbatas dan dapat mengakibatkan kerusakan pada tanaman induknya (Li et al.,,1998).
Mengingat teknik pembibitan konvensional masih memiliki banyak kendala, maka alternatif pembibitan kakao dibutuhkan untuk menghasilkan bibit dalam jumlah yang banyak dengan sifat genetik yang seragam.
2.3 Perkembangan Penelitian Embriogenesis Somatik Kakao
Salah satu teknik pembibitan yang dapat digunakan untuk menghasilkan bibit kakao dalam jumlah yang banyak dengan sifat genetika yang seragam dan sama dengan induknya adalah melalui teknik kultur jaringan tanaman. Kultur jaringan tanaman merupakan teknik perbanyakan tanaman dengan cara mengisolasi bagian tanaman dan ditumbuhkan pada media tanam buatan yang aseptis (Hendaryono & Wijayani, 1994). Teknik kultur jaringan mempunyai keunggulan yaitu dapat memperbanyak tanaman dalam jumlah besar dengan waktu yang singkat serta menghasilkan bibit yang seragam dengan induknya (Avivi et al., 2010). Namun teknik ini memerlukan keahlian khusus, dan lingkungan yang aseptis sehingga harus dilakukan di laboratorium, serta tidak semua tanaman dapat diperbanyak menggunakan teknik kultur jaringan (Hendaryono & Wijayani, 1994).
massal serta memiliki beberapa kendala seperti tumbuhan yang dihasilkan memiliki pertumbuhan yang lambat dan memiliki akar serabut (Zulkarnain, 2011). Teknik kultur tunas aksiler juga belum berhasil untuk diaplikasikan pada tanaman kakao (Figuera et al., 1991)
Salah satu teknik kultur jaringan yang mulai dikembangkan untuk menyediakan bibit kakao secara massal adalah teknik embriogenesis somatik (Wahyudi et al., 2008). Embriogenesis somatik merupakan salah satu metode perbanyakan tanaman secara klonal yang memungkinkan sekumpulan sel untuk berpoliferasi, multiplikasi, membentuk embrio somatik dan berdiferensiasi membentuk tanaman sempurna (Santos et al., 2005). Embrio somatic dapat dicirikan dari strukturnya yang bipolar, yaitu mempunyai dua calon meristem, yaitu meristem akar dan meristem tunas. Dengan memiliki struktur tersebut maka perbanyakan melalui embriosomatik lebih menguntungkan daripada pembentukan tunas adventif yang unipolar.
karena tempat yang digunakan harus aseptis (Purnamaningsih, 2002). Disamping itu, kelemahan utama dari perbanyakan tanaman kakao melalui teknik embriogenesis somatik adalah tingkat keberhasilan yang sangat bervariasi mulai dari 1 sampai 100% tergantung genotip yang digunakan (Li et al., 1998). Oleh karena itu, pengembangan teknik embriogenesis somatik sangat dibutuhkan guna menghasilkan bibit kakao berkualitas unggul.
Dalam pelaksanaannya, embriogenesis somatik dilakukan melalui empat tahap, yaitu (1) induksi kalus, (2) induksi embrio somatik, (3) perkecambahan, dan (4) aklimatisasi bibit yang dihasilkan dengan kondisi lingkungan ex vitro (Gambar 2.7; Li et al., 1998). Pada tahap induksi kalus, medium tanam ditambah dengan zat pengatur tumbuh golongan auksin dengan konsentrasi yang tinggi agar terinduksi sekelompok sel membentuk kalus (Purnamaningsih, 2002). Kalus terbentuk karena luka pada eksplan sebagai respons terhadap hormon baik endogen maupun eksogen. Terdapat dua macam kalus yang umum terbentuk pada tahapan ini, yaitu kalus embrionik dan kalus non-embrionik (Winarsih et al., 2003). Kalus embriogenik memiliki ciri berwarna kekuningan, berbentuk nodul, sel yang berukuran kecil, sitoplasma padat, inti besar, vakuola kecil-kecil dan mengandung butir pati, sedangkan kalus non-embriogenik memiliki ciri-ciri sel berukuran besar, sitoplasma tidak padat, inti kecil, vakuola yang besar dan tidak mengandung butir pati (Purnamaningsih, 2002).
Pemindahan kalus dari medium dengan konsentrasi auksin tinggi ke medium dengan penambahan auksin yang rendah akan menyebabkan sel-sel mengalami morfogenesis membentuk kelompok sel menyerupai ernbrio pada biji. Pada umumnya, embrio somatik mulai terbentuk setelah kalus dipelihara di dalam medium induksi embrio selama 2 - 32 minggu (Winarsih et al., 2003; Traore et al., 2003). Tahapan pembentukan embrio dimulai dari fase globular, hati, torpedo dan kotiledon (Gambar2.7; Purnamaningsih, 2002).
Pada tahap perkecambahan, embrio yang yang terbentuk kemudian dikecambahkan untuk menjadi tanaman lengkap dengan penambahan zat pengatur tumbuh dengan konsentrasi yang sangat rendah atau bahkan tidak ditambah dengan zat pengatur tumbuh (Purnamaningsih, 2002). Tahap akhir dalam embriogenesis somatik adalah aklimatisasi, yaitu bibit tanaman yang diperoleh dipindahkan dari lingkungan dengan kondisi in vitro ke lingkungan ex vitro (Purnamaningsih, 2002).
Gambar 2.7 Tahap perkembangan morfologi embrio somatik kakao; (a) embriosomatik kakao pada tahap globular; (b) embrio somatik kakao tahap hati; (c) embrio somatik kakao tahap torpedo; (d)
A
D
C B
embrio somatik kakao tahap kotiledon; (e) planlet; dan (f) aklimatisasi planlet (Li et al., 1998)
Banyak tanaman berhasil diperbanyak menggunakan teknik embriogenesis somatik seperti pada tanaman kacang tanah (Arachis hipogaea L.; Srilestari, 2005), kopi arabika (Coffea Arabica L.; Priyono, 1993), rotan (Calamus manan Miq.;Gunawan dan Wiendi, 1992), kedelai (Glycine max L.; Ratnadewi et al., 1996), jahe (Zingiber officinale Roscoe; Abdillah, 2013), teh (Camellia sinensis L.; Tahardi et al., 2003), jambu mete (Anacardium occidentale L.; Mariska, 1996), cendana (Santalum album L.; Sukmadjaja, 2005), dan lada liar (Piper nigrumL.; Husni et al., 1997).
Pada tanaman kakao, teknik embriogenesis somatik juga telah dicobakan untuk digunakan dalam produksi bibit. Namun demikian, tingkat keberhasilan teknik embriogenesis somatik masih relatif rendah sehingga tanaman kakao digolongkan ke dalam tanaman yang sulit diperbanyak secara in vitro (recalcitrant).
1997). Namun demikian, faktor genetis secara nyata berpengaruh dalam pembentukan embrio somatik kakao Alemanno et al. (1996) membuktikan hanya 5 klon dari 25 klon kakao yang diuji mampu menghasilkan embrio somatik sedangkan sisanya tidak berhasil diperbanyakan menggunakan teknik embriogenesis somatik (Winarsih et al., 2003).
Upaya peningkatan keberhasilan induksi embrio somatik kakao juga telah dilakukan dengan menggunakan beberapa medium dasar seperti medium MS (Murashige dan Skoog, 1962) dan medium DKW (Driver & Kuniyuki, 1984). Hasil penelitian yang dilakukan Alemanno et al (1996) menunjukkan bahwa medium MS hanya berhasil menginduksi embrio somatik dengan tingkat keberhasilan kurang dari 11%, sedangkan medium DKW memiliki tingkat keberhasilan yang bervariasi mulai dari 4 – 70% tergantung genotip yang digunakan (Maximova et al., 2002).
2.4 Medium Tanam
Salah satu faktor penentu keberhasilan dalam kultur jaringan adalah pemberian nutrisi dalam jumlah dan perbandingan yang tepat ke dalam medium tanam (Yusnita, 2003). Medium yang digunakan dalam kultur in vitro tumbuhan ada bermacam-macam. Beberapa medium dasar yang banyak digunakan dalam kultur jaringan adalah medium dasar MS (Murashige & Skoog, 1962) yang banyak digunakan untuk kultur kalus dan regenerasi hampir semua jenis kultur, medium dasar B5 (Gamborg, 1968) yang banyak digunakan untuk kultur suspensi
banyak digunakan untuk kultur kalus tanaman dikotil dan monokotil, medium dasar WPM (Woody Plant Medium, 1981) yang banyak digunakan untuk kultur jaringan tanaman berkayu, dan medium dasar DKW (Driver & Kuniyuki, 1984) yang banyak digunakan untuk kultur embrio somatik pada tanaman kakao (Hendaryono & Wijayanti, 1994).
Pada umumnya, medium tanam terdiri atas senyawa makronutrien, mikronutrien, gula, zat pengatur tumbuh dan vitamin serta asam-asam amino.
2.4.1 Makronutrien
Unsur hara makro dibutuhkan dalam jumlah cukup besar. George & Sherrington (1984) menyebutkan beberapa persenyawaan makronutrien yang umum digunakan pada medium kultur jaringan, antara lain nitrogen (N), kalium (K), kalsium (Ca), fosfor (P), magnesium (Mg), dan sulfur (S) (George & Klerk, 2008; Nursyamsi, 2010). Unsur - unsur hara makro yang diberikan ke dalam medium tanam biasanya berupa KNO3, NH4NO3, MgSO4.7H2O, NaH2PO4.H2O,
KH2PO4, KCl, KNO3, KH2PO4. CaCl2.2H2O, dan Ca(NO3)2.4H2O (Zulkarnain,
2011).
2.4.2 Mikronutrien
Klerk, 2008; Nursyamsi, 2010). Unsur-unsur hara mikro yang diberikan dalam medium tanam biasanya berupa MnSO4.4H2O, ZnSO4.4H2O, H3BO3, KJ,
NaMoO4.2H2O, CuSO4.5H2O dan CoCl2.6H2O (Zulkarnain, 2011)
2.4.3 Gula
Selain unsur hara makro dan mikro, dalam medium kultur harus memiliki bahan-bahan lain yang berguna sebagai sumber karbon dan energi bagi tanaman (Pierik, 1987). Pada medium kultur ditambahkan gula yang berguna sebagai sumber energi dan karbon. Penambahan gula tersebut disebabkan sel dan jaringan tumbuhan belum terbentuk sempurna sehingga untuk proses asimilasi autotrof diperlukan asupan energi dan karbon yang berasal dari luar. Gula yang biasanya digunakan adalah sukrosa atau komponen-komponennya yang meliputi monosakarida, glukosa atau fruktosa (Katuuk, 1989; Purnamaningsih, 2002).
2.4.4 Zat Pengatur Tumbuh
Zat Pengatur Tumbuh (ZPT) merupakan senyawa organik baik berupa hormon maupun senyawa sintetik dalam konsentrasi sangat rendah yang mampu mendukung, menghambat, atau menimbulkan respon bagi tumbuhan (Salisbury & Ross, 1995). Secara umum ada lima kelompok ZPT yang digunakan dalam kultur jaringan, yaitu auksin, sitokinin. giberelin, etilen, dan asam absisat (Salisbury & Ross, 1995).
mempunyai peranan yang penting yaitu meningkatkan keberhasilan pembelahan sel, ploriferasi pucuk, morfogenesis pucuk, perkecambahan biji (Zulkarnain, 2011). Pemberian sitokinin dalam konsentrasi yang relatif tinggi akan merangsang pembentukan tunas (Hendaryono & Wijayanti, 1994).
Salah satu sitokinin yang sering digunakan dalam kultur jaringan adalah benzil amino purine (BAP). BAP merupakan zat pengatur tumbuh golongan sitokinin dengan rumus kimia C12H11N3 dengan berat molekul 225.25 g mol-1
(Gambar 2.8; Silva, 2012). BAP berfungsi merangsang pertumbuhan tunas, berpengaruh terhadap metabolisme sel, pembelahan sel, merangsang sel, mendorong inisiasi tunas lateral, dan merangsang pertumbuhan embrio (Wattimena, 1998).
Gambar 2.8 Rumus bangun 6-benzilamino purin (BAP) (George & Sherrington, 1984; Silva, 2012)
lebih baik dibandingkan dengan penambahan sitokinin yang lain yaitu adenin (Hilyatunnisa, 2013). Oleh karena itu dalam penelitan ini ditambahkan BAP ke dalam medium tanam guna merangsang pembentukan embrio somatik tanaman kakao.
2.4.5 Vitamin dan Asam Amino
Vitamin merupakan senyawa penting yang berfungsi sebagai perantara dalam reaksi biokimia atau sebagai katalis dalam berbagai jalur biokimia (Abrahamian & Kantharajah, 2011). Vitamin mempunyai peran penting dalam kultur jaringan tumbuhan. Penambahan vitamin pada pada medium tanam berfungsi untuk mempercepat pertumbuhan, diferensiasi kalus dan embrio, pertumbuhan dan perkembangan akar (George & Sherrington, 1984). Hal tersebut karena vitamin berperan penting sebagai kofaktor atau bagian dari molekul kofaktor yang penting dalam reaksi-reaksi biokimia di dalam sel. Vitamin yang umum digunakan pada medium dasar antara lain myo-inositol, thiamin (B1), asam
nikotinat, dan piridoksin (B6) (Srilestari, 2005).
Myo-inositol merupakan bagian dari polyhydroxylated sikloalkana yang dikenal secara umum sebagai cyclitol dengan formula C6H12O6 (Barnejee et al.
2007). Myo-inositol berfungsi untuk memperbaiki pertumbuhan dan morfogenesis, berperan dalam lintasan biosintesis asam D-galakturonat yang menghasilkan vitamin C dan pektin, dan menstimulir pertumbuhan sel. Pemberian myo-inositol pada kultur jaringan anggrek terbukti mampu meningkatkan tinggi dan jumlah plantlet, meningkatkan panjang dan lebar daun serta meningkatkan pertumbuhan panjang akar planlet. Hal tersebut disebabkan karena myo-inositol berperan penting dalam mendorong proses diferensiasi dan mempercepat pembelahan sel (Widiastoety et al., 2008).
Thiamin (B1) merupakan vitamin yang berfungsi mempercepat
pembelahan sel pada meristem akar tetapi tidak berpengaruh terhadap pemanjangan sel. Thiamin juga berperan sebagai koenzim dalam proses respirasi jaringan tanaman yang dikulturkan (Agrawal, 1989). Fungsi lain dari thiamin adalah sebagai kofaktor dalam berbagai reaksi enzimatik termasuk jalur pentosa fosfat, glikolisis, siklus asam trikarboksilat (TCA), piruvat dehidrogenase komplek, transketolase, dan piruvat dekarboksilase (Abrahamian & Kantharajah, 2011). Pada kultur jaringan anggrek, penambahan thiamin ke dalam medium tanam mampu meningkatkan aktivitas respirasi sel sehingga pertumbuhan tanaman menjadi normal (Widiastoety et al., 2008).
Asam nikotinat dikenal dengan nama niasin atau vitamin B3 yang
merupakan senyawa organik dengan rumus kimia C6H5NO2 (Pudjaatmaka, 2002).
komponen koenzim nikotinamida adenin dinukleotida (NAD) dan nikotinamida adenin dinukleotida fosfat (NADP) dan berperan sebagai kofaktor berbagai oksidoreduktase yang terlibat dalam glikolisis dan metabolisme asam lemak (Suha, 2014). Penambahan asam nikotinat ke dalam medium tanam terbukti mampu meningkatkanterbentuknya embrio somatik pada tanaman kedelai (Glycine max L.) (Barwale et al., 1986; Abrahamian & Kantharajah, 2011)
Piridoksin adalah nama lain dari vitamin B6 yang merupakan kofaktor
dalam berbagai reaksi metabolisme asam amino, termasuk diantaranya proses transaminasi, deaminasi, dan dekarboksilasi (Lestari, 2012). Penambahan piridoksin ke dalam medium tanam terbukti meningkatkan terbentuknya akar pada tanaman tomat (Solanum lycopersicum L.) (George et al, 2008).
Glisin adalah asam amino yang paling sering ditambahkan pada medium kultur jaringan dan mempunyai peran meningkatkan pertumbuhan sel serta memperlancar metabolisme (Setiawan, 2008). Penambahan glisin ke dalam medium tanam terbukti meningkatkan terbentuknya akar pada tanaman anggrek (Widiastoety et al., 2008).
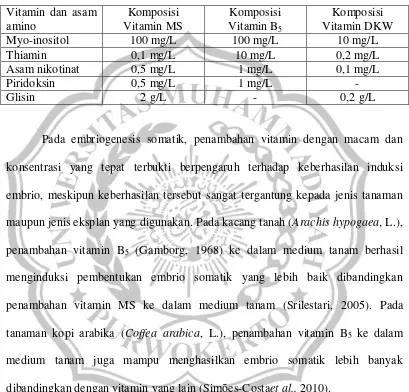
1968) dan vitamin DKW (Driver & Kuniyuki, 1984). Ketiga jenis vitamin tersebut memiliki perbedaan seperti yang terdapat pada Tabel 2.1
Tabel 2.1 Perbandingkan komposisi vitamin dan asam amino yang terkandung di dalam medium tanam
Pada embriogenesis somatik, penambahan vitamin dengan macam dan konsentrasi yang tepat terbukti berpengaruh terhadap keberhasilan induksi embrio, meskipun keberhasilan tersebut sangat tergantung kepada jenis tanaman maupun jenis eksplan yang digunakan. Pada kacang tanah (Arachis hypogaea, L.), penambahan vitamin B5 (Gamborg, 1968) ke dalam medium tanam berhasil
menginduksi pembentukan embrio somatik yang lebih baik dibandingkan penambahan vitamin MS ke dalam medium tanam (Srilestari, 2005). Pada tanaman kopi arabika (Coffea arabica, L.), penambahan vitamin B5 ke dalam
medium tanam juga mampu menghasilkan embrio somatik lebih banyak dibandingkan dengan vitamin yang lain (Simões-Costaet al., 2010).
Pada tanaman kakao, penambahan vitamin B5 ke dalam medium tanam