Abstrak—Proses absorpsi dengan reaksi kimia gas CO2 memakai larutan K2CO3 atau hot potassium carbonate dan bahan aktivator seperti DEA, MEA sangat luas dipakai di industri kimia. Salah satu proses CO2 removal yang umum diaplikasikan di industri adalah proses Benfield, proses ini terdiri dari proses absorpsi dan proses stripping gas CO2. Data kesetimbagan fase uap-cair sistem CO2-K2CO3 -DEA-H2O dan CO2-K2CO3-MEA-H2O dibutuhkan untuk perancangan yang rasional dan operasi yang optimal dari unit CO2 removal. Penelitian ini bertujuan untuk memprediksi data solubilitas gas CO2 di dalam larutan potasium karbonat dengan promotor DEA dan MEA pada variasi tekanan yaitu 1 atm dan 30 atm serta temperatur 30°C, 50°C dan 70°C pada komposisi 30% K2CO3–2% DEA dan 40°C dan 60°C dengan komposisi 22% K2CO3– 13% MEA dengan menggunakan model elektrolit UNIQUAC. Perhitungan ini menggunakan program Matlab. Validasi hasil perhitungan dengan data eksperimen pada sistem CO2-K2CO3-DEA-H2O didapatkan ARD sebesar 1,38% untuk suhu 30°C , 17,89% untuk suhu 50°C dan 29,09% suhu 70°C. Sedangkan pada sistem CO2-K2CO3-MEA-H2O didapatkan ARD program terhadap eksperimen sebesar 33,1% untuk suhu 40°C , 42,1% untuk suhu 60°C. Untuk tekanan tinggi ARD sebesar 32,7%. Pada penelitian ini, kenaikan CO2 loading menyebabkan kenaikan kelarutan CO2 dan tekanan parsial CO2. Kenaikan temperatur menyebabkan kenaikan tekanan parsial CO2. Kenaikan tekanan menyebabkan kenaikan kelarutan CO2, CO2 loading, dan tekanan parsial CO2.
Kata kunci : model elektrolit-UNIQUAC, sistem CO2 -K2CO3-DEA-H2O, sistem CO2-K2CO3-MEA-H2O, kesetimbangan fase uap-cair
I. PENDAHULUAN
as karbondioksida (CO2) merupakan gas asam (acid gas), karena sifatnya yang asam yang sangat merugikan. Berbagai industri petrochemical, bahan bakar minyak, dan gas alam, pada prosesnya memerlukan pemisahan gas CO2. Hal ini dikarenakan sifat asamnya itu, dengan adanya uap air, maka akan semakin korosif dan dapat merusak bagian dalam utilitas pabrik dan sistem perpipaan. Adanya uap air akan mengasamkan CO2 menjadi H2CO3 yang sangat korosif. Dalam pabrik sintesa ammonia, CO2 harus dipisahkan dari gas proses untuk menghindari keracunan promotor sintesa ammonia.
Namun demikian, gas CO2 yang telah dipisahkan tersebut diupayakan untuk ditangkap agar dapat dimanfaatkan dan mengurangi penumpukan Gas Rumah Kaca di atmosfer yang menyebabkan pemanasan global. Namun hanya sebagian kecil saja CO2 yang dimanfaatkan, diantaranya adalah sebagai bahan baku pembuatan urea, industri minuman berkarbonat (minuman ringan), industri logam dan karoseri sebagai pendingin pada pengelasan logam (welding) dan pengecoran, industri makanan sebagai media pengawetan sayuran, buah-buahan, gabah, daging dan lain-lain.
Metode absorpsi adalah metode pemisahan CO2 dari aliran gas yang paling ekonomis. Absorpsi CO2 dengan larutan kimia atau fisika adalah teknologi yang dikembangkan dengan baik dan telah diaplikasikan pada berbagai proses komersial, termasuk pemurnian gas dan produksi Ammonia. Banyak penelitian telah dilakukan pada teknologi ini lebih dari 50 tahun yang lalu, terutama pada pengembangan pengetahuan terhadap spesifikasi dan karakteristik dari jenis pelarut. Sebagai contoh yang telah banyak dipublikasikan yaitu jenis pelarut seperti amine. Sedangkan pengembangan pengetahuan mengenai campuran pelarut yang kompleks masih sedikit dilakukan, di mana teknologi ini merupakan teknologi yang paling efektif. Salah satu proses absorpsi/stripping yang banyak dipakai dan dikembangkan adalah dengan sirkulasi larutan kimia. Proses semacam ini banyak dipakai pada produksi ammonia dan pemurnian gas alam. Sedangkan untuk proses absorpsi fisika biasanya diaplikasikan pada tekanan yang tinggi. Beberapa pelarut yang umum digunakan yaitu Selexol, Rectisol, dan Purisol. Karena pelarut fisika tidak bereaksi dengan CO2, maka pelarut tidak terkonsumsi (tidak berkurang). Sebagai tambahan, panas absorpsi dibatasi pada enthalpy absorpsi fisika, yang mana nilainya jauh lebih rendah dibandingkan dengan menggunakan pelarut yang reaktif. Proses dibatasi oleh selektivitas dan laju absorpsi yang rendah. Pada tahun 2004, Cullinane et al [9] melakukan penelitian mengenai Data thermodinamik dan kinetik untuk larutan K2CO3 dengan promotor PZ. Penambahan PZ mengurangi tekanan parsial Kesetimbangan CO2, meningkatkan Laju absorpsi CO2, dan menaikkan panas absorpsi. Pada tahun 2008, Winarno et al [7] melakukan penelitian mengenai Proses absorpsi disertai reaksi kimia gas CO2 memakai larutan K2CO3 dan promotor DEA dengan korelasi ENRTL. Kenaikan konsentrasi CO2 dalam gas umpan
Prediksi Solubilitas Gas CO
2
Di Dalam Larutan
Potassium Karbonat Dan Amine (DEA, MEA)
Menggunakan Model Elektrolit UNIQUAC
Yuni Kurniati, Panca Setyawati Utami, Kuswandi, dan Winarsih
Jurusan Teknik Kimia, Fakultas Teknologi Industri, Institut Teknologi Sepuluh Nopember (ITS)
Jl. Arief Rahman Hakim, Surabaya 60111 Indonesia
e-mail: kuswandi@chem-eng.its.ac.id
pada temperatur konstan akan menyebabkan kenaikan CO2 loading, kadar KHCO3, kadar CO2 dalam larutan, tekanan parsial kesetimbangan CO2 , dan penurunan kadar K2CO3. Pada tahun 2011, Aronu et al [10] melakukan penelitian mengenai VLE CO2 pada larutan aqueous MEA untuk 15, 30, 45, dan 60% massa MEA pada suhu 40-120⁰C, dan memodelkannya menggunakan extended UNIQUAC framework. Model memberikan representasi yang bagus dari data VLE percobaan untuk tekanan parsial CO2 dan tekanan total untuk semua konsentrasi MEA dengan average absolute relative deviation (AARD) masing-masing 24,3% dan 11,7%. Sedangkan data solubilitas fisik direpresentasikan dengan AARD 2,7%. Sedangkan pada tahun 2012, Thee et al [11] melakukan penelitian mengenai evaluasi reaksi kinetik absorpsi CO2 kedalam larutan K2CO3 dengan promotor MEA pada kondisi seperti yang terjadi pada industri CO2 capture plant. pada 63⁰C, penambahan MEA pada jumlah kecil 1,1 M (5% berat) dan 2,2 M (10% berat) mempercepat laju overall absorpsi CO2 pada 30% berat pelarut K2CO3 dengan faktor masing-masing 16 dan 45.
II. METODOLOGI
Metode penelitian yang dilakukan terdiri dari beberapa tahap. Pertama, studi literatur yaitu mencari data, serta persamaan yang digunakan dalam perhitungan.
Tahap kedua, yaitu membuat program perhitungan koefisien aktivitas dengan menggunakan persamaan Elektrolit UNIQUAC dan validasi program dengan menggunakan data eksperimen. Tahap ketiga, yaitu fitting parameter interaksi UNIQUAC. Selanjutnya, estimasi fraksi uap CO2 dan CO2 loading perhitungan, disesuaikan dengan eksperimen hingga error minimum. Langkah terakhir yaitu melakukan simulasi dengan menggunakan parameter yang telah didapat. Simulasi dilakukan dengan komputasi menggunakan bahasa program MATLAB.
III. HASIL DAN PEMBAHASAN a. Validasi Program
Validasi program dilakukan untuk menguji keakuratan program yang telah dibuat. Hal ini dilakukan dengan membandingkan tekanan parsial CO2 dan CO2 loading hasil perhitungan program yang telah dibuat dengan hasil perhitungan tekanan parsial CO2 dan CO2 loading oleh Osman [1] dan Altway [3].
Pada validasi Program metode elektrolit UNIQUAC digunakan persamaan ARD (Average Relative Deviation) dalam menghitung deviasi. ARD dihitung berdasarkan persamaan : exp 1 exp 2 2 2
)
/
(
1
CO cal CO n i COP
P
P
n
ARD
=
∑
−
= (1)Berikut ini adalah grafik hasil validasi program pada sistem biner dengan menggunakan metode UNIQUAC :
Gambar 1. Hubungan antara Tekanan Parsial CO2 terhadap CO2 Loading pada 362,1 K dan 50% Berat DEA
Gambar 2. Hubungan antara Tekanan Parsial CO2 terhadap CO2 Loading pada 303,15 K dengan 30% Berat K2CO3 dan 2% Berat MDEA
Gambar 3. Hubungan antara Tekanan Parsial CO2 terhadap CO2 Loading pada 303,15 K dengan 30% Berat K2CO3 dan 5% Berat MDEA
menunjukkan bahwa program yang dibuat cukup akurat. Keakuratan program dapat dilihat dari kesamaan profil grafik perhitungan program pada penelitian ini dengan eksperimen Osman et al [1] dan Finalis et al [2]. Hal ini dapat ditunjukkan dengan deviasi yang lebih kecil yaitu 5,914% (Altway et al [3]) dan 4,585% (penelitian ini) untuk sistem dengan komposisi 30% K2CO3 dan 2% MDEA. Sedangkan untuk komposisi 30% K2CO3 dan 5% MDEA, nilai deviasinya 14,18% (Altway et al [3]) dan 11,069% (penelitian ini).
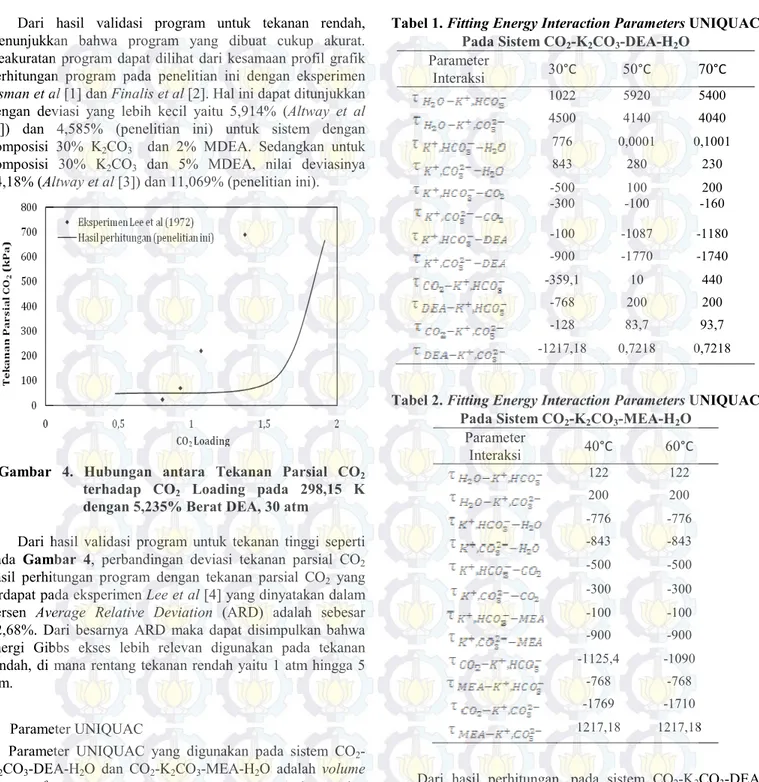
Gambar 4. Hubungan antara Tekanan Parsial CO2 terhadap CO2 Loading pada 298,15 K dengan 5,235% Berat DEA, 30 atm
Dari hasil validasi program untuk tekanan tinggi seperti pada Gambar 4, perbandingan deviasi tekanan parsial CO2 hasil perhitungan program dengan tekanan parsial CO2 yang terdapat pada eksperimen Lee et al [4] yang dinyatakan dalam persen Average Relative Deviation (ARD) adalah sebesar 32,68%. Dari besarnya ARD maka dapat disimpulkan bahwa energi Gibbs ekses lebih relevan digunakan pada tekanan rendah, di mana rentang tekanan rendah yaitu 1 atm hingga 5 atm.
b. Parameter UNIQUAC
Parameter UNIQUAC yang digunakan pada sistem CO2 -K2CO3-DEA-H2O dan CO2-K2CO3-MEA-H2O adalah volume dan surface area parameters, serta energy interaction parameters. Terdapat 12 volume dan surface area parameters, serta 25 energy interaction parameters. Dari 25 energy interaction parameters yang digunakan, 12 diantaranya difitting, sedangkan 13 sisanya diperoleh dari Al-Rashed et al [5] dan Kaewsichan et al [6]. Nilai energy interaction parameters ini difitting sampai tekanan parsial CO2 dan CO2 loading hasil perhitungan program mendekati hasil eksperimen Winarno [7] untuk DEA dan Hilliard [8] untuk MEA.
Tabel 1-2 menunjukkan 12 energy interaction parameters yang difitting :
Pada Sistem CO2-K2CO3-DEA-H2O Parameter Interaksi 30°C 50°C 70°C 1022 5920 5400 4500 4140 4040 776 0,0001 0,1001 843 280 230 -500 -300 100 -100 200 -160 -100 -1087 -1180 -900 -1770 -1740 -359,1 10 440 -768 200 200 -128 83,7 93,7 -1217,18 0,7218 0,7218
Tabel 2. Fitting Energy Interaction Parameters UNIQUAC Pada Sistem CO2-K2CO3-MEA-H2O
Parameter Interaksi 40°C 60°C 122 122 200 200 -776 -776 -843 -843 -500 -500 -300 -300 -100 -100 -900 -900 -1125,4 -1090 -768 -768 -1769 -1710 1217,18 1217,18
Dari hasil perhitungan, pada sistem CO2-K2CO3 -DEA-H2O didapatkan ARD program terhadap eksperimen sebesar 1,38% untuk suhu 30°C, 17,89% untuk suhu 50°C, dan 29,09% suhu 70°C. Nilai ARD pada suhu 70°C cukup besar, hal ini disebabkan oleh fitting parameter interaksi yang kurang efektif pada suhu tinggi baik itu interaksi antara molekul-molekul, molekul-pasangan ion maupun antar pasangan ion itu sendiri. Dalam fitting ini, interaksi yang paling berpengaruh dalam menghitung tekanan parsial CO2 yaitu interaksi antara molekul dan pasangan ion. Jika beberapa data dari hasil eksperimen pada suhu 70°C yang berada di luar profil grafik hasil hasil perhitungan dieliminasi maka ARD tekanan parsial CO2 yang dihasilkan sebesar 11,71% . Sedangkan pada sistem CO2-K2CO3-MEA-H2O didapatkan ARD program terhadap eksperimen sebesar 33% untuk suhu 40°C, dan 42% untuk
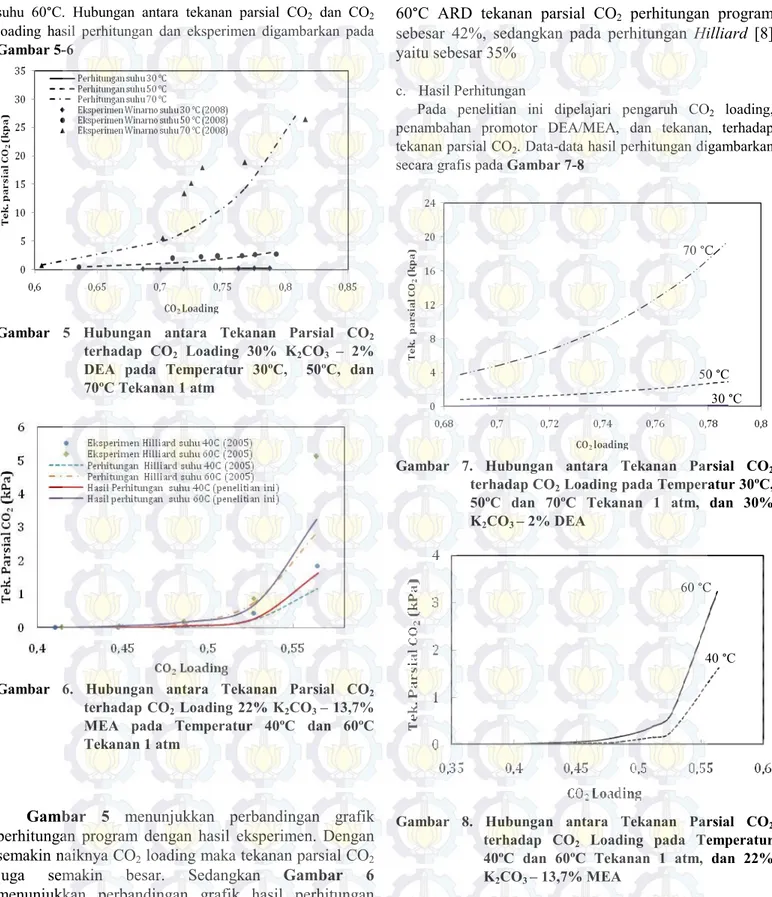
suhu 60°C. Hubungan antara tekanan parsial CO2 dan CO2 loading hasil perhitungan dan eksperimen digambarkan pada Gambar 5-6
Gambar 5 Hubungan antara Tekanan Parsial CO2 terhadap CO2 Loading 30% K2CO3 – 2% DEA pada Temperatur 30ºC, 50ºC, dan 70ºC Tekanan 1 atm
Gambar 6. Hubungan antara Tekanan Parsial CO2 terhadap CO2 Loading 22% K2CO3 – 13,7% MEA pada Temperatur 40ºC dan 60ºC Tekanan 1 atm
Gambar 5 menunjukkan perbandingan grafik
perhitungan program dengan hasil eksperimen. Dengan
semakin naiknya CO
2loading maka tekanan parsial CO
2juga
semakin
besar.
Sedangkan
Gambar
6
menunjukkan perbandingan grafik hasil perhitungan
program
dengan
eksperimen
Hilliard
[8]
dan
perhitungan Hilliard [8] yang menggunakan Aspen Plus
dengan model elektrolit NRTL. Hasil menunjukkan
bahwa pada suhu 40°C ARD tekanan parsial CO
2perhitungan program yaitu sebesar 33%, sedangkan pada
perhitungan Hilliard [8] yaitu sebesar 39,5%. Pada suhu
60°C ARD tekanan parsial CO
2perhitungan program
sebesar 42%, sedangkan pada perhitungan Hilliard [8]
yaitu sebesar 35%
c. Hasil Perhitungan
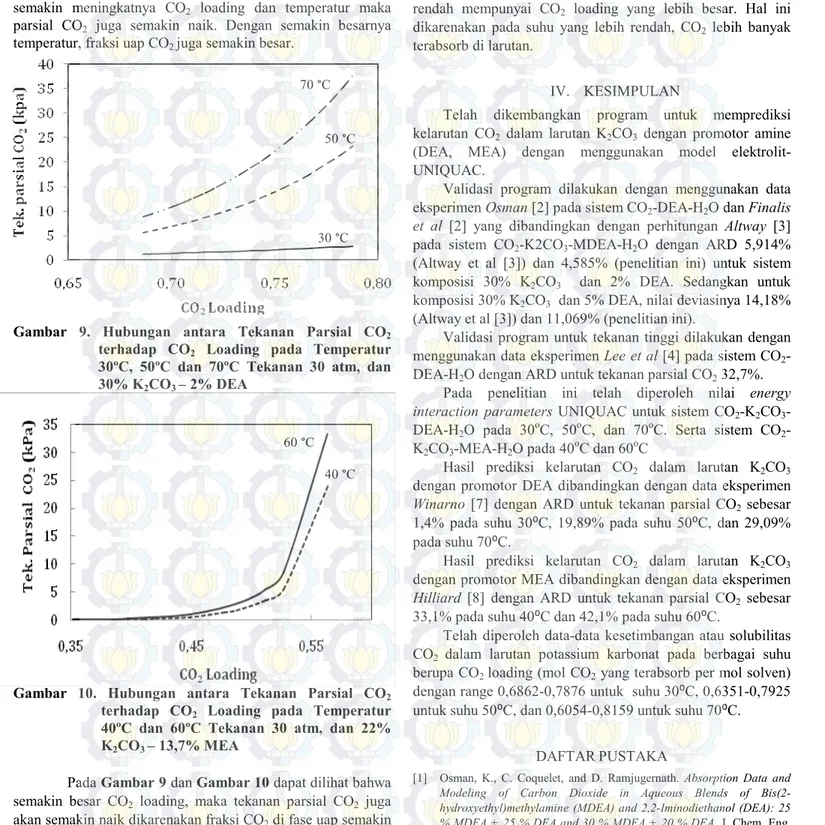
Pada penelitian ini dipelajari pengaruh CO2 loading, penambahan promotor DEA/MEA, dan tekanan, terhadap tekanan parsial CO2. Data-data hasil perhitungan digambarkan secara grafis pada Gambar 7-8
Gambar 7. Hubungan antara Tekanan Parsial CO2 terhadap CO2 Loading pada Temperatur 30ºC, 50ºC dan 70ºC Tekanan 1 atm, dan 30% K2CO3 – 2% DEA
Gambar 8. Hubungan antara Tekanan Parsial CO2 terhadap CO2 Loading pada Temperatur 40ºC dan 60ºC Tekanan 1 atm, dan 22% K2CO3 – 13,7% MEA
Berdasarkan Gambar 7 dan Gambar 8, terlihat bahwa semakin besar CO2 loading maka tekanan parsial kesetimbangan CO2 juga semakin besar. Hal ini disebabkan karena terjadinya kenaikan konsentrasi CO2 di dalam larutan yang pada dasarnya akan selalu berkesetimbangan dengan tekanan parsial CO2 dalam fase gas. Dapat dilihat pula bahwa dengan naiknya temperatur, maka tekanan parsial CO2 juga
70 °C
50 °C 30 °C
60 °C
semakin meningkatnya CO2 loading dan temperatur maka parsial CO2 juga semakin naik. Dengan semakin besarnya temperatur, fraksi uap CO2 juga semakin besar.
Gambar 9. Hubungan antara Tekanan Parsial CO2 terhadap CO2 Loading pada Temperatur 30ºC, 50ºC dan 70ºC Tekanan 30 atm, dan 30% K2CO3 – 2% DEA
Gambar 10. Hubungan antara Tekanan Parsial CO2 terhadap CO2 Loading pada Temperatur 40ºC dan 60ºC Tekanan 30 atm, dan 22% K2CO3 – 13,7% MEA
Pada Gambar 9 dan Gambar 10 dapat dilihat bahwa semakin besar CO2 loading, maka tekanan parsial CO2 juga akan semakin naik dikarenakan fraksi CO2 di fase uap semakin naik.
Berdasarkan Gambar 9 dan Gambar 10 semakin besar CO2 loading maka tekanan parsial CO2 juga semakin besar. Hal ini disebabkan karena terjadinya kenaikan konsentrasi CO2 di dalam larutan yang pada dasarnya selalu berkesetimbangan dengan konsentrasi CO2 di dalam fase gas. Dengan semakin besarnya temperatur sistem, maka fraksi mol CO2 di fase uap semakin besar, karena dengan semakin naiknya suhu, maka CO2 yang terabsorp di larutan semakin sedikit, sehingga fraksi mol uap CO2 semakin banyak. Selain
rendah mempunyai CO2 loading yang lebih besar. Hal ini dikarenakan pada suhu yang lebih rendah, CO2 lebih banyak terabsorb di larutan.
IV. KESIMPULAN
Telah dikembangkan program untuk memprediksi kelarutan CO2 dalam larutan K2CO3 dengan promotor amine (DEA, MEA) dengan menggunakan model elektrolit-UNIQUAC.
Validasi program dilakukan dengan menggunakan data eksperimen Osman [2] pada sistem CO2-DEA-H2O dan Finalis et al [2] yang dibandingkan dengan perhitungan Altway [3] pada sistem CO2-K2CO3-MDEA-H2O dengan ARD 5,914% (Altway et al [3]) dan 4,585% (penelitian ini) untuk sistem komposisi 30% K2CO3 dan 2% DEA. Sedangkan untuk komposisi 30% K2CO3 dan 5% DEA, nilai deviasinya 14,18% (Altway et al [3]) dan 11,069% (penelitian ini).
Validasi program untuk tekanan tinggi dilakukan dengan menggunakan data eksperimen Lee et al [4] pada sistem CO2 -DEA-H2O dengan ARD untuk tekanan parsial CO2 32,7%. Pada penelitian ini telah diperoleh nilai energy interaction parameters UNIQUAC untuk sistem CO2-K2CO3 -DEA-H2O pada 30oC, 50oC, dan 70oC. Serta sistem CO2 -K2CO3-MEA-H2O pada 40oC dan 60oC
Hasil prediksi kelarutan CO2 dalam larutan K2CO3 dengan promotor DEA dibandingkan dengan data eksperimen Winarno [7] dengan ARD untuk tekanan parsial CO2 sebesar 1,4% pada suhu 30⁰C, 19,89% pada suhu 50⁰C, dan 29,09% pada suhu 70⁰C.
Hasil prediksi kelarutan CO2 dalam larutan K2CO3 dengan promotor MEA dibandingkan dengan data eksperimen Hilliard [8] dengan ARD untuk tekanan parsial CO2 sebesar 33,1% pada suhu 40⁰C dan 42,1% pada suhu 60⁰C.
Telah diperoleh data-data kesetimbangan atau solubilitas CO2 dalam larutan potassium karbonat pada berbagai suhu berupa CO2 loading (mol CO2 yang terabsorb per mol solven) dengan range 0,6862-0,7876 untuk suhu 30⁰C, 0,6351-0,7925 untuk suhu 50⁰C, dan 0,6054-0,8159 untuk suhu 70⁰C.
DAFTARPUSTAKA
[1] Osman, K., C. Coquelet, and D. Ramjugernath. Absorption Data and Modeling of Carbon Dioxide in Aqueous Blends of Bis(2-hydroxyethyl)methylamine (MDEA) and 2,2-Iminodiethanol (DEA): 25 % MDEA + 25 % DEA and 30 % MDEA + 20 % DEA. J. Chem. Eng. Data 2012, 57, 1607−1620
[2] Finalis, E.R. dan Sholichatun. Pengaruh Penambahan Aditif MDEA terhadap Solubilitas CO2 dalam Larutan K2CO3. Skripsi, Jurusan
Teknik Kimia Institut Teknologi Sepuluh Nopember (2010)
[3] Altway, S. dan K. D. Marhetha. Prediksi Solubilitas Gas CO2 di Dalam
Larutan Potasium Karbonat dan MDEA Menggunakan Model Elektrolit UNIQUAC. Skripsi, Jurusan Teknik Kimia Institut Teknologi Sepuluh Nopember (2010)
[4] Lee, J., F.D. Otto, A.E. Mather. Solubility of Carbon Dioxide in Aqueous Diethanolamine Solutions at High Pressures. Journal of Chemical and Engineering Data, Vol. 17, No. 4, 1972
60 °C
40 °C 70 °C
50 °C
[5] Al-Rashed, O. A., S. H. Ali. Modeling the solubility of CO2 and H2S in DEA–MDEA alkanolamine solutions using the electrolyte–UNIQUAC model. Separation and Purification Technology 94 (2012) 71–83 [6] Kaewsichan, L., O. Al-Bofersen, V.F. Yesavage, M. S. Selim.
Predictions of The Solubility of Acid Gases in Monoethanolamine (MEA) and Methyldiethanolamine (MDEA) Solutions Using The Electrolyte-UNIQUAC Model. Fluid Phase Equilibria 183-184 (2001) 159-171
[7] Winarno, H., G. Wibawa, dan Kuswandi. Eksperimental dan Estimasi Kesetimbangan Fase Uap-Cair Sistem Larutan Elektrolit CO2-K2CO3
-Diethanolamine-H2O. Thesis, Institut Teknologi Sepuluh Nopember
(2008).
[8] Hilliard, M. D. A Predictive Thermodynamic Model for an Aqueous Blend of Potassium Carbonate, Piperazine, and Monoethanolamine for Carbon Dioxide Capture from Flue Gas. Dissertation Proposal, The University of Texas at Austin Department of Chemical Engineering (2005).
[9] Cullinane, J. Tim, G.T. Rochelle. Carbon dioxide Absorption with Aqueous Potassium Carbonate Promoted by Piperazine. Chemical Engineering Science 59 (2004) 3619-3630
[10] Aronu, U. E., S. Gondal, E.T. Hessen, T. H. Warberg, A. Hartono, K. A. Hoff, H. F. Svendsen. Solubility of CO2 in 15, 30, 45 and 60 mass%
MEA from 40 to 120 ⁰C and model representation using the extended UNIQUAC framework. Chemical Engineering Science 66 (2011) 6393-6406
[11] Thee, H., Y. A. Suryaputradinata, K. A. Mumford, K. H. Smith, G.D. Silva, S.E. Kentish, G. W. Stevens. A kinetic and process modeling study of CO2 capture with MEA-promoted potassium carbonate