KEGIATAN. 13
ZAT PADAT
Zat padat terdiri dari atom-atom, ion-ion, atau molekul-molekul yang letaknya berdekatan dan tersusun secara teratur. Perbedaan sifat dalam berbagai zat padat disebabkan oleh perbedaan gaya ikat di antara atom-atom, ion-ion, atau molekul-molekul tersebut. Semua ikatan dalam zat padat melibatkan gaya listrik, dan perbedaan utama di antara ikatan itu terletak pada distribusi elektron terluar. Walaupun zat padat hanya mengisi sebagian kecil dari alam semesta ini, namun zat padat mengisi sebagian besar dunia fisik kita, dan sebagian besar dari teknologi modern bertumpu pada sifat-sifat khusus dari zat padat.
a. Tujuan
Setelah mempelajari modul ini Anda diharapkan dapat: membedakan pengertian kristal dan amorf
membedakan beberapa jenis ikatan atom dalam kristal zat padat. menjelaskan konduktivitas listrik berdasarkan teori pita energi
Pelajarilah modul ini secara cermat agar tujuan-tujuan tersebut dapat tercapai.
b. Uraian Materi dan Contoh
1. Kristal dan Amorf
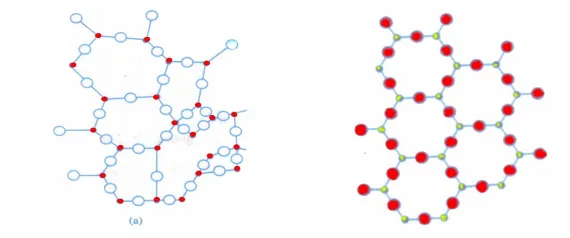
Amorf adalah zat padat yang memiliki keteraturan susunan partikel dalam rentang yang pendek. Contoh zat padat yang memiliki struktur amorf antara lain, plastik, aspal, dan kaca. Untuk melihat perbedaan keteraturan susunan partikel, perhatikan gambar 1 yang menunjukkan sebuah bahan yang dapat berada dalam bentuk kristal dan amorf.
Sifat fisis zat padat yang mudah diamati untuk membedakan struktur kristal dan amorf adalah titik lebur. Kristal memiliki titik lebur yang jelas, karena gaya ikat diantara partikel penyusunnya hampir sama sehingga putusnya ikatan akibat pemanasan akan tepat pada suatu temperatur tertentu. Sedangkan, amorf akan melunak secara berangsur-angsur karena ikatan yang paling lemah akan putus pada temperatur yang lebih rendah dari yang lainnya.
2. Jenis-jenis Kristal
Seperti telah diketahui, sifat zat padat sangat dipengaruhi oleh jenis ikatan yang terjadi diantara partikel-partikel penyusunnya. Oleh karena itu, kita dapat membedakan jenis-jenis kristal berdasarkan ikatan yang terjadi diantara partikel-partikel penyusunnya, yaitu kristal ionik, kristal kovalen, kristal logam, kristal molekuler, dan kristal ikatan hidrogen.
Kristal Ionik
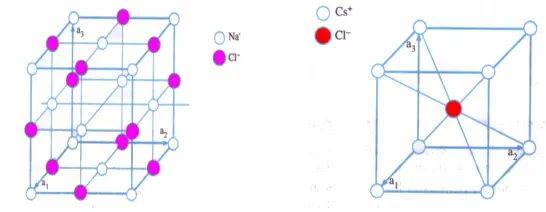
Kristal ionik adalah kristal yang terbentuk berdasarkan ikatan ionik, yaitu partikel-partikel penyusunnya saling memberi dan menerima elektron sehingga terjadi gaya tarik menarik antara ion positif dan ion negatif. Contoh kristal ionik antara lain NaCl dan CsCl.
Kristal NaCl memikili struktur fcc (face centered cubic = kubus berpusat muka) seperti tampak pada gambar 2b. setiap ion Na+ dikelilingi oleh enam ion Cl- seperti tetangga
terdekat dan demikian juga setiap ion Cl- dikelilingi oleh enam ion Na+. Jarak rata-rata antara
ion Na+ dan ion Cl- adalah sekitar 2,81 A0, sedangkan jarak rata-rata antara ion Na+ dan Na+
Kristal CsCl memiliki struktur bcc (body-centered cubic = kubus berpusat badan) seperti tampak pada gambar 2(b). Setiap ion Cs+ dikelilingi oleh delapan ion Cl-. Pada
umumnya struktur kristal bcc terbentuk jika ukuran ion-ion penyusunnya hampir sama. Kristal ionik memiliki sifat-sifat antara lain keras dan stabil, konduktor yang buruk, titik lebur tinggi, tembus cahaya, menyerap radiasi inframerah, dan mudah larut dalam cairan polar seperti air.
Kristal Kovalen
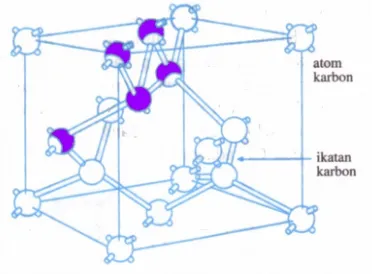
Kristal kovalen adalah kristal yang terbentuk berdasarkan ikatan kovalen, yaitu pemakaian bersama elektron-elektron dan atom-atom penyusunnya. Contoh kristal kovalen antara lain intan, silikon, germanium, dan silikon karbid (SiC).
Pada kristal intan, satu atom karbon berikatan kovalen dengan empat atom karbon lainnya dalam bentuk tetrahedral seperti tampak pada gambar 3. Bentuk kristal lain yang terbentuk dari atom karbon adalah grafit. Grafit terdiri dari lapisan atom karbon berbentuk heksagonal dan setiap atom karbon berikatan kovalen dengan tiga atom karbon lainnya. Sedangkan, lapisan-lapisan ini terikat dengan ikatan Van der Waals. Walaupun intan dan grafit merupakan kristal yang sama-sama terbentuk dari atom karbon, namun memiliki sifat fisis yang sangat berbeda karena perbedaan struktur kristalnya.
Kristal kovalen memiliki sifat-sifat antara lain sangat keras, titik lebur sangat tinggi, tembus cahaya, konduktor yang buruk, dan sukar larut dalam zat cair biasa.
Kristal Logam
Kristal logam adalah kristal yang terbentuk berdasarkan ikatan logam, yaitu ikatan antara gas elektron dengan ion positif penyusun logam tersebut. Dalam suatu logam, elektron valensi dari tiap atom mudah bergerak dari satu atom ke atom lain sehingga seolah-olah elektron-elektron valensi ini menjadi milik bersama seluruh atom dalam logam. Dengan demikian, logam dapat digambarkan sebagai lautan gas elektron dengan deretan muatan positif di dalamnya seperti tampak pada gambar 4.
Semua logam, termasuk besi, perak, seng, dan tembaga merupakan contoh kristal logam. Kristal logam memiliki sifat-sifat antara lain konduktor yang baik, tidak tembus cahaya, mengkilap, dan dapat dicampur dengan kristal logam lainnya.
Kristal Molekuler
Kristal molekuler adalah kristal yang terbentuk berdasarkan ikatan van der Waals, yaitu ikatan antara molekul-molekul yang memiliki dipol listrik tidak permanen. Contoh kristal molekuler antara lain He, Ne, Ar, CH4, dan
GeCl4 dalam bentuk padatan.
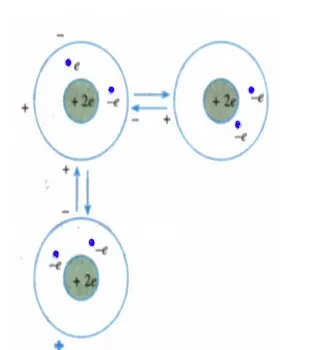
Untuk memahami terbentuknya kristal molekuler, marilah kita tinjau salah satu atom dari golongan gas mulia, yaitu He. Atom helium memiliki dua elektron pada kulit K. Pada suatu saat posisi kedua elektron dan inti tidak simetris sehingga terjadi dipol listrik sementara seperti tampak pada gambar 5. Dalam keadaan ini atom helium dapat
Gambar 5 Kristal molekuler helium terbentuk dari ikatan van der Waals Gambar 4 Gas elektron dan ion positif membentuk ikatan
mempengaruhi atom tetangganya sehingga atom tetangganya terpolarisasi dan terjadilah gaya tarik-menarik.
Kristal Ikatan Hidrogen
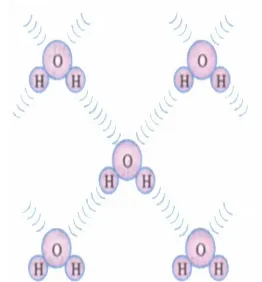
Kristal ikatan hidrogen adalah kristal yang terbentuk berdasarkan ikatan hidrogen. Sebagai contoh kristal ikatan hidrogen ini adalah kristal H2O atau es.
Dalam sebuah molekul H2O, atom-atom H dan atom O
terikat secara kovalen sehingga molekul H2O bersifat
netral. Akan tetapi, pasangan elektron bersamanya lebih tertarik ke arah atom O sehingga terjadilah dipol listrik. Dipol-dipol listrik ini saling berinteraksi yaitu sisi O dari satu molekul H2O akan menarik sisi H dari molekul H2O
yang lain seperti tampak pada gambar 6.
3. Pita Energi
Sebagaimana telah dijelaskan dalam teori atom, atom terdiri dari elektron-elektron yang bergerak mengelilingi inti dalam tingkat-tingkat energi tertentu. Semakin jauh dari inti atom, maka energi yang dimiliki elektron akan semakin besar. Pada umumnya, tingkat-tingkat energi elektron digambarkan dalam bentuk garis-garis. Gambar 7 menunjukkan tingkat-tingkat energi elektron untuk atom tunggal.
Gambar 7 (a) Tingkat-tingkat energi pada atom tunggal, (b) tingkat-tingkat energi pada kristal.
Tingkat-tingkat energi pada kristal dapat digambarkan dengan cara yang sama dengan atom tunggal. Interaksi antaratom pada kristal hanya terjadi pada elektron bagian luar sehingga tingkat energi elektron pada orbit bagian dalam tidak berubah. Pada orbit bagian luar terdapat elektron yang sangat banyak dengan tingkat-tingkat energi yang berimpit satu sama lain. Berdasarkan asas Pauli, dalam suatu tingkat energi tidak boleh terdapat lebih dari satu elektron yang berada pada keadaan yang sama, maka apabila ada elektron yang berada pada keadaan yang sama akan terjadi pergeseran tingkat energi sehingga tidak pernah ada garis-garis energi yang bertindihan. Kumpulan garis pada tingkat energi yang sama akan saling berimpit dan membentuk pita yang disebut pita energi, seperti tampak pada gambar 7.
4. Jenis-jenis Pita Energi
Berdasarkan pengisian elektron, kita dapat membedakan pita energi menjadi dua jenis, yaitu pita valensi dan pita konduksi. Pita valensi adalah pita energi teratas yang terisi penuh oleh elektron, sedangkan pita konduksi adalah pita energi di atas pita valensi yang terisi sebagian atau tidak terisi oleh elektron. Pada umumnya, antara pita valensi dan pita konduksi terdapat suatu celah yang disebut celah energi.
Untuk memahami pengertian tentang pita valensi, pita konduksi, dan celah energi, mari kita perhatikan pita energi yang terdapat pada atom Na (natrium). Atom natrium memiliki konfigurasi elektron 1s2 2s2 2p6 3s1.
Jadi, elektron-elektron pada atom natrium akan mengisi dalam empat pita energi, yaitu pita energi 1s terisi 2 elektron, pita energi 2s terisi 2 elektron, pita energi 2p terisi 6 elektron, dan pita energi 3s hanya terisi 1 elektron. Jika dalam kristal Natrium terdapat N atom, maka akan terdapat 7N elektron yang tersebar pada pita 1 s sebanyak 2 N elektron, pita 2s sebanyak 2N elektron, pita 2p sebanyak 6N elektron, dan pita 3s sebanyak N elektron, seperti tampak pada gambar 8. Pita energi 2p merupakan pita valensi dan pita 3s merupakan pita konduksi. Jarak antara pita 2p dan 3s adalah celah energi.
5. Konduktivitas Zat padat
Konduktivitas zat padat ditentukan oleh struktur pita energi dan pengisian elektron pada pita energi tersebut. Zat padat dapat dibedakan berdasarkan konduktivitasnya menjadi tiga jenis, yaitu konduktor, isolator, dan semikonduktor.
Konduktor
Logam dikenal sebagai konduktor yang baik. Konduktivitas logam dapat dijelaskan dengan pita energi. Perhatikan kembali gambar 8 yang menunjukkan pita-pita energi logam natrium. Pada umumnya, konduktor memiliki struktur pita energi seperti pada logam
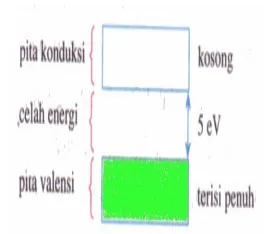
Isolator memiliki struktur pita energi seperti pada gambar 9. Pita konduksi tidak terisi oleh elektron, sedangkan celah energi antara pita valensi dan pita konduksi cukup besar (sekitar 5 eV) sehingga tidak ada elektron yang bebas bergerak. Oleh karena itu, apabila bahan isolator dihubungkan dengan sumber tegangan listrik, tidak akan terjadi aliran muatan.
Semikonduktor
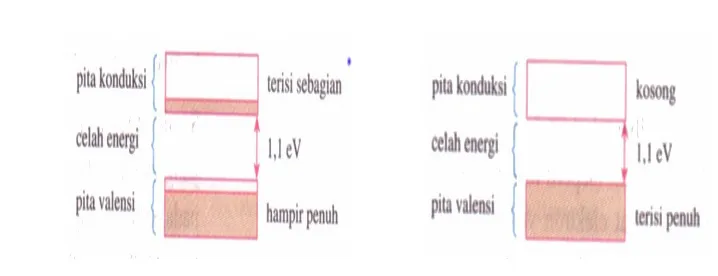
Struktur pita energi pada semikonduktor hampir sama dengan struktur pita energi pada isolator. Akan tetapi celah energi antara pita valensi dan pita konduksi pada semikonduktor relatif kecil, yaitu sekitar 1,1 eV. Pada temperatur rendah, semikonduktor akan berperilaku seperti isolator, sedangkan pada temperatur tinggi elektron yang berada pada pita valensi akan memperoleh energi kinetik yang mampu untuk memindahkan elektron ke pita konduksi sehingga pada pita konduksi terdapat elektron yang dapat bergerak bebas.
6. Semikonduktor Intrinsik dan Semikonduktor Ekstrinsik
Pada bagian sebelumnya telah dijelaskan bahwa konduktivitas semikonduktor berada di antara isolator dan konduktor. Semakin tinggi temperatur semikonduktor, maka konduktivitas semikonduktor akan semakin baik. Semikonduktor dapat dibedakan berdasarkan kemurnian atomnya menjadi dua jenis, yaitu semikonduktor intrinsik dan semikonduktor ekstrinsik.
Semikonduktor Intrinsik
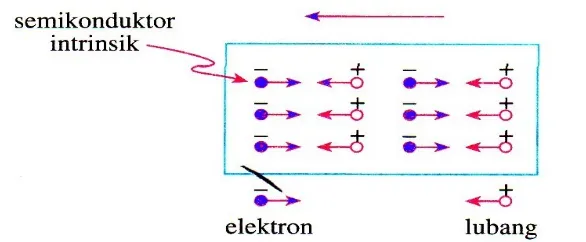
Semikonduktor intrinsik adalah semikonduktor murni yang belum dikotori atau disisipi dengan atom lain. Jadi, semikonduktor yang telah kita bahas sebelumnya adalah termasuk dalam semikonduktor intrinsik. Pada temperatur yang cukup tinggi, elektron pada pita valensi dapat pindah ke pita konduksi sehingga pada pita valensi terdapat tempat-tempat kosong. Tempat-tempat kosong yang ditinggalkan oleh elektron dapat dipandang sebagai muatan positif yang disebut dengan hole atau lubang.
Gambar 11 menunjukkan suatu semikonduktor intrinsik yang dipengaruhi oleh suatu medan listrik dalam arah ke kiri. Elektron-elektron pada semikonduktor akan bergerak ke kanan, sehingga seolah-olah lubang-lubang yang ditinggalkan elektron akan bergerak ke kiri berlawanan dengan arah gerak elektron. Jadi, arus listrik akan mengalir ke kiri searah dengan gerak lubang yang dapat dianggap sebagai muatan positif. Gambar 11
Semikonduktor Ekstrinsik
Semikonduktor ekstrinsik adalah semikonduktor yang telah dikotori atau disisipi oleh atom lain. Pengotoran atau penyisipan atom lain pada suatu semikonduktor biasanya bertujuan untuk meningkatkan konduktivitas semikonduktor. Tidak semua bahan dapat digunakan sebagai atom pengotor. Agar suatu bahan dapat digunakan sebagai atom pengotor, maka ia harus memenuhi syarat antara lain memiliki ukuran yang sama atau hampir sama dengan atom murni agar dapat menempati kisi-kisi pada atom murni tanpa merusak susunan kristal, dan memiliki elektron valensi yang berbeda satu dengan elektron valensi atom murni. Berdasarkan jumlah elektron valensi atom pengotor, semikonduktor ekstrinsik dapat dibedakan menjadi dua jenis, yaitu semikonduktor jenis-n dan semikonduktor jenis-p.
a. Semikonduktor Jenis – n
Semikonduktor jenis-n dapat dibentuk dengan menambah atom pengotor yang memiliki lima elektron valensi (seperti fosfor, arsenikum, atau antimon) pada kristal yang memiliki empat elektron valensi (seperti silikon). Untuk memenuhi struktur atom gas mulia, silikon hanya mengikat empat elektron valensi dari fosfor sehingga terdapat satu elektron isa yang tidak terikat dengan atom lain.
Atom pengotor yang memiliki lima elektron valensi seperti fosfor disebut atom donor karena memberikan elektron ekstra ke dalam semikonduktor. Semikonduktor yang terbentuk akibat pengotoran atom donor disebut semikonduktor jenis-n karena memiliki elektron ekstra (muatan negatif) sebagai pembawa muatan mayoritas.
Elektron ekstra tersebut akan menempati tingkat energi yang lebih tinggi daripada tingkat energi pita valensi, yaitu sedikit di bawah pita konduksi. Getaran dalam kristal sedikit saja dapat digunakan oleh elektron-elektron ekstra ini untuk pindah ke pita konduksi sehingga dapat meningkatkan konduktivitas semikonduktor.
b. Semikonduktor Jenis – p
Semikonduktor jenisp dapat dibentuk dengan menambahkan atom pengotor yang memiliki tiga elektron valensi (seperti galium, boron, atau indium) pada kristal yang memiliki empat elektron valensi (seperti silikon atau germanium). Untuk membentuk ikatan kovalen yang lengkap, silikon membutuhkan empat elektron valensi. Karena galium hanya memiliki tiga elektron valensi, maka ada sebuah elektron yang tidak berpasangan dan terdapat sebuah lubang atau hole yang belum terisi oleh elektron.
Gambar 12 (a) Struktur atom pada semikonduktor jenis-n, (b) pita energi pada semikonduktor jenis-n
Atom pengotor yang memiliki tiga elektron valensi seperti galium disebut atom akseptor karena membutuhkan satu elektron lagi untuk melengkapi ikatannya. Semikonduktor yang terbentuk akibat pengotoarn atom akseptor disebut semikonduktor jenis-p karena memiliki lubang (muatan positif) sebagai pembawa muatan mayoritas.
Tingkat energi atom akseptor sedikit lebih besar daripada tingkat energi pita valensi. Pemberian sedikit medan listrik akan menyebabkan elektron-elektron pada pita valensi akan naik ke tingkat energi akseptor sehingga akan meningkatkan konduktivitas semikonduktor.
A. Soal Essay
1. Apa perbedaan zat padat dan zat cair ditinjau dari keteraturan susunan atom-atomnya. 2. Mengapa ikatan pada molekul CH4 tidak berdasarkan serah terima elektron valensi
tetapi berdasrkan patungan elektron valensi?
3. Apa yang dimaksud dengan “gas elektron” dalam kristal logam?
4. Jelaskan terbentuknya pita energi dalam kristal zat padat dari tingkat-tingkat energi sebuah atom tunggal.
5. Apa yang dimaksud dengan: a. pita valensi,
b. pita konduksi, c. pita terlarang?
6. Sifat penghantaran arus listrik pada konduktor berkurang dengan kenaikan temperatur. Mengapa pada semikonduktor, sifat penghantaran arus justru bertambah dengan kenaikan temperatur?
7. Apa yang dimaksud dengan: a. semikonduktor intrinsik, b. semikonduktor ekstrinsik, c. lubang?
8. Apa yang dimaksud dengan: a. pengotoran,
b. semikonduktor jenis-n c. semikonduktor jenis-p?
9. Bagaimanakah penambahan atom pengotor bervalensi tiga pada suatu semikonduktor murni mempengaruhi pasangan elektron-lubang pada temperatur ruang?
10. Untuk tingkat pengotoran yang sama, mengapa semikonduktor-n memiliki konduktivitas yang lebih baik daripada semikonduktor-p?
B. Soal Pilihan Ganda
1. Ikatan ionik terjadi antara atom-atom ….
a. atom yang satu cenderung menerima dan yang lain cenderung melepaskan elektron b. atom-atom yang berikatan sama-sama kekurangan elektron pada kulit terluar. c. terbentuknya dipol-dipol listrik pada temperatur sangat rendah
d. atom-atomnya mempunyai elektron terluar sangat sedikit sehingga cenderung untuk bergerak bebas
e. atom-atom yang berikatan sama-sama cendeung untuk melepaskan elektron. 2. Perhatikan pernyataan berikut:
(1) ikatan ionik terjadi sebagai akibat adanya kecenderungan atom agar kulit terluarnya tertutup dengan cara pemakaian elektron sekutu.
(2) ikatan ionik terjadi bila salah satu atom cenderung menangkap elektron yang dilepaskan atom pasangannya
(3) ikatan ionik terjadi karena adanya gaya Coulomb antara dua atom yang berpasangan
Pernyataan yang benar mengenai ikatan ionik adalah ….
a. (1) d. (2) dan (3)
b. (1) dan (2) e. (3)
3. Ikatan atom yang memanfaatkan bersama-sama elektron terluar yang dimiliki atom-atom adalah ….
a. ikan Van der Waals d. ikatan kovalen
b. ikatan ionik e. ikatan hidrogen
c. ikatan logam
4. Pernyataan yang benar mengenai ikatan kovalen ialah, ikatan antara dua …. a. ion yang berlawanan jenis
b. atom dengan pertukaran masing-masing elektron valensinya
c. atom atau lebih dengan pemakaian bersama sepasang elektron terluarnya. d. atom karena gaya elektrostatisnya
e. atom atau lebih dengan pemakaian bersama salah satu elektron dari atom-atom tersebut.
5. Intan dan arang mempunyai struktur atom yang sama yaitu karbon (C), tetapi kekuatan intan jauh lebih kuat dibandingkan arang dikarenakan ….
a. ikatannya d. struktur kristalnya
b. senyawa pembentuknya e. atom penyusunnya
c. struktur atomnya
6. Pernyataan di bawah ini tentang teori pita energi, yang tidak benar adalah …. a. pita valensi adalah pita tertinggi yang penuh terisi elektron
b. pita energi adalah tingkat-tingkat energi yang melebar
c. celah energi adalah daerah larangan yang memisahkan dua pita energi
d. pita konduksi adalah pita energi di atas pita valensi yang terisi sebagian atau kosong e. pita valensi adalah pita energi di atas pita konduksi yang terisi sebagian atau kosong. 7. Jika pv = pita valensi, pk = pita konduksi, maka pernyataan yang benar untuk bahan
semikonduktor adalah ….
a. pv penuh elektron, pk kosong, celah energi sempit b. pv penuh elektron, pk kosong, celah energi lebar
8. Apabila lebar celah energi antara pita valensi dengan pita konduksi pada bahan-bahan isolator, semikonduktor, dan konduktor masing-masing k,l,m, maka ….
a. k l m d. k m l
b. l m k e. m l k
c. m k l
9. Bila semikonduktor Ge disisipi atom galium, menghasilkan semikonduktor jenis ….
a. negatif d. instrinsik
b. positif e. magnetik
c. ekstrinsik
10. Semikonduktor ekstrinsik jenis-n, ialah semikonduktor yang mempunyai …. a. tingkat energi akseptor yang terletak di dekat pita konduksi