BAB II
TINJAUAN PUSTAKA
2.1 Definisi Gastritis
Secara sederhana definisi gastritis adalah proses inflamasi pada mukosa dan
submukosa lambung secara histopatologi. Sedangkan definisi lain dari gastritis adalah
proses inflamasi pada mukosa dan submukosa lambung sebagai respon terhadap jejas
(injury) yang dapat bersifat akut maupun kronik.1,15
Mukosa lambung terdiri dari sel-sel yang memproduksi asam dan enzim. Asam
dan enzim ini akan berperan dalam pencernaan makanan, sedangkan mukus berperan
dalam melindungi mukosa lambung dari asam. Ketika mukosa mengalami inflamasi,
maka produksi asam, enzim dan mukus akan terganggu. Gastritis merupakan gangguan
kemerahan pada mukosa yang nampak pada saat pemeriksaan endoskopi dan tidak bisa
mengantikan istilah dispepsia. Sampai saat ini masih belum jelas hubungan antara
gambaran mikroskopi (histopatologi) dengan keluhan pada lambung. Hubungan antara
gambaran mikroskopi dengan endoskopi juga tidak konsisten. Pada kebanyakan pasien
dengan gambaran gastritis pada pemeriksaan PA sering tidak meunjukkan kelainan saat
endoskopi . 16
2.2Epidemiologi Gastritis
Gastritis merupakan masalah kesehatan yang umum ditemui dalam pelayanan
klinis. Sekitar 10% kunjungan pada unit gawat darurat merupakan kasus gastritis.
Berdasarkan penelitian WHO (Word Health Organization) dilaporkan prevalensi gastritis
dibeberapa negara sebagai berikut : Inggris 22%,China 31%, Jepang 14,5%, Kanada 35%
dan Perancis 29,5%. Sekitar 1,8-2,1 juta penduduk mengalami gastritis setiap
tahunnya.17,18
Angka kejadian gastritis di Indonesia menurut WHO adalah 40,8% dan
merupakan salah satu dari sepuluh penyakit terbanyak pada pasien rawat inap di rumah
23 2.3Etiologi Gastritis
Terdapat beberapa penyebab gastritis diantaranya infeksi kuman Heliobacter
pylori (H.pylori) ; gangguan fungsi sistem imun ; infeksi virus seperti : enteric rotavirus, calicivirus dan cytomegalovirus ; infeksi jamur seperti : candida species, histoplasma capsulatum dan mukonacea serta obat anti inflamasi nonsteroid, konsumsi alkohol, usia,
stress oleh karena trauma, tindakan operatif, luka bakar, dll.15
Infeksi kuman H.pylori merupakan penyebab gastritis yang sangat penting.
Prevalensi infeksi H.pylori pada orang dewasa di negara berkembang ± 90%. Di
Indonesia, prevalensi kuman H.pylori yang dinilai melalui pemeriksaan urea breath test
pada pasien dispepsia menunjukkan jumlah yang menurun .15
Gastritis dapat muncul secara tiba-tiba (gastritis akut) ataupun membutuhkan
waktu yang lama (gastritis kronik). Gastritis akut adalah proses inflamasi akut pada
mukosa lambung biasanya berupa kondisi erosi dan hemorgik. Penyebab yang paling
sering diantaranya Non Steroid Anti Inflammatory Drugs (NSAIDs), kortikosteroid,
paparan zat kimia berupa alkohol, kondisi stress seperti luka bakar berat, myocard
infarction, lesi intrakaranial dan periode postoperatif, kemoterapi dan iskemia. Secara endoskopi berupa hiperemis mukosa dengan erosi multipel, kecil dan superfisial serta
dapat juga ditemukan ulkus. Secara mikroskopi dapat ditemukan epitel superfisial injury
dan nekrosis pada kelenjar superfisial. Perdarahan pada lamina propria dapat ditemukan.
Sel-sel inflamasi dijumpai dalam jumlah kecil, meskipun neutropil lebih dominan. Pada
kasus ringan, pasien biasanya asimptomatik atau hanya memiliki gejala dispepsia ringan.
Pada kasus sedang sampai berat, biasanya pasien dengan nyeri ulu hati, mual, muntah,
hematemesis dan melena. Pada kasus berat, pasien biasanya telah mengalami ulkus yang
dalam dan komplikasi berupa perforasi. 19
Sedangkan gastritis kronik didefinisikan secara histologi berupa peningkatan
jumlah sel limfosit dan sel plasma pada mukosa lambung. Berdasarkan etiologi, gastritis
kronik dikelompokkan menjadi tipe A yaitu berasal dari autoimun, tipe B yaitu berasal
dari infeksi H.pylori dan berapa kasus lain dengan etiologi yang belum jelas. Secara
endoskopi, mukosa menunjukkan gambaran atropi. Sedangkan secara histologi
ditemukan infiltrasi sel limfosit-plasma pada daerah mukosa sel-sel parietal. Neutrofil
jarang ditemukan. Mukosa dapat menunjukkan perubahan ke arah metaplasia intestinal.
Pada stadium akhir, mukosa atropi dan sel-sel parietal tidak ditemukan, namun H. Pylori
ditemukan berupa : nyeri epigastrium ringan, mual dan tidak nafsu makan. Pemeriksaan
endoskopi perlu dilakukan oleh karena gastritis kronik berisiko terhadap terjadinya ca
gaster. Pasien gastritis tipe A, memiliki kelainan autoimun pada organ lain khususnya penyakit tiroid. 19
Etiologi gastritis oleh Rugge (2011) atas dasar agen yang ditransmisikan yaitu :
kimiawi, fisik, faktor imun, dan idiopatik. Rugge juga membagi etiologi gastritis
berdasarkan 3 bentuk utama antara lain gastritis H.pylori, gastritis kimiawi, dan gastritis
autoimun. Lalu Toljamo (2012) mengelompokkan etiologi gastritis menjadi 3 kelompok
yaitu agen kimiawi, penyakit, dan faktor fisik/mekanik. Adapun Adibi (2014)
menuliskan etiologi gastritis menjadi 2 bagian besar yaitu gastritis H. pylori dan gastritis
non H. pylori.20,21
2.3.1 Etiologi Gastritis Berdasarkan Agen yang Ditransmisikan, Kimiawi, Fisik, Imun,
dan Idiopatik
Berikut ditampilkan tabel etiologi gastritis yang ditulis oleh Rugge (2011). 20
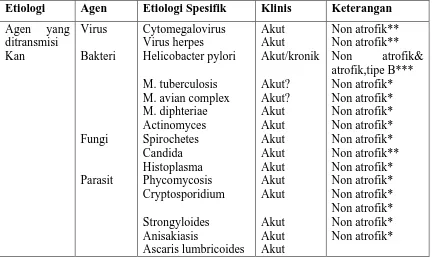
Tabel 2.1. .Etiologi Gastritis Berdasarkan Agen yang Ditransmisikan, Kimiawi, Fisik, Imun,
dan Idiopatik 20
Etiologi Agen Etiologi Spesifik Klinis Keterangan
25
Agen Fisik Radiasi Akut/kronik Non atrofik &
atrofik*
Idiopatik Crohn’s disease
Sarkoidosis
Keterangan: prevalensi : *** tinggi, ** rendah, * sangat rendah
2.3.2 Etiologi Utama
Adibi P menulis ada 2 etiologi utama dari gastritis yaitu gastritis H.pylori dan
gastritis non H.pylori (Adibi, 2014). Berbagai macam penyebab terjadinya gastritis non
H.pylori antara lain:21 1. Gastritis kimiawi
i. Gastritis alkoholik
ii. Gastritis yang diinduksi obat
Obat yang berhubungan dengan gastritis antara lain acarbose, alkohol,
antibiotik (eritromisin oral), bifosfonat, herbal (garlic, ginkgo, saw
metformin, miglitol, NSAID (termasuk COX-2), opiat, orlistat,
potasium klorida (KCl), teofilin (Loyd et al., 2011).
iii. Gastritis refluks (empedu atau duodenal juice)
iv. Gastritis kimiawi lainnya
2. Gastritis radiasi
3. Gastritis alergi
4. Gastritis autoimun
5. Bentuk khusus gastritis, gastritis NOS/ unspecified
6. Duodenitis
2.4Klasifikasi Gastritis
Sampai saat ini belum ada klasifikasi gastritis yang dapat diterima secara luas.
Salah satu klasifikasi yang digunakan oleh banyak ahli adalah the Sydney System yang
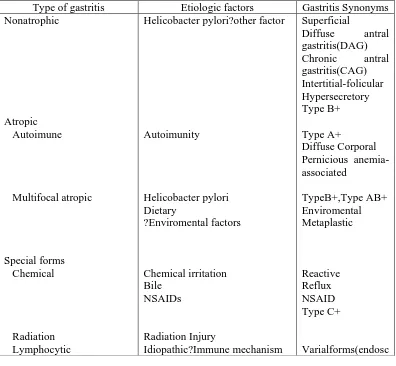
diperbaharui. Klasifikasi tersebut dapat dilihat pada tabel berikut (Dixon et al,1996):22
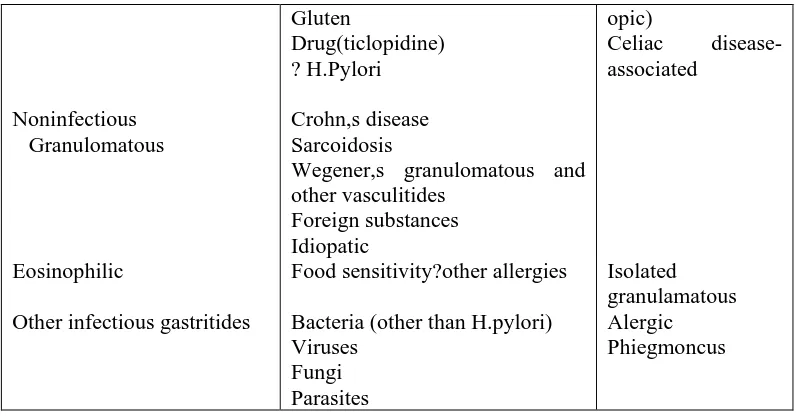
Tabel 2. Klasifikasi gastritis kronik berdasakan topograpi, morfologi & etiologi 22
Type of gastritis Etiologic factors Gastritis Synonyms
27 Noninfectious
Granulomatous
Eosinophilic
Other infectious gastritides
Gluten
Drug(ticlopidine) ? H.Pylori
Crohn,s disease Sarcoidosis
Wegener,s granulomatous and other vasculitides
Foreign substances Idiopatic
Food sensitivity?other allergies
Bacteria (other than H.pylori) Viruses
Fungi Parasites
opic)
Celiac disease-associated
Isolated granulamatous Alergic Phiegmoncus
Gastritis dibagi menjadi dua kelompok besar yaitu berdasarkan atas ada tidaknya
atropi dan distribusi topografi dari atropi. Atropi yaitu tidak ditemukannya kelenjar pada
mukosa atau terdapatnya fibrosis atau proliferasi fibromuskular atau hilangnya mukosa
normal dan digantikan dengan intestinal metaplasia. Kelompok besar ini seperti terlihat
pada gambar berikut (Dixon et al, 1994):22
Beberapa klasifikasi lain dari gastritis yaitu : klasifikasi berdasarkan infiltrat
inflamasi yang membagi menjadi akut dan kronik; klasifikasi secara makroskopis yang
membagi menjadi gastritis erosiva dan non erosiva; klasifikasi berdasarkan endoskopi
yang membagi menjadi gastritis komplit, inkomplit, dan erosif hemoragik; serta
klasifikasi menurut ICD-10.22
2.4.1 Klasifikasi secara Histopatologis
Penelitian pemetaan dari sejumlah spesimen biopsi dengan H.pylori positif
ditemukan dari pemeriksaan empat spesimen (dua daerah antrum dan dua daerah corpus).
Kedua lokasi ini memiliki probabilitas H.pylori yang tinggi. Biopsi daerah corpus
berfungsi untuk menilai respon terapi setelah pengobatan khususnya proton pump
inhibitor. Biopsi pada corpus penting untuk menilai pattern gastritis yang berimplikasi penting dalam menilai risiko yang berhubungan dengan penyakit. Biopsi di incisura
angularis penting untuk menilai atropi dan intestinal metaplasia serta merupakan daerah yang juga sering mengalami premalignan displasia. Ketiga regio ini merupakan regio yng
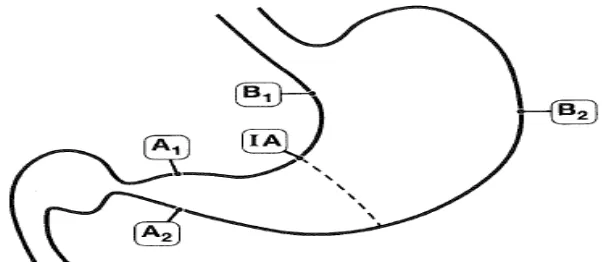
dianjurkan untuk histologi. Berikut ini merupakan gambar sisi pengambilan spesimen
biopsi (Dixon et al., 1996):22
Gambar 22. Skema daerah yang direkomendasikan untuk biopsi. Satu spesimen harus berasal dari daerah curvatura minor (A1) dan curvatura mayor (A2) daerah antrum yauitu kedua duanya berjarak 2-3 cm dari pylorus ; dari curvatura minor corpus sekitar 4 cm proximal dari angulus (B1); bagian tengah corpus dari curvatura mayor, sekitar 8 cm dari cardia (B2); dan dari insisura angularis (IA). 22
Sistem diagnosis gastritis yang dikembangkan sekarang adalah gabungan antara
temuan endoskopi dan histologis yang dikenal dengan nama Sydney System. Klasifikasi
Sydney dari gastritis per endoskopi bertujuan untuk menstandarisasi laporan klasifikasi gastritis per endoskopi berdasarkan tampilan mukosa seperti edema, punctuate and
29 intramural bleeding spots, dan coarse nodularity. Semua hasil endoskopi dilaporkan termasuk penilaian subjektif dari tingkat keparahan seperti ringan, sedang, berat, lalu
diklasifikasikan ke salah satu dari 8 kategori yaitu gastritis superfisial, gastritis
hemoragik, gastritis erosiva, gastritis verukosa, gastritis atrofik, gastritis metaplastik,
gastritis hiperplastik, dan gastritis khusus .23
2.4.2 Klasifikasi secara Makroskopis
Klasifikasi ini membagi gastritis menjadi gastritis erosiva dan gastritis non
erosiva. Gastritis erosiva merupakan erosi mukosa gaster disebabkan kerusakan/ defek
pertahanan mukosa. Umumnya bersifat akut, bisa dengan perdarahan, namun bisa
bersifat subakut atau kronik dengan sedikit gejala atau asimtomatis. Paling sering
disebabkan oleh NSAID, alkohol, stres. Penyebab lain yang jarang seperti radiasi, infeksi
virus, injuri vaskular, dan trauma langsung. Erosi superfisial dan lesi mukosa punktata
bisa terjadi. Erosi dalam, ulkus, bahkan perforasi terjadi pada kasus berat atau yang tidak
ditangani. Lesi khas muncul di korpus, tetapi antrum juga bisa terlibat. Ciri khas dari
gastritis erosiva adalah lesi mukosa tidak menembus lapisan mukosa muskularis.
Sementara gastritis non-erosiva mengacu pada kelainan histologis yang terutama akibat
infeksi H.pylori. Kebanyakan pasien gastritis non-erosiva asimtomatis. 24
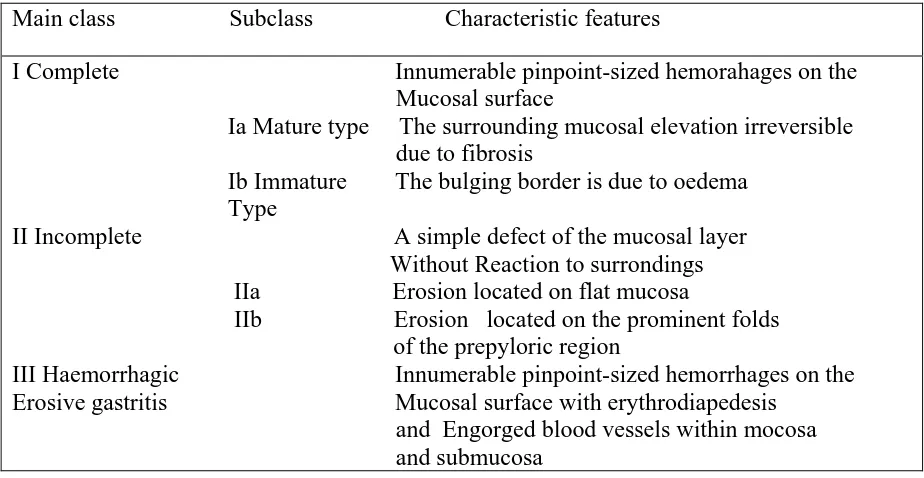
2.4.3 Klasifikasi Gastritis Berdasarkan Endoskopi
Klasifikasi ini membagi gastritis menjadi gastritis komplit dengan tipe matur
dan imatur, gastritis inkomplit, serta gastritis erosif hemoragik. 25
Tabel 2.3. Klasifikasi gastritis berdasarkan endoskopi 25
Main class Subclass Characteristic features
I Complete Innumerable pinpoint-sized hemorahages on the Mucosal surface
Ia Mature type The surrounding mucosal elevation irreversible due to fibrosis
Ib Immature The bulging border is due to oedema Type
II Incomplete A simple defect of the mucosal layer
Without Reaction to surrondings IIa Erosion located on flat mucosa
IIb Erosion located on the prominent folds of the prepyloric region
III Haemorrhagic Innumerable pinpoint-sized hemorrhages on the Erosive gastritis Mucosal surface with erythrodiapedesis
2.5Gastritis H.pylori
H.pylori pertama kali ditemukan oleh Robin Warren dan Marshall pada tahun 1983. H.pylori merupakan bakteri gram negatif yang ditemukan pada permukaan epitel
lambung yang menginfeksi sekitar 50% dari populasi umum. H.pylori bersifat
mikroaerofilik, berbentuk batang melengkung, berukuran panjang 1-3 µm dan lebar
0,3-0,6 µm serta berflagella pada satu ujung polenya. Bakteri ini memiliki adaptasi yang
sangat baik pada kondisi asam. H.pylori mengekskresikan urease yang berperan dalam
merubah urea menjadi amonia sehingga pH gaster meningkat. H.pylori juga dapat
menghindari kontak dengan gastric juice yang bersifat asam melalui crossing lapisan
tebal dari mukus dengan menggunakan flagelnya. 26
Epidemiologi H.pylori sekitar 50% populasi di dunia. Di negara barat seperti
USA, prevalensi H.pylori < 30% pada usia < 30 tahun dan > 75% pada usia > 60 tahun.
Di Asia, prevalensi H.pylori sangat tinggi namun jika dihubungkan dengan munculnya
ca gaster berbeda pada masing-masing daerahnya. 26
Infeksi kronik dari H.pylori biasanya menyebabkan atrofi serta metaplasia dan
juga diplasia serta ca gaster. H.pylori dapat menyebabkan ulkus peptikum (70%) dan
ulkus duodeni (90%). Transmisi infeksi H.pylori melalui mulut ke mulut atau feses ke
mulut. 26
Gejala klinis pada gastritis kronik biasanya asimtomatik. Tetapi pada gastritis
akut oleh karena H.pylori biasanya berupa nyeri perut, mual, muntah dan kembali pulih
setelah beberapa hari. Gejala khas gastritis kronik oleh karena H.pylori biasanya nyeri
epigastrium, disertai kram, mual dan muntah. 27,28
Indikasi diagnosis dan terapi dari infeksi H.pylori berdasarkan American
College of Gastroenterology guideline the management of H.pylori dpat dilihat pada tabel berikut :
Tabel 2.4 Indikasi diagnosis dan terapi H.pylori
Kondisi
• Active peptic ulcer disease (gastric or duodenal ulcer)
• Riwayat penyakit peptic ulcer ( tidak pernah diobati untuk H.pylori) • Gastric Malt lymphoma (low grade)
• Setelah reseksi gaster oleh karena kanker gaster stadium awal • Uninvestigative dyspepsia ( prevalensi H.pylori tinggi) Kontroversi
• Nonulcer dyspepsia
31 • Pengguna Nonsteroidal Antiinflammatory Drugs
• Anemia Defisiensi Besi
• Populasi yang memilik risiko tinggi Ca gaster
Nonulcer dyspepsia (Functional dyspepsia) merupakan kontroversi oleh karena pemeriksaan dan terapi H.pylori bergantung secara individu meliputi : usia, riwayat
penggunaan NSAID, malignansi lambung ( suku, riwayat keluarga men derita kanker
lambung). Sedangkan GERD tidak direkomendasikan untuk diagnostik dan terapi
H.pylori langsung oleh karena terdapat pendapat yang menyatakan terjadi perburukan atau perbaikan GERD pada terapi H.pylori. Pada pengguna NSAID, diagnostik dan
terapi H.pylori didasarkan pada hasil yang diperoleh. Pada anemia defisiensi besi,
penurunan jumlah besi biasanya disebabkan oleh karena H.pylori biasanya menyebabkan
pangastritis sehingga terjadi kondisi achlorhydria dan sekresi asam ascorbat menurun dan
berefek terhadap penurunan absorbsi zat besi. Selain itu juga biasanya disertai dengan
occult bleeding oleh karena gastritis erosiva dan pnggunaan zat besi yang meningkat oleh H.pylori. Namun dari beberapa penelitian dilaporkan bahwa tidak terdapat hubungan sebab akibat antara H.pylori dengan anemia defisiensi besi. Pada populasi yang memiliki
risiko tinggi terhadap H.pylori masih terdapat kontroversi diagnostik dan terapi H.pylori.
29
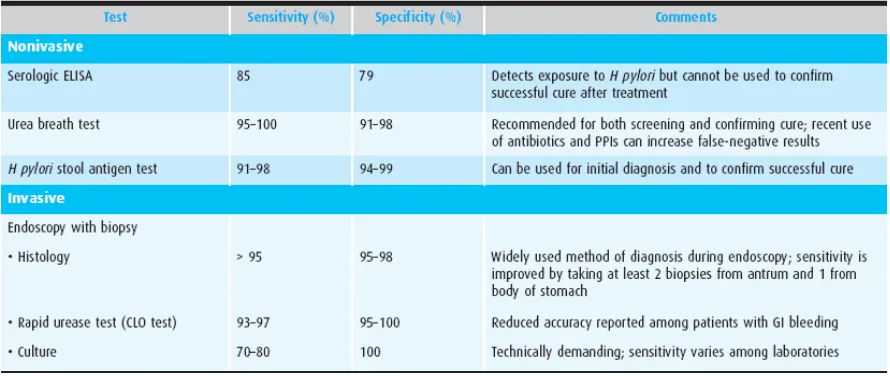
Metode diagnostik untuk mendeteksi kuman H.pylori dibagi menjadi
pemeriksaan invasif dan pemeriksaan non invasif. Beberapa metode telah dikembangkan
untuk mendeteksi keberadaan infeksi kuman H. pylori, yang dapat dilihat pada tabel di
bawah ini.28,29
Selain tabel di atas, terdapat keuntungan dan kerugian dari penggunaan masing-masing
test untuk diagnostik H.pylori. Keuntungan dan kerugian tersebut dapat dilihat pada tabel
berikut :
Tabel 2.6 Keuntungan dan kerugian test H.pylori 29
Test endoskopi Keuntungan Kerugian
1. Histologi
2. Rapid Urease Test
3. Kultur
4. Polimerase Chain Reaction
1. Antibody testing (quantitative & qualitative)
2. Urea Breath Test (13C dan 14C)
3. Faecal antigent test
Murah, tersedia, NPV baik
Identifikasi aktif H.pylori, NPV &PPV
baik, berguna pada pre& post terapi
Identifikasi aktif H.pylori, NPV &PPV
baik, berguna pada pre& post terapi
Poliklonal test lebih baik dibandingkan UBT, tidak nyaman
H.pylori dapat dideteksi dari endoskopi melalui histologi, kultur, maupun tes urease, dengan kelebihan dan kekurangannya masing-masing. Semua metode berbasis biopsi tersebut
dapat mengalami kesalahan pengambilan sampel karena infeksi tersebut bersifat patchy.
Sekitar 14% pasien tidak mengalami infeksi di antrum namun memiliki H.pylori di suatu
tempat di lambung, terutama jika pasien tersebut mengalami atrofi gaster, metaplasia
intestinal, ataupun refluks empedu. Selain itu, pasca-eradikasi dengan efektivitas parsial,
33 menimbulkan overestimasi efikasi eradikasi dan tingkat reinfeksi. Penghambat pompa proton
mempengaruhi pola kolonisasi H.pylori di lambung dan mengurangi akurasi biopsi di antrum.
Oleh karena itu, pedoman konsensus merekomendasikan untuk dilakukan biopsi multipel dari
antrum dan korpus untuk histologi dan satu untuk metode lain (baik kultur maupun
pemeriksaan urease). 39
2.5.1 Pemeriksaan invasif
1. Histologi. Meskipun H.pylori dapat dikenali dari bagian yang diwarnai dengan
hematoksilin dan eosin saja, dibutuhkan pengecatan tambahan (seperti Giemsa, Genta,
Gimenez, perak Warthin-Starry, violet Creosyl) untuk mendeteksi infeksi dalam kadar rendah
dan untuk menunjukkan karakteristik morfologi H.pylori. Keuntungan pemeriksaan secara
histologi selain dapat disimpan, irisan dari biopsi dapat diperiksa kapanpun; dan adanya
gastritis, atrofi, ataupun metaplasia intestinal dapat pula diperiksa. Spesimen biopsi dari
bagian lain lambung dapat disimpan dalam formalin untuk diproses hanya jika histologi
antrum tidak dapat disimpulkan. 39
2. Kultur. Isolasi mikrobiologi adalah baku emas teoritis untuk identifikasi infeksi bakteri,
namun kultur H.pylori kurang dapat dipercaya. Risiko pertumbuhan berlebih maupun
kontaminasi membuatnya kurang sensitif, dan metode ini adalah metode yang paling tidak
mudah dikerjakan bersama endoskopi. Meskipun hanya sedikit pusat kesehatan yang secara
rutin menawarkan isolasi mikrobiologis H.pylori, prevalensi strain multiresisten membuat
metode kultur dan uji sensitivitas terhadap antibiotik menjadi persyaratan bagi pasien dengan
infeksi persisten dengan kegagalan terapi.39
3. Uji urease. Metode ini bersifat cepat dan sederhana untuk deteksi infeksi H.pylori namun
hanya menunjukkan ada atau tidaknya infeksi. Pemeriksaan CLO dan pemeriksaan urease
yang lebih murah ternyata memiliki sensitivitas dan spesifisitas yang serupa. Namun,
sensitivitas pemeriksaan urease seringkali lebih tinggi dibanding metode berbasis biopsi
karena seluruh spesimen biopsi ditempatkan di dalam media sehingga dapat menghindari
sampel tambahan ataupun kesalahan proses terkait histologi maupun kultur. Sensitivitas
pemeriksaan urease biopsi terlihat jauh lebih rendah (sekitar 60%) pada pasien dengan
perdarahan saluran cerna atas. Namun kondisi tersebut dapat diperbaiki dengan menempatkan
2.5.2 Pemeriksaan non-invasif
1. Serologi. Infeksi H.pylori menimbulkan respon mukosa lokal dan antibodi sistemik.
Antibodi IgG terhadap H.pylori dalam sirkulasi dapat dideteksi melalui antibodi enzyme
linked immunosorbent assay (ELISA) atau uji aglutinasi lateks. Pemeriksaan tersebut
umumnya sederhana, reprodusibel, tidak mahal, dan dapat dilakukan terhadap sampel yang
disimpan. Metode ini banyak digunakan dalam studi epidemiologi, termasuk studi
retrospektif untuk menentukan prevalensi maupun insiden infeksi. Individu sangat bervariasi
terkait respon antibodi terhadap antigen H.pylori, dan tidak ada antigen yang sama yang
dapat dikenali melalui serum dari semua subyek. Oleh karena itu akurasi pemeriksaan
serologis bergantung kepada antigen yang digunakan sehingga penting untuk melakukan
validasi lokal terhadap ELISA H.pylori. Pada orang tua dengan infeksi yang telah
berlangsung lama, gastritis atrofi dikaitkan dengan hasil negatif palsu. Konsumsi obat
anti-inflamasi non-steroid juga dilaporkan mempengaruhi akurasi ELISA. Titer antibodi turun
secara perlahan pasca-keberhasilan eradikasi sehingga serologi tidak dapat digunakan untuk
menentukan eradikasi H.pylori ataupun untuk menentukan tingkat reinfeksi. Meskipun titer
antibodi IgM terhadap H.pylori menurun seiring bertambahnya usia, tidak ada assay yang
menunjukkan akuisisi baru. Karena infeksi ini biasanya asimtomatik, sulit untuk
mengidentifikasi dan menegakkan jalur transmisi. Keuntungan metode serologi adalah
perkembangan uji finger prick yang menggunakan assay fase solid terfiksir untuk mendeteksi
adanya imunoglobulin H.pylori. Near patient test (NPT) dapat dilakukan di pusat kesehatan
primer dan lebih sederhana dibanding 13C-urea breath test yang merupakan satu-satunya NPT yang digunakan saat ini. Namun akurasi NPT serologis lebih rendah dibanding yang
dilaporkan untuk pemeriksaan ELISA standar menggunakan preparat antigen yang sama.
Pemeriksaan ini sering digunakan untuk menenangkan pasien, namun saat ini belum ada studi
yang membandingkan akurasi, efektivitas biaya, dan nilai jaminan dari 13C-urea breath test dengan NPT serologis di pusat kesehatan primer.39
2. Urea breath test (UBT). Deteksi non-invasif terhadap H. pylori melalui uji 13C-urea breath test memiliki prinsip dasar yaitu larutan yang dilabel urea dengan karbon-13 akan dihidrolisasi secara cepat di sepanjang mukosa lambung dan melalui sirkulasi sistemik,
diekskresikan sebagai 13CO2 dalam udara ekspirasi. Pemeriksaan ini mendeteksi infeksi saat
35 eradikasi, dan mendeteksi infeksi pada anak. Pemeriksaan 14C-urea breath test mirip dengan
13
C-urea breath test namun bersifat radioaktif dan tidak dapat dilakukan di pusat kesehatan primer. 39
3. Faecal antigen test. Dalam pemeriksaan antigen di feses, ELISA sandwich sederhana
digunakan untuk mendeteksi keberadaan antigen H. pylori yang terbungkus feses. Studi
melaporkan sensitivitas dan spesifisitas yang mirip dengan 13C-urea breath test (>90%), dan teknik ini berpotensi untuk dikembangkan sebagai NPT. Keutungan utama dari pemeriksaan
ini adalah dalam studi epidemiologi berskala besar terhadap akuisisi H. pylori pada anak.39
2.6 Patofisiologi
2.6.1 Patofisiologi Gastritis secara Umum
Terjadinya gastritis secara umum karena ketidakseimbangan faktor agresif dan
defensif, di mana faktor agresif lebih dominan daripada faktor defensif. Yang termasuk
faktor agresif antara lain asam lambung, pepsin, refluks bilier, nikotin, alkohol, NSAID,
kortikosteroid, H.pylori, dan adanya radikal bebas. Yang termasuk faktor defensif antara
lain mikrosirkulasi mukosa, sel epitel permukaan, prostaglandin, fosfolipid, mukus,
bikarbonat, dan motilitas saluran pencernaan. 30
Gambar 2.3. Patofisiologi gastritis 31
Keterangan : (A) mukosa gaster normal akibat adanya keseimbangan antara faktor agresif dan pertahanan mukosa. (B) pembentukan ulkus gaster karena ketidakseimbangan faktor agresif dan faktor pertahanan mukosa.
2.6.2 Patofisologi Gastritis H.Pylori
H.pylori memiliki efek stimulasi terhadap respon non spesifik dan spesifik. Kolonisasi H.pylori pada mukosa gaster akan merangsang sistem imun non spesifik
berupa aktivasi proinflamasi dan faktor antibakterial dari sel epitel gaster. H.pylori juga
menstimulasi sistem imun spesifik yaitu selluler dan humoral. Meskipun demikian sangat
sulit untuk mengeliminasi H.pylori dari mukosa gaster dan biasanya infeksi H.pylori
menetap (persisten). Hal ini disebabkan H.pylori memiliki kemampuan untuk
mempengaruhi respon imun untuk menghindari eliminasi serta menurunkan regulasi
kerusakan jaringan. Respon H.pylori terhadap sistem imun humoral yaitu menstimulasi
terbentuknya antibodi yaitu IgA dan IgG. Namun efek antibodi ini masih kontroversi
yaitu melindungi sedangkan dari laporan lainnya menyebakan persistensi kolonisasi dan
menghambat efek perlindungan. Sel T memiliki efek dominan dalam sistem imun H.pylori. Sel Th1 memproduksi IFN-γ dan akan menyebabkan munculnya proinflamasi lain seperti : TNF-α, IL-12 dan IL-18.31
H.pylori tinggal di lapisan mukus yang melapisi epitel gaster. H.pylori mensekresikan faktor-faktor, peptida, dan lipopolisakarida yang bersifat kemotaktik
terhadap neutrofil dan monosit. In vivo, infeksi H.pylori di mukosa gaster menginduksi
produksi sitokin-sitokin IL-1β, IL-6, IL-8 dan TNF-α. IL-1 atau TNF-α saja, maupun
TNF-α bersinergis dengan IFN-γ menginduksi produksi IL-8 di sel gaster. Peningkatan
produksi IL-8 bisa disebabkan infeksi H.pylori maupun sekunder dari peningkatan kadar
IL-1 atau TNF-α. Produksi IL-8 oleh sel epitel gaster berkepanjangan dapat
menyebabkan rekruitmen neutrofil dan limfosit ke jaringan yang terinfeksi.24
37 H.pylori menginduksi sitokin-sitokin proinflamasi seperti IL-1β, IL-6, TNF-α, IL -8 melalui aktivasi NF-κB. Respons inflamasi yang terjadi menyebabkan Treg
mensekresikan sitokin imunosupresif, yang mempertahankan kadar H.pylori dalam
mukosa gaster. Peran Treg dalam memodulasi respon imun pejamu selama infeksi
H.pylori telah beberapa kali dipikirkan. Treg adalah subset dari sel T yang mensupresi
respon imun pejamu dan berhubungan dengan kanker. Sel T khusus tersebut
mengekspresikan marker seperti CD4, CD25, dan FoxP3. Treg meningkatkan toleransi
terhadap antigen diri sendiri dan pada saat bersamaan memfasilitasi pertumbuhan tumor
melalui imunosupresi. Beberapa studi menyebutkan peningkatan dari TH1, TH2, Treg,
mengindikasikan keseimbangan imunomodulasi pejamu untuk inflamasi. Infeksi
H.pylori memiliki respon TH1 yang kuat yang dimediasi oleh sitokin TH1 termasuk IFN-γ, IL-12, TNF-α, dll. Kondisi inflamasi ini diseimbangkan dengan IL-10 dari Treg untuk menyebabkan infeksi kronik dengan imunosupresi parsial. 32
2.7 Hubungan Sitokin Inflamasi dengan Gastritis
2.7.1 Sitokin Inflamasi terhadap Gastritis non H .pylori
Kadar serum sitokin seperti IL-6, TNF-α, IL-1β, dan IFN-γ pada pasien yang
mengalami inflamasi lebih tinggi daripada individu normal. Penurunan kadar IL-6 dan
TNF-α merupakan petunjuk terjadinya perbaikan inflamasi. IL-6 disekresikan oleh sel T
dan makrofag untuk menstimulasi respons imun terutama selama ada kerusakan jaringan
yang menyebabkan terjadinya inflamasi. IL-6 juga berperan dalam melawan infeksi. TNF-α merupakan sitokin yang terlibat dalam inflamasi sistemik dan termasuk kelompok sitokin yang menstimulasi reaksi akut. TNF-α menginduksi apoptosis dan inflamasi. IL-6 dan TNF-α berperan dalam lesi di lambung. 14
Injuri gaster akibat kimiawi seperti NSAID bisa menyebabkan peningkatan ekspresi mediator inflamasi seperti TNF-α, IL-1β, maupun IL-8. Penelitian Lee et al (2012) pada tikus menemukan pemberian indometasin secara signifikan meningkatkan
ekspresi TNF-α, IL-1β, IL-8 pada sel epitel gaster. Hal ini mengkonfirmasi mediator
inflamasi berperan dalam kerusakan sel epitel gaster akibat indometasin. Menurut
Tanigawa et al (2009), pemberian PPI bisa menurunkan produksi TNF-α dan IL-1β. Jadi
PPI memiliki efek anti inflamasi dengan menekan secara langsung induksi TNF-α dan
IL-1β melalui inhibisi NF-κB dan aktivasi ERK pada sel-sel inflamasi. Penelitian
Tanigawa et al (2009) dan Lee et al (2012) mengkonfirmasi bahwa pada erosi gaster
terjadi peningkatan sitokin-sitokin inflamasi. 12,13
Gastritis kimiawi/gastropati seperti NSAID memiliki berbagai patogenesis/
mekanisme yang menyebabkan cedera seperti inhibisi prostaglandin, efek toksik
langsung dari NSAID, dan stimulasi sitokin proinflamasi seperti TNF-α, IL-1β, IL-6,
IL-8, IFN-γ dan infiltrasi sel-sel inflamasi di lamina propria yang menyebabkan penurunan
aliran darah mukosa, hipoksia, dan penurunan pertahanan mukosa. 15,33
Pada percobaan terhadap model tikus yang terkena gastritis akibat diinduksi oleh
HCl/etanol, terjadi peningkatan kadar serum dari IL-6 dan TNF-α. Adanya penurunan
sitokin proinflamasi ini setelah mendapatkan gastroprotektor. 14
39 inflamasi jaringan gaster. Peningkatan IL-10 sebagai sitokin antiinflamasi guna menekan
inflamasi di gaster. 34
Naito et al dan Jainu et al melaporkan bahwa inflamasi gaster mukosa akibat
aspirin akibat peningkatan produksi TNF-α dan IL-1 yang berdampak pada akumulasi
neutrofil. 35,36
Iskemia pun menginduksi lesi gaster, kemungkinan akibat banyak pembentukan radikal bebas, tetapi peranan sitokin proinflamasi seperti IL-1β dan TNF-α dalam proses penyembuhan lesi ini belum dipelajari mendalam. Konturek et al melakukan percobaan
pada tikus menemukan bahwa lesi gaster dimediasi oleh pembentukan radikal bebas,
menyebabkan supresi mikrosirkulasi gaster dan aktivitas sekresi dari gaster. Serta terjadi peningkatan superoksida dismutase dan pelepasan IL-1β dan TNF-α bisa mengaktivasi ekspresi ICAM-1 dan infiltrasi neutrofil, yang berperan penting dalam progresivitas
iskemia yang menginduksi erosi gaster akut menjadi ulkus kronis. 37
2.7.2 Sitokin Inflamasi terhadap Gastritis H.pylori
H. pylori yang menginfeksi kurang lebih 50% penduduk di seluruh dunia, yang
menyebabkan inflamasi lambung kronis yang akan menjadi atrofi, metaplasia, displasia
dan akhirnya kanker lambung. 4
Inflamasi kronis tersebut melibatkan netrofil, limfosit (sel T dan B), sel plasma,
dan makrofag, sesuai dengan tingkat degenerasi dan kerusakan selnya. Mekanisme
inflamasi lainnya melalui kontak langsung dengan sel epitel lambung dan merangsang
pembentukan serta pelepasan sitokin inflamasi. Adanya inflamasi karena H pylori dapat
ditunjukkan dengan peningkatan IL-1β, IL-2, IL-6, IL-8 dan TNF-α . 38
Inflamasi lambung ditemukan bervariasi pada pasien yang terinfeksi dengan H
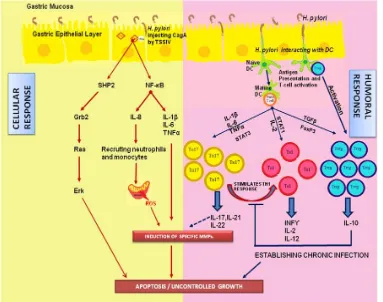
pylori tergantung dari respon imun pejamu terhadap organisme. Mekanisme inflamasi terhadap infeksi H pylori melibatkan respon imun spesifik dan imun non spesifik, seperti
terlihat pada gambar di bawah ini. Proses tersebut juga akan menimbulkan keluarnya
mediator sitokin, pada gastritis karena H pylori, seperti pada tabel di bawah. 39
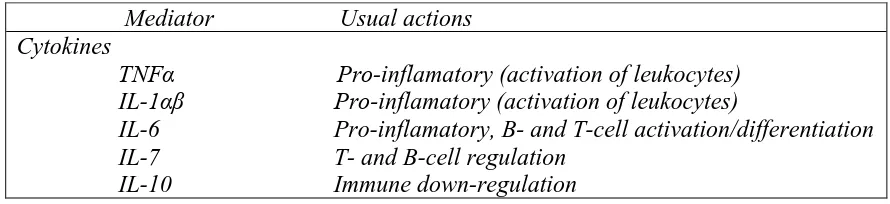
Tabel 2.7 Sitokin yang dihasilkan sebagai implikasi dari gastritis H.pylori 40
Mediator Usual actions Cytokines
TNFα Pro-inflamatory (activation of leukocytes) IL-1αβ Pro-inflamatory (activation of leukocytes)
IL-6 Pro-inflamatory, B- and T-cell activation/differentiation IL-7 T- and B-cell regulation
IL-12 Stimulation of Th 1 response
IFN-γ Pro-inflamatory, especially cellular immunity GM-CSF Pro-inflamatory, maturation factor
Chemokines
IL-8 Nuetrophil recruitment and activation GRO-α Nuetrophil recruitment and activation RANTES Mononuclear cell recruitment and activation MIP-1α Mononuclear cell recruitment and activation
Gambar 2.6. Inflamasi yang berhubungan dengan H. Pylori. 39
TNF-α berperan untuk meningkatkan reaksi inflamasi dan diyakini berperan
penting dalam kerusakan mukosa gaster akibat H.pylori. TNF-α menyebabkan kaskade
inflamasi terhadap infeksi, respons inflamasi berlebihan di mukosa gaster yang
berhubungan dengan inhibisi sekresi asam lambung dan kerentanan yang lebih tinggi
terhadap Ca gaster.40
41 neutrofil, di mana makin tinggi kadar sitokin sebanding dengan peningkatan derajat
inflamasi dan aktivitas neutrofil. 8
Sementara IL-10 yang merupakan sitokin anti inflamasi dapat mengurangi
inflamasi dan efek sitotoksik dari sitokin-sitokin proinflamasi. Lebih lanjut IL-10 dapat
menghambat perlengketan monosit ke sel endotel. IL-10 diketahui bekerja menurunkan
aktivitas sel imun dan inflamasi seperti sel T dan neutrofil. Semua data ini menunjukkan
IL-10 potensial menekan inflamasi dan mendukung kolonisasi H.pylori yang lebih lama
pada mukosa gaster.8.26,40
2.8. Interleukin-10
2.8.1 Definisi Interleukin 10
IL-10 merupakan sitokin imunoregulator yang poten dan bersirkulasi sebagai
homodimer yang terdiri dari 160 protein asam amino. IL-10 ini terletak pada kromosom
manusia 1q31-32. IL-10 pertama kali dikenal sebagai cytokine synthesis inhibiting factor
(CSIF) oleh karena dapat menekan sintesis sitokin pada sel T tertentu. IL-10 merupakan
anggota dari keluarga sitokin IL-10 yang terdiri dari IL-19, IL-20, IL-22, IL-24, IL-26,
IL-28 dan IL-9. 26
IL-10 diproduksi oleh banyak sel diantaranya sel B, sel T khususnya Tregs (T cell
regulatory), monosit dan makrofak serta sel dendritik, tetapi tidak diproduksi oleh sel-sel epitel. Sebuah penelitian yang meneliti tentang defisiensi IL-10 pada tikus menyebutkan
bahwa Tregs merupakan sumber penting dalam produksi IL-10. Pada awalnya hanya T
helper (Th)2 yang dapat memproduksi IL-10, namun pada saat-saat ini Th 1 juga dilaporkan dapat menghasilkan IL-10. Dendritic Cell (DC) yang diaktivasi oleh H.pylori
akan memproduksi sejumlah sitokin diantaranya TNF-α, IL-1β, IL-6, IL-8, IL-10, IL-12
dan IL-23. TNF-α merupakan sitokin tertinggi yang diproduksi yaitu 1000-2000 kali
lipat dibanding nilai basal, sedangkan IL-6 kenaikan 1000 kali lipat, IL-10 mengalami
kenaikan 200-400 kali lipat, IL-8 mengalami kenaikan 10 kali lipat dan IL-1β 150 kali
lipat. 41,42
IL-10 yang disekresikan oleh Tregs merupakan senyawa yang penting dalam
mencegah penyakit pada saluran gastrointestinal. Sebuah penelitian juga menyebutkan
bahwa terdapat banyak IL-10 pada intra epitel limfosit pada usus halus dan limfosit
lamina propria pada kolon setelah stimulasi sel T reseptor. Kulberg dkk, melaporkan
IL-10 juga dapat mengontrol inflamasi dan mencegah terbentuknya antigen usus dan
kerusakan epitel usus pada kolitis ulseratif. IL-10 dengan kadar tinggi merupakan
prognosis yang rendah dari Ca gaster. 26
2.8.2. Mekanisme kerja Interleukin 10
Mekanisme kerja utama 10 adalah menekan inflamasi dan regulasi sel T.
IL-10 dapat secara spesifik menekan produksi IFN-Y dan IL-2 melalui Th1. Th1
merupakan sumber utama dari IFN-Y, yang bersifat mengaktivasi monosit dan
menginhibisi proliferasi Th2. Melalui penekanan terhadap IFN-Y, IL-10 membantu
memelihara polarisasi sel T helper pada Th2. IL-10 juga dapat menghambat produksi
IFN-Y melalui sel Natural Killer (NK) dan menghambat aktivasi NF-Kb. Faktor-faktor
transkripsi ini mengontrol proinflamasi dan gen antiapototik yang berperan penting
dalam terjadinya inflamasi akut atau kronik. Melalui blokade aktivasi NF-Kb, IL-10
menginhibisi IL-1 dalam menginduksi sintesis COX-2 dan ekspresi COX-2 pada
neutrofil. IL-10 juga dapat menghambat perlekatan monosit dengan sel-sel endotel.
Disisi lain, IL-10 menunjukkan imunostimulator pada sel B dan sel endotel. IL-10 dapat
mempengaruhi fungsi sel mast dan secara signifikan memperluas aktivitas pertumbuhan
faktor stem sel pada sel ini. Berikut ini merupakan tabel yang berisikan beberapa faktor
yang diregulasi oleh NF-kB sebagai respon terhadap H. pylori . 26
Peranan yang luas dari IL-10 pada penyakit-penyakit infeksi, termasuk infeksi
H.pylori, memiliki dua gambaran utama yaitu sebagai pencegah berkembangnya lesi-lesi imunopatologi yang merupakan dampak dari respon imun protektif yang mengalami
eksarsebasi, sedangkan di sisi lain IL-10 berperan dalam timbulnya persistensi patogen
dengan cara mempengaruhi sistem imun alamiah dan adaptif. 3
Tabel 2.8. Beberapa faktor yang diregulasi oleh NF-kB sebagai respon terhadap infeksi
H.pylori . 26
H.pylory-induced
Host factors regulated by
NF-kB activation
Role References
IL-8 Chemotaxis for neurotrophil and lymphocytes
(Chu et all., 2003)
iNOS Enzyme that generates cell damaging NO
(Lim et al., 2001)
43 synthesis of prostaglandins
hBD-2 Anti-bacterial peptide (Wada et al., 2001)
MMP-9 and -7 Matrix metalloproteinases tumour invasiveness
(Mori et al., 2003;
Wroblewski et al., 2003) IAP and Mel-1 Anti-apoptotic genes (Chang et al., 2004;
Maeda et al., 2002) IL-12p40.TNF-α.
IFN-γ. IL-2.IL-6
Pro-inflammatory cytokines (Lu et al., 2005;
Takesima et al., 2009;
Toyoda et al., 2009) VEGF.HIF-α Angiogenic growth factors (Yeo et al., 2006)
Bax Apoptotic gene (Cha et al., 2009)
PAI-2 Inhibit fibrinolysis (degradation Of blood clots
(Varro et al., 2004)
Ekspresi IL-10 minimal pada jaringan yang normal dan memerlukan pencetus dari
flora patogenik maupun komensal. Induksi IL-10 melibatkan ERK1/2, p38, dan sinyal
NF-κB, dan aktivasi transkripsi melalui promoter dari faktor transkripsi NF-κB dan AP
-1. Mekanisme IL-10 dalam imunoregulasi dan efek stimulasi dapat dilihat pada gambar
berikut : 42,43
IL-10 dilepaskan oleh sel T sitotoksik untuk menghambat kerja sel NK selama
respons imun terhadap infeksi virus. IL-10 menurunkan ekspresi sitoksin Th1, antigen
MHC kelas II, dan makrofag. IL-10 dapat meningkat masa hidup sel B, proliferasi, dan
produksi antibodi. IL-10 mampu menghambat sintesis sitokin proinflamasi seperti IFN-γ,
IL-2, IL-3, TNF-α, GM-CSF yang diproduksi oleh makrofag dan sel T regulator. IL-10
juga dapat menekan kapasitas presentasi antigen dari APC (Antigen Presenting Cells). Di
satu sisi IL-10 dapat bersifat stimulasi terhadap Th2, sel mast, dan merangsang maturasi
sel B dan produksi antibodi. 42,43
IL-10 secara spesifik menekan produksi IFN-γ dan IL-2 oleh sel Th. IL-10 juga dapat menghambat produksi IFN-γ oleh sel NK dan menghambat aktivasi NF-κB. Melalui blokade aktivasi NF-κB, IL-10 menghambat IL1 yang dimediasi oleh induksi sintesis protein COX-2 dan ekspresi protein COX-2 di neutrofil. Lebih lanjut IL-10 dapat
menghambat perlengketan monosit ke sel endotel. IL-10 diketahui bekerja menurunkan
aktivitas sel imun dan inflamasi seperti sel T dan neutrofil. IL-10 juga diketahui menekan
sekresi IL-8 dan ekspresi molekul adhesi intraseluler-1 (ICAM-1). Semua data ini
menunjukkan IL-10 potensial menekan inflamasi dan mendukung kolonisasi H.pylori
yang lebih lama pada mukosa gaster. Pada model tikus, IL-10 terbukti melindungi dari
perkembangan gastritis berat dan kerusakan mukosa dengan menurunkan H.pylori yang
diinduksi oleh respons Th1. 41,42,43
Sitokin 10 merupakan agen utama dalam memodulasi berbagai penyakit.
IL-10 merupakan supresor alamiah dari reaksi imunologi. Pada penelitian yang dilaporkan
oleh Abdollahi H, et al, tidak terdapat perbedaan level IL-10 pada serum ataupun antrum
dan corpus gaster. Pada beberapa kondisi IL-10 ini tidak terdeteksi pada H.pylori oleh
karena beberapa alasan diantaranya: rendahnya respon sel Th2 terhadap H.pylori ataupun
oleh karena aktivitas yang lemah dari endotoksin LPS (Lipopolisakarida). Disebutkan
juga level serum IL-10 tidak tergantung pada infeksi H.pylori, namun peningkatan IL-10
terjadi pada kasus malignansi pada gaster. 44
2.8.3 Hubungan antara IL-10 dengan gastritis H.pylori
Populasi yang terinfeksi H.pylori memiliki manifestasi yang berbeda-beda
diantaranya ada yang simptomatik dan juga asimptomatik. Belum terdapat penjelasan yang
pasti, namun disangkakan hal ini dipengaruhi beberapa faktor diantaranya : bakteri,
45 melaporkan bahwa genetik dari host mempengaruhi inflamasi H.pylori serta genetik host juga
mengontrol patogen dari H.pylori yaitu dengan cara memproduksi IL-10.45
H.pylori bertahan secara persisten pada mukosa lambung oleh karena terjadi hasil interaksi lingkungan gaster dengan sistem imun. Faktor dari H.pylori berupa kemampuan
kolonisasi, kemampuan adhesi yang dipengaruhi oleh BabA serta virulen H.pylori lainnya.
Kolonisasi H.pylori menyebabkan rekrutmen sel-sel inflamasi seperti neutrofil, limfosit dan faktor proinflamasi kronik seperti sitokin : IL-1β, IL-6, IL-8,IL-17 dan TNF-α. Faktor virulens dari H.pylori dan Il-1β berkontribusi terhadap terjadinya ulkus peptikum dan metaplasia intestinal.46
Beberapa studi telah menunjukkan bahwa terdapat hubungan antara IL-10 dengan
gastritis H.pylori yaitu terdapat peningktan IL-10 diantaranya penelitian oleh Holck et al,
2003. Holck et al melaporkan terdapat peningkatan nilai IL-10 pada H.pylori dibandingkan
non H.pylori dan juga terdapat hubungan antara IL-10 dengan skor aktivitas inflamasi,
inflamasi kronik dan bacterial load. 8
Pada Penelitian Goll et al, 2007. Goll et al melaporkan sampel pasien dengan H.pyori
(+) terjadi peningkatan IL-10 sebanyak 6,7 kali dibandingkan dengan pasien non H.pylori .
Menurut Bodger, et al dilaporkan bahwa sekresi IL-10 pada epitel lambung dapat mereduksi
respon imun lokal dalam menghadapi antigen intralumen, IL-10 juga berperan dalam
2.9.
Kerangka Teori
Gambar 2.8. Kerangka Teori
Pasien Abdominal Discomfort
Dispepsia
Gastritis
Endoskopi: mukosa mengalami edema, eritema (spotted, patchy, linear) /eksudat/ perdarahan/ erosif.
Biopsi
CLO test: gel tetapkuning (negatif) / berubah warna menjadi merah (positif)
Histopatologi: Dinilai derajat infiltrasi limfosit, neutrofil, atrofi, dan metaplasia intestinal. Skor 0-3 (ringan, sedang, berat) menurut system Sydney.
Hubungan IL-10 pada gastritis H. pylori (+) Hubungan IL-10 pada gastritis H. pylori (-) Wawancara PADYQ: kuesioner dengan 11 pertanyaan yang mengevaluasi gejala nyeri epigastrium, mual, muntah, perut kembung, dan
early satiation. Gejala nyeri epigastrium, mual,
perut kembung bagian atas dinilai intensitas, durasi, dan frekuensi; sementara muntah dan
early satiationdinilai frekuensi. Skor > 6 :
dispepsia
Biopsi dilakukan pada 5 tempat kurvatura mayor dan minor antrum, insisuraangularis, anterior dan posterior korpus
H. pylori (+)
H. pylori (-)
IL-10 IL-10