LAPORAN PRAKTIKUM BAKTERIOLOGI
“Penghitungan Angka Kuman Pada Urine”
Oleh :
Kadek Susi Wiandari
P07134011028
KEMENTERIAN KESEHATAN REPUBLIK INDONESIA
POLITEKNIK KESEHATAN DENPASAR
JURUSAN DIII ANALIS KESEHATAN
2012
BAB I PENDAHULUAN
1.1 Latar Belakang
Urine merupakan hasil metabolisme tubuh yang dikeluarkan melalui ginjal. Dari 1200 ml darah yang melalui glomeruli per menit akan terbentuk filtrat 120 ml per menit. Filtrat tersebut akan mengalami reabsorpsi, difusi dan ekskresi oleh tubuli ginjal yang akhirnya terbentuk satu mili liter urin per menit. (R. Wirawan, S. Immanuel, R. Dharma, 2008).
Secara umum dapat dikatakan bahwa pemeriksaan urin selain untuk mengetahui kelainan ginjal dan salurannya juga bertujuan untuk mengetahui kelainan-kelainan diberbagai organ tubuh seperti hati, saluran empedu, pankreas, korteks adrenal, uterus dan lain-lain. Selama ini dikenal pemeriksaan urin rutin dan lengkap. Yang dimaksud dengan pemeriksaan urin rutin adalah pemeriksaan makroskopik, mikroskopik dan kimia urin yang meliputi pemeriksaan protein dan glukosa. Sedangkan yang dimaksud dengan pemeriksaan urin lengkap adalah pemeriksaan urin rutin yang dilengkapi dengan pemeriksaan benda keton, bilirubin, urobilinogen, darah samar dan nitrit. Pemeriksaan makroskopik meliputi pemeriksaan volume, warna, kejernihan, berat jenis, bau dan pH urin. Bau urin normal disebabkan oleh asam organik yang mudah menguap. Bau yang berlainan dapat disebabkan oleh makanan seperti jengkol, pate, obat-obatan seperti mentol, bau buah-buahan seperti pada ketonuria. Bau amoniak disebabkan perombakan ureum oleh bakteri dan biasanya terjadi pada urin yang dibiarkan tanpa pengawet. Adanya urin yang berbau busuk dari semula dapat berasal dari perombakan protein dalam saluran kemih. Pemeriksaan mikroskopik yaitu pemeriksaan sedimen urin. Sedangkan pemeriksaan kimia urine meliputi pemeriksaan pH, protein, glukosa, keton, bilirubin, darah, urobilinogen dan nitrit. Penyakit infeksi akibat kuman pathogen sendiri merupakan penyakit yang sering dijumpai di seluruh dunia. Infeksi dalam tubuh manusia sendiri beragam jenisnya, diantaranya infeksi saluran nafas, infeksi saluran kemih, dan infeksi saluran cerna. Infeksi
saluran kemih (ISK) merupakan infeksi tersering kedua setelah infeksi saluran nafas atas yang terjadi pada populasi dengan rata-rata 9.3% pada wanita di atas 65 tahun dan 2.5-11% pada pria di atas 65 tahun.Infeksi saluran kemih merupakan infeksi nosokomial tersering yang mencapai kira-kira 40-60% (Schaeferr, 2002).
Untuk menyatakan adanya ISK harus ditemukan bakteri dalam urin. Bakteriuria yang disertai dengan gejala pada saluran kemih disebut bakteriuria simptomatis. Sedangkan yang tanpa gejala disebut bakteriuria asimptomatis. Dikatakan bakteriuria positif pada pasien asimptomatis bila terdapat lebih dari 105 koloni bakteri dalam sampel urin midstream, sedangkan pada pasien simptomatis bisa terdapat jumlah koloni lebih rendah. Pemeriksaan Angka Kuman, dengan menggunakan metode pour plate. Tujuan dari pemeriksaan angka kuman adalah untuk mengetahui jumlah bakteri per ml sampel dan untuk mengetahui kemungkinan adanya ISK (infeksi saluran kemih)
Sebagian besar ISK merupakan infeksi yang bersifat asenden/menjalar ke atas. Wanita terutama sangat rentan terhadap ISK, oleh karena saluran kencingnya lebih pendek daripada pria. Pada wanita, biasanya kuman-kuman penyebab ISK yang berasal dari anus berpindah ke kemaluan dan membentuk koloni. Yang kemudian masuk ke dalam kandung kemih melalui saluran kencing yang pendek dengan spontan maupun mekanik pada saat hubungan seksual. Pada pria, pasien penderita Pembesaran Prostat Jinak (PPJ) umumnya lebih beresiko terkena ISK karena adanya hambatan dalam pengeluaran air seni. Pada pasangan homoseksual juga beresiko terkena ISK yang dihubungkan dengan frekuensi anal seks (hubungan seksual melalui anus). Pada bayi baru lahir dan juga pada laki-laki usia muda terdapat bukti bahwa sirkumsisi (sunat) memperkecil angka kejadian ISK secara bermakna.
Penyebab terbanyak adalah Gram-negatif termasuk bakteri yang biasanya menghuni usus yang kemudian naik ke sistem saluran kemih. Dari Gram-negatif ternyata E.Coli menduduki tempat teratas, yang kemudian diikuti oleh Proteus, Klebsiela, Enterobacter, dan Pseudomonas.
Jenis kokus Gram-positif lebih jarang sebagai penyebab ISK sedangkan entercoccus dan Staphylococcus aureus sering ditemukan pada pasien dengan batu saluran kemih, lelaki usia lanjut dengan hipertrofi prostat atau pada pasien yang
menggunakan kateter. Bila ditemukan Staphylococcus aureus dalam urin harus dicurigai adanya infeksi hematogen melalui ginjal. Demikian juga Pseudomonas aeroginosa dapat menginfeksi saluran kemih melalui jalur hematogen dan pada kira-kira 25% pasien demam tifoid dapat diisolasi Salmonella pada urin. Bakteri lain yang dapat menyebabkan ISK melalui jalur hematogen ialah Brusella, Nokardia, Actinomyces dan Mycobacterium tuberculosae
Pemeriksaan yang dapat dilakukan adalah pemeriksaan darah dan pemeriksaan urin. Pada pemeriksaan darah dicari apakah ada tanda-tanda infeksi. Pemeriksaan urin merupakan standar baku emas atas diagnosis ISK. Urin yang diperiksa ditanam di atas media biakan untuk kuman dan dilihat apakah ada kuman yang tumbuh. Infeksi saluran kemih pada manusia biasanya diidentifikasi melalui perhitungan angka kuman dalam urine, pada urine normal urine tidak mengandung mikroorganisme (steril). Sedangkan indikasi adanya infeksi saluran kemih apabila jumlah kuman dalam urine lebih besar 100.000/ml urine. Namun, dalam proses perhitungan angka kuman sendiri, tidak bisa apabila langsung dilakukan perhitungan angka kuman,terlebih dahulu perlu dilakukan tahap pengenceran sampel dan penanaman.
1.2 Rumusan Masalah
Adapun rumusan masalah dari penulisan laporan ini adalah :
1.2.1 Bagaimanakah teknik penghitungan angka kuman pada urine?
1.2.2 Bagaimanakah cara untuk mengetahui jumlah kuman pada urine pasien dan ada atau tidak infeksi saluran kemih pada pasien?
1.3 Tujuan Penulisan
Adapun tujuan dari penulisan laporan ini adalah :
1.3.1 Untuk mengetahui teknik penghitungan angka kuman pada urine. 1.3.2 Untuk mengetahui jumlah kuman pada urine pasien dan ada atau tidak
1.4 Manfaat Penulisan
Adapun manfaat dari penulisan laporan ini adalah :
1.4.1 Agar mengetahui teknik teknik penghitungan angka kuman pada urine 1.4.2 Agar mengetahui jumlah kuman pada urine pasien dan ada atau tidak
BAB II
TINJAUAN PUSTAKA
Menghitung atau menentukan banyaknya mikroba dalam suatu bahan (makanan, minuman, dan lain-lain) dilakukan untuk mengetahui sampai seberapa jauh bahan itu tercemar oleh mikroba. Dengan mengetahui jumlah mikroba, maka dapat diketahui kualitas mikrobiologi dari bahan tersebut. Bahan yang dapat dikatakan baik jika jumlah mikroba yang terkandung dalam bahan tersebut masih di bawah jumlah standar yang ditentukan oleh suatu lambaga. Kandungan mikroba pada suatu bahan juga sangat menentukan tingkat kerusakannya, serta dapat ditentukan oleh tingkat kelayakan untuk dikonsumsi.
Secara kebetulan seorang peneliti Jerman melihat bahwa koloni yang tumbuh pada kentang yang telah direbus pada akhirnya dapat menemukan jalan untuk memisah menjadi individu-individu. Caranya; mereka mengembangkan
media spesifik untuk menumbuhkan mikroorganisme. Media adalah substansi yang memenuhi kebutuhan nutrisi mikroorganisme. Koch dan koleganyanya juga menunjukkan bahwa senyawa dari alga yang disebut agar dapat membuat media menjadi padat. Richard J.Petri (1852 – 1921) membuat piringan kaca bertutup untuk menempatkan media agar alat tersebut selanjutnya disebut Petri dish yang masih digunakan sampai sekarang. Pada tahun 1892, dengan menggunakan teknik biakan murni Koch dan anggotanya menemukan agen-agen penyebab typus, dipteri,tetanus, pneumonia dan lain sebagainya. Koch mengenalkan penggunaan binatang model untuk penyakit manusia dengan cara menginjeksikan bakteri ke dalam mencit,kelinci, babi atau domba. Ia bahkan menempelkan kamera pada mikroskopnya untuk mengambil gambar dan menggunakannya sebagai bukti untuk menghilangkan keraguan.
Membiakkan bakteri dapat dilakukan dengan berbagi cara, salah satunya pengembangbiakan dalam media cawan petri. Pengembangbiakan dalam cawan ini ada beberapa metode, yaitu :
Metode cawan gores cukup sulit bagi pemula, terutama mahasiswa semester
awal yang baru mengambil mata praktikum mikrobiologi. Kesulitan dari metode ini, yaitu proses penggoresan yang cukup lama dan sulit, sehingga memudahkan terjadinya kontaminasi dan kegagalan. Prinsip metode ini, yaitu mendapatkan koloni yang benar-benar terpisah dari koloni yang lain, sehingga mempermudah proses isolasi.
Cara ini dilakukan dengan membagi cawan petri menjadi 3-4 bagian. Ose steril yang telah disiapkan dilekatkan pada sumber isolat, kemudian menggoreskan ose tersebut pada cawan berisi media steril. Goresan dapat dilakukan 3-4 kali membentuk garis horisontal di satu sisi cawan. Ose disterilkan lagi dengan api bunsen, setelah kering ose tersebut digunakAn untuk menggores goresan sebelumnya pada sisi cawan kedua. Langkah ini dilanjutkan hingga keempat sisi cawan tergores.
Pada metode ini, goresan di sisi pertama diharapkan koloni tumbuh padat dan berhimpitan, sedangkan pada goresan sisi kedua, koloni mulai tampak jarang dan begitu pula selanjutnya, sehingga didapatkan koloni yang tampak tumbuh terpisah dengan koloni lain. Seluruh tahap hendaknya dilakukan secara aseptik agar tak terjadi kontaminasi.
Metode cawan tuang (pour plate)
Metode cawan tuang sangat mudah dilakukan karena tidak membutuhkan keterampilan khusus dengan hasil biakan yang cukup baik. Metode ini dilakukan dengan mengencerkan sumber isolat yang telah diketahui beratnya ke dalam 9 ml garam fisiologis (NaCl 0.85%) atau larutan buffer fosfat. Larutan ini berperan sebagi penyangga pH agar sel bakteri tidak rusak akibat menurunnya pH lingkungan. Pengenceran dapat dilakukan beberapa kali agar biakan yang didapatkan tidak terlalu padat atau memenuhu cawan (biakan terlalu padat akan mengganggu pengamatan).
Perhitungan jumlah suatu bakteri dapat melalui berbagai macam uji seperti uji kualitatif koliform yang secara lengkap terdiri dari tiga tahap yaitu uji penduga (uji kuantitatif, bisa dengan metode MPN), uji penguat dan uji pelengkap. Waktu, mutu sampel, biaya, tujuan analisis merupakan beberapa faktor penentu dalam uji kualitatif koliform. Bakteri koliform dapat dihitung dengan menggunakan metode
cawan petri (metode perhitungan secara tidak langsung yang didasarkan pada anggapan bahwa setiap sel yang dapat hidup akan berkembang menjadi satu koloni yang merupakan suatu indeks bagi jumlah organisme yang dapat hidup yang terdapat pada sampel) seperti yang dilakukan pada percobaan ini (Penn, 1991).
Pengukuran kuantitatif populasi mikroorganisme sangat diperlukan untuk berbagai macam penelaahan mikrobiologis. Berbagai macam cara dapat dilakukan untuk menghitung jumlah mikroorganisme, akan tetapi secara mendasar, ada dua cara yaitu secara langsung dan secara tidak langsung. Ada beberapa cara perhitungan secara langsung, antara lain adalah dengan membuat preparat dari austu bahan (preparat sederhana diwarnai atau tidak diwarnai) dan penggunaan ruang hitung (counting chamber). Sedangkan perhitungan cara tidak langsung hanya untuk mengetahui jumlah mikroorganisme pada suatu bahan yang masih hidup saja (viabel count). Dalam pelaksanaannya, ada beberapa cara yaitu : perhitungan pada cawan petri (total plate count / TPC), perhitungan melalui pengenceran, perhitungan jumlah terkecil atau terdekat (MPN methode), dan kalorimeter (cara kekeruhan atau turbidimetri) (Sutedjo, 1991).
Jumlah mikroba dalam suatu bahan dapat dihitung menggunakan beberapa cara. Namun secara garis besar dibedakan menjadi :
Perhitungan Bakteri secara langsung
Ada beberapa cara perhitungan secara langsung, antara lain adalah dengan membuat preparat dari austu bahan (preparat sederhana diwarnai atau tidak diwarnai) dan penggunaan ruang hitung (counting chamber) (Sutedjo, 1991).
Enumerasi mikroba dapat dilakukan secara langsung yaitu dengan menghitung jumlahnya tanpa ditumbuhkan terlebih dahulu dalam suatu medium, dalam teknik ini semua sel mikroba baik yang idup maupun yang mati akan terhitung. Untuk melakukan enumerasi mikroba dalam suatu bahan seringkali diperlukan pengenceran bertingkat(Rukmi, MG.I., A.T. Lunggani, A. Suprihadi, 2008).
Perhitungan Bakteri Secara Tidak Langsung
Sedangkan perhitungan cara tidak langsung hanya untuk mengetahui jumlah mikroorganisme pada suatu bahan yang masih hidup saja (viabel count). Dalam
pelaksanaannya, ada beberapa cara yaitu : perhitungan pada cawan petri (total plate count / TPC), perhitungan melalui pengenceran, perhitungan jumlah terkecil atau terdekat (MPN methode), dan kalorimeter (cara kekeruhan atau turbidimetri) (Sutedjo, 1991).
Berdasarkan kekeruhan
Mikroba dalam suatu bahan cair dapat dideteksi berdasarkan kekeruhannya. Pertumbuhan sel bakteri didalam suatu medium cair akan meningkatkan kekeruhan media, yang akan mempengaruhi jumlah sinar yang dapat ditransmisikan menembus medium(Rukmi, MG.I., A.T. Lunggani, A. Suprihadi, 2008).
Berdasarkan jumlah lempeng total (plate count)
Cara ini adalah cara yang paling umum digunakan untuk menentukan jumlah mikroba yang masih hidup, berdasarkan jumlah koloni yang tumbuh. Teknik ini diawali dengan pengenceran sampel secara seri, dengan kelipatan 1 : 10. Masing-masing suspensi pengenceran ditanam dengan metode tuang (pour plate) atau sebar (spread plate). Bakteri akan bereproduksi pada medium agar dan membentuk koloni setelah 18-24 jam inkubasi. Untuk menghitung jumlah koloni dalam cawan petri dapat digunakan alat ’colony counter’ yang biasanya dilengkapi dengan pencatat elektronik. (Rukmi, MG.I., A.T. Lunggani, A. Suprihadi, 2008).
Dimaksud dengan total count yaitu kalau perhitungan jumlah tidak berdasarkan kepada jenis, tetapi secara kasar terhadap golongan atau kelompok besar mikroorganisme umum seperti bakteri, fungi mikroalge ataupun terhadap kelompok bakteri tertentu.
Total count bacteria misalnya ditentukan berdasarkan penanaman bahan dalam jumlah dan pengenceran tertentu ke dalam media yang umum untuk bacteria. Setelah melalui masa inkubasi pada temperature kamar selama waktu maksimal 4 x 24 jam, perhitungan koloni dilakukan. Dianggap bahwa tiap koloni berasal dari sebuah sel, maka jumlah koloni dapat diperhitungkan sebagai jumlah sel mewakili dan terdapat di dalam bahan yang dianalisis.
Juga terdapat total count fungi dilakukan metoda yang sama, kecuali temperature inkubasi 28 10 C. Di dalam pelaksanaan agar selama pertumbuhan
tidak diganggu oleh koloni bakteri maka kepada permukaan media sebelum diberi bahan yang akan dianalisis, ditambahkan terlebih dahulu larutan asam laktat 3%.
Terhadap mikroalge, media yang digunakan harus bersifat semisolid atau cair, yaitu dengan penambahantepung agar 50% dari yang diperlukan. Karena kalau penggunaan tepung agar sesuai untuk bacteria ataupun fungi, pertumbuhan mikroalge akan lambat atau terhambat sama sekali. Berbeda dengan biakan bakteri ataupun fungi, maka biakan mikroalge harus ditempatkan pada tempat yang terang atau dikenai oleh cahaya matahari, selama 5- 15 hari.
Jenis media yang digunakan untuk perhitungan total count kelompok lain, pada dasarnya berbentuk media selektif atau pengaya. Karena sifat selektifitas dari media, pada akhirnya kalaupun ada bacteria yang tidak diharapkan dapat tumbuh dan berkembang didalamnya, selain memerlukan waktu yang cukup lama (diatas 10 x 24 jam) juga koloni yang kemudian terbentuk tidak dapat menjadi besra dan mudah hilang dari pengamatan dengan menggunakan mata biasa. Pada umumnya karena kelompok bacteria tertentu memerlukan masa adaptasi/ aklimatisasi terlebih dahulu, inkubasi di dalam temperature kamar memerlukan waktu antara 4-6 x 24 jam baru koloni akan tampak jelas pertumbuhannya.
Misal, total count bakteri-pereduksi-sulfat, bakteri belerang dan bakteri-besi, dsb. Dari hasil perhitungan ini akan diketahui sampai berapa jauh kandungan bakteri yang mempunyai kemampuan untuk melakukan deteriosasi, korosi, dan degradasi terhadap benda (khususnya benda-benda logam) di dalam perairan. Dapat juga ditentukan hubungan nilai antara kehadiran kelompok bakteri di atas dengan nilai korosi pada benda-benda logam yang berhubungan langsung dengan perairan.
Total count terhadap bakteri pathogen, khususnya untuk penyebab penyakit perut, seperti tifus, paratifus, kolera, disentri, dsb, yang disebabkan oleh Salmonella, shigella danVibrio, juga memerlukan media pengaya dan media selektif.
Total count terhadap bakteri penghasil racun, khususnya yang menyebar melalui air dan mengenai bahan makanan dan disebabkan oleh bakteri aerobic (Pseudomonas,Staphylococcus) dan anaerob (Clostridium) serta total count dan identifikasi jenis-jenis fungi penghasil mikotoksin khususnya yang termasuk
kelompok Aspergillus, Penicillium, dan fusarium, juga sama seperti untuk golongan pathogen.
Dari hasil/data sementara ternyata bahwa pada lingkungan yang jelek populasi dan jumlah jenis mikroorganisme tersebut sangat tinggi, sehinga kasus atau gejala penyakit dan keracunan juga sangat tinggi. Khusus untuk fungi penghasil mikotoksin sangat ditakuti pertumbuhannya pada bahan makanan, karena akan menghasilkan racun jamur (mikotoksin) yang bersifat karsinogenik (dapat merangsang terjadinya kanker, terutama pada kanker hati).
Keberhasilan analisic terhadap kelompok pathogen dan penghasil toksin, baru dapat berhasil kalau menggunakan media pengaya dan selektif. Hal ini mengingat pula bahwa kemungkinan besar kehadiran kelompok tersebut di dalam substrat sagat sedikit atau jarang jumlahnya.
BAB III METODE
3.1 Waktu dan Tempat
• Praktikum I (Praktikum pembuatan media NA) dilaksanakan pada hari Kamis, 1 Maret 2012, pukul 12.00 – 16.00 WITA dan bertempat di Laboratorium Bakteriologi, Jurusan Analis Kesehatan, Politeknik Kesehatan Denpasar.
• Praktikum II (penanaman sampel urine pada media NA) dilaksanakan pada hari Jumat, 9 Maret 2012, pukul 08.00 – 12.00 WITA dan bertempat di Laboratorium Bakteriologi, Jurusan Analis Kesehatan, Politeknik Kesehatan Denpasar.
• Praktikum II (penghitungan angka kuman) dilaksanakan pada hari Senin, 12 Maret 2012, pukul 11.00 – 14.00 WITA dan bertempat di Laboratorium Bakteriologi, Jurusan Analis Kesehatan, Politeknik Kesehatan Denpasar.
3.2 Alat dan Bahan
3.2.1 Alat • Tabung reaksi • Rak tabung • Kapas lemak • Api bunsen • Gelas beaker • Botol semprot • Erlenmeyer • Batang pengaduk • Neraca analitik • Aluminium foil
• Plate • Colony counter • Inkubator • Pipet ukur • Bola hisap • Tisue • Label 3.2.2 Bahan
• Media Nutrient Agar (28 g/L)
• Aquadest steril
• Sampel urine
3.3 Langkah Kerja
3.3.1 Pembuatan media NA ( Nutrient Agar 28 g/L ) 1. Ditimbang 7 gram bubuk media NA
2. Dilarutkan dengan 250 mL aquadest
3. Dimasukkan ke dalam erlenmeyer dan ditutup dengan aluminium foil 4. Dipanaskan hingga larut sempurna di atas kompor listrik
5. Disterilisasi dengan autoclave pada suhu 121° C selama 15 menit 6. Media siap digunakan
3.2.2 Pembuatan aquadest steril
1. 250 mL aquadest dimasukkan ke dalam erlenmeyer 2. Erlenmeyer ditutup dengan aluminium foil
3. Disterilisasi dengan autoclave pada suhu 121° C selama 15 menit 4. Aquadest siap digunakan
3.2.3 Pengenceran sampel 1. Disiapkan alat dan bahan
2. Masing – masing tabung reaksi diberi label
3. Masing-masing tabung tersebut kemudian diisi 9 mL aquadest steril. 4. Pada tabung I ditambahkan 1 ml urine.(10-1)
5. Dari tabung I dipipet 1 mL dan dimasukan ke tabung II (10-2)
6. Dari tabung II dipipet mL dan dimasukan ke tabung III (10-3)
3.2.4 Pembuatan kontrol 1. Disiapkan alat dan bahan 2. Petridish diberi label kontrol
3. Petridish diisi dengan 10 mL aquadest
4. Dalam keadaan panas media Nutrient Agar (NA) dituang ke plate tersebut dan didiamkan hingga padat.
3.2.5 Penanaman kuman
1. Disiapkan alat dan bahan
2. Masing – masing petridish diberi label pengenceran ( 10-1, 10-2, 10 -3)
3. Dari tabung reaksi I, II, dan III, dipipet masing-masing 10 ml larutan ke dalam masing-masing plate steril sesuai dengan pengencerannya.
4. Dalam keadaan panas media Nutrient Agar (NA) dituang ke dalam masing-masing plate tersebut dan didiamkan hingga padat.
3.2.6 Inkubasi
Inkubasi dilakukan pada incubator pada suhu 370 C selama 18-24 jam
3.2.7 Penghitungan angka kuman 1. Disiapkan alat dan bahan
2. Alat Colony Counter duhubungkan dengan sumber listrik dan dinyalakan.
3. Plate yang berisi control diletakkan pada Colony Counter. 4. Dihitung jumlah koloni kuman yang ada
5. Setelah itu baru dihitung jumlah koloni kuman pada masing-masing plate yang telah ditanami sampel urine.
BAB IV PEMBAHASAN
4.1 Data Hasil Pengamatan
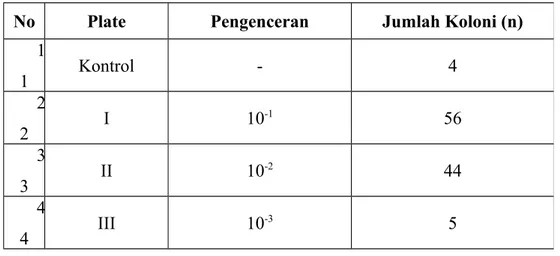
Tabel hasil pengamatan jumlah koloni kuman pada sampel urine Mr. AD (19 tahun) :
No Plate Pengenceran Jumlah Koloni (n)
1 1 Kontrol - 4 2 2 I 10 -1 56 3 3 II 10 -2 44 4 4 III 10 -3 5
Penghitungan angka kuman pada sampel dapat menggunakan rumus sebagai berikut :
Keterangan :
nk = Jumlah koloni pada control n1 = Jumlah koloni pada plate I n2 = Jumlah koloni pada plate II n3 = Jumlah koloni pada plate III
∑n = Jumlah plate yang dihitung jumlah koloninya
* Karena dalam plate pada pengenceran 10-3 hanya terdapat 5 koloni kuman
( kurang dari 30 koloni ) maka tidak dimasukkan dalam perhitungan.
Dalam penghitungan koloni kuman juga perlu diperhatikan ketentuan sebagai berikut :
• Jumlah koloni pada masing-masing plate yang dapat dihitung hanya koloni yang berjumlah antara 30-300 koloni/plate. Jika ada dalam 1 plate media terdapat koloni kurang dari 30 atau lebih dari 300 koloni maka tidak dimasukkan dalam perhitungan.
• Jika hasil penghitungan koloni kuman (Colony Count) < 10.000/ml urine menandakan tidak terjadi infeksi. Adanya kuman pada urine pasien kemungkinan karena infeksi suprapubik atau kateter.
• Jika hasil penghitungan koloni kuman (Colony Count) antara 10.000/ml s/d 100.000/ml urine, menandakan pasien mengalami infeksi saluran kemih.
• Jika hasil penghitungan koloni kuman (Colony Count) > 100.000/ml urine, menunjukkan bahwa pasien mengalami infeksi saluran kantung kemih.
4.2 Pembahasan
Percobaan penentuan angka kuman pada urine sangat penting dilakukan untuk mengetahui banyaknya jumlah bakteri atau kuman yang terdapat pada urine tersebut. Jumlah kuman yang terdapat dalam urine tersebut akan menentukan apakah pasien tersebut mengalami infeksi saluran kemih atau tidak. Percobaan kali ini mengambil sampel urine dari Mr. AD. Percobaaan dilakukan dengan prinsip dan prosedur kerja yang sudah ditentukan untuk mendapatkan hasil yang memenuhi persyaratan hitung jumlah koloni sehingga mencapai tujuan yang diharapkan.
Pemeriksaan angka kuman pada sampel urine merupakan salah satu cara yang dapat dilakukan untuk mengidentifikasi adanya suatu infeksi pada saluran kemih. Pada orang sehat, urine semestinya steril. Apabila di dalam urine ditemukan adanya mikroorganisme(kuman) yang jumlahnya ≥ 100000/mL, merupakan suatu indikasi bahwa orang tersebut mengalami infeksi. Untuk
mengetahui jumlah kuman per mL urine, dapat dilakukan dengan pemeriksaan angka kuman / colony count dengan specimen urin.
Pada penghitungan angka kuman pada urine ini memerlukan beberapa tahapan yang dilakukan. Tahapan – tahapan tersebut meliputi :
1. Pembuatan media Nutrient Agar ( NA)
Nutrien agar adalah medium umum untuk uji air dan produk lainnya. NA juga digunakan untuk pertumbuhan mayoritas dari mikroorganisme yang tidak selektif, dalam artian mikroorganisme heterotrof. Media ini merupakan media sederhana yang dibuat dari ekstrak beef, pepton, dan agar. NA merupakan salah satu media yang umum digunakan dalam prosedur bakteriologi seperti uji biasa dari air, sewage, produk pangan, untuk membawa stok kultur, untuk pertumbuhan sampel pada uji bakteri, dan untuk mengisolasi organisme dalam kultur murni. Untuk komposisi nutrien adar adalah eksrak beef 10 g, pepton 10 g, NaCl 5 g, air desitilat 1.000 ml dan 15 g agar/L. Dalam praktikum ini media dibuat sebanyak 250 mL dimana media ini mempunyai standar pembuatan 28 gram / liter, jadi untuk membuat media sebanyak 250 ml digunakan 7 gram bubuk media NA. Media dilarutkan dengan aquadest dan disterilisasi dengan autoklaf pada 121°C selama 15 menit. Kemudian media siap digunakan.
2. Pembuatan aquadest steril
Dalam praktikum ini menggunakan aquadest yang telah disterilisasi dimana pembuatan aquadest steril hampir sama dengan pembuatan media NA yaitu aquadest dimasukkan ke dalam wadah erlenmeyer kemudian ditutup dengan aluminium foil dan disterilisasi dengan autoklaf pada 121°C selama 15 menit. Aquadest steril ini nantinya akan digunakan untuk pengenceran sampel urine dan digunakan untuk pembuatan media kontrol. Penggunaan aquadest steril ini apada dasarnya adalah untuk menekan adanya kontaminasi pada sampel yang akan ditanam. Karena jika adanya kontaminasi maka akan mempengaruhi hasil dari penghitungan koloni kuman pada media nantinya.
Sampel urine yang digunakan dalam praktikum ini adalah urine yang telah diencerkan dengan aquadest steril. Dimana perbandingan sampel urine dan aquades adalah 1 : 9, yang artinya dalam 10 mL larutan terdapat 1 mL sampel. Pengenceran bertingkat yang dilakukan adalah pengenceran 10-1, 10-2, 10-3.
Dimana ini berarti pengenceran bertingkat pada dasarnya adalah penurunan volume pengambilan sampel dari tabung pertama ke tabung kedua sebanyak 1/10 bagian atau sesuai dengan ketetapan tertentu yang telah dibuat. Tujuan dari pengenceran bertingkat yaitu memperkecil atau mengurangi jumlah mikroba yang tersuspensi dalam cairan. Penentuan besarnya atau banyaknya tingkat pengenceran tergantung kepada perkiraan jumlah mikroba dalam sampel. Digunakan perbandingan 1 : 9 untuk sampel dan pengenceran pertama dan selanjutnya, sehingga pengenceran berikutnya mengandung 1/10 sel mikroorganisma dari pengenceran sebelumnya.
4. Pembuatan kontrol
Media control dalam praktikum ini adalah media yang digunakan sebagai pembanding seberapa jauh kontaminasi terjadi pada media tersebut. Dimana media ini dibuat dengan menggunakan aquadest steril tanpa campuran sampel urine dan kemudian ditanam pada media NA. Jumlah koloni yang diperbolehkan ada dalam media control adalah < 10 koloni. Jika terdapat lebih dari sepuluh
koloni, maka diperkirakan adanya kontaminasi pada media ini dan sebaiknya pembuatannya diulang untuk mendapat hasil yang lebih akurat.
5. Penanaman kuman
Pada tahap penanaman kuman ini sampel urine yang telah diencerkan masing – masing dituangkan sebanyak 10 ml ke dalam plate yang telah disediakan dan diberi label pengenceran. Kemudian media NA dituangkan ke dalam plate yang telah berisi sampel urine. Perlu diperhatikan bahwa pada saat penuangan sampel urine maupun media ke dalam plate kebersihan dan sterilisasi alat harus tetap dijaga oleh karena itu pada saat penuangan alat harus tetap difiksasi dengan api bunsen untuk menekan kontaminasi pada media dan sampel yang ditanam. media yang telah berisi sampel didiamkan hingga padat unttuk selanjutnya diinkubasi.
6. Inkubasi
Setelah sampel yang telah ditanam pada media selanjutnya diinkubasi pada inkubator dengan suhu 37° C selama 18 – 24 jam. Dimana inkubasi ini merupakan suatu teknik perlakuan bagi mikroorganismepada media, kemudian disimpan pada suhu tertentu untuk dapat melihat pertumbuhannya. Apabila suhu inkubasi tidak sesuai dengan yang diperlukan maka mikroorganisme tidak akan dapat tumbuh dengan baik. Untuk mikroorganisme seperti pembiakan bakteri suhu yang tepat adalah antara 35° - 37° C.
7. Penghitungan angka kuman
Setelah diinkubasi maka media yang telah ditanami sampel urine siap dihitung jumlah koloninya Pada praktikum kali ini, cara penghitungan kuman yang dipakai adalah cara penghitungan tidak langsung karena sampel urine harus mendapat perlakukan terlebih dahulu. Alat yang dipakai untuk melakukan perhitungan adalah Colony Counter. Adapun syarat penghitungan koloni tersebut antara lain:
a. Satu koloni dihitung 1 koloni
c. Beberapa koloni yang berhubungan dihitung 1 koloni
d. Dua koloni yang berhimpitan dan masih dapat dibedakan dihitung 2 koloni e. Koloni yang terlalu besar (lebih besar dari setengah luas cawan) tidak
dihitung
f. Koloni yang besarnya kurang dari setengah luas cawan dihitung 1 koloni. Setelah dilakukan penghitungan koloni kuman pada media yang telah ditanami sampel urine Mr. AD (19 tahun) maka didapatkan hasil sebagai berikut :
• Plate I ( pengenceran 10-1) = 56 koloni
• Plate II ( pengenceran 10-2) = 44 koloni
• Plate III ( pengenceran 10-3 ) = 5 koloni.
Hasil ini kemudian dihitung dengan menggunakan rumus pengenceran seperti yang telah dijelaskan pada hasil pengamatan. Berdasarkan hasil perhitungan maka diperoleh jumlah kuman yang terdapat dalam 1 mL urine Mr.AD adalah 2260. dari hasil yang diperoleh maka dapat disimpulkan bahwa Mr.AD diduga tidak mengalami infeksi saluran kemih karena jumlah kuman yang terdapat dalam 1 mL sampel urine Mr.AD < 10.000 kuman/mL.
Dalam praktikum ini, setelah media diinkubasi ditemukan adanya kontaminasi berupa jamur yang tumbuh pada media yang telah ditanami sampel. Hal ini mungkin disebabkan karena kesalahan pada pengambilan sampel atau prosedur kerja, dan mungkin juga karena kurangnya tingkat sterilisasi dari alat atau bahan yang digunakan.
BAB V PENUTUP
5.1 Simpulan
5.1.1 Dalam penghitungan angka kuman dalam urine memerlukan beberapa tahap yaitu : pembuatan media NA, pembuatan aquades steril, pengenceran sampel, pembuatan kontrol, penanaman sampel, inkubasi, dan penghitungan angka kuman pada sampel.
5.1.2 Dari hasil penghitungan yang diperoleh maka pasien Mr. AD dinyatakan tidak mengalami infeksi saluran kemih karena jumlah kuman yang ditemukan pada 1 ml urine pasien hanya 2260 (< 10.000 kuman /mL).
5.2 Saran
Sebaiknya pada saat praktikum benar-benar diperhatikan prosedur pewarnaan terutama pada kebersihan alat dan bahan yang digunakan untuk
menghindari adanya kontaminasi pada media dan sampel yang ditanam, sehingga tidak mempengaruhi hasil pemeriksaan.
DAFTAR PUSTAKA
Anonim. 2008. “Perhitungan Jumlah Mikroba”. Tersedia pada
http://journal.discoveryindonesia.com/PDFInterstitial,perhitungan+jumla h+mikroba.id (diakses tanggal 16 Maret 2012)
Anonim. 2008. Petunjuk Praktikum Mikrobiologi Dasar. Universites Jendral Soedirman Purwokerto : Purwokerto
Anonim. 2010. “Modul Bakteriologi I edisi II”. Tersedia pada http//:www.stikes-gunabangsa.ac.id (diakses tanggal 15 Maret 2012)
Anonim. 2009. “Infeksi Saluran Kemih”. Tersedia pada http//:www.iaui.or.id/ast/file/infeksi_saluran_kemih.doc (diakses tanggal 16 Maret 2012)
LEMBAR PENGESAHAN
Denpasar, 20 Maret 2012
Pembimbing Praktikan
( ...) ( Kadek Susi Wiandari )