BAB IV Hasil dan Pembahasan
Bab ini akan membahas hasil PCR, hasil penentuan urutan nukleotida, analisa in silico dan posisi residu yang mengalami mutasi dengan menggunakan program Pymol.
IV.1 PCR Multiplek
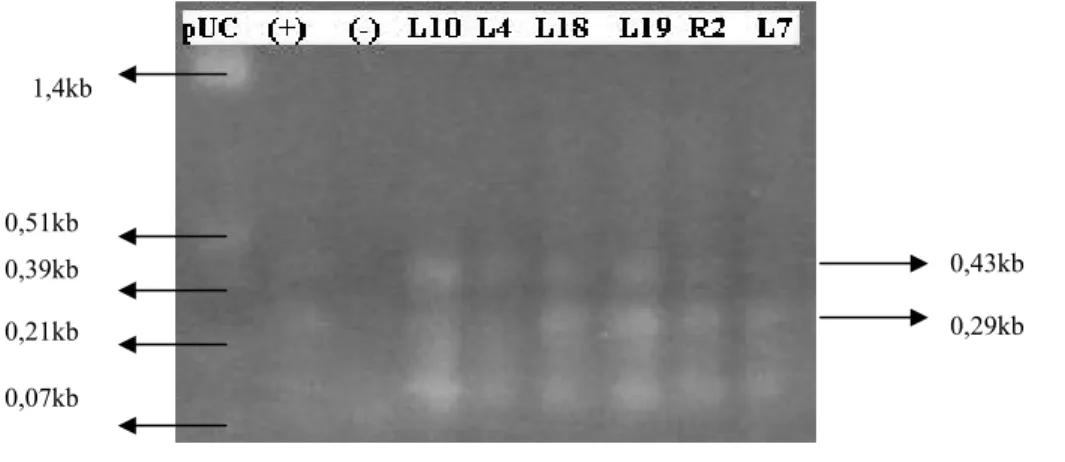
Beberapa isolat MDR-TB di amplifikasi dengan metode PCR multiplek untuk melihat adanya mutasi pada nukleotida 944 kodon 315, AGC menjadi ACC. Mutasi tersebut menyebabkan primer-dalam K315 tidak akan dapat menempel pada basa kedua kodon 315 akibatnya tidak akan terjadi amplifikasi nukleotida sepanjang 0,29kb (Mokrousov et al., 2002). Apabila tidak terjadi mutasi maka akan ada amplifikasi nukleotida sepanjang 0,43kb dan 0,29kb. Hasil PCR multiplek dapat dilihat dengan menggunakan elektroforesis gel agarosa.
Gambar IV.1 Elektroforesis Gel Agarosa Hasil PCR Multiplek. Gen katG315
enam isolat MDR-TB (L10, L4, L18,L19,R2,L7), kontrol (+): isolat galur normal H37Rv, kontrol (-): air. Enam isolat dan kontrol (+) memberikan dua pita pada 0,43kb dan 0,29kb. Pita 0,29kb menunjukkan bahwa tidak ada mutasi pada gen katG kodon 315.
Gambar IV.1 menunjukkan hasil PCR multiplek enam isolat MDR-TB yang tidak termutasi pada katG315. PCR multiplek isolat-isolat ini menguji ulang penelitian sebelumnya (komunikasi langsung dengan Noviana H., 2006). Berdasarkan pengujian
0,43kb 0,29kb 1,4kb 0,51kb 0,39kb 0,21kb 0,07kb
ini diketahui bahwa enam isolat yaitu L4, L7, L10, L18, L19 dan R2 tidak mengalami mutasi pada katG315. Fragmen DNA isolat-isolat tersebut diamplifikasi sepanjang 0,43kb, dan untuk mengkonfirmasi hasil PCR multiplek dilakukan penentuan urutan nukleotida dengan metode dideoksi Sanger.
IV.2 Hasil Penentuan Urutan Nukleotida
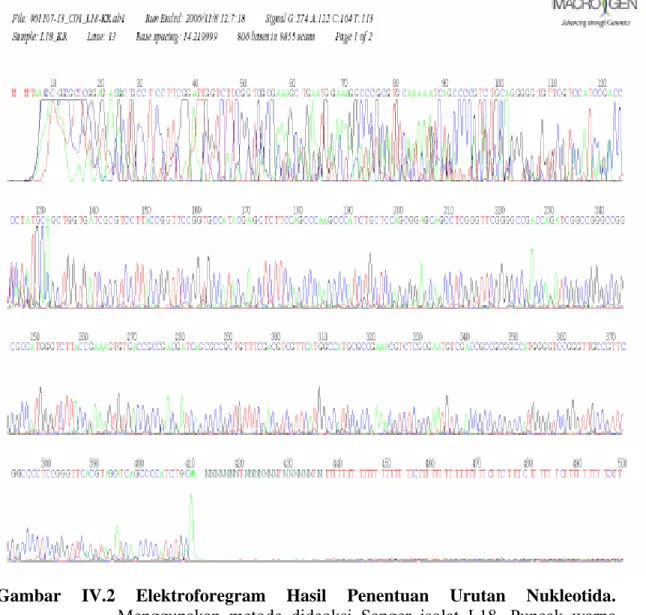
Penentuan urutan nukleotida dengan menggunakan metode dideoksi Sanger menghasilkan elektroforegram dan urutan nukleotida enam isolat MDR-TB (L4, L7, L10, L18, L19, R2) dibandingkan dengan galur normal H37Rv. Salah satu elektroforegram (isolat L18) ditunjukkan pada gambar 2. Hasil elektroforegram isolat lainnya dapat dilihat pada lampiran. Berikut ini adalah urutan nukleotida isolat L18 hasil sekuensing, sedangkan lima isolat lainnya dapat dilihat pada lampiran.
Urutan nukleotida hasil sekuensing isolat L18:
TTTTTAAGCC GGCGCTCGGA GTACGACTGC CTCCTTCGGA TTGGTCTTCG 50 GTCGCGAAAG CTGAATGGAA AGGCCCGCGT GCAAAAATCA GCCCCGTCTG 100 CAGGGGGTGT TCGTCCATCC GACCCCTATG CAGCTGGTGA TCGCGTCCTT 150 ACCGGTTCCG GTGCCATACG AGCTCTTCCA GCCCAAGCCC ATCTGCTCCA 200 GCGGAGCAGC CTCGGGTTCG GGGCCGACCA GATCGGCCGG GCCGGCGCCA 250 TGGGTCTTAC CGAAAGTGTG ACCGCCGACG ATCAGCGCCG CTGTTTCGAC 300 GTCGTTCATG GCCATGCGCC GAAACGTCTC GCGAATGTCG ACCGCCGCGG 350 CCATGGGGTC CGGGTTGCCG TTCGGCCCCT CCGGGTTCAC GTAGCATCAG 400
CCCCATCTGC AAA 413
IV.3 Analisa Homologi
Analisa homologi menggunakan program Seqman DNA*star membandingkan enam isolat dengan galur normal M. tuberculosis H37Rv.
IV.3.1 Analisa Homologi Isolat L10, L18, L19
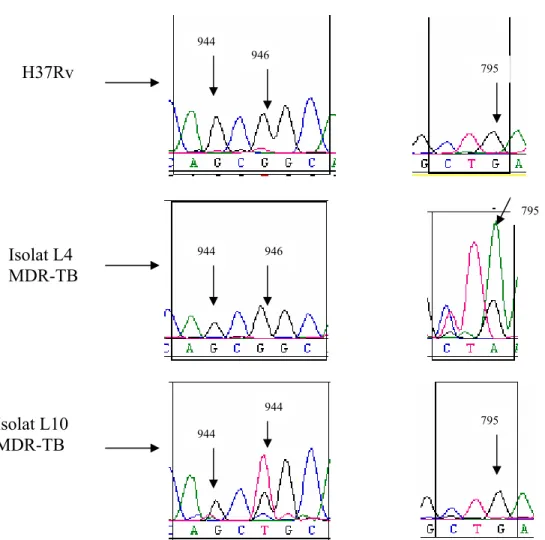
Gen katG tiga isolat (L10, L18, L19), yang ditunjukkan hanya isolat L18, dibandingkan dengan gen katG galur alami H37Rv pada nukleotida 944 dan 946
(ditunjukkan dengan tanda panah). Selain itu, dibandingkan juga dengan isolat L4 yang sifatnya MDR-TB tetapi tidak mengalami mutasi pada nukleotida 944 dan 946; dan dengan isolat L7 MDR-TB yang mengalami mutasi pada dua nukleotida tersebut. Hasil analisa homologi menunjukkan bahwa tiga isolat (L10, L18, L19) mengalami mutasi pada nukleotida 946, perubahan basa G menjadi T.
Gambar IV.2 Elektroforegram Hasil Penentuan Urutan Nukleotida.
Menggunakan metode dideoksi Sanger isolat L18. Puncak warna hijau menunjukkan basa Adenin; merah: Timin; hitam: Guanin; biru: Sitosin. Menggunakan primer KR, jumlah nukleotida 413.
Gambar IV.3 Analisa Homologi Isolat L18. Isolat L18 mengalami mutasi pada
nukleotida 946, C menjadi T, kodon 316, GGC menjadi TGC; dan tidak mengalami mutasi pada nukleotida 944, kodon 315 AGC menjadi ACC. Dibandingkan dengan H37Rv dan isolat R2 MDR-TB yang tidak mengalami mutasi di dua posisi tersebut. Pembandingan juga dilakukan dengan isolat L7 yang mengalami mutasi pada posisi 946 dan 944. Garis oranye menunjukkan basa pada kodon 315, garis hijau menunjukkan basa pada kodon 316. tanda panah menunjukkan posisi nukleotida pada basa 944 dan 946.
Analisa homologi asam amino H37Rv dibandingkan dengan tiga isolat (L10, L18,L19):
H37Rv:
301 302 303 304 305 306 307 308 309 310 311 312 313 314 315 316 317 318 319 320 901 aag agc tcg tat ggc acc gga acc ggt aag gac gcg atc acc agc ggc atc gag gtc gta
Lys Ser Ser Tyr Gly Thr Gly Thr Gly Lys Asp Ala Ile Thr Ser Gly Ile Glu Val Val K S S Y G T G T G K D A I T S G I E V V Isolat L10, L18, L19:
301 302 303 304 305 306 307 308 309 310 311 312 313 314 315 316 317 318 319 320 901 aag agc tcg tat ggc acc gga acc ggt aag gac gcg atc acc agc tgc atc gag gtc gta Lys Ser Ser Tyr Gly Thr Gly Thr Gly Lys Asp Ala Ile Thr Ser Cys Ile Glu Val Val K S S Y G T G T G K D A I T S C I E V V H37Rv Isolat L4, MDR-TB Isolat L7, MDR-TB Isolat L18, MDR-TB 946 944 944 946 946 946 944 944
Analisis data tersebut menunjukkan bahwa nukleotida 946 terletak pada kodon 316 basa pertama, GGC menjadi TGC, mengakibatkan asam amino glisin termutasi menjadi sistein. Tiga isolat ini semuanya tidak mengalami mutasi pada gen katG kodon 315. Penelitian sebelumnya telah melaporkan bahwa mutasi gen katG pada serin315threonin merupakan mutasi yang paling sering terjadi (Mokrousov et al., 2002). Mutasi pada kodon 315 mengakibatkan berkurangnya afinitas enzim katalase peroksidase terhadap INH (Wengenack et al., 1998) dan dapat mengubah ikatan hidrogen (Bertrand et al., 2004). Pengaruh mutasi pada kodon glisin316sistein terhadap pengikatan INH dalam enzim katalase peroksidase belum diketahui tetapi diperkirakan menjadi penyebab sifat resistensi tiga isolat (L10, L18, L19) terhadap INH.
IV.3.2 Analisa Homologi Isolat R2
Analisa homologi isolat R2 dibandingkan dengan galur alami H37Rv dan isolat L4. Hasil penjajaran ketiga gen katG M. tuberculosis tersebut menunjukkan bahwa isolat R2 mengalami mutasi pada nukleotida 869, basa sitosin berubah menjadi timin. Setelah dianalisa, ternyata nukleotida 869 berada pada kodon 290, GCT menjadi GTT, dan perubahan basa tersebut mengakibatkan asam amino alanin berubah menjadi valin. Mutasi yang pernah dilaporkan adalah pada kodon 291, asam amino alanin menjadi prolin (Fang et al., 1998). Analisa homologinya dapat dilihat pada Gambar IV.4.
Analisa homologi asam amino isolat R2 MDR-TB dibandingkan dengan asam amino galur normal H37Rv:
H37RV:
281 282 283 284 285 286 287 288 289 290 291 292 293 294 295 296 297 298 299 300 841 gcc gat ctg gtc ggc ccc gaa ccc gag gct gct ccg ctg gag cag atg ggc ttg ggc tgg Ala Asp Leu Val Gly Pro Glu Pro Glu Ala Ala Pro Leu Glu Gln Met Gly Leu GLy Trp A D L V G P E P E A A P L E Q M G L G W Isolat R2:
281 282 283 284 285 286 287 288 289 290 291 292 293 294 295 296 297 298 299 300 841 gcc gat ctg gtc ggc ccc gaa ccc gag gtt gct ccg ctg gag cag atg ggc ttg ggc tgg Ala Asp Leu Val Gly Pro Glu Pro Glu Val Ala Pro Leu Glu Gln Met Gly Leu GLy Trp A D L V G P E P E V A P L E Q M G L G W
Gambar IV.4 Analisa Homologi Isolat R2. Isolat R2 termutasi pada nukleotida
869, C menjadi T, basa kedua kodon 290 GCT menjadi GTT. Isolat R2 tidak mengalami mutasi pada nukleotida 944, kodon 315 (garis oranye) dan nukleotida 946, kodon 316 (garis hijau). Dibandingkan dengan H37Rv dan isolat L4 yang MDR-TB.
IV.3.3 Analisa Homologi Isolat L4
Isolat L4 dibandingkan dengan H37Rv dan isolat L10. Isolat L4 mengalami mutasi pada nukleotida 795, G menjadi A, yang terletak pada kodon 265, TTG menjadi TTA, tetapi tidak menyebabkan perubahan asam amino sehingga dapat dipastikan bahwa mutasi tersebut bukan penyebab sifat resistensi terhadap INH. Dengan demikian penyebab sifat resistensi INH isolat L4 belum diketahui.
H37Rv Isolat R2 MDR-TB Isolat L4 MDR-TB 944 946 869 869 869 946 946 944 944
Gambar IV.5 Analisa Homologi Isolat L4. Isolat L4 mengalami mutasi pada
nukleotida 795, basa G menjadi A kodon 265, CTG menjadi CTA tidak menyebabkan perubahan asam amino. Dibandingkan dengan H37RV dan isolat L10 yang MDR-TB. Isolat L4 tidak mengalami mutasi pada nukleotida 944 dan 946.
Analisa homologi asam amino isolat L4 MDR-TB dibandingkan dengan asam amino galur alami H37RV:
H37RV:
261 262 263 264 265 266 267 268 269 270 271 272 273 274 275 276 277 278 279 280 781 gaa aca gcg gcg ctg atc gtc ggc ggt cac act ttc ggt aag acc cat ggc gcc ggc ccg Glu Thr Ala Ala Leu Ile Val Gly Gly His Thr Phe Gly Lys Thr His Gly Ala Gly Pro E T A A L I V G G H T F G K T H G A G P H37Rv Isolat L4 MDR-TB Isolat L10 MDR-TB 944 944 944 946 946 944 795 795 795
Isolat L4 MDR-TB:
261 262 263 264 265 266 267 268 269 270 271 272 273 274 275 276 277 278 279 280 781 gaa aca gcg gcg cta atc gtc ggc ggt cac act ttc ggt aag acc cat ggc gcc ggc ccg Glu Thr Ala Ala Leu Ile Val Gly Gly His Thr Phe Gly Lys Thr His Gly Ala Gly Pro E T A A L I V G G H T F G K T H G A G P
IV.3.4 Analisa Homologi Isolat L7
Analisa homologi isolat L7 menunjukkan bahwa gen katG nya mengalami mutasi pada nukleotida 944, basa G menjadi C; dan nukleotida 946 basa G menjadi T. mutasi G944C pada kodon 315 yang mengubah asam amino serin menjadi threonin telah dibuktikan menjadi penyebab sifat resistensi terhadap INH. Tetapi, hasil PCR multiplek menunjukkan terjadi amplifikasi pada 0,43kb dan 0,29kb. Hal ini bisa terjadi karena kondisi PCR multiplek sangat sensitif sehingga ada kesalahan berpasangan pada primer-dalam (Mokrousov et al., 2002).
Gambar IV.6 Analisa Homologi Isolat L7. Isolat L7 mengalami mutasi pada
nukleotida 944, G menjadi C, kodon 315, AGC menjadi ACC; dan nukleotida 946, G menjadi T, kodon 316 GGC menjadi TGC.
Analisa homologi asam amino isolat L7 dengan galur alami H37Rv: H37Rv:
301 302 303 304 305 306 307 308 309 310 311 312 313 314 315 316 317 318 319 320 901 aag agc tcg tat ggc acc gga acc ggt aag gac gcg atc acc agc ggc atc gag gtc gta Lys Ser Ser Tyr Gly Thr Gly Thr Gly Lys Asp Ala Ile Thr Ser Cys Ile Glu Val Val K S S Y G T G T G K D A I T S G I E V V Isolat L7:
301 302 303 304 305 306 307 308 309 310 311 312 313 314 315 316 317 318 319 320 901 aag agc tcg tat ggc acc gga acc ggt aag gac gcg atc acc acc tgc atc gag gtc gta Lys Ser Ser Tyr Gly Thr Gly Thr Gly Lys Asp Ala Ile Thr Thr Cys Ile Glu Val Val K S S Y G T G T G K D A I T S G I E V V 944 944 946 946 H37Rv Isolat L7
Mutasi lainnya pada isolat L7 adalah pada nukleotida 946, mengubah basa G menjadi T, kodon 316 GGC menjadi TGC. Mutasi di posisi yang sama dengan tiga isolat lainnya. Diperkirakan mutasi pada kodon 316 ini menjadi salah satu penyebab sifat resistesi INH pada isolat L7, tetapi pengaruh pastinya belum diketahui.
Mutasi lain yang sering terjadi adalah pada kodon Arg463Leu, tetapi mutasi ini telah dibuktikan tidak berhubungan dengan sifat resistensi terhadap INH (Shim et al., 1996). Beberapa mutasi yang telah dilaporkan adalah pada kodon Arg128Gln, Ala291Pro (Fang et al., 1998), dan Thr275Pro (Pym et al., 2002). His-108 yang merupakan salah satu residu pengikat INH telah dilaporkan termutasi pada isolat yang resisten INH, menjadi asam glutamate dan glutamine (Rouse et al., 1995; Rouse & Morris, 1995).
Mutasi pada sisi aktif Asp-137 yang berperan penting dalam pengikatan INH belum pernah dilaporkan mengalami mutasi, tetapi mutasi yang terjadi adalah pada residu-residu di sekitarnya yaitu N138S, A139P, S140N, ataupun D142A (Zhang et al., 1992; Heym et al., 1995; Rouse et al., 1995; Cockerill et al., 1995; Musser et al., 1996). Mutan-mutan ini memberi pengaruh dengan cara mengubah konformasi lokal sehingga dapat mengganti orientasi gugus samping Asp-137 akibatnya tidak dapat mengikat INH (Jakopitsch et al., 2003).
IV.4. Visualisasi Protein Katalase Peroksidase dengan Program Pymol
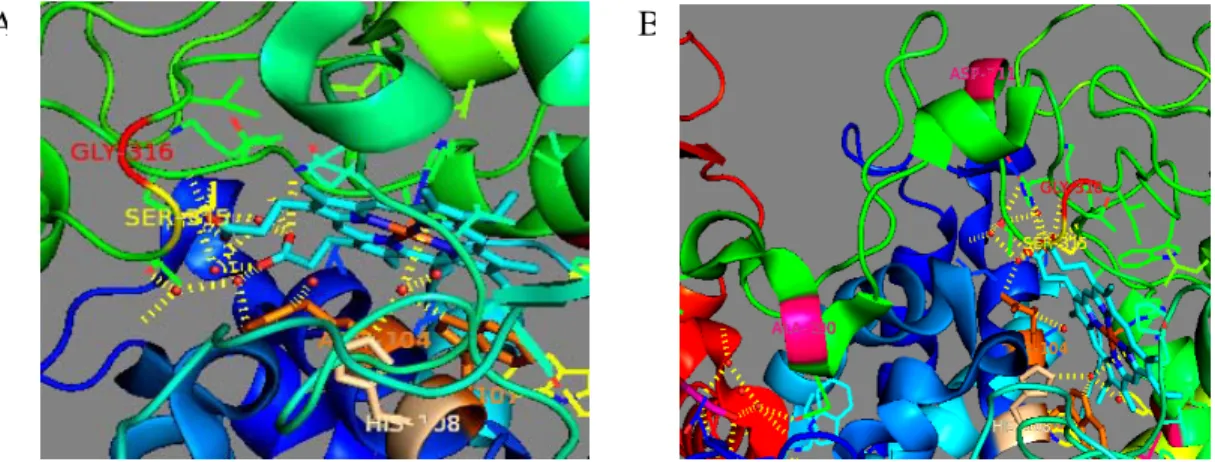
Thomas Bertrand, et al., pada tahun 2004 telah mengkristalkan katalase peroksidase M. tuberculosis dan telah menentukan struktur tiga dimensi protein tersebut. Data struktur kristal ini dapat dilihat pada situs publik www.ncbi.nlm.nih.gov dengan nama 1SJ2. Posisi residu-residu yang mengalami mutasi pada gen katG dapat dilihat berdasarkan struktur 1SJ2 dengan menggunakan program Pymol. Gambar IV.7 menunjukkan posisi residu 316 dan 290 yang mengalami mutasi.
Gambar IV.7 Posisi Residu yang Mengalami Mutasi. Posisi residu glisin 316 yang
mengalami mutasi menjadi sistein (gambar A) ditunjukkan dengan warna merah. Posisi residu alanin 290 yang mengalami mutasi menjadi valin (gambar B) ditunjukkan dengan label merah, alanin 290 berada dalam daerah loop (warna hijau).
Visualisasi struktur ruang katalase peroksidase dengan program Pymol menunjukkan residu asam amino 316 berada dekat dengan sisi aktif pengikatan INH. Gambar IV.8 menunjukkan berubahnya permukaan residu 316 akibat mutasi glisin menjadi sistein. Glisin merupakan asam amino yang paling sederhana sedangkan sistein berukuran lebih besar dan dapat membentuk ikatan disulfida dengan sistein lainnya. Tetapi pengaruh mutasi glisin316sistein ini dalam sifat resistensi terhadap INH belum diketahui.
Penelitian sebelumnya telah membuktikan bahwa mutasi pada residu 315 mengakibatkan sifat resistensi terhadap INH karena mengakibatkan berubahnya ikatan hidrogen antara heme dan serin315 (Bertrand et al., 2004; Yue et al., 2003). Tiga isolat ini tidak mengalami mutasi pada residu 315 sehingga mutasi pada residu 316 diduga kuat menjadi penyebab sifat resistensi.
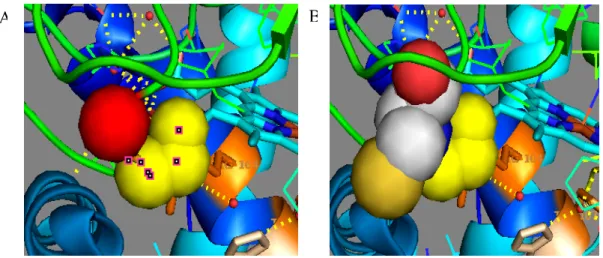
Gambar IV.8 Visualisasi Perubahan Permukaan Residu 316. (A) merah:
permukaan glisin 316, kuning: permukaan serin 315. (B) simulasi berubahnya glisin316 menjadi sistein, permukaan sistein 316 lebih luas ditunjukkan dengan warna merah muda, abu-abu, dan kuning tua. Kuning: permukaan serin 315.
Residu 278 hingga 312 pada enzim katalase peroksidase M. tuberculosis berada dalam daerah loop, konformasi ini sama dalam dua struktur katalase peroksidase lainnya yaitu pada Haloarcula marismortui dan Burkholderia pseudomallei. Dalam katalase peroksidase Burkholderia pseudomallei, daerah loop ini diperkirakan menjadi sisi pengikatan substrat tempat INH berinteraksi dengan enzim (Carpena et al., 2003). Tetapi Bertrand et al., dan Pieratelli et al., menyatakan bahwa dalam katalase peroksidase M. tuberculosis, daerah loop tersebut bukan merupakan sisi pengikatan INH yang terpenting. Mutasi pada residu asam amino 290 berada relatif jauh dari sisi aktifnya dan pengaruhnya terhadap sifat resistensi INH belum diketahui.