Foto kegiatan survei
Kapal survei. Persiapan sebelum survei.
Pemindahan contoh air laut dari sampler Penyaringan contoh air laut. ke dalam botol.
lanjutan lampiran 1
Makan siang bersama dengan staf peneliti P2O-LIPI. Foto alat-alat penelitian
Spektrofotometer. Kolom reduksi.
Vacuum pump. Nansen.
Botol polyetilen. Botol BOD 100 ml.
Lampiran 2. Prinsip Pengukuran Kualitas Air Laut.
Prinsip-prinsip pengukuran kualitas air laut untuk parameter kimia seperti oksigen terlarut (dissolved oxygen), fosfat, nitrat, dan amonium dideskripsikan sebagai berikut (Strickland dan Parsons, 1968; Hutagalung dan Rozak, 1997) : Oksigen terlarut (O2)
Prinsip penentuan kadar oksigen dalam air laut dilakukan dengan metode titrasi (iodometri) yaitu didasarkan pada pembentukan molekul iodin (I2). Metode ini pertama kali diperkenalkan oleh Winkler yang didasarkan pada terbentuknya endapan putih mangan hidroksida (
2
Mn OH ) yang
merupakan hasil reaksi suatu hidroksida (NaOH) dengan mangan klorida (MnCl2) dalam larutan basa kuat. Endapan pereduksi (Mn OH
2) dalam larutan yang bersifat basa kuat merupakan senyawa yang tidak stabilsehingga segera dioksidasi oleh oksigen yang terdapat dalam contoh air laut membentuk endapan kuning kecoklatan (
3
Mn OH ). Banyaknya
3Mn OH yang terbentuk ekivalen dengan banyaknya O2 yang terdapat dalam contoh air laut. Persamaan reaksi kimia yang terjadi adalah : MnCl22NaOHMn OH( )22NaCl (endapan putih) 2 ( )2 1 2 2 2
3 2 Mn OH O H O Mn OH (endapan coklat)Setelah proses pengendapan sempurna, larutan contoh diasamkan dengan asam kuat (H SO2 4). Dalam larutan yang bersifat asam kuat, endapan
(Mn OH
3) larut kembali dan melepaskan (Mn3) yang bersifat oksidator kuat, sehingga akan mengoksidasi ion iodida (I) dari garam (KI) menjadi iodin (I2) bebas membentuk larutan berwarna kuning kecoklatan.2Mn OH( )33H SO2 4 2KI 2MnSO46H O K SO2 2 4I2
(larutan kuning kecoklatan) Iodin (I2) kemudian dititrasi dengan natrium tio-sulfat (Na S O2 2 3), sehingga natrium tiosulfat teroksidasi menjadi natrium tetrationat sedangkan iodin tereduksi menjadi ion iodida (I). Untuk menentukan titik akhir titrasi menggunakan indikator kanji (amilum). Iodin (I2) bereaksi dengan kanji membentuk senyawa kompleks berwarna biru. Titrasi dihentikan pada saat warna biru hilang dan larutan contoh menjadi tidak berwarna. Banyaknya iodin (I2) yang terbentuk ekivalen dengan banyaknya larutan natrium tiosulfat yang terpakai dalam titrasi. Dengan demikian banyaknya molekul oksigen terlarut (O2) dalam contoh air laut ekivalen dengan banyaknya larutan natrium tiosulfat yang dipakai untuk titrasi.
2 2 2 2 3 2 4 8 2
I Na S O Na S O NaI
(larutan tidak berwarna) Fosfat (P-PO4)
Fosfat yang diukur adalah dalam bentuk ortofosfat menggunakan metode spektrofotometrik dengan panjang gelombang 885 nm. Prinsipnya
didasarkan pada pembentukan senyawa kompleks fosfomolibdat berwarna biru. Dalam suasana asam kuat, senyawa ortofosfat dalam contoh air laut bereaksi dengan amonium molibdat membentuk senyawa kompleks
lanjutan lampiran 2
amonium fosfomolibdat berwarna kuning. Dengan adanya reduktor asam askorbat, senyawa amonium fosfomolibdat direduksi menjadi senyawa kompleks fosfomolibdat berwarna biru. Absorbansi senyawa fosfomolibdat tersebut berbanding lurus dengan kadar ortofosfat dalam contoh air laut. Nitrat (N-NO3)
Penentuan kadar nitrat dalam contoh air laut menggunakan metode spektrofotometrik dengan panjang gelombang 543 nm. Prinsipnya didasarkan pada reduksi nitrat menjadi nitrit. Kadar nitrat ini tidak dapat secara langsung diketahui namun terlebih dahulu direduksi menjadi nitrit menggunakan kolom berisi kadmium (Cd). Senyawa nitrit yang terbentuk bereaksi dengan larutan sulfanilamid membentuk senyawa diazonium. Banyaknya senyawa diazonium ekivalen dengan senyawa nitrit yang terbentuk dalam contoh air laut. Dalam suasana asam lemah senyawa diazonium bereaksi dengan larutan N-(1-naptil)-etilendiamindihidroklorid atau NED membentuk senyawa kompleks azo berwarna merah muda. Banyaknya senyawa kompleks azo ekivalen dengan banyaknya senyawa diazonium sehingga ekivalen dengan senyawa nitrit dalam contoh air laut. Absorbansi senyawa kompleks azo berbanding lurus dengan kadar nitrit dalam contoh air laut. Kadar nitrat dalam contoh air laut adalah selisih
kadar nitrit hasil kolom reduksi dengan kadar nitrit dalam contoh air laut. Amonium (N-NH4)
Penentuan kadar amonium dalam contoh air laut tidak dapat diukur secara langsung namun terlebih dahulu melalui metode penentuan amoniak
berdasarkan metode spektrofotometrik dengan panjang gelombang 630 nm. Prinsipnya didasarkan pada pembentukan senyawa indofenol berwarna biru. Dalam suasana basa, amoniak dalam contoh air laut bereaksi dengan fenol dan hipoklorit membentuk senyawa indofenol berwarna biru. Untuk mempercepat reaksi pembentukan senyawa indofenol biru dan
meningkatkan sensitifitasnya ditambahkan katalisator ion nitropusside. Absorbansi senyawa indofenol berbanding lurus dengan kadar amoniak dalam contoh air. Metode ini menghasilkan kandungan total amoniak, dimana mengandung NH4 dan NH3. Penghitungan kadar amonium dalam contoh air laut dapat diekspresikan sebagai berikut :
NH4
= (absorbansi contoh – absorbansi blanko) x 5(absorbansi contoh + absorbansi standar) – absorbansi contoh
Lampiran 3. Pengkonversian satuan
Komponen-komponen ekosistem baik diperoleh dari pengamatan lapangan maupun literatur terlebih dahulu dilakukan konversi satuan kedalam bentuk mmol N m-3 sebelum dimasukkan ke dalam model sebagai data masukan/input. Proses konversi satuan tiap komponen-komponen ekosistem dijelaskan sebagai berikut : 1. Nutrien (nitrat, amonium, fosfat)
Data nutrien yang diperoleh dari pengamatan lapangan dalam bentuk satuan gAt.N-NO3 l-1 maka perlu dikonversi menjadi mmol N m-3.
Nitrat
12.11 gAt.N-NO3 l-1 = …... mmol N m-3
Pertama dikonversi kedalam bentuk g N-NO3 l-1 dengan mengalikan berat
atom/atom relatif nitrogen, yaitu 14
12.11 gAt.N-NO3 l-1 x 14 = 169.54 g N-NO3 l-1
kemudian dikonversi kedalam bentuk mol N l-1 dengan membagi berat molekul/massa relatif NO3, yaitu 62
169.54 gN-NO3 l-1 : 62 = 2.73 mol N l-1 setara dengan 2.73 mmol N m-3
Cara yang sama dilakukan untuk amonium dan fosfat. 2. Fitoplankton
Data fitoplankton yang diperoleh dari literatur dalam bentuk satuan g Chl- l-1 maka perlu dikonversi menjadi mmol N m-3.
0.27 g Chl- l-1 = ……... mmol N m-3
Pertama dikonversi kedalam bentuk g C l-1 dengan mengalikan 50 (lihat subbab 3.4)
0.27 g Chl- l-1 x 50 = 13.5 g C l-1
kemudian dikonversi kedalam bentuk mol C l-1 dengan membagi berat atom/atom relatif karbon, yaitu 12
13.5 g C l-1 : 12 = 1.125 mol C l-1
selanjutnya dikonversi kedalam bentuk mol N l-1 dengan mengalikan 16
106
(lihat subbab 3.4) 1.125 mol C l-1 x 16
106 = 0.17 mol N l
-1
setara dengan 0.17 mmol N m-3 3. Zooplankton
Zooplankton yang diperoleh dari literatur dalam bentuk ind. m-3 maka perlu dikonversi menjadi mmol N m-3.
13200 ind. m-3 setara dengan 13200 g C m-3 (lihat subbab 3.4) 13200 g C m-3 = ……... mmol N m-3
Pertama dikonversi kedalam bentuk mol C m-3 dengan membagi berat atom/atom relatif karbon, yaitu 12
13200 g C m-3 : 12 = 1100 mol C m-3
kemudian dikonversi kedalam bentuk mol N m-3 dengan mengalikan 16
106 (lihat subbab 3.4) 1100 mol C m-3 x 16 106 = 166.04 mol N m -3
selanjutnya dikonversi kedalam bentuk mmol N m-3 dengan mengalikan 10-3 166.04 mol N m-3 x 10-3 = 0.17 mmol N m-3
Lampiran 4. Data pengamatan lapangan
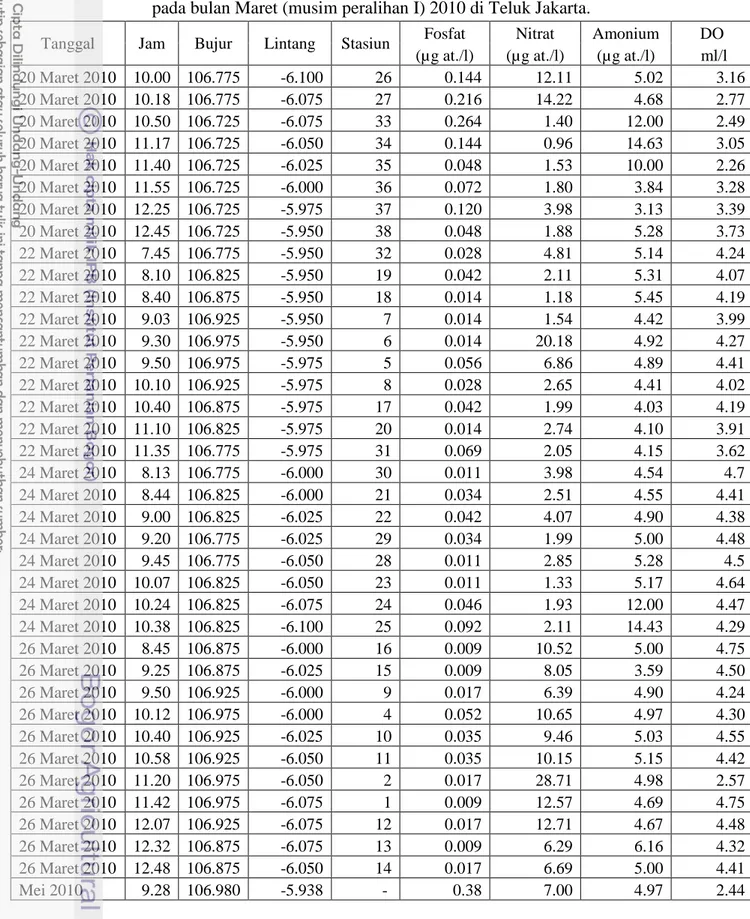
Tabel 1. Data hasil pengukuran nitrat, amonium, fosfat, dan oksigen terlarut (DO) pada bulan Maret (musim peralihan I) 2010 di Teluk Jakarta.
Tanggal Jam Bujur Lintang Stasiun Fosfat Nitrat Amonium DO
(µg at./l) (µg at./l) (µg at./l) ml/l
20 Maret 2010 10.00 106.775 -6.100 26 0.144 12.11 5.02 3.16 20 Maret 2010 10.18 106.775 -6.075 27 0.216 14.22 4.68 2.77 20 Maret 2010 10.50 106.725 -6.075 33 0.264 1.40 12.00 2.49 20 Maret 2010 11.17 106.725 -6.050 34 0.144 0.96 14.63 3.05 20 Maret 2010 11.40 106.725 -6.025 35 0.048 1.53 10.00 2.26 20 Maret 2010 11.55 106.725 -6.000 36 0.072 1.80 3.84 3.28 20 Maret 2010 12.25 106.725 -5.975 37 0.120 3.98 3.13 3.39 20 Maret 2010 12.45 106.725 -5.950 38 0.048 1.88 5.28 3.73 22 Maret 2010 7.45 106.775 -5.950 32 0.028 4.81 5.14 4.24 22 Maret 2010 8.10 106.825 -5.950 19 0.042 2.11 5.31 4.07 22 Maret 2010 8.40 106.875 -5.950 18 0.014 1.18 5.45 4.19 22 Maret 2010 9.03 106.925 -5.950 7 0.014 1.54 4.42 3.99 22 Maret 2010 9.30 106.975 -5.950 6 0.014 20.18 4.92 4.27 22 Maret 2010 9.50 106.975 -5.975 5 0.056 6.86 4.89 4.41 22 Maret 2010 10.10 106.925 -5.975 8 0.028 2.65 4.41 4.02 22 Maret 2010 10.40 106.875 -5.975 17 0.042 1.99 4.03 4.19 22 Maret 2010 11.10 106.825 -5.975 20 0.014 2.74 4.10 3.91 22 Maret 2010 11.35 106.775 -5.975 31 0.069 2.05 4.15 3.62 24 Maret 2010 8.13 106.775 -6.000 30 0.011 3.98 4.54 4.7 24 Maret 2010 8.44 106.825 -6.000 21 0.034 2.51 4.55 4.41 24 Maret 2010 9.00 106.825 -6.025 22 0.042 4.07 4.90 4.38 24 Maret 2010 9.20 106.775 -6.025 29 0.034 1.99 5.00 4.48 24 Maret 2010 9.45 106.775 -6.050 28 0.011 2.85 5.28 4.5 24 Maret 2010 10.07 106.825 -6.050 23 0.011 1.33 5.17 4.64 24 Maret 2010 10.24 106.825 -6.075 24 0.046 1.93 12.00 4.47 24 Maret 2010 10.38 106.825 -6.100 25 0.092 2.11 14.43 4.29 26 Maret 2010 8.45 106.875 -6.000 16 0.009 10.52 5.00 4.75 26 Maret 2010 9.25 106.875 -6.025 15 0.009 8.05 3.59 4.50 26 Maret 2010 9.50 106.925 -6.000 9 0.017 6.39 4.90 4.24 26 Maret 2010 10.12 106.975 -6.000 4 0.052 10.65 4.97 4.30 26 Maret 2010 10.40 106.925 -6.025 10 0.035 9.46 5.03 4.55 26 Maret 2010 10.58 106.925 -6.050 11 0.035 10.15 5.15 4.42 26 Maret 2010 11.20 106.975 -6.050 2 0.017 28.71 4.98 2.57 26 Maret 2010 11.42 106.975 -6.075 1 0.009 12.57 4.69 4.75 26 Maret 2010 12.07 106.925 -6.075 12 0.017 12.71 4.67 4.48 26 Maret 2010 12.32 106.875 -6.075 13 0.009 6.29 6.16 4.32 26 Maret 2010 12.48 106.875 -6.050 14 0.017 6.69 5.00 4.41 Mei 2010 9.28 106.980 -5.938 - 0.38 7.00 4.97 2.44
RIWAYAT HIDUP
Penulis lahir di Sukabumi tanggal 10 Oktober 1988 dari pasangan Bapak Kusnadi dan Ibu Yani Rohayani. Penulis merupakan anak kedua dari tiga bersaudara.
Pada tahun 2006, penulis menyelesaikan pendidikan Sekolah Menengah Atas Negeri 97 (SMAN 97) Ciganjur, Jakarta Selatan. Pada tahun yang sama, penulis meneruskan pendidikan di Institut Pertanian Bogor (IPB) melalui Undangan Seleksi Masuk IPB (USMI) dan
memilih Program Studi Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan.
Selama masa perkuliahan, penulis aktif mengajar selama tiga tahun sebagai asisten beberapa mata kuliah, yaitu asisten mata kuliah Dasar-Dasar Instrumentasi Kelautan tahun 2008-2009, asisten luar biasa mata kuliah Oseanografi Kimia tahun 2009-2011, dan asisten mata kuliah Oseanografi Terapan tahun 2010-2011. Selain itu, penulis pernah menjadi anggota klub Marine Instrument and Telemetry (MIT) tahun 2008-2009, ketua panitia lapangan (fieldtrip) mata kuliah Pemetaan Sumber Daya Hayati Laut tahun 2009, dan koordinator asisten praktikum mata kuliah Oseanografi Kimia tahun 2010-2011.
Penulis menyelesaikan skripsi dengan judul “Pemodelan Sebaran Nutrien dengan Pendekatan Model Perata-rataan terhadap Kedalaman (Depth Averaged) di Teluk Jakarta” sebagai salah satu syarat memperoleh gelar Sarjana Ilmu
Kelautan pada Departemen Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.