(Eurycoma longifolia) DI HUTAN ALAM DESA PAPASO, KECAMATAN BATANG LUBU SUTAM, KABUPATEN
PADANG LAWAS
SKRIPSI
TUBAGUS MARDONGAN SIAGIAN 151201032
DEPARTEMEN BUDIDAYA HUTAN FAKULTAS KEHUTANAN UNIVERSITAS SUMATERA UTARA
MEDAN
2020
(Eurycoma longifolia) DI HUTAN ALAM DESA PAPASO, KECAMATAN BATANG LUBU SUTAM, KABUPATEN
PADANG LAWAS
SKRIPSI Oleh:
TUBAGUS MARDONGAN SIAGIAN 151201032
Skripsi sebagai salah satu syarat untuk memperoleh gelar sarjana di Fakultas Kehutanan
Universitas Sumatera Utara
DEPARTEMEN BUDIDAYA HUTAN FAKULTAS KEHUTANAN UNIVERSITAS SUMATERA UTARA
MEDAN
2020
Saya yang bertanda tangan di bawah ini:
Nama : Tubagus Mardongan Siagian
Nim : 151201032
Judul Skripsi : Eksplorasi Fungi Pelarut Fosfat dan Fungi Selulolitik di Bawah Tegakan Pasak Bumi (Eurycoma longifolia) di Hutan Alam Desa Papaso, Kecamatan Lubu Sutam, Kabupaten Padang Lawas
menyatakan bahwa skripsi ini adalah hasil karya sendiri. Pengutipan-pengutipan yang penulis lakukan pada bagian-bagian tertentu dari hasil karya orang lain dalam penulisan skripsi ini, telah penulis cantumkan sumbernya secara jelas sesuai dengan norma, kaidah, dan etika penulisan ilmiah.
Medan, Januari 2020
Tubagus Mardongan Siagian 151201032
TUBAGUS MARDONGAN SIAGIAN: Eksplorasi Fungi Pelarut Fosfat dan Fungi Selulolitik di Bawah Tegakan Pasak Bumi (Eurycoma longifolia) di Hutan Alam Desa Papaso, Kecamatan Lubu Sutam, Kabupaten Padang Lawas, dibimbing oleh DENI ELFIATI dan ARIDA SUSILOWATI
Pasak bumi merupakan tanaman obat yang potensial dan punya nilai ekonomi tinggi jika dikembangkan dapat menyebabkan tingginya permintaan dan mendorong eksploitasi di habitatnya meningkat sehingga populasinya berkurang.
Pasak bumi tumbuh pada tanah masam, berpasir, dan miskin unsur hara.
Persebaran pasak bumi sangat dipengaruhi oleh kondisi tanah atau faktor edafik.
Keberadaan fungi pelarut fosfat dan fungi selulolitik didalam tanah mempengaruhi keadaan biologi tanah sehingga dapat menunjang pertumbuhan pasak bumi dialam. Tujuan dari penelitian ini untuk mengetahui total populasi fungi pelarut fosfat dan fungi selulolitik serta mengidentifikasi jenis fungi pelarut fosfat dan fungi selulolitik yang terdapat pada tanah dibawah tegakan pasak bumi.
Penelitian dilakukan menggunakan metode pengenceran bertingkat untuk mendapatkan total populasi fungi pelarut fosfat dan fungi selulolitik. Desain penelitian menggunakan rancangan acak lengkap (RAL) faktorial dengan dua faktor. Faktor pertama adalah sumber tanah dengan tiga taraf, yaitu: lereng atas, lereng tengah, lereng bawah dan faktor kedua adalah kedalaman tanah dengan dua taraf, yaitu 0-5 cm dan 5-20 cm. Hasil penelitian menunjukkan bahwa kelerengan dan kedalaman berpengaruh tidak nyata terhadap total fungi pelarut fosfat dan fungi selulolitik. Rataan hasil tertinggi total fungi pelarut fosfat pada lereng tengah dengan kedalaman 0-5 cm adalah 10,30 x 104 SPK/ml dan total fungi selulolitik 13,16 x 103 SPK/ml pada kedalaman 5-20 cm. Hasil identifikasi jenis fungi pelarut fosfat terdapat 5 jenis fungi, yaitu Aspergillus, Penicillium, Rhizopus, Fusarium, dan Mucor. Hasil identifikasi jenis fungi selulolitik terdapat 5 jenis fungi, yaitu Aspergillus, Cladosporium, Penicillium, Rhizopus, dan Mucor.
Kata kunci: fungi pelarut fosfat, fungi selulolitik, pasak bumi, tanah
TUBAGUS MARDONGAN SIAGIAN: The exploration of Phosphate Solubilizing Fungi and Cellulolytic Fungi under Pasak Bumi (Eurycoma longifolia) in Natural Forest Pasopo, Lubu Sutam, Padang Lawas.
Supervised by DENI ELFIATI and ARIDA SUSILOWATI
Pasak bumi is potential medicinal plant and has high economy value, if it developed it can cause the high demand and encouraging increased exploitation in their habitat which causes decreasing their population. Pasak bumi grows on acidic, sandy, and nutrient poor soil. The distribution of Pasak bumi is very influenced by soil conditions and edaphic factors. The existence of phosphate solubilizing fungi and cellulolytic fungi in soil is effecting the soil biologic condition so that it can support the growth of Pasak bumi in nature. The purpose of this study is to know the total population of phosphate solubilizing fungi and cellulolytic fungi, and identifying the species of phosphate solubilizing fungi and cellulolytic fungi which contained under Pasak Bumi. This study was done by using multilevel dilution method to get the total population of phosphate solubilizing fungi and cellulolytic fungi. This study was used completely randomized factorial design with two factors. The first factor is soils source with three level: upper slope, middle slope, lower slope and the second factor is soil depth with two level: 0-5 cm and 5-20 cm. The result of this study shown that the slope and depth of soil have no significant effect on total population of phosphate solubilizing fungi and cellulolytic fungi. The result of highest average total phosphate solubilizing fungi on middle slope with depth 0-5 cm is 10.30 x 104 CFU/ml and total cellulolytic fungi 13.16 x 103 CFU/ml at depth 5-20 cm. The indentify result of phosphate solubilizing fungi found 5 species of fungi: such as Aspergillus, Penicillium, Rhizopus, Fusarium, and Mucor. The indentify result of cellulolytic fungi found 5 species of fungi: such as Aspergillus, Cladosporium, Penicillium, Rhizopus, dan Mucor.
Keywords: Phosphate Solubilizing Fungi, Cellulolytic fungi, Pasak Bumi, Soil
Penulis dilahirkan di Bogor pada tanggal 8 Agustus 1997. Penulis merupakan anak kedua dari 2 bersaudara oleh pasangan Bapak Polmer Siagian dan Ibu Etty.
Penulis memulai pendidikan di SD Negeri Sindang Sari Bogor pada tahun 2003-2009, pendidikan tingkat Sekolah Menengah Pertama di SMP Negeri 6 Bogor pada tahun 2009-2012, pendidikan tingkat Sekolah Menengah Atas di SMA Negeri 9 Bogor pada tahun 2012-2015. Pada tahun 2015, penulis lulus di Fakultas Kehutanan USU melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN). Pada semester 5, penulis memilih Departemen Budidaya Hutan.
Semasa kuliah penulis merupakan anggota HIMAS-USU dan menjadi Ketua Umum HIMAS-USU Periode 2018/2019, Wakil Ketua II MPM Fakultas Kehutanan USU Periode 2017/2018, dan Pelaksana Tugas Ketua MPM Fakultas Kehutanan USU Periode 2017/2018. Penulis telah mengikuti Praktik Pengenalan Ekosistem Hutan (P2EH) di KHDTK Pondok Buluh pada tahun 2017. Penulis juga menjadi asisten Praktikum Ekonomi Umum pada tahun 2017 dan 2018, asisten Praktikum Ekonomi Sumberdaya Hutan pada tahun 2018, serta asisten Praktik Pengenalan Ekosistem Hutan (P2EH) di Desa Lubuk Kertang pada tahun 2018. Kemudian pada tahun 2018 penulis juga telah melaksanakan Praktik Kerja Lapangan (PKL) di Balai Taman Nasional Batang Gadis. Pada awal tahun 2019 penulis melaksanakan penelitian dengan judul “Eksplorasi Fungi Pelarut Fosfat dan Fungi Selulolitik di Bawah Tegakan Pasak Bumi (Eurycoma longifolia) di Hutan Alam Desa Papaso, Kecamatan Batang Lubu Sutam, Kabupaten Padang Lawas dibimbing oleh Ibu Dr. Deni Elfiati, SP., M.P dan Ibu Dr. Arida Susilowati, S.Hut., M.Si.
Puji syukur penulis ucapkan kehadirat Tuhan Yang Maha Esa atas rahmat dan karunia-Nya penulis dapat menyelesaikan skripsi ini. Skripsi ini berjudul
“Eksplorasi Fungi Pelarut Fosfat dan Fungi Selulolitik di Bawah Tegakan Pasak Bumi (Eurycoma longifolia) di Hutan Alam Desa Papaso, Kecamatan Lubu Sutam, Kabupaten Padang Lawas”.
Pada kesempatan ini penulis mengucapkan terima kasih kepada Ibu Dr.
Deni Elfiati, SP., MP dan Ibu Dr. Arida Susilowati, S.Hut., M.Si selaku komisi pembimbing saya yang telah membimbing dan mengarahkan penulis serta memberikan berbagai masukan berharga kepada penulis dalam penyelesaian skripsi ini.
Penulis juga mengucapkan terima kasih kepada kedua orang tua Bapak Polmer Siagian dan Ibu Etty, Ibu Nelly sebagai laboran dan Tim Riset di lapangan yang bersedia memberikan dukungan materi dan moral untuk pelaksanaan dan penyusunan hasil penelitian ini.
Penulis juga mengucapkan terima kasih kepada:
1. Ketua dan Sekretaris Departemen Budidaya Hutan, Mohammad Basyuni, S.Hut., M.Si., Ph.D dan Dr. Deni Elfiati, SP., MP dan seluruh staf pengajar dan pegawai di Fakultas Kehutanan USU.
2. Saudara perempuan penulis Santiara yang telah memberikan dukungan doa dan semangat kepada penulis.
3. Teman satu tim penelitian Muhammad Khabibi Hasibuan, Sri Anjeli, Sri Ratna Sari Hasibuan yang telah bekerja sama dengan baik sehingga penelitian berjalan dengan lancar.
4. Terima kasih kepada sahabat seperjuangan Arbi Handika, Akrimillah Yunus, Miftah Fahmi Ramadhan, Muhammad Bahagia Ritonga, Agi Rezka Pratama, Arbi Sabtono, Nicko Septuari Hutabarat, Aswin Sahari, teman-teman kantin, Dyah Lestari, Masitoh Darwina, Inayah, Hanna Liesmaya serta teman-teman angkatan 2015 Fakultas Kehutanan dan berbagai pihak yang telah banyak membantu penulis dalam menyelesaikan skripsi ini.
5. Terima kasih staf pegawai Laboratorium Biologi Tanah yang membantu dalam penyelesaian penelitian penulis.
Penelitian ini terlaksana atas bantuan hibah penelitian dosen dari dana hibah Talenta USU 2018. Penulis berharap semoga skripsi ini memberikan manfaat ke berbagai pihak. Akhir kata penulis mengucapkan terima kasih.
Medan, Januari 2020
Tubagus Mardongan Siagian
Halaman
LEMBAR PEGESAHAN ... i
PERNYATAAN ORISINALITAS ... ii
ABSTRAK ... iii
ABSTRACT ... iv
RIWAYAT HIDUP ... v
KATA PENGANTAR ... vi
DAFTAR ISI ... vii
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xi
PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 3
Manfaat Penelitian ... 3
TINJAUAN PUSTAKA Pasak Bumi ... 4
Fungi Pelarut Fosfat ... 4
Fungi Selulolitik ... 6
Faktor-Faktor Yang Mempengaruhi Pertumbuhan Fungi ... 7
Sifat Kimia Tanah ... 8
METODE PENELITIAN Waktu dan Tempat ... 10
Bahan dan Alat ... 10
Prosedur Penelitian ... 11
Pengambilan Contoh Tanah ... 11
Isolasi Fungi Pelarut Fosfat ... 11
Pembuatan Seri Pengenceran ... 11
Pemurnian Fungi Pelarut Fosfat ... 12
Identifikasi Fungi Pelarut Fosfat ... 13
Isolasi Fungi Selulolitik ... 13
Pembuatan Seri Pengenceran ... 13
Pemurnian Fungi Selulolitik ... 13
Identifikasi Fungi Selulolitik ... 14
Pengolahan Data ... 15
HASIL DAN PEMBAHASAN Karakteristik Sifat Kimiat Tanah ... 16
Fungi Pelarut Fosfat ... 18
Jumlah Total Fungi Pelarut Fosfat ... 18
Indeks Pelarutan (IP) Fosfat ... 19
Identifikasi Fungi Pelarut Fosfat ... 21
Indeks Selulolitik (IS) ... 29
Identifikasi Fungi Selulolitik ... 31
Peranan Fungi Selulolitik ... 36
KESIMPULAN DAN SARAN Kesimpulan ... 38
Saran ... 38
DAFTAR PUSTAKA ... 39
LAMPIRAN ... 44
No Teks Halaman
1. Hasil Analisis Sifat Kimia Tanah ... 16
2. Rataan Hasil Populasi Fungi Pelarut Fosfat ... 18
3. Hasil Isolat Fungi Pelarut Fosfat yang Diperoleh ... 19
4. Hasil Pengukuran Indeks Pelarutan (IP) Fosfat ... 20
5. Jenis Fungi Pelarut Fosfat ... 21
6. Karakteristik Isolat Fungi Pelarut Fosfat ... 26
7. Rataan Hasil Populasi Fungi Selulolitik ... 28
8. Hasil Isolat Fungi Selulolitik yang Diperoleh ... 30
9. Hasil Pengukuran Indeks Selulolitik (IS) ... 30
10. Jenis Fungi Selulolitik ... 31
11. Karakteristik Isolat Fungi Selulolitik ... 35
No Teks Halaman
1. Peta Lokasi Penelitian ... 10
2. Petak Contoh Pengambilan Sampel Tanah ... 11
3. Fungi Pelarut Fosfat yang Membentuk Zona Bening pada Media Pikovskaya ... 13
4. Fungi Selulolitik yang Membentuk Zona Bening pada Media CMC dengan Kongo Red 0,1% ... 14
5. Aspergillus sp. . ... 22
6. Penicillium sp. ... 23
7. Rhizopus sp. ... 24
8. Fusarium sp. ... 25
9. Mucor sp. ... 25
10. Aspergillus sp. . ... 32
11. Cladosporium sp. ... 32
12. Penicillium sp. ... 33
13. Rhizopus sp. ... 34
14. Mucor sp. ... 35
No Teks Halaman
1. Prosedur Analisis Kimia Tanah ... 44
2. Kriteria Analisis Kimia Tanah ... 46
3. Jumlah Total Populasi FPF ... 46
4. Analisis Sidik Ragam Total Populasi FPF ... 46
5. Jumlah Total Populasi Fungi Selulolitik ... 47
6. Analisis Sidik Ragam Total Populasi Fungi Selulolitik ... 47
7. Dokumentasi Kondisi Lapangan ... 47
PENDAHULUAN
Latar Belakang
Pasak bumi (Eurycoma longifolia) adalah salah satu sumber daya alam hayati berupa hasil hutan bukan kayu yang memiliki sebaran tumbuh di Asia Tenggara dengan penyebaran meliputi Indonesia, Semenanjung Malaysia, Laos, Kamboja, dan Vietnam. Pasak bumi merupakan salah satu tanaman obat yang potensial dan punya nilai ekonomi tinggi jika dikembangkan. Akar pasak bumi mengandung beberapa senyawa bioaktif yang berkhasiat obat. Adanya senyawa bioaktif pada pasak bumi yang berpotensi sebagai obat-obatan dapat berdampak pada meningkatnya pemanenan pasak bumi di habitat alaminya, sehingga saat ini pasak bumi sudah termasuk jenis tumbuhan yang dilindungi menurut Peraturan Menteri Pertanian Nomor: 511/Kpts/PD.310/9/2006 (Zulfahmi et al., 2015).
Pasak bumi merupakan tumbuhan obat yang seluruh bagian tanamannya dapat dimanfaatkan. Banyaknya manfaat yang dapat diperoleh dari pasak bumi sebagai bahan baku obat menyebabkan tingginya permintaan sehingga mendorong eksploitasi di habitatnya meningkat. Eksploitasi di hutan alam yang tidak diimbangi dengan budidaya menyebabkan kelangkaan (Kartikawati, 2014).
Menurut Hadiah (2000) dalam Rosmaina dan Zulfahmi (2013) pasak bumi tumbuh dengan baik pada tanah masam, berpasir, dan miskin unsur hara.
Persebaran tumbuhan pasak bumi sangat dipengaruhi oleh kondisi tanah atau faktor edafik. Tanah merupakan media tumbuh dan berkembangnya tanaman.
Kondisi tanah yang secara langsung berpengaruh terhadap tanaman adalah kesuburan. Indikator kesuburan tanah antara lain dilihat dari kandungan humus atau bahan organik, unsur hara, tekstur dan struktur tanah, serta ketersediaan air dalam pori-pori tanah. Kesuburan tanah dapat meningkat dengan adanya mikroorganisme tanah terutama pada rhizosfer karena mikroorganisme memegang peranan penting dalam proses pelapukan bahan organik dalam tanah sehingga unsur hara menjadi tersedia bagi tanaman (Azharo et al., 2017).
Beberapa mikroorganisme rhizosfer berperan dalam siklus hara dan proses pembentukan tanah, pertumbuhan tanaman, memengaruhi aktivitas mikroorganisme, serta sebagai pengendali hayati terhadap patogen akar. Rhizosfer
merupakan bagian tanah yang berada di sekitar perakaran tanaman. Populasi mikroorganisme di rhizosfer umumnya lebih banyak dan beragam dibandingkan pada tanah nonrhizosfer. Aktivitas mikroorganisme rhizosfer dipengaruhi oleh eksudat yang dihasilkan oleh perakaran tanaman (Simatupang, 2008)
Keberadaan mikroba berkaitan dengan banyaknya jumlah bahan organik.
Mikroba tanah banyak yang berperan dalam penyediaan maupun penyerapan unsur hara bagi tanaman, salah satunya mikroba pelarut fosfat (MPF). Mikroba pelarut fosfat adalah mikroba yang mampu melarutkan ikatan fosfat menjadi tersedia. Mikroba pelarut P adalah mikroba yang dapat melarutkan P sukar larut menjadi larut bagi tanaman melalui sekresi asam-asam organik yang dihasilkan untuk melepaskan P dari kompleks jerapan yang berperan dalam penyediaan unsur hara P pada tanaman (Hanafiah et al., 2009).
Di dalam ekosistem, mikroba selulolitik memegang peranan penting dalam merombak bahan organik. Sisa bahan organik yang telah mati diurai menjadi unsur-unsur yang dikembalikan ke dalam tanah (N, P, K, Ca, Mg, dan lainnya) dan atmosfer (CH4 maupun CO2) sebagai hara yang dapat digunakan kembali oleh tanaman. Selulosa dirombak oleh mikroba selulolitik dengan bantuan enzim selulase, salah satu mikroba perombak selulosa adalah fungi selulolitik. Selulosa dari sisa tumbuhan dan organisme lain diurai oleh mikroba menjadi senyawa sederhana berupa glukosa, CO2 dan H2O yang sangat berguna sebagai zat hara bagi tumbuhan dan organisme tanah lainnya (Saraswati et al., 2007).
Keberadaan fungi pelarut fosfat dan fungi selulolitik di dalam tanah mempengaruhi keadaan biologi tanah. Fungi pelarut fosfat berperan dalam melepaskan P yang terikat pada komponen tanah dan sehingga dapat diserap oleh tanaman. Keberadaan fungi selulolitik sangat penting untuk menghasilkan enzim selulase agar dapat mempercepat perombakan bahan organik menjadi unsur hara sehingga dapat digunakan kembali oleh tumbuhan pasak bumi untuk menunjang pertumbuhannya dialam. Mengingat pentingnya fungi pelarut fosfat dan fungi selulolitik di dalam tanah maka perlu dilakukan penelitian untuk mengetahui keberadaan fungi pelarut fosfat dan fungi selulolitik di bawah tegakan pasak bumi (Eurycoma longifolia) di Hutan alam Desa Papaso, Kecamatan Batang Lubu Sutam, Kabupaten Padang Lawas.
Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Menghitung total populasi fungi pelarut fosfat dan fungi selulolitik yang terdapat pada tanah di bawah tegakan pasak bumi (Eurycoma longifolia).
2. Mengidentifikasi jenis fungi pelarut fosfat dan fungi selulolitik yang terdapat pada tanah di bawah tegakan pasak bumi (Eurycoma longifolia).
Kegunaan Penelitian
Penelitian ini berguna untuk:
1. Memberikan data dan informasi mengenai keberadaan dan jenis fungi pelarut fosfat dan fungi selulolitik di bawah tegakan pasak bumi (Eurycoma longifolia).
2. Menjadi referensi untuk penelitian selanjutnya dalam menentukan potensi dan klasifikasi fungi pelarut fosfat dan fungi selulolitik pada tanah
rhizosfer yang ada di bawah tegakan tumbuhan pasak bumi (Eurycoma longifolia).
TINJAUAN PUSTAKA
Pasak Bumi (Eurycoma longifolia)
Menurut Hadiah (2000) dalam Rosmaina dan Zulfahmi (2013) pasak bumi (Eurycoma longifolia) yang termasuk ke dalam genus Eurycoma dan anggota famili suku Simarubaceae adalah tumbuhan perdu atau pohon kecil yang tingginya dapat mencapai 10-15 m. Pasak bumi umumnya tidak bercabang, dan batangnya berwarna coklat keabu-abuan, berdaun majemuk dan menyirip dengan daun berbentuk lanset atau bundar telur dan ujungnya sedikit meruncing, berjumlah ganjil (13-41 anak daun), kedudukan daunnya melingkar (rosette), bertipe pinatus dengan panjang dari pangkal tangkai 20-40 cm, bergelombang, warna anak daunnya hijau tua berukuran 5-25 cm x 1,25-3 cm, pinggirnya bergelombang, tangkai daun berwarna coklat kehitaman. Bunga berwarna merah berbentuk malai dan berbulu. Buah yang masak berwarna hijau gelap kemerahan, dengan panjang 1-2 cm dan lebarnya 0,5-1 cm.
Pasak bumi (Eurycoma longifolia) ditemukan sampai ketinggian tempat 600-750 m dari permukaan laut. Pasak bumi dapat dijumpai pada daerah pungggung bukit atau pematang, daerah datar dan berlereng dengan kemiringan 15%, tempat tumbuh yang disukai oleh pasak bumi pada tanah miring yang tidak tergenang air. Habitat pasak bumi merupakan hutan tropis dengan curah hujan yang cukup tinggi dan tanahnya tidak pernah tergenang air, datar tetapi lebih disukai kondisi tanah yang miring, aerasi baik atau banyak mengandung pasir (Hasibuan et al., 2016).
Menurut Angiosperm Phylogeny Group (2003), kedudukan taksonomi pasak bumi sebagai berikut:
Kingdom : Plantae
Divisio : Magnoliophyta Classis : Magnoliopsida Ordo : Sapindales Familia : Simaroubaceae Genus : Eurycoma
Species : Eurycoma longifolia
Fungi Pelarut Fosfat
Fosfat merupakan unsur hara esensil bagi tumbuhan, yang berfungsi membantu proses fotosintesis, respirasi, transfer dan penyimpanan energi, pembelahan dan pembesaran sel serta proses di dalam tumbuhan lainnya (Damanik et al., 2010).
Unsur fosfat (P) adalah unsur esensial kedua setelah N yang berperan penting dalam fotosintesis dan perkembangan akar. Ketersediaan fosfat dalam tanah jarang yang melebihi 0,01% dari total P. Sebagian besar bentuk fosfat terikat oleh koloid tanah sehingga tidak tersedia bagi tanaman. Mikroorganisme pelarut fosfat hidup terutama di sekitar perakaran tanaman, yaitu di daerah permukaan tanah sampai kedalaman 25 cm dari permukaan tanah. Keberadaan mikroorganisme yang dapat melarutkan P berkaitan dengan banyaknya jumlah bahan organik yang secara langsung mempengaruhi jumlah dan aktivitas hidupnya. Akar tanaman mempengaruhi kehidupan mikroorganisme dan secara fisiologis mikroorganisme yang berada dekat dengan daerah perakaran akan lebih aktif daripada yang hidup jauh dari daerah perakaran. Keberadaan mikroorganisme pelarut fosfat dari suatu tempat ke tempat lainnya sangat beragam. Salah satu faktor yang menyebabkan keragaman tersebut adalah sifat biologisnya. Ada yang hidup pada kondisi asam, dan ada pula yang hidup pada kondisi netral dan basa, ada yang hipofilik, mesofilik, dan termofilik, ada yang hidup sebagai aerob dan ada yang anaerob, dan beberapa sifat lain yang bervariasi (Ginting et al., 2006).
Ketersediaan hara fosfat di dalam tanah dipengaruhi oleh bahan organik melalui hasil pelapukannya yaitu asam organik dan CO2. Asam organik seperti asam malonat, tartarat, humat dan fulvik akan menghasilkan anion organik yang dapat mengikat logam seperti Fe, Al dan Ca dari dalam larutan tanah, kemudian memmbentuk senyawa kompleks yang bersifat sukar larut (Winarso, 2005).
Fosfat merupakan unsur yang tidak mobil di dalam tanah, hilangnya P larut dalam tanah dijumpai pada tanah yang mengalami pelapukan lanjut dan besar P larut yang hilang sebanding dengan jumlah input P dalam bentuk larut.
Unsur P tidak dimediasi secara biologi untuk berubah ke atmosfer seperti unsur C dan N, unsur P tidak juga menjadi sumber energi utama untuk oksidasi mikroba.
Meskipun demikian, organisme tanah terlibat dalam siklus P, organisme ini berperan dalam kelarutan P anorganik dan mineralisasi P organik, serta berperan dalam menyebabkan imobilisasi P tersedia dalam tanah (Hanafiah et al., 2009).
Prinsip dasar isolasi mikroba pelarut fosfat ialah menyeleksi mikroba dalam media pertumbuhan spesifik yang mengandung sumber P terikat.
Kemampuan mikroba pelarut fosfat dalam melarutkan fosfat terikat dapat diketahui dengan mengembangkan biakan murni pada media Pikovskaya yang berwarna putih keruh, karena mengandung P tidak larut air seperti kalsium fosfat Ca3(PO4)2. Pertumbuhan mikroba pelarut fosfat dicirikan dengan zona bening (holozone) di sekeliling koloni mikroba. Mikroba pelarut fosfat yang potensial dapat diseleksi dengan melihat luas zona bening paling besar pada media padat.
Pengukuran potensi pelarutan fosfat secara kualitatif ini menggunakan nilai indeks pelarutan (dissolving index), yaitu nisbah antara diameter zona jernih terhadap diameter koloni. Kemampuan pelarut fosfat terikat secara kuantitatif dapat diukur dengan membiakkan mikroba pada media Pikovskaya cair. Kandungan P terlarut dalam media cair tersebut diukur setelah masa inkubasi (Setiawati, 1998).
Fungi Selulotik
Tanah merupakan habitat utama mikroba. Salah satu peranan mikroba tanah adalah mendegradasi selulosa. Selulosa memegang peranan penting dalam siklus karbon di alam dan merupakan senyawa terbesar. Selulosa dari sisa tumbuhan dan organisme lain diurai oleh mikroba menjadi senyawa sederhana berupa glukosa, CO2 dan hidrogen yang sangat berguna sebagai zat hara bagi tumbuhan dan organisme tanah lainnya. Kebanyakan mikroba selulolitik hidup pada lapisan atas dari tanah pada kedalaman 0-30 cm dan bersifat aerob.
Beberapa bakteri, aktinomisetes, dan fungi mampu menghasilkan selulase (Roza et al., 2013).
Menurut Subowo (2015) beberapa fungi selulolitik juga telah dikembangkan untuk menghasilkan enzim selulase yang banyak dibutuhkan oleh industri. Enzim selulase memiliki beberapa aplikasi komersial seperti malting, pengolahan kayu, persiapan pembuatan kain drill dari jaringan tanaman dan proses penghilangan tinta dari kertas cetak. Enzim selulase dihasilkan oleh fungi Chaetomium, Aspergillus, Penicillium, Fusarium, Myrothesium dan Trichoderma.
Degradasi selulosa oleh mikrobia secara enzimatis merupakan proses penguraian bahan organik secara biologi. Pelapukan akibat enzim kompleks selulase yang dominan terjadi pada lapisan humus lantai hutan. Bakteri, fungi, dan aktinomisetes dapat memproduksi enzim selulolitik pada lingkup masing-masing keberadaanya dalam membentuk sistem degradasi ketika mempercepat peluruhan bahan organik yang berada di lantai hutan (Sudiana dan Rahmansyah, 2002).
Selulosa dirombak oleh mikroba selulolitik dengan bantuan enzim selulase, salah satu mikroba perombak selulosa adalah fungi selulolitik. Selulosa dari sisa tumbuhan dan organisme lain diurai oleh mikroba menjadi senyawa sederhana berupa glukosa, CO2 dan hidrogen yang sangat berguna sebagai zat hara bagi tumbuhan dan organisme tanah lainnya. Fungi memiliki kemampuan untuk menghidrolisis selulosa alami melalui aktivitas selulase yang dimilikinya.
Perolehan mikroba selulolitik yang mampu menghasilkan aktivitas selulase yang tinggi menjadi sangat penting untuk tujuan pengomposan limbah organik.
Mikroba yang mampu menghasilkan komponen selulase diantaranya adalah fungi Trichoderma, sehingga fungi ini sering disebut sebagai selulolitik sejati (Hardianty et al., 2013).
Enzim selulase merupakan kompleks enzim yang merupakan sistem sinergis dan secara bertahap mampu mengubah selulosa menjadi sumber energi dan glukosa tersedia sehingga berperan penting dalam pemanfaatan biomassa (Shaikh et al., 2013). Selulosa merupakan salah satu biopolimer melimpah di alam yang pemanfaatannya masih sangat terbatas.
Faktor –Faktor Yang Mempengaruhi Pertumbuhan Fungi
Pada umumnya pertumbuhan fungi dipengaruhi oleh faktor substrat, kelembaban, suhu, derajat keasaman substrat (pH), dan senyawa-senyawa kimia dilingkungannya (Gandjar et al., 2006) yaitu:
1. Substrat
Nutrien-nutrien baru dapat dimanfaatkan sesudah fungi mengekskresi enzim-enzim ekstraseluler yang dapat mengurai senyawa-senyawa kompleks dari substrat tersebut menjadi senyawa-senyawa yang lebih sederhana. Fungi yang tidak dapat menghasilkan enzim sesuai komposisi subtrat dengan sendirinya tidak dapat memanfaatkan nutrien-nutrien dalam substrat tersebut.
2. Kelembaban
Faktor ini sangat penting untuk pertumbuhan fungi. Pada umumnya fungi tingkat rendah seperti Rhizopus atau Mucor memerlukan lingkungan dengan kelembaban nisbi 90%, sedangkan fungi Aspergillus, Penicillium, Fusarium, banyak Hyphomycetes lainnya dapat hidup pada kelembaban nisbi yang lebih rendah, yaitu 80%. Dengan mengetahui sifat-sifat fungi ini penyimpanan bahan pangan dan materi lainnya dapat mencegah kerusakannya.
3. Suhu
Berdasarkan kisaran suhu lingkungan yang baik untuk pertumbuhan, fungi dapat dikelompokkan sebagai fungi psikrofil, mesofil, dan termofil. Secara umum pertumbuhan untuk kebanyakan fungi adalah sekitar 25- 30 0C. Selain itu, ada fungi yang bersifat termofilik yakni mampu tumbuh pada suhu tinggi. Mengetahui kisaran suhu pertumbuhan suatu fungi adalah sangat penting, terutama bila isolat- isolat tertentu atau termotoleran dapat memberikan produk yang optimal meskipun terjadi peningkatan suhu, karena metabolisme funginya.
4. Derajat keasaman (pH)
pH substrat sangat penting untuk pertumbuhan fungi, karena enzim-enzim tertentu hanya akan mengurai suatu substrat sesuai dengan aktivitasnya pada pH tertentu. Umumnya fungi dapat hidup di bawah pH 7,0. Namun beberapa jenis fungi tertentu bahkan dapat tumbuh pada pH yang cukup rendah, yaitu pH 4,5-5,5.
5. Senyawa kimia
Selama pertumbuhannya fungi menghasilkan senyawa-senyawa yang tidak diperlukannya lagi dan dikeluarkan ke lingkungan. Senyawa-senyawa tersebut merupakan suatu pengamanan bagi dirinya terhadap serangan oleh organisme lain termasuk terhadap sesama mikroorganisme.
Sifat Kimia Tanah
Sifat kimia tanah adalah segala sesuatu yang berhubungan dengan peristiwa yang bersifat kimia dan terjadi di dalam maupun di atas permukaan tanah sehingga akan menentukan sifat dan ciri tanah yang terbentuk dan berkembang seetelah peristiwa kimia tersebut. Peubah yang termasuk sifat kimia tanah yang mempengaruhi pertumbuhan, produksi dan kualitas tanaman antara
lain pH tanah, ketersediaan unsur hara makro dan mikro serta kapasitas tukar kation (KTK) (Hakim et al., 1986).
Sebagian besar unsur hara mengalami daur hara yang cepat sekitar sistem tanaman atau tanah, dan sebagian besar hara diserap oleh tumbuhan. pada hutan tropika, perakaran tanaman terkonsentrasi dekat dengan permukaan tanah dan bercampur baik dengan serasah, organisme perombak dan jasad renik lain.
Kondisi tersebut memungkinkan serapan hara meningkat dan mampu mengurangi gerakan hara kebagian tanah lebih dalam. Pada ekosistem hutan, keberadaan bahan organik tanah menjadi kunci keberlangsungan ekosistem dan produktivitas hutan. Bahan organik yang berada dipermukaan tanah sebagai lantai hutan dengan berbagai tingkat dekomposisinya merupakan sumber utama hara tegakan hutan.
Banyak unsur di dalam tanah mengalami perubahan bentuk akibat perubahan reaksi di dalam tanah. Hal ini terkait dengan perubahan tingkat kelarutan senyawa dari unsur-unsur tersebut di dalam tanah dengan pH lingkungan di dalam tanah.
Oleh karena itu, pH tanah bertanggung jawab terhadap ketersediaan hara bagi tanaman (Munawar, 2011).
Kapasitas atau kemampuan tanah menyerap dan melepaskan kation yang dinyatakan sebagai total kation yang dapat dipertukarkan per 100 gr tanah yang dinyatakan dalam satuan miliequivalen (m.e.) atau dalam SI Cmolc/kg. Menurut Winarso (2005) tanah-tanah yang mempunyai kadar liat atau kadar bahan organik tinggi mempunyai KTK lebih tinggi dibandingkan dengan tanah yang mempunyai kadar liat rendah atau bahan organik rendah.
METODE PENELITIAN
Tempat dan Waktu Penelitian
Pengambilan sampel tanah dilakukan di kawasan hutan alam Desa Papaso, Kecamatan Batang Lubu Sutam, Kabupaten Padang Lawas, Sumatera Utara (Gambar 1). Analisis sifat kimia tanah, isolasi serta identifikasi fungi pelarut fosfat dan fungi selulolitik dilakukan di Laboratorium Biologi Tanah, Fakultas Pertanian Universitas Sumatera Utara, Medan. Waktu penelitian dilaksanakan pada bulan Juli 2019 - Oktober 2019.
Gambar. 1 Peta Lokasi Penelitian
Bahan dan Alat
Bahan yang digunakan dalam penelitian adalah tanah dari tegakan pasak bumi, kapas, aquades, kantong plastik, kertas label, alkohol 96%, plastik kraf, plastik web, aluminium foil, kaca preparat, kaca objek dan kertas saring, Ca3(PO4)2 5g, larutan fisiologis steril (8,5 gr NaCl per liter akuades) dalam erlenmeyer 250 ml sebanyak 90 ml dan dalam tabung reaksi masing-masing berisi 9 ml, Carboxy Methyl Cellulose (CMC), Potato Dextrose Agar (PDA), media Pikovskaya, dan tepung selulosa.
Alat yang digunakan adalah cangkul, sarung tangan, masker, cawan petri, erlenmeyer, pipet tetes, inkubator, tabung reaksi, timbangan,pisau, kaca preparat, tali plastik, ember, oven, pipet volume, botol semprot, rak tabung reaksi, pipet steril, laminar air flow, gelas ukur, autoklaf, rotarimixer, shaker, jarum ose, sprayer, kamera, bunsen, mikroskop, dan alat tulis.
Prosedur Penelitian
1. Pengambilan Sampel Tanah
Lokasi pengambilan sampel tanah dilakukan di areal hutan Desa Papaso.
Pengambilan contoh tanah dilakukan secara diagonal, dengan kedalaman 0-5 cm dan 5-20 cm pada setiap lubang pengambilan contoh tanah yang berdasarkan kelerengan bukit yaitu lereng atas (21,3%), lereng tengah (16,6%) dan lereng bawah (12,5%). Contoh tanah yang diambil pada tiap titik kemudian dikompositkan sesuai kedalamannya dan ditempatkan pada plastik yang sudah diberi label. Menurut Saraswati et al. (2007) metode pengambilan contoh tanah komposit ditujukan untuk mendapatkan gambaran umum tentang keberadaan mikroba di suatu areal atau petak tanah. Contoh tanah komposit merupakan campuran dari anak contoh tanah yang diambil dari beberapa tempat pada areal yg sama secara diagonal. Semakin banyak jumlah anak contoh tanah yang diambil, maka semakin baik pula contoh tanah komposit yang dihasilkan.
20 m
20 m
Gambar 2. Petak Contoh Pengambilan Sampel Tanah Keterangan:
: Lokasi pengambilan sampel tanah
2. Isolasi Fungi Pelarut Fosfat A. Pembuatan Seri Pengenceran
Sepuluh (10) g tanah dimasukkan ke dalam Erlenmeyer 250 ml yang berisi 90 ml larutan fisiologis steril (pengenceran 10-1), kemudian dikocok selama 30 menit pada shaker. Dibuat pengenceran secara serial, dari pengenceran 10-1 diambil 1 ml dan dimasukkan ke dalam tabung reaksi yang telah berisi 9 ml larutan fisiologis steril (pengenceran 10-2) selanjutnya dikocok di atas rotamixer sampai homogen. Dari pengenceran 10-2 dipipet sebanyak 1 ml dan dimasukkan ke dalam tabung reaksi yang berisi 9 ml larutan fisiologis (disebut pengenceran 10-3) dilakukan hal serupa berturut-turut sampai pengenceran 10-5. Dipakai suspensi tanah dari 3 pengenceran sebagai antisipasi bila pada pengenceran tersebut tidak diperoleh fungi pelarut fosfat.
B. Pemurnian Fungi Pelarut Fosfat
Pengenceran 10-3, 10-4, 10-5 dituangkan 12 ml media Pikovskaya (suhu sekitar 450C-500C) ke dalam cawan petri yang telah berisi 1 ml suspensi tanah, lalu putar cawan petri kearah kanan 3 kali dan ke arah kiri 3 kali agar media bercampur secara merata, biarkan sampai media mengeras (padat). Setelah media mengeras, cawan petri diinkubasi pada inkubator dalam keadaan terbalik selama 3 hari dengan suhu 280C-300C. Setelah diinkubasi selama 3 hari dilakukan pengamatan fungi yang tumbuh pada media. Dihitung populasi fungi pelarut fosfat secara manual untuk menentukan total fungi dalam setiap cawan petri.
Koloni fungi pelarut fosfat yang didapatkan kemudian diukur diameter koloni dan zona beningnya dengan menggunakan penggaris. Diameter paling besar di sekitar koloni menunjukkan besar kecilnya potensi fungi pelarut fosfat dalam melarutkan unsur P dari bentuk yang tidak larut. Dihitung indeks pelarutan (IP) Fosfat secara kualitatif yaitu:
IP = iameter zona bening iameter koloni
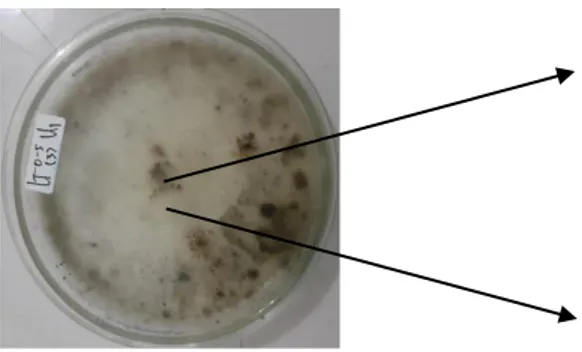
Keberadaan fungi pelarut fosfat ditandai dengan terbentuknya daerah zona bening (holozone) yang mengelilingi koloni fungi pelarut fosfat (Gambar 3).
Gambar 3. Fungi Pelarut Fosfat yang membentuk zona bening pada media Pikovskaya C. Identifikasi Fungi Pelarut Fosfat
Identifikasi fungi pelarut fosfat yang sudah tumbuh dilakukan setelah pemurnian, identifikasi dilakukan dengan mengamati ciri makroskopis dan mikroskopisnya. Pengamatan makroskopis meliputi pengukuran diameter koloni fungi pelarut fosfat dan pengamatan warna koloni yang dilakukan secara manual, sedangkan pengamatan mikroskopis fungi pelarut fosfat dilakukan dengan menggunakan mikroskop. Fungi yang sudah tumbuh di ambil sedikit dengan menggunakan selotip kemudian di tempelkan pada kaca preparat selanjutnya diamati di bawah mikroskop.
3. Isolasi Fungi Selulotik
A. Pembuatan Seri Pengenceran
Seri Pengenceran dibuat menurut metode yang disampaikan oleh Anas (1989). Siapkan pengenceran 10-2, 10-3 dan 10-4, dilakukan pemipetan 1 ml pada cawan petri. Lakukan penuangan 10-15 ml media, media yang digunakan adalah media CMC. Kemudian cawan petri digerakkan memutar kekiri dan kekanan agar suspensi fungi dapat tersebar merata pada cawan agar. Inkubasikan pada temperatur 28oC (suhu ruang) selama satu minggu (sesuai pertumbuhan).
B. Pemurniaan Fungi Selulotik
Metode yang digunakan untuk pemurnian fungi selulotik berdasarkan Saraswati et al. (2007) dimulai dengan memindahkan koloni fungi selulolitik yang sudah tumbuh pada media CMC ditambah larutan kongo red 0,1% yang baru sampai diperoleh koloni fungi selulolitik tunggal. Dihitung populasi fungi
Koloni
Zona Bening
selulolitik secara manual untuk menentukan total fungi dalam setiap cawan petri.
Jumlah sel permililiter dapat ditetapkan dengan rumus (Waluyo, 2010):
Koloni per ml atau per gram = Jumlah koloni per cawan x faktor pengenceran Koloni fungi selulolitik yang didapatkan kemudian diukur diameter koloni dan zona beningnya dengan menggunakan penggaris, kemudian dihitung nilai indeks selulolitik (IS). Daya degradasi selulosa diklasifikasikan berdasarkan nilai indeks selulolitik dengan kategori rendah apabila ≤ 1, kategori sedang antara 1-2 dan tinggi apabila ≥ 2 (Rudiansyah et al., 2017).
Indeks Selulolitik (IS) = iameter zona bening – iameter koloni
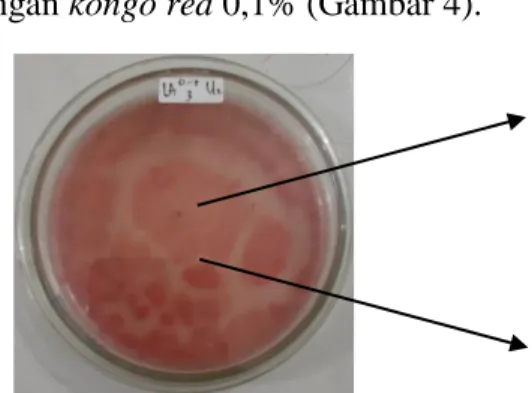
Keberadaan fungi selulolitik ditandai dengan adanya zona bening yang terbentuk mengelilingi koloni fungi selulolitik yang ditumbuhkan pada media Carboxy Methyl Cellulose (CMC) dengan kongo red 0,1% (Gambar 4).
Gambar 4. Fungi Selulolitik yang membentuk zona bening pada media CMC dengan kongo red 0,1%
C. Identifikasi Fungi Selulolitik
Identifikasi fungi selulolitik yang sudah tumbuh dilakukan setelah pemurnian, identifikasi dilakukan dengan mengamati ciri makroskopis dan mikroskopisnya. Pengamatan makroskopis meliputi pengukuran diameter koloni fungi selulolitik dan pengamatan warna koloni yang dilakukan secara manual, sedangkan pengamatan mikroskopis fungi selulolitik dilakukan dengan menggunakan mikroskop. Fungi yang sudah tumbuh di ambil sedikit dengan menggunakan selotip kemudian di tempelkan pada kaca preparat selanjutnya diamati di bawah mikroskop.
Koloni
Zona Bening
4. Pengolahan Data
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) Faktorial, yaitu dengan 2 faktor. Faktor pertama adalah sumber tanah dari 3 kelerengan (lereng atas, tengah, dan bawah) dan faktor kedua adalah dari dua kedalaman tanah (kedalaman 0-5 cm dan 5-20 cm). Semua perlakuan diulang sebanyak 3 kali sehingga diperoleh 18 jumlah unit percobaan.
Model linear Rancangan Acak Lengkap (RAL) Faktorial yang digunakan dalam percobaan ini adalah :
Yijk = µ + αi + βj + (αβ)ij + €ijk Dimana :
Yijk : Respon atau nilai pengamatan keberadaan fungi dari sumber tanah ke-i pada kedalaman tanah ke-j ulangan ke-k
µ : Rataan umum keberadaan fungi αi : Pengaruh sumber tanah ke-i βj : Pengaruh kedalaman tanah ke-j
(αβ)ij : Interaksi antara sumber tanah dengan kedalaman tanah
€ijk : Pengaruh galat pada keberadaan fungi dari sumber tanah ke-i pada kedalaman tanah ke-j ulangan ke-k
Untuk mengetahui pengaruh dari setiap perlakuan maka akan dilakukan analisis sidik ragam (Anova).
HASIL DAN PEMBAHASAN
Karakteristik Sifat Kimia Tanah
Analisis kimia tanah penting untuk mengetahui sifat dan ciri tanah pada lokasi penelitian. Keberadaan fungi di dalam tanah dipengaruhi oleh sifat kimia tanah. Hasil analisis sifat kimia tanah pasak bumi (Eurycoma longifolia) disajikan pada Tabel 1.
Tabel 1. Hasil Analisis Sifat Kimia Tanah Sumber Tanah
(Kelerengan)
Kedalaman Tanah
pH (H2O)
C-organik (%)
P-Tersedia (ppm)
KTK (m.e/100 g)
Atas 21,3% 0-5 cm 4,0 sm 1,36 r 2,69 sr 5,93 r
5-20 cm 4,1 sm 1,34 r 3,52 sr 6,38 r
Tengah 16,6% 0-5 cm 4,4 sm 2,01 s 8,96 r 7,22 r
5-20 cm 4,4 sm 1,95 r 7,44 sr 6,36 r
Bawah 12,5% 0-5 cm 4,4 sm 1,80 r 6,29 sr 7,38 r
5-20 cm 4,4 sm 1,94 r 7,56 sr 5,93 r Kriteria : *Hardjowigeno (1995)
Keterangan:
sr : sangat rendah t : tinggi sm : sangat masam
r : rendah st : sangat tinggi m : masam
s : sedang
Hasil analisis pH tanah pasak bumi pada tiga kelerengan dengan dua kedalaman, diperoleh nilai dengan kriteria yang sama yaitu berada pada kriteria sangat masam (4,0-4,4). Tingkat kemasaman tertinggi terdapat pada lereng atas yaitu 4,0 pada (kedalaman 0-5 cm) dan 4,1 (kedalaman 5-20 cm), sedangkan pH terendah pada lereng tengah dan bawah yaitu 4,4. Menurut Soewandita (2008) nilai pH menunjukkan banyaknya konsentrasi ion hidrogen (H+) di dalam tanah.
Semakin tinggi kadar ion H+ di dalam tanah, semakin masam tanah tersebut.
Jumlah ion H+ yang tinggi menyebabkan hara terikat semakin tinggi serta diikuti pula dengan penurunan pH. Penurunan pH akan diikuti kejenuhan basa yang rendah. Hal ini juga berarti ketersediaan hara yang semakin kecil.
Kandungan C-organik merupakan indikator tinggi rendahnya jumlah bahan organik tanah yang tersedia dalam tanah. Nilai C-organik pada tanah pasak bumi di tiga kelerengan dengan dua kedalaman berada pada kriteria rendah (1,34%-1,95%) dan sedang (2,01%). Rendahnya nilai C-organik pada tanah tegakan pasak bumi disebabkan oleh kurangnya bahan organik atau proses dekomposisi yang cukup lama. Menurut Munawar (2011) pada ekosistem hutan,
keberadaan bahan organik tanah menjadi kunci keberlangsungan ekosistem dan produktivitas hutan. Bahan organik yang berada dipermukaan tanah sebagai lantai hutan dengan berbagai tingkat dekomposisinya merupakan sumber utama hara tegakan hutan.
Hasil analisis KTK tanah pasak bumi pada tiga kelerengan dengan dua kedalaman berada pada kriteria rendah (5,93 m.e/100g-7,38 m.e/100g), tinggi rendahnya nilai KTK tanah pasak bumi tergantung pada sifat dan ciri tanah dilokasi penelitian. Rendahnya nilai KTK tanah tersebut dapat disebabkan karena rendahnya kandungan bahan organik tanah sebagian akibat dari kegiatan fisik di badan tanah dan kondisi tanah yang sangat masam. Hal ini sesuai dengan pernyataan Tufaila dan Alam (2014), bahwa keadaan tanah yang sangat masam menyebabkan tanah kehilangan kapasitas tukar kation dan kemampuan menyimpan hara kation dalam bentuk dapat tukar karena perkembangan muatan positif.
Fosfat merupakan salah satu unsur makro esensial, tidak hanya bagi kehidupan tumbuhan tetapi juga bagi biota tanah. Kadar P-tersedia tanah pasak bumi pada tiga kelerengan dengan dua kedalaman berada pada kriteria memiliki kriteria sangat rendah dan rendah yaitu 2,69 ppm-8,96 ppm. Rendahnya ketersediaan unsur P tersebut diduga selain karena rata-rata pH di daerah penelitian tergolong masam, juga sumber unsur P dari ketersediaan bahan organik yang juga rendah. Kadar hara P-tersedia yang tinggi akan menguntungkan bagi tanaman sehingga tanah-tanah demikian cenderung subur. Jumlah P tersedia dalam tanah ditentukan oleh besarnya P dalam jerapan yang mekanisme ketersediaannya diatur oleh pH dan jumlah bahan organik tanah (Susanto, 2005).
Kandungan bahan organik berhubungan dengan keadaan P-tersedia serta hubungan antara bahan organik dengan pH tanah. Bahan organik mengandung berbagai hara, termasuk fosfat yang akan terlepas selama dekomposisi baik dalam bentuk P-terikat ataupun P-tersedia. Besarnya bahan organik yang terdekomposisi dipengaruhi pH tanah karena besarnya pH mempengaruhi jumlah mikroba pendekomposer. Jika pH mendukung, jumlah dan aktivitas dekomposer akan meningkat sehingga semakin besar hara yang dilepaskan dalam tanah (Telaumbanua, 2011).
Fungi Pelarut Fosfat
Jumlah Total Fungi Pelarut Fosfat
Jumlah total fungi pelarut fosfat menggambarkan banyaknya populasi fungi pelarut fosfat pada lokasi pengambilan sampel tanah, populasi fungi pelarut fosfat setiap kelerengan berbeda, perbedaan jumlah ini disebabkan sumber tanah yang berbeda pula. Rataan hasil populasi fungi pelarut fosfat disajikan pada Tabel 2.
Tabel 2. Rataan Hasil Populasi Fungi Pelarut Fosfat (…x 104 SPK/ml) Sumber Tanah
(Kelerengan)
Kedalaman
Rataan
0-5 cm 5-20 cm
Atas 8,72 7,17 7,95
Tengah 10,30 6,11 8,21
Bawah 3,03 4,50 3,77
Rataan 7,35 5,93
Sidik ragam (Lampiran 6) menunjukkan bahwa tanah di bawah tegakan pasak bumi dengan tiga kelerengan dan dua kedalaman berpengaruh tidak nyata terhadap populasi fungi pelarut fosfat. Berdasarkan Tabel 2 dapat diketahui bahwa hasil rataan total populasi fungi pelarut fosfat tertingi terdapat pada sumber tanah yang berada pada kelerengan tengah kedalaman 0-5 cm (10,30 x 104 SPK/ml) sedangkan populasi fungi pelarut fosfat terendah terdapat pada sumber tanah yang berada pada kelerengan bawah kedalaman 0-5 cm (3,03 x 104 SPK/ml).
Jumlah koloni pada kelerengan tengah 0-5 cm lebih banyak ditemukan.
Hal ini disebabkan oleh kondisi pH tanah yang semakin meningkat dengan bertambahnya kedalaman tanah yang juga dinyatakan oleh Irfan (2014) bahwa kedalaman tanah mempengaruhi pH. Kondisi pH kemudian mempengaruhi ketersediaan P di dalam tanah. Menurut Sagala (2013) semakin banyak P-tersedia dalam tanah semakin banyak pula aktivitas mikroorganisme dalam tanah itu.
Kadar P-tersedia pada lereng tengah kedalaman 0-5 cm adalah 8,96 ppm. Jumlah ini termasuk dalam kategori rendah dibandingkan dengan tanah pada kelerengan atas yang memiliki kadar P-tersedia sangat rendah, sedangkan tanah pada kelerengan bawah juga memiliki kadar P-tersedia sangat rendah.
pH yang asam merupakan kondisi yang baik untuk pertumbuhan fungi sehingga pada kedalaman 0-5 cm jumlah populasi fungi lebih tinggi jika dibandingkan dengan kedalaman 5-20 cm. Hal ini sesuai dengan pernyataan Gandjar et al. (2006) bahwa kebanyakan fungi dapat tumbuh pada kisaran pH
yang luas yaitu pH 2-8,5 tetapi biasanya pertumbuhannya akan lebih baik pada kondisi asam atau pH rendah. pH rendah umumnya didominasi oleh fungi. Jumlah populasi fungi pelarut fosfat dari dua kedalaman lebih banyak pada kedalaman 0-5 cm dibandingkan kedalaman 5-20 cm karena pada daerah top soil umumnya fungi dijumpai. Hal ini juga sesuai dengan pernyataan Rao (1994) yang menyatakan bahwa fungi umumnya dijumpai pada tanah yang lebih dangkal dan jarang ditemukan di bagian tanah yang lebih dalam. Menurut Hanafiah (2005) umumnya semakin masuk ke dalam tanah konsentrasi oksigen semakin menipis sehingga menjadi salah satu faktor yang membatasi perkembangan mikroorganisme.
Populasi fungi pelarut pada lereng tengah lebih tinggi jika dibandingkan lereng atas maupun bawah (Tabel 2), hal ini disebabkan oleh Perbedaan dalam komposisi batuan dasar dan iklim. Menurut Sahara et al. (2019) komposisi batuan dasar dan iklim merupakan faktor-faktor utama yang mempengaruhi pembentukan tanah pada ketinggian yang berbeda di atas gunung, selain itu kemiringan lereng dan keterbukaan vegetasi penutup juga merupakan faktor-faktor yang penting.
Indeks Pelarutan (IP) Fosfat
Fungi yang tumbuh pada media akan melarutkan P yang ditandai dengan terbentuknya zona bening yang mengelilingi fungi pelarut fosfat. Menurut Elfiati et al. (2016) bahwa untuk melihat kemampuan suatu fungi dalam melarutkan fosfat salah satunya dapat dilakukan secara kualitatif yaitu dengan membandingkan antara diameter zona bening yang dihasilkan oleh fungi dengan diameter koloni nya. Semakin besar nilai indeks pelarutan, maka semakin besar kemampuannya dalam melepaskan P. Hasil isolasi fungi pelarut fosfat yang diperoleh disajikan pada Tabel 3.
Tabel 3. Hasil Isolat Fungi Pelarut Fosfat yang Diperoleh Sumber Tanah
(Kelerengan)
Kedalaman
Jumlah
0-5 cm 5-20 cm
Lereng Atas 2 2 4
Lereng Tengah 3 2 5
Lereng Bawah 1 1 2
Jumlah 6 5 11
Untuk mengetahui kemampuan fungi pelarut fosfat dilakukan pengukuran diameter zona bening yang di sekeliling koloni. Cara ini umum dilakukan, namun karena tidak memperhitungkan faktor pertumbuhan koloni, sering menghasilkan
hubungan korelasi yang rendah antara lebar zona bening dengan jumlah P-terlarut secara kualitatif. Menurut Premono (1994) hal tersebut dapat diatasi dengan menggunakan nilai indeks pelarutan yaitu nisbah antara diameter zona bening terhadap diameter koloni. Hasil indeks tersebut terbukti berkorelasi tinggi terhadap jumlah P yang dapat dilarutkan secara kualitatif. Hasil pengukuran indeks pelarutan fosfat disajikan pada Tabel 4.
Tabel 4. Hasil Pengukuran Indeks Pelarutan (IP) Fosfat Kode Isolat Diameter Koloni
(cm)
Diameter Zona Bening (cm)
Indeks Pelarutan (IP) Fosfat
LT U3 10-4 (0-5 cm) 2,48 2,96 1,19
LA U3 10-5 (5-20 cm) 2,16 2,66 1,23
LB U2 10-4 (0-5 cm) 2.60 3.30 1,27
LT U1 10-3 (0-5 cm) 2,33 3,13 1,34
LA U3 10-4 (5-20 cm) 1,66 2,36 1,42
LT U3 10-4 (5-20 cm) 1,56 2,16 1,44
LA U2 10-3 (0-5 cm) 1,55 2,45 1,58
LT U3 10-3 (5-20 cm) 0,86 1,36 1,58
LB U3 10-5 (5-20 cm) 0,90 1,50 1,67
LT U2 10-5 (0-5 cm) 0,65 1,25 1,92
LA U1 10-5 (0-5 cm) 0,33 0,80 2,42
Keterangan :
LA : Fungi dari tanah lereng atas LT : Fungi dari tanah lereng tengah LB : Fungi dari tanah lereng bawah
Hasil pengamatan menunjukkan indeks pelarutan fosfat tertinggi yang memiliki kemampuan tumbuh yang cepat diperoleh dari isolat fungi LA U1 10-5 (0-5 cm) dengan nilai 2,42 dan indeks pelarutan fosfat terendah terdapat pada isloat fungi LT U3 10-4 (0-5 cm). besarnya nilai IS menggambarkan besarnya daya degradasi selulosa fungi pada media spesifik yang digunakan. Tingginya nilai indeks pelarutan fosfat pada isolat fungi LA U1 10-5 (0-5 cm) diduga karena pH yang sangat masam sehingga fungi dapat tumbuh dengan baik, menurut Soewandita (2008) jumlah ion H+ yang tinggi menyebabkan hara yang terikat semakin tinggi serta diikuti dengan penurunan pH, yang berarti semakin rendah pH maka P akan semakin banyak terlarut atau terikat oleh fungi. Menurut Goenadi dan Saraswati (1994) diameter zona bening di sekitar koloni menjelaskan kemampuan fungi secara kualitatif dalam melarutkan P bervariasi tergantung sifat genetik dari masing-masing fungi dalam memproduksi asam organik yang berperan dalam menentukan kemampuan pelarutan P.
Identifikasi Fungi Pelarut Fosfat
Identifikasi dilakukan pada fungi pelarut fosfat yang mampu membentuk zona bening. Identifikasi fungi dilakukan secara makroskopis yaitu dengan mengamati warna spora, permukaan atas, permukaan bawah dan diameter koloni pada media biakan, serta pengamatan secara mikroskopis dengan melihat hifa, konidia, bentuk spora dan warna spora yang dilakukan dengan bantuan alat mikroskop. Hasil identifikasi fungi pelarut fosfat disajikan pada Tabel 5.
Tabel 5. Jenis Fungi Pelarut Fosfat Jenis
Sumber Tanah Lereng
Atas (0-5cm)
Lereng Atas (5-20cm)
Lereng Tengah (0-5cm)
Lereng Tengah (5-20cm)
Lereng Bawah (0-5cm)
Lereng Bawah (5-20cm)
Total
Aspergillus - - 1 - 1 - 2
Penicillium 1 1 - - - - 2
Rhizopus 1 - 1 2 - - 4
Fusarium - 1 - - - - 1
Mucor - - 1 - - 1 2
Total 2 2 3 2 1 1 11
Terdapat lima jenis fungi pelarut fosfat yang ditemukan yaitu Aspergillus, Penicillium, Rhizopus, Fusarium, dan Mucor yang dilihat dari ciri-ciri umum berdasarkan pengamatan makroskopis dan mikroskopis (Tabel 5). Ciri-ciri umum masing-masing jenis fungi pelarut fosfat hasil identifikasi adalah sebagai berikut:
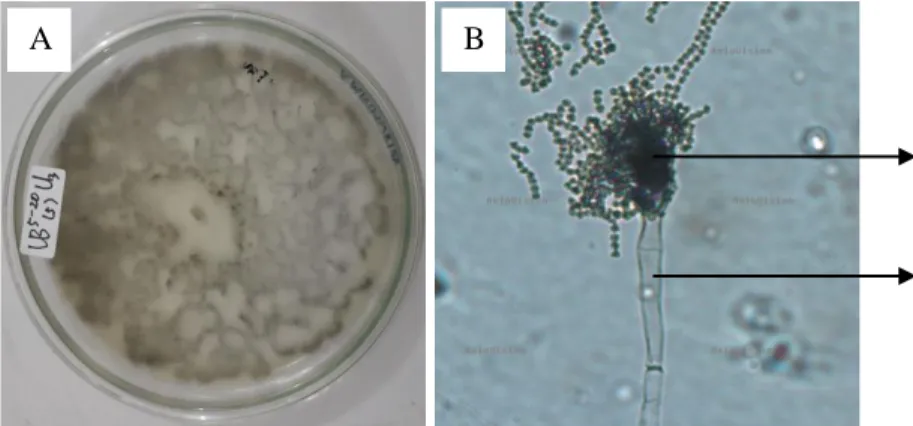
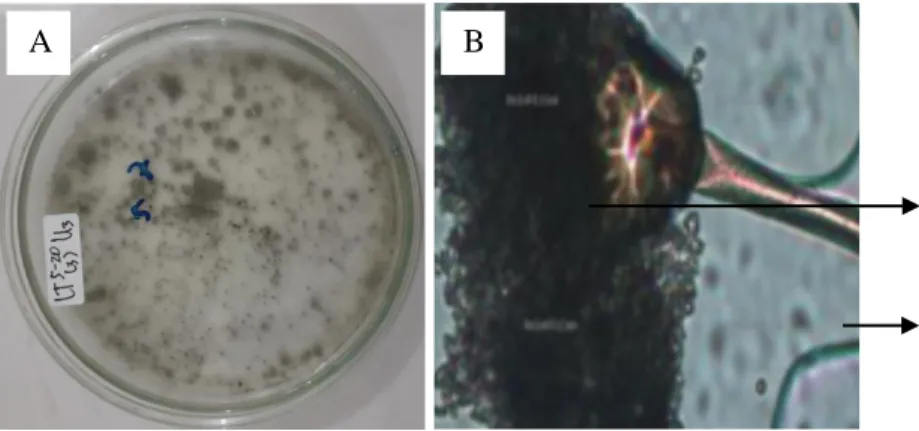
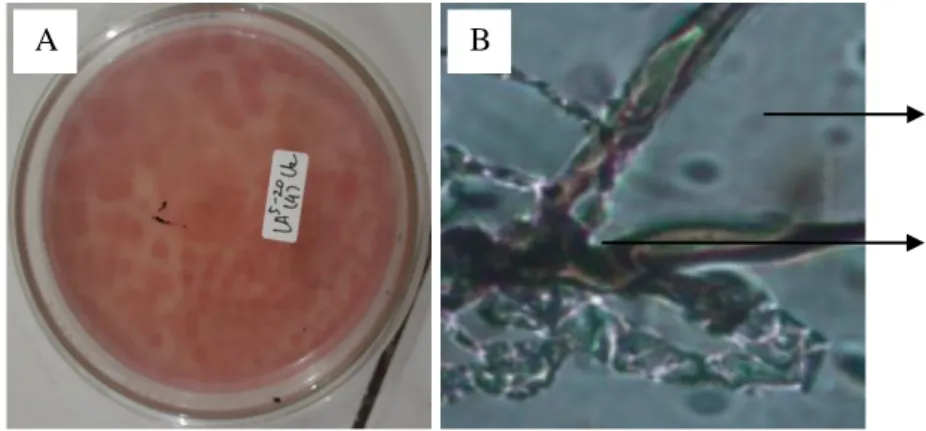
Aspergillus sp.
Berdasarkan hasil identifikasi fungi pelarut fosfat ditemukan jenis Aspergillus sp. sebanyak 2 jenis yang terdapat di lereng tengah dan lereng bawah pada kedalaman 0-5 cm. Secara makroskopis jenis tersebut ditemukan dengan diameter koloni 0,9-2,5 cm dan koloni berwarna hijau hingga hijau tua.
Sedangkan secara mikroskopis Aspergillus sp. memiliki konidia berwarna hitam keabu-abuan yang berbentuk oval dengan konidiofor yang bening. Menurut Gillman (1971) ciri-ciri Aspergillus sp. meliputi koloni terdiri dari lapisan padat yang terbentuk oleh konidiofor berwarna coklat kekuningan yang semakin gelap dengan bertambanya umur koloni. Konidiofor bening, berdinding tebal dan menyolok. Konidia berbentuk kolumnar, kemudian merekah menjadi kolom- kolom yang terpisah. Vesikula berbentuk bulat hingga oval, dan berdiameter 25- 50 μm. Fialid terbentuk langsung pada vesikula atau pada metula (pada kepala konidia yang besar), dan berukuran (10-15) × (4-8) μm. Metula berukuran (7-10)
× (4-6) μm. Konidia berbentuk bulat hingga oval, berdiameter 5-6,5 μm, berwarna hitam. Aspergillus sp. tergolong mikroba mesofilik dengan pertumbuhan pada suhu 35ºC-37ºC (optimum), 6ºC-8ºC (minimum), 45ºC-47ºC (maksimum).
Pengamatan Aspergillus disajikan pada Gambar 5.
Gambar 5. Aspergillus sp.
Keterangan:
Gambar 4. (A) Koloni Aspergillus sp. secara makroskopis dan (B) Pengamatan Aspergillus sp. di bawah mikroskop (a. konidia, b. konidiofor)
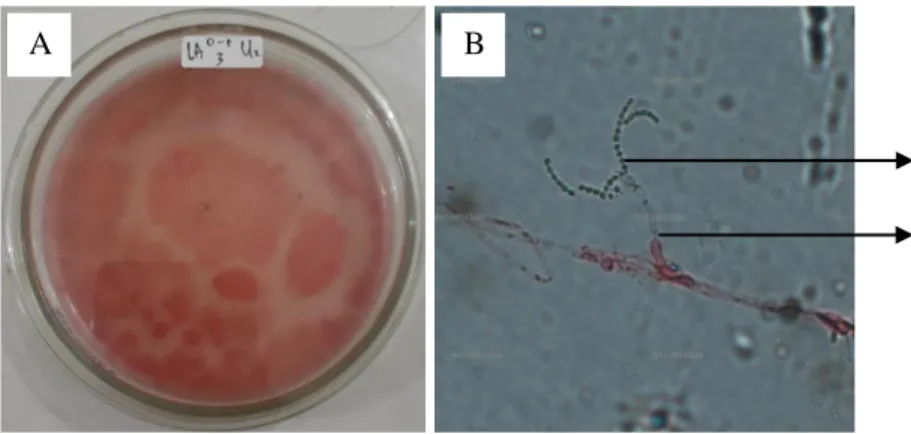
Penicillium sp.
Sebanyak 2 jenis Penicillium sp. ditemukan di lereng atas pada kedalaman 0-5 cm dan 5-20 cm. Secara makroskopis jenis tersebut ditemukan dengan diameter koloni berdiameter 1-1,6 cm dan koloni berwarna hijau tua. Sedangkan secara mikroskopis Penicillium sp. memiliki konidia yang bercabang berwarna hitam keabu-abuan yang berbentuk semi bulat dengan konidiofor yang bening.
Menurut Gillman (1971) Penicillium sp. memiliki ciri-ciri konidiofor berukuran (400-500) × (3,0-4,0) μm, khususnya tepi koloni, berdinding tipis, berwarna bening, vertisil tidak teratur dan terdiri atas 3-4 tingkat serta mempunyai cabang yang berkumpul. Fialid berbentuk agak silindris dengan leher pendek yang tidak mencolok dan berukuran (4,5-6,5) × (2,2-2,5) μm. Konidia berbentuk elips, kadang-kadang berbentuk oval, warna bening hingga hijau dan berdinding halus.
Pengamatan mikroskopis Penicillium disajikan pada Gambar 6.
a
b
A B
Gambar 6. Penicillium sp.
Keterangan:
Gambar 6. (A) Koloni Penicillium sp. secara makroskopis dan (B) Pengamatan Penicillium sp. di bawah mikroskop (a. konidia, b. konidiofor)
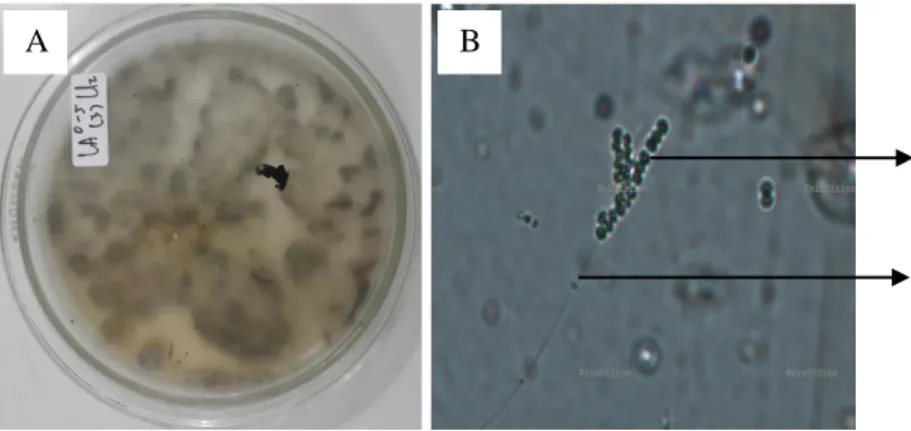
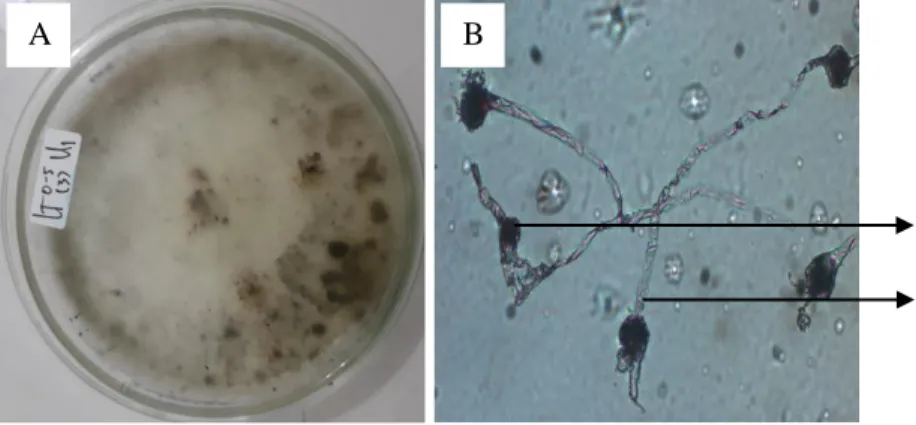
Rhizopus sp.
Sebanyak 4 jenis Rhizopus sp. ditemukan di lereng atas pada kedalaman 0- 5 cm satu jenis, 2 jenis di lereng tengah pada kedalaman 5-20 cm, dan satu jenis di lereng tengah pada kedalaman 0-5 cm. Secara makroskopis jenis tersebut ditemukan dengan diameter koloni berdiameter 0,8-1,5 cm dan koloni berwarna hijau. Sedangkan secara mikroskopis Rhizopus sp. memiliki konidia berwarna hitam keabu-abuan yang berbentuk bulat dengan konidiofor berwarna coklat keabu-abuan. Menurut Gandjar et al. (1999) Rhizopus sp. ditandai dengan warna koloni putih dan menjadi abu-abu kecoklatan, konidiofor dapat tunggal atau berkelompok, berdinding halus atau agak kasar, panjang hingga 1000 μm dan berdiameter 10-18 μm. Konidia berbentuk bulat, oval, atau berbentuk elips, berwarna hitam kecoklatan, dan berdiameter 100-180 μm. Vesikula berbentuk bulat hingga oval dengan bentuk apofise. Rhizopus sp. ini memiliki suhu pertumbuhan optimum 25ºC-35ºC, minimum 5ºC-12ºC, dan maksimum 35ºC–
44ºC. Pengamatan mikroskopis Rhizopus disajikan pada Gambar 7.
a
b
A B
Gambar 7. Rhizopus sp.
Keterangan:
Gambar 7. (A) Koloni Rhizopus sp. secara makroskopis dan (B) Pengamatan Rhizopus sp. di bawah mikroskop (a. konidia, b. konidiofor)
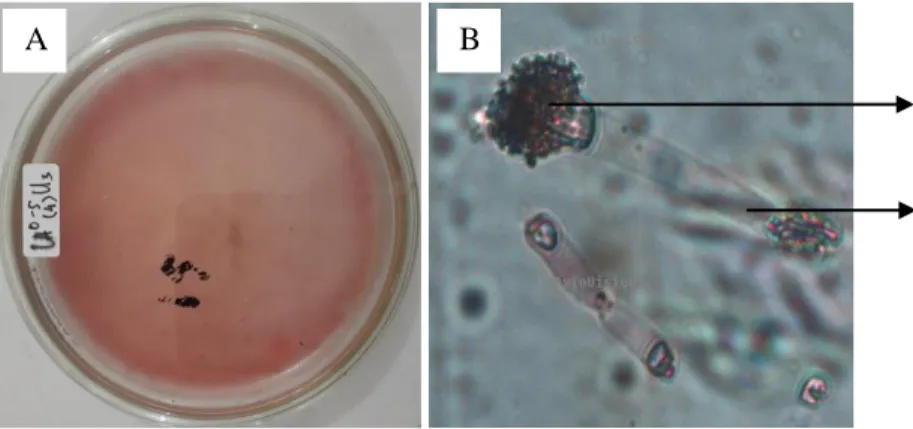
Fusarium sp.
Hanya satu jenis Fusarium sp. yang terdapat di lereng atas pada kedalaman 5-20 cm. Secara makroskopis jenis tersebut ditemukan dengan diameter koloni berdiameter 1,5-2 cm dan koloni berwarna hijau muda.
Sedangkan secara mikroskopis Fusarium sp. memiliki konidia berwarna hitam keabu-abuan yang berbentuk semi bulat dengan konidiofor yang bening. Menurut Gandjar et al. (1999) Fusarium sp. ditandai dengan warna koloni merah-carmine, atau coklat muda agak jingga. Miselia seperti kapas, semula berwarna putih kemudian menjadi kuning, atau merah agak merah muda hingga ungu dan akhirnya menjadi coklat. Konidiofor bercabang atau tidak bercabang, dengan monofialid atau polifialid. Konidia bersel tunggal, tidak bersekat, tidak berwarna, berdinding tipis, berbentuk elips hingga lurus dengan ukuran (9-12) × (2,5-3,5) μm. Pengamatan mikroskopis Fusarium sp. disajikan pada Gambar 8.
Gambar 8. Fusarium sp.
Keterangan:
Gambar 8. (A) Koloni Fusarium sp. secara makroskopis dan (B) Pengamatan Fusarium sp. di bawah mikroskop (a. konidia, b. konidiofor)
a
b
A B
b
a
A B
Mucor sp.
Sebanyak 2 jenis Mucor sp. yang terdapat di lereng tengah pada kedalaman 0-5 cm dan lereng atas pada kedalaman 5-20. Secara makroskopis jenis tersebut ditemukan dengan diameter koloni berdiameter 1,5-2 cm, koloni berwarna hijau muda, konidia berbentuk bulat semu, dan berwarna coklat keabu- abuan. Sedangkan secara mikroskopis Mucor sp. memiliki konidia berwarna hitam keabu-abuan yang berbentuk semi bulat dengan konidiofor yang bening.
Menurut Gandjar et al. (1999) Mucor sp. ditandai dengan koloni berwarna abu- abu atau abu-abu kehijauan, berbentuk semi bulat, dan terlihat kasar. Konidiofor berdinding agak keras, bercabang (secara simpodial atau monopodial), berdiameter hingga 20 μm, serta menyempit. Konidia berwarna kuning agak krem kemudian menjadi coklat atau coklat keabu-abuan. Vesikula berbentuk elips hingga elips silindris, berdiameter 25-50 μm, semula berwarna hialin kemudian menjadi coklat hingga abu-abu, berdinding halus atau kasar dengan sejumlah tonjolan, dan memiliki kerah. Mucor sp. ini kosmopolit dan dapat tumbuh dan bersporulasi pada suhu 5ºC-20ºC tetapi tidak dapat tumbuh pada suhu 37ºC.
Pengamatan mikroskopis Mucor dapat dilihat pada Gambar 9.
Gambar 9. Mucor sp.
Keterangan:
Gambar 9. (A) Koloni Mucor sp. secara makroskopis dan (B) Pengamatan Mucor sp. di bawah mikroskop (a. konidia, b. konidiofor)
a b
A B
Hasil identifikasi yang dilakukan secara makroskopis dan mikroskopis masing-masing isolat dan karakteristiknya disajikan pada Tabel 6.
Tabel 6. Karakteristik Isolat Fungi Pelarut Fosfat Jenis Fungi Pengamatan
Makroskopis
Pengamatan
Mikroskopis Karakteristik
Aspergillus sp. 1
Koloni berdiameter 0,9-1,5 cm, koloni berwarna hijau tua dan, konidia berbentuk oval, dan berwarna hitam keabu-abuan.
Aspergillus sp. 2
Koloni berdiameter 1,5-2,5 cm, koloni berwarna hijau, konidia berbentuk oval, dan berwarna hitam keabu-abuan.
Penicillium sp. 1
Koloni berdiameter 1-1,6 cm, koloni berwarna hijau tua, konidia berbentuk semi bulat, dan berwarna hitam kecoklatan.
Penicillium sp. 2
Koloni berdiameter 1,7-2,2 cm, koloni berwarna hijau, konidia berbentuk semi bulat, dan berwarna coklat keabu-abuan.
Rhizopus sp. 1
Koloni berdiameter 0,3-1 cm, koloni berwarna hijau tua, konidia berbentuk bulat, dan berwarna hitam keabu-abuan.
Rhizopus sp. 2
Koloni berdiameter 0,8-1,5 cm, koloni berwarna hijau, konidia berbentuk bulat, dan berwarna coklat.
Rhizopus sp. 3
Koloni berdiameter 1,5-2 cm, koloni berwarna hijau, konidia berbentuk oval, dan berwarna hitam.