SKRIPSI
SAMIK
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI SURABAYA
BAB II
KAJIAN PUSTAKA
A. Tinja Sapi sebagai Sumber Asam Humat
Tinja sapi merupakan produk biodegradasi vegetasi yang kaya lignin
sehingga tinja sapi dapat digunakan sebagai salah satu sumber asam humat
(Suyono, 2002). Tinja sapi potensial untuk digunakan sebagai salah satu
sumber asam humat karena tersedia melimpah dan mudah didapat. Seekor sapi
dewasa rata-rata setiap tahunnya dapat mengahasilkan 7,5 ton tinja sapi segar
atau 5 ton tinja sapi busuk (Soedijanto & Hadmadi, 1982). Berdasarkan
penelitian yang dilakukan oleh Suyono (2002) diketahui bahwa asam humat
yang diisolasi dari tinja sapi yang berumur 100 hari menghasilkan rendemen
asam humat sebesar 6,18%.
Dasar pembenaran mengenai adanya kandungan asam humat di dalam
tinja sapi adalah teori lignin dalam pembentukan asam humat (Suyono, 2002).
Menurut teori lignin, asam humat merupakan representasi dari lignin
termodifikasi. Lignin termodifikasi terbentuk akibat pemanfaatan lignin oleh
mikroorganisme secara tidak menyeluruh dan melepaskan humus sebagai
residunya (Stevenson, 1994).
Pemecahan lignin di alam terjadi melalui dekomposisi secara aerobik.
Di samping ketersediaan oksigen untuk depolimerisasi lignin diperlukan juga
keberadaan jamur pemecah lignin (seperti Basidiomycetes) dalam jumlah
memadai. Jamur pemecah lignin biasanya tidak ditemukan di dalam sedimen
yang terlalu basah. Fakta ini memperkuat logika untuk berasumsi bahwa
lignin termodifikasi merupakan penyumbang utama pembentukan asam humat
pada tanah, gambut, dan sedimen danau yang kurang mengandung air
(Stevenson, 1994). Perubahan yang terjadi pada lignin melibatkan hilangnya
gugus metoksi (OCH3) dengan dihasilkan o-hidroksifenol dan oksidasi
rantai-rantai alifatik samping membentuk gugus-gugus COOH. Sejumlah besar
bakteri mampu melakukan demetilasi lignin tanpa diikuti degradasi polimer
(Stevenson, 1994).
Dalam teori ini diasumsikan bahwa substansi humat adalah suatu
sistem polimer yang terdiri dari komponen-komponen humin, dan oksidasi
oleh jamur pemecah lignin lebih lanjut yang disertai frakmentasi akan
menghasilkan pertama asam humat dan kemudian asam fulvat. Nitrogen yang
terkandung di dalam asam humat dihasilkan melalui reaksi kondensasi antara
lignin termodifikasi dengan protein, yang merupakan hasil sintesis oleh
mikroba. Penstabilan protein terjadi melalui pembentukan basa Schiff
(Stevenson, 1994). Basa Schiff merupakan suatu senyawa imina (senyawa
yang mengandung gugus C=N) yang terbentuk melalui reaksi antara aldehid
atau keton dengan amina primer (R-NH2
[Lignin termodifikasi]-CHO + R-NH
) (Fessenden dan Fessenden, 1999).
2 [Lignin termodifikasi]-CH=NR +
H2
Fakta pendukung teori lignin pada pembentukan asam humat antara
lain: a) Baik lignin maupun asam humat sangat sulit dipecah oleh sebagian O
besar jamur dan bakteri, b) Baik lignin maupun asam humat larut di dalam
basa, c) Baik lignin maupun asam humat memiliki sifat asam, dan d) Asam
humat memiliki sejumlah sifat yang mirip dengan lignin teroksidasi
(Stevenson, 1994).
B. Karakteristik Asam Humat Tinja Sapi (AHTS)
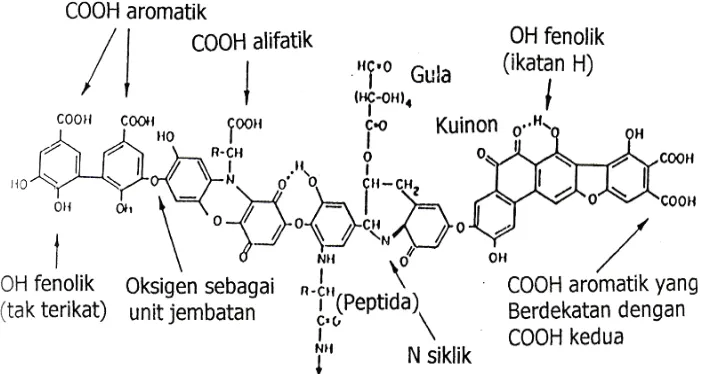
Menurut Suyono (2002) bahwa AHTS memiliki struktur hipotetik
yang mendekati struktur hipotetik asam humat Stevenson, karena karakteristik
fisikokimia AHTS mirip dengan yang diusulkan oleh Stevenson. Adapun
struktur hipotetik asam humat menurut Stevenson dapat dilihat pada
Gambar 2.1.
Gambar 2.1 Struktur Hipotetik Asam Humat Menurut Stevenson (Stevenson, 1994)
Menurut Suyono (2002) AHTS memiliki karakteristik sebagai berikut:
1. Berwujud padat, berwarna coklat kehitaman, keras, tidak meleleh pada
pemanasan hingga 400oC, larut dalam basa, dan tidak larut baik di dalam
2. Terdiri dari rangkaian inti aromatik maupun rantai alifatik.
3. Merupakan suatu makromolekul yang tidak homogen, disusun oleh
komponen-komponen senyawa turunan fenol.
4. Memiliki gugus-gugus fungsional karboksil, OH fenolik, dan metoksi.
5. Bersifat anionik.
C. Logam Berat Timbal
Timbal (Pb) termasuk logam berat karena timbal mempunyai massa
atom relatif lebih dari 23 g/mol yaitu 207,21 g/mol (Perry, 1950). Pb berwarna
abu-abu kebiruan dan termasuk golongan IVA yang dapat larut dalam
beberapa pelarut (seperti air, asam nitrat, garam dan EDTA), memiliki
kerapatan (pada suhu 200C) 11,35 g/cm3, titik leleh 327,40C, titik didih
17700C, jari-jari ion Pb2+ 119 pm, potensial elektroda standar -0,126 Volt dan
mempunyai energi ionisasi 715,4 kj/mol (Darmono, 1995; Greenwood and
Earnshaw, 1989; Kirk and Othmer, 1981).
Pb memiliki nomer atom 82, sehingga terdapat delapan puluh dua
elektron yang mengisi orbital-orbitalnya (Brady, 1999). Konfigurasi atom Pb
dalam keadaan dasar dapat dituliskan sebagai berikut:
82Pb: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p2
Keadaan oksidasi Pb yang paling umum adalah +2 (Greenwood and
Earnshaw, 1989). Kation Mn+
M
dalam air akan mengalami hidrolisis (Manku,
2002). n +
Bila ke dalam larutan Pb2+ ditambah larutan alkali (seperti KOH) maka
akan meningkatkan hasil kali kelarutan antara [Pb2+] dengan [OH-]. Jika hasil
kali kelarutan tersebut lebih besar dari Ksp Pb(OH)2 (Ksp Pb(OH)2 = 3 x 10-6)
maka larutan akan jenuh dan terbentuk endapan putih Pb(OH)2
Pb
(Day dan
Underwood, 2002; Vogel, 1990). 2+
(aq) + 2OH-(aq) Pb(OH)
D. Reaksi Asam Humat dan Kation Logam
2(s)
Pb banyak digunakan dalam industri pembuatan cat, industri
percetakan (tinta), industi baterai (aki) dan juga bisa digunakan untuk melapisi
logam lain supaya tidak mudah berkarat (Darmono, 1995). Selain bermanfaat
logam Pb juga dapat menimbulkan efek negatif berupa pencemaran pada air,
udara ataupun tanah, sehingga dapat merugikan makhluk hidup terutama
manusia.
Kation Pb (II) dapat masuk ke dalam tubuh manusia melalui absorpsi
Pb pada sayuran, asap hasil pembakaran tetraethyl lead (TEL) yang diabsorpsi
kulit atau dihirup, serta air minum yang terkontaminasi Pb. Adanya kation
Pb (II) dalam darah dan otak mengakibatkan berbagai gangguan fungsi
jaringan dan metabolisme, gangguan mulai dari sintesis hemoglobin darah,
gangguan pada ginjal, sistem reproduksi, penyakit kronis pada sistem saraf,
menghambat sistem metabolisme sel serta gangguan fungsi paru-paru
(Darmono, 1995; Martaningtyas, 2004).
Reaksi asam humat adalah salah satu jenis reaksi yang terjadi baik
C
merupakan bahan makromolekul yang memiliki gugus fungsional seperti
-COOH, -OH fenolik maupun –OH alkoholik sehingga asam humat dapat
membentuk kompleks dengan ion logam (Alimin dkk, 2005; Stevenson,
1994). Jumlah kation logam yang diikat asam humat ditentukan oleh nilai
keasaman totalnya (Stevenson, 1994). Pengikatan kation logam oleh asam
humat terjadi melalui penggantian secara reversibel hidrogen gugus fungsional
asam oleh kation logam (Manahan, 1979).
M2+ + 2 AH MA2 + 2H+ (Tan, 1995)
dengan: M2+ = Ion logam AH = Asam humat MA2
Pembentukan kompleks Pb-AHTS melibatkan dua gugus aktif AHTS
yang tidak saling bebas (ikatan kelat). Kelat cincin enam dapat dibentuk oleh
gugus-gugus orto fenolik karboksilat dengan kation logam divalen. Sifat
pembentuk ikatan kelat, menjadikan AHTS dapat mengikat kation logam dari
sistem air walaupun dalam konsentrasi renik (Suyono, 2002).
Gambar 2.2 Salah Satu Pola Pengikatan Kation M = Kompleks logam-asam humat
2+
Asam humat dapat mengikat kation logam baik pada kondisi sedikit
rentang pH 6,0-8,0, tetapi untuk kation-kation logam pembentuk basa lemah
pengikatan efektif terjadi pada pH 5,0 (Stevenson, 1994). Pengaruh perbedaan
pH pada kompleks logam-asam humat adalah terjadinya perbedaan tingkat
ionisasi gugus COOH (Stevenson, 1994). Umumnya gugus –COOH
terdisosiasi pada pH 4-5 dan pada pH yang relatif tinggi (konsentrasi H+
rendah) dapat meningkatkan konsentrasi –COO
-E. Adsorpsi
yang dapat berfungsi sebagai
ligan pada asam humat (Alimin dkk, 2005).
Karena strukturnya yang besar, maka AHTS memiliki sifat sebagai
asam lemah. Reaksi asam lemah dengan kation logam dipengaruhi oleh
konsentrasi kation dan pH sistem (Suyono, 2002). Reaksi AHTS dengan
kation timbal dipengaruhi oleh konsentrasi awal timbal. Karena banyaknya
sisi aktif yang memiliki potensi untuk mengikat kation timbal, maka pengaruh
konsentrasi kation timbal terhadap jumlah timbal diikat oleh AHTS bersifat
multiplikatif. Pada konsentrasi timbal yang berlebih (2000 ppm) pH sistem
berpengaruh terhadap jumlah timbal diikat oleh AHTS, tetapi tidak demikian
untuk konsentrasi timbal yang kecil (1-4 ppm) (Suyono, 2002).
Adsorpsi adalah suatu proses penyerapan suatu zat pada
permukaan zat lain (Day dan Underwood, 2002). Adsorpsi menyebabkan
terjadinya perubahan jumlah molekul (ion atau atom) pada permukaan karena
terjadinya ketidakseimbangan gaya pada batas antar permukaan adsorben dan
adsorbat (Oscik, 1982). Adsorpsi dapat terjadi bila lapisan muka zat padat
teradsorpsi dapat membentuk lapisan yang terdiri dari satu sampai beberapa
lapis molekul pada permukaan zat padat (Hartman, 1987).
Berdasarkan kekuatan interaksi adsorben dan adsorbat, proses adsorpsi
dapat dibedakan dengan dua cara yaitu adsorpsi fisika (fisisorpsi) dan adsorpsi
kimia (kimisorpsi) (Atkins, 1999). Energi yang menyertai adsorpsi fisika
umumnya rendah yaitu berkisar antara -1 sampai dengan -10 kkal/mol atau
antara -4,1868 sampai dengan -41,868 kj/mol, sedangkan energi yang
menyertai adsorpsi kimia berkisar antara -10 sampai dengan -200 kkal/mol
atau antara -41,868 sampai dengan -837,2 kj/mol (Levine, 1988).
Adsorpsi dipengaruhi oleh beberapa faktor antara lain:
1. Sifat Adsorbat
Adsorbat pada penelitian ini berupa kation logam. Beberapa sifat
kation logam yang dapat mempengaruhi adsorpsi antara lain konsentrasi
kation logam dan jenis kation logam. Penambahan konsentrasi kation
logam dapat mempercepat terjadinya kondisi kesetimbangan. Kondisi
tersebut dihasilkan karena semakin besarnya gaya gerak adsorbat menuju
permukaan adsorben sehingga mengakibatkan semakin kuat zat tersebut
teradsorpsi (Tsezos dan Deutman dalam Listyawan, 2005). Kation logam
diklasifikasikan dalam dua jenis yaitu keras dan lunak, demikian juga
dengan basanya. Asam-basa keras umumnya berukuran kecil dengan
muatan relatif besar dan daya tarik dengan elektron terluar sangat kuat
sehingga tidak mudah terpolarisasi. Asam-basa lunak berukuran besar
mudah terpolarisasi. Secara umum asam keras membentuk kompleks stabil
dengan basa keras, sedangkan asam lunak membentuk kompleks stabil
dengan basa lunak. Kation Pb2+
2. Sifat Adsorben
termasuk golongan kation logam
pembentuk asam madya (Basolo and Pearson, 1967; Huheey, 1983).
Luas permukaan adsorben sangat berpengaruh terutama untuk
tersedianya tempat adsorpsi. Adsorpsi merupakan gejala yang terjadi pada
permukaan sehingga besarnya adsorpsi sebanding dengan luas permukaan
spesifik. Makin besar luas permukaan makin besar pula adsorpsi yang
terjadi (Sembiring dan Sinaga, 2003). Adsorben polar cenderung
menyerap lebih kuat adsorbat polar dan adsorbat non polar terserap lebih
lemah, sedangkan adsorben non polar cenderung menyerap lebih kuat
adsorbat non polar dan adsorbat polar terserap lebih lemah
(Cahyaningrum, 2001).
3. Waktu Singgung
Waktu singgung adalah waktu yang diperlukan untuk mencapai
kesetimbangan adsorpsi. Pada saat kesetimbangan akan terjadi adsorpsi
yang maksimum. Pengadukan juga mempengaruhi waktu singgung.
Pengadukan dilakukan untuk memberi kesempatan yang lebih banyak
pada adsorben untuk bersinggungan dengan adsorbat (Sembiring dan
Sinaga, 2003).
Proses adsorpsi dipengaruhi pH larutan. Umumnya adsorpsi
bertambah dengan menurunnya pH. Untuk asam-asam organik daya
adsorpsi akan meningkat bila pH diturunkan, yaitu dengan penambahan
asam-asam mineral. Ini disebabkan karena kemampuan asam mineral
untuk mengurangi ionisasi asam organik tersebut (Sembiring dan Sinaga,
2003). Ionisasi asam humat dikendalikan oleh pH sehingga mempengaruhi
kemampuannya untuk mengikat kation logam (Stevenson, 1994). Adsorpsi
kation Pb (II) oleh AHTS terjadi maksimum pada pH 5 dengan kapasitas
ikat 157,492 mg/g AHTS (Suyono, 2002).
F. Proses Adsorpsi Logam pada Materi Organik
Proses adsorpsi logam-logam melibatkan gaya-gaya dari paling lemah
sampai paling kuat yaitu gaya Van der Waals, ikatan hidrogen, ikatan ion dan
ikatan kovalen koordinasi (Stevenson, 1994). Adsorpsi fisika melibatkan
gaya-gaya antar molekul seperti gaya Van der Walls dan ikatan hidrogen
(Oscik, 1982), sedangkan adsorpsi kimia melibatkan ikatan ionik dan ikatan
kovalen (Oscik, 1982; Stevenson, 1994). Dua atau lebih jenis ikatan dapat
terjadi secara bersamaan antara materi organik dan logam (Stevenson, 1994).
1. Gaya Van der Waals
Gaya Van der Waals terjadi karena perubahan densitas muatan listrik
dari masing-masing atom pada suatu molekul dan interaksi elektrostatik
antara dipol-dipol. Perubahan densitas muatan positif dari salah satu atom
cenderung mempengaruhi terbentuknya muatan negatif pada atom dari
C Gambar 2.3 Interaksi Elektrostatik antara Dipol-Dipol
(Stevenson, 1994)
Gaya Van der Waals terjadi antar molekul dan bersifat lemah. Energi
yang dihasilkan dari gaya Van der Waals umumnya lebih kecil dari
5 kkal/mol atau lebih kecil dari 20,934 kj/mol (Fessenden dan Fessenden,
1982).
2. Ikatan Hidrogen
Ikatan hidrogen terjadi karena atom hidrogen yang bermuatan parsial
potitif dari suatu molekul ditarik oleh pasangan elektron dari atom molekul
lain yang sangat elektronegatif, seperti oksigen, nitrogen dan flour
(Fessenden dan Fessenden, 1982). Ion H+ merupakan inti kosong dengan
muatan +1 dan mempunyai kecenderungan kuat menggunakan elektron
bersama-sama dengan atom yang mempunyai pasangan elektron bebas,
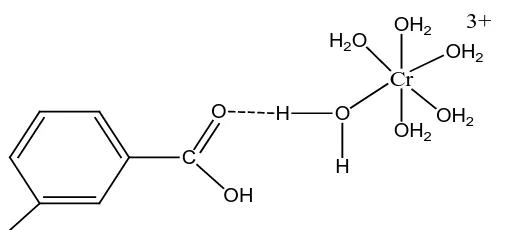
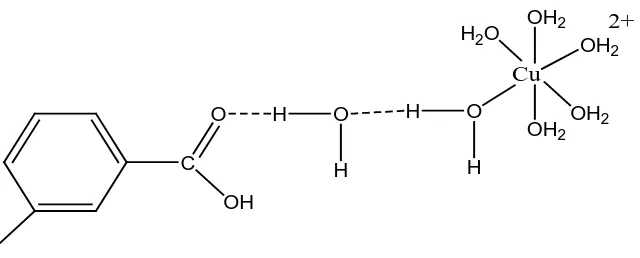
seperti oksigen (Stevenson, 1994). Pada pembentukan ikatan hidrogen,
interaksi dapat terjadi antara ion logam dengan situs aktif asam humat
melalui keterlibatan molekul air atau melalui jembatan air (Sehol, 2004;
C
Gambar 2.4 Ikatan Hidrogen antara Cr (III) dengan Asam Humat (Sehol, 2004)
Gambar 2.5 Ikatan Hidrogen antara Cu (II) dengan Asam Humat Melaui Jembatan Air (Stevenson, 1994)
Ikatan hidrogen lebih lemah dari ikatan ionik dan ikatan kovalen
tetapi lebih kuat dari gaya Van der Waals (Stevenson, 1994). Energi ikatan
hidrogen yaitu antara 20-40 kj/mol (Monk, 2004).
Tabel 2.1
Energi Ikatan Hidrogen
Ikatan Hidrogen Energi Ikatan (kj/mol) H – N
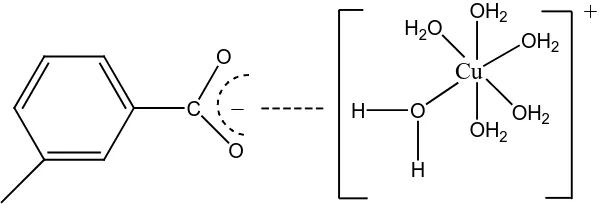
Ikatan ionik terjadi antara atom-atom yang selisih
elektronegativitasnya besar, sehingga terjadi perpindahan elektron dari
atom donor elektron ke atom akseptor elektron (Oktoby et al, 2001). Ikatan
ionik juga dapat terjadi ketika muatan positif dari kation organik ditukar
dengan dengan muatan positif dari kation anorganik (Stevenson, 1994).
C
(Fessenden dan Fessenden, 1982). Pada pembentukan ikatan ionik,
interaksi dapat terjadi antara ion logam dengan gugus COO–
Gambar 2.6 Ikatan Ionik antara Cu (II) dengan Asam Humat (Stevenson, 1994)
asam humat
melalui keterlibatan molekul air (Stevenson, 1994).
4. Ikatan Kovalen Koordinasi
Ikatan kovalen terbentuk antara atom-atom yang selisih
elektronegativitasnya kecil, sehingga elektron digunakan bersama di antara
atom-atom tersebut. Energi ikatan dari ikatan kovalen yaitu 80-
100 kkal/mol atau 334,944-418,680 kj/mol (Fessenden dan Fessenden,
1982). Ikatan kovalen koordinasi terjadi melalui penggunaan bersama
pasangan elektron yang berasal dari salah satu atom (Golberg, 2004;
Oktoby et al, 2001). Ligan menyumbangkan pasangan elektron pada ion
logam membentuk senyawa kompleks. Ion logam bertindak sebagai ion
pusat yang menyediakan orbital kosong yang dapat ditempati pasangan
elektron dari ligan. Sebagian ligan-ligan organik dapat mengikat logam
dengan lebih dari satu gugus fungsional membentuk suatu cincin
heterosiklik yang disebut cincin kelat. Proses pembentukan cincin kelat
Gambar 2.7 Ikatan Kovalen Koordinasi antara Bahan Organik dengan Logam (Stevenson, 1994)
G. Desorpsi
Desorpsi adalah terlepasnya adsorbat dari permukaan adsorben (Atkins,
1999). Desorpsi Pb-AHTS dilakukan untuk memutuskan ikatan antara AHTS
dengan kation Pb (II) yang terjadi pada waktu proses adsorpsi sehingga
didapatkan AHTS yang tidak mengikat kation Pb (II) dan eluen pendesorpsi
yang mengandung kation Pb (II). Eluen pendesorpsi yang dipilih harus
mempunyai beberapa kriteria di antaranya adalah mampu melepaskan 95%
logam yang teradsorpsi, tidak merusak adsorben, mempunyai serapan yang
tinggi pada proses adsorpsi selanjutnya, murah dan tidak mencemari
lingkungan (Schiewer and Volesky, 2000; Vijayaraghavan et al, 2004).
Berdasarkan penelitian terdahulu tentang eluen pendesorpsi diketahui
bahwa desorpsi dapat dilakukan oleh air (H2O), garam seperti CaCl2, senyawa
asam (seperti H2SO4 dan HNO3 C
N N
C C
N
R2HN NHR2
M
), dan senyawa pengkhelat seperti EDTA
Eluen pendesorpsi dapat digunakan untuk memprediksikan jenis ikatan yang
terjadi antara adsorbat dengan adsorben yaitu dengan cara melakukan desorpsi
sekuensial terhadap adsorben yang telah diinteraksikan dengan adsorbat
(Cahyaningrum, 2001).
Beberapa eluen pendesorpsi yang digunakan untuk melepaskan adsorbat
dari permukaan adsorben yaitu:
1. Air (H2
Adsorben yang mengikat logam dengan gaya Van der Waals dapat
didesorpsi dengan air karena gaya Van der Waals merupakan ikatan fisik
yang lemah sehingga dengan menambahkan air pada adsorben yang
mengikat logam maka logam akan larut di dalam air (Darmono, 1995;
Monk, 2004; Stevenson, 1994). Tiap molekul H O)
2O dalam bentuk cairan biasanya berinteraksi dengan molekul H2
2. Garam
O yang lain. Interaksi tersebut
tidak terlalu kuat yaitu sekitar 20 kj/mol (Monk, 2004).
Larutan CaCl2 0,1 M mampu melepaskan logam Cu dari biomassa
Ulva reticulata sebesar 90,25% (Vijayaraghavan et al, 2004). Adsorben
yang mengikat Cu dengan ikatan ionik dapat didesorpsi dengan larutan
CaCl2 karena terjadi pertukaran ion yaitu ion Ca2+ menggantikan posisi
ion Cu2+
3. Senyawa Asam
yang terikat sebelumnya pada situs aktif adsorben.
Larutan HNO3 0,1 M mampu melepaskan Cu yang terikat pada
Pembentukan ikatan hidrogen terjadi antara H+ dari pelarut HNO3
4. Senyawa Pengkhelat
dengan
atom yang memiliki elektronegativitas yang tinggi pada adsorben
mengakibatkan Cu yang sebelumnya terikat melalui ikatan hidrogen pada
adsorben akan lepas.
Larutan EDTA dapat melepaskan Cd dari kaolin sebesar 85% di
bawah kondisi asam lemah (Hong and Pintauro, 1994). Hal ini terjadi
karena ion EDTA
2-H. Isoterm Adsorpsi
berfungsi sebagai agen pengkhelat yang sangat kuat
sehingga ion logam yang terikat pada adsorben akan terdesorpsi melalui
pembentukan kompleks logam-EDTA yang relatif stabil.
Pada suatu keadaan kesetimbangan laju adsorpsi-desorpsi adsorbat pada
permukaan adsorben adalah sama. Keadaan kesetimbangan ini dinyatakan
dengan isoterm adsorpsi (Levine, 1988). Ada dua jenis isoterm adsorpsi yang
umumnya terjadi pada senyawa organik yaitu isoterm Langmuir dan isoterm
Freundlich (Stevenson, 1994).
1. Isoterm Langmuir
Langmuir menjelaskan bahwa pada permukaan adsorben terdapat
sejumlah tertentu situs aktif yang sebanding dengan luas permukaan. Pada
saat adsorbat memenuhi lapisan, molekul yang terserap tidak akan
melebihi jumlah situs aktif pada permukaan adsorben (Oscik, 1982).
Penerapan isoterm Langmuir didasarkan pada asumsi bahwa adsorpsi
lapisan tunggal atau monolayer (Levine, 1988; Stevenson, 1994).
Persamaan isoterm Langmuir dapat ditulis dalam bentuk persamaan linier
yaitu:
x/m adalah jumlah logam yang teradsorpsi per gram adsorben pada
konsentrasi C; C adalah konsentrasi ion logam bebas saat setimbang;
K adalah konstanta kesetimbangan; b adalah jumlah logam yang
teradsorpsi saat keadaan jenuh (kapasitas adsorpsi). b ditentukan dari
slope dan K ditentukan dari intersep (Cahyaningrum, 2001; Stevenson,
1994). Setelah nilai K ditentukan, maka dapat dicari energi adsorpsi (∆G0)
dengan menggunakan rumus 2.2.
∆G0
2. Isoterm Freundlich
= - RT ln K ... (2.2) (Dogra dan Dogra, 1990)
Isoterm Freundlich merupakan model adsorpsi yang diusulkan secara empiris untuk permukaan yang heterogen dan adsorpsi terjadi membentuk beberapa lapis (Multilayer). Isoterm Freundlich tidak berlaku jika tekanan atau konsentrasi adsorbat terlalu tinggi (Amaria, 1998; Levine, 1988). Persamaan isoterm Freundlich dapat ditulis dalam bentuk persamaan linier yaitu:
x/m adalah jumlah logam yang teradsorpsi per gram adsorben pada
konsentrasi C; C adalah konsentrasi ion logam bebas saat setimbang;
K dan n adalah konstanta (Stevenson, 1994).
I. Kimia Komputasi
Kimia komputasi telah menjadi cabang baru ilmu kimia. Dalam
kimia komputasi, hasil percobaan di laboratorium dan hasil perhitungan
teoritis dengan bantuan komputer seringkali dibandingkan dan dipadukan
(Pranowo, 2001). Selain dengan cara eksperimen, energi adsorpsi juga dapat
dihitung menggunakan metode kimia komputasi. Teori yang digunakan dalam
kimia komputasi yaitu:
1. Teori Fungsional Kerapatan (Density Fungtional Theory, DFT)
DFT adalah suatu teori yang menggambarkan suatu molekul sebagai
satu fungsi kerapatan. DFT memberikan kemudahan untuk menghitung
energi total sistem secara akurat (Cramer, 2004). Energi total sistem dalam
material elektronik dapat dikelompokkan menjadi dua jenis yaitu energi
potensial dan energi kinetik sistem. Energi potensial sistem berasal dari
interaksi inti-inti, inti-elektron dan elektron-elektron. Energi ini dapat
dihitung menggunakan teori elektrostatik klasik. Sedangkan energi kinetik
sistem berasal dari gerakan elektron-elektron. Energi ini dihitung dengan
menggunakan teori kuantum (Setiyanto, 2005). Rumus untuk menghitung
energi total sistem adalah sebagai berikut:
Energi kinetik Energi potensial Fungsi gelombang Energi total sistem (Hause, 2004)
Energi total sistem adalah fungsional dari rapat muatan elektron.
Kuadrat dari fungsi gelombang (ψ2
2. Fungsi Basis
) menggambarkan kebolehjadian untuk
menemukan elektron yang mencerminkan kerapatan elektron (Hause,
2004; Pranowo, 2001). Energi dan fungsi gelombang sistem dalam
keadaan stasioner diselesaikan dengan persamaan Schrodinger:
Ĥ ψ e,n = E ψ e,n ... (2.5) (Pranowo, 2001)
Ĥ pada persamaan (2.6) adalah operator Hamiltonian yang disusun
oleh tiga bagian yaitu energi kinetik inti, energi kinetik elektron dan energi
potensial inti dan elektron. ψ adalah fungsi gelombang yang bergantung
pada posisi elektron dan inti atom (Pranowo, 2001).
Pendekatan Born-Oppenheimer diterapkan dalam DFT dengan cara
menganggap inti bergerak lambat atau diam bila dibandingkan dengan
pergerakan elektron-elektron (Setiyanto, 2005). Pendekatan ini dilakukan
dengan memisahkan fungsi gelombang untuk inti dan elektron. Fungsi
gelombang total merupakan hasil perkalian dua faktor. Rumus fungsi
gelombang Born-Oppenheimer adalah:
ψ e,n = χn ψ e ... (2.6) (Pranowo, 2001)
Pada umumnya, perhitungan pendekatan sistem elektronik (teori
struktur elektron) menggunakan fungsi gelombang satu elektron yang
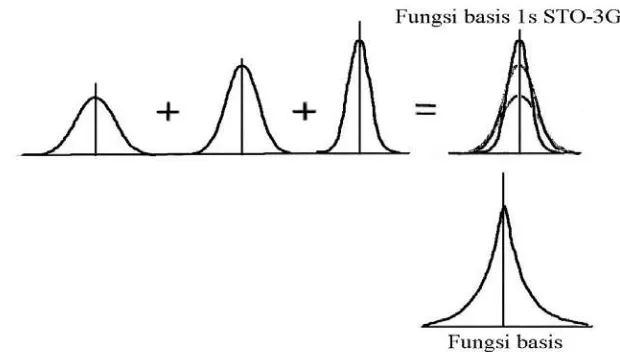
Kombinasi linear dari fungsi basis tersebut membentuk suatu orbital
molekul, φi
Gambar 2.8 Perbandingan antara Orbital 1s Tipe Slater dan Tipe Gaussian
Ketergantungan r
(Cramer, 2004; Hause, 2004). Terdapat dua tipe fungsi basis
yang umum digunakan dalam perhitungan struktur elektronik yaitu orbital
tipe Slater (Slater Type Orbital, STO) dan orbital tipe Gaussian (Gaussian
Type Orbital, GTO) (Pranowo, 2001).
2
dalam eksponensial membuat GTO memiliki
kekurangan dalam dua aspek dibandingkan STO. Pertama, pada
penggambaran inti atom, GTO mempunyai turunan nol, berbeda dengan
STO yang memiliki turunan tidak kontinyu. Hal ini menjadikan GTO
“bermasalah” dalam merepresentasikan perilaku elektron yang dekat
dengan inti. Kedua, kurva GTO turun terlalu cepat untuk jarak yang
berjauhan dari inti sehingga “ekor” dari fungsi gelombang
direpresentasikan kurang baik. Meskipun demikian, kekurangan ini dapat
diatasi dengan menggunakan GTO dalam jumlah lebih dari satu (Pranowo,
2001). Misalnya kombinasi dari beberapa GTO dapat menggantikan STO
Gambar 2.9 Kombinasi Linear dari Tiga Fungsi Basis Gaussian Membentuk satu fungsi basis Slater
3. Himpunan Basis (Basis set)
Himpunan basis adalah deskripsi matematik dari sekumpulan orbital
sistem yang telah diketahui, yang dikombinasikan untuk mendekati fungsi
gelombang total dari sistem yang dikaji (Cramer, 2004). Menurut
Foresmen and Frisch (1996) untuk mendapatkan orbital-orbital yang lebih
akurat, digunakan pendekatan himpunan basis yang diperbesar dengan tiga
cara:
a. Basis Set Valensi Terpisah
Yaitu dengan menambah jumlah fungsi basis per atom.
Himpunan basis valensi valensi terpisah, misalnya 3-21G dan 6-31G,
memiliki dua (atau lebih) ukuran fungsi basis untuk tiap orbital
valensi. Sebagai contoh untuk atom hidrogen dan karbon:
H : 1s, 1s’
Setiap orbital yang diberi tanda kutip berbeda ukurannya dengan
orbital tanpa tanda kutip.
Gambar 2.10 Memperbesar Himpunan Basis dengan Basis Set Valensi Terpisah
Notasi 3-21G menandakan di dalam set basis ini terdapat tiga
fungsi Gaussian yang mewakili orbital inti, dua fungsi Gaussian untuk
orbital elektron valensi bagian yang terkontraksi, dan satu untuk
bagian yang berdifusi.
b. Basis Set Terpolarisasi
Himpunan basis valensi terpisah memperbolehkan ukuran orbital
diubah tetapi bentuknya tetap. Himpunan basis terpolarisasi mengatasi
kesulitan ini dengan menambahkan orbital-orbital yang momentum
sudutnya lebih tinggi dari pada yang dibutuhkan. Sebagai contoh
himpunan basis terpolarisasi menambahkan fungsi p pada atom
hidrogen, dan fungsi d pada atom non-hidrogen.
Penggunaan dari basis fungsi terpolarisasi ditandai oleh asterisk
(*). Jadi, 6-31G* mengacu pada himpunan basis 6-31G dengan fungsi
polarisasi pada atom non-hidrogen. Sedangkan 6-31G** menandakan
penggunaan fungsi polarisasi pada hidrogen dan helium. Himpunan
basis 6-31G** berguna bila atom hidrogen bertindak sebagai atom
jembatan.
c. Basis Set Difusi
Kekurangan himpunan basis terpolarisasi adalah ketidak
mampuannya untuk menggambarkan molekul yang memiliki kerapatan
elektron yang jauh dari inti seperti anion atau molekul yang memiliki
pasangan elektron sunyi. Hal ini disebabkan karena amplitudo fungsi
basis Gaussian agak rendah pada daerah jauh dari inti. Untuk
mengatasi masalah ini digunakan fungsi difusi. Himpunan basis fungsi
difusi ditandai oleh suatu “+”. Set basis 31+G(d) adalah basis set
6-31G(d) dengan menambahkan fungsi difusi pada atom non-hidrogen.
Sedangkan 6-31++G(d), menambahkan fungsi difusi juga pada atom
hidrogen.
text text
+
=
textte xtC1 C2
te xt
4. GAMESS (General Atomic and Molecular Electronic Structur System)
GAMESS adalah seperangkat software kimia kuantum Ab initio
yang diciptakan oleh kelompok peneliti yang dipimpin oleh Mark S.
Gordon dari Universitas Negeri Lowa. Software ini dapat digunakan untuk
menghitung energi menggunakan perhitungan fungsional kerapatan (DFT),
semi-empiris (AM1/PM3) dan perhitungan QM/MM (Anonim, 2004;
Gordon, 2004).
GAMESS dipilih dalam penelitian ini karena programnya selain
sangat populer dan gratis (open source) juga mudah dipahami dan
dijalankan. Program GAMESS dapat diintegrasikan dengan software
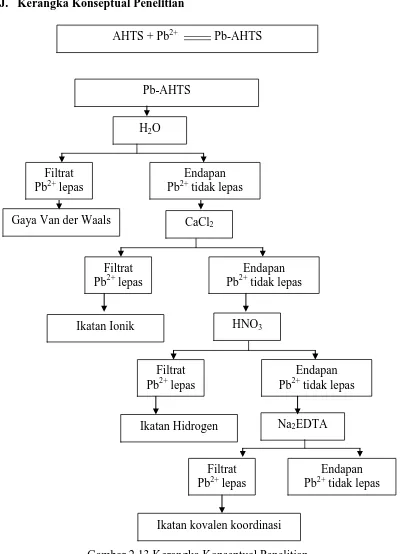
J. Kerangka Konseptual Penelitian
Gambar 2.13 Kerangka Konseptual Penelitian
Eluen pendesorpsi seperi H2O, CaCl2, HNO3 dan Na2EDTA dapat
digunakan untuk memprediksikan jenis ikatan yang terjadi antara kation Pb-AHTS
H2O
Pb (II) dengan AHTS yaitu dengan cara melakukan desorpsi sekuensial
terhadap Pb-AHTS. Jumlah ion Pb (II) yang terdesorpsi sebuah eluen
mempresentasikan kekuatan ikatan. Prinsip dari model desorpsi ini adalah
penggunaan eluen pendesorpsi yang kekuatannya meningkat secara berurutan,
yaitu: (1) Desorpsi menggunakan air (H2O) untuk menunjukkan adanya ikatan
Van der Waals, (2) Desorpsi mengunakan CaCl2 untuk menunjukkan adanya
ikatan ionik, (3) Desorpsi menggunakan HNO3 untuk menunjukkan adanya
ikatan hidrogen, dan (4) Desorpsi menggunakan Na2EDTA untuk
menunjukkan adanya ikatan kovalen (Cahyaningrum, 2001; Hong and