Lampiran 1. Gambar Sampel dan Lokasi Pengambilan Sampel
Gambar 1. Sampel Brokoli
Gambar 2. Perbedaan Sampel Brokoli (A. Brokoli yang disimpan
Lampiran 1. (Lanjutan)
Gambar 3. Kebun Brokoli Jalan udara ujung, Desa Tengkulen,
Lampiran 2. Gambar Alat Spektrofotometri Sinar Tampak
Lampiran 3. Uji Kualitatif Nitrit
1. Larutan Sampel + Asam Sulfanilat + Alfa-Naftil Etilendiamin (NED) -> Merah Ungu Muda
(+)-Gambar 5. Tanda panah menunjukan hasil uji kualitatif sampel
dengan pereaksi Asam sulfanilat dan Alfa-Naftil Etilendiamin (NED)
2. Larutan sampel + KMnO4 + H2SO4 (e) -> warna ungu hilang
Lampiran 4. Uji Kualitatif Nitrat
1. Larutan sampel + Zn + NaOH kemudian dipanaskan -> uap NH3 yang dapat membirukan lakmus merah (+)
1
Gambar 7. Hasil uji kualitatif dengan pereaksi Serbuk Zn dan NaOH
2. Larutan sampel + KI yang diasamkan dengan asam sulfat encer -> kuning sampai coklat (+).
Lampiran 5. Bagan Alir Pembuatan Larutan Induk Baku Nitrit, Penentuan
Panjang Gelombang Maksimum, Waktu Kerja, dan Kurva Kalibrasi Nitrit Baku
Natrium Nitrit
ditimbang 100 mg
dimasukkan ke dalam labu tentukur 100 ml
dilarutkan dan dicukupkan dengan air suling sampai garis tanda LIB I Nitrit (C = 10 μg/ml)
dipipet 1 ml
dimasukkan ke dalam labu tentukur 100 ml
dilarutkan dan dicukupkan dengan air suling sampai garis tanda LIB II Nitrit (C = 10 μg/ml)
dipipet masing-masing sebanyak 1,2,3,4 dan 5 ml
Lampiran 6. Bagan Alir Penentuan Kadar Nitrit dan Nitrat dalam Brokoli
Sampel
ditimbang 10 g yang telah dihaluskan dimasukkan ke dalam beaker glass 250 ml ditambahkan air suling panas (±80ºC) sampai volume 50 ml
diaduk hingga homogen
dipanaskan di atas penangas air hingga 15 menit sambil diaduk
didinginkan pada suhu kamar
dipindahkan secara kuantitatif ke dalam labu tentukur 50 ml
ditambahkan air suling sampai garis tanda dihomogenkan
disaring
dibuang 10 ml filtrat pertama
dipipet 10 ml
dimasukkan ke dalam labu tentukur 50 ml
ditambahkan 2,5 m asam sulfanilat, dikocok, dan setelah lima menit ditambahkan 2,5 ml N-(1-naftil) etilendiamin dihidroklorida
dicukupkan dengan air suling sanpai garis tanda diukur serapan pada λ 540 nm pada menit ke-12 Nilai Absorbansi
dihitung Kadar Nitrit
Lampiran 6. (Lanjutan)
Sampel
ditimbang 10 g yang telah dihaluskan dimasukkan ke dalam beaker glass 250 ml ditambahkan air suling panas (±80ºC) sampai volume 150 ml
diaduk hingga homogen
dipanaskan di atas penangas air hingga 15 menit sambil diaduk
didinginkan pada suhu kamar
dipindahkan secara kuantitatif ke dalam labu tentukur 250 ml
ditambahkan air suling sampai garis tanda dihomogenkan
disaring
dibuang 10 ml filtrat pertama
dipipet 10 ml dan dimasukkan ke dalam labu tentukur 50 ml
ditambahkan sedikit logam Zn (1 g) dan didiamkan 10 menit
ditambahkan 2,5 ml asam sulfanilat, dikocok dan setelah lima menit ditambahkan 2,5 ml N-(1-naftil) etilendiamin dihidroklorida
dicukupkan dengan air suling
diukur serapan pada λ 540 nm pada menit ke-12 Nilai Absorbansi
Lampiran 7. Kurva Serapan Nitrit Baku
Gambar 9. Kurva serapan maksimum pada konsentrasi 0,8 µ g/mL dan
Lampiran 8. Penentuan Waktu Kerja
Time absorbansi K*absorbansi
38 0,475 0,4748
39 0,475 0,4748
40 0,475 0,4747
41 0,475 0,4746
42 0,475 0,4745
43 0,475 0,4745
44 0,474 0,4744
45 0,474 0,4743
46 0,474 0,4743
47 0,474 0,4743
48 0,474 0,4742
49 0,474 0,4741
50 0,474 0,4739
51 0,474 0,4739
52 0,474 0,4738
53 0,474 0,4738
54 0,474 0,4737
55 0,474 0,4737
56 0,474 0,4737
57 0,474 0,4736
58 0,474 0,4737
59 0,474 0,4737
Lampiran 9. Data Kalibrasi Nitrit Baku dan Nitrat Baku, Persamaan Regresi,
dan Koefisien Korelasi
Kalibrasi Serapan Nitrit pada Panjang Gelombang 540 nm No. Konsentrasi (μg/mL) (X) Absorbansi (Y)
Lampiran 9. (Lanjutan)
0,0096
Maka, persamaan garis regresi adalah Y = X + 0,0096 Perhitungan Koefisien Korelasi (r)
r
r
r =
r = 0,999539
Lampiran 10. Perhitungan Batas Deteksi (Limit of Detection, LOD) dan Batas
Kuantitasi (Limit of Quantitation, LOQ) Nitrit dan Nitrat
1. Persamaan garis regresi adalah Y = X + 0,0096
No. X Y Yi Y-Yi (Y-Yi)2
1. 0,0000 0,0000 0,0096 -0,00960 0,00009216000 2. 0,2000 0,1330 0,1288 0,00413 0,00001705690 3. 0,4000 0,2558 0,2481 0,00769 0,00005913610 4. 0,6000 0,3720 0,3673 0,00467 0,00002180890 5. 0,8000 0,4860 0,4866 -0,00052 0,00000027040 6. 1,0000 0,5996 0,6058 -0,00624 0,00003893760
Σ(Y-Yi)2 0,00022936990
Simpangan Baku = 0,0075724 μg/g = 0,0075724
mg/kg
Batas Deteksi = 0,038104 μg/g = 0,038104 mg/kg
Lampiran 11. Contoh Perhitungan Kadar Nitrit dalam Brokoli yang disimpan
dalam suhu kamar pada waktu 0 jam.
Berat sampel yang digunakan = 10,0925 g Absorbansi analisis nitrit (540 nm) = 0,10213
Persamaan regresi pada absorbansi maksimum dengan panjang gelombang nitrit pada λ 540 nm: Y = 0,5962 X + 0,0096
Konsentrasi Nitrit : Y = 0,5962 X + 0,0096 0,10213 = 0,5962 X + 0,0096
X = 0,15520 Kadar Nitrit dalam sampel =
X : kadar nitrit sesudah pengenceran (μg /ml) V : volume larutan pengenceran (ml)
Fp : faktor pengenceran Kadar Nitrit dalam sampel =
= 1,5378 μg/g = 1,5378 mg/kg
Lampiran 12. Contoh Perhitungan Kadar Nitrat dalam Brokoli yang
disimpan dalam suhu kamar pada waktu 0 jam. Berat sampel yang digunakan = 10,4345 g
Absorbansi analisis nitrit (540 nm) = 0,25475
Persamaan regresi pada absorbansi maksimum dengan panjang gelombang nitrit pada λ 540 nm: Y = 0,513929 X + 0,002214
Konsentrasi Nitrit: Y = 0,5962 X + 0,0096 0,25474 = 0,5962 X + 0,0096
X = 0,41119
Kadar Nitrit dalam sampel =
X : kadar nitrit sesudah pengenceran (μg /ml) V : volume larutan pengenceran (ml)
Fp : faktor pengenceran
Kadar Nitrit dalam sampel =
= 49,2582 μg/g = 49,2582 mg/kg
Kadar nitrit dari reduksi nitrat = Kadar total nitrit sesudah reduksi – Kadar nitrit sebelum reduksi
Lampiran 12. (Lanjutan)
Karena hasil pembacaan alat spektrofotometer untuk nitrat adalah sebagai nitrit. Oleh sebab itu hasil pembacaan harus dikonfersikan.
=
=
NO3 = NO3 =
Kadar nitrat = kadar nitrit dari reduksi nitrat x 1,3478 = 47,7204 mg/kg x 1,3478
= 64,3176 mg/kg
Lampiran 13. Analisis Data Statistik untuk Menghitung Kadar Nitrit pada
brokoli yang disimpan dalam suhu kamar dalam waktu 0 jam.
NO Absorban Jumlah Nitrit (μg/g)
1 0,10213 1,5378 0,0059 0,0000351
2 0,10191 1,5357 0,0038 0,0000147
3 0,10184 1,5346 0,0028 0,0000077
4 0,10165 1,5317 -0,0002 0,0000001
5 0,10144 1,5284 -0,0035 0,0000120
0,10095 1,5230 -0,0089 0,0000790
1,5318 Σ =
0,0001486
SB = = = = 0,005452 μg/g
Pada interval kepercayaan 99% dengan nilai α = 0,01, dk = n-1= 5, maka t(α/2,dk) = 4,0321. Data diterima jika t hitung < t tabel.
t hitung 1 = = 2,6609
t hitung 2 = = 1,7224
t hitung 3 = = 1,2471
t hitung 4 = = 0,0076
t hitung 5 = = 1,5589
Lampiran 13. (Lanjutan)
Kadar nitrit pada Brokoli yang disimpan dalam suhu kamar dalam waktu 0 jam.
μ = ± (tα/2, dk) x SB/√n)
= 1,5318 μg/g ± (4,0321 x 0,005452/ ) μg/g = (1,5318 ± 0,0003926) μg/g
Lampiran 14. Tabel Rekapitulasi Data Perhitungan Kadar Nitrit Dalam
Brokoli Yang Disimpan Dalam Suhu Kamar.
Lampiran 15. Tabel Rekapitulasi Data Perhitungan Kadar Nitrat Dalam
Brokoli Yang Disimpan Dalam Suhu Kamar.
Lampiran 16. Analisis Data Statistik untuk Menghitung Kadar Nitrit pada
brokoli yang disimpan dalam suhu lemari pendingin dalam waktu 0 jam.
No. Absorban Jumlah Nitrit (μg/g)
1 0,10213 1,5378 0,0059 0,0000351
2 0,10191 1,5357 0,0038 0,0000147
3 0,10184 1,5346 0,0028 0,0000077
4 0,10165 1,5317 -0,0002 0,0000000
5 0,10144 1,5284 -0,0035 0,0000120
0,10095 1,5230 -0,0089 0,0000790
1,5318 Σ = 0,0001486
SB = = = = 0,005452 μg/g
Pada interval kepercayaan 99% dengan nilai α = 0,01, dk = n-1= 5, maka t(α/2,dk) = 4,0321. Data diterima jika t hitung < t tabel.
t hitung 1 = = 2,6609
t hitung 2 = = 1,7224
t hitung 3 = = 1,2471
t hitung 4 = = 0,0076
t hitung 5 = = 1,5589
Lampiran 16. (Lanjutan)
Kadar nitrit pada Brokoli yang disimpan dalam suhu lemari pendingin dalam waktu 0 jam :
μ = ± (tα/2, dk) x SB/√n)
= 1,5318 μg/g ± (4,0321 x 0,005452/ ) = (1,5318 ± 0,0003926) μg/g
Lampiran 17. Tabel Rekapitulasi Data Perhitungan Kadar Nitrit Dalam
Brokoli Yang Disimpan Dalam Suhu Lemari Pendingin.
Lampiran 18. Tabel Rekapitulasi Data Perhitungan Kadar Nitrat Dalam
Brokoli Yang Disimpan Dalam Suhu Lemari Pendingin.
Lampiran 19. Hasil Uji Perolehan Kembali Nitrit dan Nitrat Setelah
Penambahan Masing-Masing Larutan Standar Pada sampel 0 jam. 1. Hasil Analisis Nitrit Setelah Penambahan Larutan Standar Nitrit
Sampel λ 540Serapan
2. Hasil Analisis Nitrat Setelah Penambahan Larutan Standar Nitrat
Lampiran 20. Contoh Perhitungan Uji Perolehan Kembali Nitrit dan Nitrat
dengan Menggunakan Sampel pada waktu penyimpanan 0 jam.
Volume sampel yang digunakan = 10 ml Absorbansi analisis (Y) :
Nitrit (540 nm) = 0,1021 Nitrat (540 nm) = 0,3940
Persamaan regresi pada panjang gelombang maksimum Nitrit dan Nitrat (λ=540 nm) : Y = X + 0,00964
Konsentrasi Nitrit: Y = X + 0,00964 0,2254 = X + 0,00964
X = 0,3621
Konsentrasi Nitrat: Y = X + 0,00964 0,3940 = X + 0,00964
X = 0,6447
1. Perhitungan Uji Perolehan Kembali Nitrit
Kadar =
=
= 3,6175 µg/g (CF)
Lampiran 20. (lanjutan)
C*A = ml yang ditambahkan
= 2 ml
= 1,9984 µg/g
Maka persen perolehan kembali nitrit = 100 %
= 100%
= 104,07 % 2. Perhitungan Uji Perolehan Kembali Nitrat
Kadar nitrit = xFaktor pengenceran
=
= 79,5545 µg/g
Kadar nitrit dari reduksi nitrat = Kadar total nitrit sesudah reduksi – Kadar nitrit sebelum reduksi
= 79,5545 μg/g– 3,6175 μg/g = 75,937 μg/g
Karena hasil pembacaan alat spektrofotometer untuk nitrat adalah sebagai nitrit. Oleh sebab itu hasil pembacaan harus dikonfersikan.
=
=
Lampiran 20. (lanjutan)
Kadar nitrat = kadar nitrit dari reduksi nitrat x 1,3478 = 75,937 μg/g x 1,3478
= 102,3479 µg/g (CF )
Kadar nitrat sampel setelah ditambah larutan baku (CF ) = 102,3479 µg/g Kadar nitrat sampel sebelum ditambah larutan baku (CA) = 64,3175 µ g/g Kadar larutan baku yang ditambahkan (C*A)
C*A = ml yang ditambahkan
= 4 ml
= 39,4867 µg/g
Maka persen perolehan kembali nitrat = 100 %
= 100%
Lampiran 21. Perhitungan Simpangan Baku Relatif (Relative Standard
Deviation, RSD) Persen Perolehan Kembali Nitrit.
No. Persen Perolehan Kembali (Xi) (Xi - ) (Xi - )2
1 104,07 5,3347 28,4588
2 102,27 3,5378 12,5160
3 99,50 0,7684 0,5905
4 98,13 -0,6027 0,3632
5 95,21 -3,5270 12,4397
6 93,22 -5,5112 30,3735
= 98,74 = 84,7417
SD =
=
= 4,1168
RSD = x 100%
Lampiran 22. Perhitungan Simpangan Baku Relatif (Relative Standard
Deviation, RSD) Persen Perolehan Kembali Nitrat.
No. Persen Perolehan Kembali (Xi) (Xi - ) (Xi - )2
1 96,31 7,1639 51,32
2 88,74 -0,4063 0,17
3 93,32 4,1754 17,43
4 88,29 -0,8614 0,74
5 83,33 -5,8171 33,84
6 84,89 -4,2545 18,10
= 89,15 = 121,60
SD =
=
= 4,9315
RSD = x 100%
Lampiran 23. Daftar Nilai Distribusi t
Lampiran 24. Hasil Identifikasi Tumbuhan
DAFTAR PUSTAKA
Al, S. (2009). Metabolisme Nitrogen. Materi yang disampaikan pada pendampingan Tim Olimpiade Biologi. Purworejo : FMIPA UNY. Diakses 10 Mei 2016.
Aydin, A., Ercan, Ö., dan Taşcioğlu, S. (2005). A Novel Method For The Spectrophotometric Determination Of Nitrite In Water. Journal Food
Additive And Contaminant. 6(1): 1181-1186.
Beda, N., dan Nedospasov, A. (2005). A Spectrophotometric Assay For Nitrate In An Axcess Of Nitrite. Journal of Nitrite Oxide. 13(1) : 93-97.
Bernhard, A. (2010). The Nitrogen Cycle: Processes, Players, and Human Impact. Nature Education Knowledge 2(2):12. Halaman 1-9.
Chung, J.C., Chou, S.S. dan Hwang, D.F. (2004). Changes In Nitrate And Nitrite Content of Four Vegetables During Storage At Refrigerated And Ambient Temperatures. Journal Food Additive And Contaminant. 21(4): 317 – 322. Chou, S. S., Chung, J. C. dan Hwang, D. F. (2003). A High Performance Liquid Chromatography Method for Determining Nitrate and Nitrit Levels in Vegetables. Jurnal of Food and Drug Analysis. 11(3): 223 dan 227.
Darjamuni. (2003). Siklus Nitrogen di Laut. Bogor: IPB. Halaman 5-8.
EFSA. (2008). Nitrate in Vegetables: Scientific Opinion of The Panel on Contaminants in The Food Chain. The EFSA Journal. 689 : 1-79.
Gardjito, M., Salfarino, R., dan Handayani, W. (2015). Penanganan Segar
Hortikultura untuk Penyimpanan dan Pemasaran. Jakarta : Prenadamedia
Grup. Halaman 108-109
Garrett, R.H., dan Grisham, C.M. (2010). Biochemistry. Fourth edition. USA : Mary Fich. Halaman 768-790.
Harmita. (2004). Petunjuk Pelaksanaan Validasi Metode dan Cara
Perhitungannya. Majalah Ilmu Kefarmasian. 1(3): 117 - 135.
Herbarium Medanense. (2016). Hasil Identifikasi. Herbarium Medanense (MEDA) Universitas Sumatera Utara. Medan.
Hess, J. (2000). Meat and Meat Products. Dalam : Horwitz, W. (2000). Official
Methods Of Analysis Of AOAC International. Edisi XVII. Virginia :
Jimidar, M., Hartmann, C., Cousement, N., dan Massart, D.L. (1995). Determination Of Nitrate And Nitrite In Vegetables By Cappilary Electrophoresis With Indirect Detection. Elsevier. Journal of
chromatography. 706: 479-472.
Keeton, J.T., Osburn, W.N., Hardin, M.D., dan Bryan, N.S. (2009). A National Survey of the Nitrite/Nitrate Concentrations in Cured Meat Products and Non-meat Foods Available at Retail - NPB. Research Report Human
Nutrition. 08: 63.
Lundberg, J.O (2009). Cardiovascular Prevention by Dietary Nitrate And Nitrite.
Am J Physiol Heart Circ Physiol. 296: 1221
Manan, M.H.A. (2006). Membuat Reagen Kimia. Jakarta : Bumi aksara. Halaman 36-100.
Masfria, Muchlisyam, Nurmadjuzita, Siti, N., Tuty, R. P., Chairul, A. D., Yade, M. P. (2013). Buku Ajar Analisis Farmasi Kualitatif. Medan: USU Press. Halaman 34-35.
Maynard, D.N., Barker, A.V., Minotti, P.L., and Peck, N.H. (1976). Nitrate
Accumulation In Vegetables. Advances In Agronomy 28. Halaman
71-118.
Miranda, K.N., Espey, M.G., dan Wink, D.A. (2001). A Rapid, Simple Spectrophotometric Method For Simultaneous Detection Of Nitrate And Nitrite. Academic Press. Vol. 5 No. 1. Halaman 62-71.
Özdestan, Ö., dan Üren, A. (2011). Effects of Boiling Parameters on the Level of Nitrate, Nitrite and Colour Values of Wild Radish (Raphanus
raphanistrum). GIDA 2011 36 (4): 193-200.
Pujiyanto, S. (2015). Menjelajah Dunia Biologi. Jakarta : tiga serangkai pustaka mandiri. Halaman 291-293.
Purba, M., Launeta., Ashar, T., Santi, D., dan Nuraini. (2012). Pola Pemupukan Dan Analisa Kandungan Nitrat Pada Sayur Brokoli (Brassica Oleraceae Cv. Brocolli) Di Pertanian Desa Merdeka Kecamatan Merdeka Kabupaten Karo Tahun 2012. Medan: Repository USU. Halaman 1 – 9.
Raczuk, J., Wadas, W., dan Glozak, K. (2014). Nitrates and Nitrites in Selected Vegetables Purchased at Supermarkets in Siedlce, Poland. Rocz Panstw
Zakl Hig. 2014. 65(1): 16, 18-19.
Sastrohamidjojo. (1991). Dasar-dasar Spektroskopi. Yogyakarta: UGM. Halaman 8.
Shimada, Y., dan Ko, S. (2004). Nitrate in vegetables. Chugokugakuen journal. Vol 3. Pp 7-10.
Silalahi, J. (2005). Masalah Nitrit dan Nitrat dalam Makanan. Medika Jurnal
Kedokteran Indonesia. 31(7): 460 - 461.
Simoes, L. S., Candida, T.A.V., dan Frausto, S. (1979). Selection of Analytical Methods for the Determination of Nitrate and Nitrit in Vegetables. Rev.
Port. Quim. 21: 61.
Sudarminto. (2015). Peluang Usaha Tani Brokoli. Prospek, Khasiat Dan
Panduan Budidaya. Seri Pertanian Modern. Yogyakarta: Pustaka Baru
Press. Halaman 130-132.
Sudjana. (2005). Metode Statistika. Edisi VI. Bandung: Tarsito. Halaman 93, 168. Tamme, T., Reinik, M., Pussa, T., Roasto, M., Meremae, K., dan Kiss, A. (2010).
Dynamics Of Nitrate And Nitrite Content During Storage Of Homa Made And Small Scale Industrially Produced Raw Vegetables Juices And Their Dietary Intake. Journal of Food Additivies And Contaminants. (4): 27, 487-495.
Vogel, A. I. (1979). Textbook Of Macro and Semimicro Qualitative Inorganic
Analysis. Penerjemah: Setiono, L., dan Pudjaatmaka, A. H. (1985). Buku Teks Analisis Anorganik Kualitatif Makro dan Semimikro. Edisi V.
Jakarta: PT. Kalman Media Pusaka. Halaman 332 dan 356.
Walters, C.L. (1996). Nitrate and Nitrite In Foods. In : Walters, M. (2000).
Nitrates and Nitrites In Foods and Water. Cambridge: Woodhead
Publishing Limited. Halaman 97.
Watson, D.G. (2005). Pharmaceutical Analysis: A Textbook for Pharmacy
Students and Pharmaceutical Chemists. Penerjemah: Syarief, W. R.
BAB III
METODE PENELITIAN
Metode yang digunakan dalam penelitian ini adalah metode penelitian eksperimental yaitu untuk mengetahui pengaruh suhu dan waktu penyimpanan brokoli (Brassica oleracea. L) terhadap kadar nitrat dan nitrit secara spektrofotometri sinar tampak.
3.1 Lokasi dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Penelitan dan Laboratorium Kimia Analisis Kualitatif, Fakultas Farmasi, Universitas Sumatera Utara pada Januari-Maret 2016.
3.2 Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah satu unit alat spektrofotometer uv-vis (UV mini- 1800 Shimadzu) (Gambar alat dapat dilihat pada Lampiran 2 halaman 47), neraca analitik (Boeco Germany), penangas air,
Hot Plate, kertas saring, kertas perkamen, tissue, bola karet, spatula, termometer,
plat tetes, tabung reaksi, penjepit tabung, batang pengaduk, lumpang dan alu serta alat-alat gelas sesuai dengan kebutuhan.
3.3 Bahan-bahan
etilendiamin dihidroklorida, p.a, asam asetat 100%, HCl(e) 2N, antipirin, p.a, H2SO4(p), kalium permanganat, p.a, kalium iodida, p.a, serbuk difenilamin, p.a, natrium hidroksida, p.a, serbuk Zn, p.a dan yang tidak berkualitas pro analisis yaitu air suling.
3.4 Pengambilan Sampel
Metode pengambilan sampel dilakukan dengan cara sampling purposif yang dikenal juga sebagai sampling pertimbangan, dimana sampel ditentukan atas dasar pertimbangan bahwa sampel yang diambil dapat mewakili populasi (Sudjana, 2005).
Sampel yang digunakan diambil dari pasar induk Medan, Sumatera Utara yang berlokasi di Pasar Lau cih, Pancur Batu, Medan tuntungan.
3.5 Prosedur Penelitian
3.5.1 Pembuatan Pereaksi
Pereaksi yang digunakan dalam penelitian ini adalah larutan asam asetat 15% (v/v), larutan N-(1-naftil) etilendiamin dihidroklorida, dan larutan asam sulfanilat. Larutan asam asetat 15% (v/v) dibuat dengan cara diencerkan 75 mL asam asetat glasial dengan air suling dalam labu tentukur 500 mL (Manan, 2006).
Larutan asam sulfanilat dibuat dengan dilarutkan 0,850 g asam sulfanilat di dalam 250 mL asam asetat 15% (v/v). Disaring dengan kertas saring dan disimpan dalam botol berwarna coklat (Hess, 2000).
Larutan uji kualitatif yang digunakan antara lain pereaksi KI 0,5 N, KMnO4 0,5N dan NaOH 2N. Larutan KI 0,5N dibuat dengan cara dilarutkan 83 gram kalium iodida pro analisis (> 99%) kedalam 1000 mL air. Larutan KMnO4 0,5N dibuat dengan cara dilarutkan 2 gram serbuk kalium permanganat pro analisis (> 99%) ke dalam 200 mL aquades. Larutan NaOH 2N dibuat dengan cara dilarutkan 200 gram NaOH pelet ke dalam 2500 mL aquades (Manan, 2006).
3.5.2 Identifikasi Nitrit
Identifikasi nitrit dilakukan dengan cara sebagai berikut. Diambil sebagian sampel yang telah dihaluskan kemudian dimasukkan dalam beaker glass, ditambahkan air suling secukupnya, dipanaskan di atas penangas air beberapa saat sambil diaduk-aduk, kemudian didinginkan dan disaring. Lalu dilakukan identifikasi yaitu:
a. Dimasukkan filtrat ke dalam spot plate, kemudian ditambahkan dengan beberapa tetes larutan asam sulfanilat dan larutan NED akan terbentuk warna ungu merah (Vogel, 1979).
b. Diambil sebagian filtrat sampel dimasukkan kedalam tabung reaksi, ditambahkan 2 tetes H2SO4 pekat dan 1 tetes KMnO4 maka warna ungu dari KMNO4 akan hilang (Masfria, dkk., 2013).
3.5.3 Identifikasi Nitrat
ditambahkan air suling secukupnya, dipanaskan di atas penangas air beberapa saat sambil diaduk-aduk, kemudian didinginkan dan disaring. Lalu dilakukan identifikasi yaitu:
a. Filtrat sampel dipanaskan dengan serbuk Zn dan NaOH akan terbentuk NH3, yang akan membirukan lakmus merah (Masfria, dkk., 2013).
b. Filtrat sampel dapat mengoksidasi larutan KI yang diasamkan dengan asam setat akan terbentuk larutan kuning sampai coklat karena terbentuk iodium (Masfria, dkk., 2013).
3.5.4 Pembuatan Larutan Induk Baku Nitrit
Sebanyak 100 mg serbuk natrium nitrit dimasukkan ke dalam labu tentukur 100 mL dan dilarutkan dalam air suling, kemudian dicukupkan volumenya sampai garis tanda (C = 1000 μg/mL) (LIB I). Dipipet 1 mL LIB I dan dimasukkan ke dalam labu tentukur 100 mL kemudian diencerkan dengan air suling sampai garis tanda (C = 10 μg/mL) (LIB II).
3.6 Penetapan Kadar Nitrit dan Nitrat
3.6.1 Penentuan Panjang Gelombang Absorbansi Maksimum Nitrit Baku
Dipipet 4 mL LIB II nitrit dan dimasukkan ke dalam labu tentukur 50 mL, ditambahkan 2,5 mL pereaksi asam sulfanilat dan dikocok, setelah 5 menit, ditambahkan 2,5 mL pereaksi N-(1-naftil) etilendiamin dihidroklorida dan dicukupkan dengan air suling sampai garis tanda kemudian dihomogenkan, diukur serapan pada panjang gelombang 400 − 800 nm dengan blanko air suling (C = 0,8
μg/mL). Kurva serapan selanjutnya digunakan untuk penentuan waktu kerja dan
3.6.2 Penentuan Waktu Kerja Nitrit Baku
Dipipet 4 mL LIB II nitrit dan dimasukkan ke dalam labu tentukur 50 mL, ditambahkan 2,5 mL pereaksi asam sulfanilat dan dikocok, setelah 5 menit, ditambahkan 2,5 mL pereaksi N-(1-naftil) etilendiamin dihidroklorida dan dicukupkan dengan air suling sampai garis tanda kemudian dihomogenkan, diukur serapan pada panjang gelombang 540 nm setiap menit selama 60 menit dengan blanko air suling (C = 0,8 μg/mL). Waktu kerja selanjutnya digunakan untuk
penentuan kadar nitrit dan nitrat dalam sampel.
3.6.3 Penentuan Kurva Kalibrasi Nitrit Baku
Dari LIB II dengan konsentrasi 10 μg/mL, dipipet masing-masing sebanyak 1 mL, 2 mL, 3 mL, 4 mL, dan 5 mL (0,2 μg/mL, 0,4 μg/mL; 0,6 μg/mL;
0,8 μg/mL; 1,0 μg/mL). Masing-masing dimasukkan ke dalam labu tentukur 50
mL, kemudian ditambahkan 2,5 mL pereaksi asam sulfanilat dan dikocok. Setelah 5 menit, ditambahkan 2,5 mL pereaksi N-(1-naftil) etilendiamin dihidroklorida dan dicukupkan dengan air suling sampai garis tanda kemudian dihomogenkan. Diukur serapan pada menit ke-12 pada panjang gelombang 540 nm. Kurva kalibrasi selanjutnya digunakan untuk penentuan kadar nitrit dan nitrat dalam sampel.
3.6.4 Penentuan Kadar Nitrit dalam Brokoli (Brassica oleracea L.)
kuantitatif ke dalam labu tentukur 50 mL. Ditambahkan air suling sampai garis tanda, dihomogenkan dan disaring, filtrat pertama sekitar 10 mL dibuang. Dipipet 25 mL filtrat dan dimasukkan ke dalam labu tentukur 50 mL, ditambahkan 2,5 mL pereaksi asam sulfanilat dan dikocok. Setelah 5 menit, ditambahkan 2,5 mL pereaksi N-(1-naftil) etilendiamin dihidroklorida dan dicukupkan dengan air suling sampai garis tanda kemudian dihomogenkan. Diukur serapan pada menit ke-12 dan panjang gelombang 540 nm. Kadar nitrit dalam sampel dapat dihitung dengan persamaan regresi Y = aX+b (Hess, 2000).
Rumus perhitungan kadar nitrit: K = Keterangan: Y = Absorban
K = Kadar nitrit dalam sampel (μg/g)
X = Kadar nitrit dalam larutan sampel sesudah pengenceran V = volume larutan sampel sebelum pengenceran (mL) Fp = Faktor pengenceran
3.6.5 Penentuan Kadar Nitrat dalam Brokoli (Brassica oleracea. L.)
N-(1-naftil) etilendiamin dihidroklorida dan dicukupkan dengan air suling sampai garis tanda kemudian dihomogenkan. Diukur serapan pada menit ke-12 dan panjang gelombang 540 nm. Kadar nitrat dalam sampel dapat dihitung dengan persamaan regresi Y = aX+b (Hess, 2000).
Rumus perhitungan kadar nitrat: K = Keterangan: Y = Absorban
K = Kadar nitrat dalam sampel (μg/g)
X = Kadar nitrat dalam larutan sampel sesudah pengenceran V = volume larutan sampel sebelum pengenceran (mL) Fp = Faktor pengenceran
Kadar nitrit dari reduksi nitrat = Kadar total nitrit sesudah reduksi – Kadar nitrit sebelum reduksi.
Karena hasil pembacaan alat spektrofotometer untuk nitrat adalah sebagai nitrit, oleh sebab itu hasil pembacaan harus dikonfersikan.
Kadar nitrat = kadar nitrit dari reduksi nitrat x
3.7 Uji Validasi Metode Analisis
3.7.1 Uji Perolehan Kembali
μg/mL. Menurut Harmita (2004), Persen perolehan kembali dapat dihitung dengan rumus: % perolehan kembali = 100 %
Keterangan:
CF = Konsentrasi analit dalam sampel setelah penambahan bahan baku CA = Konsentrasi analit dalam sampel sebelum penambahan bahan baku C*A = Konsentrasi bahan baku yang ditambahkan ke dalam sampel
3.7.2 Uji Presisi
Berdasarkan hasil perolehan kembali nitrit dan nitrat ditentukan standar deviasi nitrit dan nitrat. Menurut (Sudjana, 2005) Untuk menghitung standar deviasi (SD) digunakan rumus :
SD =
Keterangan : X = Kadar kandungan zat dalam sampel = Kadar kandungan zat rata-rata sampel n = JumLah pengulangan
Berdasarkan nilai standar deviasi yang didapat, dihitung simpangan baku relatif nirit dan nitrat. Simpangan baku relatif dapat dihitung dengan rumus di bawah ini :
RSD = x 100%
Keterangan : = Kadar kandungan rata-rata zat dalam sampel SD = Standar deviasi
RSD = Relative Standard Deviation, Simpangan Baku Relatif
3.7.3 Penentuan Batas Deteksi dan Batas Kuantitas
Batas deteksi atau Limit of Detection (LOD) adalah jumLah terkecil analit dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan dibandingkan dengan blanko (Harmita, 2004).
Batas kuantitas atau limit of quantitation (LOQ) adalah kuantitas terkecil analit dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama (Harmita, 2004). Batas kuantitas dapat dihitung dengan rumus sebagai berikut:
Batas kuantitasi =
3.7.4 Analisis Data Secara Statistik
Kadar dapat dihitung dengan persamaan garis regresi dan untuk menentukan data diterima atau ditolak digunakan rumus:
t hitung =
Dengan dasar penolakan apabila t hitung ≥ t tabel. Menurut Sudjana (2005), untuk mencari kadar sebenarnya dengan %, α 1/2 , dk = n-1, dapat digunakan rumus:
µ = (α/2, dk) x SB/ ) Keterangan : µ : kadar sebenarnya
: kadar analit dalam sampel SB : simpangan baku
dk : derajat kebebasan (dk = n-1)
t : harga t tabel sesuai dengan dk = n-1 α : tingkat kepercayaan
BAB IV
HASIL DAN PEMBAHASAN
4.1 Identifikasi Nitrit dan Nitrat dalam Brokoli (Brassica oleracea. L)
4.1.1 Identifikasi Nitrit dalam Brokoli
Uji kualitatif telah dilakukan dengan berbagai pereaksi identifikasi yaitu dengan asam sulfanilat dan N-(1-naftil) etilendiamin dihidroklorida dan KI dan CH3COOH (e). Hasil identifikasi nitrit pada tabel 4.1.
Tabel 4.1 Identifikasi Nitrit dalam Brokoli
No. Sampel Dari Tabel 4.1 dapat dilihat bahwa sampel yang digunakan dalam uji nitrit dalam brokoli positif mengandung nitrit, hal tersebut dibuktikan dari hasil reaksi yang positif. Gambar hasil identifikasi nitrit dalam brokoli dapat dilihat pada Lampiran 3 halaman 48.
4.1.2 Identifikasi Nitrat dalam Brokoli
Uji kualitatif telah dilakukan dengan berbagai pereaksi identifikasi yaitu dengan Zn dan NaOH serta KI dan Asam asetat (e). Hasil identifikasi nitrit pada tabel 4.2.
Tabel 4.2 Identifikasi Nitrat dalam Brokoli
Dari Tabel 4.2 dapat dilihat bahwa sampel mengandung nitrat karna semua reaksinya positif. Gambar hasil identifikasi nitrat dalam brokoli dapat dilihat pada Lampiran 4 halaman 49.
4.2 Kurva Serapan Nitrit
Untuk memperoleh panjang gelombang maksimum, dilakukan dengan membuat kurva hubungan antara absorbansi dengan panjang gelombang dari suatu larutan baku pada konsentrasi tertentu. Penentuan kurva serapan maksimum dilakukan pada panjang gelombang 400 − 800 nm. Pengukuran serapan nitrit dilakukan pada konsentrasi 0,8 μg/mL. Kurva serapan nitrit pada konsentrasi 0,8
μg/mL dapat dilihat pada Gambar 4.1.
Gambar 4.1 Kurva serapan nitrit pada konsentrasi 0,8 μg/mL
selanjutnya digunakan untuk penentuan waktu kerja dan penentuan kadar nitrit dalam sampel.
4.3 Waktu Kerja
Penentuan waktu kerja nitrit dilakukan untuk mengetahui waktu dimana senyawa tersebut memiliki nilai serapan paling stabil saat diukur dengan spektrofotometri sinar tampak. Penentuan waktu kerja nitrit dilakukan pada konsentrasi 0,8 µg/mL diukur setiap menit selama 60 menit dimulai pada menit ke-4. Tabel waktu kerja dapat dilihat pada Lampiran 8 halaman 54. Kurva waktu kerja nitrit dapat dilihat pada Gambar 4.2.
Gambar 4.2 Kurva waktu kerja nitrit
4.4 Linieritas Kurva Kalibrasi
4.4.1 Kurva Kalibrasi
Kurva Kalibrasi adalah suatu seri larutan baku dari zat yang akan dianalisis dengan berbagai konsentrasi diukur, kemudian dibuat kurva yang merupakan hubungan antara absorbansi dengan konsentrasi. Bila hukum Lambert-Beer terpenuhi maka kurva kalibrasi ini adalah 0,2 μg/mL;0,4 μg/mL; 0,6 μg/mL;
0,8 μg/mL dan 1,0 μg/mL. Kurva kalibrasi nitrit dapat dilihat pada Gambar 4.3
dibawah ini.
Gambar 4.3 Kurva kalibrasi nitrit baku
Dari Gambar 4.3, diperoleh hubungan yang linier antara konsentrasi dengan absorbansi. Persamaan garis regresi yang diperoleh yaitu Y= 0,5962X + 0,0096 dengan koefisien korelasi (r) sebesar 0,99954. Nilai r > 0,99 menunjukkan adanya korelasi linier antara X dan Y (Watson, 2005).
4.4.2 Batas Deteksi dan Batas Kuantitasi
adalah 0,120712 mg/kg sedangkan batas kuantitasi nitrit dan nitrat adalah 0,038104 mg/kg.
Batas deteksi merupakan parameter uji batas yang dilakukan untuk mendeteksi jumLah terkecil analit dalam sampel yang masih memberikan respon signifikan dengan blanko sedangkan batas kuantitasi merupakan kuantitas terkecil analit yang masih dapat memenuhi kriteria cermat dan seksama (Harmita, 2004).
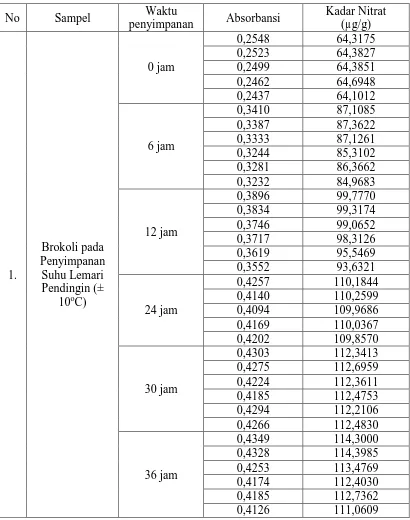
4.5 Pengaruh Lama Penyimpanan Terhadap Kadar Nitrat Dan Nitrit Pada Brokoli Dalam Penyimpanan Suhu Kamar Dan Suhu Lemari Pendingin.
Sampel diberi perlakuan berupa lama penyimpanan serta suhu penyimpanan pada suhu kamar dan suhu lemari pendingin, kemudian sampel diukur pada panjang gelombang 540 nm. Contoh perhitungan kadar nitrit dan nitrat pada sampel dapat dilihat pada Lampiran 11-12 halaman 59-60. Analisis data statistik untuk menghitung kadar nitrit dan nitrat pada sampel dapat dilihat pada Lampiran 13-19 halaman 62-69. Kadar nitrit dan nitrat dalam Sampel Brokoli dapat dilihat dalam Tabel 4.3, Gambar 4.4, Gambar 4.5, Gambar 4.6 dan Gambar 4.7.
Gambar 4.4 Grafik kadar nitrit dalam brokoli pada penyimpanan lemari
pendingin dan suhu kamar.
Gambar 4.5 Grafik kadar nitrat dalam brokoli pada penyimpanan suhu lemari
Gambar 4.6 Grafik pengaruh lama penyimpanan brokoli terhadap kadar nitrat
dan nitrit pada penyimpanan suhu lemari pendingin.
Gambar 4.7 Grafik pengaruh lama penyimpanan brokoli terhadap kadar nitrat
Tabel 4.3 Kadar Nitrit dan Nitrat dalam Brokoli Dari Tabel 4.3, Gambar 4.4, Gambar 4.5, Gambar 4.6, dan Gambar 4.7 dapat dilihat bahwa terdapat perbedaan antara kadar nitrat dan nitrit pada sampel brokoli yang disimpan pada suhu kamar maupun suhu lemari pendingin. Peningkatan kadar nitrat pada seluruh sampel yang disimpan pada suhu kamar dan suhu lemari pendingin lebih tinggi dibandingkan peningkatan kadar nitrit.
Pembentukan nitrat pada suhu kamar lebih tinggi dibandingkan pada sampel yang disimpan pada suhu lemari pendingin. Pada suhu kamar peningkatan kadar nitrat dari 64,19 mg/kg ± 0,20 mg/kg menjadi 156,04 mg/kg ± 0,30 mg/kg. Pada suhu lemari pendingin peningkatan kadar nitrat dari 64,18 mg/kg ± 0,20 mg/kg menjadi 113,06 mg/kg ± 0,85 mg/kg. Pada suhu kamar kadar nitrit mengalami peningkatan dari 1,53 mg/kg ± 0,0004 mg/kg menjadi 3,13 mg/kg ± 0,00007 mg/kg sedangkan pada suhu lemari pendingin peningkatan kadar nitrit dari 1,53 mg/kg ± 0,0004 mg/kg menjadi 2,98 mg/kg ± 0,016 mg/kg.
Peneliti mengungkapkan bahwa aktivitas endogen enzim nitrat reduktase dalam sayuran cenderung terinaktivasi pada kondisi penyimpanan pada suhu rendah, karena suhu yang rendah dapat mengurangi aktivitas enzim nitrat reduktase dengan cara menghambat transpor elektron internal nitrat reduktase. Meskipun jumlah nitrit pada penyimpanan suhu pendingin tidak lebih tinggi dibandingkan suhu kamar hal tersebut harus tetap diperhatikan agar jumlahnya tidak terlalu banyak apabila dikonsumsi dan tidak membahayakan kesehatan (Chung, et al., 2004).
peningkatkan di beberapa sayuran yang kaya nitrat setelah panen, terutama jika disimpan pada suhu kamar.
4.6 Uji Validasi
Parameter validasi yang diuji adalah akurasi (kecermatan), presisi (keseksamaan), batas deteksi dan batas kuantitasi. Akurasi dinyatakan dalam persen perolehan kembali (% recovery) yang ditentukan dengan menggunakan metode penambahan baku (standard addition method). Uji presisi dilakukan dengan menggunakan parameter Relative Standard Deviation (RSD) (Harmita, 2004).
4.6.1 Uji Presisi
Uji presisi dilakukan dengan perhitungan simpangan baku relatif. Perhitungan simpangan baku relatif dapat dilihat pada Lampiran 39 dan 40 halaman 106 - 107. Berdasarkan data perhitungan terhadap kadar nitrit dan nitrat, diperoleh simpangan baku relatif untuk nitrit yaitu 4,17 % dan nitrat 5,53 %. Hasil simpangan baku relatif untuk nirit dan nitrat memenuhi persyaratan yaitu kurang dari 5,8% (Harmita, 2004).
4.6.2 Uji Akurasi
penambahan baku standar pada Brokoli pada waktu 0 jam dapat dilihat pada Tabel 4.4.
Tabel 4.4 Persen Perolehan Kembali Nitrit Dan Nitrat Dengan Metode
Penambahan Baku Pada Brokoli Pada Waktu Penyimpanan 0 Jam.
Kadar Nitrit Brokoli pada
waktu 0 jam (µg/g) (%) Peroleh
-an
Kemba-li
Kadar Nitrat Brokoli pada
waktu 0 jam (µg/g) (%)
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan penelitian yang dilakukan, maka dapat disimpulkan:
a. Waktu penyimpanan dan suhu penyimpanan akan meningkatkan kadar nitrat dan nitrit yang ada di dalam brokoli, semakin lama kadarnya semakin tinggi. Pada penyimpanan suhu kamar terjadi peningkatan kadar nitrat dan nitrit yang lebih tinggi dibandingkan penyimpanan suhu lemari pendingin.
b. Terdapat perbedaan kadar nitrat dan nitrit dalam brokoli yang disimpan pada suhu kamar dan suhu lemari pendingin. Pada penyimpanan suhu kamar kadar nitrit dari penyimpanan 0 jam sampai 36 jam meningkat dari kadar awal 1,53 mg/kg menjadi 1,75 mg/kg. Dan kadar nitrat dari penyimpanan 0 jam sampai 36 jam meningkat dari kadar awal 64,19 mg/kg menjadi 154,51 mg/kg. Pada penyimpanan suhu lemari pendingin kadar nitrit dari penyimpanan 0 jam sampai 36 jam meningkat dari kadar awal 1,53 mg/kg menjadi 2,09 mg/kg. Dan kadar nitrat dari penyimpanan 0 jam sampai 36 jam meningkat dari kadar awal 64,19 mg/kg menjadi 113,06 mg/kg.
5.2 Saran
BAB II
TINJAUAN PUSTAKA
2.1 Siklus Daur Ulang Nitrogen
Nitrogen merupakan elemen yang sangat esensial, keberadaannya dibutuhkan oleh seluruh makhluk hidup (Bernhard, 2010). Nitrogen menempati porsi 1-2 % dari berat kering tanaman. Ketersedian nitrogen di alam berada dalam beberapa bentuk persenyawaan, yaitu berupa N2 (nitrogen), N2O (Dinitrogen oksida), NO (Nitrogen monoksida), NO2- (Nirit), NO3- (Nitrat), NH3 (Amoniak) dan NH4+ (Amonium) (Al, 2009).
Di alam terjadi siklus nitrogen sebagai proses aliran materi. Persenyawaan nitrogen di luar tubuh organisme lebih banyak sebagai N-anorganik. Sebagian berupa anion dan kation yang larut dalam air, berada dalam sistem tanah. Sebagian lain persenyawaan nitrogen berada dalam fase gas di udara. Terjadi perubahan siklis antara fase N-anorganik dan N-organik, yang melibatkan hewan, tumbuhan, jamur dan mikroorganisme lain serta faktor lingkungan abiotiknya (Al, 2009; Bernhard, 2010).
2010). Mikroorganisme yang memfiksasi nitrogen disebut diazotrof. Mikroorganisme ini memiliki enzim nitrogenase yang dapat menggabungkan hidrogen dan nitrogen. Beberapa jenis tumbuhan dapat menggunakan nitrogen bebas dari udara secara langsung karena mereka bersimbiosis dengan mikroorganisme diazotrof pada bintil-bintil akar tumbuhan tersebut (Darjamuni, 2003; Pujianto, 2015; Bernhard, 2010).
Gambar 2.1 Daur nitrogen di alam.
Tumbuhan yang tidak bersimbiosis dengan mikroorganisme memperoleh
intake atau material masukan yang sebagian besar berupa kation maupun anion
amino, sintesis amida dan peptida serta, sintesis protein dan perombakan protein (Al, 2009).
Proses pemanfataan senyawa nitrogen menjadi nitrat melalui beberapa proses, diantaranya proses nitrifikasi, asimilasi dan denitrifikasi. Nitrifikasi adalah proses pengubahan amonium menjadi nitrat oleh aktivitas enzim nitrogenase yang di miliki oleh bakteri nitrifikasi. Proses nitrifikasi berlangsung melalui dua tahap, yaitu nitritasi dan nitratasi. Nitritasi adalah proses mengubahan amonium menjadi nitrit oleh bakteri nitritasi seperti Nitrosomonas. Sedangkan nitratasi adalah proses pengubahan nitrit menjadi nitrat oleh bakteri nitratasi seperti Nitrobacter (Bernhard, 2010). Beberapa bakteri dapat mengubah senyawa nitro yang telah tereduksi kembali ke alam dengan cara oksidasi. Proses oksidasi NH4+ menjadi NO3- disebut nitrifikasi bakteri (Garrett dan Grisham, 2010).
Nitrat yang dihasilkan melalui proses nitrifikasi selanjutnya akan digunakan kedalam jaringan biologis tumbuhan melalui proses asimilasi. Asimilasi adalah proses pengolahan ion nitrat dan amonium yang difiksasi oleh tumbuhan yang akan dibentuk menjadi asam amino essensial. Senyawa ion nitrogen tersebut kemudian direaksikan hingga terbentuk berbagai unsur organik seperti asam amino, asam nukleat, protein nabati dan bahkan ada senyawa ion nitrogen yang di sisipkan ke dalam klorofil (Bernhard, 2010).
menjadi ion amonia (NH4+). Bakteri nitrifikasi dan denitrifikasi berperan pada proses konversi tersebut (Al, 2009).
Di alam terdapat beberapa bakteri yang terlibat dalam konversi nitrat menjadi amonia, atau sebaliknya. Proses-proses pengubahan dari amonia menjadi nitrat disebut nitrifikasi. Sebaliknya, terjadi peristiwa pengubahan nitrat dan nitrit menjadi amonia atau N2 yang disebut denitrifikasi. Proses nitrikasi melibatkan bakteri nitrosomonas dan nitrobakter. Pada proses pembusukan dari senyawa N-organik, akan dihasilkan ion-ion amonia yang prosesnya disebut amonifikasi (Al, 2009; Bernhard, 2010).
Tabel 2.1 Rentang Kadar Nitrat dan Nitrit dari Berbagai Sayuran
Jenis Sayur Rentang Kadar Nitrat (mg/kg)
Selada 90-13000 0,16-1,4
Daun Sop 0-4100 0-94
Kacang Polong 20-100 0,4-2,6
Kentang 57-1000 0-2,1
Lobak 60-9000 0-3,5
Bayam 2-6700 0-162
Tomat 0-170 0,16-1,6
Sumber: (Walters, 1996 dan Keeton, et al., 2009).
2.2 Kandungan Nitrat Dan Nitrit Pada Sayuran
sama, namun kadar nitrat maupun nitrit dapat berbeda sangat jauh tergantung faktor yang mempengaruhi pada saat proses penanaman dan perlakuan pasca panen, suhu dan lama penyimpanan, pada proses pengolahan bahan pangan seperti pencucian, pemasakaan dan pemisahan. Suhu yang digunakan pada saat penyimpanan, seperti suhu kamar dan suhu lemari pendingin atau suhu beku (EFSA, 2008).
2.3 Pengaruh Suhu dan Lama Penyimpanan Terhadap Kadar Nitrat Dan Nitrit
peningkatan kadar nitrit pada hari ke-3, hal tersebut membuktikan bahwa adanya aktivitas enzim nitrat reduktase pada periode waktu hari ke 3-4 yang menyebabkan perubahan kadar nitrat dan nitrit. Pengaruh lainnya berupa aktivitas mikroba pereduksi nitrat yang menyebabkan terjadinya penumpukan jumlah nitrit (Chung, et al., 2004; Tamme, et al., 2010).
2.4Efek Nitrat dan Nitrit Pada Manusia
Nitrat dan nitrit dapat memberikan efek negatif dan efek positif pada manusia. Nitrit merupakan suatu senyawa yang reaktif, dapat direduksi menjadi senyawa NO yang bersifat sebagai vasodilator (Silalahi, 2005; Miranda., et al, 2001; Lundberg, 2009). Penelitian yang dilakukan oleh EFSA, pada sukarelawan yang sehat, setelah 3 jam mengkonsumsi 500 mL jus bit yang mengandung nitrat 2,9 g/L, dapat mengurangi tekanan darah (-10 mmHg) dan efek ini mempunyai korelasi dengan kenaikan kadar nitrit dalam plasma. Dosis terapi oral natrium nitrit berkisar 0,03-0,12 gram sebagai vasodilator. Pemberian nitrit pada dosis kecil juga dapat melindungi jalannya aliran darah ke beberapa organ seperti hati, otak, ginjal. Efek lain dari nitrat dan nitrit adalah sebagai antiinflamasi (Lundberg, 2009; Silalahi, 2005).
oksigen telah berkurang dan menyebabkan warna darah menjadi coklat. Methaemoglobin dapat terjadi jika hemoglobin terpapar oleh oksidator lain, termasuk nitrit. Kadar methaemoglobin yang diperbolehkan dalam tubuh hanya 2% apabila kadarnya meningkat hingga 20% maka dapat menyebabkan gangguan yang signifikan terhadap pengangkutan oksigen, sekalipun masih dapat ditoleransi (Silalahi, 2005; Jimidar, et al., 1995).
Nitrat dan nitrit juga dapat menyebabkan pembentukan senyawa nitrosamin pada saluran pencernaan yang dapat menghasilkan senyawa karsinogenik penyebab kanker. Nitrosamin dapat terbentuk melalui reaksi kimia antara agen nitrosasi dan senyawa amin yang mudah dinitrosasi (Tamme, et al., 2010). Reaksi tersebut terjadi pada pH asam dalam air. Biasanya tingkat keasaman makanan sudah cukup untuk memicu nitrosasi, sehingga nitrit dalam makanan akan bereaksi dengan asam dilambung membentuk senyawa nitrosamin yang bersifat karsinogenik. Tingginya kasus kanker hati dan kanker lambung di Jepang serta China diduga dikarenakan mengkonsumsi cumi-cumi yang mengandung dietilamina (Silalahi, 2005).
2.5Brokoli (Brassica oleracea L.)
bahasa Italia, dimana broco berarti tunas. Tanaman brokoli termasuk cool season
crop, sehingga cocok ditanam pada daerah pegunungan (dataran tinggi), yang
beriklim sejuk (Sudarminto, 2015; Gardjito, dkk., 2015).
Taksonomi Brokoli menurut Herbanese Medan (2016) adalah sebagai berikut : Kingdom : Plantae
Divisi : Spermathophyta Class : Dicotyledoneae Ordo : Capparales Famili : Brassicaceae Genus : Brassisca
Species : Brassisca oleraceae L. Nama lokal : Brokoli
2.5.1 Jenis Tanaman
Varietas brokoli dibagi menjadi dua kelompok berdasarkan umurnya, yaitu berumur pendek (early variety) dan berumur panjang (late variety). Berdasarkan klasifikasinya brokoli termasuk divisi spermathophyta. Subdivisi angiospermae (Sudarminto, 2015).
Brokoli adalah tanaman yang termasuk dalam suku kubis-kubisan. Lahan yang cocok untuk menanam brokoli terletak pada ketinggian 1000-2000 mdpl. Sedangkan tekstur tanah yang dikehendaki adalah tanah liat berpasir dan banyak mengandung bahan organik (Sudarminto, 2015).
2.5.2 Morfologi Tanaman
dengan kubis bunga. Massa bunga brokoli tersusun secara kompak membentuk bulatan berwarna hijau tua, atau hijau kebiru-biruan, dengan diameter antara 15-20 cm atau lebih. Pada kondisi lingkungan yang sesuai massa bunga brokoli dapat tumbuh memanjang menjadi tangkai yang penuh dengan kuntum bunga, tiap bunga terdiri atas 4 helai kelopak bunga (calyx), empat helai daun mahkota (corolla), enam benang sari yang komposisinya empat memanjang dan dua pendek. Bakal buah terdiri atas dua ruang dan setiap ruang berisi bakal biji. Biji brokoli membentuk dan warna yang hampir sama, yaitu bulat kecil berwarna coklat sampai kehitaman. Biji tersebut dihasilkan oleh penyerbukan sendiri ataupun silang dengan bantuan sendiri ataupun serangga (Sudarminto, 2015; Gardjito, dkk., 2015).
Bunga brokoli berwarna hijau dan masa tumbuhnya lebih lama dari kubis bunga. Brokoli tersusun dari bunga-bunga kecil yang berwarna hijau, tetapi tidak sekompak kubis. Dibandingkan dengan kubis bunga, bunga brokoli akan terasa lebih lunak setelah direbus (Sudarminto, 2015).
2.5.3 Manfaat Brokoli Untuk Kesehatan
a. Melawan Kanker
Brokoli mengandung dua senyawa fitokimia yang disebut indoles dan
isohtiocyanate. Senyawa fitokima tersebut berfungsi meningkatkan aktivitas
enzim yang berperan untuk menghancurkan agen karsinogenik. Brokoli mempunyai agen antikanker seperti glucoraphanin, betakaroten,
diindolymetthane, selenium dan nutrisi lain seperti vitamin A, Vitamin C, vitamin
kanker payudara, rahim, kelenjar prostat, usus, ginjal, hati dan paru-paru (Sudarminto, 2015).
Sebagai tanaman dengan kandungan vitamin C yang tinggi, dapat dipastikan bahwa brokoli memiliki aktivitas antioksidan yang baik. Aktivitas antioksidan ini sangat baik sekali untuk pertahanan tubuh, terutama membantu menjaga tubuh dari penyakit kanker (Sudarminto, 2015; Raczuk, et al., 2014).
Dalam beberapa penelitian, manfaat brokoli untuk membantu mencegah kanker diperkuat dengan adanya senyawa glukorafanin, yang merupakan bentuk alami dari senyawa antikanker sulforana. Disamping sulforana, terdapat juga isotiosianat yang memiliki manfaat yang sama yaitu sebagai zat yang berkhasiat antikanker (Sudarminto, 2015).
b. Detoksifikasi
Brokoli turut berperan dalam proses detoksifikasi dan membebaskan tubuh dari radikal bebas dan racun asam urat, sehingga melindungi tubuh dari toksik seperti bisul, gatal, rematik, batu ginjal, asam urat dan eksim (Sudarminto, 2015). Detoksifikasi adalah proses pengeluaran racun atau zat-zat yang bersifat racun didalam tubuh. Organ vital yang menjadi target dalam program pembersihan racun yang efektif adalah usus besar (pengeluaran) dan liver (detoksifikasi). Pembersihan dan detoksifikasi meningkatkan proses alamiah pengeluaran toksin dari tubuh kita (Sudarminto, 2015).
c. Sehatkan Jantung
Para peneliti Amerika Serikat menyatakan bahwa menkonsumsi brokoli banyak manfaat positif bagi kesehatan tubuh. Salah satu diantara manfaat positifnya adalah melidungi jantung dari sel-sel perusak. Brokoli mengandung sulforana yang efektif untuk mencegah kerusakan pada jantung. Selain itu brokoli juga merangsang tubuh memproduksi sebuah protein yang disebut thioredoxin. Zat ini juga berfungsi melindungi jantung dari sel-sel perusak (Sudarminto, 2015).
d. Perawatan Mata
Zexanthin adalah salah satu senyawa dalam brokoli yang bermanfaat bagi kesehatan mata. Nutrisi dalam perbaikan kerusakan yan disebabkan karena radiasi UV serta mencegah gangguan kondisi mata seperti degenerasi mata manula dan katarak (Sudarminto, 2015).
e. Meningkatkan Kesehatan Kulit dan Meningkatkan Imunitas
Brokoli mengandung banyak Vitamin C, Betakaroten dan Vitamin B kompleks yang sangat dibutuhkan oleh kulit. Bahkan Vitamin E yang ada di dalam brokoli mampu membantu regenerasi kulit yang telah mati (Sudarminto, 2015).
f. Kesehatan Tulang dan Mendukung Kehamilan
Kalsium yang terkandung dalam brokoli sangat membantu dalam pertumbuhan tulang anak-anak, orang tua dan ibu hamil atau menyusui. Kekurangan kalsium dapat menyebabkan melemahnya tulang, gigi, osteoporosis. Brokoli berkontribusi terhadap kesehatan tulang karena kandungan zat besi, kalium, fosfor dan magnesium (Sudarminto, 2015).
g. Menjaga Kadar Gula Darah
Brokoli mengandung mineral yang disebut Kromim, yang membantu berfungsinya hormon insulin. Ini merupakan salah satu cara mengatur kadar gula darah (Sudarminto, 2015).
h. Mencegah Anemia
2.5.4 Kandungan Gizi Brokoli
Brokoli mengandung air, protein, lemak, karbohidrat, serat, kalsium, zat besi, vitamin (A, C, E, tiamin, nikotinamid), beta karoten dan glutation. Selain itu, brokoli mengandung senyawa cianohidroksibutena (CHB), sulforafan dan iberin yang merangsang pembentukan glutation. Nilai gizi yang terkandung dalam 156 gram brokoli (1 mangkuk brokoli yang dikukus) ditunjukan dalam tabel 2.2.
Tabel 2.2 Kandungan Gizi Brokoli
Nilai Gizi Total Kandungan
Kalori 43,68 kal
Protein 4,66 gram
Asam lemak omega 3 0,20 gram
Karbohidrat 8,19 gram
Lemak 0,55 gram
Kalsium 74,72 gram
Pottasium (kalium) 505, 44 mg
Fosfor 102,80 mg
Besi 1,37 mg
Zinc 0,62 mg
Magnesiun 39,00 mg
Vitamin A 228,07 mg
Vitamin B1 (Thiamin) 0,09 mg
Vitamin B2 (Riboflavin) 0,18 mg
Vitamin B6 (pyridoxin) 0,22 mg
Vitamin B3 (Niasin) 0,94 mg
Vitamin B5 (Panatotthenic acid) 0,79 mg
Vitamin B9 (Folat) 93,91 mcg
Vitamin C 123,40 mg
Sumber : (Sudarminto, 2015).
2.6Penetapan Kadar Nitrat Dan Nitrit
Chromatography), keluminensen dan spektrofotometri sinar tampak. Metode
pengukuran menggunakan spektrofotometri telah digunakan pada penetapan kadar nitrit dari nitrat yang direduksi menggunakan vanadium (III) yang dilarutkan kedalam HCl (Beda, et al., 2005; Miranda, et al., 2001). Penetapan kadar nitrit dalam air menggunakan spektrofotometer sinar tampak juga telah digunakan sebagai metode penetapan kadar nitrit (Aydin, et al., 2005). Untuk penentuan kadar nitrat sendiri, dilakukan dengan terlebih dahulu mereduksinya menjadi nitrit. Reduksi nitrat menjadi nitrit, dilakukan dengan cara direduksi dengan logam Zn (Walters, 1996; Vogel, 1990) maupun dengan campuran kadmium, natrium tartrat dan asam tartrat (Özdestan dan Üren, 2011; Silalahi, et al., 2007). Nitrat juga dapat direduksi dengan serbuk Zn dan HCl atau asam asetat (Masfria, dkk., 2013; Walters, 1996).
2.7 Spektroskopi Sinar Tampak
Ultra
violet Violet Nila Biru Hijau Kuning Jingga Merah
Infra merah Sumber spektrum tersebut dapat didapatkan dari sumber selain sinar matahari, misalnya pengaliran arus listrik melalui filamen yang terbuat dari bahan seperti tungsten menghasilkan suatu sumber yang berpijar yang memancarkan radiasi sinar tampak (Sastrohamidjojo, 1991).
2.7.1 Hubungan Warna Dan Panjang Gelombang
Cahaya yang dapat dilihat manusia disebut cahaya terlihat atau cahaya tampak. Biasanya cahaya tampak merupakan campuran dari cahaya yang mempunyai berbagai panjang gelombang, dari 400-700 nm, seperti pelangi yang bisa dilihat oleh mata. Hubungan antara warna atau cahaya tampak dengan panjang gelombang yang terlihat, ditunjukan pada tabel 2.3 (Sastrohamidjojo, 1991).
Tabel 2.3 Warna dan warna komplementer
Panjang gelombang (nm) Warna Warna Komplementer
400-435 Violet (Ungu) Hijau kekuningan
435-480 Biru Kuning
480-490 Biru kehijauan Jingga
490-500 Hijau kebiruan Merah
500-560 Hijau Ungu kemerahan
560-580 Hijau kekuningan Ungu
595-610 Jingga Biru kehijauan
610-680 Merah Hijau kebiruan
680-700 Ungu kemerahan Hijau
2.7.2 Instrumentasi
lain-lain, monokromator untuk mengubah radiasi menjadi komponen-komponen panjang gelombang tunggal, tempat cuplikan yang transparan dan detektor radiasi yang dihubungkan dengan sistem meter pencatat.
Diagram sederhana dari spektrofotometer adalah sebagai berikut :
Gambar 2.2 Diagram Spektrofotometer (Sastrohamidjojo, 1991).
Metode spektrofotometri sinar tampak digunakan untuk pemeriksaan kuantitatif nitrit dengan pereaksi asam sulfanilat dan NED yang membentuk warna ungu merah dan dapat diukur dengan panjang gelombang maksimum 540 nm (Hess, 2000; Beda, et al., 2005; Miranda, et al., 2001).
Metode spektrofotometri sinar tampak dalam penetapan kadar nitrit dan nitrat adalah berdasarkan reaksi kolorimetri uji Griess (lihat Gambar 2.2) dimana nitrit mengalami reaksi diazotasi dengan asam sulfanilat dan N-(1-Naftil) etilendiamin dihidroklorida yang akan menghasilkan senyawa azo berwarna ungu kemerahan yang dapat diukur secara spektrofotometri sinar tampak pada panjang gelombang 540 nm (Hess, 2000).
Gambar 2.3 Reaksi diazotasi antara nitrit, asam sulfanilat dan NED
BAB I
PENDAHULUAN
1.1 Latar Belakang
Brokoli (Brassica oleracea L.) adalah tanaman sayuran hortikultura unggulan yang termasuk dalam suku kubis-kubisan atau Brassicaceae. Sayuran ini sangat banyak dikonsumsi di Indonesia dan cukup populer digunakan sebagai bahan pangan sehari-hari karena kandungan mineral, vitamin dan zat bermanfaat lainnya (Sudarminto, 2015).
Sumber utama nitrat dan nitrit secara umum adalah makanan terutama sayuran (Silalahi, 2005). Nitrat terbentuk secara alami di dalam tumbuhan melalui daur nitrogen. Keberadaan nitrat didalam tumbuhan memiliki efek racun yang rendah bagi tubuh manusia, namun nitrat dapat berubah menjadi nitrit dimana nitrit memiliki tingkat berbahaya lebih tinggi dibanding nitrat (Shimada dan Ko, 2004; Simoes, et al., 1979).
suhu kamar maka akan mengaktifkan enzim nitrat reduktase dan aktifitas mikroflora yang menyebabkan peningkatan nitrat dan nitrit (Chung, et al., 2004).
Telah diketahui bahwa brokoli memiliki kandungan kadar nitrit dan nitrat yang semakin meningkat apabila diberikan pemupukan (Purba, dkk., 2012). Rentang kadar nitrat dalam brokoli adalah 140-2300 mg/kg dan masuk kedalam penggolongan kadar nitrat kelas 2 (Walters, 1996).
Jumlah asupan yang diizinkan atau Acceptable Daily Intake (ADI) oleh FAO/WHO untuk berat badan 60 kg adalah 220 mg nitrat dan 8 mg untuk nitrit. Mengkonsumsi banyak sayur sangat dianjurkan, tetapi mengingat kandungan nitrat yang tinggi dalam sayuran perlu dipertimbangkan serta mengingat potensi pembentukan nitrosamin dari nitrit. Untunglah bahwa sayur - sayuran mengandung vitamin C yang mampu mencegah reaksi nitrosamin (Silalahi, 2005). Metode spektrofotometri sinar tampak adalah berdasarkan reaksi diazotasi dimana senyawa amin primer aromatik dikopling dengan N-(1-Naftil) etilendiamin dihidroklorida. Dengan adanya nitrit, maka nitrat yang direduksi menjadi nitrit maka akan menghasilkan senyawa berwarna ungu kemerahan yang dapat diukur secara spektrofotometri sinar tampak (Rohman, 2007; Miranda, et al., 2001).
1.2 Perumusan Masalah
Berdasarkan latar belakang di atas, maka perumusan masalah pada penelitian ini adalah:
a. Apakah terdapat pengaruh lama penyimpanan terhadap kadar nitrat dan nitrit dalam brokoli pada suhu kamar dan suhu lemari pendingin?
b. Apakah terdapat perbedaan kadar nitrat dan nitrit dalam brokoli yang disimpan pada suhu kamar dan suhu lemari pendingin?
1.3 Hipotesis
Berdasarkan perumusan masalah di atas, maka hipotesis pada penelitian ini adalah:
a. Ada perubahan pada kadar nitrat dan nitrit dalam brokoli yang disimpan pada suhu kamar dan suhu lemari pendingin.
b. Ada perbedaan kadar nitrat dan nitrit dalam brokoli yang disimpan pada suhu kamar dan suhu lemari pendingin.
1.4 Tujuan Penelitian
Tujuan dilakukannya penelitian ini adalah:
a. Untuk mengetahui perbedaan kadar nitrit dan nitrat yang terdapat dalam brokoli karena pengaruh suhu dan waktu penyimpanan.
1.5Manfaat Penelitian
PENGARUH SUHU DAN LAMA PENYIMPANAN TERHADAP
KADAR NITRAT DAN NITRIT DALAM BROKOLI
(Brassica oleracea. L)
ABSTRAK
Sayuran merupakan sumber utama paparan nitrat dalam makanan. Nitrat terbentuk secara alami di dalam tumbuhan melalui daur nitrogen. Nitrat memiliki efek racun yang rendah bagi tubuh manusia, namun nitrat dapat berubah menjadi nitrit dimana nitrit memiliki tingkat berbahaya yang lebih tinggi dibanding nitrat. Akumulasi nitrat dan nitrit didalam tubuh dapat menyebabkan kanker usus serta methaemoglobinaemia pada bayi berumur kurang dari 6 bulan. Faktor suhu dan lama penyimpanan dapat menyebabkan perubahan kadar nitrat dan nitrit. Tujuan penelitian ini adalah untuk mengetahui pengaruh suhu dan lama penyimpanan terhadap kadar nitrat dan nitrit pada brokoli.
Dalam penelitian ini sampel yang dianalisis adalah brokoli yang berasal dari pasar induk lau cih, Medan tuntungan. Sampel disimpan selama 0 jam, 6 jam, 12 jam, 24 jam, 30 jam dan 36 jam pada dua suhu penyimpanan yaitu suhu lemari pendingin (± 10°C) dan suhu kamar (± 30°C). Sampel dihaluskan, ditimbang, dipanaskan dan dilakukan metode analisis kualitatif dan kuantitatif. Analisis kualitatif nitrit dilakukan dengan menggunakan pereaksi asam sulfanilat dan N-(1-naftil) etilendiamin dihidroklorida dan dengan menggunakan pereaksi KMnO4 dan H2SO4 (p). Analisis kualitatif nitrat dilakukan dengan menggunakan pereaksi Serbuk Zn dan NaOH(e) dan dengan menggunakan pereaksi KI dan Asam Asetat. Penentuan kadar nitrit dilakukan secara spektrofotometri sinar tampak dengan menggunakan pereaksi asam sulfanilat dan pereaksi N-(1-naftil) etilendiamin dihidroklorida pada panjang gelombang maksimum 540 nm. Penentuan kadar nitrat dilakukan dengan cara mereduksi nitrat terlebih dahulu menjadi nitrit dengan menggunakan serbuk Zn kemudian diukur menggunakan spektrofotometri sinar tampak.
Hasil Penelitian menunjukan bahwa pada suhu kamar selama penyimpanan 0 jam sampai 36 jam, kadar nitrit meningkat dari kadar awal 1,53 mg/kg menjadi 1,75 mg/kg dan kadar nitrat dari penyimpanan 0 jam sampai 36 jam meningkat dari kadar awal 64,19 mg/kg menjadi 154,51 mg/kg. kadar nitrit suhu lemari pendingin selama penyimpanan 0 jam sampai 36 jam meningkat dari kadar awal 1,53 mg/kg menjadi 2,09 mg/kg dan kadar nitrat dari penyimpanan 0 jam sampai 36 jam meningkat dari kadar awal 64,19 mg/kg menjadi 113,06 mg/kg.
Kata Kunci : Brokoli, Nitrat, Nitrit, Spektrofotometri Sinar Tampak, Suhu dan
THE EFFECT OF TEMPERATURE AND STORAGE TIME
AGAINTS NITRATE AND NITRITE IN
BROCCOLI (Brassica oleracea. L)
ABSTRACT
Vegetables are the major source of nitrates in human intake. Nitrate occurs naturally in plant by nitrogen cycle. Nitrate has low level of acute toxicity, but it can be transformed into nitrite, which has much higher acute toxicity. Accumulation of nitrate and nitrite in the body can increase risk of colon cancer and methaemoglobinaemia in infants under 6 months of age. Temperature and storage time might changes in nitrate and nitrite level in vegetable. The purpose of this research is to investigate the effect of temperature and storage time againts nitrate and nitrite level in broccoli.
The sample were analyzed was broccoli which were obtained from Lau cih market, Medan Tuntungan. Samples were stored for 0 hours, 6 hours, 12 hours, 24 hours, 30 hours and 36 hours in separated storage condition, that is refrigerated (± 10° C) and room temperature (± 30° C). Sample which has been mashed, weighed and heated were subjected to qualitative and quantitative analysis. Qualitative analysis of nitrite was performed by using sulfanilic acid and N- (1-naphthyl) ethylenediamine dihydrochloride and using KMnO4 and concentrated H2SO4. Qualitative analysis of nitrate was performed using Zn powder and NaOH 0.2N solution and by using KI and Acetic Acid. Determination of nitrite level was conducted by using visible spectrophotometry method at maximum wavelength of 540 nm with addition of sulfanilic acid and N-(1-naphthyl) ethylenediamine dihydrochloride prior to analysis. Determination level of nitrate was conducted by reducing nitrate to nitrite first by using Zn powder, and then determination level of nitrite were performed as in the step of determining the reduced nitrite level.
The results show that nitrite level of broccoli stored in room temperature during 0 to 36 hours of storage increased from 1.53 mg / kg to 1.75 mg / kg and nitrate levels during 0 to 36 hours storage increased from 64.19 mg / kg to 154.51 mg / kg. Nitrite levels of broccoli storage from refrigerator temperature during 0 to 36 hours of storage increased from 1.53 mg / kg to 2.09 mg / kg and nitrate levels increased from 64.19 mg / kg to 113.06 mg / kg.
Key Words: Broccoli, Nitrate, Nitrite, Visible Spectrophotometry, temperature
PENGARUH SUHU DAN LAMA PENYIMPANAN TERHADAP
KADAR NITRAT DAN NITRIT DALAM BROKOLI
(Brassica Oleracea. L)
SKRIPSI
OLEH:
ALVIDA DWIJAYANTY
NIM 121501131
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGARUH SUHU DAN LAMA PENYIMPANAN TERHADAP
KADAR NITRAT DAN NITRIT DALAM BROKOLI
(Brassica Oleracea. L)
SKRIPSI
Diajukan Untuk Melengkapi Salah Satu Syarat
Untuk Memperoleh Gelar Sarjana Farmasi Pada Fakultas
Farmasi Universitas Sumatera Utara
OLEH:
ALVIDA DWIJAYANTY
NIM 121501131
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
PENGARUH SUHU DAN LAMA PENYIMPANAN TERHADAP
KADAR NITRAT DAN NITRIT DALAM BROKOLI
(Brassica oleracea. L)
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal : 16 Agustus 2016
OLEH:
ALVIDA DWIJAYANTY
NIM 121501131
Panitia Penguji,
Prof. Dr. Muchlisyam, M.Si., Apt. NIP 195006221980021001
Pembimbing I,
Dra. Tuty Roida Pardede.M.Si.,Apt NIP 195401101980032001
Dra. Tuty Roida Pardede.M.Si.,Apt NIP 195401101980032001
Pembimbing II,
Prof. Dr. Jansen Silalahi, M.App.Sc., Apt. NIP 195006071979031001
Dra. Sudarmi, M.Si., Apt. NIP 195409101983032001
Drs. Fathur Rahman Harun.M.Si.,Apt NIP 195201171980031002
Medan, September 2016 Fakultas Farmasi
KATA PENGANTAR
Puji syukur penulis ucapkan kepada ALLAH SWT atas segala limpahan karuniaNya, sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini, shalawat serta salam teruntuk Baginda Rasulullah Muhammad SAW sebagai suri tauladan dalam kehidupan. Skripsi ini disusun untuk melengkapi salah satu syarat mencapai gelar sarjana farmasi Pada Fakultas Farmasi Universitas Sumatera Utara, dengan judul Pengaruh Suhu dan Lama Penyimpanan terhadap Kadar Nitrat dan Nitrit dalam Brokoli (Brassica oleracea. L).
Penulis juga mengucapkan terimakasih dan penghargaan yang tiada terhingga kepada Ayahanda Apun Kristowo dan Ibunda Titin Inayah yang telah memberikan nasihat, motivasi, dukungan dan kasih sayang yang tidak terhingga dan tidak ternilai dengan apapun, pengorbanan baik materi maupun motivasi serta doa yang tulus yang tiada terhenti. Kakak ku tersayang Vika Wijayanty dan seluruh keluarga yang selalu mendoakan dan memberikan semangat.
Penulis juga mengucapkan banyak terima kasih kepada teman-teman sejawat yang telah memberikan bantuan dan semangat tak terhingga Maulani, Anggi, Dear, Haryati, Ayu, Rivaldo, Arief, Hafizan, dan semua teman-teman angkatan 2012 lainnya.
Penulis juga memberikan penghargaan setinggi-tingginya kepada seluruh rekan-rekan saya para asisten laboratorium kimia analisis kualitatif angkatan 2013 yang selalu menyemangati penulis hingga selesainya karya ini Dwi, Fachri, Syukur dan Erik.
Penulis menyadari bahwa dalam penulisan skripsi ini masih jauh dari kesempurnaan, oleh karena itu dengan segala kerendahan hati, penulis menerima kritik dan saran demi kesempurnaan skripsi ini. Akhirnya, penulis berharap semoga skripsi ini dapat memberi manfaat bagi kita semua.
Medan, 28 Juli 2016 Penulis,
SURAT PERNYATAAN
Saya yang bertanda tangan di bawah ini:
Nama mahasiswa : Alvida Dwijayanty Nomor Induk Mahasiswa : 121501131
Program studi : Sarjana Farmasi S-1 Reguler Farmasi
Judul skripsi : Pengaruh Suhu dan Lama Penyimpanan terhadap Kadar Nitrat dan Nitrit dalam Brokoli (Brassica
oleracea. L)
Dengan ini menyatakan bahwa skripsi yang saya buat adalah hasil karya saya sendiri, bukan plagiat dan apabila dikemudian hari diketahui skripsi saya ini plagiat karena kesalahan saya sendiri, maka saya bersedia menerima sanksi yang diberikan oleh Program Studi Sarjana Farmasi Universitas Sumatera Utara. Saya tidak akan menuntut pihak manapun atas perbuatan saya tersebut.
Demikianlah surat pernyataan ini saya buat dengan sebenarnya dalam keadaan sehat.
Medan, 28 Juli 2016
Yang membuat surat pernyataan,