LAMPIRAN A: DATA PERSENTASE KULTUR HIDUP (%)
Perlakuan Ulangan Total
LAMPIRAN B: PENGAMATAN BERAT BASAH KALUS (g)
Data Pengamatan Berat Basah Kultur Sebelum Ditransformasi
Perlakuan Ulangan Total Rataan
1 2 3 4 5 6
Data Pengamatan Berat Basah Kultur Setelah Ditransformasi (Y+0,5) Perlakuan
0,5
Ulangan
Total Rataan
1 2 3 4 5 6
A0B0 2,00 1,64 1,97 1,90 1,73 0,71 9,95 1,66 A0B1 1,34 0,71 0,71 0,71 0,71 0,71 4,89 0,82 A0B2 1,26 1,67 1,48 1,41 1,61 1,41 8,84 1,47 A0B3 1,10 1,41 1,64 1,58 1,41 1,41 8,55 1,43 A1B0 1,87 1,84 1,82 1,90 1,95 1,90 11,28 1,88 A1B1 1,22 1,73 1,73 1,61 1,10 1,22 8,61 1,44 A1B2 1,34 1,41 1,61 1,22 0,90 1,48 7,96 1,33 A1B3 1,55 1,05 1,64 1,92 1,58 1,10 8,84 1,47 A2B0 2,55 2,07 1,41 1,73 0,71 1,90 10,37 1,73 A2B1 1,14 1,10 0,71 1,58 1,58 1,51 7,62 1,27 A2B2 1,90 1,87 1,87 1,76 1,76 2,07 11,23 1,87 A2B3 1,48 0,71 0,89 0,71 0,89 1,00 5,68 0,95 A3B0 1,52 1,00 0,71 1,30 0,71 1,30 6,54 1,09 A3B1 1,67 1,10 1,90 1,14 1,14 1,92 8,87 1,48 A3B2 1,48 1,10 1,00 1,73 1,84 1,34 8,49 1,42 A3B3 1,41 1,41 1,90 1,22 1,10 0,71 7,75 1,29
Daftar Sidik Ragam Berat Basah Kultur
SK DB JK KT Fhit f5% f1%
Perlakuan 15 55490,77 3699,38 1,11tn 1,80 2,28 A 3 13921,18 4640,39 1,40tn 2,72 4,04 B 3 14114,41 4704,80 1,42tn 2,72 4,04 AB 9 27455,18 3050,58 0,92tn 1,99 2,64
Galat 80 265587,7 3319,85 - - -
Total 110 321094,30 - - - -
LAMPIRAN C: DATA PENGAMATAN WARNA KALUS
Data Pengamatan Warna kalus
Perlakuan Ulangan
1 2 3 4 5 6
A0B0 Putih Coklat Coklat Kuning Putih -
A0B1 Putih - - - - -
A0B2 Putih Putih Coklat Putih Kuning Coklat A0B3 Kuning Coklat Putih Coklat Putih Kuning A1B0 Kuning Kuning Coklat Coklat Kuning Coklat A1B1 Coklat Putih Putih Coklat Kuning Coklat A1B2 Putih Kuning Coklat Coklat Coklat Putih A1B3 Coklat Coklat Kuning Putih Kuning Coklat
A2B0 Kuning Coklat Kuning Coklat - Kuning
A2B1 Coklat Kuning - Kuning Kuning Coklat
A2B2 Kuning Putih Coklat Kuning Kuning Kuning
A2B3 Coklat - Coklat - Kuning Kuning
A3B0 Kuning Kuning - Coklat - Kuning
LAMPIRAN D: PERSENTASE WARNA KALUS
% Warna kalus = jumlah warna kalus
jumlah keseluruhan kalus yang hidup x 100%
Perlakuan Warna Kalus Total Kalus yang
Hidup Putih Kuning Coklat
A0B0 2 1 2 5
A0B1 1 0 0 1
A0B2 3 1 2 6
A0B3 2 2 2 6
A1B0 2 3 3 8
A1B1 2 1 3 6
A1B2 1 1 3 5
A1B3 0 2 3 5
A2B0 0 3 2 5
A2B1 1 3 2 6
A2B2 0 4 1 5
A2B3 0 2 2 4
A3B0 0 3 1 4
A3B1 0 4 2 6
A3B2 0 3 3 6
A3B3 0 4 1 5
TOTAL 14 37 32 83
LAMPIRAN E: DATA PENGAMATAN PERSENTASE KULTUR TERKONTAMINASI
Keterangan :
0 = Kalus terkontaminasi 0 = Kalus tumbuh
- = Kalus tidak tumbuh
% Kalus hidup = jumlah eksplan yang hidup
jumlah eksplan seluruh perlakuan x 100% = 8 x 100%
96 = 8,33 %
Perlakuan Ulangan Total
1 2 3 4 5 6
A0B0 0 0 0 0 0 1 1
A0B1 0 - - - 0
A0B2 0 0 0 0 0 0 0
A0B3 0 0 0 0 0 0 0
A1B0 0 0 0 0 0 0 0
A1B1 0 0 0 0 0 0 0
A1B2 0 0 0 0 0 0 0
A1B3 0 0 0 0 0 0 0
A2B0 0 0 0 0 1 0 1
A2B1 0 0 1 0 0 0 1
A2B2 0 0 0 0 0 0 0
A2B3 0 1 0 1 0 0 2
A3B0 0 0 1 0 1 0 2
A3B1 0 0 0 0 0 0 0
A3B2 0 0 0 0 0 0 0
LAMPIRAN F: KOMPOSISI MEDIA MS
Bahan Kimia Konsentrasi dalam Media (mg/l)
LAMPIRAN G: KOMPOSISI AIR KELAPA
- Sitrat, dan zat lain yang tidak diketahui - Skillo inositol 0,050 mg/l
Vitamin
- Asam nikotinat 0,040 mg/l - Asam pantotenat 0,520 mg/l - Biotin 0,020 mg/l
LAMPIRAN H: ALUR KERJA
Pucuk Andaliman
dipotong ± 2 cm dengan menggunakan pisau tajam dan steril dibersihkan dengan air mengalir hingga bersih
direndam dalam HgCl 100 mg/l dan dishaker pada 100 rpm selama 15 menit
dibersihkan dengan alkohol 70% selama 2 menit, dibilas dengan akuades
dimasukkan dalam larutan benlate 2 g/l yang ditetesi dengan tween 80 sebanyak 2 tetes kemudian dishaker selama 30 menit disterilkan dengan larutan klorox 20 dan 10% selama 10 menit lalu dibilas 3 kali dengan akuades steril
dikeringkan di atas kertas saring steril dalam cawan petri
Pucuk andaliman steril
ditumbuhkan pada media MS padat yang telah ditambahkan dengan zat pengatur tumbuh
Kultur pucuk andaliman
Inkubasi
DAFTAR PUSTAKA
Abidin, Z. 1983. Dasar-Dasar Pengetahuan Tentang Zat Pengatur Tumbuh. Bandung: Angkasa. hal. 14-15
Andayanie, L. 2000. Kajian Daya Insektisida Alami Nabati Kulit Buah Manggis (Garcinia mangostana. L), Buah Andaliman (Zanthoxylum acanthopodium DC.), Getah Gambir (Uncaria gambir Roxb.) dan Daun Teh (Camellia sintesis L.) terhadap perkembangan hama gudang Sitophilus zeamais Motsch. Skripsi. Bogor: Fakultas Teknologi pertanian IPB. hal. 36
Butar-butar, B. L. S. 1979. Mempelajari Sifat Difusitas Panas pada Tanaman Lada (Piper nigrum L.) dan Andaliman (Zanthoxylum acanthopodium DC.). Skripsi. Bogor: Fakultas Tekhnologi Pertanian IPB.
Caplin, S. M. and F. C. Steward. 1949. A Technique for the Controlled Growth of Excised Plant Tissue Liquid Media Under Aseptic Conditions. Nature. 163: 920-921
Chen, M., Y. Choi, D. F. Voytas, and S. Rodermel. 2000. Mutations in the Arabidopsis VAR2 locus cause leaf variegation due to the loss of chloroplast FtsH protease. Plant J. 22: 303-313
Evans, D. A. and W. R. Sharp. 1981. Plant Tissue Culture. New Jersey: Campbel Institute for Research and Technology
Fitriani, A. 2003. Kandungan Ajmalisin Pada Kultur Kalus Catharanthus roseus L. dan Setelah Dielisitasi Homogenat Jamur Pythium aphanidermatum Edson Fitzp. Makalah Pengantar Falsafah Sains. Bogor: Program Pascasarjana IPB. hal. 10
George, E. T. and P. D. Sherrington. 1984. Plant Propagation by Tissue Culture, Handbook and Directory of Comercial Laboratories. England: Exegetics Limited Eastern Press. pages. 262, 267, 271, 279
Gunawan, L. W. 1987. Teknik Kultur Jaringan. Laboratorium Kultur Jaringan Tanaman. Pusat Antar Universitas Bioteknologi. Bogor: Institut Pertanian Bogor. hal. 56-68
---. 1994. Teknik Kultur In Vitro Dalam Hortikultura. Jakarta: Penebar Swadaya. hal. 50.
---. 1995. Teknik Kultur Jaringan. Bogor: IPB. hal. 68, 69
Heddy, S. 1983. Hormon Tumbuhan. Jakarta: CV. Rajawali. hal. 3
Hendaryono, D. P. S. dan A. Wijayani. 1994. Teknik Kultur Jaringan. Yokyakarta: Kanisius. hal. 18-29,69
Hutami, S. dan P. Ragapadmi. 2003. Perbanyakan Klonal Temu Mangga (Curcuma mangga) Melalui Kultur In Vitro. Buletin Plasma Nutfah. 9(1): 39-44
Imelda, M. dan Aida W. 2007. Regenerasi Tunas dari Kultur Tangkai Daun Iles-iles (Amorphophallus muelleri). Biodiversitas. 9(3): 173-176
Jenimar. 1993. Penggunaan Zat Pengatur Tumbuh 2,4-D pada Perbanyakan Kentang Secara Kultur Jaringan. Skripsi. Medan: Fakultas Pertanian USU
Katuuk, J. R. P. 1989. Teknik Kultur Jaringan dalam Mikropropagasi Tanaman. Jakarta: Departemen Pendidikan dan Kebudayaan. hal. 75-106
Katzer. 2004. Sichuan Pepper (Zanthoxylum piperatum/simulans /bungeanum/rhetsa
/achanthopodium and others)
Keese, J. R., Rupert, E. A. and Carter, G. E. Physiologia Plantarum. An International Journal For Plant Biology. 81(4): 513-520
Kosmiatin, M. dan L. Mariska. 2005. Kultur Embrio dan Penggandaan Kromosom Hasil Persilangan Kacang Hijau dan Kacang Hitam. Jurnal Bioteknologi Pertanian. 10(1): 29-30
Kusumo, S. 1990. Zat Pengatur Tumbuh. Jakarta: Yasaguna. hal. 18
Mariska, I. 1996. Penyelamatan Embrio Hasil Persilangan Antara Panili Budidaya dan Panili Luar. Balitbio. 1(1): 1-5
Nugroho, A. dan Sugito, H. 2000. Pedoman Pelaksanaan Tehnik Kultur Jaringan. Cetakan 2. Jakarta: Penebar Swadaya. hal. 4
Nusmawarhaeni, S. Prihartini, D. dan Pohan, E.P. 2001. Membuat Tanaman Cepat Berbuah. Cetakan 16. Jakarta: Penebar Swadaya. hal. 24
Parhusip, A.J.N., P. Sibuea dan A. Tarigan. 1999. Studi Tentang Aktivitas Antimikroba Alami Pada Andaliman (Piper rebesioides Wall). Prosiding Seminar Nasional Teknologi Pangan. Jakarta 12-13 Oktober 2000. hal. 190-193. Bogor: Perhimpunan Ahli Teknologi Pangan Indonesia.
Pierik, R.L.M. 1987. In Vitro Culture Of Higher Plants. Netherland: Martinus Nijhoff Publisher. pages. 70, 197.
Priyono dan Agung, W. H. 2002. Respon Regenerasi In Vitro Eksplan Sisik Mikro Kerk Lily (Lilium longiflorum) Terhadap Ethyl Methane Sulphonate (EMS). Jurnal Ilmu Dasar. 3(20): 15-20
Purwati, R. D, Untung S. B. dan Sudarsono. 2008. Penggunaan Asam Fusarat dalam Seleksi In Vitro untuk Resistensi Abaka Terhadap Fusarium oxysporum f.sp. Cubense Jurnal Littri. 13(2): 64-72
Rahardja, P. C. 1994. Kultur Jaringan, Teknik Perbanyakan Tanaman Secara Modern. Jakarta: Penebar Swadaya. hal. 29
Robinson, T. 1995. Kandungan Organik Tumbuhan Tinggi. Edisi ke-6. Bandung: Institut Teknologi Bandung. hal. 225
Salisbury, F. B. dan Ross, C. W. 1995. Fisiologi Tumbuhan. Jilid ke-3. Edisi ke-4. Bandung: Institut Teknologi Bandung. hal. 1,6
Santoso. U. dan F. Nursandi. 1995. Kultur Jaringan Tanaman. Malang: UMM Press. hal. 1,105
Sastrosupadi, A. 1995. Rancangan Percobaan Praktis untuk Bidang Pertanian. Yokyakarta: Kanisius. hal. 53-65
Sibuea, P. 2002. Potensi Andaliman Sebagai Antioksidan Alami. http://www.compas.com. Diakses tanggal 13 April 2007
Siregar, B. L. 2003. Andaliman (Zanthoxylum acanthopodium DC.) di Sumatera Utara: Deskripsi dan Perkecambahan. Hayati. 10(1): 38
Soegihardjo, C.J. 1993. Bioteknologi Kultur Jaringan Tanaman. Yogyakarta: UGM Press. hal. 1-2
Steward, F. C. and S. M. Caplin. 1951. A Tissue Culture From Potato Tuber the Synergistic Action of 2,4 D and of Coconut Milk. Science. 111: 518-520 Sudarmadji. 2003. Penggunaan Benzil Amino Purine Pada Pertumbuhan Kalus Kapas
Secara In Vitro. Buletin Teknik Pertanian. 8(1): 8-10
Suryowinoto, M. 1996. Pemuliaan Tanaman Secara In Vitro. Jakarta: Kanisius. hal. 43
Tensiska. 2001. Aktivitas Antioksidan Ekstrak Buah Andaliman dalam Beberapa Sistem Pangan dan Kestabilan Aktivitasnya terhadap Kondisi Suhu dan pH. Thesis. Bogor: Program Pascasarjana IPB
Tjionger, M. 2006. Protephon 480 SL Biar Melon Cepat Masak dan Berkualitas. Tanindo.com/abdi 16/hal 1001/htm. Diakses tanggal 24 April 2007
Wetter, L. R. dan Constabel. 1991. Metode Kultur Jaringan Tanaman. Edisi ke-2. Terjemahan Mathilda B. Widianto. Bandung: ITB. hal. 3
Wijaya, C. H. 1999. Andaliman, Rempah Tradisional Sumatera Utara dengan Antioksidan dan Antimikroba. Teknologi dan Industri Pangan. 2(10): 59-61 ---. 2001. Isolasi dan Identifikasi Senyawa Trigeminal Aktif Buah
Andaliman (Zanthoxylum acanthopodium DC.). Hayati. 7(3): 91-92
Wuryaningsih, S. dan T. Sutater. 1993. Pengaruh Zat Pengatur Tumbuh Terhadap dan Pupuk N Terhadap Pertumbuhan dan Produksi Bunga Krisan Standard Warna Putih. Jurnal Holtikultural. 1(1): 47-56
Yusnida, B. 2006. Pengaruh Pemberian Giberelin (GA3) dan Air Kelapa Terhadap Perkecambahan Bahan Biji Anggrek bulan (Phalaenopsis amabilis BL.) secara in Vitro. Hayati. 2(2): 41-46
BAB 3
BAHAN DAN METODA
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan April tahun 2011 sampai Agustus tahun 2011 bertempat di Laboratorium Kultur Jaringan Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan.
3.2 Bahan dan Alat
Bahan tanaman yang digunakan dalam penelitian ini adalah primordial daun andaliman (Gambar 3.2.1) yang berasal dari desa Raya, Kabupaten Raya, Pematang Siantar. Bahan kimia yang digunakan adalah bahan-bahan penyusun media MS, zat pengatur tumbuh BAP dan atonik, agar, HgCL 100 mg/l, HCl 0,1N, NaOH 0,1N, air kelapa, glutamin, akuades, alkohol 70%, benlate 2 g/l, bayclin 10 dan 20%, tween 80. Alat-alat yang digunakan adalah botol kultur, pisau, gunting, pinset, autoklaf, neraca analitik, pemanas, shaker, gelas ukur, cawan petri, kertas saring, spatula, pipet tetes, pipet serologi, propipet, handsprayer, bunsen, pH meter, kertas pembungkus, aluminium foil, tissu gulung, kertas label, selotip, karet, entkas, dan rak kultur yang dilengkapi dengan lampu fluorescent (neon) 500 lux.
3.3 Metoda Penelitian
Penelitian ini menggunakan metode percobaan dengan Rancangan Acak Lengkap (RAL) faktorial dengan 2 faktor, yaitu:
Faktor 1 (A) : Perlakuan media ½ MS dengan penambahan ZPT Atonik A0
A
A2 A
: Konsentrasi 2 ml/l 3
Faktor 2 (B) : Perlakuan media ½ MS dengan penambahan ZPT BAP : Konsentrasi 3 ml/l
B0 B
: Konsentrasi 0 ml/l (sebagai kontrol) 1
Sehingga diperoleh kombinasi perlakuan 4 X 4 = 16 perlakuan : Konsentrasi 3 ml/l
Jumlah percobaan adalah 16 perlakuan, dengan masing-masing ulangan 6 X, sehingga jumlah total 96 botol.
3
Gambar 3.2.1 Tanaman Andaliman (Zanthoxylum acanthopodium D.C.)
3.4 Prosedur Kerja
3.4.1 Sterilisasi alat dan bahan
3.4.2 Pembuatan media
Media yang digunakan adalah media ½ MS dengan penambahan zat pengatur tumbuh Atonik dan BAP. Tahap awal pembuatan media adalah pembuatan larutan stok terlebih dahulu yaitu hara makro, mikro, iron, dan vitamin. Unsur-unsur lain ditimbang sesuai kebutuhan seperti sukrosa dan agar. Pembuatan media sebanyak 1000 ml.
Unsur-unsur hara makro, mikro, iron, vitamin, sukrosa, ZPT, glutamin 0,1 g/l dan air kelapa 150 ml/l dimasukkan ke dalam gelas piala dan ditambah dengan akuades sehingga volumenya menjadi 1000 ml. Pada media tersebut kemudian ditambahkan zat pengatur tumbuh atonik dan BAP. Keasaman media diukur dengan menggunakan pH meter sekitar 5,8. Untuk mendapatkan keasaman yang diharapkan, ditambah dengan HCl 0,1 N atau NaOH 0,1 N. Ke dalam media dimasukkan agar, lalu dipanaskan hingga larutan menjadi bening. Larutan tersebut kemudian dituang ke dalam botol kultur lalu ditutup dengan aluminium foil dan dikencangkan dengan karet gelang. Lalu media diautoklaf pada suhu 1210C dengan tekanan 17,5 psi selama 30 menit, lalu disimpan di ruang kultur lebih kurang selama 1 minggu sebelum digunakan.
3.4.3 Sterilisasi bahan
Eksplan berupa pucuk andaliman dipotong ± 2 cm dengan menggunakan pisau tajam dan steril, dibersihkan dengan air mengalir hingga bersih. Selanjutnya direndam dalam HgCl 100 mg/l dan dishaker pada 100 rpm selama 15 menit. Lalu dibersihkan dengan alkohol 70% selama 2 menit. Dibilas dengan akuades, kemudian dimasukkan dalam larutan benlate 2 g/l yang ditetesi dengan Tween 20 sebanyak 2 tetes kemudian dishaker selama 30 menit. Kemudian disterilkan dengan larutan klorox 20% selama
3.4.4 Penanaman eksplan
Penanaman eksplan dilakukan di dalam laminar air flow. Botol-botol berisi media yang sudah disterilkan, dibuka tutupnya dengan menggunakan pinset yang sudah dicelupkan pada alkohol dan telah dibakar. Disediakan juga 2 lampu bunsen untuk mencegah kontaminasi. Kemudian setelah tutup botol dibuka, bagian sekitar mulut botol dilewatkan di atas api bunsen untuk memperkecil kontaminasi. Lalu eksplan yang telah disterilkan, diambil dari dalam cawan petri dan dimasukkan ke dalam botol kultur dengan menggunakan pinset steril. Lalu botol kultur ditutup dengan aluminium foil dan disusun di rak kultur.
3.4.5 Pemeliharaan kultur pucuk
Eksplan yang telah ditanam di dalam botol kultur diletakkan pada rak pemeliharaan dengan kondisi ruangan yang steril, suhu berkisar antara 170C. Intensitas cahaya dengan penyinaran lampu neon 500 lux. Botol-botol yang berisi eksplan tersebut disusun dengan rapi sehingga memudahkan dalam pengamatan. Diupayakan ruangan dalam keadaan steril atau dengan menyemprotkan alkohol 70% setiap harinya sampai eksplan membentuk kalus atau planlet.
3.4.6 Parameter pengamatan
Parameter yang diamati dalam penelitian ini adalah: a. Pertumbuhan kultur pucuk andaliman
Pertumbuhan kultur pucuk andaliman diamati pada hari awal tumbuhnya kalus hingga akhir terbentuknya kalus.
b. Persentase kultur yang membentuk kalus (%)
persentase eksplan yang berkalus = jumlah eksplan yang berkalus
jumlah eksplan per berat basah kultur x 100% c. Berat basah kultur (g)
e. Persentase terkontaminasi (%)
persentase kultur terkontaminasi dihitung setiap hari sejak awal hingga akhir penelitian dengan rumus :
persentase terkontaminasi = jumlah eksplan yang terkontaminasi jumlah eksplan seluruh perlakuan
x 100%
3.5 Analisis Data
BAB IV
HASIL DAN PEMBAHASAN
4.1 Pertumbuhan Kultur Pucuk Andaliman
Dari pengamatan pertumbuhan kultur pucuk andaliman diperoleh kalus. Dimana kalus merupakan suatu kumpulan sel amorphous yang terjadi dari sel-sel jaringan awal yang membelah diri secara terus menerus. Dalam keadaan in vivo, kalus pada umumnya terbentuk pada bekas-bekas luka akibat serangan infeksi mikro organisme: Agrobacterium tumafaciens, gigitan atau tusukan serangga dan nematoda. Kalus juga
dapat terbentuk sebagai akibat stress. Dalam hal kalus sebagai akibat serangan bakteri Agrobacterium tumafaciens sering disebut sebagai tumor (George & Sherrington,
1984). Dalam kultur in vitro, kalus dapat dihasilkan dari potongan organ dalam media yang mengandung auksin dan juga sitokinin (Gunawan 1987).
Dari Pengamatan langsung hasil kultur pucuk andaliman pada media ½ MS dengan pemberian atonik dan BAP diperoleh bahwa pertumbuhan kalus dimulai pada minggu ke-2 sampai minggu ke-7 setelah penanaman. Kalus tersebut tumbuh dari bagian pucuk. Kalus dapat diinisiasi dari hampir semua bagian tanaman, tetapi organ yang berbeda menunjukkan kecepatan pembelahan sel yang berbeda pula. Bagian tanaman seperti: embrio muda, hipokotil, kotiledon dan batang muda merupakan bagian yang mudah untuk terdeferensiasi dan membentuk kalus (Gunawan, 1987). Hasil pengamatan kultur yang membentuk kalus ditampilkan pada Tabel 4.1.1.
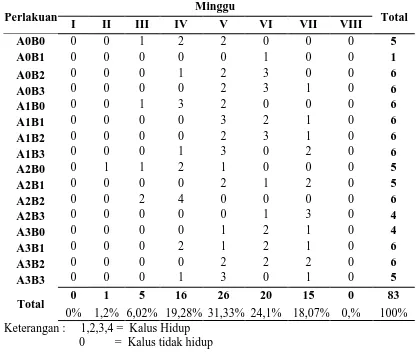
Tabel 4.1.1 Pertumbuhan kultur andaliman yang membentuk kalus per minggu
Perlakuan Minggu Total
I II III IV V VI VII VIII
Dari hasil penelitian ini dapat dilihat bahwa regenerasi tanaman belum diperoleh secara maksimal. Perbanyakan tanaman baik secara embriogenesis maupun organogenesis belum tercapai. Hasil yang dicapai masih dalam tahap inisiasi kalus.
Menurut Hartman et al. (2002), regenerasi tanaman pada kultur in vitro dapat terjadi melalui dua cara yaitu organogenesis dan embriogenesis somatik. Menurut Katuuk (1989), organogenesis tergantung pada hal berikut: media dan lingkungan, namun perbandingan zat pengatur tumbuh juga mempengaruhi derajat organogenesis.
4.2 Persentase kultur yang membentuk kalus
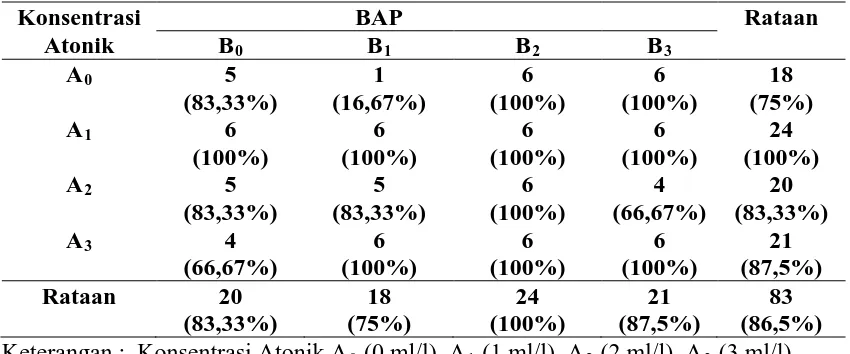
Persentase kultur yang membentuk kalus dari semua perlakuan adalah sebesar 86,5% yaitu sebanyak 83 botol dari 96 botol perlakuan (Lampiran A halaman 34). Persentase kultur yang hidup menunjukkan hasil yang fluktuatif untuk konsentrasi atonik dan BAP. Jumlah ini sudah dapat mewakili untuk menjelaskan pengaruh konsentrasi Atonik dan BAP terhadap pertumbuhan eksplan pucuk andaliman secara in vitro. Kultur yang hidup dapat diamati dengan ciri kalus segar, bernodul, terlihat kompak dan tidak berwarna kehitaman. Pengaruh perlakuan atonik dan BAP terhadap persentase kultur yang hidup ditampilkan pada Tabel 4.2.1.
Tabel 4.2.1 Persentase kultur yang membentuk kalus
Konsentrasi
Menurut Saptarini et al. (2001), atonik biasanya digunakan untuk merangsang pertumbuhan akar tanaman, meningkatkan daya serap daun, keluarnya bunga, pembentukan buah, dan meningkatkan jumlah dan bobot buah.
Sedangkan berdasarkan data kultur hidup pada perlakuan A0B1 memiliki jumlah kultur hidup yang paling sedikit yaitu 16,67%. Hal ini menunjukkan bahwa, kombinasi perlakuan atonik 0 ml/l dan BAP 1 mg/l kurang cocok untuk pertumbuhan kultur pucuk andaliman. Menurut Pierik (1987), zat pengatur tumbuh auksin dan sitokinin mampu menginduksi kalus apabila digunakan pada konsentrasi tinggi yaitu berkisar 2-10 mg/l, tetapi pada penggunaan konsentrasi tinggi mampu menghambat pembentukan akar. Golongan sitokinin yang umum digunakan adalah BAP karena telah diketahui lebih tahan terhadap kerusakan. Dan pada perbanyakan buah naga penggunaan atonik 4 ml/l mampu memacu pertumbuhan tunas.
Menurut Gunawan (1995) & Yusnita (2003), jenis dan konsentrasi zat pengatur tumbuh (ZPT) juga menentukan keberhasilan kultur jaringan. Menurut Heddy (1983), zat pengatur tumbuh mempunyai peranan yang penting terhadap pembelahan sel dan diferensiasi sel mulai perkembangan endosperm sampai perkecambahan biji pada fase vegetatif dan reproduktif.
Penggunaan zat pengatur tumbuh adalah untuk menambah kadar yang ada guna mempercepat pertumbuhan tanaman dengan harapan agar diperoleh hasil yang lebih cepat dan mungkin lebih besar (Kusumo, 1990). Pada kultur embrio, keberhasilan perkecambahan in vitro juga ditentukan oleh media dan zat pengatur tumbuh yang ditambahkan ke dalam media untuk menggantikan peran endosperma (Kosmiatin & Mariska, 2005).
4.3 Berat Basah Kultur (g)
pada kombinasi perlakuan yang memiliki berat basah kalus yang tertinggi pada A1B0 dan kombinasi perlakuan yang memiliki berat kalus yang terendah pada A0B1. Hasil rataan berat basah kalus dapat dilihat pada Tabel 4.3.1.
Tabel 4.3.1 Rata-rata Berat Basah Kalus (g) Pada Perlakuan Konsentrasi Atonik dan BAP
Dari Tabel 4.3.1 diperoleh hasil bahwa perlakuan A1B0 memiliki rataan berat basah kalus tertinggi yaitu sebesar 3,03 g, sedangkan pada perlakuan A0B1 memiliki rataan berat basah kalus terendah sebesar 0,22 g. Hal ini menunjukkan bahwa pada kombinasi perlakuan A1B0 (konsentrasi atonik 1 ml/l dan BAP 0 mg/l) merupakan kombinasi yang paling baik untuk pertumbuhan pada eksplan pucuk andaliman, ini ditandai dengan peningkatan berat basah kalus. Sedangkan kombinasi perlakuan A0B1 (konsentrasi atonik 0 ml/l dan BAP 1 mg/l) merupakan kombinasi yang kurang baik untuk pertumbuhan pada eksplan pucuk andaliman. Hal ini dapat diperjelas pada Gambar 4.3.2.
Gambar 4.3.2 Hubungan rata-rata berat basah kalus dengan kombinasi ZPT Keterangan : Konsentrasi Atonik A0 (0 ml/l), A1 (1 ml/l), A2 (2 ml/l), A3
Konsentrasi BAP B
(3 ml/l) 0 (0 mg/l), B1 (1 mg/l), B2 (2 mg/l), B3 (3 mg/l)
Menurut Hutami & Ragapadmi (2003), selain hara makro dan mikro dalam kultur in vitro zat pengatur tumbuh sitokinin dan auksin berperan dalam pertumbuhan dan morfogenesis. Keseimbangan zat pengatur tumbuh tersebut sangat berperan dalam pembentukan kalus. Sudarmaji (2003) melakukan penelitian terhadap tanaman kapas, dari penelitian dihasilkan bahwa penggunaan BAP 2 mg/l menghasilkan berat basah kalus tertinggi. Sedangkan Saptarini et al. (2001), atonik biasanya digunakan untuk merangsang pertumbuhan akar tanaman, meningkatkan daya serap daun, keluarnya bunga, pembentukan buah, dan meningkatkan jumlah dan bobot buah.
Menurut Pierik (1987), zat pengatur tumbuh auksin dan sitokinin mampu menginduksi kalus apabila digunakan pada konsentrasi tinggi yaitu berkisar 2-10 mg/l, tetapi pada penggunaan konsentrasi tinggi mampu menghambat pembentukan akar. Golongan Sitokinin yang umum digunakan adalah BAP karena telah diketahui lebih tahan terhadap kerusakan. Dan pada perbanyakan buah naga penggunaan atonik 4 ml/l mampu memacu pertumbuhan tunas.
4.4 Warna Kalus
yaitu persentase sebesar 44,58%, sedangkan untuk warna kalus coklat sebesar 38,55% dan untuk warna kalus putih sebesar 16,87% (Lampiran D halaman 38).
a b c
Gambar 4.4.1 Warna kalus pada kombinasi perlakuan Atonik dan BAP: (a) putih; (b) kuning; (c) coklat
Menurut Keese et al. (1991), kalus yang paling baik adalah kalus yang berwarna kuning karena kalus ini memiliki ciri-ciri kalus yang kompak dan bernodul serta bersifat embriogenik. Sedangkan kalus yang kurang baik adalah kalus yang berwarna coklat. Kalus yang berwarna putih dan kuning merupakan kalus yang berpotensi membentuk tunas. Untuk kalus yang berwarna coklat terjadi karena kalus mengalami penuaan dimana kalus tersebut cenderung mengeluarkan senyawa fenolat.
Menurut Fitriani (2003), bahwa warna kalus kekuningan dan kehijauan merupakan warna kalus yang bagus, dimana banyak kalus yang mengalami defferensiasi menjadi planlet, sedangkan warna coklat pada kalus menandakan sel mengalami cekaman karena luka pada jaringan selain cekaman dari medium itu sendiri, sehingga terjadi sintesis senyawa fenolat sebagai pertahanan sel tanaman tersebut.
4.5 Persentase Kultur Terkontaminasi (%)
Kultur yang bebas dari kontaminasi adalah salah satu yang penting dalam menentukan keberhasilan kultur in vitro. Data pengamatan persentase kultur yang terkontaminasi dapat dilihat pada Lampiran E halaman 39. Dari data tersebut dapat diketahui bahwa persentase kultur terkontaminasi sebesar 8,33 % yaitu sebanyak 8 botol dari 96 botol perlakuan.
Dari hasil data tersebut menunjukkan bahwa dalam proses kerja teknik kultur jaringan harus dilakukan secara aseptik, baik dari awal pembuaatan media, sterilisasi bahan tanaman yang akan digunakan sampai tahap pemeliharaannya. Dalam penelitian ini penyebab kontaminasi berasal dari eksplan yang digunakan. Dan kontaminasi lebih banyak disebabkan oleh jamur. Menurut Katuuk (1989), kontaminasi yang sering terjadi disebabkan oleh spora jamur yang ada di mana-mana, karena massa jamur yang ringan dan ukuran yang sangat kecil memungkinkan spora untuk berpindah hanya dengan gerakan udara yang lambat. Kontaminasi juga dapat berasal dari eksplan, organisme kecil yang masuk ke dalam media, botol-botol kultur serta alat-alat yang kurang steril, lingkungan kerja dan ruang kultur yang kotor, serta kecerobohan dalam pelaksanaan kultur jaringan.
Menurut Gunawan (1995), bahwa salah satu pembatas dalam keberhasilan kultur jaringan adalah kontaminasi. Kontaminasi dapat berasal dari eksplan, botol kultur, alat penanam yang kurang steril, lingkungan kerja dan ruang kultur yang kotor serta kecerobohan dalam pelaksanaan.
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari penelitian yang telah dilakukan, diperoleh kesimpulan sebagai berikut :
a. Pertumbuhan kultur andaliman yang membentuk kalus dimulai dari minggu ke-2 sampai minggu ke-7 setelah penanaman, dimana pertumbuhan kalus terbesar pada minggu ke-5 yaitu sebesar 31,33%.
b. Persentase kultur yang membentuk kalus dari semua perlakuan adalah sebesar 86,5% atau sebanyak 84 botol dari 96 botol.
c. Kombinasi atonik dan BAP memberikan pengaruh yang tidak nyata, namun pada perlakuan A1B0
d. Warna kalus yang dihasilkan adalah putih (16,87%), kuning (44,58%) dan coklat (38,55%).
(atonik 1 ml/l dan BAP 0 mg/l) memberikan pengaruh tertinggi terhadap berat basah kalus.
e. Persentase kultur yang terkontaminasi adalah sebesar 8,33% atau sebanyak 8 botol dari 96 botol.
5.2 Saran
a. Perlu dilakukan penelitian lebih lanjut untuk mengetahui konsentrasi Atonik dan BAP yang tepat guna memacu pengkulturan organ vegetatif pucuk tanaman andaliman (Zanthoxylum acanthopodium DC.) secara in vitro.
BAB 2
TINJAUAN PUSTAKA
2.1 Botani dan Manfaat Tanaman Andaliman
Andaliman (Zanthoxylum acanthopodium DC.) merupakan salah satu jenis rempah-rempah dari tumbuhan liar yang dikenal oleh masyarakat Batak Angkola dan Mandailing, Sumatera Utara. Tumbuhan ini merupakan jenis yang sangat dekat kekerabatannya dengan Zanthoxylum piperitum yang banyak ditemukan di daratan Cina serta Z. stimulans yang banyak dijual di Eropa (Hasairin, 1994). Di Indonesia, tumbuhan ini tumbuh liar di pegunungan dengan ketinggian 1400 m dpl pada temperatur 15-180 C. Asal tumbuhan ini dari daerah Himalaya Subtropis. Di dunia, tumbuhan ini tersebar antara lain di India Utara, Nepal, Pakistan Timur, Myanmar, Thailand, dan Cina. Di Cina, tumbuhan ini tumbuh pada ketinggian 2900 m dpl (Wijaya, 1999).
Menurut Hsuang Keng (1978 dalam Wijaya 1999) menyatakan bahwa sistematika tanaman andaliman adalah sebagai berikut:
Kingdom : Plantae
Divisio : Spermatophyta Klass : Angiospermae Sub klass : Dicotyledoneae Ordo : Rutales
Family : Rutaceae Genus : Zanthoxylum
Spesies : Zanthoxylum acanthopodium DC.
karena andaliman memiliki sifat karminativum (Hasairin, 1994). Khusus yang di Sumatera Utara mempunyai bunga lengkap dengan panjang ± 3 mm (Tensiska, 2001).
Famili jeruk-jerukan ini di habitatnya berupa tanaman semak dengan tinggi sekitar 5 meter (Sortha et al., 2004). Daunnya majemuk menyirip, panjang 1-20 cm dan lebar 3-15 cm, memiliki kelenjar minyak. Permukaan atas daun berwarna hijau mengkilat dan permukaan bawahnya hijau muda atau pucat, sedangkan pada daun muda permukaan bawahnya berwarna hijau kemerahan (Siregar, 2003; Wijaya, 1999). Bunga aksilar, majemuk terbatas, anak payung menggarpu, berkelamin dua, dan berwarna kuning pucat. Buah berbentuk kapsul, bulat hijau kecil, diameter 2-3 mm, mirip lada, jika sudah tua berwarna merah. Tiap buah memiliki 1 biji dengan kulit biji yang keras berwarna hitam berkilat (Sibuea, 2002). Tipe perkecambahan biji andaliman ialah epigin yakni tipe perkecambahan di atas tanah yang terjadi karena pembentangan ruas batang di bawah daun lembaga sehingga daun lembaganya terangkat ke atas tanah (Siregar, 2003).
Daya kecambah andaliman rendah. Perkecambahannya yang rendah dan umur berkecambah yang relatif lama disebabkan oleh struktur kulit biji yang keras. Struktur ini dapat menghalangi imbibisi air dan pertukaran gas dalam proses perkecambahan. Komponen volatil, berupa senyawa terpenoid yang terdapat pada andaliman (Wijaya 2001), diketahui merupakan senyawa penghambat perkecambahan. Tanaman yang tumbuh alami berasal dari biji yang disebarkan oleh burung (setelah memakan buah andaliman). Petani juga memperoleh bibit secara tidak sengaja dari lokasi bekas pembakaran gulma di daerah tanaman yang sudah tua (Siregar, 2003).
Andaliman mengandung senyawa terpenoid yang mempunyai aktivitas antioksidan yang sangat bermanfaat bagi kesehatan dan berperan penting untuk mempertahankan mutu produk pangan dari berbagai kerusakan seperti ketengikan, perubahan nilai gizi serta perubahan warna dan aroma makanan. Selain itu senyawa terpenoid pada andaliman juga dapat dimanfaatkan sebagai antimikroba. Hal ini memberikan peluang bagi andaliman sebagai bahan baku senyawa antioksidan atau antimikroba bagi industri pangan dan farmasi (Wijaya, 1999).
Hasil pengujian aktivitas antimikroba pada penelitian Andayanie (2000), menunjukkan bahwa ekstrak buah andaliman bersifat bakterisidal terhadap bakteri Bacillus stearothermophilus, Pseudomonas aeruginosa, Vibrio cholera, dan
Salmonella thypimurium. Selain itu andaliman juga mampu menghambat Bacillus
cereus, Staphylococcus aureus, dan S. thyposa. Dengan diketahuinya aktivitas
antimikroba dari minyak atsiri andaliman serta komponen aktif penyusunnya, maka pemanfaatan andaliman dapat ditingkatkan sebagai bahan obat-obatan (Butar Butar, 2002).
2.2 Teknik Kultur Jaringan
Kultur adalah budidaya, sedangkan jaringan adalah sekelompok sel yang mempunyai bentuk dan fungsi yang sama. Berarti kultur jaringan adalah suatu metode untuk mengisolasi bagian dari tanaman seperti protoplasma, sel, jaringan dan organ serta menumbuhkannya dalam kondisi aseptik, sehingga bagian-bagian tersebut dapat memperbanyak diri dan beregenerasi menjadi tanaman lengkap kembali (Gunawan, 1994). Kegunaan utama dari kultur jaringan adalah untuk mendapatkan tanaman baru dalam jumlah banyak dalam waktu yang relatif singkat, yang mempunyai sifat fisiologi dan morfologi sama persis dengan tanaman induknya (Hendaryono & Wijayani, 1994).
usaha perbanyakan vegetatif tanaman yang dapat dikatakan masih baru. Namun saat ini sudah banyak sekali penemuan-penemuan tentang ilmu pengetahuan kultur jaringan dalam bidang pertanian, biologi, farmasi, kedokteran, dan sebagainya (Hendaryono & Wijayani, 1994).
Menurut Katuuk (1989), kultur jaringan dapat membantu mengurangi perubahan-perubahan faktor lingkungan juga pengaruh negatif yang disebabkan oleh perubahan cahaya, suhu serta zat-zat hara dapat diatur. Selanjutnya kemampuan multiplikasi yang sangat cepat dari metode kultur jaringan memberi peluang bagi para pengusaha agar dapat menghemat waktu serta uang. Pengusaha yang memperbanyak tanaman dengan jalan stek jelas memerlukan waktu yang panjang. Bagi kultur jaringan hal ini tidaklah demikian.
2.3 Kultur Pucuk
Eksplan adalah bagian tanaman yang dijadikan bahan inokulum awal yang ditanam dalam media yang akan menunjukkan pertumbuhan dan perkembangan tertentu. Eksplan ini menjadi bahan dasar bagi pembentukan kalus yaitu bentuk awal calon tunas yang kemudian mengalami proses pelengkapan tanaman seperti daun, batang dan akar. Agar pertumbuhan bibit secara kultur jaringan berlangsung mudah, sebaiknya diambil sel yang berasal dari bagian yang meristem atau bagian tanaman yang masih muda, misalnya daun muda, ujung akar, dan keping biji. Bagian meristem dipilih karena bagian tersebut memiliki sifat pertumbuhan yang lebih cepat (Nusmawarhaeni et al., 2001).
Eksplan untuk kultur pucuk boleh berasal dari berbagai pucuk batang, baik pucuk apikal, pucuk lateral, maupun pucuk aksilar. Keuntungan menggunakan eksplan pucuk atau tunas aksilar adalah memungkinkan mengontrol tunas yang dihasilkan bebas virus, tanaman yang dihasilkan secara genetik seragam dan pada banyak tanaman laju perbanyakannya lebih tinggi (Katuuk, 1989).
proliferasi massa jaringan yang belum terdiferensiasi. Massa sel ini terbentuk pada seluruh permukaan irisan eksplan, sehingga semakin luas permukaan irisan eksplan semakin cepat dan semakin banyak kalus yang terbentuk (Hendaryono & Wijayani, 1994).
Dalam budidaya in vitro atau budidaya kultur jaringan, menginduksi terbentuknya kalus merupakan salah satu langkah penting. Setelah itu diusahakan rangsangan agar terjadi diferensiasi, terjadi akar dan tunas (Suryowinoto, 1996). Sebagai contoh dalam rangka kegiatan produksi metabolit sekunder dengan teknik kultur suspensi atau kalus maka sebagai langkah pertama untuk membuat inokulum perlu dibuat kalus sebagai starting material. Membuat kalus berarti menginduksi dari bagian tanaman tertentu. Biasanya dengan jalan dirangsang secara hormonal. Hormon yang banyak digunakan untuk induksi kalus berarti menginduksi dari bagian tanaman tertentu, biasanya dengan jalan dirangsang secara hormonal. Menyangkut macam eksplan, Santoso & Nursandi (1995) memperoleh hasil bahwa macam eksplan sangat mempengaruhi kecepatan membentuk kalus. Eksplan daun mempunyai kemampuan tumbuh lebih cepat dibandingkan eksplan batang utama, atau tangkai bunga (Santoso & Nursandi, 1995).
2.4 Media Kultur Jaringan
Mata rantai pertama dalam pelaksanaan kultur in vitro adalah persiapan media tanam. Dalam media tanam diberikan berbagai garam mineral, air, gula, asam amino, vitamin zat pengatur tumbuh, pemadat media untuk pertumbuhan dan perkembangan, dan kadang-kadang arang aktif untuk mengurangi efek penghambatan dari persenyawaan polifenol (warna coklat hitam) yang keluar akibat pelukaan jaringan pada jenis-jenis tanaman tertentu. Gula, asam amino, dan vitamin ditambahkan karena eksplan yang ditanam tidak lagi sepenuhnya hidup secara autotrof melainkan secara heterotrof atau mendapat suplai organik (Gunawan, 1995).
untuk jenis-jenis tanaman (Rahardja, 1994). Komponen media kultur antara lain air, hara makro dan mikro, gula, vitamin, asam amino, bahan organik lain, agar-agar sebagai pemadat media serta zat pengatur tumbuh (Yusnita, 2003).
Jenis medium pada komposisi unsur kimia yang berbeda dapat digunakan untuk media tumbuh dari jaringan tanaman yang berbeda. Untuk tanaman andaliman ini menggunakan media MS (Murashige dan Skoog), dimana media ini digunakan untuk hampir semua tanaman, terutama tanaman herbaceus. Media ini mempunyai konsentrasi garam-garam mineral yang tinggi dan senyawa N dalam bentuk NO3- dan NH4+ (Hendaryono & Wijayani, 1994).
2.5 Zat Pengatur Tumbuh
Zat pengatur tumbuh pada tanaman adalah senyawa organik bukan hara, yang dalam jumlah sedikit dapat mendukung, menghambat, dan dapat merubah proses fisiologis tanaman (Hendaryono & Wijayani, 1994). Menurut Heddy (1983), zat pengatur tumbuh mempunyai peranan yang penting terhadap pembelahan sel, dan diferensiasi sel mulai perkembangan endosperm sampai perkecambahan biji pada fase vegetatif dan reproduktif. Penggunaan zat pengatur tumbuh pada konsentrasi yang sesuai adalah untuk mempercepat pertumbuhan tanaman dengan harapan agar diperoleh hasil yang lebih cepat dan mungkin lebih besar (Kusumo, 1990).
Hormon tanaman itu sendiri terbagi dalam beberapa kelompok diantaranya: auksin, giberelin, sitokinin, etilen dan retardan (Tjionger, 2006). Pada kultur embrio, keberhasilan perkecambahan in vitro juga ditentukan oleh media dan zat pengatur tumbuh yang ditambahkan ke dalam media untuk menggantikan peran endosperm (Kosmiatin & Mariska, 2005).
perlu diperhatikan dalam penggunaan zat pengatur tumbuh adalah jenis zat pengatur tumbuh, konsentrasi, periode masa induksi dalam kultur tertentu (Gunawan, 1995).
2.5.1 Auksin
Auksin adalah suatu hormon tumbuh yang tidak terlepas dari proses pertumbuhan dan perkembangan suatu tanaman. Pengaruh auksin terhadap perkembangan sel menunjukkan bahwa terdapat indikasi yaitu auksin dapat menaikkan tekanan osmotik, meningkatkan permeabilitas sel terhadap air, menyebabkan pengurangan tekanan pada dinding sel, meningkatkan sintesa protein, meningkatkan plastisitas dan pengembangan dinding sel (Abidin, 1983).
Irvine et al. (1983 dalam Katuuk 1989), melakukan percobaan kultur jaringan pada tanaman tebu, menemukan bahwa 2,4-D paling banyak berpengaruh untuk inisiasi kalus. Untuk induksi kalus tanaman berdaun lebar 2,4-D banyak digunakan dengan konsentrasi 1-3 mg/l.
2.5.2 Sitokinin
Sitokinin adalah turunan dari adenine. Golongan ini sangat penting dalam pengaturan pembelahan sel dan morfogenesis. Seperti juga auksin, sitokinin ada yang alamiah dan sintetis. Sitokinin yang pertama kali ditemukan adalah kinetin, yang diisolasi dari DNA ikan Herring yang diautoklaf dalam larutan yang asam oleh Skoog di Laboratorium Botany University of Wisconsin. Persenyawaan dari DNA tersebut sewaktu ditambahkan ke dalam media untuk tembakau dapat memacu pembelahan sel atau sitokinesis. Sitokinin mempengaruhi proses fisiologi dalam tanaman. Sitokinin juga berpengaruh di dalam perkembangan embrio (Wattimena, 1988).
Menurut (Gunawan, 1995), menyatakan bahwa sitokinin yang biasa digunakan dalam kultur jaringan adalah:
Kinetin (6-furfuryl amino purine)
Zeatin (4-hydroxil-3-methyl-trans-2-butenyl aminopurine)
BAP/BA (6-benzyl amino purine/6-benzyl adenine) PBA
ZCl-4
2,6- Cl-4 PU ; N (2,6-dicloro-4 pyridyl)-N-phenylurea). Thidiazuron (N-phenyl-N-1,2,3-thiadiazol-5-tl-urea).
Menurut Wetter & Constabel (1991), sitokinin dibutuhkan bersama 2,4-D untuk mendapatkan pembentukan kalus yang baik. Golongan sitokinin yang umumnya digunakan adalah BAP karena telah diketahui lebih tahan terhadap kerusakan. BAP dan Thidiazuron adalah golongan sitokinin yang aktif.
2.5.3 Zat pengatur tumbuh atonik
Atonik adalah suatu zat pengatur tumbuh sintetik berbentuk larutan dalam air, berwarna cokelat dan berbau khas (Wuryaningsih, 1993). Atonik adalah gabungan garam-garam natrium dari S-nitroquiocol dan garam natrium dari paranitrophenol (Kusumo, 1990). Atonik mengandung zat aktif natrium orto nitrofenol, natrium paranitrofenol, natrium 2,4 di nitrofenol, dan natrium 5 nitroguaiakol (Saptarini et al., 2001).
Atonik bukan merupakan hormon tanaman (fitohormon) atau pestisida tetapi suatu zat kimia yang dapat merangsang proses biokimia dan fisiologis tanaman, sehingga atonik termasuk zat pengatur tumbuh (Kusumo, 1990). Atonik biasanya digunakan untuk merangsang pertumbuhan akar tanaman terhadap unsur hara, meningkatkan daya serap daun, keluarnya bunga, pembentukan buah, meningkatkan jumlah dan bobot buah (Saptarini et al., 2001)
2.6 Glutamin
(Yusnita, 2003). Karena glutamin merupakan penyimpan nitrogen yang utama pada tumbuhan dan juga mudah di sintesis oleh tumbuhan (Salisbury & Ross, 1991).
Glutamin berperan dalam metabolisme asam amino karena dapat menjadi pembawa amonia untuk sintesis asam-asam amino baru dalam jaringan (Hendaryono & Wijayani, 1994). Keberadaan asam amino dalam bentuk D-asam glutamat mempunyai berbagai pengaruh terhadap pertumbuhan dan metabolisme tumbuhan. (Robinson, 1991). Glutamin juga sangat penting untuk inisiasi dan perkembangan embrio somatik. Penambahan asam amino dapat merangsang terjadi-nya komunikasi di antara sel dan jaringan pada organ multiselular (Salisbury & Ross, 1991).
2.7 Induksi Kalus
Kalus adalah suatu kumpulan sel amorphous yang terjadi dari sel-sel jaringan awal yang membelah diri secara terus menerus. Dalam keadaan in vivo, kalus pada umumnya terbentuk pada bekas-bekas luka akibat serangan infeksi mikroorganisme seperti Agrobacterium tumefaciens, gigitan atau tusukan serangga dan nematoda. Kalus juga dapat terbentuk sebagai akibat stress (George & Sherrington, 1984).
Budidaya maristem atau embrio bertujuan untuk menumbuhkan kalus dari eksplan yang ditanam. Kalus ini biasanya muncul dari bagian periderm, periblem dan plerom, sepanjang tulang daun atau di antara tulang daun. Kalus sebenarnya adalah proliferasi massa jaringan yang belum terdeferensiasi. Massa sel ini terbentuk pada seluruh permukaan eksplan, sehingga semakin luas permukaan irisan eksplan semakin cepat dan semakin banyak kalus yang terbentuk (Hendaryono & Wijayani, 1994).
Dalam kultur in vitro, kalus dapat dihasilkan dari potongan organ dalam media yang mengandung auksin dan kadang-kadang juga sitokinin. Bila eksplan yang digunakan mengandung kambium, maka kalus dapat terbentuk tanpa perlakuan zat pengatur tumbuh. Pembentukan kalus pada eksplan yang ada kambium ini serupa dengan kejadian penyangkokan dan penyetekan (Gunawan, 1987).
Menurut Yusnida (2006), air kelapa merupakan endosperm dalam bentuk cair yang mengandung unsur hara dan zat pengatur tumbuh sehingga dapat menstimulasi perkecambahan dan pertumbuhan. Air kelapa sudah sejak dahulu digunakan sebagai campuran media. Ada yang melaporkan bahwa air kelapa muda lebih baik dari air kelapa tua, namun ada yang membuktikan sebaliknya. Konsentrasi air kelapa yang biasa digunakan adalah 7-15% (70-150 ml/l) (Katuuk, 1989), dapat juga sampai 200 ml/l (Hendaryono & Wijayani, 1994).
Pada air kelapa selain mengandung bahan makanan seperti asam amino, asam organik, gula dan vitamin juga terkandung sejumlah hormon tumbuh seperti sitokinin 5,8 mg/l, auksin 0,07 mg/l dan giberelin serta senyawa lain yang dapat memacu proses perkecambahan biji (Yusnida, 2006) selanjutnya dapat dilihat di Lampiran G halaman 41. Selain itu, air kelapa juga digunakan untuk merangsang pertumbuhan tanaman karena mengandung sejumlah besar zat-zat biokimia yang berperan untuk pertumbuhan tanaman, juga berfungsi sebagai suplemen karena dapat memacu pertumbuhan sel, jaringan, maupun organ pada tanaman, seperti biji dan akar pada teknik kultur jaringan (Katuuk, 1989).
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Andaliman (Zanthoxylum acanthopodium DC.) merupakan salah satu bumbu masakan yang memiliki potensi sebagai sumber antioksidan alami. Tanaman ini ditemukan tumbuh liar di daerah Tapanuli sebagai rempah pada masakan Batak Angkola dan Batak Mandailing. Sebagai rempah, andaliman memiliki keistimewaan seperti yang dinyatakan oleh Parhusip et al. (1999), bahwa masakan khas Batak yang menggunakan andaliman umumnya memiliki ketahanan yang lebih lama. Buah andaliman, rempah-rempah asli dari Sumatera Utara. Andaliman sering disebut sebagai “The Golden Spicy From North Sumatera”. Buah ini dipakai sebagai bumbu masakan dimana memberikan aroma yang khas (Katzer’s, 2004; Sibuea, 2002).
Andaliman secara umum belum dikenal masyarakat Indonesia. Walau telah diperdagangkan di luar daerah asalnya, namun masih hanya dikenal dan dipergunakan oleh kalangan terbatas. Padahal melihat keunikan sensorik yang dimiliki dan mungkin juga aktivitas fisiologisnya, bukan mustahil rempah ini dapat menjadi salah satu rempah yang berpotensi merebut peluang pasar ekspor. Untuk itu perlu ditunjang dengan informasi hasil penelitian ilmiah yang dapat dipertanggungjawabkan, disamping teknologi penanganan yang tepat sehingga diperoleh terobosan-terobosan produk yang mempunyai nilai ekonomi lebih (Wijaya, 1999).
Penulis menggunakan zat pengatur tumbuh atonik dan BAP pada media ½ MS. Menurut Imelda (2007), BAP sering digunakan karena BAP mempunyai efektivitas untuk perbanyakan tunas, mudah didapat dan harganya relatif murah. Selain itu BAP diketahui lebih tahan terhadap kerusakan (Wetter & Constabel, 1991).
dan bobot buah. Menurut Pranata (2010), penggunaan atonik 2 ml/l terhadap kultur kemenyan mampu menginisiasi pembentukan kalus dan memberikan pengaruh terbaik terhadap berat basah kalus
Secara konvensional, tanaman andaliman berkembangbiak melalui biji. Namun daya kecambahnya rendah dan umur untuk berkecambah benih cukup lama dan bervariasi, yaitu dari 24-100 hari setelah semai dengan persentase perkecambahan sebesar 17,5%. Usaha untuk memecahkan dormansi benih andaliman belum menunjukkan hasil yang konsisten. Biji yang dihasilkan setiap tanaman berjumlah banyak, namun biji tersebut belum tentu dapat berkecambah. Oleh karena itu dalam hal ini digunakan primordial daun andaliman dengan perbanyakan secara teknik kultur jaringan, karena dengan teknik kultur jaringan ini dapat diperoleh bibit yang banyak dalam waktu singkat, dan memiliki sifat genetika yang serupa dengan induknya bila dibandingkan menanamnya secara konvensional (Siregar, 2003).
Pada penelitan ini penulis menggunakan media ½ MS yang diperkaya dengan air kelapa, sebab media kultur merupakan salah satu faktor penentu keberhasilan perbanyakan tanaman secara kultur jaringan (Nugroho & Sugito, 2000). Media yang digunakan secara luas dalam kultur jaringan adalah media Murashige dan Skoog (MS) yang dikembangkan pada tahun 1962 (Gunawan, 1995). Media MS ini mengandung amonium dengan konsentrasi tinggi (20 mµ) serta kandungan nitrat dan kalsium yang tinggi dibandingkan dengan metode lainnya (Evans, 1981). Gunawan (1995) menyatakan bahwa, dari berbagai komposisi di media MS kadang-kadang dibuat modifikasi, misalnya hanya menggunakan setengah dari konsentrasi garam-garam makro yang digunakan (½ MS).
Selain ZPT, air kelapa sudah sejak dahulu digunakan sebagai campuran media. Penggunaannya dilaporkan oleh Ovenbeek pada tahun 1941 dalam mengkulturkan embrio tanaman Datura. Telah diselidiki bahwa air kelapa mengandung sejumlah komponen yang sangat berguna untuk pertumbuhan (Katuuk, 1989). Menurut Hendaryono & Wijayani (1994), menyatakan bahwa konsentrasi air kelapa yang biasa digunakan adalah 200 ml/l, dapat juga digunakan mulai 70-150 ml/l (Katuuk, 1989).
DC.), tetapi setelah peneliti melakukan percobaan pada kultur biji andaliman dengan menggunakan media ½ MS dengan penambahan GA (gibberelic acid) yaitu konsentrasi 0; 1,0; 1,5; dan 2 mg/l tetapi kultur tidak mau terinisiasi. Kemudian dilakukan percobaan lagi dengan perlakuan eksplan yaitu biji andaliman dibakar pada ranting-ranting tanaman andaliman yang kering, biji diskarifikasi, dan biji didinginkan di dalam lemari pendingin selama 1 jam dengan media yang sama tetapi kultur tetap juga tidak mau terinisiasi. Kemudian dilakukan lagi percobaan kultur biji andaliman dengan kombinasi ZPT, yaitu GA dengan konsentrasi 0; 1,0; 1,5; 2,0 mg/l dan BAP dengan konsentrasi 0; 1,0; 1,5; 2,0 mg/l tetap saja kultur tersebut tidak terinisiasi.
Setelah itu dilakukan lagi percobaan dengan menggunakan media ½ MS yang diperkaya dengan air kelapa sebanyak 150 ml dengan kombinasi GA 0; 0,5; 1,0; 1,5 mg/l, tetapi kultur biji andaliman juga tidak mau terinisiasi. Akhirnya dilakukan percobaan lagi dengan menggunakan media ½ MS diperkaya dengan air kelapa 150 ml dengan kombinasi ZPT 2,4 D dan BAP yaitu dengan masing-masing konsentrasi ZPT 0; 0,5; 1,0; 1,5 mg/l, tetapi kultur tetap juga tidak mau terinisiasi. Lalu dilakukan percobaan dengan media yang sama tetapi dengan ZPT NAA dan kinetin masing-masing konsentrasi 0; 0,5; 1,0; 1,5 mg/l, tetapi kultur tetap juga tidak mau terinisiasi.
Kemudian dilakukan lagi percobaan dengan menggunakan media ½ MS ditambah 150 ml air kelapa dan ditambah 2 ml atonik dengan kombinasi ZPT 2,4 D dan BAP masing-masing konsentrasi 0; 0,5; 1,0; 1,5 mg/l tetapi kultur tetap tidak terinisiasi. Akhirnya diganti dengan kombinasi ZPT kinetin dan BAP masing-masing konsentrasi 0; 0,5; 1,0; 1,5 mg/l tetap kultur tidak terinisiasi.
kombinasi atonik dan BAP masing-masing konsentrasi 0; 0,5; 1,0; 1,5 mg/l, tetapi kultur tetap juga tidak mau terinisiasi.
Berdasarkan pada percobaan-percobaan yang telah dilakukan, akhirnya eksplan biji andaliman diganti dengan menggunakan primordial daun andaliman yang dilkultur pada media ½ MS ditambah dengan 150 ml air kelapa dan 0,1 g/l glutamin dengan kombinasi ZPT atonik dan BAP masing-masing konsentrasi 0; 1,0; 2,0; 3,0 ml/l.
1.2 Permasalahan
Andaliman (Zanthoxylum acanthopodium DC.) merupakan rempah yang sangat bermanfaat terhadap kesehatan manusia serta memberi sifat-sifat ketahanan (pengawetan) pada makanan dan minuman. Namun rendahnya daya perkecambahan biji andaliman menjadi permasalahan dalam upaya pembudidayaannya. Untuk itu perlu dilakukan suatu cara untuk membudidayakan andaliman dengan tehnik kultur jaringan. Di dalam penelitian dilakukan pengkulturan organ vegetatif primordial daun andaliman dengan penambahan atonik dan BAP.
1.3 Tujuan Penelitian
Penelitian ini bertujuan mendapatkan formula terbaik dari kombinasi zat pengatur tumbuh atonik dan BAP terhadap pertumbuhan kultur primordial daun andaliman (Zanthoxylum acanthopodium DC.) pada media ½ MS yang diperkaya dengan air kelapa dan glutamin.
1.4 Hipotesis
1.5 Manfaat
ABSTRAK
Penelitian tentang ”Pengaruh Penambahan Atonik dan BAP (Benzil Amino Purin) Pada Media ½ MS Terhadap Kultur Primordial Daun Andaliman (Zanthoxylum
acanthopodium DC.)” telah dilakukan di Laboratorium Kultur Jaringan Tumbuhan
Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara dari bulan April 2011 sampai dengan bulan Agustus 2011. Penelitian yang bertujuan untuk mengetahui kombinasi atonik dan BAP terhadap pertumbuhan kultur primordial daun andaliman (Zanthoxylum acanthopodium DC.) ini menggunakan Rancangan Acak Lengkap Faktorial 2 faktor dengan 4 taraf atonik yaitu 0,0; 1,0; 2,0; 3,0 ml/l dan 4 taraf BAP yaitu 0,0; 1,0; 2,0; 3,0 mg/l. Hasil analisis statistik menunjukkan bahwa interaksi kedua zat pengatur tumbuh tersebut memberikan pengaruh yang tidak berbeda nyata terhadap berat basah kalus. Perlakuan yang terbaik berdasarkan berat basah kalus adalah atonik 1 ml/l dan BAP 0 mg/l. Pertumbuhan kultur yang membentuk kalus terbesar pada minggu ke-5 sebesar 31,33%. Persentase kultur yang membentuk kalus sebesar 86,5% dan menghasilkan kalus berwarna putih sebesar 16,87%, kuning 44,58% dan coklat 38,55%.
Kata kunci : Kultur Jaringan, Andaliman, Atonik, BAP
THE EFFECT OF ATONIC AND BAP (BENZIL AMINO PURIN) COMBINATION IN ½ MS MEDIA ON THE GROWTH OF THE LEAF
PRIMORDIAL TISSUE CULTURE OF ANDALIMAN (Zanthoxylum acanthopodium DC.)
ABSTRACT
The research of ”The Effect Atonic and BAP (benzil amino purin) Combination in ½ MS Media on The Growth of The Leaf Primordial Tissue Culture of Andaliman (Zanthoxylum acanthopodium DC.)” has been done in Plant Tissue Culture Laboratory, University of Sumatera Utara from April 2011 to August 2011. The aim of the research was to obtain the effect of atonic and BAP combination on the growth of the leaf primordial culture of Andaliman (Zanthoxylum acanthopodium DC.) using Complete Randomized Design, two factors which are 4 levels of atonic concentrations: 0.0; 1.0; 2.0; 3.0 ml/l and 4 concentrations of BAP: 0.0; 1.0; 2.0; 3.0 mg/l. The statistical analysis indicated that the interaction of Atonic and BAP give have no significant effect on the percentage of callus fresh weight. The best treatment of callus fresh weight found in media atonic 1ml/l and BAP 0 mg/l. The highest growth of culture to form callus the found on 5th week is 31,33%. Percentage of the culture to form callus is 86,5% and to produced white callus 16,87%, yellow 44,58% and brown 38,55%.
PENGARUH PENAMBAHAN ATONIK DAN BAP (BENZIL
AMINO PURIN) PADA MEDIA ½ MS TERHADAP KULTUR
PRIMORDIAL DAUN ANDALIMAN
(Zanthoxylum acanthopodium DC.)
SKRIPSI
SUSILAWATI
050805004
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PENGARUH PENAMBAHAN ATONIK DAN BAP (BENZIL
AMINO PURIN) PADA MEDIA ½ MS TERHADAP KULTUR
PRIMORDIAL DAUN ANDALIMAN
(Zanthoxylum acanthopodium DC.)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
SUSILAWATI 050805004
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : PENGARUH PENAMBAHAN ATONIK DAN BAP
(BENZIL AMINO PURIN) PADA MEDIA ½ MS TERHADAP KULTUR PRIMORDIAL DAUN ANDALIMAN (Zanthoxylum acanthopodium DC.)
Kategori : SKRIPSI
Nama : SUSILAWATI
Nomor Induk Mahasiswa : 050805004
Program Studi : SARJANA (S1) BIOLOGI
Departemen : BIOLOGI
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM (FMIPA) UNIVERSITAS SUMATERA
UTARA
Diluluskan di Medan, Mei 2012 Komisi Pembimbing :
Pembimbing II Pembimbing I
Dra.Isnaini Nurwahyuni, M.Sc Dra.Elimasni, M.Si
NIP. 19600523 198502 2 001 NIP. 1965024 199103 2 001
Diketahui/Disetujui oleh
Departemen Biologi FMIPA USU Ketua,
PERNYATAAN
PENGARUH PENAMBAHAN ATONIK DAN BAP (BENZIL AMINO PURIN) PADA MEDIA ½ MS TERHADAP KULTUR PRIMORDIAL DAUN
ANDALIMAN (Zanthoxylum acanthopodium DC.)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Mei 2012
PENGHARGAAN
Bismillahirrahmannirrahim,
Dengan segala kerendahan hati, puji dan syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan kesehatan, nikmat Iman, Islam dan Ikhsan serta karunia yang berlimpah yang telah diberikan, sehingga skripsi ini dapat diselesaikan.
Terima kasih penulis sampaikan kepada Dra. Elimasni, M.Si selaku Dosen Pembimbing I sekaligus Pembimbing Akademik dan Dra. Isnaini Nurwahyuni, M.Sc selaku Dosen Pembimbing II yang telah memberikan bimbingan, arahan dan masukan kepada penulis sehingga penelitian dan skripsi ini dapat diselesaikan. Kepada Dra. Emita Sabri, M.Si dan Drs. HM Zaidun Sofyan, M.Si sebagai dosen penguji yang telah memberikan masukan dan arahan dalam penyelesaian skripsi ini. Penulis juga tidak lupa mengucapkan terima kasih kepada Dr. Nursahara Pasaribu, M.Sc selaku Ketua Departemen Biologi FMIPA USU dan Drs. Kiki Nurtjahja, M.Sc selaku Sekretaris Departemen Biologi FMIPA USU. Terima kasih juga penulis sampaikan kepada Bapak/Ibu dosen Pengajar di Departemen Biologi FMIPA USU yang telah mendidik dan memberikan ilmu pengetahuan yang bermanfaat selama masa perkuliahan, serta Ibu Roslina Ginting, Abang Raswin, Ibu Nurhasni Muluk dan Alm.Sukirmanto selaku pegawai di Departemen Biologi. Ucapan terima kasih juga penulis tujukan untuk Dekan, Pembantu Dekan, dan seluruh pegawai FMIPA USU.
Skripsi ini penulis persembahkan untuk keluarga tercinta khususnya kedua orangtua, Ayahanda Samino dan Ibunda Suparmi terima kasih atas kasih sayang, rasa hangat, nasehat, bimbingan serta cinta yang tulus yang diberikan tanpa mengharapkan imbalan serta terima kasih atas doa, dukungan moral dan spiritual. Terima kasih penulis persembahkan kepada suami tercinta Briptu Endarianto, S.H atas doa, semangat, serta dukungan moral dan spiritual serta selalu ada disaat penulis butuh dorongan. Terima kasih juga penulis sampaikan untuk ananda tersayang Firdianto yang telah memberikan penulis semangat, serta menjadi pendorong sehingga skripsi ini dapat diselesaikan. Terima kasih juga penulis sampaikan untuk kedua mertua Suhardi dan Marsiyem serta adinda Rosmiati dan Purwanti. Penulis juga tidak lupa mengucapkan terima kasih untuk Paklek Sutrisno dan Buklek Wiwik Aminingsih, Mas Endar, adinda Arum Nur Indah Sari dan Sugiarto. Terima kasih atas bantuan, semangat, dukungan serta doanya.
terima kasih yang sedalamnya buat para peneliti di dunia atas segala informasi yang berharga. Semoga Tuhan Yang Maha Esa senantiasa membalasnya.
Penulis menyadari adanya ketidak sempurnaan dari skripsi ini maka dari itu penulis mengharapkan adanya kritik dan saran yang membangun dalam melengkapi kekurangan serta penyempurnaan skripsi ini. Penulis juga mengharapkan skripsi ini dapat berguna bagi penelitian selanjutnya. Akhir kata penulis mengucapkan terima kasih.
Medan, Mei 2012
ABSTRAK
Penelitian tentang ”Pengaruh Penambahan Atonik dan BAP (Benzil Amino Purin) Pada Media ½ MS Terhadap Kultur Primordial Daun Andaliman (Zanthoxylum
acanthopodium DC.)” telah dilakukan di Laboratorium Kultur Jaringan Tumbuhan
Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara dari bulan April 2011 sampai dengan bulan Agustus 2011. Penelitian yang bertujuan untuk mengetahui kombinasi atonik dan BAP terhadap pertumbuhan kultur primordial daun andaliman (Zanthoxylum acanthopodium DC.) ini menggunakan Rancangan Acak Lengkap Faktorial 2 faktor dengan 4 taraf atonik yaitu 0,0; 1,0; 2,0; 3,0 ml/l dan 4 taraf BAP yaitu 0,0; 1,0; 2,0; 3,0 mg/l. Hasil analisis statistik menunjukkan bahwa interaksi kedua zat pengatur tumbuh tersebut memberikan pengaruh yang tidak berbeda nyata terhadap berat basah kalus. Perlakuan yang terbaik berdasarkan berat basah kalus adalah atonik 1 ml/l dan BAP 0 mg/l. Pertumbuhan kultur yang membentuk kalus terbesar pada minggu ke-5 sebesar 31,33%. Persentase kultur yang membentuk kalus sebesar 86,5% dan menghasilkan kalus berwarna putih sebesar 16,87%, kuning 44,58% dan coklat 38,55%.
Kata kunci : Kultur Jaringan, Andaliman, Atonik, BAP
THE EFFECT OF ATONIC AND BAP (BENZIL AMINO PURIN) COMBINATION IN ½ MS MEDIA ON THE GROWTH OF THE LEAF
PRIMORDIAL TISSUE CULTURE OF ANDALIMAN (Zanthoxylum acanthopodium DC.)
ABSTRACT
The research of ”The Effect Atonic and BAP (benzil amino purin) Combination in ½ MS Media on The Growth of The Leaf Primordial Tissue Culture of Andaliman (Zanthoxylum acanthopodium DC.)” has been done in Plant Tissue Culture Laboratory, University of Sumatera Utara from April 2011 to August 2011. The aim of the research was to obtain the effect of atonic and BAP combination on the growth of the leaf primordial culture of Andaliman (Zanthoxylum acanthopodium DC.) using Complete Randomized Design, two factors which are 4 levels of atonic concentrations: 0.0; 1.0; 2.0; 3.0 ml/l and 4 concentrations of BAP: 0.0; 1.0; 2.0; 3.0 mg/l. The statistical analysis indicated that the interaction of Atonic and BAP give have no significant effect on the percentage of callus fresh weight. The best treatment of callus fresh weight found in media atonic 1ml/l and BAP 0 mg/l. The highest growth of culture to form callus the found on 5th week is 31,33%. Percentage of the culture to form callus is 86,5% and to produced white callus 16,87%, yellow 44,58% and brown 38,55%.
Bab 4 Hasil Dan Pembahasan 21
4.1 Pertumbuhan Kultur Pucuk Andaliman 21
4.2 Persentase Kultur Yang Membentuk Kalus 23
4.3 Berat Basah Kultur (g) 24
4.4 Warna Kalus 26
4.5 Persentase Kultur Terkontaminasi (%) 28
Bab 5 Kesimpulan Dan Saran 30
5.1 Kesimpulan 30
5.2 Saran 30
Daftar Pustaka 31
DAFTAR TABEL
Halaman
Tabel 4.1.1 Data Pengamatan Kultur Kalus Pucuk Andaliman 22 Tabel 4.2.1 Persentase Kultur Kalus Yang Hidup Terhadap Perlakuan 23
Atonik Dan BAP
DAFTAR GAMBAR
Halaman Gambar 3.2.1 Tanaman Andaliman (Zanthoxylum acanthopodium DC.) 17 Gambar 4.3.2 Hubungan Rata-rata Berat Basah Kalus Dengan Kombinasi 26
ZPT
DAFTAR LAMPIRAN
Halaman Lampiran A: Data Persentase Kultur Hidup (%) 34 Lampiran B: Pengamatan Berat Basah Kultur (g) 35 Lampiran C: Data Pengamatan Warna Kalus 37
Lampiran D: Persentase Warna Kalus 38
Lampiran E: Data Pengamatan Persentase Kultur Terkontaminasi 39
Lampiran F: Komposisi Media MS 40
Lampiran G: Komposisi Air Kelapa 41