Lampiran 1.Rataan umur perkecambahan (hari)
Lampiran 2.Rataan persentasi perkecambahan (%) Perlakuan
Lampiran 4. Sidik ragam dari persentasi perkecambahan (%) setelah di transformasi dengan √x + 0.5
SK Db JK KT Fhitung F5% F1%
Lampiran 5. Rataan kecepatan perkecambahan / Indeks Vigor (hari) Perlakuan
Lampiran 7. Sidik ragam dari rataan kecepatan perkecambahan/ Indeks Vigor (hari) setelah di transformasi dengan √x + 0.5
SK db JK KT F.hitung F5% F1%
Lampiran 8. Rataan laju perkecambahan / Germination Rate (hari) Perlakuan
Lampiran 9. Rataan laju perkecambahan / Germination Rate (hari) setelah di transformasi dengan √x + 0.5
Perlakuan BLOK Total Rataan
Lampiran 10. Sidik ragam dari rataan laju perkecambahan / Germination Rate (hari) Setelah di transformasi dengan √x + 0.5
SK db JK KT Fhitung F5% F1%
Lampiran 11. Rataan uji daya kecambah ( kecambah normal (%) Perlakuan Lampiran 12. Rataan uji daya kecambah (kecambah normal (%)) setelah di
Lampiran 13. Sidik ragam dari rataan uji daya kecambah (kecambah normal (%) setelah di transformasi dengan √x + 0.5
SK db JK KT Fhitung F5% F1%
Lampiran 14. Rataan uji daya kecambah ( kecambah abnormal (%) Perlakuan Lampiran 15. Rataan uji daya kecambah ( kecambah normal (%) setelah di
Lampiran 16. Sidik ragam dari rataan uji daya kecambah (kecambah abnormal (%)) setelah di transformasi dengan √x + 0.5
SK db JK KT Fhitung F5% F1% Blok 2 1.086 0.543 0.779 2.77 4.28 tn Perlakuan 7 16.989 2.427 3.483 3.74 6.51 tn P0 vs P1-P7 1 1.798 1.798 2.581 4.6 8.86 tn P1 vs P2-P7 1 2.398 2.398 3.442 4.6 8.86 tn P2-P3 vs P4-P7 1 0.658 0.658 0.945 4.6 8.86 tn P4-P5 vs P6-P7 1 8.225 8.225 11.804 4.6 8.86 ** P2 vs P3 1 2.900 2.900 4.162 4.6 8.86 tn P4 vs P5 1 0.562 0.562 0.807 4.6 8.86 tn P6 vs P7 1 0.447 0.447 0.642 4.6 8.86 tn
Galat 14 9.755 0.697
Total 23
Lampiran 18. Bagan penanaman di bak kecambah
32 cm
Ket. a : 5 cm b : 3 cm c : 1 cm d : 1 cm
X X X X X X X X X X
X X X X X X X X X X
X X X X X X X X X X
X X X X X X X X X X
X X X X X X X X X X
22 cm
a b
c
Lampiran 20. Gambar tanaman andaliman
Lampiran 21. Gambar benih andaliman
Buah Biji
Lampiran 22. Gambar fase perkecambahan
15 hari 18 hari 20 hari
Lampiran 23.Gambar penelitian di laboratorium
Lampiran 26.Gambar kecambah abnormal
P5 P5
P3 P4
P5 P5
DAFTAR PUSTAKA
Abidin, Z., 1983. Dasar-dasar Pengetahuan Tentang Zat Pengatur Tumbuh.Angkasa. Bandung. Hal:53-54.
Bewley J.D and Black M., 1983.Physiologi and Biochemistry of Seeds in Relation to Germination.Vol 2.Springer-Verlag.Berlin.
Chen, S.S.C. and J.L.L. Chang. 1972. Does Gibberellic Acid Stimulate Germination Via Amylase Synthesis.Plant Physiol 49:441-442.
Davies, P.J., 2004. Plant Hormones.Physiology, Biochemistry, and Molecular Biology.KluwerAcademic Publishers dengan perendaman dalam larutan Accu Zurr.Skripsi.Institut Pertanian Bogor. Bogor.
Gardner.F.P., R.B.Pearce dan R.L. Mitchell, 1991. Fisiologi Tanaman Budidaya terjemahan dari Physiiology of Crop Plants. Oleg Susilo, H. Universitas Indonesia, Jakarta.Hal 424.
Fahmi Z. I. 2012. Studi Perlakuan Pematahan Dormansi Benih Dengan Skarifikasi Mekanik dan Kimiawi.J. Balai Besar Perbenihan dan Proteksi Tanaman Perkebunan Surabaya.hlm : 3.
Harahap, N., 2007.Perkecambahan Benih Pasak Bumi (Eurycoma longifolia) Dengan Berbagai Perlakuan Pematahan Dormansi. Skripsi. Departemen Kehutanan Fakultas Pertanian Universitas Sumatera Utara, Medan.
Haryati, 2002.Pengaruh Perlakuan Pemanasan Pada Benih jati.Tesis S-2 Program Pasca Studi Agronomi kelompok Bidang Ilmu Ilmu Pertanian.Sekolah Pasca Sarjana. Universitas Sumatera Utara.
Hartmann, H.T., D.E. Kester, F.T. Davies, and R. L. Geneve., 2002.Plant propagation principles and practices.6th ed. Prentice Hall, Englewood cliffs, New Jersey.pp 198 199.
Kartasapoetra, A. G. 2003. Teknologi Benih. Bina Aksara. Jakarta.
Katzer,G. (2001). Spice Pages. Maret 01, 2016.
Maryani, A.T. 1998. Pengaruh Skarifikasi dan Giberellin terhadap Perkecambahan Benih dan Pertumbuhan Bibit Rotan Manau. Program Pasca Sarjana Universitas Andalas, Padang.
Maryani, A.T. dan Irafandri.2008. Pengaruh Skarifikasi dan Pemberian Giberellin
Miftakhurohmah dan Sintha, S. 2009. Potensi Andaliman Sebagai Sumber Antioksidan dan Antimikroba alami.Warta Penelitian dan Pengembangan Tanaman Industri, 15(2).
Nababan, E. N. W. (2012). Histoteknik Hati Mencit (Mus musculus L.) Strain DDW Setelah Pemberian Ekstrak Segar dan Ekstrak Etanol Buah Andaliman (Zanthoxylum acanthopodium DC.).Skripsi. Medan: Fakultas Farmasi.Universitas Sumatera Utara.
Napitupulu, B., Sortha, S., dan Mery, S., 2004.Potensi andaliman sebagai Food Additive tradisional etnis batak Sumatera Utara.BPTP Sumatera Utara.Medan, hlm. 53- 56.
Nuraeni dan M. S. Saleh.2006.Peningkatan Perkecambahan Benih Aren pada Berbagai Cara Ekstraksi Buah dan Pematahan Dormansi.Laporan Fakultas Pertanian UNTAD Palu.
Parhusip, A.J.N. 2006.Kajian Mekanisme Antibakteri Ekstrak Andaliman (Zanthoxylum acanthopodium D.C.) terhadap Bakteri Patogen Pangan.Disertasi. Sekolah Pascasarjana Institut Pertanian Bogor, Bogor. Sajad S, Hari S, Sri SH, Jusup S, Sugihharsono dan Sudarsono. 1975. Dasar-
Dasar Teknologi Benih. Biro Penataran.Institut Pertanian Bogor. Bogor
Salisbury, F.B dan Cleon W.Ross, 1995.Fisiologi Tumbuhan Terjemahan.Terjemahan dari Plant Physiology.Oleh Lukman D. R. dan Sumaryono ITB.Bandung hal.186.
Sastrosupadi, A., 1999. Rancangan Percobaan Praktis Bidang Pertanian. Kanisius, Jakarta.
Schmidth L. 2002. Pedoman Penanganan Benih Tanaman Hutan Tropis dan Subtropis. Jakarta: Direktorat Jendral Rehabilitasi Lahan dan Perhutanan Sosial Departemen Kehutanan.
Silvertown, J. 1999. Seed Ecology, Dormancy and Germination, A Modern Synthesis from Baskin and Baskin. J. Amer Bot.
Samosir, B. 2000.Pengaruh berbagai metode pemecahan dormansi terhadap perkecambahan benih andaliman.Skripsi.Universitas Katolik St.Thomas. Medan.
Sirait J. 1991. Penggunaan Kompos Dalam Pengecambahan Biji Andaliman (Piper ribesioides Wall).[Skripsi]. Medan: Unika St. Thomas.
Siregar, B.L. 2003. Andaliman (Zanthoxylum acanthopodium DC.) di Sumatera Utara: Deskripsi dan Perkecambahan. Hayati J. Biosci. 10:38-40.
Siregar, B.L. 2010. Upaya Perbanyakan Andaliman (Zanthoxylum acanthopodium DC.).VISI 18:17-28.
Siregar, B.L. 2012. Andaliman (Zanthoxylum acanthopodium DC) dan Potensi Pemanfaatannya. Media Unika 25:123-132.
Siregar, B.L. 2013. Perkecambahan dan Pematahan Dormansi Benih Andaliman (Zanthoxylum acanthopodium DC.). J.Argon. Indonesia 41 (3) :249-254. Sormin, R. N. 2010. Serapan Hara NPK dan Biomassa Mucuna dengan Perlakuan
Zat Pengatur Tumbuh dan Perbedaan Media Tanam.Skripsi.Departemen Budidaya Pertanian. Fakultas Pertanian. Medan.
Sutopo L. 2012. Teknologi Benih. Edisi Revisi. Rajawali Pers. Jakarta.
Sutopo, L. 2004. Teknologi Benih. Edisi Revisi. Cetakan ke-6.PT Raja Grafindo. Jakarta.
Tampubolon T. 1998. Usaha-usaha mengecambahkan biji andaliman (Piper ribesioides Wall).[Skripsi]. Medan: Unika St. Thomas.
Villiers, T.A., 1972. Seed Dormancy..Dalam Seed Biology. Ed. By T.T.Kozlowski. Vol. IIAcademic Pres.
Wijaya CH, Irene T.H, Anton A. 2002. Identification Of Volatile Compounds and Key Aroma Compounds Of Ndaliman Fruit
(Zanthoxylum acanthopodium DC). Food Sci.Biotechnol. 11 (6) : 680 – 683.
Wijaya, C. H. 1999. Andaliman, Rempah Tradisonal Sumatera Utara Dengan Aktivitas Antioksidan dan Antimikroba. Bul.Teknologi dan Industri Pangan.10(2).
Wijaya, C. H., Irene, T., dan Anton, A., 2001.Komponen Volatile
Karakterisasi Komponen Kunci Aroma Buah Andaliman (Zanthoxylum acanthopodium DC.).J. Teknol. dan Industri Pangan.
12(2).
BAHAN METODE PENELITIAN
Penelitian ini dilaksanakan di Laboratorium Teknologi Benih Fakultas Pertanian Universitas Sumatera Utara dengan ketinggian ± 25 m di atas permukaan laut. Penelitian ini dilaksanakan pada Bulan Mei sampai Agustus 2016.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah biji andaliman (Zanthoxylum acanthopodium DC.) yang telah diseleksi sebagai bahan percobaan, KNO3, giberelin (GA3) , serta H2SO4 1%, sebagai bahan untuk perlakuan
pematahan dormansi, aquadest sebagai bahan pelarut dan merendam biji, top soil kompos dan pasir sebagai media tanam, label digunakan untuk memberi tanda setiap perlakuan.
Alat yang digunakan dalam penelitian ini adalah bak kecambah plastik (seed bag) digunakan sebagai wadah media tanam biji, kertas pasir sebagai alat pelukaan biji, beaker glass sebagai wadah untuk perendaman biji, gelas ukur untuk mengukur kebutuhan pelarut dan bahan kimia yang digunakan, batang pengaduk yang digunakan untuk mengaduk larutan kimia yang diencerkan, stopwatch digunakan untuk mengukur waktu perendaman biji, kamera sebagai dokumentasi penelitian serta alat-alat lain yang mendukung dalam penelitian ini Metode Penelitian
Penelitian di Laboratorium menggunakan metode Rancangan AcakKelompok (RAK) non factorial dengan faktor perlakuan perbandingan berat yaitu:
P0 : Perlakuan Kontrol
P1 : Skarifikasi dengan kertas amplas, perendaman hingga 24 jam, air diganti P2 : Biji disiramdengan air panas 70oC dibiarkan hingga dingin selama 24
jam, air diganti
P3 : Bijidisiram dengan air panas 80oC dibiarkan hingga dingin selama 24 jam, air diganti
P4 :Perendamanbiji dengan 0.6 g KNO3L-l selama 24 jam dan giberelin 250
ppm selama5jam
P5 :Perendamanbiji dengan 0.6 gKNO3L-l selama 24 jamdan giberelin
500 ppm selama5 jam
P6 :Perendaman dengan H2SO4 1% selama 10 menit
P7 :Perendaman dengan H2SO4 1% selama 15 menit
Jumlah ulangan =3 ulangan
Jumlah unit percobaan = 24 unit percobaan Jumlah biji/unit percobaan = 20 biji
Jumlah biji seluruhnya = 480 biji Metode Data
Data hasil penelitian dianalisa dengan menggunakan sidik ragamberdasarkan model linier: Yij = μ + Ti + Bj + €ij
Ti = Pengaruh perlakuan ke-i. Bj = Pengaruh blok ke-j.
€ij = Pengaruh galat percobaan dari perlakuan ke-i dan ulangan ke-j
Jika hasil sidik ragam menunjukkan beda yang nyata, makadilanjutkan dengan uji kontras (Sastrosupadi, 1999).
K1 : P0 vs P1-P7 (tanpa perlakuan vs diberi perlakuan)
K2 : P1 vs P2-P7 (skarifikasi mekanikvspenyiraman air panasdan skarifikasi kimia)
K3 : P2-P3vs P4-P7 (penyiraman air panasvs skarifikasi kimia) K4 : P4-P5vs P6-P7 (KNO3dangiberelin vs H2SO4)
K5 : P2 vs P3 (air 70oC vs air 80oC)
K6 : P4 vs P5 (KNO3 dangiberelin 250ppmvs KNO3dan
giberelin 500 ppm)
PELAKSANAAN PENELITIAN
Persiapan wadah perkecambahan
Wadah perkecambahan yang digunakan dalam penelitian ini adalahbak kecambah plastik yang berukuran sedang yaitu 30 x 22 cm sebanyak 24 bakkecambah (seed bag).Bak perkecambahan yang digunakan dibersihkan darikotoran.
Persiapan media perkecambahan
Media perkecambahan yang digunakan adalah pasir steril, kompos dantop soil dengan perbandingan 1:2:2. Pasir yangdigunakan terlebih dahulu diayak dengan ayakan 10 mesh disterilkan dengan cara digonseng. Setelah itudimasukkan kedalam wadah perkecambahan dengan ketebalan ± 5 cm.
Seleksi biji
Pengambilan biji andaliman untuk penelitiaan ini berasal dari desa Tanjung Beringin Kabupaten Dairi, biji diambil dari 1 kebun tanaman andaliman yang didalam kebun tersebut terdapat + 10 tanaman andaliman dengan fenotip simanuk. Selanjutnya seleksi biji dilakukan sebelum perendaman biji dengan memasukkan benihke dalam air, benih yang tenggelam yang digunakan dalam penelitian, sedangkanbenih yang mengapung disingkirkan. Benih yang baik umumnya mempunyaiwarna yang kilat, bebas dari hama dan penyakit, tidak pecah kulitnya, tidak kisutdan tidak berjamur.
Pengenceran larutan kimia
Pembuatan larutan kimia yang digunakan untuk perendaman benihdilakukan dengan cara:
aquadest.
b. KNO3 diperoleh dengan cara melarutkan 0.6 gr KNO3 dalam 1000 mlaquadest.
c. Giberelin (GA3) 250 ppm dan 500 ppm diperoleh dengan cara melarutkan 0,25 g dan 0,5 dalam 1 literaquadest.
Pengamplasan kulit biji
Perlakuan pengamplasan kulit biji dilakukan pada permukaan kulit biji denganmenggunakan kertas amplaspengamplasankulit biji dilakukan tidak sampai melukai embrio biji tersebut.
Pemanasan Air
Perlakuan penyiraman biji, dengan memanaskan air hingga 700 dan 800 dengan mengunakan alat mengukur suhu yaitu termometer untuk mengukur suhu air yang yang diinginkan.
Perendaman biji
Perlakuan perendaman benih dilakukan dengan merendam biji yang telahdiseleksi. Perendaman dilakukan dengan cara skarifikasi dengan kertas amplas, perendaman hingga 24 jam, benih disiram dengan air panas 70oC dan dibiarkan dingin selama 24 jam, dan air diganti. Benih disiram dengan air panas 80oC dan dibiarkan hingga dingin selama 24 jam, dan air diganti. Perendaman biji dengan 0.6 g KNO3 selama24 jam, kemudian direndam dengan giberelin 250
dan500 ppm 5 jam.Perendaman dengan H2SO41% selama 10menit dan15 menit
Perkecambahan biji
dengankedalaman tanam ± 1cm. Perkecambahan biji ditunggu sampai 100 hari setelahperkecambahan.
Pemeliharaan
Penyiraman
Penyiraman air dilakukan pada saat biji dikecambahkan.Waktu penyiraman dikondisikan dengankeadaan media tanam.Apabila masih dalam keadaan lembab maka tidak perludilakukan penyiraman.
Pengendalian hama dan penyakit
Selama penelitian di laboratorium biji yang dikecambahkan terserangjamur, sehingga biji busuk dan tidak dapat berkecambah lagi. Pengendaliandilakukan dengan cara membuang biji yang terserang jamur dan menyemprotkanalkohol pada media disekitar biji berjamur tersebut.
Peubah Amatan
1. Umur Berkecambah (Hari)
Pengamatan ini dilakukan dengan menghitung jumlah hari yang dibutuhkan plumula untuk muncul kepermukaan media tanam.Pengamatan dimulai setelah benih dikecambahkan dengan rentang waktu 1 – 100 hari. Jika lewat dari 100 hari benih dikatakan tidak berkecambah.
2. Persentase Perkecambahan (%)
Persentase perkecambahan benih diamati dengan menghitung benih yang berkecambah pada setiap unit percobaan. Pengamatan dilakukan mulai dari hari pertama setelah benih dikecambahkan dengan rentang waktu 1 -100 hari. Jikalewat dari 100 hari benih dikatakan tidak berkecambah.
% Perkecambahan = Jumlah benih yang berkecambah
(Kuswanto, 1996).
3. Kecepatan Perkecambahan / Indeks Vigor( Benih Berkecambah/Hari)
Pengamatan ini dihitung tiap satuan percobaan berdasarkan persentase kecambah normal per etmal (hari) pada kurun waktu berkecambah dalam kondisi optimum berkecambah.
G1 + G2 + G3 + G4 +……..Gn D1 D2 D3 D4 Dn Keterangan :
V.I. : Indeks Vigor
G : Jumlah benih yang berkecambah pada hari tertentu D : Waktu yang bersesuaian dengan jumlah tersebut n :Jumlah hari pada penilaian / perhitungan akhir (Kartasapoetra, 2003).
4. Laju Perkecambahan / Germination Rate (Hari)
Menurut Sutopo (2004) laju perkecambahan dapat diukur dengan menghitung jumlah hari yang diperlukan untuk munculnya radikel atau plumula. Rata-rata hari = N1T1 + N2T2+….+NxTx
Jumlah total benih yang berkecambah
Dimana: N = jumlah benih yang berkecambah pada satuan waktu tertentu T = menunjukkan jumlah waktu antara awal pengujian sampai dengan akhir dari interval tertentu suatu pengamatan.
4. Uji Daya Kecambah
Analisa dayakecambah ataudaya tumbuh dilakukan setelah benih
dikecambahkan selama 30 hari dengan kondisi optimum. Menurut Sutopo (2012) untuk evaluasi kecambah digunakan kriteria sebagai berikut :
a. Kecambah normal (%).
Kriteria kecambah normal adalah :
1. Kecambah yang memiliki perkembangan sistem perakaran yang baik terutama akar primer dan untuk tanaman yang secara normal menghasilkan akar seminal maka akar ini tidak boleh kurang dari dua.
2. Perkembangan hipokotil yang baik dan sempurna tanpa ada kerusakan pada jaringan-jaringannya.
3. Pertumbuhan plumula yang sempurna dengan daun hijau dan tumbuh baik, di dalam atau muncul dari koleoptil atau pertumbuhan epikotil yang sempurna dengan kuncup yang normal.
4. Memiliki satu kotiledon untuk kecambah dari monokotil dan dua bagi dikotil.Perhitungan persentase kecambah normal sebagai berikut :
Kecambah normal = Jumlah kecambah
Jumlah contoh benih yang diuji b. Kecambah abnormal (%)
Kriteria kecambah abnormal adalah :
1. Kecambah yang rusak, tanpa kotiledon, embrio yang pecah, dan akar primernya yang pendek.
2. Kecambah yang bentuknya cacat, perkembangannya lemah atau kurang seimbang dari bagian-bagian yang penting. Plumula yang terputar, hipokotil, epikotil, kotiledon yang membengkok, akar yang pendek, koleoptil yang pecah atau tidak mempunyai daun, dan kecambah yang kerdil.
3. Kecambah yang tidak membentuk klorofil serta kecambah yang lunak
4. Untuk benih pohon-pohonan bila dari microphyl keluar daun dan bukannya akar.
Perhitungan persentase kecambah abnormal sebagai berikut : Kecambah abnormal = Jumlah kecambah abnormal
HASIL DAN PEMBAHASAN
Hasil
Berdasarkan hasil pengamatan dan sidik ragam penelitian menunjukkan bahwa pematahan dormansi dengan berbagai perlakuanberbeda nyata terhadap parameter yang diamati yaitu persentasi berkecambah (%), kecepatan perkecambahan (benih yang tumbuh/hari), laju perkecambahan (hari), uji daya kecambah kecambah normal (%), kecambah abnormal (%)tetapi untuk parameter umur berkecambah tidak uji lanjut kontras, karena tingginya persentasi kecambah yang tidak tumbuh, mempengaruhi dalam pengolahan data. Hasil pengamatan dan sidik ragam dapat di lihat pada Lampiran 1 sampai 16.
Umur Berkecambah ( Hari )
Hasil pengamatan menunjukkan bahwa pematahan dormansi dengan berbagai metode perlakuan menghasilkannilai rataan umur berkecambahyang berbeda. Hasil pengamatan umur berkecambah (hari) dapat dilihat pada lampiran 1.Rataan umur berkecambah (hari) dapat dilihat pada Tabel 1.
Tabel 1.Rataan Umur Berkecambah benih (hari) andaliman pada 100 HST Perlakuan Rataan+ S
Pada Tabel 1 dapat dilihat bahwa umur berkecambah tercepat terdapat pada perlakuanP7 yaitu perendaman H2SO4 1 % selama 15 menitdengan rataan18
yaitu penyiraman air panas 700C karena tidak terjadi perkecambahan sehingga nilai yang diperoleh yaitu 0 hari. Sedangkan pada perlakuan P1 skarifikasi mekanik dengan kertas pasir, P3 yaitu benih disiram air panas 800 C, P6 yaitu perendaman H2SO4 menunjukkan nilai rataan umur berkecambah yang lama juga
karena dalam 1 atau2 blok diperoleh rataan 0 hari, yaitu tidak terjadi perkecambahan.
Persentasi Perkecambahan (%)
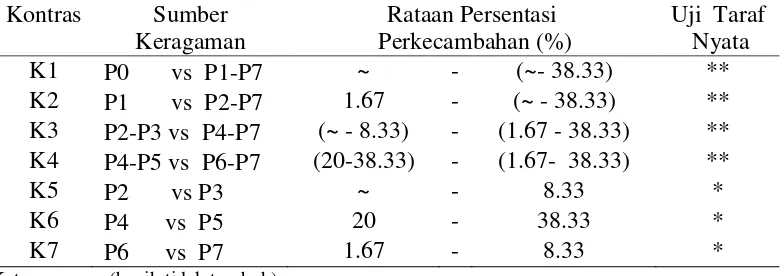
Hasil pengamatan dan sidik ragam menunjukkan bahwa pematahan dormansi dengan perbandingan antara perlakuan menunjukkanperbedaan terhadap persentasi perkecambahan(%). Hasil pengamatan dan sidik ragam presentasi perkecambahan (%) dapat dilihat pada Lampiran 2,3 dan 4. Rataan persentasi perkecambahan (%) dan hasil uji lanjut kontras dapat dilihat pada Tabel 2.
Tabel 2.RataanPresentasi Perkecambahan (%) biji andaliman pada beberapa perlakuan
Keterangan :~ (benih tidak tumbuh)
*(nyata pada taraf α 5%) **( sangat nyata pada taraf α 1%)
yang sangat nyata. Kontras K3 (P2-P3 vs P4-P7) yaitu perlakuanpenyiraman air panas dibandingkan perlakuan skarifikasi kimiamenunjukkan perbedaan yang sangat nyata dan kontras K4 (P4-P5 vs P6-P7) yaitu perlakuan KNO3 dengan
giberelin dibandingkan perlakuan H2SO4menunjukkan perbedaan yang sangat
nyata, sedangkan pada kontras K5 ( P2 vs P3) yaitu penyiraman air panas 700C dibandingkan air panas 800C, K6 (P4 VS P5) yaitu perlakuan KNO3 dengan
giberelin 250 ppm dibandingkan perlakuan KNO3 dengan giberelin 500 ppm dan
K7 (P6 vs P7) yaitu perlakuan H2SO4 1 % , 10 menit dibandingkan H2SO4 1 %
, 15 menit ketiga kontras menunjukkan perbedaan yang nyata.
Kecepatan Perkecambahan /Indeks Vigor(Benih Berkecambah/Hari)
Hasil pengamatan dan sidik ragam menunjukkan bahwa pematahan dormansi dengan perbandingan antara perlakuan menunjukkan perbedaan terhadap kecepatan perkecambahan /Indeks Vigor (benih berkecambah/hari).Hasil pengamatan dan sidik ragam kecepatan perkecambahan (benih berkecambah/hari) dapat dilihat pada lampiran 5,6 dan 7. Rataan kecepatan perkecambahan Indeks Vigor (benih berkecambah/hari)dan hasil uji lanjut kontras dapat dilihat pada Tabel 3.
Tabel 3.RataanKecepatanPerkecambahan /Indeks Vigor(benih berkecambah /hari) biji andaliman pada beberapa perlakuan
Kontras Sumber
**( sangat nyata pada taraf α 1%)
Dari Tabel 3 dapat diketahui bahwa pengamataan parameter kecepatan perkecambahan Indeks Vigor (benih berkecambah/hari)pada uji kontras K1 (P0 vs P1-P7) yaitu tanpa perlakuan dibandingkan seluruh perlakuan menunjukkan perbedaan yang nyata.Kontras K2 (P1 vs P2-P7) yaitu perlakuan skarifikasi mekanik dibandingkan perlakuanpenyiraman air panas dan skarifikasi kimia menunjukkan perbedaan yang nyata. Kontras K3 (P2-P3 vs P4-P7) yaitu perlakuan penyiraman air panas dibandingkan perlakuan skarifikasi kimia menunjukkan perbedaan yang sangat nyata. Kontras K4 (P4-P5 vs P6-P7) yaitu perlakuan KNO3 dengan giberelin dibandingkan perlakuan H2SO4 menunjukkan
perbedaan yang sangat nyata dan kontras K6 (P4 VS P5) yaitu perlakuanKNO3
dengan giberelin 250 ppm dibandingkan perlakuan KNO3 dengan giberelin 500
ppm menunjukkan perbedaan yang nyata.
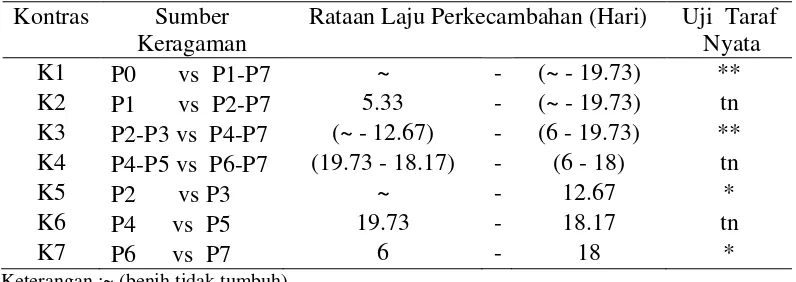
Laju Perkecambahan /Germination Rate (Hari)
Tabel 4.Rataan LajuPerkecambahan /Germination Rate (hari) biji andaliman pada beberapa perlakuan.
Kontras Sumber Keragaman
Rataan Laju Perkecambahan (Hari) Uji Taraf Nyata
Keterangan :~ (benih tidak tumbuh)
*(nyata pada taraf α 5%) **( sangat nyata pada taraf α 1%)
Dari Tabel 4 dapat diketahui bahwa pengamataan parameter laju
perkecambahan /Germination Rate (hari) pada uji kontras K1 (P0 vs P1-P7) yaitu tanpa perlakuan dibandingkan semua perlakuan menunjukkan perbedaan
yang sangat nyata. Kontras K3 (P2-P3 vs P4-P7) yaituperlakuan penyiraman air panasdibandingkan perlakuan skarifikasi kimia menunjukkan perbedaan yang sangat nyata. Kontras K5(P2vs P3) yaitu perlakuan penyiraman air 70oC dibandingkan air 80oC menunjukkan perbedaan yang nyatadan kontras K7 (P6 vs P7) yaitu perlakuan H2SO4 1 % , 10 menit dibandingkan H2SO4 1 % , 15 menit
menunjukkan perbedaan yang nyata. Uji Daya Kecambah
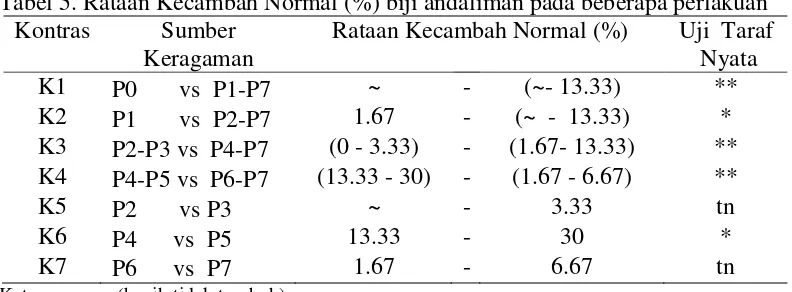
Kecambah Normal (%)
a. Kecambah perlakuan P3b. Kecambah perlakuan P5 Gambar 1. Kecambah Normal
Hasil pengamatan dan sidik ragam menunjukkan bahwa pematahan
dormansi dengan perbandingan antara perlakuan menunjukkan perbedaanterhadap parameter kecambah normal (%). Hasil pengamatan dan sidik
ragam kecambah normal (%) dapat dilihat pada lampiran 11,12 dan 13. Rataan kecambah normal (%) dan hasil uji lanjut kontras dapat dilihat pada Tabel 5. Tabel 5. Rataan Kecambah Normal (%) biji andaliman pada beberapa perlakuan
Kontras Sumber Keterangan :~ (benih tidak tumbuh)
*(nyata pada taraf α 5%)
**( sangat nyata pada taraf α 1%)
nyata.Kontras K4 (P4-P5 vs P6-P7) yaitu perlakuan KNO3 dengan giberelin
dibandingkan perlakuan H2SO4menunjukkan perbedaan yang sangat nyata dan
kontras K6 (P4 vs P5) yaitu perlakuan KNO3 dengan giberelin 250 ppm
dibandingkan perlakuan KNO3 dengan giberelin 500 ppm menunjukkan
perbedaan yang nyata. Kecambah Abnormal (%)
Kecambah abnormal dikatakan jika kecambah yang bentuknya cacat, perkembangannya lemah atau kurang seimbang dari bagian-bagian yang penting.Plumula yang terputar, hipokotil, epikotil, kotiledon yang membengkok, akar yang pendek, koleoptil yang pecah atau tidak mempunyai daun, dan kecambah yang kerdil.Gambar kecambah normal dapat dilihat pada Gambar 2.
Gambar 2. Perkecambahan abnormal
Hasil pengamatan dan sidik ragam menunjukkan bahwa pematahan dormansi dengan perbandingan antara perlakuan menunjukkan perbedaan terhadap parameter kecambah abnormal (%). Hasil pengamatan dan sidik ragam kecambah abnormal (%) dapat dilihat pada lampiran 14,15 dan 16. Rataan kecambah abnormal (%) dan hasil uji lanjut kontras dapat dilihat pada Tabel 6.
Kontras Sumber
Keterangan :~ (benih tidak tumbuh)
*(nyata pada taraf α 5%)
**( sangat nyata pada taraf α 1%)
Dari tabel 6 dapat diketahui bahwa pengamataan kecambah abnormal (%) pada uji kontras K4 (P4-P5 vs P6-P7) yaitu perlakuan KNO3 dengan giberelin
dibandingkan perlakuan H2SO4menunjukkan perbedaan yang sangat nyata.
Pembahasan
dormansi yang telah diketahui adalah perlakuan mekanis, perlakuan kimia, perlakuan perendaman dengan air, perlakuan pemberian temperatur tertentu dan perlakuan dengan cahaya.
Perbandingan perlakuan P1 yaitu skarifikasi mekanik dengan perlakuan P2-P7yaitu perendaman dengan air dan skarifikasi kimia menunjukkan perbedaan yang nyata terhadap parameter persentasi, kecepatan perkecambahan. Pada parameter laju perkecambahandan kecambah normal menunjukkan perbedaan yang sangat nyata. Pada persentasi perkecambahan perlakuan P1 dengan rataan 1.6 % lebih rendah dibandingkan perlakuan P2-P7 dengan rataan12.7 %. Sehingga dapat disimpulkan bahwa perlakuan P2-P7 yaitu penyiraman air panas dan skarifikasi kimialebih baik dibandingkan perlakuan P1 yaitu skarifikasimekanik dengan kertas pasir. Hal ini diduga karena struktur biji andaliman yang sangat kecil pada saat perlakuan skarifikasi mekanik dengan kertas pasir terjadi kerusakaan pada embrio sehingga tidak terjadi perkecambahan. Hal ini sesuai dengan Sutopo (2004) yang menyatakan bahwa pengikisan dengan kertas pasir merupakan salah satu cara untuk memecahkan dormansi benih yang disebabkan oleh struktur benih yaitu kulit benih yang keras. Oleh karena itu perlakuan skarifikasi ini tidak efektif dilakukan karena bji andaliman yang kecil, sangat sulit untuk diskarifikasi dan lebih mudah merusak bagian embrio biji terutama bagian titik tumbuh.
rataan 17.08 %. Pada parameter kecepatan perkecambahan dan uji kecambah normal menunjukkan perbedaan yang sangat nyata.Berdasarkan penjelasan diatas dapat disimpulkan bahwa perlakuan P4-P7skarifikasi kimia lebih baik dari perlakuan P2-P3penyiraman air panas. Perlakuan P2-P3penyiraman air panasbertujuan untuk meningkatkan permeabilitas kulit biji yang keras. Hal ini sesuai dengan Gardner dkk., (1991) yang menyatakan bahwa perendaman biji dalam air panas bertujuan untuk memperbaiki permeabilitas kulit benih sehingga dapat mempermudah masuknya air dan gas. Sehingga dapat meningkatkan persentasi benih berkecambah.Namun untuk biji andaliman dengan perlakuan penyiraman air panas dengan suhu 700C dan 800C masih menunjukkan persentasi perkecambahan yang rendah. Sedangkan pada perlakuan skarifikasi kimia membuat kulit biji menjadi lebih lunak sehingga dapat dilalui oleh air dengan mudah, karena perkecambahan biji sangat tergantung pada proses imbibisi.
Perlakuan P4-P5 yaituKNO3 dengan giberelin dibandingkan perlakuan
P6-P7 yaitu H2SO4 1 % menunjukkan perbedaan yang sangat nyata terhadap
persentasi perkecambahan, kecepatan perkecambahan, uji daya kecambah normal dan kecambah abnormal. Pada parameter persentasi perkecambahan perlakuan P4-P5 memiliki rataan sebesar 29.1% lebih tinggi dibandingkan perlakuan P6-P7 sebesar 5.8 %dan uji daya kecambah abnormal perlakuan P4-P5 memiliki nilai rataan 7.5 % lebih tinggi dibandingkan perlakuan P6-P7 dengan nilai rataan 0.8%.sehinggadapat disimpulkan bahwa perlakuan P4-P5 yaitu KNO3 dan
giberelin lebih baik dari perlakuan P6-P7yaitu H2SO4 1 %. Dikarenakan KNO3
perkecambahan. Menurut Davies (2004) menyatakan bahwa cara kerja giberelin dalam perkecambahan biji diawali dengan terjadinya imbibisi air merangsang sintesis giberelin, lalu giberelin tersebut berdifusi ke lapisan aleuron dan merangsang sintesis enzim. Selanjutnya enzim memecahkan amilim dan gula yang kemudian ditransportasikan ke embrio yang sedang berkembang.Sedangkan perlakuan H2SO4dengan konsentrasi pekat membuat kulit bijimenjadi lebih lunak
sehingga dapat dilalui air dengan mudah.Namun perlakuan H2SO4 belum optimal
dalam memecahkan dormansi biji andaliman.Diduga karena konsentrasi dan lamanya perendamansangat mempengaruhi proses perkecambahan, sifat zat ini sangat keras sehingga bisa mereduksi lapisan bahan dengan cepat. Hal ini sesuai dengan Fahmi (2012) yang menyatakan larutan asam kuat seperti H2SO4 sering
digunakan dengan konsentrasi yang bervariasi sampai pekat tergantung jenis benih yang diperlakukan.
Pemberian penyiraman air panas bertujuan untuk memperbaiki permeabilitas kulit benih sehingga dapat mempermudah masuknya air dan gas, sehingga dapat meningkatkan persentasi perkecambahan. Hal ini sesuai dengan Salisbury dan Ross ( 1995) yang menyatakan bahwa beberapa jenis perlu diberi perlakuan dalam air panas dengan tujuan meningkatkan permeabilitas.
Pada perlakuan P4 yaitu KNO3 dengan giberelin 250 ppm dibandingkan
dengan P5 yaitu KNO3 dengan giberelin 500 ppm menunjukkan perbedaan yang
nyata terhadap parameter persentasi perkecambahan, kecepatan perkecambahan laju perkecambahan dan uji daya kecambah normal. Perlakuan P4 memiliki persentasi perkecambahan 20 % lebih rendah dibandingkan perlakuan P5 dengan rataan 38.3 %.Dengan demikian kombinasi perlakuan KNO3 dan giberelin lebih
optimal meningkatkan perkecambahan pada pemberian giberelin 500 ppm. Hal ini dikarenakan senyawa KNO3 selain dapat mempercepat melunakkan kulit benih
yang keras, KNO3 juga berfungsi sebagai pengganti fungsi suhu dan mempercepat penerimaan oksigen pada benih, sehingga terjadi proses imbibisi dan benih dapat lebih mudah berkembang dan berkecambah. Hal ini sesuaidengan Kartasapoetra (2003), bahwa penggunaan zat kimia KNO3 sebagai pengganti
fungsi cahaya dan suhu serta untuk mempercepat penerimaan benih akan oksigen. Sedangkan giberelin merupakan hormon yang mampu mempercepat perkecambahan.Dan menurut Abidin (1983) yang menyatakan bahwa giberelin adalah hormon tanaman yang terlibat dalam pertumbuhan dan perkembangan tanaman, perpanjangan batang, pembungaan dan perkecambahan biji.
Perlakuan P6 yaitu H2SO4 1% selama 10 menit dibandingkan perlakuan P7
parameter persentasi perkecambahan dan laju perkecambahan. Perlakuan P6 memiliki persentasi perkecambahan 1.6 % lebih rendah dibandingkan perlakuan P7 dengan rataan 8.3 % dan pada parameter laju perkecambahan menunjukkan perbedaan yang nyata yaitu P6 memiliki rataan 6 hari lebih rendah dibandingkan perlakuan P7 dengan rataan 18 hari. Berdasarkan hal diatas dapat disimpulkan bahwa perlakuan P7 yaitu H2SO4 1% selama 15 menit lebih baik dalam
meningkatkan persentasi dan laju perkecambahan. Hal ini diduga karena larutan H2SO4 1% dapat menyebabkan kerusakan pada kulit biji, sehingga membantu
dalam proses imbibisi dan lamanya waktu perendaman juga sangat mempengaruhi perkecambahanbenih. Hal ini sesuai dengan Menurut Sadjad et al. (1975) perlakuan kimia seperti H2SO4 pada prinsipnya adalah membuang lapisan lignin
pada kulit biji yang keras dan tebal sehingga biji kehilangan lapisan yang permiabel terhadap gas dan air sehingga metabolisme dapat berjalan dengan baik.Akan tetapi apabila terlalu berlebihan dalam hal konsentrasi atau lama waktu perlakuan dapat menyebabkan kerusakan embrio,sehingga benih tidak berkecambah.
Pada pengamatan parameter umur berkecambah, diamati sampai 100 hari dari awal penanaman, jika lewat 100 hari benih dikatakan tidak berkecambah. Pada parameter umur berkecambah ini tercepat pada perlakuan P7 yaitu H2SO4 1% selama 15 menit
dengan rataan 18 hari, tidak jauh berbeda dibandingkanperlakuan P5 yaitu KNO3 dengan
giberelin 500 ppm dengan rataan 18.1 sedangkan umur berkecambah terlama terdapat pada perlakuan P0 yaitu kontrol dan P2 yaitu penyiraman air panas 700C karena tidak terjadi perkecambahan. Sedangkan pada perlakuan P1 skarifikasi mekanik, P3 yaitu benih disiram air panas, P6 yaitu perendaman H2SO4 menunjukkan nilai rataan umur
Berdasarkan penjelasan diatas dapat disimpulkan bahwa umur berkecambah terbaik pada perlakuan P7 yaitu H2SO4 1% selama 15 menit mampu mempercepat umur
KESIMPULAN DAN SARAN
Kesimpulan
1. Pematahan dormansi pada benih andaliman (Zanthoxylum acanthopodium DC.) dengan pemberian perlakuan terbukti dapat meningkatkan daya kecambah.
2. Skarifikasi kimia dengan KNO3 dan giberelin 500 ppm merupakan
perlakuaan yang terbaik untuk meningkatkan persentasi perkecambahan yaitu 38.33 % dan uji daya kecambah normal 30 %.
3. Perlakuan H2SO4 1% selama 15 menit mampu mempercepat umur
perkecambahan andaliman hingga 18 hari. Saran
Diperlukan percobaan dengan meningkatkan konsentrasi KNO3 dan
TINJAUAN PUSTAKA
Menurut Hsuan Keng (1978) dalam Wijaya (1999), kedudukan taksonomi andaliman adalah sebagai berikut: Kingdom : Plantae, Divisio : Spermatophyta, Klass : Angiospermae, Sub klass : Dicotyledoneae, Ordo : Rutales, Family : Rutaceae, Genus : Zanthoxylum, Spesies : Zanthoxylum acanthopodium DC.
Bentuk dari tanaman andaliman yaitu semak atau pohon kecil bercabang
rendah, tegak, tinggi mencapai 5 m.Batang, cabang, dan ranting berduri (Siregar, 2003).
Sistem akar tunggang dimana tumbuh menjadi akar pokok yang bercabang menjadi akar yang lebih kecil dan sedikit berbulu halus diseluruh permukaannya (Parhusip, 2006).
Tumbuhan ini tumbuh pada ketinggian 2900 m dpl. Di Indonesia,tumbuhan ini tumbuh liar pada daerah dengan ketinggian 1.200 - 1.400 m dpl pada temperatur 15 - 18 oC (Wijaya, 1999). Di Sumatera Utara tanaman ini tumbuh liar pada berbagai tempat, yaitu di daerah Angkola, Mandailing, Humbang, Silindung, Dairi dan Toba Holbung (Parhusip, 2006).
Di sekitar kawasan Danau Toba Sumatera Utara terdapat tiga jenis varietas tanaman andaliman yaitu :
1. Sihorbo-tanaman andaliman dengan bentuk buah besar, kurang aromatic dan produksi rendah.
2. Simanuk-tanaman andaliman dengan bentuk buah kecil, aroma dan rasa lebih tajam dari sihorbo danproduksi lebih tinggi.
3. Sitanga-tanaman dengan aroma buah sangat tajam hingga mirip bau kepinding alias tanga, produksi tinggi, namun kurang disenangi masyarakat sampai sekarang.
( Parhusip, 2006). Dormansi
Benih dikatakan dorman apabila benih tersebut sebenarnya hidup tetapi tidak berkecambah walaupun diletakkan pada keadaan yang secara umum dianggap telah memenuhi persyaratan bagi suatu perkecambahan.Dormansi pada benih dapat berlangsung selama beberapa hari, semusim, bahkan sampai beberapa tahun tergantung pada jenis tanaman dan tipe dari dormansinya (Sutopo, 2012).
terbentuknya zat pengatur tumbuh atau karena ketidakseimbangan antara zat penghambat dengan zat pengaturtumbuh di dalam embrio (Hartmann,et. al, 2002; Villiers, 1972).
Menurut Silvertown (1999), dormansi terbagi atas beberapa tipe yaitu tipe endogenus, berhubungan dengan keadaan embrio, dan tipe eksogenus, berhubungan dengan endosperm atau jaringan-jaringan lain pada benih atau buah. Tipe dormansi endogenus terbagi atas tiga bagian, yaitu 1) dormansi endogenus yang disebabkan oleh hambatan fisiologi embrio, 2) dormansi endogenus yang disebabkan oleh tidak berkembangnya embrio secara sempurna atau disebut juga morphological dormancy 3) dormansi endogenus yang disebabkan oleh gabungan kedua sebab di atas yang disebut juga morphophysiological dormancy. Tiga tipe dormansi eksogenus adalah 1) physical dormancy, yang disebabkan oleh impermiabilitas benih atau kulit benih terhadap air, 2) chemical dormancy yang disebabkan oleh senyawa penghambat perkecambahan, 3) mechanical dormancy yang disebabkan oleh struktur keras dari benih yang menghalangi pertumbuhan kecambah.
Dipandang dari segi ekonomis terdapatnya keadaan dormansi pada benih dianggap tidak menguntungkan. Oleh karena itu diperlukan cara agar dormansi dapat dipecahkan atau sekurang-kurangnya lama dormansinya dipersingkat. Beberapa cara yang telah diketahui adalah perlakuan mekanis, perlakuan kimia, perlakuan perendaman dengan air, perlakuan pemberian temperatur tertentu dan perlakuan dengan cahaya (Sutopo, 2012).
Skarifikasi
pada benih yang ditujukan untuk mematahkan dormansi dan mempercepat terjadinya perkecambahan benih yang seragam.Skarifikasi (pelukaan kulit benih) adalah cara untuk memberikan kondisi benih yang impermeabel menjadi permeabel melalui penusukan; pembakaran, pemecahan, pengikiran, dan penggoresan dengan bantuan pisau, jarum, pemotong kuku, kertas, amplas, dan alat lainnya (Schmidth, 2002).
Perlakuan mekanis umum dipergunakan untuk memecahkan dormansi benih yang disebabkan oleh impermeabilitas kulit biji baik terhadap air atau gas, resistensi mekanis yang terdapat pada kulit biji. Perlakuan mekanis yang dilakukan yaitu dengan mengikir atau menggosok kulit biji dengan kertas ampelas yang bertujuan untuk melemahkan kulit biji yang keras, sehingga lebih permeabel terhadap air atau gas (Sutopo, 2004).
Hasil penelitian perlakuan pengampelasan dapat lebih meningkatkan perkecambahan benih pasak bumi (E. longifolia) jika dibandingkan dengan perlakuan yang lainnya. Pada perlakuan pengampelasan proses perkecambahan menjadi lebih cepat dan persentase perkecambahan yang diperoleh lebih tinggi, perlakuan pengampelasan menghasilkan umur berkecambah tercepat yaitu 14,00 hari setelah tanam, dan menghasilkan nilai rataan tertinggi pada parameter persentase perkecambahan (66,67 %) dan kecepatan perkecambahan (0,57). Dengan perlakuan pengampelasan, kulit biji menjadi semakin tipis yang akan mempermudah masuknya air dan gas sehingga terjadi proses imbibisi dan semakin cepat pula benih dapat menembus kulit biji dalam melakukan proses perkecambahan ( Harahap, 2007).
tetapi skarifikasi pada bagian pangkal biji dekat dengan embrio menyebabkan air lebih mudah menembus kulit biji sehingga mempercepat perkecambahan dan skarifikasi juga dapat dilakukan dengan penipisan kulit endokarp pada seluruh permukaan biji sampai kelihatan endosperm biji yang menghalangi masuknya air ke dalam benih.Skarifikasi pada bagian pangkal biji harus dilakukan dengan hatihati jangan sampai embrio rusak (Meerow, 2004).
Perendaman KNO3
Perlakuan dengan menggunakan bahan-bahan kimia sering pula dilakukan untuk memecahkan dormansi pada benih. Tujuannya adalah menjadikan agar kulit biji lebih mudah dimasuki oleh air pada waktu proses imbibisi. Menurut Kartasapoetra (2003), penggunaan zat kimia KNO3 sebagai pengganti fungsi cahaya dan suhu serta untuk mempercepat penerimaan benih akan O2.
Pada Casuarianaequiaetifolia perkecambahan meningkat dari 46% dalam kontrol menjadi 65%setelah perendaman dalam 1,5% KNO3 selama 36 jam. Pada percobaan ini, konsentrasi tertinggi dan terendah dan lamanya waktu perendaman yang sangatsingkat memperlihatkan perkecambahan yang sangat rendah.Konsentrasi danlamanya waktu perendaman mempengaruhi tingkat kerusakan pada biji.Semakintinggi dan semakin lama waktu perendaman maka kerusakan biji juga semakintinggi (Schmidth, 2002).
Bila benih aren direndam KNO3 selama 36 jam + suhu 40oC selama 5 menit menghasilkan daya berkecambah 60-80 % (Nuraeni dan Saleh, 2006). Perendaman Giberelin
cahaya, seperti benih Latuca sativa; (2) benih yang dihambat oleh cahaya, seperti benih Phacelia tanacetifolia; (3) benih yang membutuhkan stratifikasi, seperti Corylus avellana L.; (4) benih yang membutuhkan after-ripening (penyimpanan pada temperatur ruang dalam kondisi kering), seperti benih Avena fatua L. (Chen dan Chang, 1972).
Penelitian menggunakan giberelin dalam mematahkan dormansi banyakdilakukan menurut Sormin (2010) juga melaporkan bahwa biji mucuna yangdirendam dalam zat pengatur tumbuh GA3 300 ppm mampu menghasilkanperkecambahan sebesar 66%. Hasil penelitian Sugiharti dalam Maryani (1998) melaporkan bahwa pemberian giberellin dengan konsentrasi 50 ppm mampu memberikan daya kecambah benih rotan manau yang terbaik, yaitu 85,55% dan apabila konsentrasi giberellin ditingkatkan menjadi 75 ppm dan 95 ppm menyebabkan daya kecambah semakin menurun (Maryani dan Irfandri, 2008).
Perendaman H2SO4
Larutan asam sulfat pekat (H2SO4) menyebabkan kerusakan pada kulit biji
dan dapat diterapkan baik pada legum dan non legum.Lamanya perlakuan larutan asam harus memperhatikan dua hal yaitu kulit biji atau pericarp dapat diretakkan untuk memungkinkan imbibisi dan larutan asam tidak mengenai embrio. Perendaman selama 1 – 10 menit terlalu cepat untuk dapat mematahkan dormansi, sedangkan perendaman selama 60 menit atau lebih dapat menyebabkan kerusakan (Schimdt, 2000 dalam Winarni , 2009).
Perendaman benih jati dalam H2SO4 pada konsentrasi 70%, 80%, dan 90%
tinggi dari kontrol. Hal ini dikarenakan kombinasi perlakuan ini lebih optimal dan lebih cepat untuk melunakkan kulit benih dari pada benih yang hanya direndam dalam air pada lama perendaman yang sama (Suyatmi et al., 2011).
PenyiramanAir Panas
Beberapa jenis benih perlu diberi perlakuan dalam air panas denga tujuan meningkatkan permeabilitas ( Salisbury dan Ross, 1995).
Perendaman biji dalam air panas bertujuan untuk memperbaiki permeabilitas kulit benih sehingga dapat mempermudah masuknya air dan gas. Sehingga dapat meningkatkan preentasi biji berkecambah. Telah dilaporkan bahwa pemanasan biji legum pada suhu 1000C selama 5-20 detik dapat menyebabkan terbukanya pleurogram dan menghasilkan perkecambahan 95-100 % ( Olivere dkk., 1982 dalam Gardner dkk., 1991).
PENDAHULUAN
Latar Belakang
Andaliman (Zanthoxylum acanthopodiumDC.) adalah tanaman rempah liar di Sumatera Utara. Buahnya biasa digunakan sebagai bumbu masakan ikan dan daging. Buah andaliman mengandung senyawa aromatik dengan rasa pedas dan getir yang khas serta hangat. Saat ini andaliman diperhitungkan menjadi sumber senyawa aromatik dan minyak esensial yang mempunyai aktivitas mikroba (antijamur, antibakteri) penolak dan membunuh serangga, antioksidan dan antitumor. Pemanfaatan andaliman dapat lebih ditingkatkan tidak lagi sekedar bumbu masakan tradisional.Hal ini memberi peluang bagi andaliman sebagai bahan baku senyawa antioksidan atau antimikroba bagi industri pangan dan industri farmasi (Siregar, 2012).
Buah andaliman mengandung senyawa polifenolat, monoterpen dan seskuiterpen sertakuinon.Selain itu juga terdapat minyak atsiri seperti geraniol, linalool, cineol dan citronella yang menimbulkan kombinasi bau mint dan lemon (Sinaga, 2009).Ekstrak andaliman diketahui juga mengandung flavonoid, alkaloid, terpenoid dan steroid (Nababan, 2012).
Indonesia danZ. acanthopodiumDC di bagian timur Himalaya, Cina, Asia Tenggara, danSumatera (Katzer, 2001).
Selain dijual di pasar tradisional, seperti pasar Senen Jakarta dengan harga Rp 50.000/kg, buah andaliman juga diekspor ke Amerika Serikat, dengan harga US$ 14,99/ons atau setara dengan Rp 140.990/ons (Miftakhurohmah dan Sintha, 2009).
Populasi andaliman masih sangat terbatas, kira-kira 1000 – 2000 pohon , dengan produksi 7 – 10 kg per pohon/tahun pada tanaman dewasa. Bibit yang diperoleh petani berasal dari hutan, karena benih andaliman tidak mau berkecambah walau pun kondisi tempat tumbuhnya sudah optimal.Dibudidayakan dengan sistem pekarangan.Rata-rata petani yang menanam andaliman 1 – 5 batang (Napitupulu, et al., 2004).
Perkecambahan andaliman sampai saat ini masih sangat rendah. Sirait (1991) memperoleh daya kecambah 0-3.6% dengan perlakuan kontrol dan
pembenaman benih andaliman dalam kompos; Tampubolon (1998) memperoleh daya kecambah dengan perlakuan kontrol 0%, pembenaman dalam kompos 0%,
perendaman dalam air 0%, perendaman dalam giberelin 6.9-14.4%; Samosir (2000) memperoleh daya kecambah dengan perlakuan kontrol 6%,
perendaman dalam larutan giberelin 0-3%, perendaman dalam larutan KNO3
perkecambahan benih andaliman mencapai 36.25% pada 63.31 hari setelah pengecambahan.
Perkecambahan andaliman yang rendah dan umur berkecambah yang relatif lama disebabkan oleh struktur kulit biji yang keras. Struktur ini dapat menghalangi imbibisi air dan pertukaran gas dalam proses perkecambahan. Komponen volatil, berupa senyawa terpenoid yang terdapat pada andaliman (Siahaan 1991; Wijaya et al., 2001), diketahui merupakan senyawa penghambat perkecambahan.Tanaman yang tumbuh alami berasal dari biji yang disebarkan oleh burung (setelah memakan buah andaliman).Petani juga memperoleh bibit secara tidak sengaja dari lokasi bekas pembakaran gulma di daerah tanaman yang sudah tua (Siregar, 2003).
Penyebab laindaya perkecambahan rendah yaitu banyak diantara biji andaliman tidak mempunyai embrio. Embrio beberapa spesies tidak berkembang ( immature). Embrio immature dapat dijumpai pada biji berukuran kecil, bahkan pada beberapa species embrio tidak berkembang ( Bewley dan Black, 1983). Biji andaliman kecil diameter 1-2 mm. Siregar (2010) melakukan sortasi biji dengan merendam biji dalam air. Biji yang mengapung dalam air tidak mengandung embrio dan ini bisa mencapai 70 % bahkan 90 %. Perlakuan sortasi memberi daya berkecambah sebesar 15,83 % sedangkan tanpa sortasi sebesar 0.83 %. Sortasi dengan perendaman air dapat memisahkan benih yang di duga memiliki embrio, namun presentasinya masih renah.Dengan dasar inilah maka dilakukan
efisien dalam meningkatkan jumlah benih berkecambah dan mempercepat perkecambahan benih
Tujuan Penelitian
Untuk memperoleh perlakuan pematahan dormansi yang terbaik pada bijiandaliman (Zanthoxylum acanthopodiumDC.) dengan nberbagai metode pemecahan dormansi.
Hipotesis Penelitian
Ada perbedaan pematahan dormansi dari perlakuan yang diuji terhadap viabilitas benih andaliman (Zanthoxylum acanthopodium DC.).
Kegunaan Penelitian
ABSTRAK
LILIS HABEAHAN: Berbagai Metode Pemecahan Dormansi Biji Andaliman (Zanthoxylum acanthopodium DC.). Dibimbing oleh Mbue Kata Bangun dan Eva
Sartini Bayu
Perbanyakan Andaliman secara generatif menghasilkan persentasi perkecambahan sangat rendah dan memerlukan waktu yang lama berkecambah, akibatadanya dormansi yang disebabkan kulit biji keras yang menghambat air dan pertukaran gas dalam proses perkecambahan. Untuk itu suatu penelitian telah dilakukan di Laboratorium Teknologi Benih Fakultas PertanianUSU (± 25 m dpl) pada Mei-Agustus 2016 menggunakan rancangan acak kelompokdengan 8 perlakuan dan 3 ulangan. Perlakuan terdiri dari P0 (tanpa perlakuan), P1 (skarifikasi mekanik, perendaman hingga 24 jamdan air diganti), P2 (benih disiram air panas70oC dibiarkan hingga dingin selama 24 jam, dan air diganti.), P3 (benih disiram air panas 80oC dibiarkan hingga dingin selama 24 jam, dan air diganti), P4 (perendaman 0.6 g KNO3 L-l selama 24 jam dan giberelin 250 ppm
selama5 jam), P5 (perendaman 0.6 g KNO3 L-l selama 24 jam dan giberelin 500
ppm selama5 jam), P6 (perendaman H2SO4 1% selama 10 menit), dan P7
(perendaman H2SO4 1% selama 15 menit). Peubah amatan yang diamati adalah
umur berkecambah (hari), persentasi berkecambah (%), kecepatan perkecambahan (benih berkecambah/hari), laju perkecambahan (hari), kecambah normal (%), kecambah abnormal (%) dan benih yang belum tumbuh (%).
Hasil penelitian menunjukkan pematahan dormansi dengan skarifikasi mekanik, penyiraman air panas, perendamanKNO3dengan giberalin dan H2SO4
1% berbeda nyata terhadap semua parameter kecuali umur berkecambah (hari) dan kecambah abnormal (%). Perlakuan yang terbaik digunakan untuk mematahkan dormansi biji andaliman adalah perlakuan P5 (perendaman 0.6 g KNO3 L-l selama 24 jam dan giberelin 500 ppm selama5 jam).
ABSTRACT
LILIS HABEAHAN: Various methods of breaking seed dormancy Zanthoxylum acanthopodium DC., supervised by Mbue Kata Bangun and Eva
Sartini Bayu
Generative propagation of andaliman produces low germination percentageand requires a long time to germinate due to seed dormancy which is caused by hard skin that inhibits water and gas into the seed. Therefore, a study has been carried out at the Laboratory of Seed Technology Association at Agriculture Faculty of University of Sumatera Utara (USU) (± 25 m asl) in May-August 2016 using randomized block design with 8 treatments and 3 replications. Treatment consists of P0 (without treatment), P1 (mechanical scarification,water submersion for 24 hours and the water is replaced),P2 (seeds of hot water poured 700C allowed to cool for 24 hours and the water is replaced), P3 (seeds of hot water poured 800C allowed to cool for 24 hours and the water is replaced), P4 (submersion in 0.6 g of KNO3 for 24 hours and 250 ppm of giberelin for 5 hours ), P5 (Submersion in 0.6 g of KNO3 for 24 hours and 500 ppm of giberelin for 5
hours), P6(submersion in 1% of H2SO4 for 10 minutes), and P7 (submersion in
1% of H2SO4 for 15 minutes). The parameters measured were age germination
(day),germination ability (%), seed growth rate (seeds germination/day), germination rate(day),normal seedling (%), abnormal seedling (%).
The results showed that dormancy breaking by mechanical scarification, watering hot water, submersion in KNO3 1%,GA3 and H2SO41% means
significantly allparameters except the age germination(day) and abnormal seedling (%).The best treatment used tobreak seed dormancy of andaliman is the treatment of P5 (Submersion in 0.6 g of KNO3 for 24 hours and 500 ppm of
giberelin for 5 hours).
BERBAGAI METODEPEMECAHAN DORMANSI BIJI ANDALIMAN(Zanthoxylum acanthopodium DC.)
SKRIPSI
OLEH :
LILIS HABEAHAN
120301198/ AGROEKOTEKNOLOGI
PROGRAM STUDI AGROEKOTEKNOLOGI
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
BERBAGAI METODEPEMECAHAN DORMANSI BIJI ANDALIMAN(Zanthoxylum acanthopodium DC.)
SKRIPSI
OLEH :
LILIS HABEAHAN
120301198/ AGROEKOTEKNOLOGI
Skripsi Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana di Fakultas Pertanian
Universitas Sumatera Utara
PROGRAM STUDI AGROEKOTEKNOLOGI
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
Judul : Berbagai Metode Pemecahan Dormansi Biji Andaliman (Zanthoxylum acanthopodium DC.)
Nama : Lilis Habeahan
Nim :120301198
Minat : Pemuliaan Tanaman Program Studi : Agroekoteknologi
Disetujui Oleh : Komisi Pembimbing
Ir.Mbue Kata Bangun, M.S Ir.Eva Sartini Bayu, M.P. Ketua Komisi Pembimbing Anggota Komisi Pembimbing
Mengetahui,
KATA PENGANTAR
Puji dan syukur kepada Tuhan Yang Maha Kuasa karena atas segala rahmat dan karunia-Nya penulis dapat menyelesaikan skripsi yang berjudul
“Berbagai Metode Pemecahan Dormansi Biji Andaliman (Zanthoxylum acanthopodium DC.)”
Pada kesempatan ini, penulis mengucapkan terima kasih kepada kedua orang tua penulis yang telah berjuang membesarkan,merawat, dan mendidik penulis selama ini. Penulis juga mengucapkan terimakasih kepada Bapak Ir.Mbue Kata Bangun, M.S.,selaku ketua komisi pembimbingdan Ibu Ir. Eva Sartini Bayu, MP., selaku anggota komisi pembimbing yang telahmembimbing dan memberikan berbagai saran yang berharga kepada penulis.
Disamping itu, penulis juga mengucapkan terimakasih kepada seluruh staf pengajar, pegawai serta kerabat di lingkungan Fakultas Pertanian Universitas Sumatera Utara yang telah berkontribusi dalam kelancaran studi dan penyelesaian skripsi ini.
Akhir kata penulis mengucapkan terima kasih. Semoga skripsi ini dapatmenjadi bahan informasi yang bermanfaat bagi pihak yang membutuhkan.
Medan, November 2016
DAFTAR ISI
Penyiraman Air Panas ... 11
BAHAN DAN METODE PENELITIAN Tempat dan Waktu Penelitian ... 12
Bahan dan Alat ... 12
Metode Penelitian ... 13
Metode Analisis Data ... 14
PELAKSANAAN PENELITIAN Persiapan Wadah Perkecambahan ... 15
Persiapan Media Perkecambahan ... 15
Seleksi Biji ... 15
Pengenceran Larutan Kimia ... 15
Pengamplasan Kulit Biji ... 16
Pemanasan Air ... 16
Perkecambahan Biji ... 16
Pemeliharaan Penyiraman ... 17
Pengendalian Hama Penyakit ... 17
Peubah Amatan Umur Berkecambah (Hari) ... 17
Persentase Perkecambahan (%) ... 17
Kecepatan Perkecambahan/ Indeks Vigor (Hari) ... 17
Laju Perkecambahan/ Germination Rate (Hari) ... 18
Uji Daya Kecambah Kecambah Normal (%) ... 18
Kecambah Abnormal (%) ... 19
HASIL DAN PEMBAHASAN Hasil Umur Berkecambah (Hari) ... 20
Persentasi Perkecambahan (%)... 21
Kecepatan Perkecambahan(Benih berkecambah/ Hari) ... 22
Laju Perkecambahan/ Germination Rate (Hari) ... 23
Uji Daya Kecambah Kecambah Normal (%) ... 24
Kecambah Abnormal (%) ... 25
DAFTAR TABEL
No JUDUL Hal
1. Rataan Umur berkecambah (Hari) ... 20
2. Rataan Persentasi Perkecambahan (%) ... 21
3. Rataan Kecepatan Perkecambahn (Benih berkecambah/Hari) ... 22
4. Rataan Laju Perkecambahan (Hari) ... 23
5. Rataan Perkecambahan Normal (%) ... 24
DAFTAR GAMBAR
No JUDUL Hal
DAFTAR LAMPIRAN
No JUDUL Hal
1. Data Umur Perkecambahan ... 38
2. Data Persentasi Perkecambahan ... 38
3. Tranformasi √(x + 0,5) Persentasi Perkecambahan ... 38
4. Tranformasi √(x + 0,5) Sidik Ragam Persentasi Perkecambahan ... 39
5. Data Kecepatan Perkecambahan... 39
6. Tranformasi √(x + 0,5) Kecepatan Kerkecambahan ... 39
7. Tranformasi √(x + 0,5) Sidik Ragam Kecepatan Kerkecambahan ... 40
8. Data Laju Perkecambahan ... 40
9. Tranformasi √(x + 0,5) Laju Perkecambahan ... 40
10. Tranformasi √(x + 0,5) Sidik Ragam Laju Perkecambahan ... 41
11. Data Kecambah Normal ... 41
12. Tranformasi √(x + 0,5)Kecambah Normal ... 41
13. Tranformasi √(x + 0,5) Sidik Ragam Kecambah Normal ... 42
14. Data Kecambah Abnormal ... 42
15. Tranformasi √(x + 0,5) Kecambah Abnormal ... 42
16. Tranformasi √(x + 0,5) Sidik Ragam Kecambah Abnormal ... 43
17. Bagan Penelitian di Laboratorium ... 44
18. Bagan penanaman di bak kecambah ... 45
19. Jadwal Kegiatan ... 46
20. Gambar Tanaman ... 47
22. Gambar Fase Perkecambahan ... 47
23. Gambar Penelitian di Laboratorium ... 48
24. Gambar Tamanan Pada Akhir Pengamatan 100 Hari ... 48
25. Gambar Seluruh Bagian Tamanan Pada Akhir Pengamatan 100 Hari ... 50
26. Gambar Kecambah Abnormal ... 52