BAB II
TINJAUAN PUSTAKA
2.1. Deskripsi Colletotrichum capsici 2.1.1. Klasifikasi Colletotrichum capsici
Klasifikasi fungi Colletotrichum capsici pada tanaman cabai (Capsicum annum L.) menurut Alexopoulus (1996) yaitu:
Kingdom : Fungi Divisi : Aschomycota Classis : Ascomycetes Order : Melanconiales Family : Melanconiaceae Genus : Colletotrichum
Species : Colletotrichum capsici 2.1.2. Morfologi Colletotrichum capsici
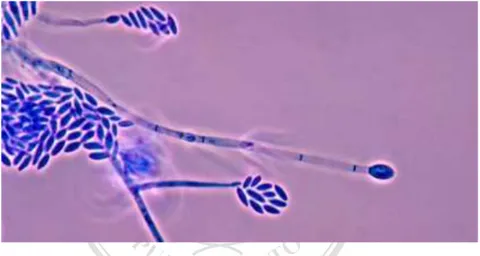
Fungi Colletotrichum capsici mempunyai konidiofor yang pendek dan konidia dibentuk dalam aservulus. Colletotrichum mempunyai stroma yang terdiri dari massa miselium yang berbentuk aservulus, bersepta, panjang antara 30-90 μm, umumnya yang berkembang merupakan perpanjangan dari setiap aservulus. Konidia berwarna hialin, bersel tunggal dan berukuran 5-15 μm (Daniel, 1972).
Aservulus tersusun di bawah epidermis tumbuhan inang. Epidermis pecah apabila konidia telah dewasa. Konidia keluar sebagai percikan berwarna putih, kuning, jingga, hitam atau warna lain sesuai dengan pigmen yang dikandung
konidia. Diantara bangsa Melanconiales yang konidianya cerah (hialin) adalah Gloeosporium dan Colletotrichum. Keduanya mempunyai konidia yang memanjang dengan penciutan di tengah (Dwidjoseputro, 1978). Morfologi fungi
C. capsici dapat dilihat pada gambar 2.1.
Gambar 2.1. Morfologi C. capsici
Sumber : USDA (2014)
2.1.3. Gejala Serangan
Gejala awal serangan fungi C. capsici yang terdapat pada tanaman cabai mula-mula berbentuk bintik-bintik kecil berwarna kehitaman dan berlekuk, pada buah yang masih hijau atau yang sudah masak. Bintik-bintik ini tepinya berwarna kuning, membesar dan memanjang. Bagian tengahnya menjadi semakin gelap (Semangun, 1994). Menurut Rukmana & Oesman (2002), pada buah yang terserang fungi C. capsici akan menjadi busuk berwarna seperti terkena sinar matahari yang kemudian menyebabkan busuk basah berwarna hitam (Gambar 2.2).
Gambar 2.2. Buah cabai yang terserang fungi C. capsici
Sumber : Halil (2013)
Pada tahap awal infeksi konidia Colletotrichum yang berada di permukaan kulit buah cabai merah akan berkecambah dan membentuk tabung perkecambahan. Setelah tabung perkecambahan berpenetrasi ke lapisan epidermis kulit buah cabai merah maka akan terbentuk jaringan hifa. Kemudian hifa intra dan interseluler menyebar keseluruh jaringan dari buah cabai merah (Photita, et al., 2005)
Tanaman cabai dewasa yang terkena fungi C. Capsici akan menimbulkan gejala mati pucuk, kemudian menjalar pada daun bawah dan batang, menimbulkan busuk kering berwarna coklat kehitam-hitaman. Fungi C. capsici
menyebar dengan cepat dengan timbulnya gejala yang cepat (Rukmana & Oesman, 2002)
2.1.4. Siklus Hidup Fungi Colletotrichum capsici
Siklus hidup dari fungi C. capsici yang terdapat pada tanaman cabai yaitu berawal dari buah, masuk menginfeksi biji. Pada umumnya fungi tersebut menginfeksi semai yang tumbuh dari biji buah yang sakit. Fungi C. capsici juga menyerang daun dan batang, hingga buah tanaman dan dapat mempertahankan dirinya dalam sisa-sisa tanaman sakit. Konidium dari fungi akan disebarkan oleh angin (Semangun, 1994).
Spora fungi Colletotrichum dapat disebarkan oleh angin dan percikan air hujan dan pada inang yang cocok akan berkembang dengan cepat (Dickman, 1993). Pertumbuhan awal fungi Colletotrichum membentuk koloni miselium yang berwarna putih dengan miselium yang timbul di permukaan, kemudian perlahan-lahan berubah menjadi hitam dan akhirnya berbentuk aservulus. Aservulus
berwarna merah muda sampai coklat muda merupakan kumpulan massa konidia (Rusli & Zulpadli, 1997).
2.1.5. Faktor – Faktor yang Mempengaruhi Kehidupan Colletotrichum capsici
Pertumbuhan fungi Colletotrichum capsici sangat dipengaruhi oleh faktor lingkungan. Faktor lingkungan tersebut adalah:
1. pH
pH sangat penting dalam mengatur metabolisme dan sistem-sistem enzim. Bila terjadi penyimpangan pH, maka proses metabolisme fungi dapat terhenti. Menurut Yulianty (2006), pH optimal untuk pertumbuhan fungi
2. Suhu
Suhu optimum pertumbuhan Colletotrichum capsici yaitu antara 24-30o C (Nurhayati, 2011) dengan kelembaban relatif antara 80-90% (Rompas, 2001).
3. Musim
Pertumbuhan fungi C. capsici kurang baik pada musim kemarau dan lahan yang mempunyai drainase baik. fungi tersebut dapat dibantu oleh angin dan hujan untuk penyebaran konidia (Semangun, 1991).
2.2 Deskripsi Fusarium oxysporum 2.2.1. Klasifikasi Fusarium oxysporum
Klasifikasi Fusarium oxysporum menurut Alexopoulus & Mims (1979) sebagai berikut : Kingdom : Fungi Divisi : Eumycota Classis : Deuteromycetes Order : Moniliales Family : Tuberculariaceae Genus : Fusarium
2.2.2 Morfologi Fusarium oxysporum
Fungi F. oxysporum memiliki struktur yang terdiri dari mikrokonidia dan makrokonidia. Permukaan koloninya berwarna ungu dan tepinya bergerigi serta memiliki permukaan yang kasar berserabut dan bergelombang. Di alam, fungi ini membentuk konidium. Konidiofor bercabang dan makrokonidium berbentuk sabit, bertangkai kecil dan seringkali berpasangan (Lucas et al., 1985). Gambar 2.3. Morfologi Fusarium oxysporum.
Gambar 2.3. Morfologi Fusarium oxysporum.
Sumber : BBPPKETINDAN(2015)
Miselium Fusarium oxysporum terdapat di dalam sel khusus di dalam pembuluh tanaman, juga terdapat diantara sel-sel, yaitu di dalam kulit dan di jaringan parenkim didekat terjadinya infeksi. F. oxysporum adalah fungi aseksual.
Fungi F. oxysporum menghasilkan 3 jenis spora yaitu mikrokonidia makrokonidia, dan klamidospora (Gambar 2.4). Makrokonidia berbentuk panjang melengkung seperti kumparan, tidak berwarna, dan pada kedua ujungnya sempit menyerupai bulan sabit yang terdiri dari 3-5 sekat dengan ukuran 25-33 x 3,5-5,5
µm . Mikrokonidia merupakan spora bersel satu atau dua yang tidak berwarna, berbentuk lonjong atau bulat telur dengan ukuran 6-15 x 2,5-4 µm. Klamidiospora merupakan spora berbentuk bulat yang terdapat di dalam hifa atau di ujung hifa. Klamidiospora dapat terbentuk jika kondisi lingkungan tidak mendukung dan klamidiospora yang dihasilkan bersifat dorman (Semangun, 1996).
Gambar 2.4. (A) Makrokonidia, (B) Mikrikonidia, (C) Klamidiospora Sumber : Seifert and Gams (2001)
2.2.3. Gejala Serangan
Gejala awal yang terlihat akibat serangan patogen ini yaitu memucatnya tulang-tulang daun terutama daun-daun atas kemudian diikuti dengan menggulungnya daun yang lebih tua selanjutnya tangkai daun akan merunduk dan akhirnya tanaman menjadi layu secara keseluruhan (Gambar 2.5). Jika tanaman sakit dipotong maka dekat pangkal batang akan terlihat suatu cincin dari berkas pembuluh (Semangun, 1996).
Pada tanaman yang masih sangat muda, penyakit ini dapat menyebabkan matinya tanaman secara mendadak, karena pada pangkal batang terjadi kerusakan atau kanker yang menggelang (Semangun, 2001).
Gambar 2.5.Tanaman cabai yang terserang Fusarium oxysporum
Sumber : Langit (2014)
2.2.4. Siklus Hidup Fungi Fusarium oxysporum
Fungi Fusarium mengalami 2 fase dalam siklus hidupnya yakni
patogenesa dan saprogenesa. F. oxysporum tersebut hidup sebagai parasit pada tanaman inang yang masuk melalui luka pada akar dan berkembang dalam jaringan tanaman yang disebut sebagai fase patogenesa. Pada fase saprogenesa
merupakan fase bertahan yang diakibatkan tidak adanya inang, hidup sebagai saprofit dalam tanah dan sisa-sisa tanaman dan menjadi sumber inokulum untuk menimbulkan penyakit pada tanaman yang lain. Patogen ini dapat menimbulkan gejala penyakit karena mampu menghasilkan enzim, toksin, polisakarida dan antibiotik dalam jaringan tanaman (Agrios 1997 dalam Susetyo 2010),
2.2.5. Faktor – Faktor yang Mempengaruhi Kehidupan Fusarium oxysporum
Kehidupan Fusarium oxysporum dipengaruhi oleh beberapa faktor. Faktor-faktor tersebut adalah temperatur, kelembaban tanah yang rendah, panjang hari yang pendek, intensitas cahaya yang rendah, nutrisi N dan P yang rendah, nutrisi K yang tinggi dan pH yang rendah (Booth, 1985).
Fungi F. oxysporum mampu bertahan hidup pada temperatur tanah 21o -33oC, temperatur optimumnya adalah 280C (Semangun, 1996). Fungi F. oxysporum sangat cocok pada tanah yang mempunyai kisaran pH 4,5-6,0 (Sastrahidayat, 1989). Kelembaban tanah yang sangat rendah atau tinggi dapat menahan pertumbuhan tanaman dan juga perkembangan penyakit layu fusarium (Mehrotra, 1980). Faktor lain yang mempengaruhi perkembangan Fusarium
adalah unsur-unsur yang terkandung dalam tanah. Di banyak negara diketahui bahwa penyakit berkembang lebih berat bila tanah mengandung banyak nitrogen tapi miskin akan kalium (Semangun, 1996).
2.3. Pengendali Hayati
Pengendalian terhadap penyakit tanaman saat ini masih bertumpu pada penggunaan pestisida sintetis. Namun penggunaan pestisida sintetis secara terus-menerus dapat menimbulkan berbagai macam dampak negatif. Penggunaan pestisida sintetis dapat membahayakan keselamatan hayati termasuk manusia dan keseimbangan ekosistem. Oleh sebab itu, saat ini metode pengendalian telah diarahkan pada pengendalian secara hayati (Suwahyono, 2009).
Pengendalian biologi (hayati) menunjukkan alternatif pengendalian yang dapat dilakukan tanpa harus memberikan pengaruh negatif terhadap lingkungan dan sekitarnya, salah satunya adalah dengan pemanfaatan agens hayati seperti virus, fungi, bakteri atau aktiomisetes (Ismail, 2010).
Mekanisme fungi dalam menghambat patogen tanaman dapat melalui antibiosis, lisis, kompetisi, dan parasitisme (Arwiyanti, 2003).
1. Antibiosis
Antibiosis adalah interaksi antar organisme dimana salah satu organisme menghasilkan zat antibiotik yang dapat menghancurkan sel fungi melalui perusakan terhadap permeabilitas membran sel.
2. Lisis
Lisis adalah proses pemecahan komponen dinding sel fungi patogen oleh fungi antagonis dengan cara menghasilkan enzim seperti kitinase yang dapat mendegradasi kitin pada dinding sel patogen.
3. Kompetisi
Kompetisi yaitu mempunyai kemampuan berkompetisi memperebutkan tempat hidup dan sumber makanan.
4. Parasitisme
Parasitisme yaitu memarasit miselium fungi lain dengan menembus dinding sel dan masuk ke dalam sel untuk mengambil zat makanan dari dalam sel sehingga fungi akan mati.
Penggunaan pengendali hayati dalam mengendalikan organisme pengganggu tanaman (OPT) semakin berkembang karena cara ini lebih unggul dibanding pengendalian berbasis pestisida. Beberapa keunggulan tersebut antara lain: (1) aman bagi manusia, musuh alami dan lingkungan; (2) dapat mencegah timbulnya ledakan OPT sekunder, (3) produk tanaman yang dihasilkan bebas dari residu pestisida; (4) aman bagi kesehatan manusia; (5) terdapat di sekitas pertanaman sehingga dapat mengurangi ketergantungan petani terhadap pestisida sintetis dan (6) dapat menurunkan biaya produksi karena aplikasi agens
pengendali hayati dilakukan satu atau dua kali dalam satu musim panen (Tombe et al., 1999).
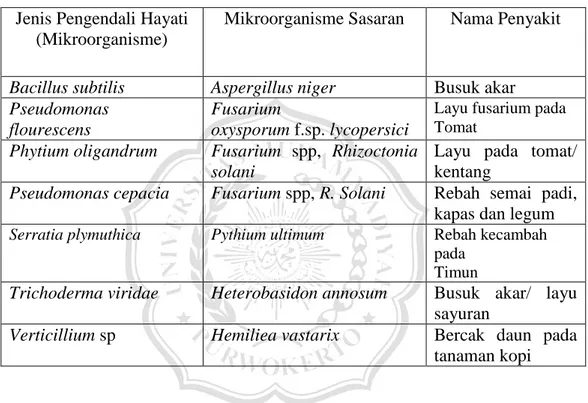
Telah diketahui beberapa mikroorganisme yang digunakan sebagai pengendali hayati. Sebagai contohnya dapat dilihat pada Tabel 2.1
Tabel 2.1. Contoh mikroorganisme yang digunakan sebagai pengendali hayati Jenis Pengendali Hayati
(Mikroorganisme)
Mikroorganisme Sasaran Nama Penyakit
Bacillus subtilis Aspergillus niger Busuk akar
Pseudomonas flourescens
Fusarium
oxysporum f.sp. lycopersici
Layu fusarium pada Tomat
Phytium oligandrum Fusarium spp, Rhizoctonia solani
Layu pada tomat/ kentang
Pseudomonas cepacia Fusarium spp, R. Solani Rebah semai padi, kapas dan legum
Serratia plymuthica Pythium ultimum Rebah kecambah
pada Timun
Trichoderma viridae Heterobasidon annosum Busuk akar/ layu sayuran
Verticillium sp Hemiliea vastarix Bercak daun pada tanaman kopi
2.4. Deskripsi Trichoderma harzianum
2.4.1. Klasifikasi FungiTrichoderma harzianum
Klasifikasi Trichoderma harzianum menurut Rivai (1969) adalah sebagai berikut : Kingdom : Fungi Divisi : Ascomycota Subdivisi : Pezizomycotina Classis : Sordariomycetes Order : Hypocreales Family : Hypocreaceae Genus : Trichoderma
Species : Trichoderma harzianum
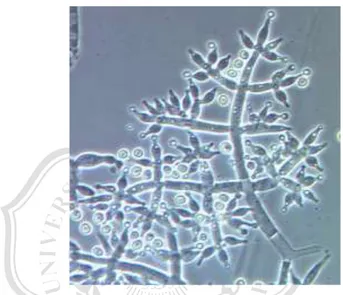
2.4.2. Morfologi Fungi Trichoderma harzianum
Morfologi T. harzianum terdiri dari konidia yang terdapat pada struktur konidiofor. Konidiofor dapat bercabang menyerupai piramida berupa cabang lateral yang berulang-ulang, sedangkan ke arah ujung percabangan menjadi bertambah pendek. Phialida/ cabang hifa tampak langsing dan panjang terutama pada apeks dari cabang dan berukuran 18 x 2,5 µm, konidia berbentuk semi bulat hingga oval pendek, berukuran (2,8-3,2)x(2,5-2,8) µm dan berdinding halus
(Gambar 2.6). Trichoderma mempunyai klamidiospora (spora aseksual berdinding tebal dan mampu bertahan hidup dalam lingkungan yang kurang menguntungkan) yang umumnya ditemukan dalam miselia dari koloni yang sudah
tua, terletak interkalar dan kadang-kadang terminal, umumnya berbentuk bulat, berwarna hialin dan berdinding halus. Kemampuan Trichoderma dalam memproduksi klamidiospora merupakan aspek penting dalam proses sporulasi sedangkan reproduksi aseksual Trichoderma menggunakan konidia (Gandjar, 1999).
Gambar 2.6. Morfologi Trichoderma harzianum dengan perbesaran 400 kali Sumber : USDA (2008)
Trichoderma harzianum adalah fungi non mikoriza yang dapat menghasilkan enzim kitinase, sehingga dapat berfungsi sebagai pengendali penyakit tanaman. Kitinase merupakan enzim ekstraseluler yang dihasilkan oleh fungi dan bakteri serta berperan penting dalam pemecahan kitin (Wijaya, 2002).
2.4.3. Manfaat Trichoderma harzianum
Trichoderma harzianum memiliki aktivitas antifungal yang tinggi dibanding Trichoderma jenis lain. T. harzianum dapat memproduksi enzim litik dan antibiotik antifungal. T. harzianum juga dapat berkompetisi dengan patogen dan dapat membantu pertumbuhan tanaman. Fungi tersebut juga memiliki kisaran
harzianum memproduksi metabolit seperti asam sitrat, etanol, dan berbagai enzim seperti urease, selulose, glukanase, dan kitinase. Hasil metabolit tersebut dipengaruhi kandungan nutrisi yang terdapat dalam media. Saat berada pada kondisi yang kaya akan kitin, T. harzianum memproduksi protein kitinolitik dan enzim kitinase. Enzim tersebut berguna untuk meningkatkan efisiensi aktivitas biokontrol terhadap patogen yang mengandung kitin (Suwahyono, 2010 dalam
Azmi, 2011)
Menurut Salma & Gunarto (1999), Trichoderma harzianum mempunyai kemampuan menghasilkan enzim selulase sehingga dapat merusak dinding sel fungi patogen famili Pythiaceae. Fungi tanah T. harzianum mempunyai kemampuan melakukan pelilitan dan penetrasi hifa patogen serta menghasilkan antibiotik yang bersifat toksin bagi patogen lawannya (Dennis & Webster, 1971
dalam Salma & Gunarto, 1999).
2.5. Kandungan Metabolit Sekunder (Antifungi)
Metabolit sekunder adalah substansi kimia yang diperoleh dari metabolit primer sebagai produk dari proses metabolisme respirasi maupun fotosintesis (Ramawat et al., 2009). Metabolit sekunder merupakan senyawa dari hasil metabolisme primer yang tidak diperlukan untuk pertumbuhan fungi tersebut. Secara umum metabolit sekunder pada fungi terjadi pada fase akhir petumbuhan dan mulai memasuki fase stationer. Metabolisme sekunder pada fungi diartikan sbagai suatu proses diferensiasi dan sporulasi.
Beberapa kelompok senyawa metabolit sekunder diantaranya adalah sebagai berikut:
1. Alkaloid
Alkaloid adalah senyawa biologis heterosiklik aktif yang mengandung nitrogen (Kurnar & Rawat, 2011). Alkaloid pada umumnya mencakup senyawa yang bersifat basa yang mengandung satu atau lebih atom nitrogen, biasanya dalam gabungan, sebagai bagian dari sistem siklik (Harborne, 1987).
Mekanisme kerja alkaloid sebagai antifungi dilakukan dengan merusak membran sel fungi. Alkaloid akan berikatan dengan ergosterol membentuk lubang yang menyebabkan kebocoran membran sel. Hal ini mengakibatkan kerusakan sel dan kematian sel fungi.
2. Flavonoid
Flavonoid adalah salah satu dari golongan fenol alam yang paling besar. Flavonoid mengandung 15 atom karbon dalam inti dasarnya, rumus kimia C6-C3-C6 yang artinya kerangka karbonnya terdiri atas dua gugus C6 (Cincin benzene tersubtitusi) yang dihubungkan secara alifatis oleh tiga karbon (Lumbanraja, 2009).
Senyawa-senyawa flavonoid mempunyai kemampuan sebagai antifungi. Selain itu flavonoid juga berperan sebagai antivirus, antibakteri, antiradang, dan antialergi. Flavonoid mampu menyebabkan gangguan permeabilitas membran sel fungi karena gugus hidroksil yang dimiliki flavonoid mampu merubah komponen organik dan transport nutrisi yang menimbulkan efek toksik pada fungi (Wiryowidagdo, 2006).
Saponin adalah glikosida dan stereol yang telah terdeteksi pada lebih dari 90 suku tumbuhan. Saponin juga merupakan senyawa aktif permukaan dan bersifat seperti sabun. Saponin dapat dideteksi berdasarkan kemampuannya membentuk busa dan menghemolisis sel darah (Harborne, 1987).
Saponin pada bakteri mampu meningkatkan permeabilitas membran sel bakteri sehingga struktur dan fungsi membran bakteri berubah, menyebabkan denaturasi protein membran sehingga membran sel akan rusak dan lisis (Siswandono & Soekarjo, 2000).
2.5.1. Mekanisme Kerja Antifungi
Antifungi adalah suatu bahan yang dapat mengganggu pertumbuhan dan metabolisme mikroorganisme. Pemakaian bahan antifungi merupakan suatu usaha untuk mengendalikan fungi maupun bakteri, yaitu segala kegiatan yang dapat menghambat, membasmi atau menyingkirkan mikroorganisme (Pelczar & Chan, 1988). Mekanisme antifungi dapat berupa gangguan pada membran sel yang terjadi karena adanya ergosterol dalam sel fungi, penghambatan sintesis asam nukleat dan protein fungi yang disebabkan oleh senyawa turunan pirimidin dan penghambatan mitosis fungi karena adanya senyawa griseofulvin. (Sholichah, 2010).
2.6. Pengujian Aktivitas Antifungi
Pengujian aktivitas antifungi dapat dilakukan melalui dua cara yaitu:
1. Metode Dilusi
Metode dilusi digunakan untuk menentukan kadar hambat minimum dan kadar bunuh minimum dari bahan antimikroba. Prinsip dari metode dilusi yaitu menggunakan satu seri tabung reaksi yang diisi medium cair dan sejumlah tertentu sel mikroba yang diuji. Selanjutnya masing-masing tabung diisi dengan bahan antimikroba yang telah diencerkan secara serial, kemudian seri tabung diinkubasi pada suhu 370 C selama 18-24 jam dan diamati terjadinya kekeruhan konsentrasi terendah bahan antimikroba pada tabung yang ditunjukkan dengan hasil biakan yang mulai tampak jernih (tidak ada pertumbuhan fungi merupakan konsentrasi hambat minimum). Biakan dari semua tabung yang jernih ditumbuhkan pada medium agar padat, diinkubasi selama 24 jam, dan diamati ada tidaknya koloni fungi yang tumbuh . Konsentrasi terendah obat pada biakan pada medium padat yang ditunjukan dengan tidak adanya pertumbuhan fungi adalah merupakan konsentrasi bunuh minimum bahan antimikroba terhadap fungi uji (Tortora et al., 2001).
2. Metode Difusi Cakram (Uji Kirby-Bauer)
Prinsip dari metode difusi cakram adalah menempatkan kertas cakram yang sudah mengandung bahan antimikroba tertentu pada medium lempeng padat yang telah dicampur dengan fungi yang akan diuji. Medium ini kemudian diinkubasi pada suhu 370 selama 18-24 jam,
selanjutnya diamati adanya zona jernih di sekitar kertas cakram. Daerah jernih yang tampak di sekeliling kertas cakram menunjukkan tidak adanya pertumbuhan mikroba. Fungi yang sensitif terhadap bahan antimikroba akan ditandai dengan adanya daerah hambatan disekitar cakram, sedangkan jamur yang resisten terlihat tetap tumbuh pada tepi kertas cakram (Tortora et al., 2001).
2.7. Kromatografi Lapis Tipis (KLT)
Kromatografi Lapis Tipis (KLT) merupakan metode pilihan untuk memisahkan suatu senyawa yang larut dalam lipid. Plat silika digunakan sebagai fase diam, sedangkan fase gerak dalam kromatografi lapis tipis berupa pelarut maupun campuran pelarut yang disebut larutan pengembang. Fase gerak yang dikenal sebagai pelarut pengembang akan bergerak sepanjang fase diam karena pengaruh kapiler pada pengembangan secara menaik (ascending), atau karena pengaruh gravitasi pada pengembangan secara menurun (descending) (Gandjar & Rohman, 2007).
Beberapa keuntungan dari kromatografi lapis tipis adalah (Gandjar & Rohman, 2007):
a. Kromatografi lapis tipis banyak digunakan untuk tujuan analisis.
b. Identifikasi pemisahan komponen dapat dilakukan dengan pereaksi warna, flourensi, atau radiasi dengan sinar ultraviolet.
c. Dapat dilakukan elusi secara menaik (ascending), menurun (descending) atau dengan cara elusi 2 dimensi.
d. Ketepatan penentuan kadar akan lebih baik karena komponen yang akan ditentukan merupakan bercak yang tidak bergerak.