INTISARI
Khasiat teh untuk kesehatan telah diketahui sejak lama. Salah satu kandungan dari teh yaitu flavonoid memliki aktivitas antioksidan serta memiliki gugus kromofor sehingga dapat dijadikan zat aktif dalam krim sunscreen.
Penelitian ini merupakan penelitian non eksperimental karena tidak ada manipulasi terhadap subjek penelitian. Tujuan penelitian ini untuk mengetahui akurasi dan presisi dari penetapan kadar kuersetin dalam krim dengan basis krim yang telah dioptimasi oleh Prasetya (2008). Kuersetin merupakan salah satu jenis flavonoid golongan flavonol yang digunakan sebagai baku atau standar dalam penetapan kadar tersebut. Penelitian ini merupakan penelitian awal untuk menetapkan kadar flavonoid dalam sediaan krim dengan kandungan flavonoid teh sebagai senyawa aktif. Kompleks antara AlCl3 dan kuersetin dapat diukur pada
panjang gelombang visibel (427,4 nm).
Parameter validitas metode analisis yang digunakan adalah akurasi dan presisi. Parameter tersebut diperoleh dengan perhitungan recovery dan koefisien variasi (CV). Dari percobaan didapatkan nilai recovery sebesar 89,49 - 96,85 %, koefisien variasi sebesar 3,14%. Dapat disimpulkan bahwa penetapan kadar kuersetin dalam sediaan krim dengan metode kolorimetri memiliki nilai validitas yang baik.
Kata kunci : validasi, penetapan kadar, kuersetin, krim, akurasi, presisi
ABSTRACT
Tea effects for health have been known for a long time. Tea contain flavonoid which have antioxidant activity and chromophore so it can be used as active compound in sunscreen cream.
It is non experimental research, because there was no manipulation to the research subject. The aim for this study is to know the accuracy and precision of determination method of quercetin in cream using base cream created by Prasetya (2008). Quercetin is one of flavonoid group that can be used as standard in this experiment. This research is useful as first phase experiment which can be applicated to determine flavonoid concentration in cream that contains tea flavonoid as active compound. The complex between AlCl3 and quercetin can be
measured at visible wavelength (427,4 nm).
Accuracy and precision was used to measure the validity of analysis method. The measurements were obtained from analyzing recovery and Coefficient variance (CV). The result of the recovery was 89,49 - 96,85 %, and the result of coefficient varians was 3.14%. It could be concluded that the determination of quercetin in cream using colometric method has good accuracy and precision
Keyword : validity, determination concentration, quercetin, cream, precision, accuracy
VALIDASI PENETAPAN KADAR KUERSETIN DALAM SEDIAAN KRIM SECARA KOLORIMETRI DENGAN PEREAKSI AlCl3
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Ilmu Farmasi
Oleh: Selvi Indrayani NIM : 048114099
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2008
HALAMAN PERSEMBAHAN
Jika
kita
melakukan
suatu
hal
1-2
kali
itu
baru
mencoba
,
Lebih
dari
2
kali
itu
baru
disebut
berjuang
Karya ini kupersembahkan kepada
Papa & mama yang kucintai
Pipin & W
2,ooh-oohku yang
kusayangi
Almamaterku
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya Mahasiswa Universitas Sanata Dharma :
Nama : Selvi Indrayani
Nomor Mahasiswa : 048114099
Demi pengembangan ilmu pengetahuan, saya memberikan kepada perpustakaan
Universitas Sanata Dharma karya ilmiah saya yang berjudul : Validasi Penetapan
Kadar Kuersetin Dalam Sediaan Krim secara Kolorimetri dengan Pereaksi AlCl3
beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan
kepada perpustakaan Universitas Sanata Dharma hak untuk menyimpan,
mengalihkan dalam bentuk media lain, mengelolanya dalam bentuk pangkalan
data, mendistribusikan secara terbatas, dan mempublikasikannya di internet atau
media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya
maupun memerikan royalti kepada saya selama tetap mencantumkan nama saya
sebagai penulis.
Demikian pernyataan ini yang saya buat dengan sebenarnya.
Dibuat di Yogyakarta
Pada tanggal 25 Mei 2008
Yang menyatakan
(Selvi Indrayani)
PRAKATA
Puji syukur penulis panjatkan kepada Tuhan Yesus Kristus atas semua
berkat dan anugerah-Nya sehingga penulis dapat menyelesaikan skripsi ini
sebagai syarat untuk memperoleh gelar Sarjana Farmasi Jurusan Farmasi
Universitas Sanata Dharma.
Pada kesempatan ini penulis hendak mengucapkan terima kasih yang
sebesar-besarnya kepada:
1. Rita Suhadi, M.Si., Apt., selaku Dekan Fakultas Farmasi Universitas Sanata
Dharma Yogyakarta,
2. Jeffry Julianus, M.Si., selaku dosen pembimbing yang telah membantu penulis
selama mengerjakan penelitian ini,
3. Rini Dwi Astuti, S. Farm, Apt., selaku dosen pengampu proyek yang telah
memberi kesempatan pada penulis untuk bergabung dalam proyek ini,
4. Yohanes Dwiatmaka, M.Si., selaku dosen penguji yang telah memberi
masukkan yang membangun,
5. Christine Patramurti, M.Si., Apt., selaku kepala program studi dan dosen
penguji yang telah meluangkan waktunya untuk memberi masukkan dan
diskusi,
6. Segenap dosen fakultas Farmasi Universitas Sanata Dharma yang telah
memberi bekal ilmu kepada penulis,
7. Keluarga besar: Gyu-gyu, Gyumei, Yiyi, Hijong, Devi, dan Kevin yang selalu
mendukung,
vii
8. Teman-teman proyek “Teh” : Dian ‘Sapi’, Agung, Rinta, Yoyo, Dona, Tere,
Resti, Ika, dan Feri untuk kerja sama dalam tim,
9. Teman-teman kos “Dewi”: Cie Ratih ‘pigem’, Cie Nike, Cie Indah, Cie
Lanny, Cie Lia ‘KKT’, Chika, Novi, Cie Aning, Cie Yohana, Cie Melissa dan
teman-teman 1 kos lainnya, terima kasih untuk kebersamaannya hingga
sekarang,
10.Teman-teman kecilku: Nita, Linda, Happy, Angel, Wina, Novi, Susan A.,
Nana, Belina, Tasia, Bobby yang telah memberikan warna tersendiri dalam
kehidupan penulis,
11.Adi Krisnawan, S.T., yang telah memberi dukungan, nasihat, dan
menunjukkan hal-hal yang baik kepada penulis,
12.Teman-teman kuliah seluruh mahasiswa farmasi USD angkatan 2004
khususnya minat FST yang memberikan keceriaan selama kuliah,
13.Mas Parlan, Pak Prapto, Mas Kunto, Mas Sarwanto, Mas Otok dan segenap
laboran yang telah banyak membantu penulis selama bekerja di laboratoium,
14.Kepada semua pihak yang tidak dapat disebutkan satu per satu penulis
mengucapkan terima kasih. Tanpa kalian semua penulis bukanlah siapa-siapa.
Penulis menyadari bahwa masih banyak kekurangan dan kelemahan
dalam penulisan skripsi ini mengingat keterbatasan kemampuan dan pengetahuan
penulis. Penulis terbuka menerima masukkan, saran, dan kritik dari pembaca.
Harapan penulis semoga skripsi ini dapat berguna dan bermanfaat bagi pembaca.
Atas perhatiannya penulis ucapkan terima kasih.
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak
memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam
kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, 22 Februari 2008
Penulis,
Selvi Indrayani
DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN... iii
HALAMAN PERSEMBAHAN... iv
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS ... v
PRAKATA...vi
PERNYATAAN KEASLIAN KARYA... viii
DAFTAR ISI... ix
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xvi
INTISARI...….... xvii
ABSTRACT ... xviii
BAB I. PENGANTAR ...1
A. Latar belakang ...1
B. Perumusan masalah ...3
C. Keaslian karya ...3
D. Manfaat penelitian ... 4
E. Tujuan penelitian ... 4
BAB II. PENELAAHAN PUSTAKA ... 5
A. Krim ... 5
B. Analisis Sediaan Krim ... 6
C. Flavonoid ...7
1. Struktur dan kegunaan flavonoid ... 7
2. Isolasi flavonoid ... 8
3. Kuersetin ... 8
4. Metode kuantifikasi flavonoid ... 9
D. Ekstraksi Cair-cair ... 10
E. Spektrofotometri Visibel ... 11
1. Interaksi elektron dengan radiasi elektromagnetik...11
2. Analisis kuantitatif menggunakan spektrofotometri visibel ... 11
3. Kolorimetri ... 12
F. Validasi Metode Analisis ... 12
G. Landasan teori ... 14
H. Hipotesis ... 15
BAB III. METODOLOGI PENELITIAN ... 16
A. Jenis dan rancangan penelitian ...16
B. Definisi operasional ...16
C. Variabel penelitian...16
D. Alat dan bahan penelitian ... 17
E. Tata cara penelitian ...17
1. Pembuatan pereaksi ... 17
2. Pembuatan larutan baku ... 18
3. Pembuatan blangko ... 19
4. Optimasi metode ... 19
5. Penetapan kadar kuersetin dalam sediaan krim ... 20
F. Analisis hasil ... 22
BAB IV. HASIL DAN PEMBAHASAN ... 23
A. Pamilihan baku ... 23
B. Optimasi metode ... 24
1. Penetapan operating time ... 24
2. Penetapan panjang gelombang maksimum ... 26
3. Penetapan kurva baku kuersetin ... 29
C. Ekstraksi kuersetin dari sediaan krim ... 31
1. Tahap pemecahan sediaan krim ... 32
2. Tahap hidrolisis glikosida flavonoid ... 33
3. Ekstraksi cair-cair ... 34
D. Penetapan kadar sampel kuersetin dalam sediaan krim ... 36
E. Analisis validitas penetapan kadar sampel kuersetin dalam sediaan krim.38 1. Akurasi ... 38
2. Presisi ... 39
BAB V. KESIMPULAN DAN SARAN ... 41
A. Kesimpulan ... 41
B. Saran ... 41
C. Keterbatasan ... 41
DAFTAR PUSTAKA ... 42
xii
LAMPIRAN ... 45
DAFTAR TABEL
Tabel I. Kriteria akurasi metode analisis ... 13
Tabel II. Kriteria presisi metode analisis ... 13
Tabel III. Formula basis krim ... 20
Tabel IV. Hasil penetapan panjang gelombang maksimum ... ... 28
Tabel V. Data hubungan antara kadar kuersetin dengan absorbansi kompleks antara kuersetin dengan AlCl3 ... 29
Tabel VI. Data recovery sampel kuersetin dalam sediaan krim ... 38
Tabel VII. Data koefisien variasi sampel kuersetin hasil ekstraksi dari sediaan krim ……… 40
DAFTAR GAMBAR
Gambar 1. Sistem emulsi tipe O/W dan W/O ... 5
Gambar 2. Kerangka dasar flavonoid ... 7
Gambar 3. Sistem penomoran flavonoid ... 7
Gambar 4. Struktur golongan flavonol ... 8
Gambar 5. Struktur kuersetin ... 8
Gambar 6. Reaksi pembentukan kompleks antara AlCl3 dengan flavonol ... 9
Gambar 7. Reaksi pembentukan kompleks antara AlCl3 dengan flavon ... 10
Gambar 8. Struktur katekin (A) dan struktur kuersetin (B) serta gugus-gugus yang dapat bereaksi dengan AlCl3 ... 24
Gambar 9. Reaksi pembentukan kompleks antara kuersetin dengan AlCl3 ... 25
Gambar 10. Spektrum pengukuran operating time kompleks antara kuersetin dengan AlCl3 ... 26
Gambar 11. Spektrum pengukuran panjang gelombang maksimum dari kompleks kuersetin dengan AlCl3 ... 27
Gambar 12. Grafik hubungan antara kadar kuersetin dengan absorbansi kompleks antara kuersetin dengan AlCl3 ... 30
Gambar 13. Struktur trietanolaminstearat, penyabunan dari asam stearat dan trietanolamin ... 32
Gambar 14. Mekanisme reaksi hidrolisis glikosida flavonoid menjadi gula dan aglikon menggunakan asam ... 33
Gambar 15. Struktur metil paraben (A) dan struktur kuersetin (B) ... 36
Gambar 16. Reaksi pembentukan kompleks antara AlCl3 dengan kuersetin ... 37
xv
Gambar 17. Gambar struktur setil alkohol ... 56
Gambar 18. Gambar struktur asam stearat ... 56
Gambar 19. Gambar struktur metil paraben ... 56
Gambar 20. Gambar struktur asam sitrat ... 20
DAFTAR LAMPIRAN
Lampiran 1. Perhitungan kurva baku kuersetin ... 45
Lampiran 2. Perhitungan kadar kuersetin terhitung yang ditambahkan ke dalam
sediaan krim ... 48
Lampiran 3. Perhitungan kadar kuersetin terukur dalam sediaan krim ... 50
Lampiran 4. Perhitungan recovery dan koefisien variasi kadar kuersetin dalam
sediaan krim ... 51
Lampiran 5. Dokumentasi ... 52
Lampiran 6. Tabel toleransi alat-alat gelas ... 54
Lampiran 7. Struktur dan kelarutan komponen penyusun formula basis krim .... 55
INTISARI
Khasiat teh untuk kesehatan telah diketahui sejak lama. Salah satu kandungan dari teh yaitu flavonoid memliki aktivitas antioksidan serta memiliki gugus kromofor sehingga dapat dijadikan zat aktif dalam krim sunscreen.
Penelitian ini merupakan penelitian non eksperimental karena tidak ada manipulasi terhadap subjek penelitian. Tujuan penelitian ini untuk mengetahui akurasi dan presisi dari penetapan kadar kuersetin dalam krim dengan basis krim yang telah dioptimasi oleh Prasetya (2008). Kuersetin merupakan salah satu jenis flavonoid golongan flavonol yang digunakan sebagai baku atau standar dalam penetapan kadar tersebut. Penelitian ini merupakan penelitian awal untuk menetapkan kadar flavonoid dalam sediaan krim dengan kandungan flavonoid teh sebagai senyawa aktif. Kompleks antara AlCl3 dan kuersetin dapat diukur pada
panjang gelombang visibel (427,4 nm).
Parameter validitas metode analisis yang digunakan adalah akurasi dan presisi. Parameter tersebut diperoleh dengan perhitungan recovery dan koefisien variasi (CV). Dari percobaan didapatkan nilai recovery sebesar 89,49 - 96,85 %, koefisien variasi sebesar 3,14%. Dapat disimpulkan bahwa penetapan kadar kuersetin dalam sediaan krim dengan metode kolorimetri memiliki nilai validitas yang baik.
Kata kunci : validasi, penetapan kadar, kuersetin, krim, akurasi, presisi
ABSTRACT
Tea effects for health have been known for a long time. Tea contain flavonoid which have antioxidant activity and chromophore so it can be used as active compound in sunscreen cream.
It is non experimental research, because there was no manipulation to the research subject. The aim for this study is to know the accuracy and precision of determination method of quercetin in cream using base cream created by Prasetya (2008). Quercetin is one of flavonoid group that can be used as standard in this experiment. This research is useful as first phase experiment which can be applicated to determine flavonoid concentration in cream that contains tea flavonoid as active compound. The complex between AlCl3 and quercetin can be
measured at visible wavelength (427,4 nm).
Accuracy and precision was used to measure the validity of analysis method. The measurements were obtained from analyzing recovery and Coefficient variance (CV). The result of the recovery was 89,49 - 96,85 %, and the result of coefficient varians was 3.14%. It could be concluded that the determination of quercetin in cream using colometric method has good accuracy and precision
Keyword : validity, determination concentration, quercetin, cream, precision, accuracy
BAB I PENGANTAR
A. Latar Belakang
Krim merupakan salah satu bentuk sediaan yang banyak digunakan
untuk penyakit topikal. Di dunia industri, perlu dilakukan pengujian terhadap
produk akhir, terlebih jika digunakan senyawa yang berasal dari bahan alam
(Lund, 1994). Analisis kuantitatif senyawa aktif dalam sediaan krim diperlukan
sebagai kontrol kualitas untuk menjamin bahwa proses produksi telah dilakukan
dengan benar dan dapat dipercaya. Hal ini didasarkan pada asumsi bahwa efek
yang dihasilkan dalam suatu sediaan disebabkan karena kandungan senyawa
aktifnya.
Salah satu jenis senyawa yang digunakan sebagai zat aktif dalam sediaan
krim adalah flavonoid teh. Tokusoglu dkk., (2003) mengemukakan kegunaan
flavonoid antara lain sebagai agen antiinflamasi, antioksidan dan antialergi.
Aktivitas flavonoid teh sebagai antioksidan dapat digunakan untuk melindungi
kulit dari pengaruh buruk sinar UV yang berasal dari paparan sinar matahari
(Svobodova dkk, 2003). Selain itu, flavonoid teh memiliki gugus kromofor yang
mengabsorpsi sinar UV sehingga dapat digunakan sebagai zat aktif dalam krim
sunscreen.
Kuersetin merupakan salah satu jenis flavonoid golongan flavonol
(Bruneton 1999). Kuersetin digunakan sebagai baku untuk penetapan kadar dalam
sediaan krim dengan metode kolorimetri. Penelitian ini bermanfaat sebagai
penelitian awal yang dapat dikembangkan untuk menetapkan kadar flavonoid
dalam sediaan krim dengan kandungan flavonoid teh sebagai senyawa aktif.
Penelitian mengenai penetapan kadar kuersetin dalam sediaan krim
belum pernah dilakukan, oleh karena itu dibutuhkan suatu metode penetapan
kadar yang tervalidasi. Suatu metode perlu divalidasi agar ketika digunakan
dengan benar dapat memberikan hasil yang sesuai untuk tujuan analisis (Anonim,
2004). Penelitian ini berguna untuk menemukan langkah kerja yang tepat dan
untuk mengetahui apakah prosedur penetapan kadar kuersetin dalam sediaan krim
memenuhi parameter metode analisis yang ditentukan. Suatu prosedur analitik
mencakup informasi mengenai preparasi sampel, termasuk metode ekstraksi zat
aktif dari produk (Anonim, 2004). Prosedur penetapan kadar kuersetin dalam
sediaan krim pada penelitian ini merupakan modifikasi prosedur ekstraksi aglikon
flavonoid dalam tanaman yang dilakukan oleh Janeska dkk. (2007).
Penelitian ini merupakan lanjutan dari penelitian Prasetya (2008) yang
telah mengoptimasi formula sediaan krim sunscreen ekstrak kering polifenol teh
hijau (Camelia sinensis) dengan asam stearat dan VCO sebagai fase minyak.
Sediaan krim yang telah dioptimasi dalam penelitian tersebut digunakan sebagai
basis krim untuk penetapan kadar kuersetin pada penelitian ini.
Penetapan kadar kuersetin dalam sediaan krim pada penelitian ini
dilakukan dengan metode kolorimetri dengan pereaksi aluminium klorida (AlCl3).
Metode ini dipilih karena reaksi warna dapat meningkatkan kepekaan dan
selektifitas metode (Fell, 1986). Flavonoid dapat membentuk kompleks warna
3
Menurut Mursyidi (1990), dengan adanya pereaksi AlCl3, terjadi kompleks tahan
asam pada gugus hidroksi dan keton yang bertetangga. Sedangkan dengan gugus
hidroksi pada kedudukan orto, kompleks yang terjadi tidak tahan asam.
Metode kolorimetri yang sama juga pernah digunakan oleh Pertiwi
(2006) untuk penetapan kadar flavonoid dalam fraksi air dan fraksi etil asetat
ekstrak etanol teh hijau dan teh hitam..Hasil penelitian tersebut menunjukkan
bahwa metode tersebut dapat diaplikasikan untuk menetapkan kadar flavonoid
total dalam teh hijau dan teh hitam dan memiliki tingkat validitas yang baik.
Berdasarkan penelitian tersebut, maka kuersetin dalam sediaan krim pada
penelitian ini dapat ditetapkan kadarnya menggunakan metode kolorimetri dengan
pereaksi AlCl3.
B. Perumusan Masalah
Permasalahan yang akan diteliti adalah apakah penetapan kadar
kuersetin dalam sediaan krim secara kolorimetri dengan pereaksi AlCl3 memenuhi
parameter validasi metode analisis yang baik?
C. Keaslian Karya
Sejauh yang diketahui penulis, penelitian mengenai validasi penetapan
kadar kuersetin dalam sediaan krim secara kolorimetri dengan pereaksi AlCl3
D. Manfaat Penelitian Dari penelitian ini diharapkan dapat:
1. Menambah wawasan di bidang ilmu pengetahuan mengenai penetapan kadar
kuersetin dalam sediaan krim dengan secara kolorimetri dengan pereaksi
AlCl3 yang tervalidasi
2. Penelitian ini dapat digunakan sebagai acuan jika hendak dilakukan penelitian
sejenis maupun penelitian pengembangan dari penelitian ini.
E. Tujuan Penelitian
Tujuan dari penelitian yang dilakukan adalah mengetahui validitas
penetapan kadar kuersetin dalam sediaan krim secara kolorimetri dengan pereaksi
BAB II
PENELAAHAN PUSTAKA
A. Krim
Krim adalah bentuk sediaan setengah padat mengandung satu atau lebih
bahan obat terlarut atau terdispersi dalam bahan dasar yang sesuai. Krim
merupakan bentuk sediaan setengah padat yang mempunyai konsistensi relatif cair
diformulasi sebagai emulsi air dalam minyak atau minyak dalam air. Sekarang ini
produksi lebih diarahkan untuk emulsi minyak dalam air yang dapat dicuci dengan
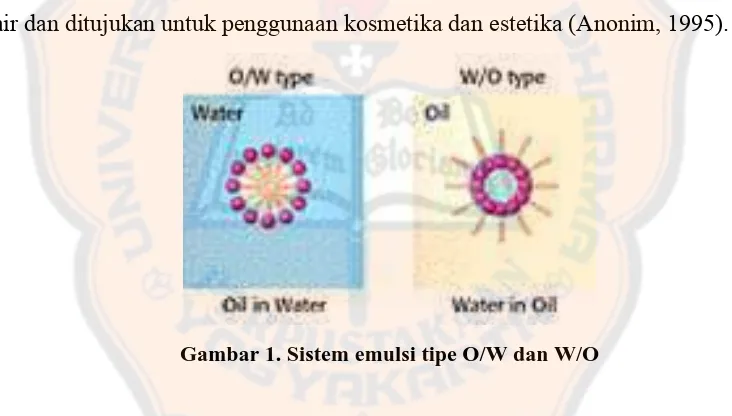
air dan ditujukan untuk penggunaan kosmetika dan estetika (Anonim, 1995).
Gambar 1. Sistem emulsi tipe O/W dan W/O
Emulsi adalah sistem heterogen yang mengandung minimal satu cairan
yang tidak campur, didispersikan pada cairan lainnya dalam bentuk droplet.
Emulsi terdiri dari fase dispers (fase internal), medium dispers (fase eksternal),
dan agen pengemulsi. Diameter droplet umumnya 0,1 sampai 10 µm. Krim
ditujukan untuk penggunaan eksternal.
Istilah krim biasanya ditujukan untuk emulsi tipe minyak dalam air sehingga lebih
sesuai untuk penggunaan eksternal. Emulsi air dalam minyak bersifat tidak larut
air, tidak mudah tercuci, dan terasa berminyak, sedangkan emulsi minyak dalam
air akan bercampur dengan air, tercuci oleh air, dan tidak terasa berminyak (Allen,
2002). Salah satu aplikasi bentuk sediaan krim yaitu sebagai sediaan sunscreen.
Sunscreen merupakan bahan yang menyerap atau memantulkan radiasi sehingga
melemahkan energi ultraviolet sebelum terpenetrasi ke kulit (Stanfield, 2003).
B. Analisis Sediaan Krim
Analisis senyawa dalam sediaan krim dapat dilakukan dengan cara
merusak bentuk sediaan kemudian mengekstraksi senyawa dalam sediaan tersebut
dengan pelarut yang sesuai. Krim pada dasarnya merupakan sistem emulsi yang
berisi fase minyak, fase air, dan emulgator. Emulgator berfungsi menurunkan
tegangan permukaan antara fase air dan fase minyak sehingga terbentuk sistem
emulsi. Sifat khas dari emulgator adalah memiliki gugus polar dan nonpolar pada
strukturnya. Jika emulgator dalam sediaan krim dirusak, maka sistem emulsi akan
terpecah dan terjadi pemisahan fase air dan fase minyak (Voigt, 1994).
Selanjutnya, untuk memisahkan analit dari senyawa-senyawa lain dilakukan
ekstraksi cair-cair menggunakan pelarut organik.
Emulgator menurut jenisnya terbagi menjadi emulgaor ionik (anionik
dan kationik), emulgator nonionik, dan emulgator amfoter. Contoh emulgator
amfoterik adalah N-alkil asam amino, contoh emulgator nonionik adalah eter
7
satu emulgator anionik adalah trietanolaminstearat, yang disebut juga dengan
sabun organik. Emulgator anionik dapat dirusak strukturnya menggunakan asam.
Ion H+ dari asam akan ditangkap oleh gugus R-COO- menjadi R-COOH, sehingga
trietanolaminstearat akan kembali menjadi bentuk trietanolamin dan asam stearat
(Cunniff, 1995; Senzel, 1977).
C. Flavonoid 1. Struktur dan kegunaan flavonoid
Tokusoglu dkk. (2003) mengemukakan flavonoid mempunyai aktivitas
antara lain sebagai agen antiinflamasi, antioksidan dan antialergi. Selain itu,
flavonoid juga memiliki aktivitas sebagai antivirus dan antikarsinogenik
(Harborne, 1994). Flavonoid merupakan senyawa pereduksi yang baik dan banyak
menghambat reaksi oksidasi dan bertindak sebagai penangkap radikal yang baik
dari radikal hidroksi dan superoksida (Robinson,1995). Aktivitas sebagai
antioksidan dimiliki oleh sebagian besar flavonoid disebabkan oleh adanya gugus
hidroksi fenolik dalam struktur molekulnya. Ketika bereaksi dengan radikal bebas,
flavonoid membentuk radikal baru yang distabilkan oleh efek resonansi benzen.
2.Isolasi flavonoid
Flavonoid berupa senyawa polifenol, sehingga mempunyai sifat kimia
seperti fenol. Adanya gula yang terikat pada aglikon akan menaikkan
kepolaritasan dari flavonoid. Senyawa polar akan larut dalam pelarut polar, oleh
karena itu glikosida flavonoid larut dalam pelarut polar (Mursyidi, 1990). Secara
umum, glikosida larut dalam air dan alkohol. Bentuk gula dari flavonoid bersifat
larut air, sedangkan aglikon flavonoid bersifat lipofilik (Bruneton, 1999).
Hidrolisis glikosida flavonoid akan menghasilkan aglikon flavonoid dan
gula yang selanjutnya dapat dipisahkan dan diidentifikasi. Untuk tujuan ini
digunakan cara hidrolisis, yaitu dengan asam, enzim, dan basa (Mursyidi, 1990).
3.Kuersetin
Kuersetin adalah senyawa flavonoid golongan aglikon flavonol. Dalam
tumbuhan, flavonoid biasanya terikat dalam bentuk glikosida flavonoid
(Robinson, 1995). Budavari (1989) menyebutkan bahwa aglikon kuersetin tidak
larut dalam air. Menurut Chebil dkk. (2007) aseton merupakan pelarut yang paling
baik untuk melarutkan flavonoid. Kuersetin mempunyai aktivitas sebagai
antioksidan, antiinflamasi, antiplatelet, antineoplastik, antiviral, dan antihistamin
9
4. Metode kuantifikasi flavonoid
Metode kuantifikasi flavonoid klasik yang paling banyak digunakan
adalah kolorimetri atau spektrofotometri, dengan menggunakan pereaksi AlCl3
(Bruneton, 1999).
Aluminium klorida digunakan sebagai pereaksi pengompleks dengan
gugus orto-dihidroksi dan menimbulkan pergeseran khas menuju pita panjang
gelombang tinggi yang berguna pada analisis beberapa golongan flavonoid
(Robinson, 1995).
Pereaksi AlCl3 dan flavonoid akan membentuk kompleks tahan asam
antara gugus hidroksi dan keton yang bertetangga. Sedangkan dengan gugus
hidroksi pada kedudukan orto, kompleks yang terjadi tidak tahan asam (Mursyidi,
1990).
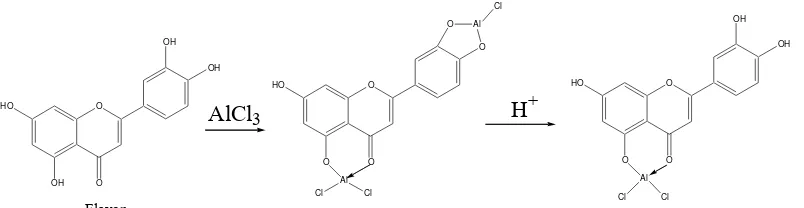
Tipe kompleks yang dihasilkan antara AlCl3 dengan beberapa flavon dan
flavonol dengan ada atau tidaknya asam digambarkan sebagai berikut:
O
O
Gambar 7. Reaksi pembentukan kompleks antara AlCl3 dengan flavon
D. Ekstraksi Cair-cair
Ekstraksi adalah suatu metode pemisahan komponen dari suatu
campuran dengan menggunakan suatu pelarut. Metode ini paling sering digunakan
untuk proses pemisahan. Alat yang digunakan tidak khusus dan sederhana, jika
tidak dinyatakan lain, maka alat yang digunakan untuk pemisahan adalah corong
pisah (Khopkar,1990).
Ekstraksi pelarut dapat dilakukan baik dalam tingkat makro maupun
mikro. Prinsip metode ini didasarkan pada distribusi zat tersebut dengan
perbandingan tertentu antara dua pelarut yang tidak saling bercampur. Zat terlarut
dapat ditransfer pada jumlah yang berbeda dalam kedua fase pelarut
(Khopkar,1990).
Pada kesetimbangan akan terjadi:
[
X1[
X]
]
adalah kadar zat terlarut pada pase pertama (fase organik),
sedangkan adalah kadar zat terlarut pada fase kedua (fase air). Semakin
11
pada fase organik. Sedangkan nilai KD yang kecil menunjukkan bahwa kadar zat
yang terlarut dalam fase organik kecil (Khopkar,1990).
E. Spektrofotometri Visibel 1. Interaksi elektron dengan radiasi elektromagnetik
Suatu senyawa organik memiliki tiga macam elektron, antara lain
elektron pi (π), sigma (σ), dan elektron pasangan bebas (n). Jika suatu molekul
terpancar radiasi elektromagnetik, maka akan terjadi eksitasi elektron ke tingkat
yang lebih tinggi (Mulya dan Suharman, 1995). Metode spektroskopik analisis
tergantung pada pengukuran radiasi elektromagnetik yang diabsorpsi oleh analit
(Skoog, 1994).
Eksitasi elektron σ ke σ* terjadi pada ikatan tunggal, eksitasi elektron π
ke π* terjadi pada ikatan rangkap dua dan tiga. Sedangkan eksitasi elektron n ke σ* atau n ke π* terjadi pada atom yang memiliki pasangan elektron bebas (Mulya
dan Suharman, 1995).
2. Analisis kuantitatif menggunakan spektrofotometri visibel
Analisis kuantitatif zat tunggal dengan metode spektrofotometri visibel
dilakukan dengan mengukur harga absorbansi (A) pada panjang gelombang
maksimum. Alasan dilakukan pengukuran pada panjang gelombang tersebut
adalah: perubahan absorban untuk setiap satuan kadar adalah paling besar pada
panjang gelombang maksimal, sehingga akan diperoleh kepekaan analisis yang
datar dan pengukuran ulang memberikan kesalahan yang kecil sehingga akan
memenuhi hukum Lambert-Beer (Mulya dan Suharman, 1995).
3. Kolorimetri
Metode kolorimetri dapat digunakan untuk penetapan kadar flavonoid
yaitu dengan menggunakan pereaksi AlCl3. Terjadi kompleks tahan asam antara
gugus hidroksi dan keton yang bertetangga dengan pereaksi AlCl3 dan
membentuk kompleks tidak tahan asam dengan gugus ortohidroksi pada
flavonoid. Oleh karena itu, pereaksi AlCl3 digunakan untuk mendeteksi kedua
gugus tersebut (Mursyidi, 1990).
Penetapan kadar secara kolorimetri harus memenuhi beberapa kriteria,
antara lain (Vogel, 1994):
1. Selektivitas reaksi warna
2. Kesebandingan antara warna dan kadar
3. Kestabilan warna
4. Reprodusibilitas
5. Kejernihan larutan
6. Sensitivitas
F. Validasi Metode Analisis
Validasi merupakan suatu dasar untuk memastikan kualitas dan
reliabilitas hasil analisis (Ermer and Miller, 2005). Parameter-parameter validasi
13
1. Akurasi, menunjukkan kedekatan hasil analisis yang diperoleh menggunakan
metode analisis tertentu dengan nilai yang sebenarmya. Penentuan akurasi
metode analisis dapat dilakukan dengan cara membandingkan kadar terukur
dari suatu senyawa standar yang sengaja ditambahkan ke dalam sampel pada
jumlah yang tertentu pula. Harga perbandingan tersebut dikenal sebagai
persen perolehan kembali (recovery) (Anonim, 2003). Tabel berikut ini ialah
kriteria penerimaan akurasi yang baik
Tabel I. Kriteria akurasi metode analisis
Kadar zat aktif /
impurities yang diukur (%)
Rata-rata recovery
yang diterima (%) ≥ 10 98 – 102
≥1 90 - 110 0,1 – 1 80 - 120 < 0,1 75 - 125
(Anonim,2004)
2. Presisi, merupakan kedekatan suatu hasil analisis dengan hasil analisis yang
lain pada beberapa penentuan kuantitatif pada sampel yang sama dan
homogen dengan menggunakan metode analisis yang sama. Presisi biasanya
dinyatakan dengan persen koefisien variansi (CV). Tabel berikut ini ialah
kriteria penerimaan presisi yang baik
Tabel II. Kriteria presisi metode analisis
3. Spesifisitas (selektivitas), menunjukkan kemampuan suatu metode analisis
untuk mengukur suatu analit dalam campuran yang kompleks tanpa adanya
pengaruh dari komponen lain dalam campuran (Christian, 2004).
4. Limit of detection (LOD) merupakan jumlah analit terkecil yang masih dapat
terdeteksi.
5. Limit of quantitation (LOQ) merupakan jumlah analit terkecil yang masih
dapat terukur dengan akurasi dan presisi yang dapat diterima.
6. Linearitas, merupakan kemampuan metode analisis untuk menghasilkan nilai
yang proporsional terhadap kadar analit dalam sampel pada rentang kadar
tertentu (Christian, 2004).
7. Range, merupakan rentang kadar terendah sampai kadar tertinggi analit yang
dapat diukur secara kuantitatif menggunakan metode analisis tertentu dan
menghasilkan akurasi, presisi, dan linearitas yang memadai (Anonim, 2003).
G. Landasan teori
Penetapan kadar senyawa dalam sediaan krim dapat dilakukan dengan
cara merusak sediaan dan menarik analit dengan pelarut yang sesuai. Pemilihan
pelarut didasarkan pada sifat kelarutan analit.
Krim terdiri atas minyak dan air yang membentuk emulsi dengan
bantuan emulgator. Pada sediaan krim yang mengandung emulgator anionik,
struktur emulgator tersebut dapat dirusak dengan menggunakan asam sehingga
15
analit dalam sediaan krim memiliki kelarutan yang baik dalam etil asetat sehingga
kuersetin dalam krim dapat diekstraksi menggunakan pelarut etil asetat.
Kuersetin mempunyai gugus –OH yang bertetangga dengan gugus
karbonil dan 2 gugus –OH pada posisi orto sehingga dapat membentuk kompleks
dengan pereaksi AlCl3. Kompleks antara kuersetin dengan AlCl3 dapat diukur
secara kuantitatif menggunakan spektrofotometer visibel.
Penetapan kadar kuersetin dalam sediaan krim secara kolorimetri dengan
pereaksi AlCl3 dinyatakan valid jika memenuhi parameter validasi metode
analisis.
H. Hipotesis
Berdasarkan landasan teori di atas, maka penetapan kadar kuersetin
dalam sediaan krim secara kolorimetri dengan pereaksi AlCl3 memiliki validitas
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk penelitian non eksperimental karena tidak
dilakukan manipulasi terhadap subjek penelitian.
B. Definisi Operasional
1. Penetapan kadar kuersetin dilakukan menggunakan metode kolorimetri
dengan menggunakan pereaksi AlCl3
2. Parameter validasi penetapan kadar kuersetin dalam sediaan krim yang
digunakan adalah akurasi dan presisi.
3. Penentuan akurasi dan presisi penetapan kadar kuersetin dalam krim dilakukan
dengan menambahkan larutan baku kuersetin dengan kadar tertentu ke dalam
basis krim, diekstraksi, dan diukur kadarnya dengan spektrofotometer visibel.
4. Basis krim yang digunakan adalah krim dengan komposisi yang telah
ditentukan, yaitu: asam stearat, virgin coconut oil (VCO), trietanolamin
(TEA), cethyl alcohol, metil paraben, asam sitrat, dan air.
C. Variabel Penelitian
Variabel dalam penelitian ini adalah kadar kuersetin yang terdapat dalam
sediaan krim
17
D. Alat dan Bahan Penelitian
Alat yang digunakan dalam penelitian ini adalah: seperangkat alat
spektrofotometer UV-Vis (Perkin-Elmer Lambda 20), pipet mikro 0,5 – 5,0 ml
(Socorec), neraca analitik merk Scaltec SBC 22 max 60/210 g; d = 0,01/0,1 mg; e
= 1 mg, waterbath, alat-alat gelas (Pyrex-Germany).
Bahan yang digunakan dalam penelitian ini adalah baku kuersetin
trihidrat p.a. (Sigma), etil asetat p.a. (Merck), aseton p.a. (Merck), HCl p.a.
(Merck), asam asetat p.a. (J.T. Bakker), metanol p.a. (J.T. Bakker), kloroform p.a.
(Merck), AlCl3.6H2O p.a. (Merck), heksamin farmasetis (MKR), natrium sitrat
farmasetis (MKR), akuades, dan basis krim dengan formula sebagai berikut:
Asam stearat 4,0 g
Virgin Coconut Oil (VCO) 3,5 g Trietanolamin (TEA) 0,8 g
Cethyl Alcohol 3,5 g
Asam sitrat 0,5 g
Metil paraben 0,25 g
Air 60,0 g
E. Tata Cara Penelitian 1. Pembuatan pereaksi
a. Larutan HCl 25 % dalam akuades. HCl 37 % 67,56 ml dimasukkan ke
dalam labu ukur 100 ml. Akuades ditambahkan ke dalam labu tersebut hingga
b. Larutan heksamin 0,5 % dalam akuades. Heksamin 0,5 gram
dimasukkan ke dalam labu ukur 100 ml. Akuades ditambahkan ke dalam labu
tersebut hingga tanda.
c. Larutan natrium sitrat 0,5 % dalam akuades. Natrium sitrat 0,5 gram
dimasukkan ke dalam labu ukur 100 ml. Akuades ditambahkan ke dalam labu
tersebut hingga tanda.
d. Larutan asam asetat 5 % dalam metanol. Asam asetat glasial 25 ml
dimasukkan ke dalam labu ukur 500 ml. Metanol ditambahkan ke dalam labu ukur
tersebut hingga tanda.
e. Larutan aluminium klorida 2% dalam asam asetat 5 % dalam metanol.
Aluminium klorida 2 g dimasukkan ke dalam labu ukur 100 ml. Asam asetat 5 %
dalam metanol 25 ml ditambahkan ke dalam labu ukur tersebut. Larutan
didegassing selama 5 menit. Asam asetat 5 % dalam metanol ditambahkan ke
dalam labu ukur sampai tanda.
2. Pembuatan larutan baku
a. Larutan stok kuersetin 500 ppm. Sebanyak kurang lebih 25,0 mg
serbuk kuersetin ditimbang seksama dan dimasukkan dalam labu ukur 50 ml. Etil
asetat 15 ml ditambahkan ke dalam labu ukur tersebut. Larutan didegassing
selama 5 menit. Etil asetat ditambahkan ke dalam labu ukur sampai tanda.
b. Larutan intermediet kuersetin 50 ppm. Larutan stok kuersetin 500
ppm 2,50 ml dimasukkan dalam labu ukur 25 ml. Larutan diencerkan dengan etil
19
3. Pembuatan blangko
Etil asetat 10,0 ml dimasukkan ke dalam labu ukur 25 ml. Setelah itu
ditambahkan AlCl3 2 % (dalam asam asetat 5 % dalam metanol) 1,0 ml dan
natrium sitrat 0,5 ml. Larutan diencerkan dengan asam asetat 5 % dalam metanol
sampai tanda.
4. Optimasi metode
a. Penetapan Operating time. Larutan intermediet kuersetin 50 ppm 2,0
ml dimasukkan ke dalam labu ukur 25 ml. AlCl3 2 % (dalam asam asetat 5 %
dalam metanol) 1,00 ml dan natrium sitrat 0,50 ml ditambahkan ke dalam labu
tersebut. Larutan diencerkan dengan asam asetat 5 % dalam metanol sampai
tanda. Absorbansi diukur pada panjang gelombang maksimum teoritis (428 nm)
selama 60 menit.
b. Penetapan panjang gelombang absorbansi maksimum. Larutan
intermediet kuersetin 50 ppm 1,50 ml; 3,00 ml; 4,00 ml dimasukkan dalam labu
ukur 25 ml. Ke dalam labu ukur tersebut ditambahkan AlCl3 2 % (dalam asam
asetat 5 % dalam metanol) 1,00 ml dan natrium sitrat 0,50 ml. Larutan diencerkan
dengan asam asetat 5 % dalam metanol sampai tanda. Absorbansi diukur pada
menit ke-30 setelah ditambah pereaksi pada rentang panjang gelombang 400-500
nm.
c. Penetapan kurva baku. Larutan intermediet kuersetin 50 ppm 1,00 ml;
labu ukur 25 ml. AlCl3 2 % (dalam asam asetat 5 % dalam metanol) 1,00 ml dan
natrium sitrat 0,50 ml ditambahkan ke dalam labu ukur. Larutan diencerkan
dengan asam asetat 5 % dalam metanol sampai tanda. Pengukuran absorbansi
dilakukan pada menit ke-30 setelah ditambah pereaksi pada panjang gelombang
427,4 nm.
5. Penetapan kadar kuersetin dalam sediaan krim a. Pembuatan basis krim
Tabel III. Formula basis krim
Senyawa penyusun formula basis krim
Komposisi (g) Asam stearat 4,0
VCO 3,5
Cethyl alcohol 3,5 Trietanolamin 0,8
Akuades 60,0
Metil paraben 0,25 Asam sitrat 0,5 g
Asam stearat dan cethyl alcohol dilelehkan secara terpisah di atas
waterbath, kemudian dicampur dalam keadaan panas. Trietanolamin, VCO dan
metil paraben ditambahkan ke dalam campuran tersebut dan diaduk hingga
merata. Akuades sebanyak 2/3 bagian ditambahkan ke dalam campuran dan
dicampur menggunakan mikser dengan kecepatan 400 rpm selama 15 menit.
Asam sitrat dilarutkan ke dalam 1/6 bagian akuades, kemudian ditambahkan ke
dalam campuran sedikit demi sedikit sambil diaduk dengan mikser kecepatan 400
rpm selama 30 menit. Sisa akuades ditambahkan ke dalam campuran sambil
21
b. Ekstraksi kuersetin dari basis krim. Basis krim lebih kurang 20 g
ditimbang seksama kemudian dimasukkan ke dalam labu alas bulat dengan
bantuan batang pengaduk. Larutan baku kuersetin 200 ppm (dalam aseton) 5,0 ml
ditambahkan ke dalam labu alas bulat tersebut. Aseton 25 ml ditambahkan ke
dalam labu alas bulat. Larutan heksamin 0,5% 1,00 ml dan larutan HCl 25% 2,00
ml ditambahkan ke dalam labu alas bulat, refluks dengan pemanasan dalam
waterbath pada suhu 70°C selama 30 menit.
Setelah dihidrolisis selama 30 menit, pendingin balik dilepas kemudian
aseton diuapkan menggunakan waterbath pada suhu 75°C selama 1 jam. Setelah
itu, fase air dan fase minyak dalam labu alas bulat dituang ke dalam corong pisah
100 ml. Etil asetat 15 ml ditambahkan ke dalam corong pisah tersebut. Larutan
digojog selama 30 detik dan diamkan hingga memisah selama 15 menit. Pisahkan
kedua fase yang terbentuk. Fase air diekstraksi kembali dengan 15 ml etil asetat
sebanyak 2 kali. Fase etil asetat ditampung dalam beaker glass 100 ml dan
diuapkan di atas waterbath. Fase etil asetat yang telah diuapkan dibiarkan hingga
dingin. Setelah dingin, fase etil asetat disaring menggunakan kertas saring dan
dimasukkan ke dalam labu ukur 50 ml, lalu etil asetat ditambahkan hingga tanda.
c. Tahap penetapan kadar kuersetin. Fase etil asetat 10,0 ml dimasukkan
ke dalam labu ukur 50 ml. Sebanyak AlCl3 2 % (dalam asam asetat 5 % dalam
metanol) 1,00 ml dan natrium sitrat 0,50 ml ditambahkan ke dalam labu ukur
tersebut. Larutan diencerkan dengan asam asetat 5 % dalam metanol sampai
tanda. Absorbansi diukur pada operating time, yaitu pada menit ke-30 setelah
F. Analisis Hasil
Analisis kuantitatif yang dilakukan dalam penelitian ini adalah
penetapan kadar kuersetin dalam sediaan krim dengan cara memasukkan nilai
absorbansi ke dalam persamaan kurva baku sehingga didapatkan kadar kuersetin
dalam sediaan krim.
Analisis penetapan kadar kuersetin dalam sediaan krim dilakukan
dengan parameter akurasi dan presisi. Akurasi dinyatakan dengan perhitungan %
recovery sebagai berikut:
%
Suatu metode dinyatakan memiliki akurasi yang baik jika pada kadar analit <0,1%
nilai % recovery berada pada rentang 75-125%.(Anonim, 2004).
Presisi dinyatakan dengan perhitungan koefisien variasi (% CV) sebagai
berikut
Suatu metode dinyatakan memiliki presisi yang baik jika pada kadar analit <0,1%
BAB IV
HASIL DAN PEMBAHASAN
A. Pemilihan Baku
Tujuan penelitian ini adalah memvalidasi metode penetapan kadar
senyawa dalam sediaan krim sehingga dapat diaplikasikan untuk penetapan kadar
flavonoid dalam sediaan krim yang berisi ekstrak teh hijau. Baku yang digunakan
dalam penelitian ini adalah kuersetin. Pemilihan baku kuersetin didasarkan karena
kuersetin merupakan salah satu jenis flavonoid yang terdapat dalam ekstrak teh
hijau. Kuersetin juga merupakan senyawa yang memiliki aktivitas antioksidan
sehingga dipercaya dapat mencegah efek buruk dari sinar UV.
Selain kuersetin senyawa yang banyak terdapat pada ekstrak teh hijau
adalah katekin. Kuersetin dan katekin dapat menangkap reactive oxygen species
(ROS) yang dihasilkan akibat paparan sinar UV. Mekanisme senyawa yang
mempunyai aktivitas antioksidan adalah dengan menangkap ROS dan kemudian
senyawa tersebut akan menstabilkan dirinya dengan adanya resonansi. Struktur
katekin dan kuersetin (gambar 9) memiliki struktur benzen yang sama sehingga
kemungkinan terjadinya resonansi adalah sama.
Kuersetin dapat digunakan sebagai baku meskipun senyawa mayor yang
terdapat dalam teh hijau adalah katekin. Pada penetapan kadar flavonoid teh hijau
senyawa yang dapat bereaksi dengan AlCl3 bukan hanya kuersetin saja, senyawa
flavonoid lain yang memiliki gugus ortohidroksi juga dapat bereaksi dengan AlCl3
dan dapat ditetapkan kadarnya. Berdasarkan alasan tersebut maka kuersetin dapat
digunakan sebagai baku dalam penelitian ini.
Gambar 8. Struktur katekin (A) dan struktur kuersetin (B) serta gugus-gugus yang dapat bereaksi dengan AlCl3
B. Optimasi Metode 1. Penetapan operating time
Penetapan operating time bertujuan untuk menentukan waktu
pengukuran suatu senyawa yang memberikan absorbansi paling stabil. Penetapan
operating time perlu dilakukan untuk meminimalkan terjadinya kesalahan
pengukuran. Hal ini disebabkan karena senyawa yang akan diukur absorbansinya
dalam penelitian ini merupakan suatu senyawa kompleks antara kuersetin dengan
AlCl3. Senyawa kompleks ini membutuhkan waktu agar reaksi yang terbentuk
stabil. Bila pengukuran dilakukan sebelum operating time, maka terdapat
kemungkinan reaksi yang terbentuk belum sempurna. Pada gambar 9 ditunjukkan
bahwa ikatan yang terbentuk antara AlCl3 dengan gugus –OH posisi orto pada
kuersetin bersifat tidak stabil dengan adanya asam. Oleh sebab itu, diperlukan
penentuan operating time sehingga diperoleh rentang waktu pada saat absobansi
25
setelah operating time, terdapat kemungkinan bahwa senyawa kompleks antara
kuersetin dan AlCl3 menjadi rusak.
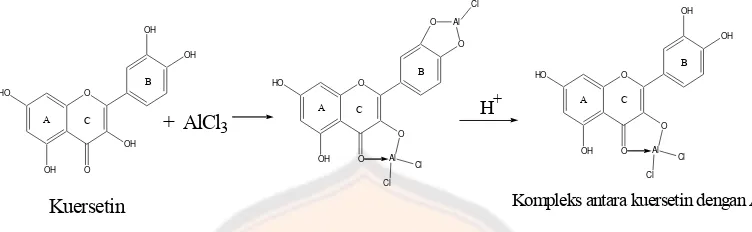
O
Kuersetin Kompleks antara kuersetin dengan AlCl3
H+
Gambar 9. Reaksi pembentukan kompleks antara kuersetin dengan AlCl3
Pengukuran operating time kompleks kuersetin dengan AlCl3 dilakukan
menggunakan larutan baku kuersetin dengan kadar 4 ppm pada panjang
gelombang maksimum teoritis yaitu 428 nm. Absorbansi kompleks yang
terbentuk diukur selama 60 menit. Kestabilan pembentukan warna ditandai
dengan stabilnya nilai absorbansi dari senyawa tersebut. Dari spektrum
pengukuran operating time (gambar 10), terlihat bahwa absorbansi yang
dihasilkan kompleks kuersetin dengan AlCl3 telah stabil sejak menit ke-25 hingga
menit ke-60. Hal ini ditunjukkan dengan spektrum yang membentuk garis hampir
lurus pada menit ke-25 hingga menit ke-60, artinya pada rentang waktu tersebut,
absorbansi senyawa yang terukur relatif stabil. Kestabilan absorbansi ini
menandakan reaksi pembentukan kompleks sudah optimum. Dari percobaan
Gambar 10. Spektrum pengukuran operating time kompleks antara
2. Penetapan panjang gelombang maksimum
Penetapan panjang gelombang maksimum bertujuan untuk menentukan
panjang gelombang pengukuran dimana kompleks antara kuersetin dengan AlCl3
memberikan absorbansi optimum. Penetapan panjang gelombang maksimum
merupakan faktor penting dalam analisis kimia dengan metode spektrofotometri.
Pengukuran pada panjang gelombang maksimum akan memberikan perubahan
absorbansi paling besar untuk setiap satuan kadar. Selain itu, kurva absorbansi
pada sekitar panjang gelombang maksimum relatif datar sehingga jika akan
dilakukan pengukuran ulang dan replikasi akan meminimalkan terjadinya
kesalahan pengukuran.
Menurut Mabry (1970), panjang gelombang maksimum kompleks yang
terbentuk antara kuersetin dengan AlCl3 adalah 428 nm. Pada penelitian ini
dilakukan verifikasi penetapan panjang gelombang maksimum teoritis karena
27
penelitian dilakukan pada kondisi, alat, bahan, waktu dan individu yang berbeda
sehingga dapat dihasilkan panjang gelombang maksimum yang berbeda.
Penetapan panjang gelombang maksimum dilakukan terhadap tiga seri
kadar lar
3
Penetapan panja kukan pada larutan baku
kuersetin
utan baku kuersetin untuk memastikan bahwa pada panjang gelombang
tersebut benar-benar terjadi absorbansi yang maksimum dan untuk mengetahui
reprodusibilitas metode yang digunakan. Pembacaan absorbansi dilakukan pada
rentang panjang gelombang antara 400-500 nm karena kompleks antara kuersetin
dengan AlCl3 akan menghasilkan warna yang memiliki panjang gelombang
maksimum pada rentang tersebut.
Gambar 11. Spektrum pengukuran panjang gelombang maksimum kompleks antara kuersetin dengan AlCl
ng gelombang maksimum dila
dengan kadar 4 ppm, 6 ppm, dan 8 ppm. Hasil pengukuran panjang
larutan baku kuersetin didapat panjang gelombang maksimum untuk kadar 8 ppm
yaitu 427,4 nm dan untuk kadar 6 ppm 427,1 nm. Sedangkan untuk kadar 4 ppm,
spektrofotometer yang digunakan tidak dapat mendeteksi panjang gelombang
maksimum. Hal ini terjadi karena pada kadar tersebut didapatkan puncak kurva
yang relatif datar. Kurva dengan puncak yang relatif datar menunjukkan bahwa
absorbansi maksimum senyawa tersebut tidak terbaca pada satu titik panjang
gelombang sehingga spektrofotometer tidak dapat memberikan informasi secara
pasti berapa panjang gelombang pada saat absorbansinya maksimum.
Tabel IV. Hasil penetapan panjang gelombang maksimum
maksimum yang diperoleh
Kadar larutan kuersetin Panjang gelombang
4 ppm Tidak terdeteksi
6 ppm 427,1 nm
8 ppm 427,4 nm
Panjang gelo maksimum yang dipilih untuk penetapan kadar
kuersetin
mbang
dalam krim adalah 427,4 nm. Panjang gelombang ini dipilih karena
lebih mendekati panjang gelombang maksimum teoritisnya, yaitu 428 nm. Dalam
Farmakope Indonesia edisi IV (1995) disebutkan bahwa pengujian panjang
gelombang maksimum mempunyai makna jika absorbansi maksimum tersebut
tepat pada atau dalam batas 2 nm dari panjang gelombang yang ditentukan. Hasil
penelitian menunjukkan bahwa panjang gelombang maksimum yang didapat
adalah 427,4 nm, artinya absorbansi kompleks antara kuersetin dengan AlCl3
29
ini memiliki selisih kurang dari 2 nm dari panjang gelombang teoritisnya sehingga
panjang gelombang ini masih dapat diterima.
3. Penetapan kurva baku kuersetin
Nilai koefisien korelasi (r) menunjukkan hubungan linearitas antara dua
variabel. Nilai r > 0,99 menunjukkan bahwa terdapat hubungan linearitas yang
baik antar variabel tersebut (Christian 2004). Pada penetapan kurva baku kuersetin
ini, kadar kuersetin merupakan variabel bebas dan absorbansi kompleks antara
kuersetin dengan AlCl3 merupakan variabel tergantung.
Tabel V. Data hubungan antara kadar kuersetin dengan absorbansi kompleks kuersetin dengan AlCl3
Replikasi I Replikasi II Replikasi III
kadar
0,3194 0,181 0,3134 0,162 0,3065 0,172 0,4260 0,268 0,4179 0,236 0,4086 0,243 0,5324 0,314 0,5224 0,279 0,5108 0,290 0,6389 0,388 0,6269 0,324 0,6130 0,349 0,7454 0,444 0,7314 0,402 0,7151 0,404 0,8518 0,475 0,8358 0,486 0,8173 0,486
a = 0.002 a = -0,025 a = -0,008
b = 0.5560 b = 0,5914 b = 0,5906 r = 0.9919 r = 0,9926 r = 0,9971 α = 30.03° α = 30,45° α = 30,24º
Nilai r dari ketiga replikasi di atas lebih besar dari nilai r yang tertera
pada r tabel (derajat bebas 5, taraf kepercayaan 95%) yaitu 0,775. Pemilihan taraf
kepercayaan 95% didasarkan atas hal-hal berikut di bawah ini:
1. Prosedur penetapan kadar kuersetin dalam sediaan krim yang dilakukan
relatif panjang dan melibatkan beberapa tahap pengenceran sehingga
2. Toleransi kesalahan alat-alat gelas analitik yang digunakan pada penelitian
ini paling besar adalah ±0,05 sehingga taraf kepercayaan yang dipilih adalah
95%.
Dengan membandingkan nilai r yang didapat dari data dan dari r tabel, dapat
dikatakan bahwa ketiga replikasi tersebut memenuhi standard nilai r tabel. Dari
ketiga replikasi tersebut, dipilih salah satu persamaan kurva baku yang akan
digunakan untuk perhitungan kadar kuersetin selanjutnya. Pemilihan kurva baku
dilakukan berdasarkan replikasi yang memiliki nilai r yang paling mendekati satu.
Nilai r yang mendekati satu menunjukkan bahwa terdapat korelasi yang baik
antara kadar kuersetin dan absorbansi. Kadar kuersetin meningkat akan diikuti
dengan peningkatan absorbansi secara proporsional. Berdasarkan data yang
diperoleh, maka persamaan kurva baku yang dipilih adalah replikasi III, yaitu
y=0,5906x-0,008
0 0.1 0.2 0.3 0.4 0.5 0.6
0 0.2 0.4 0.6 0.8 1
kadar kuersetin (mg/100ml)
absorbansi komleks antara kuersetin denga
n
aluminium klorida
31
C. Ekstraksi Kuersetin dari Sediaan Krim
Sebelum menetapkan kadar kuersetin dalam sediaan krim, perlu
dilakukan ekstraksi senyawa dari dalam sediaan. Hal ini bertujuan untuk
menemukan langkah kerja yang tepat dalam menarik analit dari sampel (krim).
Ekstraksi merupakan bagian dari preparasi sampel untuk memperoleh
selektivitas (Christian 2004), sehingga didapatkan senyawa yang diinginkan
seoptimal mungkin. Metode ekstraksi yang digunakan adalah ekstraksi cair-cair
dengan menggunakan 2 jenis cairan yang tidak saling campur. Teknik ini dipilih
karena dapat memisahkan senyawa dengan cepat.
Krim dalam penelitian ini merupakan bentuk sediaan yang diformulasi
sebagai emulsi minyak dalam air. Krim terdiri dari dua fase, yaitu fase air dan fase
minyak yang dengan bantuan emulgator akan membentuk sistem emulsi. Di alam,
flavonoid biasanya terikat pada gula yang menyebabkan glikosida flavonoid
tersebut bersifat relatif polar dan dapat larut dalam air. Analit dalam percobaan
adalah kuersetin yang merupakan golongan flavonoid. Kuersetin merupakan
aglikon flavonoid dan tidak terikat pada gulanya. Bentuk glikosida flavonoid akan
larut dalam air (Bruneton, 1999), sedangkan kuersetin tidak larut dalam air
(Budavari, 1989). Berdasarkan kelarutannya, maka kuersetin akan berada dalam
fase minyak pada sediaan krim.
Kuersetin yang akan ditetapkan kadarnya pada penelitian ini adalah baku
kuersetin dengan kadar 200 ppm yang ditambahkan ke dalam basis krim.
agar jumlah kuersetin yang akan diekstraksi diketahui secara tepat. Basis krim dan
larutan baku kuersetin ini kemudian akan diproses dan ditetapkan kadarnya secara
kolorimetri menggunakan pereaksi AlCl3. Ekstraksi kuersetin dari sediaan krim
diawali dengan menambahkan aseton sebanyak 25 ml ke dalam basis krim yang
telah diberi larutan baku kuersetin 200 ppm. Penambahan aseton berguna untuk
menambah volume sampel sehingga memudahkan untuk proses selanjutnya
1. Tahap pemecahan sediaan krim
Larutan HCl 25 % berfungsi untuk memecah bentuk sediaan krim.
Gambar 13 menunjukkan sabun organik (trietanolamin stearat) yang terbentuk
dari asam stearat dan trietanolamin. Ion H+ dari HCl akan ditangkap oleh gugus
R-COO- menjadi R-COOH, sehingga trietanolaminstearat kembali menjadi
trietanolamin dan asam stearat. Rusaknya struktur trietanolaminstearat sebagai
emulgator akan mengakibatkan sistem emulsi terpecah menjadi fase air dan fase
minyak.
C1 7H3 5-C O O
-O H
C H2
C H2
H N
C H2
C H2
O H
C H2 C H2 O H
33
2. Tahap hidrolisis glikosida flavonoid
Pada penelitian ini hidrolisis glikosida flavonoid dilakukan
menggunakan asam (HCl 25%) untuk memecah glikosida flavonoid menjadi
aglikon flavonoid dan gulanya. Dalam penelitian ini, kuersetin sesungguhnya
tidak perlu dihidrolisis karena kuersetin sudah berada dalam bentuk aglikonnya.
Proses hidrolisis pada penelitian ini hanya dilakukan sebagai model jika akan
dilakukan penetapan kadar flavonoid. Flavonoid di alam terdapat dalam bentuk
glikosida flavonoid sehingga proses hidrolisis perlu dilakukan. Mekanisme reaksi
hidrolisis glikosida flavonoid oleh asam dapat dilihat pada gambar 14. Heksamin
0,5 % berguna untuk menangkap kelebihan ion H+ dari HCl agar tidak terjadi
oksidasi flavonoid oleh HCl.
HO
Proses hidrolisis pada penelitian ini dilakukan selama 30 menit pada
suhu 70°C. Pada penelitian ini tidak dilakukan optimasi proses hidrolisis (waktu
dan suhu hidrolisis) glikosida flavonoid. Markham (1988) menyebutkan bahwa
untuk glikosida flavonoid dengan ikatan gula pada 3-O-glikosida, hidrolisis terjadi
antara menit ke-8 hingga menit ke-30. Sedangkan glikosida flavonoid dengan
ikatan gula pada 4’-O-glikosida, hidrolisis terjadi antara menit ke-2 hingga menit
ke-8. Berdasarkan teori tersebut, maka dapat diasumsikan hidrolisis glikosida
flavonoid selama 30 menit sudah cukup mewakili proses hidrolisis ekstrak teh
hijau. Prosedur hidrolisis pada penelitian ini mengacu pada prosedur hidrolisis
flavonoid yang tertera pada Anonim (2000). Selama proses hidrolisis, di atas labu
alas bulat diberi pendingin balik untuk mengembunkan kembali pelarut sehingga
(campuran antara aseton dan air) tidak menguap.
3. Ekstraksi cair-cair
Tahap pemurnian dilakukan dengan ekstraksi menggunakan pelarut yang
tidak saling campur. Pada penelitian ini digunakan pelarut organik etil asetat yang
bertujuan untuk mengekstraksi aglikon kuersetin. Etil asetat adalah pelarut yang
baik untuk aglikon flavonoid dan dianjurkan dalam proses pemurnian (Robinson
1995). Bentuk gula dari flavonoid akan larut dalam air sehingga hanya aglikonnya
saja yang terekstraksi ke dalam fase etil asetat.
Aseton merupakan pelarut yang dapat bercampur dengan air maupun etil
asetat. Namun, karena indeks polaritas aseton (5,1) lebih mirip dengan indeks
polaritas etil asetat (4,4) dari pada air (9,0), maka dengan prinsip “like dissolves
35
Fase campuran antara etil asetat dan aseton akan berada di bagian atas,
sedangkan fase air akan berada di bagian bawah corong pisah. Hal ini disebabkan
karena berat jenis etil asetat (0,989 g/cm3) lebih kecil daripada air (1,000 g/cm3).
Etil asetat dan aseton merupakan pelarut yang lebih nonpolar dibanding air, maka
kuersetin akan lebih tertarik pada fase etil asetat dan aseton daripada fase air
karena kuersetin merupakan aglikon flavonoid yang bersifat relatif nonpolar.
Selain kuersetin, terdapat senyawa penyusun formula krim yang ikut
terekstraksi pada fase etil asetat. Senyawa tersebut antara lain asam stearat, cetyl
alcohol, metil paraben, dan virgin coconut oil (VCO). Meskipun senyawa tersebut
ikut terekstraksi dalam etil asetat, namun tidak mempengaruhi penetapan kadar
kuersetin menggunakan pereaksi AlCl3 karena senyawa tersebut tidak memiliki 2
gugus hidroksi pada posisi orto maupun gugus karbonil dan –OH yang berdekatan
sehingga tidak dapat bereaksi dengan AlCl3. Senyawa penyusun formula yang
larut dalam fase air adalah asam sitrat dan trietanolamin. Ekstraksi dilakukan
secara berulang sebanyak 3 kali bertujuan untuk mengefektifkan ekstraksi
sehingga analit yang didapat lebih banyak dibanding ekstraksi tunggal.
Fase etil asetat hasil ekstraksi disaring menggunakan kertas saring untuk
menyaring zat-zat pengotor atau partikel yang mungkin terdapat dalam sediaan
krim. Larutan perlu disaring untuk memenuhi syarat pengukuran menggunakan
spektrofotometer, yaitu larutan yang hendak diukur harus jernih. Fase etil asetat
hasil penyaringan kemudian ditetapkan kadarnya menggunakan metode
spektrofotometri visibel dengan pereaksi AlCl3.
D. Penetapan Kadar Sampel Kuersetin dalam Sediaan Krim
Penetapan kadar kuersetin dalam sediaan krim dilakukan secara
kolorimetri, yaitu pembentukan kompleks antara AlCl3 dengan kuersetin sehingga
terjadi pergeseran pita absorbsi menuju ke panjang gelombang yang lebih panjang
(batokromik). Senyawa lain penyusun formula basis krim selain kuersetin (metil
paraben) dapat mengabsorpsi radiasi elektromagnetik karena metil paraben juga
memiliki gugus kromofor dan auksokrom yang dapat dilihat pada gambar 15.
Metil paraben dan kuersetin dapat menyerap radiasi pada daerah UV (200nm-300
nm) sehingga penetapan kadar kuersetin lebih mudah dilakukan secara kolorimetri
yang memiliki selektivitas yang lebih baik daripada spektrofotometri ultraviolet.
Gambar 15. Struktur metil paraben (A) dan struktur kuersetin (B)
Penggunaan AlCl3 sebagai senyawa pengompleks karena dapat
membentuk kompleks dengan kuersetin yang mempunyai gugus –OH yang
bertetangga dengan gugus karbonil dan 2 gugus –OH pada posisi orto. Kompleks
yang terbentuk pada gugus ini bersifat stabil dengan adanya asam. Sedangkan
37
bersifat tidak stabil dengan adanya asam (Markham, 1988). Senyawa yang diukur
absorbansinya adalah kompleks AlCl3 dengan kuersetin yang berikatan pada
gugus –OH yang bertetangga dengan gugus karbonil.
O
Kuersetin Kompleks antara kuersetin dengan AlCl3
H+
Gambar 16. Reaksi pembentukan kompleks antara AlCl3 dengan kuersetin
Kompleks yang terbentuk antara kuersetin dengan AlCl3 dapat menyerap
radiasi pada daerah visibel karena adanya transisi dari eksitasi ion logam, ekstitasi
ligan, dan transfer muatan antara ion logam dan ligan (Christian, 2004). Transisi
yang menghasilkan molar absorptivitas paling besar adalah transfer muatan.
Kompleks yang diukur absorbansinya pada penelitian ini merupakan
kompleks yang stabil dengan penambahan asam. Asam yang digunakan pada
penelitian ini berasal dari pelarut asam asetat 5% dalam metanol. Natrium sitrat
pada percobaan ini berfungsi sebagai larutan buffer untuk menjaga keasaman
larutan.
Pelarut yang digunakan dalam penetapan kadar kuersetin dalam sediaan
krim tidak mempengaruhi pengukuran absorbansi karena pelarut-pelarut tersebut
memiliki cutoff point yang lebih rendah dari pada panjang gelombang yang
digunakan dalam pengukuran. Cutoff point adalah panjang gelombang terkecil
dimana senyawa tersebut tidak memberikan absorbansi. Cutoff point dari etil
absorbansi kompleks antara kuersetin dengan AlCl3 dilakukan pada panjang
gelombang 428 nm sehingga pelarut-pelarut tersebut tidak mempengaruhi
absorbansi pengukuran.
E. Analisis Validitas Penetapan Kadar Sampel Kuersetin dalam Sediaan Krim
1. Akurasi
Akurasi menunjukkan kedekatan hasil pengukuran dengan hasil
sebenarnya. Akurasi dikatakan baik jika nilai % recovery telah memenuhi standar
yang ditentukan. Hasil penetapan kadar kuersetin dalam sediaan krim dapat dilihat
pada tabel VI.
Tabel VI. Data recovery sampel kuersetin dalam sediaan krim
Replikasi absorbansi
Jumlah kuersetin terukur dalam
krim (mg)
39
Kadar analit dalam sediaan krim pada penelitian ini lebih kecil dari
0,1%, maka standar akurasi yang digunakan adalah untuk kadar analit > 0,1%
yang ditetapkan pada Anonim (2004), yaitu 75%-125%. Dari data penelitian di
atas didapatkan nilai recovery antara 89,49% sampai 96,85%. Data tersebut
memenuhi kriteria akurasi yang baik yaitu pada rentang 75%-125%. Rata-rata
nilai recovery yang didapat adalah 92,91 ± 2,92 %, artinya kurang lebih 92 %
jumlah kuersetin dalam krim dapat terukur kadarnya menggunakan metode
penetapan kadar yang dilakukan dalam penelitian ini. Nilai recovery yang
diperoleh pada penelitian ini tidak mencapai 100 %. Hal ini dikarenakan prosedur
kerja yang dilakukan relatif panjang sehingga kemungkinan terjadinya kesalahan
pengukuran analit menjadi semakin besar.
2. Presisi
Presisi yang dimaksud dalam penelitian ini adalah repeatability yang
menggambarkan penggunaan prosedur analitik pada suatu laboratorium dalam
periode waktu singkat yang dilakukan oleh analis dan alat yang sama. Nilai presisi
semakin kecil akan memberikan keterulangan hasil yang baik. Presisi yang baik
ditunjukkan dengan nilai coefficient variance (CV) yang memenuhi standar. Data
hasil perhitungan koefisien variasi kadar kuersetin dalam sediaan krim dapat
Tabel VII. Data koefisien variasi sampel kuersetin dalam sediaan krim
Replikasi
I II III IV V VI
Jumlah kuersetin terhitung dalam sediaan krim (mg)
0.9900 1.0200 0.9832 1.0104 1.0504 1.0028
Jumlah kuersetin terukur dalam sediaan krim (mg)
0,9588 0,9613 0,9313 0,9338 0,9400 0,9000
Kadar sampel kuersetin terhitung dalam sediaan krim (%b/b)
Standar deviasi (SD) 2,92
Koefisien variasi (CV) 3,14 %
Kadar analit dalam sediaan krim pada penelitian ini lebih kecil dari
0,1%, maka standar presisi yang digunakan adalah untuk kadar analit > 0,1% yang
ditetapkan pada Anonim (2004), yaitu CV kurang dari 20%. Dari data di atas
didapatkan nilai CV sebesar 3,14 %. Nilai CV ini memenuhi standar yang
ditetapkan pada Anonim (2004). Hal ini menunjukkan bahwa penetapan kadar
kuersetin dalam sediaan krim menggunakan metode kolorimetri memiliki hasil
keterulangan yang baik.
Parameter presisi yang digunakan adalah coefficient variance (CV),
bukan standar deviasi (SD) karena nilai standar deviasi sangat dipengaruhi oleh
junlah sampel yang digunakan. Semakin banyak jumlah sampel, maka nilai SD
41
dipengaruhi oleh nilai rata-rata sampel dan tidak tergantung pada jumlah sampel
yang digunakan.
Faktor yang menyebabkan hasil yang tidak seragam pada penelitian ini
terutama disebabkan karena penggunaan alat-alat laboratorium yang bersifat
manual, misalnya penggunaan corong pisah pada proses ekstraksi cair-cair.
Penggunaan corong pisah sebagai alat ekstraksi cair-cair karena metode ini
mudah, sederhana dan cepat dilakukan. Ketidakseragaman hasil disebabkan
karena proses penggojogan corong pisah dilakukan secara subjektif sehingga
terdapat kemungkinan jumlah kuersetin yang didapat pada tiap replikasi kurang
BAB V
KESIMPULAN, SARAN, DAN KETERBATASAN
A. Kesimpulan
Penetapan kadar kuersetin dalam krim secara kolorimetri dengan
pereaksi AlCl3 memenuhi kriteria metode analisis yang baik, yaitu akurasi antara
89,49 - 96,85 % dan CV 3,14 %.
B. Saran
Metode penetapan kadar kuersetin dalam sediaan krim dalam penelitian
ini perlu diaplikasikan pada penetapan kadar sampel flavonoid teh hijau dalam
sediaan krim.
C. Keterbatasan
Sampel pada penelitian ini bukan merupakan glikosida flavonoid,
melainkan aglikon flavonoid, yaitu kuersetin.
DAFTAR PUSTAKA
Allen, V., L., 2002, The Art, Science, and Technology of Pharmaceutical Compounding, 2nd Ed., 264-291
Anonim, 1995, Farmakope Indonesia, Edisi IV, Departemen Kesehatan Republik Indonesia, Jakarta, 6
Anonim, 2000, Parameter Standar Umum Ekstrak Tumbuhan Obat, Edisi I, Departemen Kesehatan Republik Indonesia, Jakarta, 11, 35-36
Anonim, 2003, The United States Pharmacopeia, 6th Ed., United States Pharmacopeia Convention. Inc., Rockville, 2440-2442
Anonim, 2004, Guidelines for The Validation of Analytical Methods for Active Constituent, Agricultural, and Veterinary Chemical Products, APVMA, Australia
Bruneton, J, 1999, Pharmacognosy and Phytochemistry Medical Plant, 2th Ed, translated by Caroline K hatton, Intercept Ltd., Londres, NY, Paris, 309-321
Budavari. S., 1989, The Merck Index, 11th Ed, Merck & Co Inc, USA
Chebil, L., Humeau, C., Anthoni, J., Dehez, F., Engasser, J., and Ghoul, M., 2007, Solubility of Flavonoid in Organic Solvent, J.Chem. Eng., 52, 1552-1556
Christian, G. D., 2004, Analytical Chemistry, 6th Ed, John Wiley & Sons, Inc., USA, 457-468, 473
Cunniff, P., 1995, Official Methods of Analysis of AOAC International Vol. II 16th Ed., AOAC Internatioanl, USA, ch. 33 p. 46-47
Ermer, J., Miller, J. H., 2005, Method Validation in Pharmaceutical Analysis, Wiley-VCH Verlag GmbH & Co., Weinheim
Fell, A. F., 1986, UV and Visible Flourecense Spectrophotometric, in Wade, Clarke’s Isolation and Identification of Drug, 2nd ed, The Pharmaceuitcal Press, London, 222-225
Janeska, B., Stefova, M., and Alipieva., K., 2007, Assay of Flavonoid Aglycones from the species of genus Sideritis (Lamiaceae) from Macedonia with HPLC-UV DAD, Acta Pharm, 57, 371 - 377