INTISARI
Penelitian ini bertujuan untuk mencari toksisitas akut biji alpukat (Persea americana Mill.)yang dilihat dari tolok ukur kuantitatif(LD50) dan tolok ukur
kualitatif dari gejala klinis, sifat dan wujud toksisitas.
Penelitian ini merupakan penelitian eksperimental murni dengan rancangan sederhana acak lengkap pola searah. Penelitian ini menggunakan 50 ekor mencit galur Swiss (25 jantan dan 25 betina) dan dibagi acak menjadi lima kelompok perlakuan. Kelompok I, yaitu kontrol negatif yang diberi aquadest secara peroral. Kelompok II (perlakuan dosis 1) diberi infusa biji alpukat (Persea americana Mill.) dengan dosis 230,09 mg/kgBB. Kelompok III (perlakuan dosis 2) diberi infusa biji alpukat (Persea americana Mill.) dengan dosis 520,00 mg/kgBB. Kelompok IV (perlakuan dosis 3) diberi infusa biji alpukat (Persea
americana Mill.) dengan dosis 1175,20 mg/kgBB. Kelompok V (perlakuan dosis
4) diberi infusa biji alpukat (Persea americana Mill.) dengan dosis 2655,95 mg/kgBB. Pemberian infusa biji alpukat (Persea americana Mill.) dilakukan secara peroral, sekali hanya hari pertama dan selanjutnyadilakukan uji reversibilitas 14 hari tanpa diberikan perlakuan. Hewan uji kemudian dikorbankan dan dilihat histopatologinya, jumlah kematian, gejala, dan wujud efek toksik.
Hasil penelitian ini menunjukkan bahwa LD50 semu infusa biji alpukat
(Persea americana Mill.) adalah >2655,95 mg/kgBB dan memiliki makna toksikologi kategori sedikit toksik (0,5-5 g/kg). Gejala yang teramati pada mencit jantan dan betina yaitu aktifitas meningkat/ beringas, dan penjilatan meningkat. Wujud sifat efek toksik yang teramati dari hasil histopatologik tidak dapat ditentukan karena tidak ada perubahan pada mencit jantan maupun mencit betina kelompok perlakuan infusa biji alpukat setelah 24 jam maupun setelah uji reversibilitas 14 hari.
ABSTRACT
This study aims to examine the acute toxicity of avocado seeds infuse (Persea americana Mill.) through its quantitative parameter (LD50) and qualitative
parameter (clinical signs of toxicity and spectrum of toxic effects)
This study is purely experimental research with simple designs completely randomized direction. This study used 50 mice Swiss strain (25 male and 25 female) and were divided randomly into 5 groups. First group or negative group were given distilled water orally. Second group (dose 1) were given avocado seeds infuse (Persea americana Mill.) 230.09 mg/kgBB. Third group (dose 2) were given avocado seeds infuse (Persea americana Mill.) 520.00 mg/kgBB. Fourth group (dose 3) were given avocado seeds infuse (Persea americana Mill.) 1175.20 mg/kgBB. Fifth group (dose 4) were given avocado seeds infuse (Persea americana Mill.) 2655.95 mg/kgBB. Avocado seeds (Persea americana Mill.) were given by oral route, single exposure and furthermore reversibility test for 14 days without treatment given to the animal. The animals were sacrificed and examinated histopathologically, the number of death, clinical signs of toxicity, and spectrum of toxicity effects.
This study showed that pseudo LD50 avocado seeds infuse (Persea
americana Mill.) is >2655.95 and categorized light toxic (0.5-5 g/kg). The clinical signs of toxicity in male and female mice were alteration of animal behavior , more active, and higher lick. The spectrum of toxic effects can not be determined because no changes in treatment animal after 24 hours or reversibility test 14 days.
UJI TOKSISITAS AKUT INFUSA BIJI ALPUKAT Persea americana Mill. PADA MENCIT GALUR SWISS
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh :
Betzylia Wahyuningsih NIM : 118114109
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
UJI TOKSISITAS AKUT INFUSA BIJI ALPUKAT Persea americana Mill. PADA MENCIT GALUR SWISS
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh :
Betzylia Wahyuningsih NIM : 118114109
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
HALAMAN PERSEMBAHAN
Ketahuilah, demikian hikmat untuk jiwamu :
Jika engkau mendapatnya, maka ada masa depan, dan harapanmu tidak akan hilang.
(Amsal 24 : 14)
PRAKATA
Puji syukur penulis panjatkan ke hadirat Tuhan Yesus Kristus atas karunia
dan bimbingan-Nya sehingga penulis dapat menyelesaikan penulisan skripsi ini. Skripsi ini berjudul “Uji Toksisitas Akut Infusa Biji Alpukat Persea americana
Mill. pada Mencit Galur Swiss”. Skripsi ini merupakan karya ilmiah penulis untuk memperoleh gelar sarjana Farmasi (S.Farm.) di Fakultas Farmasi Sanata Dharma Yogyakarta.
Penulis menyadari bahwa dalam proses pelaksanaan dan penyusunan skripsi ini banyak pihak-pihak yang telah membantu dan melancarkan penyelesaian skripsi
ini. Oleh karena itu, pada kesempatan ini penulis ingin mengucapkan terimakasih kepada:
1. Dekan Fakultas Farmasi Universitas Sanata Dharma
2. Ibu drh. Sitarina Widyarini, M.P., Ph.D. selaku Pembimbing Utama yang benar-benar membimbing dan lebih dari sekedar ‘pembimbing’ tetapi
mengajarkan banyak hal dan mengarahkan untuk perbaikan selama pelaksanaan dan penulisan skripsi.
3. Ibu Phebe Hendra, M.Si., Ph.D., Apt. selaku Pembimbing Pendamping yang
benar-benar membimbing dan lebih dari sekedar ‘pembimbing’ tetapi mengajarkan banyak hal dan mengarahkan untuk perbaikan selama
pelaksanaan dan penulisan skripsi.
5. Bapak Prof. Dr. C. J. Soegihardjo, Apt., selaku Dosen Penguji Skripsi atas segala bantuan dan masukan demi perbaikan skripsi ini.
6. Ibu Agustina Setiawati, M.Sc., Apt., selaku Kepala Laboratorium Fakultas Farmasi Universitas Sanata Dharma yang telah memberikan ijin dalam
penggunaan semua fasilitas laboratorium untuk kepentingan penelitian ini. 7. Bapak Heru Purwanto dan Bapak Supardjiman selaku Laboran Farmakologi
dan Toksikologi, Bapak Kayatno selaku Laboran Biokimia, Bapak Wagiran
selaku Laboran Farmakognosi-Fitokimia, Bapak Kunto selaku Laboran Kimia Analisis, Bapak Ottok selaku pengelola gudang kefarmasian atas
segala bantuan selama pelaksanaan skripsi ini.
8. Bapak drh. Sugiyono, M.Sc. yang telah banyak membantu dalam pemeriksaan dan menentukan diagnosis histopatologis organ, serta Bapak
Lilik selaku laboran Laboratorium Patologi Fakultas Kedokteran Hewan UGM yang membantu dalam pembuatan preparat histopatologis.
9. Sahabat dan rekan sekerja “Tim Biji Alpukat” Levina Apriyani, Rosita Olimpia Bagiastrasari, Agustina Iswara, Christina Desi, Trifonia Ingrid dan Marselina Cresentia atas kerjasama, bantuan, motivasi, perjuangan, dan
kebersamaan selama penelitian dan pengerjaan skripsi ini sampai akhir. 10.Sahabat-sahabatku tersayang Rosita Olimpia Bagiastrasari, Primalova
11.Teman-teman Farmasi angkatan 2011, khususnya FSM C dan FKK B 2011 Fakultas Farmasi Universitas Sanata Dharma Yogyakarta yang telah banyak
memberikan membantu, berbagi ilmu, pengalaman, kebersamaan dan kebahagian kepada penulis.
12.Ardhita Dhani Kurniawan yang selalu memberikan semangat, dukungan, perhatian dan kasih sayang selama pelaksanaan dan penyusunan skripsi. 13.Sabrina Handayani Tambun dan Tengku Nur Indah Sari yang membantu
dan mendukung untuk melengkapi naskah skripsi.
14.Semua pihak yang tidak dapat penulis sebutkan satu persatu, yang
telah membantu dalam kelancaran penyelesaian skripsi ini.
Dengan segala kerendahan hati, penulis menyadari bahwa skripsi ini jauh dari sempurna. Oleh karena itu penulis menerima kritik, saran, dan koreksi dari
berbagai pihak untuk menjadikan skripsi lebih baik. Semoga skripsi ini dapat memberikan manfaat dan informasi bagi pembaca.
DAFTAR ISI
Halaman
HALAMAN JUDUL ………... i
HALAMAN PERSETUJUAN PEMBIMBING ……….. ii
HALAMAN PENGESAHAN ………. iii
HALAMAN PERSEMBAHAN ……….. iv
PERNYATAAN KEASLIAN KARYA ……….. v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI ……….. vi
PRAKATA ……….. vii
DAFTAR ISI ………... x
DAFTAR TABEL ………... xiv
DAFTAR GAMBAR ………... xvi
DAFTAR LAMPIRAN ………... xvii
INTISARI ……… xix
ABSTRACT ……….. xx
BAB I PENGANTAR ………. 1
A. Latar Belakang ………. 1
1. Rumusan masalah ……….. 3
2. Keaslian penelitian ……… 4
3. Manfaat penelitian ………. 5
B. Tujuan Penelitian ………. 5
1. Tujuan umum ………. 5
BAB II PENELAAHAN PUSTAKA ……….. 6
A. Persea americana Mill. ………... 6
B. Infudasi………... 9
C. Toksikologi ……….. 9
D. Organ ………... 15
1. Ginjal ………. 15
2. Usus ……….. 17
3. Limpa ………. 19
4. Lambung ……… 20
5. Jantung ………... 21
6. Paru-paru ………... 23
7. Hati ……… 24
E. Keterangan Empiris ………. 27
BAB III METODE PENELITIAN ……….. 28
A. Jenis dan Rancangan Penelitian ……….. 28
B. Variabel dan Definisi Operasional ……….. 28
1. Variabel utama ……….. 28
2. Variabel pengacau ………. 28
3. Definisi operasional ……….. 29
C. Bahan Penelitian ……….. 30
1. Bahan utama ……….. 30
2. Bahan kimia ………... 31
1. Alat pembuatan serbuk biji alpukat (Persea americana Mill.).. 31
2. Alat penetapan kadar air ……… 31
3. Alat pembuatan infusa biji alpukat (Persea americana Mill.)... 31
4. Alat uji toksisitas dan pemeriksaan histopatologik …………... 32
E. Tata Cara Penelitian ……….. 32
1. Determinasi tanaman Persea americana Mill. ……….. 32
2. Pengumpulan bahan ………... 32
3. Pembuatan serbuk biji alpukat ………... 32
4. Penetapan kadar air serbuk biji Persea americana Mill. …….. 33
5. Pembuatan infusa biji alpukat (Persea americana Mill.) ……. 33
6. Penetapan dosis infusa Persea americana Mill. ……… 33
7. Pengelompokan dan perlakuan hewan uji ………. 34
F. Tata Cara Analisis Hasil ……….. 36
G. Skema Alur Penelitian ……….. 37
BAB IV HASIL DAN PEMBAHASAN ………. 38
A. Determinasi Biji Alpukat ………. 38
B. Penetapan Kadar Air Serbuk Kering Biji Persea americana Mill.. 38
C. Potensi Ketoksikan Akut (LD50) ………. 39
D. Pengamatan Perubahan Berat Badan Mencit ………. 40
E. Pengamatan Gejala-Gejala Toksik ……… 43
F. Pemeriksaan Histopatologik ……… 46
G. Rangkuman Pembahasan ………. 62
A. Kesimpulan ………. 65
B. Saran ……… 65
DAFTAR PUSTAKA ……… 66
LAMPIRAN ……… 70
DAFTAR TABEL
Halaman
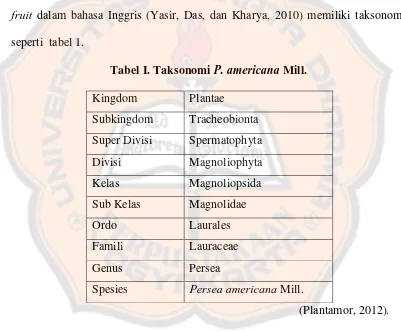
Tabel I. Taksonomi P. americana Mill. ……… 6
Tabel II. Skrining fitokimia ekstrak biji Persea americana Mill.
dengan berbagai pelarut ……….. 7
Tabel III. Hasil kuantitatif (dalam %) fitokimia biji alpukat ………….. 8
Tabel IV. Kriteria ketoksikan akut xenobiotika (Loomis, 1978) ………. 15 Tabel V. Jumlah mencit mati (% respon) setelah pemberian infusa biji
alpukat (n = 10) ……… 39
Tabel VI. Purata berat badan ± SE mencit jantan akibat pemberian
infusa biji alpukat ……… 40
Tabel VII Purata berat badan ± SE mencit betina akibat pemberian
infusa biji alpukat ……… 42
Tabel VIII. Hasil pemeriksaan gejala toksik pada mencit akibat pemejanan infusa biji alpukat dan aquadest selama 6 jam
pertama ………... 44
Tabel IX. Gambaran histopatologik organ mencit betina setelah 24 jam pemberian infusa biji alpukat ……….. 48
Tabel X. Gambaran histopatologik organ mencit jantan setelah 24 jam
pemberian infusa biji alpukat ……… 49
Tabel XI. Perubahan histopatologik organ mencit betina setelah 14 hari
Tabel XII. Perubahan histopatologik organ mencit jantan setelah 14 hari
DAFTAR GAMBAR
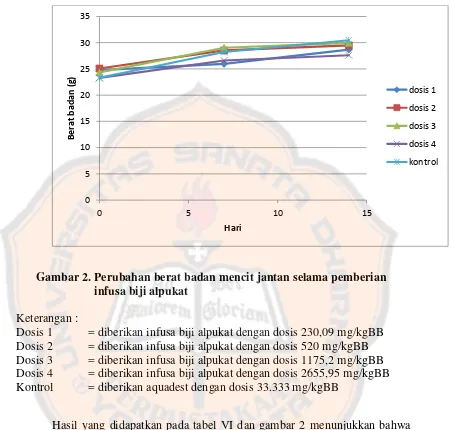
Halaman Gambar 1. Skema alur penelitian ...
Gambar 2. Perubahan berat badan mencit jantan selama pemberian infusa
biji alpukat ………... 37
41 Gambar 3. Perubahan berat badan mencit betina selama pemberian infusa
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Foto biji alpukat ……… 71
Lampiran 2. Foto serbuk biji alpukat ……… 71
Lampiran 3. Foto infusa biji alpukat ………. 71
Lampiran 4. Foto pembuatan infusa biji alpukat ……….. 72
Lampiran 5. Foto pembedahan hewan uji ………. 72
Lampiran 6. Surat pengesahan determinasi biji alpukat (Persea americana Mill.) ……….. 73
Lampiran 7. Surat Ethics Committee Approval ………. 74
Lampiran 8. Data berat badan mencit jantan ………. 75
Lampiran 9. Data berat badan mencit betina ………. 76
Lampiran 10. Hasil pengamatan histopatologik setelah 24 jam …………. 77
Lampiran 11. Hasil pengamatan histopatologik setelah 14 hari ………… 78
Lampiran 12. Hasil konversi LD50 mencit ke manusia ……….. 80
Lampiran 13. Hasil pengamatan gejala toksik pada mencit jantan setelah pemberian infusa biji alpukat pengamatan 6 jam ………... 81
Lampiran 14. Hasil pengamatan gejala toksik pada mencit betina setelah pemberian infusa biji alpukat pengamatan 6 jam ………… 85
Lampiran 15. Hasil pengamatan gejala toksik pada mencit jantan setelah pemberian infusa biji alpukat pengamatan 14 hari ………. 89
INTISARI
Penelitian ini bertujuan untuk mencari toksisitas akut biji alpukat (Persea americana Mill.) yang dilihat dari tolok ukur kuantitatif (LD50) dan tolok ukur
kualitatif dari gejala klinis, sifat dan wujud toksisitas.
Penelitian ini merupakan penelitian eksperimental murni dengan rancangan sederhana acak lengkap pola searah. Penelitian ini menggunakan 50 ekor mencit galur Swiss (25 jantan dan 25 betina) dan dibagi acak menjadi lima kelompok perlakuan. Kelompok I, yaitu kontrol negatif yang diberi aquadest secara peroral. Kelompok II (perlakuan dosis 1) diberi infusa biji alpukat (Persea americana Mill.) dengan dosis 230,09 mg/kgBB. Kelompok III (perlakuan dosis 2) diberi infusa biji alpukat (Persea americana Mill.) dengan dosis 520,00 mg/kgBB. Kelompok IV (perlakuan dosis 3) diberi infusa biji alpukat (Persea americana Mill.) dengan dosis 1175,20 mg/kgBB. Kelompok V (perlakuan dosis 4) diberi infusa biji alpukat (Persea americana Mill.) dengan dosis 2655,95 mg/kgBB. Pemberian infusa biji alpukat (Persea americana Mill.) dilakukan secara peroral, sekali hanya hari pertama dan selanjutnya dilakukan uji reversibilitas 14 hari tanpa diberikan perlakuan. Hewan uji kemudian dikorbankan dan dilihat histopatologinya, jumlah kematian, gejala, dan wujud efek toksik.
Hasil penelitian ini menunjukkan bahwa LD50 semu infusa biji alpukat
(Persea americana Mill.) adalah >2655,95 mg/kgBB dan memiliki makna toksikologi kategori sedikit toksik (0,5-5 g/kg). Gejala yang teramati pada mencit jantan dan betina yaitu aktifitas meningkat/ beringas, dan penjilatan meningkat. Wujud sifat efek toksik yang teramati dari hasil histopatologik tidak dapat ditentukan karena tidak ada perubahan pada mencit jantan maupun mencit betina kelompok perlakuan infusa biji alpukat setelah 24 jam maupun setelah uji reversibilitas 14 hari.
ABSTRACT
This study aims to examine the acute toxicity of avocado seeds infuse (Persea americana Mill.) through its quantitative parameter (LD50) and qualitative
parameter (clinical signs of toxicity and spectrum of toxic effects)
This study is purely experimental research with simple designs completely randomized direction. This study used 50 mice Swiss strain (25 male and 25 female) and were divided randomly into 5 groups. First group or negative group were given distilled water orally. Second group (dose 1) were given avocado seeds infuse (Persea americana Mill.) 230.09 mg/kgBB. Third group (dose 2) were given avocado seeds infuse (Persea americana Mill.) 520.00 mg/kgBB. Fourth group (dose 3) were given avocado seeds infuse (Persea americana Mill.) 1175.20 mg/kgBB. Fifth group (dose 4) were given avocado seeds infuse (Persea americana Mill.) 2655.95 mg/kgBB. Avocado seeds (Persea americana Mill.) were given by oral route, single exposure and furthermore reversibility test for 14 days without treatment given to the animal. The animals were sacrificed and examinated histopathologically, the number of death, clinical signs of toxicity, and spectrum of toxicity effects.
This study showed that pseudo LD50 avocado seeds infuse (Persea
americana Mill.) is >2655.95 and categorized light toxic (0.5-5 g/kg). The clinical signs of toxicity in male and female mice were alteration of animal behavior , more active, and higher lick. The spectrum of toxic effects can not be determined because no changes in treatment animal after 24 hours or reversibility test 14 days.
BAB I
PENGANTAR
A. Latar Belakang
Pemanfaatan tanaman sebagai obat tradisional sudah lama dilakukan sebagai upaya pencegahan dan pengobatan penyakit. Hal ini karena mulai bergesernya pengobatan modern (dengan obat-obatan) menjadi pengobatan
alternatif dan didukung dengan sumber tanaman yang melimpah di Indonesia. Selain itu pergeseran ini juga dikarenakan keterbatasan dari segi biaya pengobatan
modern dan tingginya efek samping dari obat modern sehingga masyarakat kembali mencari pengobatan tradisional.
Alpukat (Persea americana Mill.) adalah salah satu tumbuhan yang banyak dijumpai dan dimanfaatkan sebagai pengobatan. Salah satu bagian alpukat
yang memiliki khasiat farmakologi yaitu biji. Biji alpukat bahkan telah teruji dapat menurunkan kolesterol total, LDL, dan trigliserid (Imafidon dan Amaechina, 2010
; Nwaoguikpe dan Braide, 2011), aktivitas antiprotozoa dan antimikobakteri (Jiménez- Arellanes, Luna-Herrera, Ruiz-Nicolás, Cornejo-Garrido, Tapia, dan
Yépez-Mulia, 2013 ; Idris, Ndukwe, dan Gimba, 2009), antidiabetes dan pelindung jaringan (Ezejiofor, Okorie, dan Orisakwe, 2013 ; Alhassan, Sule, Atiku, Wudil, Abubakar, dan Mohammed, 2012), antihipertensi (Anaka, Ozolua, dan Okpo,
2009), hepatoprotektif (Sasadara, 2013), serta nefroprotektif (Yoseph, 2013).
optimal memerlukan standar. Upaya pencapaian standar dan pengembangan tanaman obat tradisional ini sesuai dengan UU No.36 Tahun 2009 tentang kesehatan yang menyebutkan bahwa obat tradisional harus memenuhi standar
yang ditetapkan dan World Health Assembly (WHA) ke-56 juga merekomendasikan sebelas langkah kepada negara-negara anggota World Health
Organization (WHO), diantaranya agar meningkatkan penelitian obat tradisional
dan menjamin khasiat, keamanan dan mutu. Upaya penegasan keamanan melalui
uji toksisitas merupakan salah satu upaya untuk meningkatkan mutu obat tradisional (Departemen Kesehatan Republik Indonesia, 2008).
Pernyataan sebagaimana dinyatakan oleh Paracelsus (1493-1541), seorang
pakar yang mengkaji toksikologi secara ilmiah pertama kali, bahwa semua senyawa adalah racun, tidak ada satupun yang bukan racun, tetapi takaran (dosis) yang
tepatlah yang membedakan antara racun dan obat (Loomis dan Hayes, 1996). Uji toksisitas akut ini dapat menjangkau hubungan kuantitatif antara dosis dan respon.
Uji toksisitas akut biji alpukat pernah dilakukan dalam bentuk ekstrak
aquaeous (Ozolua, Anaka, Okpo, dan Idogun, 2009) yang menunjukkan bahwa sampai pada dosis 10 g/kgBB di tikus tidak menunjukkan adanya kematian. Pada
ekstrak alkohol (Marlinda, Sangi, dan Wuntu, 2012 menunjukkan bahwa harga LC50
ekstrak alkohol biji alpukat kering dengan metode Brine Shrimp Lethality Test (BST) sebesar 34,302 mg/L sedangkan LD50 ekstrak etanol biji alpukat pada mencit
sebesar 1200,75 mg/kg (Padilla-Camberos, Marinez- Velázquez, Flores-Fernández, dan Villanueva-Rodriguez, 2013 ), tetapi dalam bentuk infusa belum pernah
alpukat (Persea americana Mill.). Sediaan yang digunakan adalah infusa karena alpukat yang sering dimanfaatkan sebagai pengobatan dalam masyarakat biasanya
diserbuk dan direbus dengan air panas. Secara umum teknik yang digunakan di masyarakat serupa dengan pembuatan sediaan infusa. Pembuatan ini pada
masyarakat juga lebih mudah dan sederhana.
Uji toksisitas akut merupakan uji yang dirancang dengan pemberian dosis tunggal senyawa uji untuk menentukan efek toksik dari suatu senyawa dalam waktu
yang singkat setelah pemenjanan ataupun pemberiannya dengan takaran tertentu dan organ yang diamati lebih komperehensif yaitu organ-organ secara menyeluruh
(Donatus, 2001). Penelitian ini akan melihat perubahan pada organ lambung, usus, jantung, paru-paru, hati, ginjal, dan limpa.
1. Rumusan masalah
a. Berapa nilai ketoksikan akut infusa biji alpukat (Persea americana Mill.)
yang dinyatakan sebagai kisaran lethal dose 50 (LD50) pada mencit galur
Swiss?
b. Apa gejala yang timbul akibat pemejanan infusa biji alpukat (Persea
americana Mill.) pada mencit galur Swiss?
c. Apa kecenderungan wujud dan sifat toksik yang timbul yang dilihat dari
2. Keaslian penelitian
Terdapat sejumlah penelitian yang telah menguji ketoksikan akut dan subakut alpukat (Persea americana Mill.) dengan bentuk ekstrak aquaeous maupun alkohol. Pada toksisitas akut ekstrak aquaeous, dosis maksimal 10 g/kg tidak menunjukkan LD50 dan pada toksisitas subakut ditemukan kenaikan jumlah
minum pada tikus dan kenaikan total protein pada hematologi darah yang signifikan (Ozolua, Anaka, Okpo, dan Idogun, 2009). Penelitian lain yaitu Marlinda, Sangi, dan Wuntu (2012) menyatakan bahwa analisis senyawa metabolit sekunder dan uji toksisitas ekstrak etanol biji buah alpukat memiliki LC50 biji alpukat biasa, segar, dan kering masing-masing sebesar
42,270; 36,078; dan 34,302 mg/L. Uji toksisitas terbaru Padilla-Camberos, Marinez- Velázquez, Flores-Fernández, dan Villanueva-Rodriguez (2013) menyatakan bahwa ekstrak etanol biji alpukat menunjukkan efek toksisitas akut mulai pada dosis 500 mg/kg , LD50 sebesar 1200,75 mg/kg, dan tidak menunjukkan
adanya aktivitas genotoksisitas.
Yoseph (2013) menyatakan bahwa biji alpukat memiliki khasiat untuk nefroprotektif pada tikus dengan dosis 360,71 mg/kgBB dan didukung dengan hasil
penelitian Sasadara (2013) yang menyatakan bahwa biji alpukat pun juga memiliki khasiat sebagai hepatoprotektif. Sejauh studi pustaka yang dilakukan oleh peneliti,
3. Manfaat penelitian a. Manfaat teoritis
Penelitian ini diharapkan memberikan manfaat bagi pengembangan ilmu pengetahuan maupun dasar untuk penelitian selanjutnya, khususnya ilmu
kefarmasian terkait toksisitas akut infusa biji alpukat ( Persea americana Mill.).
b. Manfaat praktis
Penelitian ini diharapkan dapat memberikan informasi kepada masyarakat
mengenai dosis maupun ketoksikan akut biji alpukat (Persea americana Mill.).
B. Tujuan Penelitian 1. Tujuan umum
Mendapatkan gambaran umum tentang ketoksikan akut infusa biji alpukat
(Persea americana Mill.)
2. Tujuan khusus
a. Untuk mengetahui nilai ketoksikan akut infusa biji alpukat (Persea americana Mill.) yang dinyatakan sebagai kisaran lethal dose 50 (LD50) pada mencit galur
Swiss.
b. Untuk mengetahui gejala yang timbul akibat pemejanan infusa biji alpukat (Persea americana Mill.) pada mencit galur Swiss.
BAB II
PENELAAHAN PUSTAKA
A.Persea americana Mill.
1. Taksonomi
Biji alpukat yang sering disebut apokado atau avocado dalam bahasa Malay atau yang sering disebut alligator pear, avocado, avocado-pear, atau butter fruit dalam bahasa Inggris (Yasir, Das, dan Kharya, 2010) memiliki taksonomi
seperti tabel 1.
Tabel I. Taksonomi P. americana Mill.
Kingdom Plantae
Subkingdom Tracheobionta Super Divisi Spermatophyta
Divisi Magnoliophyta
Kelas Magnoliopsida
Sub Kelas Magnolidae
Ordo Laurales
Famili Lauraceae
Genus Persea
Spesies Persea americana Mill.
(Plantamor, 2012).
2. Morfologi
Tinggi tanaman ini berkisar antara 9-20 m. Buahnya berbiji tunggal dan besar yang dikelilingi oleh daging buah yang tertutup oleh kulit buah. Daging
varietasnya. Bentuk buahnya dari bulat sampai lonjong dengan berat mencapai 2,3
kg per buahnya (Orwa, Mutua, Kindt, Jamnadass, dan Anthony, 2009).
3. Kandungan
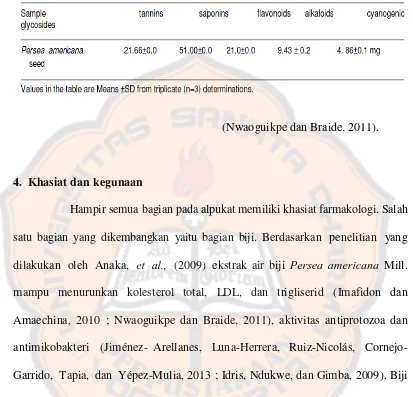
Menurut Nwaoguikpe dan Braide (2011), ekstrak air biji Persea americana
Mill. mengandung sejumlah senyawa antioksidan seperti saponin (51,00±0,0) sebagai senyawa terbanyak, tanin (21,66±0,0) dengan urutan kedua , flavonoid (21,00±0,0), alkaloid (9,43±0,2), dan sianogenik glikosida (4,86±0,0). Menurut
Arukwe, Amadi, Duru, Agomuo, Adindu, Odika, et al. (2012), kandungan biji Persea americana Mill. adalah saponin, tanin, flavonoid, cyanogenic glycosides,
alkaloid, fenolik, dan steroid. Idris, Ndukwe, dan Gimba (2009) menyatakan kandungan biji alpukat (Persea americana Mill.) hampir serupa dengan penelitian yang lain tetapi menambahkan adanya kandungan terpenoid dan cardiac glycoside
pada pelarut polar dan semakin non polar pelarut yang digunakan, semakin sedikit kandungan fitokimia yang tersari dalam pelarut. Kandungan-kandungan
[image:30.595.106.512.246.708.2]lengkapnya dapat dilihat pada tabel II dan III.
Tabel II. Skrining fitokimia ekstrak biji Persea americana Mill. dengan berbagai pelarut
Tabel III. Hasil kuantitatif (dalam %) fitokimia biji alpukat
(Nwaoguikpe dan Braide, 2011).
4. Khasiat dan kegunaan
Hampir semua bagian pada alpukat memiliki khasiat farmakologi. Salah satu bagian yang dikembangkan yaitu bagian biji. Berdasarkan penelitian yang dilakukan oleh Anaka, et al., (2009) ekstrak air biji Persea americana Mill.
mampu menurunkan kolesterol total, LDL, dan trigliserid (Imafidon dan Amaechina, 2010 ; Nwaoguikpe dan Braide, 2011), aktivitas antiprotozoa dan
antimikobakteri (Jiménez- Arellanes, Luna-Herrera, Ruiz-Nicolás, Cornejo-Garrido, Tapia, dan Yépez-Mulia, 2013 ; Idris, Ndukwe, dan Gimba, 2009). Biji
alpukat juga memiliki aktivitas antidiabetes dan pelindung jaringan (Ezejiofor, Okorie, dan Orisakwe, 2013 ; Alhassan, Sule, Atiku, Wudil, Abubakar, dan Mohammed, 2012) dengan cara menahan laju peningkatan glukosa darah
(Anggraeni, 2006). Menurut Anaka, Ozolua, dan Okpo (2009), biji alpukat terbukti dapat digunakan sebagai antihipertensi. Biji alpukat dalam bentuk infusa,
B. Infudasi
Infusa merupakan sediaan cair yang dibuat dengan cara mengekstraksi
bahan-bahan herbal dengan air sebagai pelarut pada suhu 90oC selama 15 menit di atas penangas air terhitung mulai dari suhu mencapai 90oC sambil diaduk. Serkai dalam keadaan panas dengan menggunakan kain flannel, kemudian ditambahkan air panas secukupnya melalui ampas hingga diperoleh volume infusa yang dikehendaki (Badan POM RI, 2010).
C. Toksikologi 1. Definisi
Uji toksikologi dapat dibagi menjadi uji ketoksikan tak khas dan uji ketoksikan khas. Uji ketoksikan tak khas (uji toksisitas akut, subkronis, dan kronis)
merupakan uji yang dirancang untuk mengevaluasi keseluruhan atau spektrum efek toksik suatu senyawa pada aneka ragam jenis hewan uji. Uji ketoksikan khas
merupakan uji untuk mengevaluasi secara rinci efek yang khas sesuatu senyawa pada aneka ragam jenis hewan uji (Donatus, 2001).
2. Asas toksikologi
Berdasar alur peristiwa timbulnya efek toksik, ada 4 asas utama dalam toksikologi yang meliputi kondisi efek toksik, mekanisme aksi, wujud, dan sifat
efek toksik (Donatus, 2001). a. Kondisi efek toksik
Kondisi efek toksik antara lain kondisi pemejanan yang meliputi jenis
Kondisi makhluk hidup berupa keadaan fisiologi (berat badan, umur, suhu tubuh, kecepatan pengosongan lambung, kecepatan aliran darah, status gizi, kehamilan,
genetika, dan jenis kelamin) dan patologi dapat mempengaruhi pula (Donatus, 2001).
b. Mekanisme aksi
Mekanisme efek toksik dapat dijelaskan berdasarkan tempat kejadian, sifat antaraksi antara racun dengan tempat aksi, dan resiko penumpukan racun
dalam tubuh. Berdasarkan sifat kejadian, mekanisme efek toksik dibagi menjadi dua golongan yaitu mekanisme luka intrasel (mekanisme langsung) dan
mekanisme luka ekstrasel (mekanisme tidak langsung) (Donatus, 2001). c. Wujud
Wujud efek toksik dapat berupa perubahan biokimia, fungsional, dan
struktural. Perubahan biokimia meliputi respon dan kekacauan biokimia terhadap luka sel akibat antaraksi zat beracun yang sifatnya tak terbalikkan (Lu, 1995).
Wujud fungsional berkaitan dengan antaraksi yang tak terbalikkan dengan reseptor atau aksi tempat racun sehingga mempengaruhi fungsi homeostasis antaranya anoreksia, gangguan pernafasan. Perubahan struktural seperti perlemakan yang
bersifat terbalikkan, nekrosis, karsinogenesis, mutagenesis, dan teratogenesis yang tak terbalikkan (Donatus, 2001).
d. Sifat efek toksik
Terdapat dua jenis sifat efek toksik yaitu terbalikkan dan tak terbalikkan. Ciri khas sifat yang terbalikkan adalah bila kadar racun yang ada dalam tempat aksi
kecepatan absorbsi, distribusi, dan eliminasi. Sedangkan sifat tak terbalikkan lebih menetap (Lu, 1995).
3. Uji toksisitas akut a. Definisi dan tujuan
Uji toksisitas akut adalah uji untuk menentukan efek toksik suatu senyawa dengan cara memberikan dosis tunggal senyawa uji dalam waktu singkat setelah pemejanan (Donatus, 2001).
Sebagian besar uji toksisitas akut dirancang untuk menentukan dosis lethal medium (LD50) bahan uji. LD50 merupakan dosis tunggal suatu zat yang
secata statistik diharapkan akan membunuh 50% hewan uji (Lu, 1995). LD50
merupakan satu dari beberapa indikasi yang digunakan dalam menetapkan toksisitas akut (Dipasquale dan Hayes, 2001).
Uji toksisitas akut selain itu juga dapat untuk identifikasi karakteristik suatu efek toksik suatu senyawa, identifikasi target organ dan manifestasi klinis
lainnya dari toksisitas akut, memperkirakan resiko toksisitas terhadap spesies yang bukan sasaran atau toksisitasnya terhadap spesies sasaran, menentukan reversibilitas dari respon toksik, dan menyediakan data kisaran dosis yang dapat
digunakan untuk penelitian yang lain atau yang lebih lama (Klaassen dan Watkins, 2010).
b. Tata cara pelaksanaan
Hewan uji yang digunakan idealnya dapat memberikan respon toksik yang mirip dengan manusia (Dipasquale dan Hayes, 2001). Secara umum, dalam uji
hewan uji seperti tikus atau mencit (Derelanko dan Hollinger, 2002) karena hewan ini murah, mudah didapat, mudah ditangani,banyak data toksikologi
mengenai hewan ini yang mempermudah pembandingan toksisitas senyawa (Lu, 1995).
Jalur pemberian yang akan digunakan melalui jalur yang akan digunakan oleh manusia atau jalur yang memungkinkan manusia terpejani dengan senyawa itu (Donatus, 2001). Jalur yang paling sering digunakan adalah jalur oral dengan
menggunakan sonde. Jalur lain yang dapat digunakan sebagai pilihan adalah parenteral, injeksi intravena dan intraperitonial, dermal, subkutan, dan inhalasi
(Lu, 1995).
Takaran dosis yang dianjurkan paling tidak empat peringkat dosis, berkisar dari dosis terendah yang tidak atau hampir tidak mematikan seluruh
hewan uji sampai dengan dosis tertinggi yang dapat mematikan hampir atau seluruh hewan uji (kisaran dosis diperkirakan menyebabkan 10-90% kematian
hewan uji) (Lu, 1995).
Banyak peneliti memilih rasio atau faktor interval 1,2-2. Belakangan ini dianjurkan prosedur uji sederhana yang menggunakan hanya enam sampai
sembilan untuk setiap uji dan dalam menentukan LD50 pada hewan besar,
umumnya digunakan hewan uji yang jauh lebih sedikit (Lu, 1995).
c. Pengamatan
hewan yang mati, dan (3) histopatologik organ (Donatus, 2001; Dipasquale dan Hayes, 2001).
Autopsi harus dilakukan pada semua hewan yang sekarat, mati, dan dikorbankan pada akhir masa uji dengan tujuan mendapatkan informasi
mengenai organ sasaran, terutama bila kematian tidak terjadi segera setelah pemberian obat (Dipasquale dan Hayes, 2001).
d. Analisis dan evaluasi data
Tolok ukur utama ketoksikan racun memiliki hubungan yang erat (kekerabatan) antara kondisi pemejanan, wujud, dan sifat efek toksik yang
selanjutnya dapat digunakan untuk menaksir batas aman. Tolok ukur dapat dibagi menjadi dua yaitu tolok ukur kualitatif dan tolok ukur kuantitatif.
1) Tolok ukur kualitatif
Tolok ukur kualitatif meliputi mekanisme aksi toksik, jenis wujud efek toksik, sifat efek toksik, dan gejala-gejala klinis yang nampak pada diri
penderita atau subyek uji (Donatus, 2001). 2) Tolok ukur kuantitatif
Kekerabatan antara takaran atau lebih luasnya kondisi pemejanan dan
wujud efek toksik merupakan tolok ukur dasar atau utama dengan cara bagaimana ketoksikan dapat dikuantifikasi. Jadi pada dasarnya kekerabatan
antara kondisi pemejanan dan wujud efek toksik, dapat dibagi menjadi kekerabatan antara takaran dan efek (takaran-efek) serta waktu dan efek (waktu-efek). Kekerabatan ini untuk mengetahui kekerabatan antara kondisi pemejanan
wujud efek toksik, juga dapat dibagi menjadi kekerabatan takaran dan respon (takaran-respon) dan waktu-respon yang dapat untuk mengetahui frekuensi atau
angka kejadian timbulnya efek toksik pada sekelompok populasi subyek uji (Donatus, 2001).
Kekerabatan takaran-respon lebih banyak digunakan dalam evaluasi ketoksikan karena tentu tujuan evaluasi ketoksikan racun lebih ditujukan pada resiko (ukuran kemungkinan timbulnya efek berbahaya racun pada sekelompok
populasi tertentu) (Donatus, 2001).
Dosis pemejanan dimana 50% individu dalam populasi menunjukkan efek
toksik baku (dosis median), digunakan sebagai tolok ukur potensi ketoksikan racun bila efek toksik bakunya berupa salah satu dari perubahan biokimia, fungsional, atau struktural disebut sebagai toxic dose (TD50). Bila efek toksiknya
berupa kematian, dosis median ini disebut lethal dose (LD50) (Donatus, 2001).
Harga LD50 atau TD50 dapat diperoleh secara statistik. Metode yang paling
lazim digunakan untuk menghitung harga takaran median ialah metode grafik Litchifield dan Wilcoxon (1949), metode kertas grafik logaritmik Miller dan Tainter (1944), dan tatacara menemukan kisaran Thomson dan Weil (1952).
Bila sampai dengan batas volum maksimal yang boleh diberikan pada hewan uji, dosis yang diberikan tidak menimbulkan kematian hewan uji maka dosis
tertinggi tersebut dinyatakan sebagai LD50 semu (Donatus, 2001).
Harga LD50 atau TD50 merupakan tolok ukur ketoksikan akut. Semakin kecil
harga LD50 atau TD50, berarti semakin besar potensi toksik atau ketoksikan akut
Tabel IV. Kriteria ketoksikan akut xenobiotika (Loomis, 1978)
Kriteria LD50(mg/kg)
1. Luar biasa toksik 2. Sangat toksik 3. Cukup toksik 4. Sedikit toksik 5. Praktis tidak toksik 6. Relatif kurang berbahaya
1 atau kurang 1-50
50-500 500-5000 5000-15000 Lebih dari 15000
D. Organ 1. Ginjal
Ginjal (ren, nephros) merupakan bagian dari sistema urinarium yang terletak di dalam ruang retroperitoneum pada dinding belakang abdomen, di kedua sisi columna
vertebralis. Ginjal kiri dan kanan berbentuk seperti kacang dengan bagian atas terlindung oleh skeleton thoracis. Pada posisi berdiri, ginjal memanjang dari vertebrae lumbales pertama sampai keempat dengan letak ginjal kanan lebih rendah
dibandingkan ginjal kiri karena adanya hepar. Tinggi rendahnya letak ginjal berubah sesuai dengan respirasi dan perubahan posisi tubuh (Wibowo dan Paryana, 2009).
Setiap ginjal memliki sisi medial cekung yaitu hilus (tempat masuknya saraf, keluarnya ureter serta masuk dan keluarnya pembuluh darah dan pembuluh limfe) dan memiliki permukaan lateral yang cembung, keduanya dilapisi oleh suatu simpai fibrosa
tipis. Ginjal memiliki korteks di luar dan medula di dalam. Pada manusia, medula ginjal terdiri atas 8-15 struktur berbentuk kerucut yang disebut piramida ginjal, yang
lobus ginjal. Setiap ginjal terdiri atas 1-1,4 juta unit fungsional yang disebut nefron (Mescher, 2010).
Fungsi utama dari ginjal yang sebagian besar membantu mempertahankan stabilitas lingkungan cairan internal yaitu mempertahankan keseimbangan H2O di
tubuh, mempertahankan osmolaritas cairan tubuh yang sesuai, mengatur jumlah dan konsentrasi sebagian besar ion, mempertahankan volume plasma yang tepat, membantu mempertahankan keseimbangan asam basa tubuh, mengeluarkan
produk akhir atau sisa metabolisme tubuh, mengeluarkan banyak senyawa asing misal obat dan bahan aditif makanan, menghasilkan eritropoietin, menghasilkan
renin dan mengubah vitamin D menjadi bentuk aktifnya (Sherwood, 2011). Beberapa efek toksik zat beracun terhadap ginjal seperti berikut ini : a. Nekrosis
Nekrosis dapat terjadi di berbagai tempat pada ginjal seperti tubulus proximal, tubulus distal, medula, papila, dan tempat lainnya. Nekrosis ini ditandai
dengan sitoplasmik eosinofilik dan piknosis atau karioreksis dari inti sel. Nekrosis dapat memicu adanya respon inflamasi akut. Nekrosis dapat terjadi sebagai respon langsung adanya metabolit atau xenobiotika tetapi dapat pula merupakan efek
sekunder dari iskemik. Nekrosis papila sering terjadi di nefropati tubulus ginjal karena berhubungan dengan fungsi tubulus distal dalam mengatur keseimbangan
b. Perubahan pada glomerulus
Glomerulus merupakan organ target yang jarang dipengaruhi oleh bahan
beracun. Organ ini dapat dipengaruhi oleh bahan beracun baik secara langsung maupun tidak langsung. Contoh perubahan yang terjadi pada glomerulus yaitu
glomerulonefritis, nefritis interstitial, edema, dan perubahan lainnya (Frazier, Seely, Hard, Betton, Burnett, Nakatsuji, et al., 2012).
2. Usus
Organ usus dibagi menjadi dua, yaitu usus halus dan usus besar. Usus halus
merupakan tempat akhir berlangsungnya pencernaan, absorpsi nutrien, dan sekresi endokrin. Peristiwa pencernaan dituntaskan dalam usus halus, tempat nutrien (hasil pencernaan) diabsorpsi oleh sel-sel epitel pelapis. Usus halus relatif
panjang sekitar 5 meter dan terdiri atas tiga segmen yaitu duodenum, jejenum, dan ileum. Segmen-segmen tersebut memiliki banyak kemiripan ciri (Mescher,
2010).
Usus besar terdiri atas kolon, sekum, apendiks, dan rektum. Sekum membentuk kantung buntu di bawah pertemuan antara usus halus dan usus besar
di katup ileosekum. Tonjolan kecil seperti jari di dasar sekum adalah apendiks, suatu jaringan limfoid yang mengandung limfosit. Kolon yang membentuk
sebagian besar usus besar tidak bergelung seperti usus halus tetapi terdiri dari tiga bagian yang relatif lurus – kolon asenden, kolon transversum, dan kolon desenden. Bagian terakhir kolon desenden membentuk huruf S membentuk kolon
organ pengering dan penyimpan selain itu juga menyerap garam dan air dan mengubah isi lumen menjadi feses (Sherwood, 2011).
Beberapa respon toksik yang dapat timbul di usus akibat pemberian bahan beracun antara lain sebagai berikut.
a. Erosi, ulcer, dan inflamasi
Lapisan mukosa usus halus dilapisi oleh selapis sel epitel kolumnar dengan kerentanan yang sama dengan mukosa lambung. Secara patologis ulser ini mirip
dengan yang terjadi di lambung. Inflamasi yang tersebar pada usus besar disebut enteritis dan pada kondisi parah/kronis dapat menyebabkan adanya hemoragi tetapi
bila kerusakan sel masih ringan dan berpengaruhi bagian vili.
Vili usus dapat dirintangi oleh suatu bahan beracun yang menghambat pembelahan sel-sel prekursor yang cepat dalam kriptus di dasar vilus, mempercepat
pembelahan sel, atau menimbulkan respons immunologis yang menimbulkan atropi vili. Beberapa kondisi kerusakan pada vili akan berpengaruh pada feses yang
dihasilkan. Biasanya feses akan berwarna hitam (Glaister, 1986 ; Turton dan Hooson, 2005).
b. Diare
Respon ini biasa terjadi terhadap ingesti bahan beracun. Dalam beberapa kasus gejala ini berhubungan dengan luka mukosa usus seperti enteritis.
Faktor-faktor penyebab diare bervariatif seperti infeksi, motilitas usus, maupun karena malabsorbsi. Malabsorbsi dapat dikarenakan adanya penyakit penyerta lain yang membuat adanya penurunan luas permukaan usus halus (Glaister, 1986 ; Turton
3. Limpa
Limpa adalah organ limfoid terbesar dalam tubuh dan satu-satunya organ yang
terlibat dalam filtrasi darah sehingga limpa merupakan organ penting pada pertahanan terhadap antigen dalam darah. Organ ini juga menjadi tempat penghancuran eritrosit tua.
Sebagaimana halnya organ limfoid sekunder lainnya, limpa adalah tempat produksi antibodi dan limfosit aktif yang dihantarkan ke dalam darah (Mescher, 2010).
Limpa terdiri atas jaringan retikular yang mengandung sel-sel retikular, banyak
limfosit dan sel darah lain, makrofag dan APC. Pulpa limpa memiliki dua komponen, pulpa putih dan pulpa merah. Massa kecil pulpa putih terdiri atas nodul limfoid dan
selubung periarteriolar, sementara pulpa merah terdiri atas sinusoid yang berisi darah dan korda limpa (korda Bilroth) (Mescher, 2010).
Limpa bukan merupakan organ yang vital pada orang dewasa meskipun
mempunyai fungsi imunogenik yang memproduksi antibodi, fungsi fagosit dari sitem retikuloendotelial, dan fungsi penghancuran eritrosit. Limpa selain itu juga
berfungsi sebagai tempat penyimpanan darah yang kemudian dapat dilepaskan ke dalam sirkulasi dengan kontraksi otot polos di dalamnya. Fungsi hematopoesis dari limpa hanya di dapatkan pada masa fetus (Wibowo dan Paryana, 2009).
Manifestasi klinik utama gangguan limpa adalah pembesaran limpa (splenomegali). Limpa normal tidak dapat teraba. Splenomegali dapat terjadi pada
hipersplenisme (penyakit yang berhubungan dengan aktivitas berlebihan dan pembesaran limpa) dengan anemia, leukopenia, dan trombositopenia akibat meningkatnya perombakan sel-sel tersebut di hati (Chandrasoma dan Taylor,
degeneratif lesi seperti atropi dan fibrosis. Perubahan ini dapat terjadi secara spontan, pengaruh umur, xenobiotika yang mempengaruhi secara langsung
maupun tidak langsung (Suttie, 2006).
4. Lambung
Lambung adalah organ campuran eksokrin endokrin yang mencerna makanan dan menyekresi hormon. Organ ini dibagi menjadi tiga bagian berdasarkan pembedaan anatomik, histologis, dan fungsional. Fundus adalah bagian lambung yang terletak di atas
lubang esofagus. Bagian tengah atau utama lambung adalah korpus. Lapisan otot polos di fundus dan korpus relatif tipis tetapi bagian bawah lambung, antrum, memiliki otot
jauh lebih tebal. Perbedaan ketebalan otot ini memiliki peran penting dalam motilitas lambung di kedua regio tersebut. Juga terdapat perbedaan kelenjar di mukosa regio ini. Bagian terminal lambung adalah sfingter pilorus yang bekerja sebagai sawar antara
lambung dan bagian atas usus halus (Sherwood, 2011).
Letak lambung ada di dalam perut bagian atas mulai dari hypochondrium kiri
sampai epigastrium dan kadang-kadang mencapai regio umbilicalis. Lambung dapat membesar sampai mencapai kapasitas dua sampai tiga liter dan tidak mempunyai bentuk yang tetap. Dalam keadaan kosong mempunyai ukuran seperti colon dan bentuknya
menyerupai huruf J. Bentuk ini dapat berubah tergantung pada isi, posisi tubuh, dan pernafasan (Wibowo dan Paryana, 2009).
Fungsi utama lambung ada tiga dimana fungsi terpenting lambung adalah menyimpan makan yang masuk sampai makanan dapat disalurkan ke usus halus dengan kecepatan yang sesuai untuk pencernaan dan penyerapan yang optimal. Fungsi yang
pencernaan protein. Fungsi terakhir melalui gerakan mencampur lambung, makanan yang tertelan dihaluskan dan dicampur dengan sekresi lambung untuk menghasilkan
campuran cairan kental atau kimus (Sherwood, 2011).
Beberapa respon patologis yang sering terjadi pada organ lambung seperti
yang disebutkan berikut: a. Gastritis
Gastritis merupakan inflamasi pada mukosa lambung. Gastritis dapat
berupa gastritis kronik maupun gastritis akut. Gastritis dapat disebabkan karena adanya infeksi Helicobacter pylori, keasaman lambung, enzim peptik, maupun
xenobiotika (Kumar, Cotran, Robbins, 2007).
b. Ulcer lambung
Ulcer lambung dapat terjadi secara akut maupun kronis. Pada ulcer
lambung akut biasanya ditandai dengan adanya multipel lesi. Penyebab adanya ulcer lambung antara lain trauma berat, pasca oprasi, hemoragi intraserebral, serta
pemaparan kronik dari xenobiotika misal karena obat NSAIDs dan kortikosteroid yang cenderung iritatif lambung (Kumar, Cotran, Robbins, 2007).
5. Jantung
Jantung adalah organ berotot yang berkontraksi secara ritmis, memompa darah
utama atau tunika: endokardium di dalam, miokardium di tengah, dan epikardium di luar (Mescher, 2010).
Letak jantung ada di rongga toraks (dada) sekitar garis tengah antara sternum (tulang dada) di sebelah anterior dan vertebra (belakang) di posterior. Jantung berfungsi
sebagai pompa yang memberi tekanan pada darah untuk mengalirkan darah ke jaringan. Seperti semua cairan, darah mengalir menuruni gradien tekanan dari daerah dengan tekanan tinggi ke daerah dengan tekanan rendah (Sherwood, 2011).
Bahan-bahan toksik terhadap jantung mungkin mengganggu fungsi jantung dengan proses berikut pada beberapa tempat.
a. Kardiomiopati (CMP)
Istilah kardiomiopati sering digunakan untuk penyakit yang menunjukkan adanya perubahan fungsi dari miokardial. Penyebab kardiomiopati berupa IHD
(ischemic cardiomyopathy), kardiak hipertropi, penyakit infeksi (kardiomiopati viral), obat maupun senyawa-senyawa xenobiotika yang menginduksi
kardiomiopati. CMP primer atau idiopatik merupakan kelainan miokardium yang tidak diketahui sebabnya atau gangguan yang timbul tanpa adanya iskemi, hipertensi, kelainan bawaan, kelainan katup, dan bentuk penyakit jantung lainnya.
CMP sekunder adalah penyakit otot jantung yang penyebabnya diketahui atau merupakan penyakit sistemik yang jelas (Klaassen, 2001).
b. Hipertropi kardiak dan gagal jantung
Peningkatan masa otot jantung disebut hipertropi kardiak. Efek ini biasanya merupakan respon kompensasi terhadap meningkatnya kerja jantung. Kardiak
perubahannya belum dapat diketahui. Kardiak hipertropi sering ditemui karena adanya pemaparan secara kronik dari adanya xenobiotika. (Klaassen, 2001).
6. Paru-paru
Sistem pernafasan mencakup paru-paru dan sistem saluran bercabang yang
menghubungkan tempat pertukaran gas dengan lingkungan luar. Udara digerakkan melalui paru oleh suatu mekanisme ventilasi yang terdiri atas rongga toraks, otot interkostal, diafragma, dan komponen elastis jaringan paru (Mescher, 2010).
Pulmo atau paru-paru adalah organ pernafasan yang penting karena udara yang masuk dapat berhubungan secara erat dengan darah kapiler di dalam
paru-paru. Tiap paru-paru melekat pada jantung dan trakea melalui radix pulmonis dan ligamentum pulmonale. Paru-paru sehat selalu berisi udara dan akan mengapung bila dimasukkan ke dalam air. Paru-paru orang dewasa mempunyai permukaan yang
berwarna lebih gelap dan sering ada bercak-bercak yang disebabkan oleh penimbunan partikel debu yang terisap. Dibandingkan dengan paru-paru kiri, maka
paru-paru kanan lebih besar dan lebih berat tetapi lebih pendek karena kubah diafragma kanan letaknya lebih tinggi. Paru-paru kanan juga lebih lebar karean adanya jantung yang letaknya lebih ke kiri dalam rongga toraks (Wibowo dan
Paryana, 2009).
Bentuk reaksi pada sistem pernafasan dapat dibagi menjadi 2, yaitu
pada bagian air-system conducting dan respiratory area. Air-conducting system bentuk reaksi dari kerusakan sel, inflamasi, dan perbaikan dapat mempengaruhi pada epitel dan struktur sekitar. Pada luka akut, epitelium dapat mempengaruhi
syncytial epithelial giant cell dan nekrosis pada epitelium. Sedangkan luka kronik
dapat menyebabkan peningkatan jumlah sel goblet, bahkan bila dalam waktu yang
berlanjut dapat menyebabkian adanya squamous metaplasia dari epitelium dan hiperplasia epitelium dan metaplasia sel goblet (van Dijk, Gruys, Mouewen, 2007).
7. Hati
Hati merupakan kelenjar terbesar dalam tubuh dengan berat sekitar 1,5 kg atau sekitar 2% berat tubuh orang dewasa dengan lobus kanan yang besar dan lobus
kiri yang lebih kecil. Hati merupakan kelenjar terbesar dengan letak dalam rongga perut di bawah diafragma. Hati menjadi perantara sistem perncernaan dengan
darah. Organ dalam saluran cerna tempat penyerapan nutrien yang digunakan di bagian tubuh lain. Kebanyakan darah di hati (70-80%) berasal dari vena porta yang berasal dari lambung, usus, dan limpa; sisanya (20-30%) disuplai oleh hepatika.
Posisi hati dalam sistem sirkulasi sangat optimal untuk menampung, mengubah, dan mengumpulkan metabolit dari darah serta untuk menetraliasi dan
mengeluarkan zat toksik dalam darah (Mescher, 2010).
Hati selain memiliki fungsi dalam sistem pencernaan melalui sekresi garam empedu, tetapi juga memiliki fungsi lain, yaitu memproses secara metabolis ketiga
kategori utama nutrien (karbohidrat, protein, dan lemak) setelah zat-zat ini diserap dari saluran cerna, mendetoksifikasi atau menguraikan zat sisa tubuh dan hormon
serta obat dan senyawa asing lainnya, membentuk protein plasma termasuk protein yang dibutuhkan untuk pembekuan darah dan yang untuk mengangkut hormon steroid dan tiroid serta kolesterol dalam darah. Hati juga berfungsi menyimpan
vitamin D, mengeluarkan bakteri dan sel darah merah yang sudah tua serta mengeskresikan kolesterol dan bilirubin (Sherwood, 2011).
Hati sering menjadi sasaran utama kerusakan karena beberapa hal. Hati memiliki kapasitas tinggi untuk mengikat zat kimia. Hal ini mungkin berkaitan
dengan kenyataan bahwa hati merupakan tempat terpenting bagi eliminasi, berturut-turut metabolisme, dan ekskresi racun dari dalam tubuh (Donatus, 2001).
Efek toksik zat beracun terhadap hati antara lain sebagai berikut.
a. Perubahan lemak/lipidosis
Perubahan lemak/lipidosis dapat ditandai dengan adanya vakuola-vakuola
berbatas jelas pada bagian sitoplasma sel dan memberikan penampakan yang foamy. Perubahan lemak atau lipidosis ini dapat disebabkan karena beberapa agen
yang berbeda dan biasanya dibedakan menjadi mikrovesikular dan makrovesikular.
Makrovesikular lipidosis merupakan reaksi yang disebabkan karena luka dan dapat juga merupakan adaptasi fisiologi karena ketidakseimbangan antara lemak yang
diambil dari darah dan pengeluaran lipoprotein dari hepatosit. Mikrovesikular lipidosis biasanya mengindikasikan adanya disfungsi hati yang lebih serius tetapi dapat juga dikarenakan adanya gangguang nutrisi. Xenobiotika dapat mnginduksi
mikrovasikular maupun makrovesikular lipidosis (Thoolen, Maronpot, Harada, Nyska, Rousseaux, Nolte, et al., 2010).
b. Hipertropi hepatoselular
Hipertropi hepatoselular sering disebut pula hepatositomegali. Kondisi ini sering terjadi karena adanya gangguan pada induksi enzim metabolik yang
ini dapat disebabkan karena adanya xenobiotika. Pada beberapa kasus, hipertropi hepatoselular sering disertai pula dengan hepatoselular degenerasi dan nekrosis.
Penanda adanya hipertropi umumnya yaitu peningkatan berat hati (Thoolen, et al., 2010).
c. Hepatoselular atropi
Patogenesis hepatoselular atropi yaitu kurangnya asupan pakan (kelaparan), perubahan hemodinamik, maupun tekanan atropi dari neoplasia.
Penanda adanya hepatoselular atropi, yaitu pengurangan ukuran dari hepatosit, nukleus hepatosit yang umumnya berukuran lebih kecil dan adanya pengurangan
jumlah glikogen maupun mitokondria secara ultrastruktural (Thoolen, et al., 2010). d. Degenerasi hidropik
Degenerasi hidropik sering ditandai dengan adanya vakuola pada
sitoplasma. Gangguan pada integritas membran sel dapat menyebabkan adanya akumulasi cairan intrasitoplasmik yang menyebabkan pembesaran atau ballooning
pada sel. Agen penyebab degerasi hidropik ini dapat karena xenobiotika dan merupakan prekursor nekrosis hepatosit (Thoolen, et al., 2010).
e. Nekrosis
Nekrosis merupakan perubahan yang ireversibel. Nekrosis secara morfologi dapat nampak sendiri atau kombinasi dengan perubahan yang lain.
Nekrosis berdasar jumlahnya dapat dibedakan menjadi nekrosis sel tunggal maupun fokal/multifokal sedangkan berdasarkan letaknya dapat dibedakan menjadi nekrosis sentrilobular, midzonal maupun periportal. Nekrosis pada
karena adanya xenobiotika. Nekrosis hepatoselular dapat terjadi pula karena spontan atau toksin (Thoolen, et al., 2010).
E. Keterangan Empiris
Penelitian ini bersifat eksploratif untuk mengetahui toksisitas akut infusa biji alpukat (Persea americana Mill.) yang dinyatakan dengan LD50, gejala toksik,
BAB III
METODOLOGI PENELITIAN A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk jenis penelitian eksperimental murni dengan
rancangan acak lengkap pola searah.
B. Variabel dan Definisi Operasional 1. Variabel utama
a. Variabel bebas.Variabel bebas dalam penelitian ini adalah variasi dosis
pemberian infusa biji alpukat (Persea americana Mill.)
b. Variabel tergantung.Variabel tergantung dalam penelitian ini adalah tolok ukur kuantitatif yang dilihat dari nilai LD50, sedangkan tolok ukur kualitatif yang
dilihat dari gejala toksik, wujud, dan sifat efek toksik.
2. Variabel pengacau
a. Variabel pengacau terkendali. Variabel pengacau terkendali dalam penelitian ini antara lain, mencit jantan dan betina galur Swiss, berat badan 20-30 g dari Lab Imono, umur 1,5-2,5 bulan, frekuensi pemberian infusa satu kali dalam
24 jam hari pertama, rute pemberian peroral, biji alpukat dari Es Teller 77 Galeria Yogyakarta pada bulan Juni 2014 yang diambil dari perkebunan Klaten yang
memiliki waktu panen yang sama, makanan dan minuman dari Lab Imuno.
b. Variabel pengacau tak terkendali. Variabel pengacau tak terkendali dalam penelitian ini adalah kondisi patologis dan fisiologis mencit jantan dan mencit
3. Definisi operasional
a. Biji alpukat (Persea americana Mill.). Biji alpukat (Persea americana
Mill.) adalah biji alpukat berbentuk bulat yang diambil dari tanaman Persea americana Mill. dengan warna kuning, segar, dan tidak bercacat. Biji digunakan
dalam bentuk serbuk yang dibuat di lab Farmakognosi Fitokimia Universitas Sanata Dharma.
b. Dosis infusa biji alpukat (Persea americana Mill.). Infusa biji alpukat
(Persea americana Mill.) yang diperoleh dengan mengekstraksi sediaan herbal sebanyak 8 gram dengan pelarut aquadest 100,0 ml suhu 90oC selama 15 menit dengan konsentrasi 8% b/v dibagi mejadi empat peringkat dosis dengan rentang dosis dari yang tidak mematikan seluruh hewan uji sampai hampir atau mematikan seluruh hewan yaitu dosis I = 230,09 mg/kgBB; dosis II = 520,00 mg/kgBB; dosis
III = 1175,20 mg/kgBB; dosis IV = 2655,95 mg/kgBB.
c. Lethal dose 50 (LD50). Lethal dose 50 adalah dosis tunggal suatu zat yang
secara statistik diharapkan akan membunuh 50% hewan uji
d. Gejala. Gejala didefinisikan sebagai gejala klinis maupun toksik yang muncul karena pemejanan infusa biji alpukat (Persea americana Mill.) yang
meliputi gerakan (tremor, konvulsi, paralisis, keterpaksaan gerak, tidur), reaktif terhadap rangsangan dan refleks (beringas, pasif), perubahan perilaku (perubahan
sikap/aneh seperti lompat dan berputar berlebihan atau menggeliat, penjilatan, pencakaran, vokalisasi luar biasa, gelisah), sekresi (salivas, lakrimasi), nafas (bradipnea, trakipnea), kardiovaskuler (vasodilatasi), perubahan kulit dan bulu,
e. Wujud. Wujud didefinisikan sebagai kecenderungan wujud perubahan struktural yang dapat dilihat dari perubahan histopatologik organ hewan uji dengan
membandingkan perbedaan organ mencit kontrol dan organ mencit yang diberi perlakuan infusa biji alpukat.
f. Sifat. Sifat didefinisikan sebagai kecenderungan sifat efek toksik senyawa uji yang dapat dikategorikan menjadi sifat terbalikkan dan sifat tak terbalikkan yang dilihat dari uji reverbilitas dan diidentifikasi melalui hasil histopatologik
organ hewan uji.
C. Bahan Penelitian 1. Bahan utama
a. Hewan uji yang digunakan, yaitu mencit galur Swiss dengan umur 1,5-2,5
bulan dan berat badan 20-30 g yang diperoleh dari Laboratorium Imono Fakultas Farmasi Universitas Sanata Dharma Yogyakarta. Penelitian dengan hewan coba
telah mendapat ethical clearance dari Komisi Etik Fakultas Kedokteran Universitas Gajah Mada (Lampiran 7).
b. Biji alpukat bentuk bulat (Persea americana Mill.) yang diperoleh dari Es
2. Bahan kimia
a. Pelarut untuk infusa dan kontrol negatif uji toksisitas akut digunakan
aquadest yang diperoleh dari Laboratorium Farmakognosi-Fitokimia Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
b. Pelet AD-2 digunakan sebagai asupan makan mencit sedangkan asupan minum menggunakan air reverse osmose (RO) yang diperoleh dari Laboratorium Imono, Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
c. Pengawet formalin 10% yang dibuat dengan mengencerkan formalin 30% dengan aquadest sesuai volume yang dikehendaki untuk mencapai konsentrasi
10%. Formalin 30% diperoleh dari Laboratorium Kimia Analisis Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
D. Alat atau Instrumen Penelitian
1. Alat pembuat serbuk biji alpukat (Persea americana Mill.)
Timbangan digital, ayakan no.40, blender, oven, dan wadah penyimpanan serbuk biji alpukat.
2. Alat penetapan kadar air
Timbangan, sendok, alat moisture balanced, stopwatch.
3. Alat pembuatan infusa biji alpukat (Persea americana Mill.)
4. Alat uji toksisitas dan pemeriksaan histopatologik
Seperangkat alat gelas berupa Bekker glass, gelas ukur, tabung reaksi,
pipet tetes, timbangan elektrik, spuit per oral syringe 1 cc untuk pemejanan aquadest dan infusa, alat bedah, pot penyimpan organ, mikroskop untuk memeriksa
preparat histopatologi, kamera untuk memotret preparat histopatologi.
E. Tata Cara Penelitian 1. Determinasi tanaman Persea americana Mill
Determinasi dilakukan di Bagian Biologi Farmasi, Fakultas Farmasi
Universitas Gadjah Mada Yogyakarta.
2. Pengumpulan bahan
Bahan uji yang digunakan adalah biji Persea americana Mill. yang
diperoleh dari Es Teller 77 Galeria Yogyakarta pada bulan Juni 2014 yang diambil dari perkebunan Klaten yang memiliki waktu panen dan waktu tumbuh
yang sama.
3. Pembuatan serbuk biji alpukat
Serbuk dicuci bersih di bawah air mengalir, dipotong-potong, disortir dan
dikeringanginkan hingga tidak tampak basah lagi kemudian pengeringan dengan oven suhu kurang dari 60oC. Biji yg kering kemudian diserbukkan dan
4. Penetapan kadar air serbuk biji Persea americana Mill.
Sampel serbuk biji Persea americana Mill. yang sudah diayak sebanyak 5
g dimasukkan ke dalam alat moisture balanced pada suhu 1050C selama 15 menit, kemudian persen kadar air akan muncul pada alat moisture balanced
secara otomatis.
5. Pembuatan infusa biji alpukat (Persea americana Mill.)
Caranya serbuk kering ditimbang 8,0 g dan dimasukkan dalam panci
enamel lalu dibasahi dengan aquadest sebanyak 2 kali bobot bahan yang ditimbang yakni 16 mL aquadest. Pelarut aquadest kemudian ditambahkan
sebanyak 100,0 mL. Panci enamel dipanaskan pada suhu 900 C dan dijaga tetap dalam suhu tersebut selama 15 menit. Waktu 15 menit dihitung ketika suhu campuran mencapai 90o C. Campuran tersebut setelah 15 menit diambil dan
diperas selagi hangat dengan menggunakan kain flannel kemudian bila perlu ditambahkan aquadest panas melalui ampas hingga didapatkan volume 100,0
mL infusa biji.
6. Penetapan dosis infusa Persea americana Mill.
Penetapan dosis didasarkan dosis yang digunakan pada masyarakat, yaitu
kurang lebih 2 sendok makan (4g). Dosis pada manusia 4g/70 kgBB. Dosis dikonversi untuk mencit. Faktor konversi dari manusia 70kg ke mencit 20 g
adalah 0,0026. Jadi dosis untuk mencit 20 g sebagai berikut : Dosis infusa untuk mencit 20 g= 4g/70kgBB X 0,0026
Penetapan dosis maksimal dengan menggunakan volume maksimal 1 mL yang dapat diberikan pada mencit. Berat badan maksimal 30 g dan
menggunakan konsentrasi infusa maksimal yang dapat dibuat 8% b/v (Yoseph, 2013) adalah
DxBB = CxV
D x 30g = 8g/100mL x 1 mL
D = 0,00267 g/gBB = 2670 mg/kgBB
Penelitian ini dibuat empat peringkat dosis dan dosis 520 mg/kgBB digunakan sebagai dosis ke-2 sedangakan 2670 mg/kgBB digunakan sebagai dosis ke-4.
Sehingga dari dosis peringkat tinggi dan peringkat rendah dicari faktor pengali yang berguna untuk peringkat dosis.
Faktor pengali = √ � � ���
� �ℎ
�−
= √2 0 �/����
20 �/���� 4−
=2,26
Peringkat dosis yang didapatkan, yaitu
Dosis I = 520 mg/kgBB : 2,26 = 230,09 mg/kgBB;
Dosis II = 520,00 mg/kgBB;
Dosis III = 520 mg/kgBB x 2,26 = 1175,20 mg/kgBB; Dosis IV = 1175,20 mg/kgBB x 2,26 = 2655,95 mg/kgBB.
7. Pengelompokkan dan perlakuan hewan uji
Penelitian ini membutuhkan lima puluh ekor mencit (25 jantan, 25 betina).
Pengelompokan dilakukan dengan membagi secara acak lima puluh mencit ke dalam lima kelompok perlakuan menggunakan undian, masing-masing kelompok sejumlah sepuluh ekor mencit (5 jantan, 5 betina). Kelompok I, yaitu
diberi infusa biji alpukat (Persea americana Mill.) dengan dosis terendah 230,09 mg/kgBB. Kelompok perlakuan III diberi infusa biji alpukat (Persea
americana Mill.) dengan dosis peringkat ke 2, yaitu 520,00 mg/kgBB. Kelompok perlakuan IV diberi infusa biji alpukat (Persea americana Mill.)
dengan dosis peringkat ke 3, yaitu 1175,20 mg/kgBB. Kelompok perlakuan V diberi infusa biji alpukat (Persea americana Mill.) dengan dosis tertinggi 2655,95 mg/kgBB. Mencit diadaptasikan terlebih dahulu pada lingkungan uji
selama satu minggu. Mencit dipuasakan selama 3-4 jam sebelum perlakuan dengan tetap diberikan air minum setelah itu pemberian infusa biji Persea
americana Mill. dilakukan secara peroral, sekali hanya hari pertama. Analisis
dilakukan dengan melihat sebagai berikut. a. jumlah kematian,
b. gejala klinis dan efek toksik yang meliputi gerakan (tremor, konvulsi, paralisis, keterpaksaan gerak, tidur), reaktif terhadap rangsangan dan refleks
(beringas, pasif), perubahan perilaku (perubahan sikap/aneh seperti lompat dan berputar berlebihan atau menggeliat, penjilatan, pencakaran, vokalisasi luar biasa, gelisah), sekresi (salivas, lakrimasi), nafas (bradipnea, trakipnea),
kardiovaskuler (vasodilatasi), perubahan kulit dan bulu, saluran cerna (diare, sembelit) (Dipasquale dan Hayes, 2001 ; Badan POM, 2014).
c. histopatologis pada organ hati, ginjal, usus, limpa, lambung, jantung, dan paru-paru setelah 24 jam dan dilanjutkan hingga 14 hari bila tidak terjadi kematian dan diamati pula histopatologisnya untuk mengetahui sifat efek toksik
preparat dan pemeriksaan histopatologik dilakukan di Laboratorium Patologi Klinik Fakultas Kedokteran Hewan Universitas Gadjah Mada Yogyakarta.
F. Tata Cara Analisis Hasil
Data yang diperoleh dianalisis dan dievaluasi untuk memperoleh tolok ukur
toksisitas baik kuantitatif maupun kualitatif. Analisisnya adalah sebagai berikut. 1. Data jumlah kematian masing-masing kelompok (bila ada) selama 24 jam
digunakan untuk mengetahui nilai LD50.
2. Data gejala yang timbul setelah pemejanan diamati 24 jam dan dilanjutkan sampai hari ke 14 bila tidak terjadi kematian.
3. Data pemeriksaan histopatologi setelah 24 jam dan setelah 14 hari digunakan untuk mengevaluasi spektrum efek toksik yang timbul akibat pemejanan (sifat dan wujud efek toksik).
4. Data perubahan berat badan dianalisis dengan tren perubahan purata berat badan pada hari ke 0,7, dan 14 untuk melihat apakah ada perubahan berat
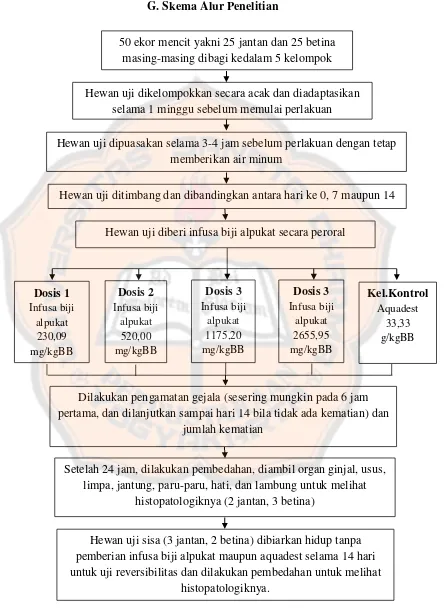
G. Skema Alur Penelitian
Gambar 1. Skema alur penelitian
Hewan uji dikelompokkan secara acak dan diadaptasikan selama 1 minggu sebelum memulai perlakuan
Hewan uji dipuasakan selama 3-4 jam sebelum perlakuan dengan tetap memberikan air minum
Hewan uji ditimbang dan dibandingkan antara hari ke 0, 7 maupun 14
Hewan uji diberi infusa biji alpukat secara peroral
Dosis 1 Infusa biji alpukat 230,09 mg/kgBB Dosis 2 Infusa biji alpukat 520,00 mg/kgBB Dosis 3 Infusa biji alpukat 1175,20 mg/kgBB Dosis 3 Infusa biji alpukat 2655,95 mg/kgBB Kel.Kontrol Aquadest 33,33 g/kgBB
Dilakukan pengamatan gejala (sesering mungkin pada 6 jam pertama, dan dilanjutkan sampai hari 14 bila tidak ada kematian) dan
jumlah kematian
Setelah 24 jam, dilakukan pembedahan, diambil organ ginjal, usus, limpa, jantung, paru-paru, hati, dan lambung untuk melihat
histopatologiknya (2 jantan, 3 betina)
Hewan uji sisa (3 jantan, 2 betina) dibiarkan hidup tanpa pemberian infusa biji alpukat maupun aquadest selama 14 hari untuk uji reversibilitas dan dilakukan pembedahan untuk melihat
histopatologiknya.
BAB IV
HASIL DAN PEMBAHASAN
Penelitian ini dilakukan dengan tujuan mendapatkan gambaran umum
tentang toksisitas akut infusa biji alpukat (Persea americana Mill.) dan khususnya mengetahui nilai ketoksikan akut yang dinyatakan dengan kisaran LD50, gejala
toksik, wujud dan sifat akibat pemejanan infusa biji alpukat pada mencit galur
Swiss yang dilihat melalui pengamatan histopatologik.
A. Determinasi Biji Alpukat
Determinasi dilakukan di Bagian Biologi Farmasi, Fakultas Farmasi UGM dengan tujuan untuk identifikasi, menghindari agar tidak ada kekeliruan dengan tanaman lain sehingga memastikan bahwa tanaman yang dimaksud adalah Persea
americana Mill. Hasil determinasi yang dilakukan di Bagian Biologi Farmasi, Fakultas Farmasi UGM menunjukkan bahwa tanaman benar-benar merupakan
tanaman alpukat dengan nama ilmiah Persea americana Mill. dan hasil determinasi dapat dilihat pada lampiran 6.
B.Penetapan Kadar Air Serbuk Kering Biji Persea americana Mill.
Penetapan kadar air dilakukan pada biji alpukat yang telah mengalami pengeringan dan berubah menjadi serbuk dengan tujuan untuk mengecilkan ukuran
partikel sehingga permukaan serbuk yang kontak