I. PENDAHULUAN A. Judul Percobaan
Kolorimetri B. Tujuan Percobaan
II. METODE PERCOBAAN A. Alat dan bahan
a. Alat yang digunakan dalam percobaan ini adalah 1. Labu ukur
2. Pro pipet 3. Pipet ukur 4. Tabung reaksi 5. Vortex
b. Bahan yang digunakan dalam percobaan ini adalah 1. NH4Fe(SO4)2 2. KCNS 10% 3. Aquades 4. Cuplikan A 5. Cuplikan B B. Cara kerja
1. Pembuatan larutan standar Fe
Sebanyak 10 ml larutan feri ammonium sulfat ( NH4Fe(SO4)2 )
dimasukkan ke labu ukur berukuran 100 ml. Aquades ditambahkan hingga tanda batas. Homogenkan NH4Fe(SO4)2 dengan aquades
dengan mengocok labu ukur. Larutan NH4Fe(SO4)2 dimasukkan ke
dalam tabung reaksi yang berbeda sebanyak 1 ml, 2 ml, 4 ml, 6 ml, dan 8 ml. Sebanyak 5 ml KCNS 10% ditambahkan ke tiap tabung reaksi. Aquades ditambahkan ke dalam tiap tabung sampai volume 20 ml. Tabung reaksi divortex. Perubahan warna pada larutan diamati.
2. Penentuan konsentrasi larutan cuplikan
Sebanyak 10 ml larutan cuplikan A dan B diambil. Warna larutan standar pada tabung reaksi dibandingkan dengan cuplikan A dan B. Konsentrasi ion Fe larutan standar dihitung.
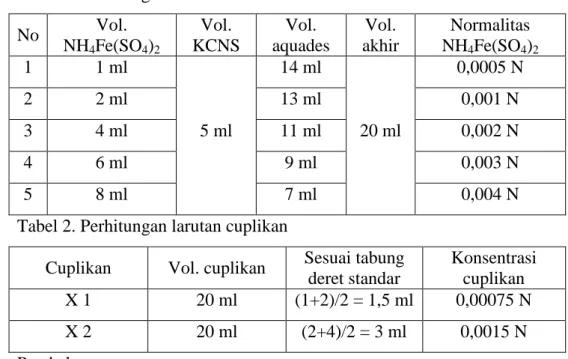
III. HASIL DAN PEMBAHASAN A. Tabel 1. Perhitungan deret larutan standar
No Vol. NH4Fe(SO4)2 Vol. KCNS Vol. aquades Vol. akhir Normalitas NH4Fe(SO4)2 1 1 ml 5 ml 14 ml 20 ml 0,0005 N 2 2 ml 13 ml 0,001 N 3 4 ml 11 ml 0,002 N 4 6 ml 9 ml 0,003 N 5 8 ml 7 ml 0,004 N
Tabel 2. Perhitungan larutan cuplikan
Cuplikan Vol. cuplikan Sesuai tabung deret standar Konsentrasi cuplikan X 1 20 ml (1+2)/2 = 1,5 ml 0,00075 N X 2 20 ml (2+4)/2 = 3 ml 0,0015 N B. Pembahasan
Kolorimetri dikaitkan dengan penetapan konsentrasi suatu zat dengan mengukur absorpsi relative cahaya sehubungan dengan konsentrasi tertentu zat itu dalam kolorimetri visual, cahaya putih alamiah ataupun buatan umumnya digunakan sebagai sumber cahaya, dan penetapan biasanya dilakukan dengan suatu instrument sederhana yang disebut kolorimetri atau pembanding (komparator) warna bila mata digantikan oleh sel foto listrik (jadi sebagian besar sesatan yang disebabkan karakteristik pribadi tiap pengamat dapat dihilangkan) instrument itu disebut kolorimetri fotolistrik (Dini, 2013).
Kolorimetri adalah suatu maca ikhtiar laboratorium kimia untuk menetapkan kadar suatu zat berwarna dalam larutan. Yang diukur sebenarnya bukan warna, melainkan intensitas warna yang dilihat. Intensitas warna sesuatu larutan ditentukan oleh dua faktor, oleh kadar zat yang berwarna itu dan oleh tebal lapisan larutan yang harus dilalui cahaya. Pada kolorimetri dibandingkan intensitas warna sesuatu larutan yang kadarnya akan ditentukan dengan intensitas warna larutan zat sejenis yang
kadarnya diketahui. Dari perbandingan tebal lapisan cairan dapat diperhitungkan kadar yang tidak kental (Basset, 1994). Kolorimeter adalah alat untuk menentukan intensitas atau gelapnya larutan berwarna atau untuk membandingkan dengan warna pembanding, digunakan dalam analisis kuantitatif (Pudjaatmaka, 2002).
Menggunakan metode kolorimeter tentu ada keuntungan dan kekurangannya. Keuntungan utama metode kolorimeter adalah bahwa metode ini memberikan cara sederhana untuk menentukan kuantitas zat yang sangat kecil. Batas atas metode kolorimeter pada umumnya adalah penetapan konstituen yang ada dalam kuantitas kurang dari 1 atau 2 persen. Penegmbangan kolorimeter fotolistrik yang tidak mahal menyebabkan cabang analisis kimia instrumental ini bahkan dapat dilakukan dalam lembaga pendidikan yang kecil sekalipun (Basset, 1994). Kelemahan dari penggunaan metode kolorimetri adalah pengukuran konsentrasi tidak tepat, karena di amati secara visual saja. Data yang ada juga cenderung subjektiif, karena penglihatan praktikan berbeda-beda sehingga bisa berbeda pendapat dalam pengambilan data. Dan kalau ada perbedaan cahaya di tempat untuk melihat persamaan warna, datanya bisa berbeda juga.
Pada percobaan ini, praktikan menggunakan metode deret standar larutan. Dalam metode ini biasa digunakan tabung kaca tak berwarna yang penampangnya seragam dan berdasar datar. Metode deret standar larutan ini dilakukan dengan membuat suatu deret larutan standar zat yang akan diketahui konsentrasinya dengan berbagai macam variasi konsentrasi. Kemudian larutan sampel dibandingkan dengan deret yang ada. Larutan dengan warna yang serupa secara eksak dengan standar memiliki konsentrasi sama dengan konsentrasi standar (Basset, 1994).
Pembuatan larutan standar berfungsi sebagai pembanding. Dengan membuat larutan standar ragam konsentrasi yang berbeda, praktikan dapat membandingkan larutan cuplikan/ sampel dengan larutan standar yang memiliki warna sama. Hasilnya adalah konsentrasi cuplikan sama dengan
konsentrasi larutan standar yang memiliki warna sama. Konsentrasi larutan sampel dapat ditentukan karena larutan standar diketahui konsentrasinya.
Menurut Chang (2004), larutan standar adalah suatu larutan yang konsentrasinya diketahui secara pasti, selain itu, konsentrasinya juga tidak mudah berubah. Menurut Pudjaatmaka (2002), larutan sampel adalah bagian dari bahan yang akan diuji, dianalisis atau diperiksa, yang dianggap dapat mewakili bahan itu; analisis itu biasanya menetapkan sifat-sifat dasar bahan itu, komposisi, atau kadang hanya kandungan zat penyusun tertentu dari bahan itu.
Hukum yang mendasari kolorimetri adalah hukum Lambert dan hukum Beer. Menurut Baseet (1994), hukum Lambert mengatakan bahwa bila cahaya monokromatik melewati medium tembus cahaya, laju berkurangnya intensitas oleh bertambahnya ketebalan, berbanding lurus dengan intensitas cahaya. Ini setara dengan menyatakan bahwa intensitas cahaya yang dipancarkan berkurang secara eksponensial dengan bertambahnya ketebalan medium yang menyerap. Menurut Effendi (2003), Beer mengkaji efek konsentrasi penyusun yang berwarna dalam larutan, terhadap transmisi maupun absorpsi cahaya. Dijumpainya hubungan yang sama antara transmisi dan konsentrasi seperti yang ditemukan Lambert antara transmisi dan ketebalan lapisan. Jadi, hukum Beer mengatakan cahaya warna tunggal yang diserap dan diteruskan zat antara tembus cahaya sebanding dengan kepekatan zat antara.
Fungsi pengenceran dalam percobaan adalah membuat ragam konsentrasi dari larutan standar sehingga konsentrasi dapat ditentukan ketika dilakukan perbandingan warna antara larutan standard an larutan cuplikan. Hasil dari pengenceran adalah ragam normalitas yang lebih kecil atau kurang pekat dari normalitas larutan awal yang lebih pekat. Semakin banyak akuades yang ditambahkan saat pengenceran larutan, semakin kecil normalitas larutan tesebut. Menurut Chang (2004), pengenceran atau dilution adalah prosedur untuk penyiapan larutan yang kurang pekat dari larutan yang lebih pekat.
Tabung reaksi dimasukkan larutan feri ammonium sulfat masing-masing dengan volume berbeda. Ditambahkan lagi KCNS sebanyak 5 ml ke dalam masing- masing tabung reaksi. Akuades dimasukan ke dalam masing-masing tabung reaksi sehingga volume di tiap tabung menjadi 20 ml. Tabung-tabung tersebut dimasukan ke dalam alat vortex satu persatu secara bergantian, setelah muncul pusaran angkat tabung reaksi dari alat. Tujuan tabung-tabung tersebut dimasukan ke dalam vortex adalah untuk menghomogenkan larutan secara baik. Karena kalau hanya dihomogenkan dengan cara menggoncangkan dengan tangan, hasilnya tidak sebaik dihomogenkan dengan alat vortex.
Reaksi dari ion ferry dengan tiosianat menghasilkan warna merah dari senyawa kompleks yang terbentuk
Fe3+ + 6CNS Fe(CNS)63-
Untuk kesempurnaan reaksi dipergunakan tiosianat yang berlebihan, sedangkan untuk menghindari hidrolisa diperlukan asam kuat.
Fe3+ + 3H20 Fe(OH)3 + 3H+
Dalam percobaan ini asam kuat yang terbentuk adalah H2SO4 (asam
sulfat). Fungsi KCNS sebagai reagen spesifik untuk Fe yang berasal dari NH4Fe(SO4)2, agar semua ion Fe3+ dapat bereaksi dengan ion tiosanat
CNS- dari KCNS.
Berdasarkan percobaan, jika larutan cuplikan A dibandingkan dengan deret standar, yaitu perbandingan warna antara larutan dari campuran 1ml, 2ml, 4ml, 6ml, dan 8ml dari larutan NH4Fe(SO4)2 memiliki
keserupaan warna dengan larutan antara hasil pengenceran 1ml larutan NH4Fe(SO4)2 dan 5ml larutan KCNS dalam 14ml akuades, dan 2ml larutan
NH4Fe(SO4)2 dan 5ml larutan KCNS dalam 13ml akuades. Larutan
cuplikan B jika dibandingkan dengan deret standar memiliki keserupaan warna dengan larutan antara hasil pengenceran 2ml larutan NH4Fe(SO4)2
NH4Fe(SO4)2 dan 5 ml KCNS dalam 11ml akuades. Untuk melihat
persamaan warna, dibutuhkan kertas berwarna putih di belakang tabung reaksi, agar warna larutan yang ditimbulkan lebih jelas.
Keserupaan warna ini menunjukkan konsentrasi larutan cuplikan kurang lebih sama dengan larutan standar tersebut. Hasil konsentrasi larutan cuplikan A adalah 0,00075 N, hasil konsentrasi larutan cuplikan B adalah 0,0015 N. Volume antara larutan cuplikan dan larutan standar harus sama, yaitu sebesar 20ml.
Faktor-faktor yang mempengaruhi hasil adalah besar volume larutan NH4Fe(SO4)2, volume larutan KCNS, volume akuades, ketepatan
pengukuran volume dengan alat, dan ketepatan menentukan kesamaan warna. Semakin besar volume larutan NH4Fe(SO4)2, semakin pekat warna
yang dihasilkan dan semakin besar normalitasnya. Dalam percobaan, volume KCNS belum berpengaruh karena perlakuan yang sama pada setiap larutan standar sebesar 5ml. Semakin besar volume air yang ditambahkan, semakin kecil normalitasnya.
IV. SIMPULAN
1. Konsentrasi dari larutan cuplikan A adalah 0,00075 N dan konsentrasi dari larutan cuplikan B adalah 0,0015 N.
DAFTAR PUSTAKA
Basset, J. 1994. Buku Ajar Vogel: Kimia Analisis Kuantitatif Anorganik. EGC, Jakarta.
Chang, Raymond. 2004. Kimia Dasar. Jakarta: Erlangga.
Dini, P.A. 2013. Pembuatan Tes Kit Tiosianat Berdasarkan Pembentukan Kompleks Merah Besi (III) Tiosianat. Jurnal Ilmu Kimia 1(2): 9.
Effendi, H. 2003. Telaah Kualitas Air. Kanisius, Yogyakarta. Pudjaatmaka, H. A. 2002. Kamus Kimia. Balai Pustaka, Jakarta.
LAMPIRAN
Gambar 1. Larutan NH4Fe(SO4)2
dimasukkan ke dalam tabung reaksi.
Gambar 2. Larutan NH4Fe(SO4)2
ditambahkan akuades hingga volum 20ml.
Gambar 4. Warna larutan cuplikan dibandingkan dengan deret larutan standar.
Gambar 3. Tabung reaksi
PERHITUNGAN Normalitas NH4Fe(SO4)2 1 ml V1.C1=V2.C2 1.0,01=20.C2 0,0005 N =C2 2 ml V1.C1=V2.C2 2.0,01=20.C2 0,001 N=C2 4 ml V1.C1=V2.C2 4.0,01=20.C2 0,002 N=C2 6 ml V1.C1=V2.C2 6.0,01=20.C2 0,003 N=C2 8 ml V1.C1=V2.C2 8.0,01=20.C2 0,004 N=C2 Konsentrasi Cuplikan X 1 V1.C1=V2.C2 1,5.0,01=20.C2 0,00075 N=C2 X 2 V1.C1=V2.C2 3.0,01=20.C2 0,0015N=C2