LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI PT. FERRON PAR PHARMACEUTICALS
JALAN JABABEKA VI BLOK J No. 2-3, CIKARANG, JAWA BARAT
PERIODE 1 JULI – 26 AGUSTUS 2011
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
YUDHO PRABOWO, S.Farm.
1006835596
ANGKATAN LXXIII
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
PROGRAM PROFESI APOTEKER – DEPARTEMEN FARMASI
DEPOK
DESEMBER 2011
i
LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT. FERRON PAR PHARMACEUTICALS
JALAN JABABEKA VI BLOK J No. 2-3, CIKARANG, JAWA BARAT PERIODE 1 JULI – 26 AGUSTUS 2011
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
Diajukan sebagai salah satu syarat untuk memperoleh gelar Apoteker
YUDHO PRABOWO, S.Farm. 1006835596
ANGKATAN LXXIII
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM PROGRAM PROFESI APOTEKER – DEPARTEMEN FARMASI
DEPOK DESEMBER 2011
ii Laporan Praktek Kerja Profesi ini diajukan oleh : Nama : Yudho Prabowo S. Farm
NPM : 1006835596
Program Studi : Apoteker
Judul Laporan : Laporan Praktek Kerja Profesi Apoteker Di PT. Ferron Par Pharmaceuticals Jalan Jababeka VI Blok J No. 2-3, Cikarang, Jawa Barat Periode 1 Juli – 26 Agustus 2011
Telah berhasil dipertahankan di hadapan Dewan Penguji dan diterima sebagai bagian persyaratan yang diperlukan untuk memperoleh gelar Apoteker pada Program Studi Apoteker – Departemen Farmasi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Indonesia
DEWAN PENGUJI
Pembimbing I : Rejeki Indiastuti, S.F., Apt. ( ……….. ) Pembimbing II : Drs. Hayun, M.Si., Apt ( ……….. )
Penguji : ……… ( ……….. )
Penguji : ……… ( ……….. )
Penguji : ……… ( ……….. )
Ditetapkan di : Depok
iii
Segala puji dan syukur hanyalah untuk Allah SWT atas limpahan nikmat, rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan Praktek Kerja Profesi Apoteker di PT. Ferron Par Pharmaceutical dan penyusunan laporan ini tepat waktu. Shalawat dan salam senantiasa tercurah kepada Nabi Muhammad SAW beserta keluarga dan sahabatnya.
Laporan ini disusun sebagai salah satu syarat kelulusan dari Program Profesi Apoteker Departemen Farmasi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Indonesia untuk mencapai gelar apoteker. Pada kesempatan ini Penulis ingin mengucapkan terima kasih kepada:
1. Bapak Drs. Djoko Sujono, MBA selaku Managing Director PT. Ferron Par Pharmaceutical karena telah memberi penulis kesempatan untuk melakukan PKPA di PT. Ferron Par Pharmaceuticals.
2. Bapak Rahmat Budi Yuwono, S.Si., Apt. selaku Quality ManagerPT. Ferron Par Pharmaceuticals yang telah memberikan kesempatan kepada penulis untuk belajar dan memperoleh banyak pengalaman di bagian Quality PT. Ferron Par Pharmaceuticals.
3. Ibu Rejeki Indiastuti, S.F., Apt, selaku Validation Manager dan pembimbing PKPA ini. Terima kasih atas kesempatan yang diberikan pada penulis sehingga mendapatkan banyak pengalaman dan pelajaran berharga di PT. Ferron Par Pharmaceuticals.
4. Bapak Drs. Hayun, M.Si., Apt. sebagai pembimbing dari Program Profesi Apoteker Departemen Farmasi FMIPA UI, yang telah memberikan pengarahan dan bimbingan dalam penyusunan laporan.
5. Ibu Prof. Dr. Yahdiana Harahap, MS., Apt. sebagai Ketua Departemen Farmasi FMIPA UI.
6. Bapak Dr. Harmita, Apt. Sebagai Ketua Program Profesi Apoteker Departemen Farmasi FMIPA UI.
7. Anton Sulistiawan, S.Si., Apt, Arif Budianto, S.Farm., Apt., dan para Supervisordi PT. Ferron Par Pharmaceuticals yang telah memberikan induksi, arahan, dan bimbingan selama pelaksanaan PKPA, khususnya dalam
iv
atas kerjasama dan pengetahuan yang telah dibagikan kepada penulis.
9. Keluarga yang telah memberikan bantuan moril dan materil sehingga pelaksanaan PKPA dan laporan berjalanlancar.
10. Semua teman-teman Apoteker Universitas Indonesia Angkatan 73 yang saling mendukung dan bekerjasama selama perkuliahan dan pelaksanaan PKPA. 11. Serta pihak lain yang telah membantu sehingga Laporan Praktek Kerja Profesi
Apoteker ini dapat selesai.
Penulis menyadari bahwa dalam pembuatan laporan ini masih terdapat banyak kekurangan dan kesalahan. Oleh karena itu, penulis sangat mengharapkan kritik dan saran yang membangun. Akhir kata, penulis berharap semoga pengetahuan dan pengalaman yang penulis peroleh selama menjalani Praktek Kerja Profesi Apoteker ini dapat memberikan manfaat bagi rekan-rekan sejawat dan semua pihak yang membutuhkan.
Jakarta, Desember 2011 Penulis
i
LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT. FERRON PAR PHARMACEUTICALS
JALAN JABABEKA VI BLOK J No. 2-3, CIKARANG, JAWA BARAT PERIODE 1 JULI – 26 AGUSTUS 2011
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
Diajukan sebagai salah satu syarat untuk memperoleh gelar Apoteker
YUDHO PRABOWO, S.Farm. 1006835596
ANGKATAN LXXIII
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM PROGRAM PROFESI APOTEKER – DEPARTEMEN FARMASI
DEPOK DESEMBER 2011
ii Laporan Praktek Kerja Profesi ini diajukan oleh : Nama : Yudho Prabowo S. Farm
NPM : 1006835596
Program Studi : Apoteker
Judul Laporan : Laporan Praktek Kerja Profesi Apoteker Di PT. Ferron Par Pharmaceuticals Jalan Jababeka VI Blok J No. 2-3, Cikarang, Jawa Barat Periode 1 Juli – 26 Agustus 2011
Telah berhasil dipertahankan di hadapan Dewan Penguji dan diterima sebagai bagian persyaratan yang diperlukan untuk memperoleh gelar Apoteker pada Program Studi Apoteker – Departemen Farmasi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Indonesia
Ditetapkan di : Depok
iii
Segala puji dan syukur hanyalah untuk Allah SWT atas limpahan nikmat, rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan Praktek Kerja Profesi Apoteker di PT. Ferron Par Pharmaceutical dan penyusunan laporan ini tepat waktu. Shalawat dan salam senantiasa tercurah kepada Nabi Muhammad SAW beserta keluarga dan sahabatnya.
Laporan ini disusun sebagai salah satu syarat kelulusan dari Program Profesi Apoteker Departemen Farmasi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Indonesia untuk mencapai gelar apoteker. Pada kesempatan ini Penulis ingin mengucapkan terima kasih kepada:
1. Bapak Drs. Djoko Sujono, MBA selaku Managing Director PT. Ferron Par Pharmaceutical karena telah memberi penulis kesempatan untuk melakukan PKPA di PT. Ferron Par Pharmaceuticals.
2. Bapak Rahmat Budi Yuwono, S.Si., Apt. selaku Quality ManagerPT. Ferron Par Pharmaceuticals yang telah memberikan kesempatan kepada penulis untuk belajar dan memperoleh banyak pengalaman di bagian Quality PT. Ferron Par Pharmaceuticals.
3. Ibu Rejeki Indiastuti, S.F., Apt, selaku Validation Manager dan pembimbing PKPA ini. Terima kasih atas kesempatan yang diberikan pada penulis sehingga mendapatkan banyak pengalaman dan pelajaran berharga di PT. Ferron Par Pharmaceuticals.
4. Bapak Drs. Hayun, M.Si., Apt. sebagai pembimbing dari Program Profesi Apoteker Departemen Farmasi FMIPA UI, yang telah memberikan pengarahan dan bimbingan dalam penyusunan laporan.
5. Ibu Prof. Dr. Yahdiana Harahap, MS., Apt. sebagai Ketua Departemen Farmasi FMIPA UI.
6. Bapak Dr. Harmita, Apt. Sebagai Ketua Program Profesi Apoteker Departemen Farmasi FMIPA UI.
7. Anton Sulistiawan, S.Si., Apt, Arif Budianto, S.Farm., Apt., dan para Supervisordi PT. Ferron Par Pharmaceuticals yang telah memberikan induksi, arahan, dan bimbingan selama pelaksanaan PKPA, khususnya dalam
iv
atas kerjasama dan pengetahuan yang telah dibagikan kepada penulis.
9. Keluarga yang telah memberikan bantuan moril dan materil sehingga pelaksanaan PKPA dan laporan berjalanlancar.
10. Semua teman-teman Apoteker Universitas Indonesia Angkatan 73 yang saling mendukung dan bekerjasama selama perkuliahan dan pelaksanaan PKPA. 11. Serta pihak lain yang telah membantu sehingga Laporan Praktek Kerja Profesi
Apoteker ini dapat selesai.
Penulis menyadari bahwa dalam pembuatan laporan ini masih terdapat banyak kekurangan dan kesalahan. Oleh karena itu, penulis sangat mengharapkan kritik dan saran yang membangun. Akhir kata, penulis berharap semoga pengetahuan dan pengalaman yang penulis peroleh selama menjalani Praktek Kerja Profesi Apoteker ini dapat memberikan manfaat bagi rekan-rekan sejawat dan semua pihak yang membutuhkan.
Jakarta, Desember 2011 Penulis
HALAMAN JUDUL ... i
HALAMAN PENGESAHAN ... ii
KATA PENGANTAR ... iii
DAFTAR ISI ... v
DAFTAR GAMBAR ... viii
DAFTAR TABEL ... ix
DAFTAR LAMPIRAN ... x
BAB 1. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
BAB 2. TINJAUAN UMUM ... 3
2.1 Industri Farmasi ... 3
2.1.1 Pengertian Industri Farmasi ... 3
2.1.2 Persyaratan Usaha Industri Farmasi ... 3
2.1.3 Pembinaan dan pengawasan Industri Farmasi ... 5
2.2 Cara Pembuatan Obat yang Baik (CPOB) ... 6
2.2.1 Manajemen Mutu ... 7
2.2.2 Personalia ... 8
2.2.3 Bangunan dan fasilitas ... 10
2.2.4 Peralatan ... 10
2.2.5 Sanitasi dan Higiene ... 11
2.2.6 Produksi ... 11
2.2.7 Pengawasan Mutu ... 12
2.2.8 Inspeksi Diri dan Audit Mutu ... 13
2.2.9 Penanganan Keluhan Terhadap Produk, Penarikan Kembali Produk, dan Produk Kembalian ... 14
2.2.10 Dokumentasi ... 15
2.2.11 Pembuatan dan Analisis Berdasarkan Kontrak ... 15
2.2.12 Kualifikasi dan Validasi ... 16
BAB 3. TINJAUAN KHUSUS PT FERRON PAR PHARMACEUTICALS ... 17
3.1 Sejarah PT. Ferron Par Pharmaceuticals (PT. FPP) ... 17
3.2 Visi dan Misi ... 19
3.3 Lokasi dan Tata Letak Bangunan ... 20
3.4 Batas-Batas Ferron Cikarang Plant ... 20
3.5 Sistem Managerial PT. Ferron Par Pharmaceuticals ... 20
3.6 Personalia ... 21
3.6.1 Departemen pemasaran (Marketing Department) ... 22
3.6.2 Departemen Sistem dan Perencanaan (System and Planning Department) ... 22
3.6.5.1 Bagian Validasi ... 24
3.6.5.2 Bagian Internal Quality Audit (IQA) ... 25
3.6.5.3 Bagian Post Production and Quality Monitoring(PPQM) ... 26
3.6.5.4 Bagian Laboratorium... 27
3.6.5.5 Bagian In Process Control(IPC) ... 28
3.6.6 Departemen Sumber Daya Manusia (Human and Resources Department/HRD) ... 29
3.6.7 Departemen Keuangan dan Akunting (Finance and Accounting Departement) ... 29
3.6.8 Departemen Urusan Umum (General Affair) ... 29
3.7 Bangunan dan Fasilitas PT. FPP ... 30
3.7.1 Pembagian Ferron Cikarang Plant ... 30
3.7.2 Pembagian Ruangan (Zoning Area) ... 32
3.8 Sanitasi dan Higiene ... 32
3.8.1 Higiene Personalia dan Keselamatan Kerja ... 33
3.8.2 Sanitasi Bangunan ... 33
3.8.2.1. Pembersihan Ruangan Produksi untuk Area Blackdan Grey... 33
3.8.2.2. Pembersihan Ruangan Produksi untuk Ruang Steril ... 34 3.8.3 Sanitasi Peralatan ... 34 3.9 Factory PT. FPP ... 35 3.9.1 Produksi ... 35 3.9.1.1 Lini Timbang ... 35 3.9.1.2 Lini Solida 1 ... 37 3.9.1.3 Lini Solida 2 ... 38 3.9.1.4 Lini Likuida ... 38 3.9.1.5 Lini Semisolida ... 39 3.9.1.6 Lini Steril 1 ... 40 3.9.1.7 Lini Steril 2 ... 41 3.9.2 Bagian Gudang ... 42 3.9.2.1 Penerimaan Barang ... 42 3.9.2.2 Penyimpanan Barang ... 44 3.9.2.3 Pendistribusian Barang ... 45
3.9.2.4 Perhitungan Stok Barang ... 46
3.9.2.5 Penanganan BMT (Bahan Mudah Terbakar) dan BMM (Barang Mudah Meledak) ... 46
3.9.3 Bagian Teknik ... 46 3.9.3.1 Building Maintenance ... 47 3.9.3.2 Production Machinery ... 47 3.9.3.3 Utility ... 47 BAB 4. PEMBAHASAN ... 54 4.1 Manajemen Mutu ... 54 4.2 Personalia ... 56
4.5 Sanitasi dan Higiene ... 60
4.6 Produksi ... 62
4.7 Pengawasan Mutu ... 68
4.8 Inspeksi Diri dan Audit Mutu ... 69
4.9 Penanganan Keluhan Terhadap Produk, Penarikan Kembali Produk, dan Produk Kembalian ... 70
4.10 Dokumentasi ... 74
4.11 Pembuatan dan Analisis Berdasarkan Kontrak ... 75
4.12 Kualifikasi dan Validasi ... 75
BAB 5. KESIMPULAN DAN SARAN ... 80
5.1 Kesimpulan ... 80
5.2 Saran ... 80
Gambar 3.1. Logo PT. Ferron Par Pharmaceuticals ... 18
Gambar 3.2. Denah Lokasi Ferron Cikarang Plant ... 83
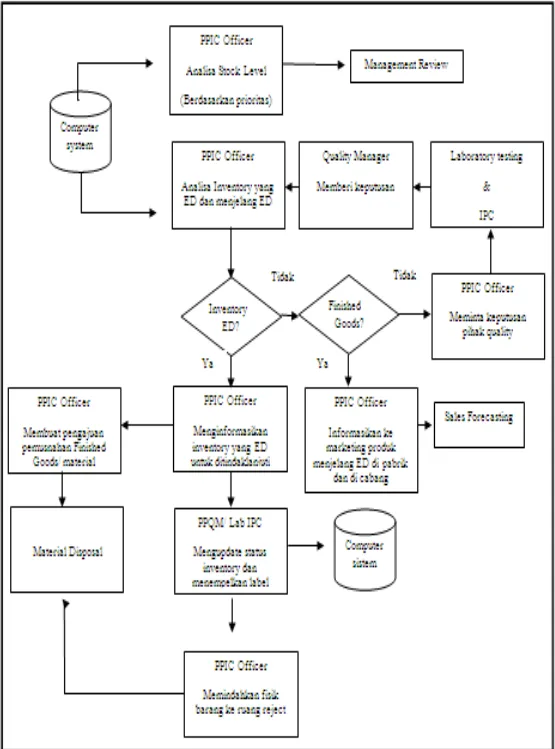
Gambar 3.3. Alur Inventory ControlPada PT. FPP ... 84
Gambar 3.4. Konsep (A) Deadlag(B) Zerodeadlag ... 85
Gambar 3.5. Pengolahan Air di PT. FPP ... 85
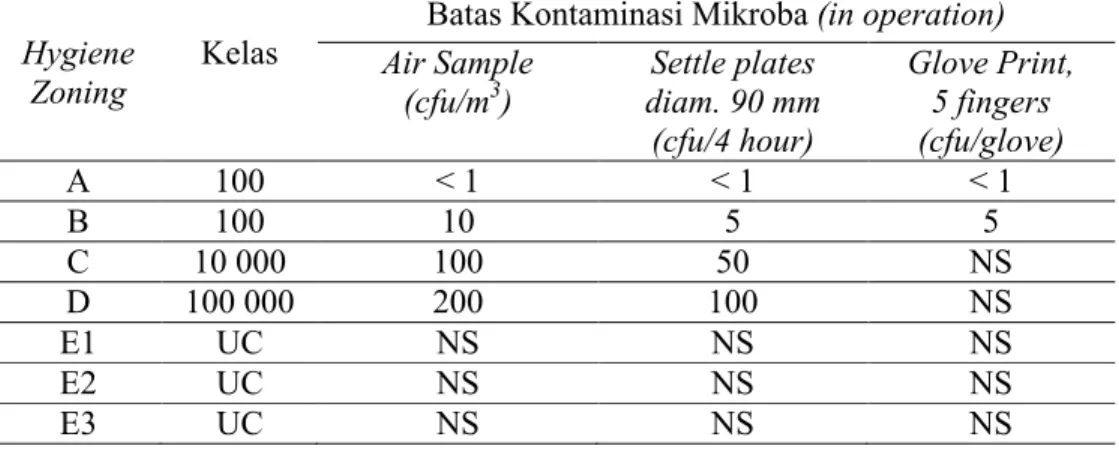
Tabel 3.1. Daftar Sertifikasi CPOB PT. FPP ... 87 Tabel 3.2. Daftar Sertifikat MHRA PT. FPP ... 88 Tabel 3.3. Pembagian Kelas Ruangan Berdasarkan Jumlah Partikel ... 89 Tabel 3.4. Pembagian Kelas Ruangan Berdasarkan Batas Kontaminasi
Mikroba ... 89 Tabel 3.5. Parameter Spesifikasi Air ... 90
Lampiran 1. Struktur Organisasi Umum PT. FPP ... 92
Lampiran 2. Struktur Organisasi Departemen Sistem dan Perencanaan ... 92
Lampiran 3. Struktur Organisasi Umum Bagian Quality PT. FPP ... 93
Lampiran 4. Alur Kegiatan Lini Timbang ... 94
Lampiran 5. Alur Proses Produksi Lini Solida 1 ... 95
Lampiran 6. Alur Proses Produksi Lini Solida 2 ... 96
Lampiran 7. Alur Proses Produksi Lini Likuida ... 97
Lampiran 8. Alur Produksi Lini Semisolida ... 98
Lampiran 9. Alur Produksi Lini Steril 1 ... 99
Lampiran 10. Alur Proses Produksi Steril Pada Lini Steril 2 ... 100
Lampiran 11. Alur Penerimaan Barang Eksternal Untuk Produksi ... 101
Lampiran 12. Alur Distribusi Barang Dari Gudang (Internal) ... 102
Lampiran 13. Alur Distribusi Barang Dari Gudang (Eksternal) ... 102
HALAMAN JUDUL ... i
HALAMAN PENGESAHAN ... ii
KATA PENGANTAR ... iii
DAFTAR ISI ... v
DAFTAR GAMBAR ... viii
DAFTAR TABEL ... ix
DAFTAR LAMPIRAN ... x
BAB 1. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
BAB 2. TINJAUAN UMUM ... 3
2.1 Industri Farmasi ... 3
2.1.1 Pengertian Industri Farmasi ... 3
2.1.2 Persyaratan Usaha Industri Farmasi ... 3
2.1.3 Pembinaan dan pengawasan Industri Farmasi ... 5
2.2 Cara Pembuatan Obat yang Baik (CPOB) ... 6
2.2.1 Manajemen Mutu ... 7
2.2.2 Personalia ... 8
2.2.3 Bangunan dan fasilitas ... 10
2.2.4 Peralatan ... 10
2.2.5 Sanitasi dan Higiene ... 11
2.2.6 Produksi ... 11
2.2.7 Pengawasan Mutu ... 12
2.2.8 Inspeksi Diri dan Audit Mutu ... 13
2.2.9 Penanganan Keluhan Terhadap Produk, Penarikan Kembali Produk, dan Produk Kembalian ... 14
2.2.10 Dokumentasi ... 15
2.2.11 Pembuatan dan Analisis Berdasarkan Kontrak ... 15
2.2.12 Kualifikasi dan Validasi ... 16
BAB 3. TINJAUAN KHUSUS PT FERRON PAR PHARMACEUTICALS ... 17
3.1 Sejarah PT. Ferron Par Pharmaceuticals (PT. FPP) ... 17
3.2 Visi dan Misi ... 19
3.3 Lokasi dan Tata Letak Bangunan ... 20
3.4 Batas-Batas Ferron Cikarang Plant ... 20
3.5 Sistem Managerial PT. Ferron Par Pharmaceuticals ... 20
3.6 Personalia ... 21
3.6.1 Departemen pemasaran (Marketing Department) ... 22
3.6.2 Departemen Sistem dan Perencanaan (System and Planning Department) ... 22
3.6.5.1 Bagian Validasi ... 24
3.6.5.2 Bagian Internal Quality Audit (IQA) ... 25
3.6.5.3 Bagian Post Production and Quality Monitoring(PPQM) ... 26
3.6.5.4 Bagian Laboratorium... 27
3.6.5.5 Bagian In Process Control(IPC) ... 28
3.6.6 Departemen Sumber Daya Manusia (Human and Resources Department/HRD) ... 29
3.6.7 Departemen Keuangan dan Akunting (Finance and Accounting Departement) ... 29
3.6.8 Departemen Urusan Umum (General Affair) ... 29
3.7 Bangunan dan Fasilitas PT. FPP ... 30
3.7.1 Pembagian Ferron Cikarang Plant ... 30
3.7.2 Pembagian Ruangan (Zoning Area) ... 32
3.8 Sanitasi dan Higiene ... 32
3.8.1 Higiene Personalia dan Keselamatan Kerja ... 33
3.8.2 Sanitasi Bangunan ... 33
3.8.2.1. Pembersihan Ruangan Produksi untuk Area Blackdan Grey... 33
3.8.2.2. Pembersihan Ruangan Produksi untuk Ruang Steril ... 34 3.8.3 Sanitasi Peralatan ... 34 3.9 Factory PT. FPP ... 35 3.9.1 Produksi ... 35 3.9.1.1 Lini Timbang ... 35 3.9.1.2 Lini Solida 1 ... 37 3.9.1.3 Lini Solida 2 ... 38 3.9.1.4 Lini Likuida ... 38 3.9.1.5 Lini Semisolida ... 39 3.9.1.6 Lini Steril 1 ... 40 3.9.1.7 Lini Steril 2 ... 41 3.9.2 Bagian Gudang ... 42 3.9.2.1 Penerimaan Barang ... 42 3.9.2.2 Penyimpanan Barang ... 44 3.9.2.3 Pendistribusian Barang ... 45
3.9.2.4 Perhitungan Stok Barang ... 46
3.9.2.5 Penanganan BMT (Bahan Mudah Terbakar) dan BMM (Barang Mudah Meledak) ... 46
3.9.3 Bagian Teknik ... 46 3.9.3.1 Building Maintenance ... 47 3.9.3.2 Production Machinery ... 47 3.9.3.3 Utility ... 47 BAB 4. PEMBAHASAN ... 54 4.1 Manajemen Mutu ... 54 4.2 Personalia ... 56
4.5 Sanitasi dan Higiene ... 60
4.6 Produksi ... 62
4.7 Pengawasan Mutu ... 68
4.8 Inspeksi Diri dan Audit Mutu ... 69
4.9 Penanganan Keluhan Terhadap Produk, Penarikan Kembali Produk, dan Produk Kembalian ... 70
4.10 Dokumentasi ... 74
4.11 Pembuatan dan Analisis Berdasarkan Kontrak ... 75
4.12 Kualifikasi dan Validasi ... 75
BAB 5. KESIMPULAN DAN SARAN ... 80
5.1 Kesimpulan ... 80
5.2 Saran ... 80
Gambar 3.1. Logo PT. Ferron Par Pharmaceuticals ... 18
Gambar 3.2. Denah Lokasi Ferron Cikarang Plant ... 83
Gambar 3.3. Alur Inventory ControlPada PT. FPP ... 84
Gambar 3.4. Konsep (A) Deadlag(B) Zerodeadlag ... 85
Gambar 3.5. Pengolahan Air di PT. FPP ... 85
Tabel 3.1. Daftar Sertifikasi CPOB PT. FPP ... 87 Tabel 3.2. Daftar Sertifikat MHRA PT. FPP ... 88 Tabel 3.3. Pembagian Kelas Ruangan Berdasarkan Jumlah Partikel ... 89 Tabel 3.4. Pembagian Kelas Ruangan Berdasarkan Batas Kontaminasi
Mikroba ... 89 Tabel 3.5. Parameter Spesifikasi Air ... 90
Lampiran 1. Struktur Organisasi Umum PT. FPP ... 92
Lampiran 2. Struktur Organisasi Departemen Sistem dan Perencanaan ... 92
Lampiran 3. Struktur Organisasi Umum Bagian Quality PT. FPP ... 93
Lampiran 4. Alur Kegiatan Lini Timbang ... 94
Lampiran 5. Alur Proses Produksi Lini Solida 1 ... 95
Lampiran 6. Alur Proses Produksi Lini Solida 2 ... 96
Lampiran 7. Alur Proses Produksi Lini Likuida ... 97
Lampiran 8. Alur Produksi Lini Semisolida ... 98
Lampiran 9. Alur Produksi Lini Steril 1 ... 99
Lampiran 10. Alur Proses Produksi Steril Pada Lini Steril 2 ... 100
Lampiran 11. Alur Penerimaan Barang Eksternal Untuk Produksi ... 101
Lampiran 12. Alur Distribusi Barang Dari Gudang (Internal) ... 102
Lampiran 13. Alur Distribusi Barang Dari Gudang (Eksternal) ... 102
1.1 Latar Belakang
Peningkatan derajat kesehatan masyarakat Indonesia adalah salah satu tujuan dari Kementerian Kesehatan Republik Indonesia. Obat merupakan salah satu hal yang menunjang peningkatan kesehatan tersebut sehingga ketersediaan obat yang merata dan terjangkau oleh masyarakat dipasaran dapat mendorong terciptanya kualitas hidup masyarakat yang lebih baik. Obat adalah bahan atau zat yang berasal dari tumbuhan, hewan, mineral maupun zat kimia tertentu yang dapat digunakan untuk mengurangi rasa sakit, memperlambat proses penyakit dan atau menyembuhkan penyakit. Karena berhubungan langsung dengan fungsi fisiologis dan nyawa manusia, maka obat harus memiliki kualitas yang baik dan bermutu, bersifat aman dan mempunyai khasiat yang diinginkan.
Produksi obat adalah salah satu kegiatan dari sebuah industri farmasi. Obat yang dihasilkan harus sedemikian rupa agar sesuai dengan tujuan penggunaannya, memenuhi persyaratan yang tercantum dalam dokumen izin edar (registrasi) dan tidak menimbulkan resiko yang membahayakan karena tidak aman, mutu rendah atau tidak efektif. Industri farmasi harus memperhatikan setiap aspek yang berhubungan dengan mutu dan keamanan obat. Pembuatan obat terdiri dari beberapa tahap yang harus dilalui dan memungkinkan mempunyai pengaruh terhadap mutu obat, begitu juga dengan bahan-bahan dan peralatan yang berkontak langsung dengan bahan obat. Oleh karena terdapat banyak resiko yang dapat mempengaruhi mutu dan keamanan obat, maka dalam pembuatan obat-obatan industri farmasi diatur dalam keputusan menteri yang dituang dalam Surat Keputusan Menteri Kesehatan RI No.43/MENKES/SK/II/1988 pada tanggal 2 Februari 1988 untuk mewujudkan standar kualitas produk obat berupa kebijakan yang dinamakan Cara Pembuatan Obat yang Baik (CPOB).
Penerapan CPOB harus diikuti dengan pengetahun kefarmasian yang luas agar CPOB dapat diterapkan dengan sempurna. Salah satu sumber daya yang diharapkan memiliki pengetahuan kefarmasian yang dibutuhkan adalah seorang apoteker. Sesuai dengan Peraturan Pemerintah No. 51 Tahun 2009 tentang
Pekerjaan Kefarmasian, seorang apoteker memegang peranan penting dalam hal pengadaan, pengendalian dan distribusi obat-obatan yang dilakukan dalam industri farmasi. Oleh karena itu, keberadaan apoteker dalam industri farmasi minimal berjumlah 3 orang. Sebagai pemegang otoritas penuh tentang obat, seorang apoteker harus mempunyai standar kompetensi tertentu agar dapat menjamin konsistensi kualitas mutu industri farmasi dan produk farmasi di tengah-tengah persaingan industri yang ada. Untuk itu, diperlukan adanya pembekalan mengenai peran apoteker di dalam industri farmasi.
Salah satu pembekalan yang dapat dilakukan adalah dilaksanakannya program PKPA (Praktek Kerja Profesi Apoteker) di industri farmasi. Diharapkan dari PKPA ini para calon apoteker dapat mengetahui seluk beluk industri farmasi dan segala hal yang menyangkut kelangsungan suatu industri farmasi. Pengetahuan seperti ini dapat dimanfaatkan untuk mempersiapkan diri sebaik-baiknya dalam memasuki dunia kerja kefarmasian, khususnya terkait dengan kebutuhan informasi perkembangan bisnis farmasi, baik dari sisi manajerial maupun pengetahuan tentang peran strategis apoteker secara profesional di industri farmasi. Melalui kegiatan ini pula, mahasiswa tingkat profesi diharapkan dapat mengamati secara langsung penerapan CPOB di industri farmasi.
1.2 Tujuan
Praktek Kerja Profesi Apoteker di PT. Ferron Par Pharmaceuticals bertujuan agar :
a. Mahasiswa profesi Apoteker dapat melihat langsung aktivitas yang berlangsung dalam suatu industri farmasi.
b. Mahasiswa profesi Apoteker dapat memperoleh pengetahuan dan wawasan tentang segala aspek yang terkait di industri farmasi terutama dalam hal penerapan CPOB di PT. Ferron Par Pharmaceuticals.
c. Mahasiswa profesi Apoteker dapat memiliki pemahaman yang mendalam mengenai peran dan tugas Apoteker di industri farmasi.
2.1 Industri Farmasi
2.1.1 Pengertian Industri Farmasi
Menurut Peraturan Menteri Kesehatan Republik Indonesia No. 1799/Menkes/Per/XII/2010 tentang Industri Farmasi, industri farmasi adalah badan usaha yang memiliki izin dari Menteri Kesehatan untuk melakukan kegiatan pembuatan obat atau bahan obat. Industri farmasi dapat melakukan kegiatan proses pembuatan obat dan/atau bahan obat untuk semua tahapan dan/atau sebagian tahapan. Pembuatan obat adalah seluruh tahapan kegiatan dalam menghasilkan obat, yang meliputi pengadaan bahan awal dan bahan pengemas, produksi, pengemasan, pengawasan mutu dan pemastian mutu sampai diperoleh obat untuk didistribusikan (Kementerian Kesehatan, 2010).
2.1.2 Persyaratan Usaha Industri Farmasi (Kementerian Kesehatan, 2010)
Industri farmasi untuk melaksanakan proses industrinya harus memenuhi ketentuan yang ditetapkan oleh pemerintah. Menurut peraturan Menteri Kesehatan Republik Indonesia No. 1799/Menkes/Per/XII/2010 tentang Industri Farmasi, usaha industri farmasi wajib memenuhi persyaratan sebagai berikut :
a. Setiap pendirian Industri Farmasi wajib memperoleh izin industri farmasi dari Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan.
b. Industri Farmasi yang membuat obat dan/atau bahan obat yang termasuk dalam golongan narkotika wajib memperoleh izin khusus untuk memproduksi narkotika sesuai dengan ketentuan peraturan perundang-undangan.
Persyaratan untuk memperoleh izin industri farmasi terdiri atas : a. Berbadan usaha berupa perseroan terbatas,
b. Memiliki rencana investasi dan kegiatan pembuatan obat, c. Memiliki Nomor Pokok Wajib Pajak,
d. Memiliki secara tetap paling sedikit 3 (tiga) orang apoteker Warga Negara Indonesia masing-masing sebagai penanggung jawab pemastian mutu, produksi dan pengawasan mutu,
e. Komisaris dan direksi tidak pernah terlibat, baik langsung atau tidak langsung dalam pelanggaran peraturan perundang-undangan di bidang kefarmasian.
Untuk memperoleh izin industri farmasi diperlukan persetujuan prinsip yang berlaku selama 3 (tiga) tahun. Permohonan persetujuan prinsip diajukan secara tertulis kepada Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan. Dalam hal permohonan persetujuan prinsip dilakukan oleh Industri Penanaman Modal Asing atau Penanaman Modal Dalam Negeri, pemohon harus memperoleh Surat Persetujuan Penanaman Modal dari instansi yang menyelenggarakan urusan penanaman modal sesuai ketentuan peraturan perundang-undangan. Persetujuan prinsip diberikan oleh Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan setelah pemohon memperoleh persetujuan Rencana Induk Pembangunan (RIP) dari Kepala Badan Pengawasan Obat dan Makanan. Dalam hal permohonan persetujuan prinsip telah diberikan, pemohon dapat langsung melakukan persiapan, pembangunan, pengadaan, pemasangan dan instalasi peralatan termasuk produksi percobaan dengan memperhatikan ketentuan perundang-undangan.
Setiap pendirian industri farmasi wajib memenuhi ketentuan sebagaimana diatur dalam peraturan perundang-undangan di bidang tata ruang dan lingkungan hidup. Industri Farmasi wajib memenuhi persyaratan CPOB yang dibuktikan dengan sertifikat CPOB. Sertifikat CPOB berlaku selama 5 (lima) tahun sepanjang memenuhi persyaratan. Ketentuan mengenai persyaratan dan tata cara sertifikasi CPOB diatur oleh Kepala Badan Pengawasan Obat dan Makanan. Selain wajib memenuhi ketentuan yang telah disebutkan, Industri Farmasi juga wajib melakukan farmakovigilans.
Izin usaha industri farmasi diberikan oleh Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan dengan rekomendasi dari kepala Badan Pengawasan Obat dan Makanan (Badan POM). Izin ini berlaku seterusnya selama perusahaan industri farmasi tersebut berproduksi dan memenuhi ketentuan peraturan perundang-undangan. Industri Farmasi yang akan melakukan perubahan bermakna terhadap pemenuhan persyaratan CPOB, baik untuk perubahan kapasitas dan/atau fasilitas produksi wajib melapor dan mendapat persetujuan sesuai ketentuan perundang-undangan. Untuk industri farmasi Penanaman Modal
Asing (PMA) masa berlakunya sesuai dengan ketentuan dalam UU No. 1 tahun 1967 tentang Penanaman Modal Asing dan peraturan pelaksanaannya.
Perusahaan Industri Farmasi yang telah mendapat Izin Usaha Industri wajib :
a. Menyampaikan laporan industri secara berkala mengenai kegiatan usahanya yaitu sekali dalam enam bulan, meliputi jumlah dan nilai produksi setiap obat atau bahan obat yang dihasilkan serta sekali dalam satu tahun.
b. Melaksanakan upaya keseimbangan dan kelestarian sumber daya alam serta pencegahan timbulnya kerusakan dan pencemaran terhadap lingkungan hidup akibat kegiatan Industri Farmasi yang dilakukannya;
c. Melaksanakan upaya yang menyangkut keamanan dan keselamatan alat, bahan baku dan bahan penolong, proses serta hasil produksinya termasuk pengangkutannya dan keselamatan kerja;
d. Melakukan Analisa Mengenai Dampak Lingkungan (AMDAL) yang berlaku bagi jenis-jenis industri yang telah ditetapkan dan kewajiban untuk melakukannya setelah memperoleh Izin Usaha Industri Farmasi.
2.1.3 Pembinaan dan Pengawasan Industri Farmasi
Pembinaan terhadap pengembangan industri farmasi dilakukan oleh Kepala BPOM. Dalam melaksanakan pengawasan, tenaga pengawas dapat memasuki setiap tempat yang digunakan dalam kegiatan pembuatan, penyimpanan, pengangkutan dan perdagangan obat dan bahan obat untuk memeriksa, meneliti dan mengambil contoh, membuka dan meneliti kemasan obat, serta memeriksa dokumen atau catatan lain yang diduga memuat keterangan mengenai kegiatan pembuatan, penyimpanan, pengangkutan dan perdagangan obat dan bahan obat. Tenaga pengawas juga dapat mengambil gambar (foto) seluruh atau sebagian fasilitas dan peralatan yang digunakan dalam pembuatan, penyimpanan, pengangkutan dan/atau perdagangan obat dan bahan obat.
Pelanggaran terhadap ketentuan yang tercantum dalam peraturan Menteri Kesehatan Republik Indonesia No. 1799/Menkes/Per/XII/2010 tentang Industri Farmasi dapat dikenakan sanksi administratif berupa :
b. Larangan mengedarkan untuk sementara waktu dan/atau perintah untuk penarikan kembali obat atau bahan obat dari peredaran bagi obat atau bahan obat yang tidak memenuhi standar dan persyaratan keamanan, khasiat, atau mutu (diberikan oleh Kepala BPOM);
c. Perintah pemusnahan obat atau bahan obat jika terbukti tidak memenuhi persyaratan keamanan, khasiat atau mutu (diberikan oleh Kepala BPOM); d. Penghentian sementara kegiatan (diberikan oleh Kepala BPOM);
e. Pembekuan izin industri farmasi (diberikan oleh Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan atas rekomendasi Kepala BPOM); dan f. Pencabutan izin industri farmasi (diberikan oleh Direktur Jenderal Bina
Kefarmasian dan Alat Kesehatan atas rekomendasi Kepala BPOM). Izin usaha industri farmasi dapat dicabut dalam hal :
a. Perusahaan Industri Farmasi yang telah mendapat Izin Usaha Industri Farmasi melakukan pemindahtanganan hak milik Izin Usaha Industri Farmasi dan perluasan tanpa memiliki izin sesuai dengan ketentuan dalam Surat Keputusan ini; dan atau
b. Perusahaan Industri Farmasi yang telah mendapat Izin Usaha Industri Farmasi tidak menyampaikan informasi industri farmasi secara berturut-turut 3 (tiga) kali atau dengan sengaja menyampaikan informasi yang tidak benar; dan atau c. Perusahaan Industri Farmasi yang telah mendapat Izin Usaha Industri Farmasi
melakukan pemindahan lokasi usaha industri tanpa persetujuan tertulis terlebih dahulu dari menteri; dan atau
d. Perusahaan Industri Farmasi yang telah mendapat Izin Usaha Industri Farmasi dengan sengaja memproduksi Obat Jadi atau Bahan Baku Obat yang tidak memenuhi persyaratan dan ketentuan yang berlaku, obat palsu; dan atau e. Tidak dipenuhinya ketentuan dalam Izin Usaha Industri Farmasi yang
ditetapkan dalam Surat Keputusan.
2.2 Cara Pembuatan Obat yang Baik (CPOB)
CPOB merupakan bagian dari sistem pemastian mutu yaitu suatu konsep dalam industri farmasi mengenai prosedur atau langkah-langkah yang dilakukan dalam suatu industri farmasi untuk menjamin mutu obat jadi, yang diproduksi
dengan menerapkan Good Manufacturing Practices (GMP) dalam seluruh aspek dan rangkaian kegiatan produksi, sehingga obat yang dihasilkan senantiasa memenuhi persyaratan mutu yang ditentukan sesuai dengan tujuan penggunaannya.
CPOB merupakan suatu pedoman untuk memastikan agar mutu obat yang dihasilkan sesuai persyaratan dan tujuan penggunaannya, bila perlu dapat dilakukan penyesuaian pedoman dengan syarat bahwa standar mutu obat yang telah ditentukan tetap dicapai. Mutu obat tergantung pada bahan awal, bahan pengemas, proses produksi, pengendalian mutu, bangunan, peralatan yang digunakan, dan personel yang terlibat. Pada proses pembuatan obat, pengendalian menyeluruh sangat penting untuk menjamin bahwa konsumen menerima obat yang bermutu tinggi. Pembuatan yang tidak sesuai dengan prosedur tidak dibenarkan bagi produk yang digunakan untuk menyelamatkan jiwa, memulihkan atau memelihara kesehatan.
CPOB mencakup seluruh aspek produksi dan pengendalian mutu. Ruang lingkup CPOB edisi 2006, meliputi manajemen mutu, personalia, bangunan dan fasilitas, peralatan, sanitasi dan higiene, produksi, pengawasan mutu, inspeksi diri dan audit mutu, penanganan keluhan terhadap produk, penarikan kembali produk dan produk kembalian, dokumentasi, pembuatan dan analisis berdasarkan kontrak, serta kualifikasi dan validasi.
2.2.1 Manajemen Mutu
Industri farmasi harus membuat obat sedemikian rupa agar sesuai dengan tujuan penggunaannya, memenuhi persyaratan yang tercantum dalam izin edar (registrasi) dan tidak menimbulkan risiko yang membahayakan bagi penggunanya karena tidak aman, mutu rendah atau tidak efektif. Manajemen mutu bertanggung jawab untuk pencapaian tujuan ini melalui suatu “Kebijakan Mutu”, yang memerlukan partisipasi dan komitmen dari semua jajaran di semua departemen di dalam perusahaan, para pemasok, dan para distributor. Untuk mencapai tujuan mutu secara konsisten dan dapat diandalkan, diperlukan manajemen mutu yang didesain secara menyeluruh dan diterapkan secara benar. Unsur dasar manajemen mutu adalah :
a. Suatu infrastruktur atau sistem mutu yang tepat mencakup struktur organisasi, prosedur, proses, dan sumber daya.
b. Tindakan sistematis yang diperlukan untuk mendapatkan kepastian dengan tingkat kepercayaan yang tinggi, sehingga produk atau jasa pelayanan yang dihasilkan akan selalu memenuhi persyaratan yang telah ditetapkan.
Keseluruhan tindakan tersebut disebut pemastian mutu. Pemastian mutu adalah suatu konsep luas yang mencakup semua hal baik secara tersendiri maupun secara kolektif, yang akan mempengaruhi mutu dari obat yang dihasilkan. Pemastian mutu merupakan totalitas semua pengaturan yang dibuat dengan tujuan untuk memastikan bahwa obat dihasilkan dengan mutu yang sesuai dengan tujuan pemakaiannya. Pemastian mutu suatu obat tidak hanya mengandalkan pelaksanaan pengujian tertentu saja namun obat hendaklah dibuat dalam kondisi yang dikendalikan dan dipantau secara cermat. Karena itu pemastian mutu mencakup CPOB ditambah dengan faktor lain, seperti desain dan pengembangan produk.
2.2.2 Personalia
Sumber daya manusia sangat penting dalam pembentukan dan penerapan sistem pemastian mutu yang memuaskan dan pembuatan obat yang benar. Oleh sebab itu, industri farmasi bertanggung jawab untuk menyediakan personel yang terkualifikasi dalam jumlah yang memadai untuk melaksanakan semua tugas. Seluruh personel hendaklah memahami prinsip CPOB, memperoleh pelatihan awal dan berkesinambungan, termasuk instruksi mengenai higiene yang berkaitan dengan pekerjaan serta memahami tanggung jawab masing-masing.
Industri farmasi harus memiliki struktur organisasi di mana tugas spesifik dan kewenangan dari personel pada posisi penanggung jawab hendaklah dicantumkan dalam uraian tugas tertulis. Tugas tersebut boleh didelegasikan kepada wakil yang ditunjuk dan mempunyai tingkat kualifikasi yang memadai. Dalam hal ini, aspek penerapan CPOB tidak ada yang terlewatkan ataupun tumpang tindih dalam tanggung jawab yang tercantum pada uraian tugas. Personil kunci mencakup kepala bagian Produksi, kepala bagian Pengawasan Mutu dan kepala bagian Pemastian Mutu. Kepala bagian Produksi dan kepala bagian
Manajemen Mutu (Pemastian Mutu) atau kepala bagian Pengawasan Mutu harus independen satu terhadap yang lain.
Tanggung jawab masing-masing personil kunci adalah sebagai berikut : a. Kepala bagian Produksi
1) Memastikan obat dibuat dan disimpan sesuai prosedur agar memenuhi syarat mutu yang ditetapkan.
2) Memberi persetujuan prosedur tetap (protap) yang berkaitan dengan produksi serta implementasinya.
3) Memastikan catatan produksi telah dievaluasi dan ditandatangani sebelum diserahkan ke bagian pemastian mutu.
4) Memastikan pemeliharaan gedung dan peralatan produksi. 5) Memastikan validasi proses telah dilaksanakan.
6) Memastikan pelatihan dilaksanakan. b. Kepala bagian Pemastian Mutu
1) Memastikan penerapan sistem mutu. 2) Memprakarsai pembuatan Quality Manual. 3) Inspeksi diri dan eksternal audit.
4) Melakukan pengawasan bagian pengawasan mutu.
5) Mengkoordinasi program validasi, kualifikasi dan kalibrasi. 6) Memastikan pemenuhan persyaratan CPOB dan dari regulator. 7) Mengkaji Catatan Bets dan Product Quality Review.
8) Menangani keluhan (teknis dan medis).
9) Menangani obat kembalian dan penarikan obat. c. Kepala bagian Pengawasan Mutu
1) Meluluskan atau menolak bahan awal, bahan pengemas, produk antara/ruahan dan obat jadi.
2) Memberi persetujuan spesifikasi, instruksi sampling, metode uji dan protap pengawasan mutu.
3) Memberi persetujuan dan memantau kontrak analisa. 4) Memastikan pemeliharaan gedung dan alat.
5) Memastikan validasi metoda telah dilakukan. 6) Melakukan stabilitas obat jadi.
7) Memastikan pelatihan dilaksanakan. 2.2.3 Bangunan dan Fasilitas
Bangunan dan fasilitas untuk pembuatan obat termasuk area produksi, laboratorium, area penyimpanan, koridor, dan lingkungan sekeliling bangunan hendaklah memiliki desain, konstruksi, dan letak yang memadai, serta disesuaikan kondisinya dan dirawat dengan baik untuk memudahkan pelaksanaan operasional yang benar. Bangunan dan fasilitas hendaklah dirawat dengan cermat, dibersihkan dan didesinfeksi sesuai prosedur tertulis secara rinci. Kondisi bangunan hendaklah ditinjau secara teratur dan diperbaiki bila perlu. Tindakan perbaikan dan perawatan terhadap bangunan dan fasilitas dilakukan hati-hati agar kegiatan tersebut tidak mempengaruhi mutu obat pasokan.
Tata letak dan desain ruangan harus dibuat sedemikian rupa untuk memperkecil risiko terjadinya kekeliruan, pencemaran silang, memudahkan pembersihan, sanitasi dan perawatan yang efektif, menghindari penumpukan debu atau kotoran dan dampak lain yang dapat menurunkan mutu obat. Letak bangunan diatur sedemikian rupa untuk menghindari pencemaran dari lingkungan sekelilingnya, seperti pencemaran dari udara, tanah, air, serta dari kegiatan industri lain yang berdekatan. Apabila letak bangunan tidak sesuai, hendaklah diambil tindakan pencegahan yang efektif terhadap pencemaran tersebut.
Seluruh bangunan dan fasilitas termasuk area produksi, laboratorium, area penyimpanan, koridor dan lingkungan sekeliling bangunan hendaklah dirawat dalam kondisi bersih dan rapi. Kondisi bangunan hendaklah ditinjau secara teratur dan diperbaiki bila perlu. Perbaikan dan perawatan bangunan dan fasilitas hendaklah dilakukan hati-hati agar kegiatan tersebut tidak mempengaruhi mutu obat pasokan.
2.2.4 Peralatan
Peralatan untuk pembuatan obat hendaklah memiliki desain dan konstruksi yang tepat, ukuran yang memadai serta ditempatkan dan dikualifikasi dengan tepat, agar mutu obat terjamin sesuai desain serta seragam dari bets ke bets dan untuk memudahkan pembersihan serta perawatan.
Peralatan hendaklah didesain dan dikonstruksi sesuai dengan tujuannya. Permukaan peralatan yang bersentuhan dengan bahan awal, produk antara atau produk jadi tidak boleh menimbulkan reaksi, adisi atau absorbsi yang dapat mempengaruhi identitas, mutu atau kemurnian di luar batas yang ditentukan. Bahan yang diperlukan untuk pengoperasian alat khusus misalnya pelumas atau pendingin tidak boleh bersentuhan dengan bahan yang sedang diolah sehingga tidak mempengaruhi identitas, mutu atau kemurnian bahan awal, produk antara ataupun produk jadi. Peralatan tidak boleh merusak produk akibat katup bocor tetesan pelumas dan hal sejenis atau karena perbaikan, perawatan, modifikasi dan adaptasi yang tidak tepat. Peralatan hendaklah didesain sedemikian rupa agar mudah dibersihkan. Pembersihan peralatan dilakukan sesuai dengan prosedur tertulis yang rinci serta disimpan dalam keadaan bersih dan kering. Peralatan hendaklah dirawat sesuai jadwal untuk mencegah malfungsi atau pencemaran yang dapat mempengaruhi identitas, mutu atau kemurnian produk.
2.2.5 Sanitasi dan Higiene
Tingkat sanitasi dan higiene yang tinggi hendaklah diterapkan pada setiap aspek pembuatan obat. Ruang lingkup sanitasi dan higiene meliputi personil, bangunan, peralatan dan perlengkapan, bahan produksi serta wadahnya, dan segala sesuatu yang dapat menjadi sumber pencemaran produk. Sumber pencemaran potensial harus dihilangkan melalui suatu program sanitasi dan higiene yang menyeluruh dan terpadu. Sanitasi dan higiene yang diatur dalam pedoman CPOB terbaru adalah terhadap personalia, bangunan dan peralatan. Prosedur sanitasi dan higiene hendaklah divalidasi dan dievaluasi secara berkala untuk cukup efektif dan selalu memenuhi persyaratan.
2.2.6 Produksi
Produksi hendaklah dilaksanakan dengan mengikuti prosedur yang telah ditetapkan dan memenuhi ketentuan CPOB yang senantiasa menjamin bahwa produk yang dihasilkan memenuhi ketentuan izin pembuatan dan izin edar (registrasi). Mutu suatu obat tidak hanya ditentukan oleh hasil analisis terhadap produk akhir melainkan juga oleh mutu yang dibangun selama tahapan proses
produksi (built in quality) sejak pemilihan bahan awal, penimbangan, proses produksi personalia, bangunan, peralatan kebersihan, dan higiene sampai dengan pengemasan.
Produksi hendaklah dilakukan dan diawasi oleh personel yang kompeten. Prosedur produksi dibuat oleh penanggung jawab produksi bersama dengan penanggung jawab pengawasan mutu yang dapat menjamin obat yang dihasilkan memenuhi spesifikasi yang telah ditentukan. Prosedur kerja standar hendaklah tertulis, mudah dipahami dan dipatuhi oleh karyawan produksi, serta didokumentasikan. Dokumentasi setiap langkah dilakukan dengan cermat, tepat dan ditangani oleh karyawan yang melaksanakan tugas.
2.2.7 Pengawasan Mutu
Pengawasan mutu merupakan bagian yang esensial dari Cara Pembuatan Obat yang Baik (CPOB) untuk memberikan kepastian bahwa produk secara konsisten mempunyai mutu yang sesuai dengan tujuan pemakaiannya. Keterlibatan dan komitmen semua pihak yang berkepentingan pada semua tahap merupakan keharusan untuk mencapai sasaran mutu mulai dari awal pembuatan sampai kepada distribusi produk jadi. Pengawasan mutu tidak terbatas pada kegiatan laboratorium, tetapi juga harus terlibat dalam semua keputusan yang terkait dengan mutu produk. Ketidaktergantungan pengawasan mutu dari produksi dianggap hal yang fundamental agar pengawasan mutu dapat melakukan kegiatan dengan memuaskan. Tiap pemegang izin pembuatan harus mempunyai bagian pengawasan mutu. Bagian ini harus independen dari bagian lain dan berada di bawah tanggung jawab dan wewenang seorang dengan kualifikasi dan pengalaman yang sesuai, yang membawahi satu atau beberapa laboratorium. Sarana yang memadai harus tersedia untuk memastikan bahwa segala kegiatan pengawasan mutu dilaksanakan dengan efektif dan dapat diandalkan.
Pengawasan mutu hendaklah mencakup semua kegiatan analisis yang dilakukan di laboratorium, termasuk pengambilan sampel, pemeriksaan, dan pengujian bahan awal, produk antara, produk ruahan, dan produk jadi. Kegiatan ini mencakup juga uji stabilitas, program pemantauan lingkungan, pengujian yang
dilakukan dalam rangka validasi, penanganan sampel pertinggal, menyusun dan memperbaharui spesifikasi bahan dan produk serta metode pengujiannya.
Dokumentasi dan prosedur pelulusan yang diterapkan bagian pengawasan mutu hendaklah menjamin bahwa pengujian yang diperlukan telah dilakukan sebelum bahan digunakan dalam produksi dan produk disetujui sebelum didistribusikan. Personel pengawasan mutu hendaklah memiliki akses ke area produksi untuk pengambilan sampel dan penyelidikan yang diperlukan. Personel, bangunan dan fasilitas, serta peralatan laboratorium hendaklah sesuai untuk segala jenis tugas yang ditentukan dan skala kegiatan pembuatan obat.
2.2.8 Inspeksi Diri dan Audit Mutu
Tujuan inspeksi diri adalah untuk mengevaluasi apakah semua aspek poduksi dan pengawasan mutu industri farmasi memenuhi ketentuan CPOB. Program inspeksi diri hendaklah dirancang untuk mendeteksi kelemahan dalam pelaksanaan CPOB dan untuk menetapkan tindakan perbaikan yang diperlukan. Inspeksi diri hendaklah dilakukan secara independen dan rinci oleh petugas yang kompeten dari perusahaan. Ada manfaatnya juga bila menggunakan auditor luar yang independen. Inspeksi diri hendaklah dilakukan secara rutin dan di samping itu, pada situasi khusus, misalnya dalam hal terjadi penarikan kembali obat jadi atau terjadi penolakan yang berulang. Semua saran untuk tindakan perbaikan supaya dilaksanakan. Prosedur dan catatan inspeksi diri hendaklah didokumentasikan dan dibuat program tindak lanjut yang efektif.
Pada aspek–aspek inspeksi diri hendaklah dibuat daftar periksa inspeksi diri yang menyajikan standar persyaratan minimal dan seragam. Daftar periksa inspeksi diri ini hendaklah mengandung pertanyaan mengenai ketentuan CPOB yang meliputi personalia, bangunan termasuk fasilitas untuk personil, perawatan bangunan dan peralatan, penyimpanan bahan awal, bahan pengemas dan obat jadi, peralatan, pengolahan dan pengawasan selama proses, pengawasan mutu, dokumentasi, sanitasi dan higiene, program validasi dan revalidasi, kalibrasi alat atau sistem pengukuran, prosedur penarikan kembali obat jadi, penanganan keluhan, pengawasan label dan hasil inspeksi diri sebelumnya dan tindakan perbaikan.
Inspeksi diri dapat dilakukan oleh tiap bagian sesuai kebutuhan pabrik, namun inspeksi diri yang dilaksanakan secara menyeluruh hendaklah dilaksanakan minimal satu kali dalam setahun. Frekuensi inspeksi diri hendaklah tertulis dalam prosedur tetap inspeksi diri. Penyelenggaraan audit mutu berguna sebagai pelengkap inspeksi diri. Audit mutu meliputi pemeriksaan dan penilaian semua atau sebagian dari sistem manajemen mutu dengan tujuan spesifik untuk meningkatkan mutu. Audit mutu umumnya dilaksanakan oleh spesialis dari luar atau independen atau tim yang dibentuk khusus untuk hal ini oleh manajemen perusahaan. Audit mutu juga dapat diperluas terhadap pemasok dan penerima kontrak.
2.2.9 Penanganan Keluhan Terhadap Produk, Penarikan Kembali Produk, dan Produk Kembalian
Keluhan terhadap obat dan laporan keluhan dapat menyangkut mutu, efek samping yang merugikan atau masalah efek terapetik. Semua keluhan dan laporan keluhan hendaklah diteliti dan dievaluasi dengan cermat, kemudian diambil tindak lanjut yang sesuai dan dibuatkan laporan. Penarikan kembali obat jadi dapat berupa penarikan kembali satu atau beberapa bets atau seluruh obat jadi tertentu dari semua mata rantai distribusi. Penarikan kembali dilakukan apabila ditemukan adanya produk yang tidak memenuhi persyaratan mutu atau atas dasar pertimbangan adanya efek samping yang tidak diperhitungkan yang merugikan kesehatan. Penarikan produk dari peredaran dapat mengakibatkan penundaan atau penghentian pembuatan obat tersebut.
Obat kembalian adalah obat jadi yang telah beredar, yang kemudian dikembalikan ke pabrik karena adanya keluhan, kerusakan, kadaluwarsa, masalah keabsahan atau sebab lain mengenai kondisi obat, wadah atau kemasan sehingga menimbulkan keraguan akan keamanan, identitas, mutu dan jumlah obat yang bersangkutan.
Industri farmasi hendaklah menyiapkan prosedur untuk penahanan, penyelidikan dan pengujian produk kembalian serta pengambilan keputusan apakah produk kembalian dapat diproses ulang atau harus dimusnahkan setelah dilakukan evaluasi secara kritis. Produk kembalian yang tidak dapat diolah ulang hendaklah dimusnahkan. Prosedur pemusnahan bahan atau pemusnahan produk
harus disiapkan dan mencakup tindakan pencegahan terhadap pencemaran lingkungan dan penyalahgunaan bahan atau produk oleh orang yang tidak mempunyai wewenang.
2.2.10 Dokumentasi
Dokumentasi adalah bagian dari sistem informasi manajemen dan merupakan bagian yang esensial dari pemastian mutu. Dokumentasi yang jelas adalah fundamental untuk memastikan bahwa tiap personel menerima uraian tugas yang relevan secara jelas dan rinci sehingga memperkecil risiko terjadinya kekeliruan yang biasanya timbul karena hanya mengandalkan komunikasi lisan. Spesifikasi, dokumen produksi induk/formula pembuatan, prosedur, metode dan instruksi, laporan dan catatan harus bebas dari kekeliruan dan tersedia secara tertulis.
2.2.11 Pembuatan dan Analisis Berdasarkan Kontrak
Pembuatan dan analisis berdasarkan kontrak harus dibuat secara benar, disetujui dan dikendalikan untuk menghindari kesalahpahaman yang dapat menyebabkan produk atau pekerjaan dengan mutu yang tidak memuaskan. Kontrak tertulis antara pemberi kontrak dan penerima kontrak harus dibuat secara jelas menentukan tanggung jawab dan kewajiban masing-masing pihak. Kontrak harus menyatakan secara jelas prosedur pelulusan tiap bets produk untuk diedarkan yang menjadi tanggung jawab penuh kepala bagian Manajemen Mutu (Pemastian Mutu). Kontrak tertulis harus dibuat meliputi pembuatan dan/atau analisis obat yang dikontrakkan dan semua pengaturan teknis terkait. Semua pengaturan untuk pembuatan dan analisis berdasarkan kontrak termasuk perubahan dalam pengaturan teknis atau pengaturan lain hendaklah sesuai dengan izin edar untuk produk yang bersangkutan. Kontrak hendaklah mengizinkan pemberi kontrak untuk mengaudit sarana dari penerima kontrak. Pelulusan akhir dalam analisis berdasarkan kontrak harus diberikan oleh kepala bagian manajemen mutu (pemastian mutu) pemberi kontrak.
2.2.12 Kualifikasi dan Validasi
CPOB mensyaratkan industri farmasi untuk mengidentifikasi validasi yang diperlukan sebagai bukti pengendalian terhadap aspek kritis dari kegiatan yang dilakukan. Perubahan signifikan terhadap fasilitas, peralatan dan proses yang dapat mempengaruhi mutu produk hendaklah divalidasi. Pendekatan dengan kajian risiko hendaklah digunakan untuk menentukan ruang lingkup dan cakupan validasi.
Seluruh kegiatan validasi hendaklah direncanakan. Unsur utama program validasi hendaklah dirinci dengan jelas dan didokumentasikan di dalam Rencana Induk Validasi (RIV) atau dokumen setara. RIV hendaklah merupakan dokumen yang singkat, tepat dan jelas. RIV hendaklah mencakup sekurang-kurangnya data sebagai berikut: kebijakan validasi; struktur organisasi kegiatan validasi; ringkasan fasilitas, sistem, peralatan dan proses yang akan divalidasi; format dokumen: format protokol dan laporan validasi, perencanaan dan jadwal pelaksanaan; pengendalian perubahan; dan acuan dokumen yang digunakan.
Protokol validasi hendaklah merinci langkah kritis dan kriteria penerimaan. Laporan harus dibuat mengacu pada protokol kualifikasi dan/atau protokol validasi dan memuat ringkasan hasil yang diperoleh, tanggapan terhadap penyimpangan yang terjadi, kesimpulan dan rekomendasi perbaikan. Tiap perubahan terhadap rencana yang ditetapkan dalam protokol hendaklah didokumentasikan dengan pertimbangan yang sesuai.
PT. FERRON PAR PHARMACEUTICALS
3.1 Sejarah PT.. Ferron Par Pharmaceuticals
PT.. Ferron Par Pharmaceuticals (FPP) merupakan perusahaan farmasi yang tergabung dalam Grup Dexa Medica. Sejak didirikan pada tanggal 27 September 1970 oleh Rudy Soetikno, Hetty Soetikno, dan Lydia Siptiani Dexa Medica telah tumbuh menjadi salah satu industri besar farmasi di Indonesia. Perkembangan ini dan tuntutan globalisasi perindustrian, membuat PT. Dexa Medica membutuhkan fasilitas manufaktur baru dengan kemampuan memproduksi bentuk-bentuk sediaan farmasi yang lebih kompleks dibawah operasional perusahaan yang berbeda. FPP berdiri secara inkorporasi di bawah hukum pada 5 Desember 1994 dan proses operasionalnya dimulai sebagai perusahaan pemasaran pada 24 Januari 2001. Pembangunan FPP direncanakan pada bulan Juli 2000, mulai dibangun pada Oktober 2000 dan selesai dibangun pada bulan Juli 2002, dan mulai menjalankan proses produksi.
Produk yang diproduksi adalah produk PT. Dexa Medica, produk perusahaan lain yang melakukan toll in, serta produk FPP sendiri. Distribusi dilakukan oleh PT. Anugrah Argon Medica (PT. AAM), sebuah perusahaan distribusi yang juga tergabung dalam Dexa Medica Group. Perusahaan lain yang juga tergabung dalam Dexa Medica Group yaitu Equilab yang merupakan laboratorium BABE (Bioavaibility and Bioequivalent), Inmark yang bergerak dalam penyediaan jasa Medical Representative dan DLBS (Dexa Labolatory and Biomolecule Science) yang berperan dalam riset produk biomolekul dan vaksin. FPP mempunyai motto yaitu Inovasi (Innovation), Kualitas (Quality), dan Pelayanan (Care), dan dengan moto ini FPP telah mampu memproduksi berbagai sediaan farmasi dan menerapkan strategi diferensiasi segmen terapetik dengan pengelompokan produknya menjadi 5 kategori yaitu Opta (sediaan farmasi untuk mata), Derma (sediaan farmasi untuk kulit), Oncology (sediaan farmasi untuk penyakit kanker), serta Kualita dan Inova yang merupakan produk-produk campuran obat lainnya selain 3 kategori tersebut yaitu kardiovaskular,
antineoplastik, antidiabetes, analgesik dan vitamin.
FPP mempunyai logo berwarna merah berbentuk segitiga seperti gambar di bawah ini.
Gambar 3.1.Logo PT. Ferron Par Pharmaceuticals
Pada logo tersebut terdapat tulisan “fe” dalam segitiga merah yang merupakan simbolisasi dari unsur ferrum (besi), asal nama “Ferron”. Besi merupakan salah satu unsur penting dalam kehidupan, karenanya diharapkan FPP memiliki sifat yang sama dengan besi dalam hal kekuatan, kegunaan dan keberadaannya. Kata “Par” berasal dari istilah dalam olah raga golf yang berarti target yang harus dicapai. Oleh karena itu kata “Par” menunjukkan bahwa perusahaan selalu berusaha untuk memenuhi standar yang telah ditetapkan baik dalam hal kualitas produk maupun dalam hal praktek bisnisnya. Sedangkan “Pharmaceuticals” menunjukkan bahwa perusahaan ini bergerak di bidang industri farmasi.
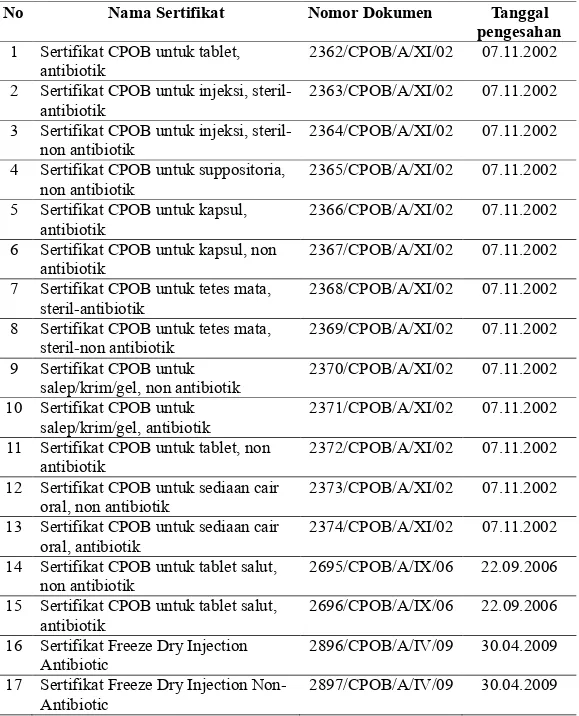
Pada 7 November 2002, FPP berhasil memperoleh sertifikasi CPOB dan pada 14 Mei 2003 mendapatkan sertifikat ISO 9001 edisi tahun 2000 (Resertifikasi pada tanggal 17-19 Mei 2006). ISO 9000 bukan merupakan suatu standar produk, tetapi merupakan sistem standar manajemen dalam menghasilkan suatu produk. Daftar sertifikat CPOB FPP dapat dilihat pada Tabel 3.1.
Selain itu, FPP berhasil memperoleh sertifikat GMP dari UK-MHRA (United Kingdom Medicine and Healthcare Product Regulatory) pada tahun 2008. UK-MHRA merupakan lembaga yang bertanggung jawab memantau keamanan, kualitas dan efektivitas obat-obatan yang dipasarkan di Inggris. Sertifikasi oleh Australia diberikan kepada FPP oleh TGA dari Department Of Health And Ageing, Therapeutic Goods Administration, khususnya untuk lini solida di FPP pada tanggal 15 Agustus 2009. Pada tanggal 15 Juni 2010 diperoleh serifikat Zentrale Arzneimitteluberwachung Bayern (ZAB) dari Bavarian, Bayern suatu badan yang berwenang dalam peredaran obat di Jerman untuk produk freeze dry Vancomycin lyomark yang diproduksi di lini steril FPP. Oleh karena berbagai
sertifika yang dimiliknya, FPP telah berhasil menembus pasar Inggris, Jerman, Afrika (Nigeria), dan Asia (Kamboja, Filipina, Vietnam, Srilanka, Hongkong). Daftar sertifikat MHRA FPP dapat dilihat pada Tabel 3.2.
3.2 Visi dan Misi 3.2.1 Visi
Perusahaan ini mempunyai visi untuk menjadi perusahaan terkemuka dengan tekad memberikan nilai tambah yang tinggi bagi setiap pelanggan dan para stakeholder dengan :
a. Produk inovatif dan berkualitas tinggi
b. Pelayanan yang unggul melalui proses yang efektif dan efisien c. Penyempurnaan yang berkesinambungan
Demi menciPT.akan kesehatan bagi semua di tingkat nasional, regional maupun global.
3.2.2 Misi
Untuk mewujudkan visi tersebut, FPP mempunyai misi untuk memantapkan kapasitas dan kompetensi untuk berperan dalam meningkatkan kualitas pelayanan kesehatan, melalui :
a. Inovasi dalam produk dan proses
b. Perbaikan berkesinambungan untuk kepentingan stake holder c. Produk dan layanan bernilai tambah bagi pelanggan
d. Kemitraan regional dan global demi pertumbuhan dan eksistensi.
Dalam menerapkan visi dan misi perusahaan, FPP menerapkan 5R yaitu Ringkas, Rapi, Resik, Rawat, dan Rajin. Hal ini bertujuan untuk meningkatkan efisiensi kerja, produktivitas, kualitas kerja, peningkatan moral, disiplin kerja, dan kenyamanan kerja. Selain itu juga terdapat program Ferron Suggestion System (FeSS) yang merupakan sarana bagi para karyawan Ferron dalam menyampaikan ide-ide kreatif dan saran untuk kemajuan Ferron. Ide dan saran dari para karyawan disampaikan ke komite saran dan kemudian dilombakan tiap 3 bulanan / tahunan. Dengan adanya program ini, diharapkan karyawan dapat ikut berpartisipasi secara aktif dalam perkembangan Ferron.
3.3 Lokasi dan Tata Letak Bangunan
FPP terletak di Jababeka Industrial Estate I, kawasan industri 40 km sebelah Timur Jakarta. Alamat FPP yaitu di Jalan Jababeka VI, Blok J No 2-3, Cikarang, Jawa Barat. Bagian pemasaran FPP dan kantor pusat FPP berada di Titan Center, lantai 7, Jalan Boulevard Bintaro Blok B7/B1 No. 05, Bintaro Jaya Sektor 7, Tangerang. FPP dibangun di atas tanah seluas 1,05 hektar, dengan lantai ruangan seluas 13.150 m2dan 20 % dari lahan tersebut dialokasikan untuk future extension yang terletak di sebelah selatan pabrik. Denah lokasi Ferron Cikarang Plant dapat dilihat pada Gambar 3.2.
3.4 Batas-Batas Ferron Cikarang Plant
Batas-batas Ferron Cikarang Plant(FCP) adalah :
a. Sebelah kiri (Utara) : berbatasan dengan Pabrik PT. Byung Hwa (komponen elektrik)
b. Sebelah depan (Timur) : berbatasan dengan jalan utama kawasan industri (Jababeka VI)
c. Sebelah kanan (Selatan) : berbatasan dengan tanah kosong dan sebagian gudang CV Echo (Technical spare part)
d. Sebelah belakang (Barat) : berbatasan dengan daerah pemukiman umum yang berjarak 3 m dari pagar yang ada di sekeliling pabrik.
3.5 Sistem Managerial PT.. Ferron Par Pharmaceuticals
Ferron Integrated System (FIS)merupakan sistem yang meregulasi semua aspek bisnis dan operasional kegiatan pengembangan, produksi dan pemasaran produk-produk farmasi PT.. Ferron Par Pharmaceuticals. Sebagai sistem integrasi utama, FIS mengakomodasikan kebutuhan dan standar yang diadopsi oleh perusahaan. Standar utama yang saat ini diadopsi oleh perusahaan adalah CPOB dan ISO 9001:2000 (Quality Management Sistem).
Struktur dokumentasi dalam FIS adalah sebagai berikut: a. Ferron Integrated System Manual (FIS Manual)
lingkup dan juga ringkasan dari prosedur. b. Prosedur
Dalam prosedur dijelaskan mengenai deskripsi detail mengenai langkah yang harus diambil dalam pelaksanaan kegiatan perusahaan. Pihak terkait, hubungan antar prosedur dan departemen lain dalam perusahaan dan juga laporan yang relevan dibuat dalam bentuk grafik alur proses. Dalam prosedur dicantumkan pula referensi standar yang diacu oleh FPP, yaitu Asean GMP 1996 dan ISO 9001:2000. Meskipun demikian dapat digunakan standar lain dalam kondisi tertentu bila dibutuhkan.
c. Dokumen pendukung
Dokumen pendukung terdiri dari instruksi kerja, standar operasional dan form yang dibutuhkan untuk melakukan kegiatan tertentu.
d. Record
Record terdiri dari form yang telah diisi, label dan sampel tertinggal, grafik, dan catatan lain yang menyediakan bukti bahwa sistem telah dilaksanakan secara benar dan efektif.
3.6 Personalia
FPP dipimpin oleh seorang managing director yang bertanggungjawab secara langsung kepada Coorporate Managing Director. Gambar struktur organisasi umum FPP dapat dilihat di Lampiran 1.
3.6.1 Departemen Pemasaran (Marketing Departement)
Departemen ini dipimpin oleh seorang kepala pemasaran dan penjualan (Head of Marketing and Sales). Departemen ini menangani pemasaran produk yang telah diproduksi. Kepala pemasaran dan penjualan membawahi marketing support manager, bussiness unit manager OPT.a, bussines unit manager Derma, marketing manager Kualita, marketing manager Inova dan bussiness unit manager Onco.
Dasar dari proses pemasaran melibatkan tiga hal, yaitu rencana pemasaran dan manajemen strategi, perencanaan dan kontrol penjualan, dan aktivitas pendukung pemasaran.
3.6.2 Departemen Sistem dan Perencanaan (System and Planning Departement) Departemen ini dipimpin oleh System and Planning Manager, yang membawahi Toll Manufacturing Officer, PPIC Officer, System Development Officer, dan Sytem Analyst. Struktur organisasi departemen sistem dan perencenaan dapat dilihat pada Lampiran 2. Departemen sistem dan perencanaan memberikan laporan secara langsung kepada manajemen puncak untuk memastikan bahwa Ferron Integrated System telah dilaksanakan dengan baik. Dengan demikian Manajer Sistem dan Perencanaan berperan sebagai System Management Representative.
SDO bertanggungjawab terhadap pengendalian dokumen, pengendalian proses, improvement dan memastikan agar semua dokumen standar FPP terkendali. Bagian SDO juga melakukan pengendalian proses dengan melakukan internal audit dan monitoring Balanced Score Card (BSC) atau target kerja. Bagian SDO juga mendapat tugas untuk mengolah quisioner dari customer supaya tidak terjadi konflik kepentingan pada bagian pemasaran. Sedangkan PPIC memiliki 3 tugas utama yang dapat disingkat IPC, yaitu I (inventory), P (Production Planning) dan C (Capacity Planning). Peran PPIC dalam Inventory yaitu menjaga agar level persediaan tidak terlalu berlebihan maupun kekurangan, sebab kelebihan stock dapat menjadi beban. Perencanaan produksi oleh PPIC dibuat melalui penyusunan MPS (Master Production Schedule). Pembuatan MPS berdasarkan atas ROFO (Rolling Forecast) yang dibuat tiap 6 bulan sekali. PPIC juga bertugas untuk memperkirakan kapasitas produksi yang mampu dilaksanakan oleh perusahaan. Bila ternyata kapasitas perusahaan tidak mampu mengcover kebutuhan produksi, dapat dilakukan toll out.
3.6.3 Departemen Pembelian (Purchasing Departement)
Departemen ini dipimpin oleh seorang manajer (Purchasing Manager). Departemen pembelian dibagi menjadi dua, yakni procurement dan pembelian umum. Procurement mencakup pembelian material produksi (bahan baku dan bahan kemas) serta barang jadi. Pembelian barang-barang yang tidak terkait atau tidak terkait secara langsung dengan produk dilakukan oleh bagian pembelian
umum. Bagian procurement bertujuan untuk memastikan bahwa material yang dibeli berkualitas dan memiliki harga yang kompetitif. Kegiatan di bagian ini antara lain kualifikasi supplieruntuk mengidentifikasi, memilih dan mengevaluasi supplier. Secara periodik dilakukan evaluasi performa supplier. Supplier dinilai berdasarkan reliabilitas (harga, ketepatan waktu dalam pengiriman, ketersediaan barang) dan perjanjian kerjasama. Pembelian dilakukan menggunakan Purchase Order yang dibuat berdasarkan daftar Permintaan (Purchase Requisition/PR). Daftar permintaan ini disusun berdasarkan Material Requirement Planning. 3.6.4 Departemen Pabrik (Factory Departement)
Departemen Pabrik dipimpin oleh seorang Manajer Pabrik yang membawahi tiga bagian, yaitu Produksi, Teknik, dan Gudang. Bagian Produksi dipimpin oleh seorang manajer produksi yang membawahi supervisor di setiap lini produksi. Proses manufaktur dan pengemasan adalah aktivitas harian utama yang dilakukan pada departemen produksi, sementara kajian mengenai kinerja produksi dilakukan setiap tiga bulan sekali. Pengemasan merupakan proses dimana produk ruahan atau produk dikemas dalam kemasan primer dan sekunder sehingga menjadi produk akhir yang akan dipasarkan. Dalam proses ini perlu dipastikan bahwa semua label, nomor batch dan semua penandaan lain yang diperlukan telah disertakan dengan baik. Perlu dihindari juga kejadian seperti salah label atau tidak terpasangnya label.
3.6.5 Departemen Quality(Quality Departement)
Bagian Quality berperan dalam pemeriksaan bahan awal, pemeriksaan proses produksi, pemeriksaan produk ruahan, dan pemeriksaan produk jadi. Departemen Qualitybertanggung jawab untuk memastikan bahwa bahan, produk, dan metode dalam proses produksinya telah memenuhi kriteria yang ditentukan sehingga hasilnya dapat memenuhi persyaratan yang ditentukan secara konsisten.
Kualitas suatu produk dipengaruhi oleh banyak faktor, antara lain kualitas bahan baku, personel, bangunan, peralatan, metode dan keseluruhan proses produksi. Departemen Quality memastikan bahwa semua hal yang dapat mempengaruhi kualitas produk bahan, telah memenuhi kriteria yang telah
ditentukan sehingga hasilnya dapat memenuhi persyaratan yang telah ditentukan secara konsisten. Departemen Qualitydipimpin oleh Quality Managerdan dibagi menjadi 6 bagian yakni Validation, Internal Quality Audit (IQA), Post Production and Quality Monitoring (PPQM), Quality Chemical Laboratory, Quality Microbiology Laboratory dan In Process Control (IPC). Gambar struktur organisasi FPP bagian quality dapat dilihat pada Lampiran 3.
3.6.5.1 Bagian Validasi
Bagian validasi dikoordinasi oleh manajer validasi dalam rangka memastikan terlaksananya prinsip-prinsip CPOB yang ditetapkan dalam proses produksi di industri farmasi. Tanggung jawab bagian validasi terangkum dalam Validation Master Plan (VMP). Ruang lingkup dari VMP ini antara lain :
a. Kualifikasi
Kualifikasi adalah kegiatan untuk memastikan bahwa fasilitas/mesin/ peralatan/ ruangan memenuhi spesifikasi yang ditetapkan.
b. Kalibrasi
Kalibrasi adalah kegiatan untuk memastikan bahwa pembacaan alat ukur yang terdapat pada mesin, instrumen, dan fasilitas lainnya, dibandingkan dengan alat ukur standar, masih dalam rentang kriteria penerimaan. Pelaksanaan kalibrasi di FPP ada yang kalibrasi secara internal dan eksternal. Jadwal kalibrasi tahunan dikeluarkan setiap awal tahun yang memuat daftar alat ukur dan frekuensi pengujian. Jadwal dibuat oleh Validation Managerdan disetujui oleh Quality Manager.
c. Validasi pembersihan
Validasi pembersihan adalah kegiatan untuk memastikan proses pembersihan perlatan yang kontak langsung dengan produk berlangsung secara efektif sehingga tidak mendatangkan kontaminasi kimia maupun mikroba untuk produksi berikutnya.
d. Validasi proses
Validasi proses adalah kegiatan untuk memastikan bahwa proses oPT.imasi dan validasi proses produksi suatu produk dapat menghasilkan parameter-parameter proses produksi yang sesuai sehingga diperoleh suatu proses produksi yang