BAB III
METODE PENELITIAN
Metode penelitian yang dilakukan adalah penelitian eksperimental, karena penelitian bertujuan untuk mengetahui pengaruh/hubungan antara variabel bebas dengan variabel terikat. Dalam penelitian ini perlakuan terhadap pakkat merupakan variabel bebas sedangkan uji aktivitas antioksidan dan penentuan kandungan fenolik total merupakan variabel terikat. Penelitian ini dilakukan di Laboratorium Penelitian Fakultas Farmasi Universitas Sumatera Utara, pada bulan Oktober 2016 sampai Desember 2016.
3.1 Alat dan Bahan 3.1.1 Alat
Alat-alat yang digunakan dalam penelitian ini adalah: alat-alat gelas yang diperlukan dalam penelitian, blender (Philips), hot plate, kuvet, neraca analitik (Baeco), pisau (Stainless), spektrofotometer UV-Vis (Shimadzu), stopwatch dan vortex.
3.1.2 Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah bahan yang berkualitas pro analisis dari E. Merck yaitu DPPH (Sigma), vitamin C, asam galat, natrium karbonat, Folin-Ciocalteau, metanol dan akuadest.
3.2Pembuatan Pereaksi 3.2.1 Larutan DPPH 0,5 mM
3.2.2 Larutan Natrium Karbonat 20%
Sebanyak 4 g natrium karbonat ditimbang kemudian dilarutkan dalam akuades hingga diperoleh volume larutan 20 ml.
3.3 Prosedur Penelitian 3.3.1 Pengambilan Sampel
Pengambilan sampel dilakukan secara sampling purposif, artinya sampel dipilih hanya atas dasar pertimbangan peneliti yang menganggap unsur-unsur yang dikehendaki telah ada dalam anggota sampel yang diambil (Sudjana, 2005).
Sampel yang digunakan dalam penelitian ini adalah rotan muda dari hutan Desa Lumban Pasir Kecamatan Tambangan Kabupaten Mandailing Natal. Panjang rotan muda yang diambil sekitar 70 cm.
3.3.2 Penyiapan Sampel 3.3.2.1 Pakkat Segar
Rotan muda yang telah dibersihkan, lalu diambil bagian dalam yang berwarna putih. Kemudian dicuci dengan air mengalir dan ditiriskan sampai air cuciannya kering. Selanjutnya ditimbang sebanyak 100 gram dihaluskan dengan blender. Ditimbang 5 gram pakkat segar untuk digunakan dalam uji aktivitas
antioksidan dan kandungan total fenol. 3.3.2.2 Pakkat Rebus
dengan sekali perebusan, dinginkan dan dihaluskan dengan blender. Ditimbang 5 gram pakkat segar untuk digunakan dalam uji aktivitas antioksidan dan kandungan total fenol.
3.3.2.3 Pakkat Bakar
Rotan muda yang kulit luarnya berwarna hijau dibakar menggunakan kayu bakar selama ±15 menit sampai kulit luarnya berwarna kehitaman, dinginkan, kemudian dikupas kulit luarnya dan diambil bagian dalamnya. Kemudian dicuci bersih dengan air mengalir dan ditiriskan sampai air cuciannya kering, selanjutnya sebanyak 100 gram dihaluskan dengan blender. Ditimbang 5 gram pakkat segar untuk digunakan dalam uji aktivitas antioksidan dan kandungan total fenol.
3.4Pengujian Aktivitas Antioksidan Menggunakan Metode Pemerangkapan Radikal Bebas DPPH
3.4.1 Pembuatan Larutan Blanko
Larutan DPPH 0,5 mM (konsentrasi 200 ppm) dipipet sebanyak 5 ml, kemudian dimasukkan ke dalam labu tentukur 25 ml, lalu dicukupkan dengan metanol sampai garis tanda (konsentrasi 40 μg/ml) (Molyneux, 2004).
3.4.2 Pengukuran Panjang Gelombang Serapan Maksimum DPPH
Larutan DPPH konsentrasi 40 µg/ml dihomogenkan dan diukur serapannya pada panjang gelombang 400-800 nm yang merupakan panjang gelombang sinar tampak (Gandjar dan Rohman, 2007).
3.4.3 Penentuan Waktu Kerja (Operating Time)
diamati waktu larutan tersebut mulai menghasilkan absorbansi yang stabil, yang akan digunakan sebagai operating time.
3.4.4 Pembuatan Larutan Induk
3.4.4.1 Pembuatan Larutan Induk Pakkat
Pakkat segar, pakkat rebus dan pakkat bakar ditimbang 5 gram, masing-masing dimasukkan ke dalam labu tentukur 100 ml dilarutkan dengan metanol lalu volumenya dicukupkan dengan metanol sampai garis tanda (konsentrasi 50000 μg/ml).
3.4.4.2 Pembuatan Larutan Induk Vitamin C
Serbuk vitamin C ditimbang 25 mg, dimasukkan ke dalam labu tentukur 25 ml dilarutkan dengan metanol lalu volumenya dicukupkan dengan metanol sampai garis tanda (konsentrasi 1000 μg/ml).
3.4.5 Pembuatan Larutan Uji
3.4.5.1 Pembuatan Larutan Uji Pakkat
3.4.5.2 Pembuatan Larutan Uji Vitamin C
Larutan induk dipipet sebanyak 0,05 ml; 0,1 ml; 0,15 ml dan 0,2 ml kedalam labu ukur 25 ml untuk mendapatkan konsentrasi larutan uji 2 μg/ml, 4 μg/ml, 6 μg/ml,dan 8 μg/ml, ke dalam masing-masing labu ukur ditambahkan 5 ml larutan DPPH 0,5 mM (konsentrasi 200 μg/ml) lalu volumenya dicukupkan dengan metanol sampai garis tanda. Diamkan selama 60 menit, lalu diukur serapannya menggunakan spektrofotometer UV-Vis pada panjang gelombang yang diperoleh.
3.4.6 Analisis Persen Pemerangkapan Radikal Bebas DPPH
Menurut Molyneux (2004), penentuan persen pemerangkapan radikal bebas oleh sampel pakkat segar, pakkat rebus dan pakkat bakar dengan vitamin C sebagai kontrol positif, menggunakan metode pemerangkapan radikal bebas 1,1-diphenyl-2-picryhydrazil (DPPH), yaitu dihitung dengan rumus sebagai berikut:
Aktivitas pemerangkapan radikal bebas (%) = A kontrol −A sampel
A kontrol x 100%
Keterangan: Akontrol = Absorbansi tidak mengandung sampel Asampel = Absorbansi sampel
3.4.7 Analisis Nilai IC50
3.5 Penentuan Kandungan Fenolik Total
3.5.1 Pembuatan Larutan Induk Baku Asam Galat
Sebanyak 10 mg serbuk asam galat, dimasukkan ke dalam labu tentukur 10 ml dilarutkan dengan metanol lalu volumenya dicukupkan dengan metanol sampai garis tanda (konsentrasi 1000 μg/ml)..
3.5.2 Penentuan Panjang Gelombang Maksimum Asam Galat
Dipipet larutan asam galat konsentrasi 1000 μg/ml sebanyak 0,5 ml dan dimasukkan ke dalam labu tentukur 10 ml. Ditambahkan 7,5 ml akuades dan 0,5 ml larutan Folin-Ciocalteu, kemudian dihomogenkan dengan alat vortex selama 1 menit lalu didiamkan, selanjutnya ditambahkan 1,5 ml larutan natrium karbonat 20%. Ukur panjang gelombang maksimum menggunakan
spektrofotometer UV-Visibel pada rentang 400 nm ̶ 800 nm. 3.5.3 Penentuan Waktu Kerja (Operating Time)
Dipipet larutan asam galat konsentrasi 1000 μg/ml sebanyak 0,5 ml dan dimasukkan ke dalam labu tentukur 10 ml. Ditambahkan 7,5 ml akuades dan 0,5 ml larutan Folin-Ciocalteu, kemudian dihomogenkan dengan alat vortex selama 1 menit lalu didiamkan, selanjutnya ditambahkan 1,5 ml larutan natrium karbonat 20%. Diukur absorbansi larutan pada panjang gelombang 775 nm setiap 1 menit dan diamati waktu larutan tersebut mulai menghasilkan absorbansi yang stabil, yang akan digunakan sebagai operating time.
3.5.4 Pembuatan Kurva Kalibrasi Asam Galat
20 μg/ml, 30 μg/ml, 40 μg/ml dan 50 μg/ml). Sebanyak 0,5 ml dari setiap kosentrasi larutan dalam labu tentukur 10 ml ditambahkan 7,5 ml akuades dan 0,5 ml larutan Folin-Ciocalteu, kemudian dihomogenkan dengan alat vortex selama 1 menit lalu didiamkan, selanjutnya ditambahkan 1,5 ml larutan natrium karbonat 20% dan didiamkan selama 90 menit, diukur absorbansinya pada panjang gelombang maksimum dan didapat kurva kalibrasi asam galat serta persamaan garis linear y = ax + b.
3.5.5 Pembuatan Larutan Uji Pakkat
BAB IV
HASIL DAN PEMBAHASAN
4.1 Identifikasi Tumbuhan
Hasil identifikasi tumbuhan menunjukkan bahwa tumbuhan yang diuji adalah pakkat (Calamus caesius Blume.) famili Arecaceae, yang dilakukan oleh Herbarium Medanense Universitas Sumatera Utara, Medan. Hasil identifikasi dapat dilihat pada Lampiran 1, halaman 36.
4.2 Hasil Analisis Aktivitas Antioksidan Pakkat Metode DPPH
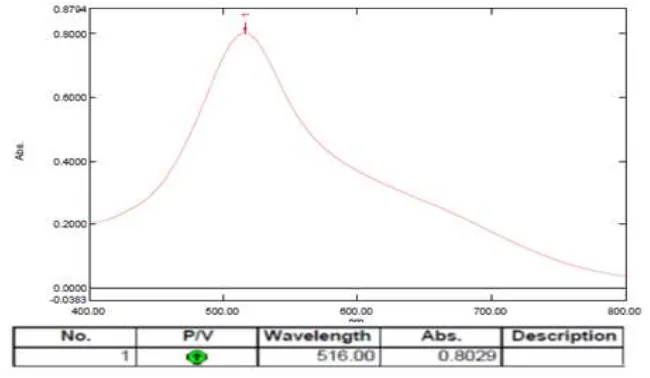
Hasil uji aktivitas antioksidan Pakkat dengan metode pemerangkapan 1,1-diphenyl-2-picrylhidrazyl (DPPH) secara spektrofotometri UV-Vis dilakukan pengukuran pada panjang gelombang 516 nm. Larutan DPPH dalam metanol menghasilkan serapan maksimum pada panjang gelombang 516 nm, termasuk dalam kisaran panjang gelombang sinar tampak (400-800 nm) (Gandjar dan Rohman, 2007).
4.2.1 Hasil Penentuan Panjang Gelombang Serapan Maksimum
Pengukuran serapan maksimum larutan DPPH dengan konsentrasi 40 µg/ml dalam metanol menggunakan spektrofotometri UV-Visibel. Kurva
serapan panjang gelombang maksimum dapat dilihat pada Gambar 4.1.
tampak 400-800 nm, serta termasuk dalam rentang panjang gelombang DPPH yang berkisar antara 515-520 nm (Gandjar dan Rohman, 2007; Molyneux, 2004).
Gambar 4.1 Kurva serapan larutan DPPH (40 μg/ml) dalam metanol 4.2.2 Hasil Penentuan Waktu Kerja (Operating Time)
Waktu kerja bertujuan untuk mengetahui waktu pengukuran yang stabil. Ditentukan dengan mengukur hubungan antara waktu pengukuran dengan absorbansi larutan (Gandjar dan Rohman, 2007). Hasil analisis pengukuran waktu kerja (operating time) dengan menggunakan larutan DPPH 0,5 mM dalam metanol dengan konsentrasi 40 μg/ml diukur selama 80 menit, sudah menunjukkan kestabilan pada menit ke 59 sampai dengan menit ke 62. Lama pengukuran metode DPPH menurut beberapa literatur yang direkomendasikan adalah selama 60 menit, tetapi dalam beberapa penelitian waktu yang digunakan sangat bervariasi dari 1 menit hingga 240 menit (Marinova dan Batchvarov, 2011).
4.2.3 Hasil Analisis Aktivitas Antioksidan Pakkat
penambahan larutan uji dengan konsentrasi 1000 μg/ml; 2000 μg/ml; 3000 μg/ml dan 4000 μg/ml yang dibandingkan dengan kontrol DPPH tanpa
larutan uji. Persen pemerangkapan DPPH oleh pakkat segar, pakkat rebus dan pakkat bakar serta persen pemerangkapan DPPH oleh vitamin C dapat dilihat pada Tabel 4.1 dan 4.2.
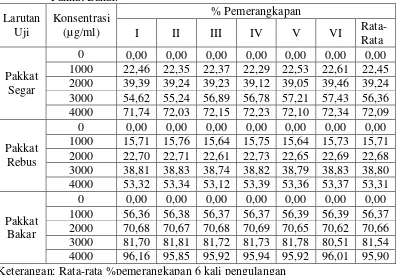
Tabel 4.1 Persen Pemerangkapan DPPH oleh Pakkat Segar, Pakkat Rebus dan Pakkat Bakar. Keterangan: Rata-rata %pemerangkapan 6 kali pengulangan
Tabel 4.2 Persen Pemerangkapan DPPH oleh Vitamin C
Keterangan: Rata-rata %pemerangkapan 6 kali pengulangan
bakar serta vitamin C sebagai pembanding dalam metanol pada setiap kenaikan konsentrasi. Persen pemerangkapan terjadi karena adanya senyawa yang bereaksi sebagai penangkap radikal yang akan mereduksi DPPH membentuk DPPH-H yang tereduksi. Reaksi ini diamati dengan adanya perubahan warna DPPH dari ungu menjadi kuning ketika elektron ganjil dari radikal DPPH telah berpasangan dengan hidrogen dari senyawa penangkap radikal bebas. Keberadaan antioksidan dalam tumbuhan akan menetralisasi radikal DPPH dengan memberikan elektron kepada DPPH, menghasilkan perubahan warna dari ungu menjadi kuning atau intensitas warna ungu larutan jadi berkurang (Molyneux, 2004). Penghilangan warna akan sebanding dengan jumlah elektron yang diambil oleh DPPH sehingga dapat diukur secara spektrofotometri (Garcia, dkk., 2012)
4.2.4 Hasil Analisis Nilai IC50 (Inhibitory Concentration)
Nilai IC50 diperoleh berdasarkan perhitungan persamaan regresi dengan cara memplot konsentrasi larutan uji dan % peredaman DPPH sebagai parameter aktivitas antioksidan, konsentrasi sampel (μg/ml) sebagai absis (sumbu X) dan nilai % inhibisi sebagai ordinat (sumbu Y). Hasil persamaan regresi linier dan hasil analisis nilai IC50 yang diperoleh dari pakkat segar, pakkat rebus, pakkat bakar, dan vitamin C dapat dilihat pada Tabel 4.3 dan kategori nilai IC50 sebagai antioksidan dapat dilihat pada Tabel 4.4.
Tabel 4.3 Hasil Persamaan Regresi Linier dan Hasil Analisis IC50 dari Pakkat Segar, Pakkat Rebus, Pakkat Bakar, dan Vitamin C
Larutan Uji Persamaan Regresi IC50 (μg/ml) Pakkat Segar Y= 0,017809x + 2,410 2672,24 Pakkat Rebus Y= 0,012972x + 2,393 3841,76 Pakkat Bakar Y= 0,021698x + 17,501 1497,74
Tabel 4.4 Kategori Nilai IC50 sebagai Antioksidan
No. Kategori Konsentrasi (µg/ml )
1. Sangat Kuat < 50
2. Kuat 50-100
3. Sedang 101-150
4. Lemah >151
Sumber: Winarsi (2014)
Hasil dari Tabel 4.3 dan 4.4 diatas diketahui bahwa pakkat segar, pakkat rebus, dan pakkat bakar menunjukkan aktivitas antioksidan kategori sangat lemah dengan nilai IC50 berturut-turut sebesar 2672,24 μg/ml; 3841,76 μg/ml; dan 1497,74 μg/ml. Dibandingkan dengan vitamin C sebagai kontrol positif yang termasuk dalam kategori sangat kuat dengan nilai IC50 4,81 μg/ml. Berdasarkan data yang didapat diketahui bahwa terjadinya penurunan aktivitas antioksidan pada pakkat rebus dibandingkan dengan pakkat segar dan hal berbeda terjadi pada pakkat bakar mengalami peningkatan aktivitas antioksidan dibandingkan pakkat segar.
Penurunan aktivitas antioksidan pada pakkat rebus dibandingkan pakkat
segar kemungkinan terjadi senyawa kimia yang berpotensi sebagai antioksidan
terlarut didalam air perebusan. Hal ini seesuai dengan penelitian yang sebelumnya
menyatakan bahwa proses perebusan mengakibatkan dinding sel dan membran
plasma cepat mengalami kerusakan. Air masuk kedalam dinding sel dan vakuola kemudian melarutkan senyawa kimia yang berpotensi sebagai antioksidan kedalam cairan pengolahan (Syaifuddin, 2015).
bentuk terikat dengan jenis-jenis gula tertentu. Selama proses pemanasan ikatan gikosidik pecah sehingga dihasilkan bentuk glikon flavonoid. glikon ini aktivitasnya antioksidannya lebih tinggi daripada yang dalam bentuk terikat dengan gula.
Penetapan kadar air pada pakkat segar, rebus dan bakar yang telah dilakukan oleh Lubis (2015), diperoleh masing-masing sebesar 88,68%, 90,66%, dan 88,25% serta persen rendemen bahan basah menjadi bahan kering masing-masing perlakuan sebesar 11,35%, 11,74%, dan 9,33%. Pakkat segar, pakkat rebus dan pakkat bakar sejumlah 5 gram akan menghasilkan bahan kering masing-masing 0,567 g, 0,587 g, dan 0,466 g, sehingga nilai IC50 yang dihasilkan dari bahan kering akan lebih kuat jika dibandingkan bahan basah (segar) dengan perlakuan yang sama.
Penelitian yang telah dilakukan Aisyah dkk., (2015), aktivitas antioksidan bahkan menjadi lebih kuat setelah perlakuan panas. Hal yang sama juga telah dilakukan Turkmen dkk., (2005), menyatakan bahwa kacang polong dan brokoli setelah dimasak mempunyai jumlah aktivitas antioksidan lebih kuat atau tidak berubah (tetap) bergantung pada cara pengolahannya.
4.3 Hasil Analisis Kandungan Fenoik Total
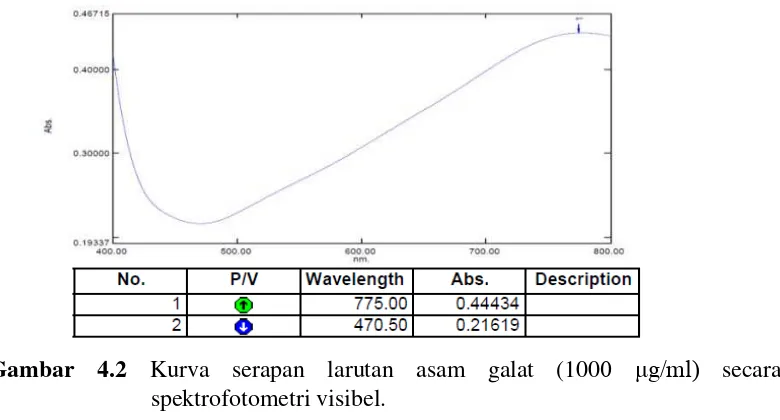
4.3.1 Hasil Penentuan Panjang Gelombang Maksimum Asam Galat
Pengukuran serapan maksimum asam galat dengan penambahan reagen Folin-Ciocalteu, natrium karbonat 20% serta akuades pada konsentrasi
Gambar 4.2 Kurva serapan larutan asam galat (1000 μg/ml) secara spektrofotometri visibel.
4.3.2 Hasil Penentuan Waktu Kerja (Operating Time)
Waktu kerja (operating time) bertujuan untuk mengetahui waktu pengukuran yang stabil. Waktu kerja ditentukan dengan mengukur hubungan antara waktu pengukuran dengan absorbansi larutan (Gandjar dan Rohman, 2007) Lama pengukuran metode Folin-Ciocalteu dilakukan setelah masing-masing sampel yang telah ditambahkan reagen lalu didiamkan selama 90 menit masa inkubasinya pada suhu ruangan (Sayuti dan Yenrina, 2015).
y = 0.00674x - 0.0016
4.3.3 Hasil Penentuan Kurva Kalibrasi Asam Galat
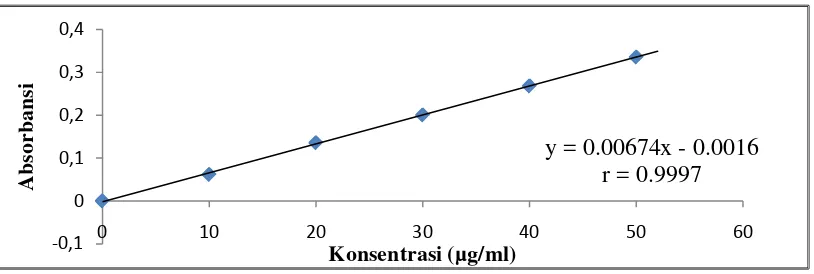
Penentuan Kurva kalibrasi asam galat dibuat dengan mengukur absorbansi larutan asam galat dengan konsentrasi 10 μg/ml, 20 μg/ml, 30 μg/ml, 40 μg/ml, dan 50 μg/ml dengan penambahan Folin-Ciocalteu, natrium karbonat 20% serta akuades pada panjang gelombang 775 nm. Nilai absorbansi standar asam galat dapat diihat pada Tabel 4.5.
Tabel 4.5 Nilai Absorbansi Standar Asam Galat Sampel Konsentrasi (µg/ml)
(x)
Absorbansi
(y) Persamaan Regresi
Asam Galat
Berdasarkan tabel tersebut diperoleh kurva kalibrasi larutan asam galat seperti ditunjukkan pada Gambar 4.3 berikut:
Gambar 4.3 Kurva Kalibrasi Larutan Standar Asam Galat
data yang sebenarnya. Berdasarkan kurva kalibrasi diatas diperoleh persamaan garis regresi y = 0.00674x - 0.0016 dengan nilai Koefisien korelasi = 0,9997. 4.3.4 Hasil Penentuan Kandungan Fenolik Total pada Pakkat
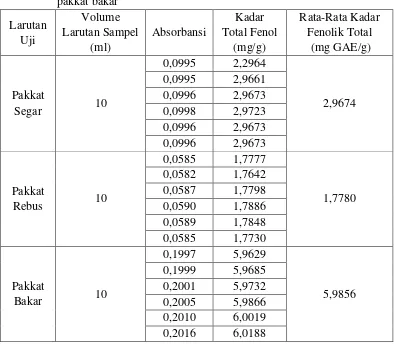
Kandungan fenolik total dilakukan dengan metode Folin-Ciocalteu. Untuk menentukan kandungan fenolik total digunakan asam galat sebagai standar. Nilai absorbansi dari pakkat segar, pakkat rebus dan pakkat bakar diplotkan terhadap kurva standar asam galat dan dihitung senyawa fenoliknya. Hasil Kandungan fenolik total dari pakkat segar, pakkat rebus dan pakkat bakar dapat dilihat pada Tabel 4.6.
Tabel 4.6 Hasil kandungan fenolik total dari pakkat segar, pakkat rebus dan pakkat bakar
Berdasarkan Tabel 4.6 dapat dillihat kadar kandungan fenolik total dari
pakkat segar, pakkat rebus dan pakkat bakar berturut-turut sebesar 2,9674 mg GAE/g; 1,7780 mg GAE/g; dan 5,9856 mg GAE/g. Berdasarkan data
yang didapat diketahui bahwa terjadi penurunan kadar fenolik total pada pakkat rebus sebesar 40,07% dibandingkan dengan pakkat segar. Penurunan kadar kandungan fenolik total setelah perebusan diduga karena larutnya fenol dalam air. Senyawa fenol cenderung mudah larut dalam air karena umumnya mereka sering kali berikatan dengan gula sebagai glikosida, dan biasanya terdapat dalam vakuola sel (Harbone, 1987).
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
a. Hasil perhitungan nilai IC50 dari pakkat segar, rebus, dan bakar diperoleh dengan nilai IC50 masing-masing sebesar 2672,24 μg/ml; 3841,76 μg/ml; dan 1497,74 μg/ml menunjukkan kekuatan antioksidan dalam kategori sangat lemah.
b. Kadar fenolik total pada pakkat yang segar, rebus dan bakar masing-masing sebesar 2,9674 mg GAE/g; 1,7780 mg GAE/g; dan 5,9856 mg GAE/g dengan metode Folin-Ciocalteu.
5.2 Saran
a. Disarankan kepada masyarakat untuk mengkonsumsi pakkat bakar karena aktivitas antioksidan lebih tinggi dibandingkan dengan pakkat segar dan pakkat rebus.