PEMISAHAN GOLONGAN I A PEMISAHAN GOLONGAN I A
Analisis Kation Analisis Kation
Analisis kation memerlukan pendekatan yang sistematis. Umumnya ini dilakukan dengan dua Analisis kation memerlukan pendekatan yang sistematis. Umumnya ini dilakukan dengan dua cara yaitu pemisahan dan
cara yaitu pemisahan dan identifikasi. Pemisahan dilakukaidentifikasi. Pemisahan dilakukan dengan cara n dengan cara mengendapkmengendapkan suatuan suatu kelompok kation dari larutannya. Kelompok kation yang mengendap dipisahkan dari
kelompok kation dari larutannya. Kelompok kation yang mengendap dipisahkan dari larutan denganlarutan dengan cara sentrifus dan menuangkan filtratnya ke tabung uji yang lain.Larutan yang masih berisi
cara sentrifus dan menuangkan filtratnya ke tabung uji yang lain.Larutan yang masih berisi sebagiansebagian besar kation kemu
besar kation kemudian diendapdian diendapkan kembalkan kembali membentui membentuk kelompok kk kelompok kation baru. Jika daation baru. Jika dalam kelomplam kelompok ok kation yang terendapkan masih berisi
kation yang terendapkan masih berisi beberapa kation maka kation-kation tersebut dipisahkan lagibeberapa kation maka kation-kation tersebut dipisahkan lagi menjadi kelompok kation yang lebih kecil, demikian seterusnya sehingga pada
menjadi kelompok kation yang lebih kecil, demikian seterusnya sehingga pada akhirnya dapatakhirnya dapat dilakukan uji spesifik untuk satu kation.Jenis dan konsentrasi pereaksi serta pengaturan pH dilakukan uji spesifik untuk satu kation.Jenis dan konsentrasi pereaksi serta pengaturan pH
larutandilakukan untuk memisahkan kation menjadi beberapa kelompok.Suatu skema analisis standar larutandilakukan untuk memisahkan kation menjadi beberapa kelompok.Suatu skema analisis standar untuk mengidentifikasi 25 kation dan 13 anion yang berbeda telah disusun. Skema analisis tersebut untuk mengidentifikasi 25 kation dan 13 anion yang berbeda telah disusun. Skema analisis tersebut terus dikembangkan sehingg
terus dikembangkan sehingga sekarang orang dapat memilih skema yang sesuai a sekarang orang dapat memilih skema yang sesuai dengan kondisi yangdengan kondisi yang ada dilaboratorium masing-masing. Bahkan tidak menutup kemungkinan untuk memodifikasi dan ada dilaboratorium masing-masing. Bahkan tidak menutup kemungkinan untuk memodifikasi dan mengembang
mengembangkan sendiri skema kan sendiri skema tersebut. Tabel berikut ini tersebut. Tabel berikut ini menunjukkmenunjukkan kelompok kation danan kelompok kation dan pereaksi yang d
pereaksi yang digunakan dalam igunakan dalam analisis kualitanalisis kualitatif standar.atif standar. Tabel 4.
Tabel 4. Kelompok kation analisis kualitatif Kelompok kation analisis kualitatif Golongan
Golongan KationKation Preaksi Preaksi pengendap/ppengendap/pengisiengisi 1 1 Ag Ag++, Hg, Hg++, Pb, Pb2+2+ HCl 6 MHCl 6 M 2 2 CuCu2+2+, Cd, Cd2+2+, BI, BI3+3+, Hg, Hg2+2+,, Sn Sn4+4+, Sb, Sb3+3+ H H22S 0,1 M pada pH 0,5S 0,1 M pada pH 0,5 3 3 Al Al3+3+, Cr , Cr 3+3+, Co, Co2+2+, Fe, Fe2+2+,, Ni Ni2+2+, Mn, Mn2+2+, Zn, Zn2+2+ H H22S 0,1 M pada pH 9S 0,1 M pada pH 9 4 4 BaBa2+2+, Ca, Ca2+2+, Mg, Mg2+2+, Na, Na++,, K K++, NH, NH44
Tidak ada pereaksi Tidak ada pereaksi pengendap pengendap golongan. golongan. Golongan 1 : Ag Golongan 1 : Ag++, Hg, Hg++, Pb, Pb2+2+
Untuk memisahkan ketiga kation ini kita menambahkan HCl 6 M pada Untuk memisahkan ketiga kation ini kita menambahkan HCl 6 M pada sampel uji. Kation golongan 1 akan mengendap sebagai garam klorida sampel uji. Kation golongan 1 akan mengendap sebagai garam klorida yang berwarna putih. Reaksi yang terjadi:
yang berwarna putih. Reaksi yang terjadi: Ag Ag+++ Cl+ Cl-- AgClAgCl 2Hg 2Hg+++ 2Cl+ 2Cl-- HgHg22ClCl22 Pb Pb2+2++ 2Cl+ 2Cl-- PbClPbCl22 Endapan PbCl
Endapan PbCl22akan larut dengan kenaikan suhu. Karena itu PbClakan larut dengan kenaikan suhu. Karena itu PbCl22dapatdapat
dipisahkan dari kedua kation yang lain dengan menambahkan air panas dipisahkan dari kedua kation yang lain dengan menambahkan air panas kemudian mensentrifus dan memisahkanny
kemudian mensentrifus dan memisahkannya dari a dari larutan. Adanya Pblarutan. Adanya Pb2+2+
dapat diidentifikasi dengan penambahan K
dapat diidentifikasi dengan penambahan K 22CrOCrO44membentuk endapanmembentuk endapan
kuning atau dengan H
kuning atau dengan H22SOSO44membentuk endapan putih.membentuk endapan putih.
Pb
Pb2+2++ CrO+ CrO4 4 2+2+ PbCrOPbCrO4 4 2-
2-Pb
Pb2+2++ SO+ SO4 4 2+2+ PbSOPbSO44
Hg
Hg1+1+dan Agdan Ag++dapat dipisahkan dengan penambahan NHdapat dipisahkan dengan penambahan NH33. Jika ada Hg. Jika ada Hg22ClCl22
maka dengan NH
maka dengan NH33akan bereaksi:akan bereaksi:
Hg
Hg22ClCl22+ 2NH+ 2NH33 HgNHHgNH22Cl + Hg + NHCl + Hg + NH44ClCl
Putih hitam
Endapan yang teramati menjadi berwarna abu-abu.Sedangkan penambahan amonia terhadap Ag Endapan yang teramati menjadi berwarna abu-abu.Sedangkan penambahan amonia terhadap Ag++
menyebabkan endapan AgCl larut kembali karena terjadi pembentukan kompleks Ag(NH
menyebabkan endapan AgCl larut kembali karena terjadi pembentukan kompleks Ag(NH33))2+2+yangyang
stabil.AgCl + 2NH
stabil.AgCl + 2NH3 3 33))2+2++ Cl+ Cl--Adanya AgAdanya Ag++dapat diuji dengan menambahkan asam kuatdapat diuji dengan menambahkan asam kuat
HNO
HNO336 M. Ion H6 M. Ion H++akan mendekomposisi kompleks Ag(NHakan mendekomposisi kompleks Ag(NH33))2+2+sehingga Ag+ akan bebas dansehingga Ag+ akan bebas dan
bereaksi dengan Cl
bereaksi dengan Cl--yang sudah ada membentuk endapan AgClyang sudah ada membentuk endapan AgCl
kembali. kembali. Ag(NH
Ag(NH33))2+2++ 2H+ 2H+++ Cl+ Cl--AgCl + 2NHAgCl + 2NH4+4+
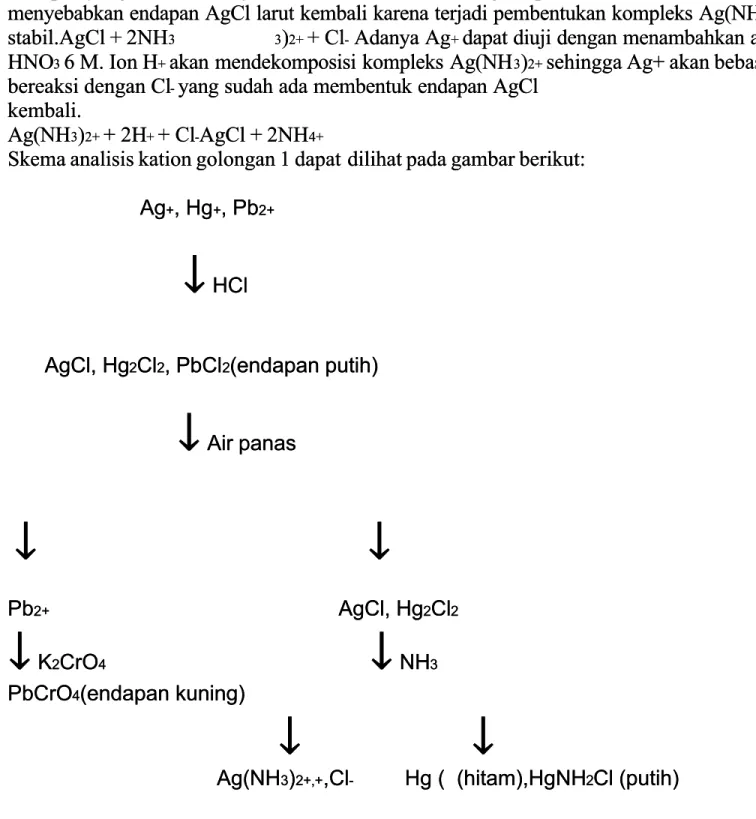
Skema analisis kation golongan 1 dapat
Skema analisis kation golongan 1 dapat dilihat pada gambar berikut:dilihat pada gambar berikut:
Ag
Ag++, Hg, Hg++, Pb, Pb2+2+
↓
↓
HClHCl AgCl, HgAgCl, Hg22ClCl22, PbCl, PbCl22(endapan putih)(endapan putih)
↓
↓
Air panasAir panas↓
↓
↓
↓
Pb Pb2+2+ AgCl, Hg AgCl, Hg22ClCl22↓
↓
KK22CrOCrO44↓
↓
NHNH33 PbCrOPbCrO44(endapan kuning)(endapan kuning)
↓
↓
↓
↓
Ag(NH
Ag(NH33))2+,+2+,+,Cl,Cl-- Hg Hg ( ( (hitam),HgNH(hitam),HgNH22Cl (putih)Cl (putih)
Gambar 2. Skema analisis kation golongan 1 Gambar 2. Skema analisis kation golongan 1
Kation golongan 2: Cu
Kation golongan 2: Cu2+2+, Cd, Cd2+2+, BI, BI3+3+, Hg, Hg2+2+, As, As3+3+, Sn, Sn4+4+, Sb, Sb3+3+
Kation golongan 2, 3,4, dan 5
Kation golongan 2, 3,4, dan 5 tidak membentuk endapan klorida. Dengatidak membentuk endapan klorida. Dengan demikian kation tersebutn demikian kation tersebut tetap ada dalam filtrat larutan setelah penambahan HCl 6M. Untuk memisahkan kation golongan 2 tetap ada dalam filtrat larutan setelah penambahan HCl 6M. Untuk memisahkan kation golongan 2 dengan kelompok kation 22 lainnya maka kation gol 2 diendapkan sebagai garam sulfida dengan dengan kelompok kation 22 lainnya maka kation gol 2 diendapkan sebagai garam sulfida dengan konsentrasi ion H
konsentrasi ion H++dibuat menjadi sekitar 0,3 M (pH=0,5). Kondisi pH dibuat menjadi sekitar 0,3 M (pH=0,5). Kondisi pH ini penting karena jikaini penting karena jika
konsentrasi asam terlalu tinggi maka
konsentrasi asam terlalu tinggi maka tembaga,tembaga, kadmium, kobalt dan timbal tidak akan
kadmium, kobalt dan timbal tidak akan sempurna pengendapannsempurna pengendapannya, sebaliknya jika keasaman terlya, sebaliknya jika keasaman terlalualu rendah maka sulfida
rendah maka sulfida dari golongan 3 dapat dari golongan 3 dapat ikut terendapkan.Larutan kemudian dijenuhikut terendapkan.Larutan kemudian dijenuhkan dengankan dengan sulfida. Ion sulfida terbentuk dari ionisasi asam
sulfida. Ion sulfida terbentuk dari ionisasi asam lemah Hlemah H22S yang berasal dari gas HS yang berasal dari gas H22S yang dilarutkanS yang dilarutkan
dalam air atau
Penambahan hidrogen peroksida dapat dilakukan untuk mengoksidasi Sn
Penambahan hidrogen peroksida dapat dilakukan untuk mengoksidasi Sn2+2+menjadi Snmenjadi Sn4+4+sehinggasehingga
endapan SnS yang agak gelatin menjadi SnS
endapan SnS yang agak gelatin menjadi SnS22.. Reaksi yang terjadi Reaksi yang terjadi diantaranydiantaranya:a:
Cu
Cu2+2++S+S2-2-
→
→
2CuS (endapan hitam)2CuS (endapan hitam)Endapan kation lainnya adalah CdS(kuning), Bi
Endapan kation lainnya adalah CdS(kuning), Bi22SS33(hitam), SnS(hitam), SnS22(kuning),dan Sb(kuning),dan Sb22SS33(jingga). PbCl(jingga). PbCl22
mempunyai Ksp yang cukup tinggi sehingga agak mudah larut dalam larutan asam klorida encer, mempunyai Ksp yang cukup tinggi sehingga agak mudah larut dalam larutan asam klorida encer, karena itu dalam kation golongan 2 ini kemungkinan kation Pb masih ditemukan.Pemisahan kation karena itu dalam kation golongan 2 ini kemungkinan kation Pb masih ditemukan.Pemisahan kation gol 2 menjadi: sub gol tembaga dan arsen.Kation gol 2 dibagi menjadi dua sub golongan yaitu gol 2 menjadi: sub gol tembaga dan arsen.Kation gol 2 dibagi menjadi dua sub golongan yaitu sub-gol tembaga dan arsen.pembagian ke dua sub-sub-gol ini
gol tembaga dan arsen.pembagian ke dua sub-gol ini berdasarkan kelarutan endapan garam sulfidaberdasarkan kelarutan endapan garam sulfida dan amonium polisulfida. Sulfida dari sub-gol tembaga yaitu PbS, CuS, CdS, HgS dan
dan amonium polisulfida. Sulfida dari sub-gol tembaga yaitu PbS, CuS, CdS, HgS dan BiBi22SS33tidak tidak
larut dalam pereaksi ini, sedangkan sulfida dari sub
larut dalam pereaksi ini, sedangkan sulfida dari sub gol arsen yaitu Asgol arsen yaitu As22SS33, As, As22SS55, SnS, SnS22dan Sbdan Sb22SbSb33
akan larut membentuk garam tio. Reaksi yang terjadi: akan larut membentuk garam tio. Reaksi yang terjadi:
As
As22SS55+ 3S+ 3S2-2-
→
→
2AsS2AsS4 3-4 3-(tioarsenit)(tioarsenit)As
As22SS33+ 3S2-+ 3S2-
→
→
2AsS2AsS 3-3-(tioarsenat)(tioarsenat)Sb Sb22SS33+ 3S2-+ 3S2-
→
→
2SbS2SbS3 3-3 3-(tioantimonat)(tioantimonat) Sb Sb22SbSb55+ 3S+ 3S2-2-→
→
2SbS2SbS4 3-4 3-→
→
(tioantimonit)(tioantimonit) SnS + S SnS + S2-2-→
→
SnSSnS32-32-(tiostanat)(tiostanat) Amonium sulfida (NHAmonium sulfida (NH44))22S tidak dapat melarutkan SnS, karena itu S tidak dapat melarutkan SnS, karena itu SnS haru dioksidasi telebihSnS haru dioksidasi telebih
dahulu. Hal ini dapat dilakuka dengan penambahan hidrogen peroksida sebelum pengendapan sulfida dahulu. Hal ini dapat dilakuka dengan penambahan hidrogen peroksida sebelum pengendapan sulfida atau mengganti amonium sulfida dengan amonium polisulfida(NH
atau mengganti amonium sulfida dengan amonium polisulfida(NH44))22SS22) yang dapat mengoksidasi) yang dapat mengoksidasi
kation tersebut. kation tersebut.
●
● Pemisahan dan identifikasi HgPemisahan dan identifikasi Hg
Sulfida dari tembaga, kadmium, bismut, dan
Sulfida dari tembaga, kadmium, bismut, dan timbal larut dalam asam timbal larut dalam asam nitrat,sedangnitrat,sedangkankan
merkuri tidak. Berdasarkan hal tersebut, maka merkuri dapat dipisahkan dari kation lainnya yang ada merkuri tidak. Berdasarkan hal tersebut, maka merkuri dapat dipisahkan dari kation lainnya yang ada dalam sub gol tembaga. Sulfida tembaga, kadmium, bismut dan timbal latut dengan asam nitrat dalam sub gol tembaga. Sulfida tembaga, kadmium, bismut dan timbal latut dengan asam nitrat berdasarkan reaksi b
berdasarkan reaksi berikut;erikut;
3CuS + 2NO
3CuS + 2NO3 -3 -+ 8H+ 8H++
→
→
3Cu3Cu2+2++ 3S + 2NO + 4H+ 3S + 2NO + 4H22OOEndapan HgS berwarna hitam, bila ada warna
Endapan HgS berwarna hitam, bila ada warna lain misalnya putih atau kuning maka perlu dilakukanlain misalnya putih atau kuning maka perlu dilakukan uji kemungkinan adanya Hg. HgS dapat larut dengan aqua regia (campuran HCl:HNO
uji kemungkinan adanya Hg. HgS dapat larut dengan aqua regia (campuran HCl:HNO33=3:1). Reaksi=3:1). Reaksi
yang terjadi: yang terjadi: 3HgS + 2NO
3HgS + 2NO3-3-+ 8H+ 8H+++ 12Cl+ 12Cl--
→
→
3HgCl3HgCl4 2-4 2-+ 2NO + H+ 2NO + H22O + 3SO + 3SIon HgCl
Ion HgCl4 2-4 2-akan segera terdisosiasi menjadi ion Hgakan segera terdisosiasi menjadi ion Hg2+2+dan Cldan Cl--yang tidak yang tidak
berwarna. Ion Hg2
berwarna. Ion Hg2+ dapat diidentifi+ dapat diidentifikasi dengan cara kasi dengan cara reduksi oleh Snreduksi oleh Sn2+2+. 2Hg. 2Hg2+2++ Sn+ Sn2+2++ 2Cl+ 2Cl
--→
→
HgHg22ClCl22(putih) + Sn(putih) + Sn4+4+jika Hgjika Hg2+2+dalam jumlah banyak dan Sndalam jumlah banyak dan Sn2+2+terus ditambahkan maka endapanterus ditambahkan maka endapanHg akan terbentuk. Hg
Hg akan terbentuk. Hg22ClCl22+ Sn+ Sn2+ 2+ 4+4++ 2Cl+ 2Cl--Karena SnKarena Sn2+2+ pereaksi ya pereaksi yangng
ditambahkan secara berlebih, maka endapan yang terbentuk akan terlihat abu abu atau hitam. Sn ditambahkan secara berlebih, maka endapan yang terbentuk akan terlihat abu abu atau hitam. Sn2+2+
merupakan senyawa pereduksi yang kuat, tetapi kemampun ini akan hilang jika terdapat ion Cl merupakan senyawa pereduksi yang kuat, tetapi kemampun ini akan hilang jika terdapat ion Cl
--karena Cl
●
● Pemisahan dan identifikasPemisahan dan identifikasi Pb dari i Pb dari Bi, Cu, dan Bi, Cu, dan CdCd
PbSO
PbSO44sangat tidak larut dalam air, sedangkan sulfat dari Bi, Cu dan Cd sangat tidak larut dalam air, sedangkan sulfat dari Bi, Cu dan Cd sebaliknysebaliknya, mudaha, mudah
larut. Hal ini menjadi dasar
larut. Hal ini menjadi dasar pemisahan Pb dengan ketiga kation tersebut.pemisahan Pb dengan ketiga kation tersebut.
Pb
Pb2+2++ SO+ SO4 2-4 2-
→
→
PbSOPbSO44(putih)(putih)Identifikasi lebih lanjut dapat dilakukan dengan melarutkan endapan dengan amonium asetat Identifikasi lebih lanjut dapat dilakukan dengan melarutkan endapan dengan amonium asetat membentuk kompleks Pb-asetat dengan reaksi:
membentuk kompleks Pb-asetat dengan reaksi:
PbSO
PbSO44+ 4C+ 4C22HH33OO2-2-
→
→
Pb(CPb(C22HH33OO22))44 2-2-+ SO+ SO44 2-2-Kemudian dengan penambahan K
Kemudian dengan penambahan K 22CrOCrO44akan terbentuk endapan PbCrOakan terbentuk endapan PbCrO44yang berwarna kuning.yang berwarna kuning.
Kation Pb sebagaian besar
Kation Pb sebagaian besar sudah diendapkansudah diendapkan dalam kelompok kation gol 1 sehingga uji pada gol 2dalam kelompok kation gol 1 sehingga uji pada gol 2 ini tidak akan begitu
ini tidak akan begitu seperti yang terlihat pada uji kation lainnya.seperti yang terlihat pada uji kation lainnya.
●
● Pemisahan dan identifikasPemisahan dan identifikasi Bi i Bi dari Cu dan Cddari Cu dan Cd
Penambahan NH
Penambahan NH44OH pada larutan yang mengandung kation Bi,Cu dan Cd pada awalnya akanOH pada larutan yang mengandung kation Bi,Cu dan Cd pada awalnya akan
mengendapk
mengendapkan ketiga an ketiga hidroksida kation tersebut.hidroksida kation tersebut. Cu
Cu2+2++ 2NH+ 2NH44 22(biru) + 2NH(biru) + 2NH4+4+
Tetapi jika pereaksi
Tetapi jika pereaksi diberikan secara berlebih, hidroksida Cu diberikan secara berlebih, hidroksida Cu akan larut membentuk kompleksakan larut membentuk kompleks Cu(NH
Cu(NH33))44 2+2+.. Warna larutan akan berubah dari warna biru Warna larutan akan berubah dari warna biru muda menjadi biru gelap.muda menjadi biru gelap.
Cu(OH)
Cu(OH)22+ 4NH+ 4NH44OHOH
→
→
Cu(NHCu(NH33))4 2+4 2++ 2OH+ 2OH--+ 4H+ 4H22OODemikian juga dengan hidroksida kadmium, Cd(OH)
Demikian juga dengan hidroksida kadmium, Cd(OH)22(putih) akan larut dalam pereaksi (putih) akan larut dalam pereaksi berlebihberlebih
membentuk kompleks Cd(NH
membentuk kompleks Cd(NH33))44 2+2+. Tetapi . Tetapi tidak demikian dengan hidroksida bhismut, Bi(OH)tidak demikian dengan hidroksida bhismut, Bi(OH)33,,
tidak akan larut dalam pereaksi berlebih. Karena itu
tidak akan larut dalam pereaksi berlebih. Karena itu adanya endapan putih menunjukkan adanyaadanya endapan putih menunjukkan adanya kation Bi. Identifikasi lebih
kation Bi. Identifikasi lebih lanjut dapat dilakukan dengan mereduksi Bi(OH)lanjut dapat dilakukan dengan mereduksi Bi(OH)33menjadi logam Bimenjadi logam Bi
yang merupakan endapan berwarna hitam. yang merupakan endapan berwarna hitam. 2Bi(OH)
2Bi(OH)33+ 3 Sn(OH)+ 3 Sn(OH)4 2-4 2-2Bi + 3Sn(OH)2Bi + 3Sn(OH)6 2-6
2-Sn(OH)
Sn(OH)4 24 2- diperoleh dari SnCl- diperoleh dari SnCl22sebagai pereaksi yang ditambahkan bersama dengan NaOH sebagai pereaksi yang ditambahkan bersama dengan NaOH berlebihberlebih
yang telah ditambahkan sebelumnya. yang telah ditambahkan sebelumnya.
Sn
Sn2+2++ 2OH+ 2OH--
→
→
Sn(OH)Sn(OH)22Sn(OH)
Sn(OH)22+ 2OH+ 2OH--
→
→
Sn(OH)Sn(OH)4 2-42-●
● Identifikasi Cu dan CdIdentifikasi Cu dan Cd
Cu dapat diidentifikasi secara visual lewat warna larutan yang berwarna biru
Cu dapat diidentifikasi secara visual lewat warna larutan yang berwarna biru (jika konsentrasi Cu(jika konsentrasi Cu dalam larutan 1 bag per
dalam larutan 1 bag per 25000 air). Jika larutan tidak berwarna 25000 air). Jika larutan tidak berwarna maka sebaiknymaka sebaiknya tetap a tetap dilakukan ujidilakukan uji Cu dengan penambahan Fe(CN)
Cu dengan penambahan Fe(CN)66 3-3-yang dengan Cu akan membentuk endapan warna merah dariyang dengan Cu akan membentuk endapan warna merah dari
kompleks [Cu
kompleks [Cu22Fe(CN)Fe(CN)66]. Pereaksi ini dapat mengidentifikasi Cu sampai]. Pereaksi ini dapat mengidentifikasi Cu sampai
konsentrasi 1 ppm.Jika Cu tidak ada,
konsentrasi 1 ppm.Jika Cu tidak ada, maka pada larutan yang tidak berwarna dapat langsungmaka pada larutan yang tidak berwarna dapat langsung ditambahkan amoni
ditambahkan amonium sulfida. Jika terbentuk endapan kuning,CdS, maka Cd ada. um sulfida. Jika terbentuk endapan kuning,CdS, maka Cd ada. Tetapi jika CuTetapi jika Cu ada, maka untuk mengidentifikasi Cd dilakukan dengan membentuk Cu dan Cd menjadi kompleks ada, maka untuk mengidentifikasi Cd dilakukan dengan membentuk Cu dan Cd menjadi kompleks Cu(CN)
Cu(CN)44 2-2-dan Cd(CN)dan Cd(CN)44 2-2-..
Reaksi yang terjadi: Reaksi yang terjadi:
2Cu(NH
2Cu(NH33))4 2+4 2++ 5CN + H+ 5CN + H22OO
→
→
2Cu(CN)2Cu(CN)44Kompleks Cu(CN)
Kompleks Cu(CN)4 2-4 2-sangat stabil dibandingkan kompleks Cd(CN)sangat stabil dibandingkan kompleks Cd(CN)4 2-4 2-,,
sehingga komplek Cd dapat terdisosiasi : sehingga komplek Cd dapat terdisosiasi :
Cd(CN)
Cd(CN)4 2-4 2-++
→
→
CdCd2+2++ 4CN+ 4CN--Kation Cd yang dihasilkan cukup untuk membentuk endapan sulfidaKation Cd yang dihasilkan cukup untuk membentuk endapan sulfidadengan
dengan penambahan penambahan amonium sulfamonium sulfida menghasilkida menghasilkan sulfida kadmium yan sulfida kadmium yangang berwarna kuning berwarna kuning..
●
● Kation golongan 3: AlKation golongan 3: Al3+3+, Cr , Cr 3+3+, Co, Co2+2+, Fe, Fe2+2+, Ni, Ni2+2+, Mn, Mn2+2+, Zn, Zn2+2+
Kation golongan 3 membentuk sulfida yang lebih larut dibandingkan kation golongan.Karena itu Kation golongan 3 membentuk sulfida yang lebih larut dibandingkan kation golongan.Karena itu untuk mengendapkan kation golongan 3 sebagai garam
untuk mengendapkan kation golongan 3 sebagai garam sulfida konsentrasi ion Hsulfida konsentrasi ion H++dikurangi menjadidikurangi menjadi
sekitar 10
sekitar 10-9-9M atau pH 9. M atau pH 9. Hal ini dapat dilakukan dengan penambahan amonium hidroksida danHal ini dapat dilakukan dengan penambahan amonium hidroksida dan
amonium klorida. Kemudian dijenuhkan dengan H
amonium klorida. Kemudian dijenuhkan dengan H22S. Dalam kondisi ini kesetimbangan:S. Dalam kondisi ini kesetimbangan:
H
H22SS→→2H2H+++ S+ S2-2-akan bergeser ke kanan. Dengan demikian konsentrasi Sakan bergeser ke kanan. Dengan demikian konsentrasi S2-2-akan meningkatakan meningkat
dan cukup untuk mengendapkan kation golongan 3.
dan cukup untuk mengendapkan kation golongan 3. HH22S dapat juga diganti dengan (NHS dapat juga diganti dengan (NH44))22S.S.
Penambahan amonium hidroksida dan amonium klorida juga dapat Penambahan amonium hidroksida dan amonium klorida juga dapat
mencegah kemungkinan mengendapnya Mg menjadi Mg(OH)2. Penambahan kedua pereaksi ini mencegah kemungkinan mengendapnya Mg menjadi Mg(OH)2. Penambahan kedua pereaksi ini menyebabkan mengendapnya kation Al
menyebabkan mengendapnya kation Al3+3+, Fe, Fe3+3+dan Cr dan Cr 3+3+sebagai hidroksidanya, Fe(OH)sebagai hidroksidanya, Fe(OH)33(merah),(merah),
Al(OH)
Al(OH)33(putih) dan Cr(OH)(putih) dan Cr(OH)33(putih). Hidroksida kation yang lain pada awalnya juga akan(putih). Hidroksida kation yang lain pada awalnya juga akan
mengendap tetapi penambahan amonium hidroksida berlebih menyebabkan hidroksida kation-kation mengendap tetapi penambahan amonium hidroksida berlebih menyebabkan hidroksida kation-kation tersebut menjadi kompleks Zn(NH
tersebut menjadi kompleks Zn(NH33))44 2+
2+, Ni(NH, Ni(NH33))6 2+6 2+,, Co(NHCo(NH33))6 2+6 2+yang larut. Ion sulfida dapat yang larut. Ion sulfida dapat bereaksi dengan Zn(NHbereaksi dengan Zn(NH33))4 2+4 2+,,
Ni(NH
Ni(NH33))6 2+6 2+, Co(NH, Co(NH33))6 2+6 2+membentumembentuk endapan sulfida k endapan sulfida CoS (hitam),CoS (hitam), NiS(hitam), dan NiS(hitam), dan ZnS (putih)ZnS (putih)
dengan reaksi seperti
dengan reaksi seperti berikut:berikut: Ni(NH Ni(NH33))6 2+6 2++ S+ S2-2-
→
→
2NiS + NH2NiS + NH33Sedangkan MnSedangkan Mn2+2+dan Fedan Fe2+2+akanakanbereaksi langsun
bereaksi langsung membentug membentuk endapank endapan sulfida FeS (hitam) dan sulfida FeS (hitam) dan MnS(coklat).MnS(coklat).
●
● Pemisahan Sub golongan Aluminium dan NikelPemisahan Sub golongan Aluminium dan Nikel
Hidroksida aluminium
Hidroksida aluminium, kromium dan , kromium dan seng bersifat amfoter sehingga larut seng bersifat amfoter sehingga larut dengan NaOH. Sebaliknyadengan NaOH. Sebaliknya hidroksida besi, mangan, kobalt dan nikel tidak bersifat
hidroksida besi, mangan, kobalt dan nikel tidak bersifat amfoter sehingga kation tersebut tidak larutamfoter sehingga kation tersebut tidak larut dengan NaOH. Hal ini yang mendasari pemisahan kedua subgolongan dalam kation golongan 3. dengan NaOH. Hal ini yang mendasari pemisahan kedua subgolongan dalam kation golongan 3. Endapan kation golongan 3 larut dengan HCl, kecuali NiS dan CoS yang agak sullit, keduanya dapat Endapan kation golongan 3 larut dengan HCl, kecuali NiS dan CoS yang agak sullit, keduanya dapat larut cepat dengan aqua regia (HCl dan HNO
larut cepat dengan aqua regia (HCl dan HNO33). Aqua regia juga akan mengoksidasi Fe). Aqua regia juga akan mengoksidasi Fe2+2+menjadimenjadi
Fe
Fe3+3+.Jika NaOH ditambahkan maka hidroksida ke tujuh kation tersebut akan terbentuk, tetapi.Jika NaOH ditambahkan maka hidroksida ke tujuh kation tersebut akan terbentuk, tetapi
aluminium, kromium dan seng yang bersifat
aluminium, kromium dan seng yang bersifat amfoter akan larut amfoter akan larut membentuk komplekmembentuk kompleks Al(OH)s Al(OH)44 --,,
Cr(OH)
Cr(OH)44 --, Zn(OH), Zn(OH)4-4-, sedangkan kation yang lain tidak larut. , sedangkan kation yang lain tidak larut. Mn(OH)Mn(OH)22dan Co(OH)dan Co(OH)22akan teroksidasiakan teroksidasi
oleh udara menjadi MnO
oleh udara menjadi MnO22dan Co(OH)dan Co(OH)33yang berwarna hitam. Penambahan hidrogen peroksidayang berwarna hitam. Penambahan hidrogen peroksida
mempercepat oksidasi kedua zat tersebut,
mempercepat oksidasi kedua zat tersebut, juga mengoksidasi Cr(OH)juga mengoksidasi Cr(OH)4-4-menjadi CrOmenjadi CrO42-42-..
Hidroksida besi dan nikel cepat larut dalam asam
Hidroksida besi dan nikel cepat larut dalam asam sulfat menjadi Fesulfat menjadi Fe2+2+danNidanNi22+, tetapi MnO+, tetapi MnO22
dan Co(OH)
dan Co(OH)33lambat larut. Hidrogen lambat larut. Hidrogen peroksida ditambahkan untuk mempercepat kelarutan endapanperoksida ditambahkan untuk mempercepat kelarutan endapan
ini dengan cara mereduksinya menjadi MnO dan Co(OH)
ini dengan cara mereduksinya menjadi MnO dan Co(OH)22. Reaksi yang berlangsung:. Reaksi yang berlangsung:
MnO
MnO22+ H+ H22OO22
→
→
MnO + HMnO + H22O + OO + O222Co(OH)
2Co(OH)33+ H+ H22OO22
→
→
2Co(OH)2Co(OH)22+ 2H+ 2H22O + OO + O22MnO + 2H
Co(OH)
Co(OH)22+ 2H++ 2H+
→
→
CoCo2+2++ 2H+ 2H22OO●
● Identifikasi besiIdentifikasi besi
Identifikasi besi dapat dilakukan dengan beberapa cara
Identifikasi besi dapat dilakukan dengan beberapa cara diantaranydiantaranya:a: 1. Kaliumheksasianoferat(II), K
1. Kaliumheksasianoferat(II), K 44Fe(CN)Fe(CN)66Membentuk endapan biru PrussianMembentuk endapan biru Prussian
4Fe
4Fe3+3++ 3Fe(CN)+ 3Fe(CN)64-64-
→
→
FeFe44[Fe(CN)[Fe(CN)66]]332. Kalium tiosianat, KSCN 2. Kalium tiosianat, KSCN Larutan berwarna merah Larutan berwarna merah
Fe
Fe3+3++ SCN+ SCN--
→
→
Fe(SCN)Fe(SCN)63-63-●
● Identifikasi kobaltIdentifikasi kobalt
Identifikasi kobalt dapat dilakukan dengan pereaksi yang sama dengan besi yaitu KSCN dalam Identifikasi kobalt dapat dilakukan dengan pereaksi yang sama dengan besi yaitu KSCN dalam alkohol memberikan warna larutan biru.
alkohol memberikan warna larutan biru. Kompleks besi dengan tiosianat merupakan kompleks yangKompleks besi dengan tiosianat merupakan kompleks yang stabil sedangkan kompleks Co dengan tiosiant merupakan kompleks yang kurang stabil sehingga stabil sedangkan kompleks Co dengan tiosiant merupakan kompleks yang kurang stabil sehingga untuk penentuan besi dengan adanya Co tidak akan mengganggu. Tetapi untuk identifikasi Co harus untuk penentuan besi dengan adanya Co tidak akan mengganggu. Tetapi untuk identifikasi Co harus ditambahkan NaF untuk mengkompleks Fe menjadi FeF
ditambahkan NaF untuk mengkompleks Fe menjadi FeF63-63-yang tidak berwarna sehingga tidak yang tidak berwarna sehingga tidak
menggangg
mengganggu kompleks Co u kompleks Co tiosianat. Kompleks Co tiosianat ini tiosianat. Kompleks Co tiosianat ini akan lebih stabil dalam akan lebih stabil dalam alkohol.alkohol.
Co
Co2+2++ 4SCN+ 4SCN
→
→
Co(SCN)Co(SCN)42-42-●
● Identifikasi NiIdentifikasi Ni
Buat larutan menjadi basa
Buat larutan menjadi basa dengan penambahan NHdengan penambahan NH33. Jika pada penambahan ini terbentuk endapan. Jika pada penambahan ini terbentuk endapan
hidroksida besi dan mangan, sentrifus dan dekantasi. Pada filtrat
hidroksida besi dan mangan, sentrifus dan dekantasi. Pada filtrat yang tidak berwarna ditambahkanyang tidak berwarna ditambahkan dimetil glioksim. Endapan merah dari NiC
dimetil glioksim. Endapan merah dari NiC88HH1414 N N44OO44(Ni-dimetil glioksim) menunjukkan adanya Ni.(Ni-dimetil glioksim) menunjukkan adanya Ni.
(CH
(CH33)C)C22(NOH)(NOH)22+ Ni(NH+ Ni(NH33))62+62+
→
→
2NH2NH4+4++ NiC+ NiC88HH1414 N N44OO44+ 4NH+ 4NH33●
● Identifikasi MnIdentifikasi Mn
Mangan dapat diidentifikasi dengan mengoksidasi Mn
Mangan dapat diidentifikasi dengan mengoksidasi Mn2+2+menjadi MnOmenjadi MnO4-4-yang berwarna ungu denganyang berwarna ungu dengan
natrium bismutat (NaBiO
natrium bismutat (NaBiO33) dalam asam nitrat.) dalam asam nitrat.
2Mn
2Mn2+2++ 5HBiO+ 5HBiO33+ 9H+ 9H++
→
→
2MnO2MnO4-4-+ 5Bi+ 5Bi3+3++ 7H+ 7H22OO●
● Pemisahan dan Identifikasi Sub golongan Al Pada filtrat hasil pemisahan dengan subPemisahan dan Identifikasi Sub golongan Al Pada filtrat hasil pemisahan dengan sub
golongan besi, penambahan asamnitrat akan memberikan reaksi
golongan besi, penambahan asamnitrat akan memberikan reaksi berikut:berikut:
Al(OH)
Al(OH)4-4-+ 4H+ 4H++
→
→
AlAl3+3++ 4 H+ 4 H22OZn(OH)OZn(OH)4-4-+ 4H+ 4H++→
→
ZnZn2+2++ 4H+ 4H22OO 2CrO2CrO4 2-4 2-+ 2H+ 2H++→
→
Cr Cr 22O7O72-2-+ H+ H22OOJika terdapat kromat warna
Jika terdapat kromat warna larutan berubah menjadi jingga dengan terbentuknya dikromat.larutan berubah menjadi jingga dengan terbentuknya dikromat.
Penambahan amonium hidroksida lebih lanjut akan membentuk endapan putih yang menunjukkan Penambahan amonium hidroksida lebih lanjut akan membentuk endapan putih yang menunjukkan adanya Al.
adanya Al. SedangkanCr SedangkanCr 22OO7272- dan Zn- dan Zn2+2+akan menjadi CrOakan menjadi CrO42-42-dan Zn(NH3)dan Zn(NH3)42+42+..
Identifikasi Cr Identifikasi Cr
dapat dilakukan dengan BaCl
dapat dilakukan dengan BaCl22memberikan endapan kuning barium kromat.memberikan endapan kuning barium kromat.
CrO CrO44
2-2-+ Ba+ Ba2+2+
→
→
BaCrOBaCrO44Identifikasi Zn dapat dilakukan dengan
Identifikasi Zn dapat dilakukan dengan kertas difeniltiokarbazkertas difeniltiokarbazon atau on atau kertas ditizhone memberikankertas ditizhone memberikan warna merah keunguan menunjukkan adanya Zn. Kation golongan 4: Ba
warna merah keunguan menunjukkan adanya Zn. Kation golongan 4: Ba2+2+, Ca, Ca2+2+, Mg, Mg2+2+, Na, Na++, K , K ++dandan
NH NH4+4+
●
Barium sulfat merupakan garam sulfat yang sangat tidak larut dengan air,
Barium sulfat merupakan garam sulfat yang sangat tidak larut dengan air, sedangkan kalsium agak sedangkan kalsium agak larut, dan kation logam lainnya larut dalam air.
larut, dan kation logam lainnya larut dalam air. Pemisahan barium dengan kation lainnyPemisahan barium dengan kation lainnya berdasarkana berdasarkan hal tersebut. Penambahan amonium sulfat akan
hal tersebut. Penambahan amonium sulfat akan memberikan endapan putih jika terdapat barium. memberikan endapan putih jika terdapat barium. UjiUji selanjutnya dapat dilakukan dengan uji nyala memberikan warna hijau kekuningan.
selanjutnya dapat dilakukan dengan uji nyala memberikan warna hijau kekuningan.
●
● Pemisahan dan Identifikasi CaPemisahan dan Identifikasi Ca
Pemisahan kalsium dengan kation lainnya berdasarkan kelarutan garam kalsium oksalat yang sangat Pemisahan kalsium dengan kation lainnya berdasarkan kelarutan garam kalsium oksalat yang sangat tidak larut dalam air,
tidak larut dalam air, sedangkan kation lainnysedangkan kation lainnya mudah larut. Ja mudah larut. Jika kalsium ada endapan putih kalsiumika kalsium ada endapan putih kalsium oksalat akan terbentuk pada
oksalat akan terbentuk pada penambahan amoniupenambahan amonium oksalat. Larutan m oksalat. Larutan dibuat basa untuk mencegahdibuat basa untuk mencegah kelarutan garam oksalat.
kelarutan garam oksalat.
●
● Pemisahan dan Identifikasi MgPemisahan dan Identifikasi Mg
Magnesium diendapkan dengan Na
Magnesium diendapkan dengan Na22HPOHPO44dalam keadaan basa menjadi magnesium amoniumphodalam keadaan basa menjadi magnesium amoniumphosfatsfat
dengan reaksi berikut: dengan reaksi berikut:
Mg
Mg2+2++ HPO+ HPO42-42-+ NH+ NH33
→
→
MgNHMgNH44POPO44Karena endapan putih fosfat dari kation lain
Karena endapan putih fosfat dari kation lain juga dapat terbentuk maka perlu dilakukan identifikasijuga dapat terbentuk maka perlu dilakukan identifikasi lebih lanjut. Hal ini dapat dilakukan dengan menggunakan pereaksi magneson I
lebih lanjut. Hal ini dapat dilakukan dengan menggunakan pereaksi magneson I (p-nitribensenazo
nitribensenazoresorsinol) resorsinol) atau atau magneson magneson II (p-nitrobenII (p-nitrobense-se- -nftol) -nftol) dengan dengan penambahan penambahan basa basa NaOH.NaOH. Ion OH
Ion OH--dari basa akan dari basa akan bereaksi dengan Mgbereaksi dengan Mg2+2+membentuk endapan putih hidroksida Mg(OH)membentuk endapan putih hidroksida Mg(OH)22..
Hidroksida tersebut akan bereaksi
Hidroksida tersebut akan bereaksi dengan pereaksi magneson atau mengabsorbsinya sehinggadengan pereaksi magneson atau mengabsorbsinya sehingga menjadi berwarna biru.
menjadi berwarna biru.
●
● Pemisahan dan Identifikasi NaPemisahan dan Identifikasi Na++, K , K ++, NH, NH4+4+
Uji nyala dapat dilakukan untuk menguji adanya Na
Uji nyala dapat dilakukan untuk menguji adanya Na++dan K dan K ++dimana Nadimana Na++akan memberikan warnaakan memberikan warna
nyala kuning dan K
nyala kuning dan K ++warna merah warna merah keunguan.keunguan. Warna nyala dari kaliu dapat tertutupi jika terdapatWarna nyala dari kaliu dapat tertutupi jika terdapat
natrium, karena itu
natrium, karena itu diperlukan kaca kobalt untuk melihat warna diperlukan kaca kobalt untuk melihat warna nyala kalium tersebut. Ujinyala kalium tersebut. Uji spesifik spesifik dapat dilakukan untuk Na+ dengan menggunakan pereaksi seng
dapat dilakukan untuk Na+ dengan menggunakan pereaksi seng uranil asetat membentuk endapan kuning [NaZn(UO
uranil asetat membentuk endapan kuning [NaZn(UO22))33(C(C33HH33OO22))99]. Sedangkan untuk K ]. Sedangkan untuk K ++dapatdapat
dilakukan dengan pereaksi natrium
dilakukan dengan pereaksi natrium heksanitrikobheksanitrikobaltat (III) altat (III) memberikan endapan kuningmemberikan endapan kuning [K
[K 22 NaCo(NO NaCo(NO22))66] Ion amonium juga memberikan reaksi yang serupa dengan K ] Ion amonium juga memberikan reaksi yang serupa dengan K ++sehingga harussehingga harus
dihilangkan terlebih dulu dengan cara
dihilangkan terlebih dulu dengan cara pemanasan.pemanasan. NH
NH4 +4 +dapat diketahui dengan memanaskan larutan sampel asli dengandapat diketahui dengan memanaskan larutan sampel asli dengan NaOH 6 M. NaOH 6 M.
NH
NH4 +4 ++ OH+ OH- - 33+ H+ H22OO
Bau gas amoniak yang khas menunjukkan adanya kation ini. Gas tersebut merubah lakmus merah Bau gas amoniak yang khas menunjukkan adanya kation ini. Gas tersebut merubah lakmus merah menjadi biru.
menjadi biru.
ANALISIS ANION ANALISIS ANION
Analisis anion tidak jauh berbeda dengan analisis kation, hanya saja pada
Analisis anion tidak jauh berbeda dengan analisis kation, hanya saja pada analisis anion tidak analisis anion tidak memiliki metode analisis standar yang sistematis seperti
memiliki metode analisis standar yang sistematis seperti analisis kation. Uji pendahuluan awal padaanalisis kation. Uji pendahuluan awal pada analisis anion juga berdasarkan pada sifat fisika
analisis anion juga berdasarkan pada sifat fisika seperti warna, bau, terbentuknya gas, danseperti warna, bau, terbentuknya gas, dan kelarutanny
kelarutannya. Beberapa a. Beberapa anion menghasilkan asam lemah volatil atau dioksidasi dengan asam anion menghasilkan asam lemah volatil atau dioksidasi dengan asam sulfatsulfat pekat seperti dap
pekat seperti dapat dilihat padat dilihat pada tabel berikut.a tabel berikut. Tabel 2. Reaksi sampel garam
Tabel 2. Reaksi sampel garam dengan asam sulfat pekat dingindengan asam sulfat pekat dingin Anion
Anion PengamatanPengamatan ReaksiReaksi
Cl
Cl-- Bergelembung, tidak berwarna,Bergelembung, tidak berwarna,
bau menusuk, asap putih pada bau menusuk, asap putih pada udara lembab, lakmus biru udara lembab, lakmus biru menjadi merah
menjadi merah Br
bau menusuk, berasap, lakmus bau menusuk, berasap, lakmus biru menjadi merah
biru menjadi merah
II-- Bergelembung, uap ungu jikaBergelembung, uap ungu jika
dipanaskan, bau seperti H2S. dipanaskan, bau seperti H2S. S
S2-2- Bau khas gas H2SBau khas gas H2S
CO
CO3 2-3 2- Bergelembung, tidak berwarnaBergelembung, tidak berwarna
dan tidak berbau dan tidak berbau SO
SO3 2-3 2- Bergelembung, tidak berwarna,Bergelembung, tidak berwarna,
bau sengak bau sengak CrO
CrO4 2-4 2- Perubahan warna dari kuningPerubahan warna dari kuning
menjadi jingga menjadi jingga
31 31
Anion lainnya tidak memberikan reaksi dengan asam sulfat pekat dalam Anion lainnya tidak memberikan reaksi dengan asam sulfat pekat dalam keadaan dingin, tetapi nitrat bereaksi menghasilkan uap coklat dari NO2 keadaan dingin, tetapi nitrat bereaksi menghasilkan uap coklat dari NO2 yang dihasilkan, dan asetat memberikan bau khas cuka jika direaksikan yang dihasilkan, dan asetat memberikan bau khas cuka jika direaksikan dengan asam sulfat pekat.
dengan asam sulfat pekat.
Umumnya anion dibagi menjadi 3 golongan, yaitu: Umumnya anion dibagi menjadi 3 golongan, yaitu: a. golongan sulfat: SO a. golongan sulfat: SO44 2-2-, SO, SO33 2-2-, PO, PO44 3-3-, Cr , Cr 22OO44 2-2-, BO, BO22 --, CO, CO33 2-2-, C, C22OO44 2-2-,, AsO AsO44 3- b. golongan ha
b. golongan halida : Cllida : Cl--, Br , Br --, I, I--, S, S2-
2-c. golongan nitrat : NO c. golongan nitrat : NO33 --, NO, NO22 --,C,C22HH33OO22 --.. Garam BaSO
Garam BaSO44, BaSO, BaSO33, Ba, Ba22(PO(PO44))33, BaCr , BaCr 22OO44, Ba(BO, Ba(BO22))22, BaCO, BaCO33,,
BaC
BaC22OO44,Ba,Ba33( AsO( AsO44))22tidak larut dalam air kondisi basa, tidak larut dalam air kondisi basa, sedangkan garamsedangkan garam
barium anion l
barium anion lainnya mudah lainnya mudah larut. Berdasarkan sifat arut. Berdasarkan sifat tersebut makatersebut maka pemisahan dan i
pemisahan dan identifikasi undentifikasi untuk golongan tuk golongan sulfat dapat dilaksulfat dapat dilakukan dengukan denganan penambahan p
penambahan pereaksi BaClereaksi BaCl22. Kecuali barium kromat yang berwarna. Kecuali barium kromat yang berwarna
kuning, garam barium lainnya berwarna kuning, garam barium lainnya berwarna putih.putih.
Jika larutan sampel diasamkan dengan asam nitrat dan ditambahkan perak Jika larutan sampel diasamkan dengan asam nitrat dan ditambahkan perak nitrat maka hanya golongan anion halida yang akan mengendap sebagai nitrat maka hanya golongan anion halida yang akan mengendap sebagai garam perak, yaitu: AgCl (putih), AgBr(kuning), AgI(kuning muda), Ag garam perak, yaitu: AgCl (putih), AgBr(kuning), AgI(kuning muda), Ag22SS
(hitam). (hitam).
Anion yang tidak menunjukkan uji yang positif untuk kedua golongan di Anion yang tidak menunjukkan uji yang positif untuk kedua golongan di atas kemungkinan mengandung anion golongan nitrat.
atas kemungkinan mengandung anion golongan nitrat. Jika sampel mengandung beberapa kation maka
Jika sampel mengandung beberapa kation maka uji pendahuluan diatasuji pendahuluan diatas tidak cukuk untuk menentukan ada atau tidaknya suatu anion. Karena itu tidak cukuk untuk menentukan ada atau tidaknya suatu anion. Karena itu setelah pengujian pendahuluan dilakukan maka perlu juga dilakukan uji setelah pengujian pendahuluan dilakukan maka perlu juga dilakukan uji spesifik untuk tiap anion.
spesifik untuk tiap anion. 32
32
Berikut ini contoh uji spesifik beberapa anion: Berikut ini contoh uji spesifik beberapa anion: 1. sulfat
1. sulfat
Ambil 1 ml sampel, tambahkan asam dan BaCl
Ambil 1 ml sampel, tambahkan asam dan BaCl22. Jika terbentuk . Jika terbentuk
endapan putih maka anion sulfat ada. endapan putih maka anion sulfat ada. 2. kromat
2. kromat
Perhatikan filltrat pada uji 1, jika
Perhatikan filltrat pada uji 1, jika berwarna kuning maka anionberwarna kuning maka anion kromat ada. Tambahkan pada filtrat Pbnitrat, jika terbentuk kromat ada. Tambahkan pada filtrat Pbnitrat, jika terbentuk endapan kuning maka kromat ada.
endapan kuning maka kromat ada. 3. nitrat
3. nitrat
Ambil 1 ml sampel, tambahkan 2 ml asam sulfat pekat. Miringkan Ambil 1 ml sampel, tambahkan 2 ml asam sulfat pekat. Miringkan tabung uji sehingga membentuk sudut 30
tabung uji sehingga membentuk sudut 30ooC, kemudianC, kemudian
tambahkan beberapa tetes ferosulfat melalui dinding tabung tambahkan beberapa tetes ferosulfat melalui dinding tabung perlahan-lahan. Jik
perlahan-lahan. Jika terbentuk cina terbentuk cincin coklat makcin coklat maka nitrat ada.a nitrat ada. 4. asetat
4. asetat
Ambil beberapa tetes sampel,
Ambil beberapa tetes sampel, tambahkan etanol, perhatikan bautambahkan etanol, perhatikan bau yang terbentuk, jika tercium bau buah maka asetat ada.
yang terbentuk, jika tercium bau buah maka asetat ada. 5. Cl
5. Cl
--Setelah dilakukan uji golongan, maka penambahan NH
Setelah dilakukan uji golongan, maka penambahan NH44OH akanOH akan
melarutkan anion Cl
melarutkan anion Cl--dan Br dan Br --, sedangkan I, sedangkan I--tidak larut.tidak larut.
Penambahan asam lebih lanjut dapat
Penambahan asam lebih lanjut dapat membentumembentuk endapan putihk endapan putih jika Cl
jika Cl--ada.ada.
Latihan soal Latihan soal
1. Larutan sampel diketahui mengandung ion Cu dan Ni masing-masing 1. Larutan sampel diketahui mengandung ion Cu dan Ni masing-masing 0,1 M. Jika diberikan pereaksi H
0,1 M. Jika diberikan pereaksi H22S dengan konsentrasi SS dengan konsentrasi S2-2-1 x 101 x 10-20-20,,
apakah keduanya akan mengendap? apakah keduanya akan mengendap? 2. Lengkapi tabel berikut:
2. Lengkapi tabel berikut: Kation Golongan Kation Golongan analisis analisis Pereaksi Pereaksi pengendap pengendap Endapan yang Endapan yang terbentuk terbentuk Hg Hg2+2+ Bi Bi3+3+ 33 33 Fe Fe2+2+ Al Al3+3+
3. Larutan yang mengandung kation golongan 1 dengan HCl 3. Larutan yang mengandung kation golongan 1 dengan HCl
memberikan endapan putih yang larut seluruhnya saat dipanaskan. memberikan endapan putih yang larut seluruhnya saat dipanaskan. Jelaskan ion apa yang ada dan tidak ada dalam sampel tersebut? Jelaskan ion apa yang ada dan tidak ada dalam sampel tersebut? 4. Lengkapi tabel berikut:
4. Lengkapi tabel berikut: Kation/anio
Ba
Ba2+2+Uji nyalaUji nyala
Ca
Ca2+2+Uji nyalaUji nyala
NH
NH33Endapan abu-abuEndapan abu-abu
Ni
Ni2+2+DMGDMG
Asam sulfat pekat Gelembung, tdk Asam sulfat pekat Gelembung, tdk berwarna, tdk berbau
berwarna, tdk berbau
Barium klorida Endapan putih Barium klorida Endapan putih
5. Larutan sampel terlihat berwarna kuning, penambahan asam 5. Larutan sampel terlihat berwarna kuning, penambahan asam menyebabkan warnanya berubah menjadi jingga. Uji nyala menyebabkan warnanya berubah menjadi jingga. Uji nyala menunjukkan warna ungu. Tentukan kation dan anion yang menunjukkan warna ungu. Tentukan kation dan anion yang mungkin ada. Tuliskan
mungkin ada. Tuliskan persamaan reaksinya.persamaan reaksinya.
I. Maksud dan Tujuan I. Maksud dan Tujuan
Agar Praktikan dapat mengenal berbagai larutan anion
Agar Praktikan dapat mengenal berbagai larutan anion dan kation dalam larutan
dan kation dalam larutan
contoh, serta dapat mengetahui cara pemisahan golongan I.
contoh, serta dapat mengetahui cara pemisahan golongan I.
II. Teori dasar II. Teori dasar
Golongan I
Golongan I
kation golongan ini membentuk endapan dengan asam klorida encer. Ion-
kation golongan ini membentuk endapan dengan asam klorida encer.
Ion-ion golongan ini
ion golongan ini adalah Timbel, merkurium(I)(raksa)
adalah Timbel, merkurium(I)(raksa), dan
, dan perak.
perak.
Golongan Kation Pertama : Golongan Kation Pertama : Pereaksi golongan :
Pereaksi golongan :
asam klorida encer (2 M)
asam klorida encer (2 M)
Reaksi golongan :
Reaksi golongan :
endapan putih timbel klorida, PbCl
endapan putih timbel klorida, PbCl
22, merkurium (I) klorida HgCl
, merkurium (I) klorida HgCl
22, dan perak
, dan perak
klorida AgCl.
klorida AgCl.
Kation golongan pertama, membentuk klorida-klorida yang tidak larut. Namun, timbel
Kation golongan pertama, membentuk klorida-klorida yang tidak larut. Namun, timbel
klorida sedikit larut dalam air, dan karena itu timbel tidak pernah mengendap dengan sempurna
klorida sedikit larut dalam air, dan karena itu timbel tidak pernah mengendap dengan sempurna
bila ditambahkan asam klorida encer kepada suatu cuplikan; ion timbel yang tersisa itu,
bila ditambahkan asam klorida encer kepada suatu cuplikan; ion timbel yang tersisa itu,
diendapkan secara kuantitatif dengan hidrogen sulfida dalam Suasana asam bersama-sama
diendapkan secara kuantitatif dengan hidrogen sulfida dalam Suasana asam bersama-sama
kation golongan kedua.
kation golongan kedua.
Nitrat dari kation-kation ini sangat mudah larut. Diantara sulfat-sulfat, timbel sulfatan
Nitrat dari kation-kation ini sangat mudah larut. Diantara sulfat-sulfat, timbel sulfatan
praktis tidak larut, sedang perak sulfat larut jauh lebih banyak. Kelarutan merkurium (I) sulfat
praktis tidak larut, sedang perak sulfat larut jauh lebih banyak. Kelarutan merkurium (I) sulfat
terletak diantara kedua zat diatas. Bromida dan iodida
terletak diantara kedua zat diatas. Bromida dan iodida juga tidak larut, sedangkan pengendapan
juga tidak larut, sedangkan pengendapan
timbel halida tidak sempurna, dan endapan itu mudah sekali melarut dalam air panas. Sulfida
timbel halida tidak sempurna, dan endapan itu mudah sekali melarut dalam air panas. Sulfida
tidak larut. Asetat-asetat lebih mudah larut, meskipun perak asetat bisa mengendap dari larutan
tidak larut. Asetat-asetat lebih mudah larut, meskipun perak asetat bisa mengendap dari larutan
yang agak pekat. Hidroksida dan karbonat akan diendapkan dengan reagensia yang jumlahnya
yang agak pekat. Hidroksida dan karbonat akan diendapkan dengan reagensia yang jumlahnya
ekuivalen, tetapi kalau reagensia berlebihan, ia dapat bertindak dengan bermacam-macam cara.
ekuivalen, tetapi kalau reagensia berlebihan, ia dapat bertindak dengan bermacam-macam cara.
Juga ada perbedaan dalam sifat
Juga ada perbedaan dalam sifat zat-zat ini terhadap ammonia.
zat-zat ini terhadap ammonia.
III Alat-alat III Alat-alat
•
•
Tabung reaksi dan raknya
Tabung reaksi dan raknya
••
Pengaduk kaca
Pengaduk kaca
••
Pipet tetes
Pipet tetes
••
Tabung sentrifuge
Tabung sentrifuge
••
Piala gelas
Piala gelas
••
Pencapit kayu
Pencapit kayu
Pereaksi Pereaksi
HCl
HCl 2
2 N
N
HCl
HCl 4
4 N
N
HCl
HCl 6
6 N
N
H
H
22O
O
K
K
22CrO
CrO
445
5 %
%
Alkohol
Alkohol 96
96 %
%
NH
NH
44OH
OH 2N
2N
SnCl
SnCl
225%
5%
HNO
HNO
332N
2N
KI/B/R
KI/B/R
Reaksi Reaksi
Reaksi pada pemisahan golongan I.
Reaksi pada pemisahan golongan I.
Larutan
Larutan contoh
contoh +
+ HCl
HCl (AgCl,
(AgCl, PbCl
PbCl
22, Hg
, Hg
22Cl
Cl
22))
PbCl
PbCl
22+ K
+ K
22CrO
CrO
44PbCrO
PbCrO
44(( kuning) + 2KCl
kuning) + 2KCl
PbCl
PbCl
22+ H
+ H
22SO
SO
44PbSO
PbSO
44(( putih ) + 2HCl
putih ) + 2HCl
Hg
Hg
22Cl
Cl
22+ SnCl
+ SnCl
22Hg
Hg
22Cl
Cl
22(( putih ) + SnCl
putih ) + SnCl
22AgCl + HNO
AgCl + HNO
33AgNO
AgNO
33(( putih ) + HCl
putih ) + HCl
AgCl
AgCl +
+ KBr
KBr AgBr
AgBr (( putih kuning ) + KCl
putih kuning ) + KCl
IV. Cara Kerja IV. Cara Kerja
Bagan Pemisahan Golongan I
Bagan Pemisahan Golongan I
V. Data Percobaan V. Data Percobaan
kation kation
•
•
Contoh uji + K
Contoh uji + K
22CrO
CrO
44kuning
kuning
••
Contoh uji + alkohol 96% + H
Contoh uji + alkohol 96% + H
22SO
SO
44putih
putih
••
Contoh uji + HNO
Contoh uji + HNO
33tidak ada endapan
tidak ada endapan
••
Contoh
Contoh uji
uji +
+ KI
KI
tidak
tidak ada
ada endapan
endapan
••
Contoh
Contoh uji
uji +
+ logam
logam Cu
Cu
warna
warna tembaga
tembaga memudar/a
memudar/abu
bu
– –abu
abu
•Anion Anion
•
•
Contoh uji + HCl + BaCl
Contoh uji + HCl + BaCl
22putih
putih
••
Contoh uji + H
Contoh uji + H
22SO
SO
44+ FeSO
+ FeSO
44bubuk + H
bubuk + H
22SO
SO
44pekat
pekat
tidak
tidak terdapat
terdapat cincin
cincin
coklat
coklat
•
•
Contoh
Contoh uji
uji +
+ alkohol
alkohol 96%
96%
bau
bau pisang
pisang ambon
ambon
VI. Diskusi VI. Diskusi
Dalam praktik pemisahan golongan I, terdapat beberapa kesalahan yang mungkin terjadi,
Dalam praktik pemisahan golongan I, terdapat beberapa kesalahan yang mungkin terjadi,
yaitu:
yaitu:
•
•
Alat yang digunakan masih kotor, sehingga
Alat yang digunakan masih kotor, sehingga mengganggu laju reaksi.
mengganggu laju reaksi.
••
Larutan yang digunakan tidak sesuai dengan
Larutan yang digunakan tidak sesuai dengan prosedur, misal yang harusnya larutan
prosedur, misal yang harusnya larutan
HCl 4N di ganti menjadi 2N, dsb.
HCl 4N di ganti menjadi 2N, dsb.
•
•
Alat yang digunakan masih dalam keadaan
Alat yang digunakan masih dalam keadaan basah.
basah.
VII. Kesimpulan VII. Kesimpulan
Kandungan beberapa kation dan anion dalam larutan contoh uji:
Kandungan beberapa kation dan anion dalam larutan contoh uji:
Kation: Kation: • •
Ag
Ag
++( - )
( - )
• •Hg
Hg
2+2+( + )
( + )
• •Pb
Pb
2+2+( + )
( + )
Anion: Anion: • •SO
SO
442-2-( - )
( - )
• •CH
CH
33COO
COO
--( + )
( + )
• •NO
NO
33( - )
( - )
•• Daftar PustakaDaftar Pustaka
Sekolah Tinggi Teknologi Tekstil.
Sekolah Tinggi Teknologi Tekstil. Pedoman praktikum kimia analisaPedoman praktikum kimia analisa. Bandung. 2003. Bandung. 2003 Svehla,
Svehla, G. Vogel Buku Teks Analisis Anorganik Kualitatif Makro dan Semimikro.G. Vogel Buku Teks Analisis Anorganik Kualitatif Makro dan Semimikro. Jakarta: PTJakarta: PT Kalman
Kalman Media Media Pusaka Pusaka 19901990
PEMISAHAN GOLONGAN III A PEMISAHAN GOLONGAN III A
I. Maksud dan Tujuan I. Maksud dan Tujuan
Agar Pratikan dapat mengenal larutan anion
Agar Pratikan dapat mengenal larutan anion dan kation dalam larutan contoh, serta
dan kation dalam larutan contoh, serta
dapat engetahui cara pemisahan golongan III.
dapat engetahui cara pemisahan golongan III.
II. Teori dasar II. Teori dasar Golongan III
Golongan III kation golongan ini tak bereaksi dengan asam klorida encer, ataupun dengankation golongan ini tak bereaksi dengan asam klorida encer, ataupun dengan hidrogen sulfida dalam suasana asam mineral encer. Namun kation ini membentuk endapan hidrogen sulfida dalam suasana asam mineral encer. Namun kation ini membentuk endapan dengan ammonium sulfida dalam suasana netral atau amoniakal. Kation-kation golongan ini dengan ammonium sulfida dalam suasana netral atau amoniakal. Kation-kation golongan ini adalah kobalt(II), nikel(II), besi(II), Besi(III), Kromium(III), Almunium, Zink dan man
adalah kobalt(II), nikel(II), besi(II), Besi(III), Kromium(III), Almunium, Zink dan man gan(II).gan(II). Golongan Kation Ketiga :
Golongan Kation Ketiga : Reagensia
Reagensia golongan golongan :: hidrogen sulfida (gas atau larutan air jenuh) dengan adanya amonia danhidrogen sulfida (gas atau larutan air jenuh) dengan adanya amonia dan amonium klorida, atau larutan amonium sulfida.
amonium klorida, atau larutan amonium sulfida. Reaksi
Reaksi golongan golongan :: endapan-endapan dengan berbagai warna: Besi(I) sulfida (hitam),endapan-endapan dengan berbagai warna: Besi(I) sulfida (hitam), almuminium hidroksida (putih), kromium (III) hidroksida (hijau), nikel sulfida (hitam), kobalt almuminium hidroksida (putih), kromium (III) hidroksida (hijau), nikel sulfida (hitam), kobalt sulfida (hitam), mangan (II) sulfida (merah jambu), dan zink sulfida(putih).
sulfida (hitam), mangan (II) sulfida (merah jambu), dan zink sulfida(putih).
Logam-logam golongan ini tidak diendapkan oleh reagensia golongan untuk golongan I dan II, Logam-logam golongan ini tidak diendapkan oleh reagensia golongan untuk golongan I dan II, tetapi semuannya diendapkan, dengan adanya amonium klorida, oleh hidrogen sulfida dari tetapi semuannya diendapkan, dengan adanya amonium klorida, oleh hidrogen sulfida dari larutan yang telah dijadikan basa dengan larutan amonia. Logam-logam ini diendapakan sebagai larutan yang telah dijadikan basa dengan larutan amonia. Logam-logam ini diendapakan sebagai sulfida, kecuali almunium dan kromium, yang diendapkan sebagai hidroksida, karena hidrolisis sulfida, kecuali almunium dan kromium, yang diendapkan sebagai hidroksida, karena hidrolisis yang sempurna dari sulfida dalam larutan air. Besi, almunium dan kromium (sering disertai yang sempurna dari sulfida dalam larutan air. Besi, almunium dan kromium (sering disertai sedikit mangan) juga diendapkan sebagai hidroksida oleh larutan amonia dengan adanya sedikit mangan) juga diendapkan sebagai hidroksida oleh larutan amonia dengan adanya amonium klorida, sedang logam-logam lain dari golongan ini tetap berada dalam larutan dan amonium klorida, sedang logam-logam lain dari golongan ini tetap berada dalam larutan dan dapat diendapkan sebagai sulfida oleh hidrogen sulfida. Maka golongan ini biasanya dibagi dapat diendapkan sebagai sulfida oleh hidrogen sulfida. Maka golongan ini biasanya dibagi menjadi golongan besi(besi, almunium, kromium) atau
menjadi golongan besi(besi, almunium, kromium) ataugolongan III Agolongan III A dan golongan zink (nikel,dan golongan zink (nikel, kobalt, mangan dan zink) atau
kobalt, mangan dan zink) ataugolongan III Bgolongan III B
III Alat-alat III Alat-alat
•
• Tabung reaksi dan raknyaTabung reaksi dan raknya •
• Pengaduk kacaPengaduk kaca •
•
• Tabung sentrifugeTabung sentrifuge •
• Piala gelasPiala gelas •
• Labu semprotLabu semprot •
• Pingan proselenPingan proselen
Pereaksi Pereaksi NH NH44 NO NO33 6N 6N NHNH44OH 5 %OH 5 % HCl HCl 4 4 N N HH22OO NaOH NaOH KCNSKCNS H H22SOSO44 KIOKIO44 CH
CH33COOH COOH 5 5 % % CHCH33COONHCOONH44 5 %5 % AgNO
AgNO33 BaClBaCl22
Pb Asetat Pb Asetat
Reaksi Reaksi
Larutan contoh + NH
Larutan contoh + NH44 NO NO33 + NH+ NH44OHOH Fe(OH)Fe(OH)33 + Mn(OH)+ Mn(OH)22 + Na+ Na33AlOAlO33 + + NaNa22CrOCrO44 Fe(OH)
Fe(OH)33 + + KCNS KCNS Fe(CNS)Fe(CNS)33 (( merah tua ) + KOHmerah tua ) + KOH Fe(OH)
Fe(OH)33 + K + K 44Fe(CN)Fe(CN)66 KFe(Fe(CN)KFe(Fe(CN)66) ) (( biru trumbul ) + KOH biru trumbul ) + KOH Mn(OH)
Mn(OH)22+ H+ H22SOSO44 + KIO+ KIO44 MnSOMnSO44 (( violet ) + Hviolet ) + H22O + OO + O22 Na
Na33AlOAlO33 + CH+ CH33COOHCOOH HH33AlOAlO33 + CH+ CH33COONaCOONa Na
Na22CrOCrO44 + CH+ CH33COOH HCOOH H22CrOCrO44+ CH+ CH33COONaCOONa H
H33AlOAlO33 + NH+ NH44OH Al(OH)OH Al(OH)33+ NH+ NH44OHOH H
H33AlOAlO33 + CH+ CH33COONHCOONH44 CHCH33COOH + NHCOOH + NH33 + Al(OH)+ Al(OH)33 Na
Na22CrOCrO44+ AgNO+ AgNO33 NaNO NaNO33+ AgCrO+ AgCrO44 (( merah)merah) Na
Na22CrOCrO44 + BaCl+ BaCl22 NaCl + BaCrO NaCl + BaCrO44 (( kuning)kuning)
IV. Cara Kerja IV. Cara Kerja
Bagan pemisahan golongan III (Fe
V. Data Percobaan
V. Data Percobaan
Kation: Kation:
•
•
Contoh
Contoh uji
uji +
+ KCNS
KCNS
merah
merah darah
darah (
( +
+ ))
••
Contoh uji + K
Contoh uji + K
44Fe(CN)
Fe(CN)
66biru terumbul
biru terumbul (
( + )
+ )
••
Contoh uji + H
Contoh uji + H
22SO
SO
44+ KIO
+ KIO
44violet
violet (
( +
+ ))
••
Contoh uji + CH
Contoh uji + CH
33COOH
COOH
selai
selai (
( +
+ ))
••
Contoh uji + AgNO
Contoh uji + AgNO
33merah
merah
(
( +
+ ))
••
Contoh
Contoh uji
uji +
+ BaCl2
BaCl2
kuning
kuning
(
( +
+ ))
•Anion: Anion:
•
•
contoh uji + HCl + BaCl
contoh uji + HCl + BaCl
22putih
putih (
( +
+ ))
••
Contoh
Contoh uji
uji +
+ alkohol
alkohol 96
96 %
%
bau
bau pisang
pisang ambon
ambon
(
( +
+ ))
••
Contoh uji + H
Contoh uji + H
22SO
SO
44+ FeSO
+ FeSO
44bubuk + H
bubuk + H
22SO
SO
44pekat
pekat
cincin
cincin coklat
coklat (-)
(-)
••
Contoh uji + HNO
Contoh uji + HNO
33+ AgNO
+ AgNO
33putih + NH
putih + NH
44OH
OH 6N
6N (
( +
+ ))
VI. Diskusi
VI. Diskusi
Kesalahan yang sering
Kesalahan yang sering terjadi adalah ketika membedakan bau pisang ambon. Selain itu,
terjadi adalah ketika membedakan bau pisang ambon. Selain itu,
membedakan cincin coklat dengan endapan yang
membedakan cincin coklat dengan endapan yang membulat pada tabung reaksi. Terkadang
membulat pada tabung reaksi. Terkadang
dalam penentuan warna juga sering
dalam penentuan warna juga sering mengalami kesukaran.
mengalami kesukaran.
VII. Kesimpulan VII. Kesimpulan Kation: Kation: • •
Fe
Fe
3+3+( + )
( + )
• •Mn
Mn
33+
+
(
( +
+ ))
• •Cr
Cr
3+3+( + )
( + )
• •Al
Al
3+3+( + )
( + )
Anion: Anion: • •Cl
Cl
--( + )
( + )
• •SO
SO
442-2-( - )
( - )
• •CH
CH
33COO
COO
--( - )
( - )
• •NO
NO
33--( + )
( + )
PEMISAHAN GOLONGAN V PEMISAHAN GOLONGAN VI. Maksud dan Tujuan I. Maksud dan Tujuan
Agar Pratikan dapat mengenal larutan anion
Agar Pratikan dapat mengenal larutan anion dan kation dalam larutan contoh, serta
dan kation dalam larutan contoh, serta
dapat mengetahui cara pemisahan golongan V.
II. Teori dasar II. Teori dasar
Gologan kation kelima : Gologan kation kelima : Reagensia Golongan :
Reagensia Golongan : larutan amonium karbonat 1 Mlarutan amonium karbonat 1 M Reagensia tak berwarna, dan
Reagensia tak berwarna, dan memperlihatkan reaksi basa memperlihatkan reaksi basa karena hidrolisis karena hidrolisis :: CO
CO332-2- + + H H O O HCOHCO33--+ OH+ OH
--Reagensia terurai oleh asam-asam (bahakan oleh asam asetat), pada mana terbentuk gas karbon Reagensia terurai oleh asam-asam (bahakan oleh asam asetat), pada mana terbentuk gas karbon dioksida :
dioksida : CO
CO332-2- + + 2 2 CHCH33COOH COCOOH CO22 + H+ H22O + 2 CHO + 2 CH33COOCOO
--Reagensia harus dipakai dalam suasana netral atau sedikit basa. Reagensia harus dipakai dalam suasana netral atau sedikit basa. Amonium karbonat
Amonium karbonat komersial selalu komersial selalu mengandung amonium mengandung amonium hidrogen karbonat (Nhidrogen karbonat (NHH44HCOHCO33) dan) dan amonium karbamat NH
amonium karbamat NH44O(NHO(NH22)CO. Senyawa-senyawa ini harus dihilangkan sebelum memulai)CO. Senyawa-senyawa ini harus dihilangkan sebelum memulai dengan reaksi golongan, karena golongan alkali-alkali tanah dari keduanya larut dalam air. Ini dengan reaksi golongan, karena golongan alkali-alkali tanah dari keduanya larut dalam air. Ini dapat dilakukan dengan mendidihkan larutan reagensia sebentar; baik amonium hidrogen dapat dilakukan dengan mendidihkan larutan reagensia sebentar; baik amonium hidrogen karbonat maupun amonium karbamat, dapat diubah menjadi amonium karbonat dengan cara ini karbonat maupun amonium karbamat, dapat diubah menjadi amonium karbonat dengan cara ini 2NCO CO + CO + HO 2NCO CO + CO + HO O O C = O + H C = O + H22 O O NH NH + + COCO H N H N
Reaksi golongan : kation-kation golongan kelima , tidak bereaksi dengan asam klorida, hidrogen Reaksi golongan : kation-kation golongan kelima , tidak bereaksi dengan asam klorida, hidrogen sulfida ataupun amonium sulfida; tetapi amonium karbonat (jika ada amonia atau ion amonium sulfida ataupun amonium sulfida; tetapi amonium karbonat (jika ada amonia atau ion amonium dalam jumlah yang sedang) membentuk endapan-endapan putih. Uji ini harus dijalankan dalam dalam jumlah yang sedang) membentuk endapan-endapan putih. Uji ini harus dijalankan dalam larutan netral atau basa. Jika tak ada amonia atau ion amonium, magnesium juga akan larutan netral atau basa. Jika tak ada amonia atau ion amonium, magnesium juga akan mengendap. Endapan-endapan putih yang terbentuk dengan reagensia golongan adalah: barium mengendap. Endapan-endapan putih yang terbentuk dengan reagensia golongan adalah: barium karbonat BaCO
karbonat BaCO33, strontium karbonat SrCO, strontium karbonat SrCO33, dan kalsium karbonat CaCO, dan kalsium karbonat CaCO33..
Ketiga golongan alkali tanah ini menguraikan air dengan laju yang berbeda-beda, dengan Ketiga golongan alkali tanah ini menguraikan air dengan laju yang berbeda-beda, dengan membentuk hidroksida dan gas hidrogen. Hidroksidanya merupakan basa kuat, meskipun dengan membentuk hidroksida dan gas hidrogen. Hidroksidanya merupakan basa kuat, meskipun dengan kelarutan yang berbeda-beda: barium hidroksida adalah yang paling mudah larut diantara ketiga kelarutan yang berbeda-beda: barium hidroksida adalah yang paling mudah larut diantara ketiga ini. Klorida dan nitrat dari alkali tanah s
ini. Klorida dan nitrat dari alkali tanah sangat mudah larut;karbonat, sulfat, fosfat, dan oksalatnangat mudah larut;karbonat, sulfat, fosfat, dan oksalatn yaya tidak larut. Sulfidanya dapat dibuat hanya dalam keadaan kering; semua sulfida terhidrolisis tidak larut. Sulfidanya dapat dibuat hanya dalam keadaan kering; semua sulfida terhidrolisis dalam air, membentuk
dalam air, membentuk hidrogen sulfida dan hidrogen sulfida dan hidroksida, misalnya hidroksida, misalnya :: 2BaS +
2BaS + 2 H O 2 H O 2 Ba2 Ba2+2+ + 2SH+ 2SH--+ 2OH+ 2OH
--Garam-garam membentuk larutan yang tak berwarna, kecuali kalau anionnya berwarna. Garam-garam membentuk larutan yang tak berwarna, kecuali kalau anionnya berwarna.
Karena alkali tanah bersifat hampir serupa satu sama lain dalam bentuk larutan, sukarlah bagi Karena alkali tanah bersifat hampir serupa satu sama lain dalam bentuk larutan, sukarlah bagi kita untuk membedakannya dan terutama untuk memisahkannya. Namun ada kita untuk membedakannya dan terutama untuk memisahkannya. Namun ada perbedaan- perbedaan
perbedaan dalam dalam kelarutan kelarutan beberapa beberapa garam garam mereka mereka dalam dalam medium medium bukan bukan air. air. Begitulah, Begitulah, 100 100 gg etanol yang bebas-air, melarutkan 12,5 g kalium klorida, 0,91 g strontium klorida, dan hanya etanol yang bebas-air, melarutkan 12,5 g kalium klorida, 0,91 g strontium klorida, dan hanya 0,012 g barium klori
0,012 g barium klorida da (semuanya merupakan garam tak (semuanya merupakan garam tak berhidrat). Seratus gram berhidrat). Seratus gram campuran 1 :campuran 1 : 1 dietileter dan etanol bebas-air, melarutkan lebih 40 g kalsium nitrat anhidrat, sedang kelarutan 1 dietileter dan etanol bebas-air, melarutkan lebih 40 g kalsium nitrat anhidrat, sedang kelarutan strontium dan barium
strontium dan barium nitrat anhidrat nitrat anhidrat dalam larutan ini boleh didalam larutan ini boleh diabaikan. Perbedaan-perbedaan iniabaikan. Perbedaan-perbedaan ini dipakai untuk pemisahan.
dipakai untuk pemisahan. III Alat-alat
III Alat-alat
•
• Tabung reaksi dan raknyaTabung reaksi dan raknya •
• Pengaduk kacaPengaduk kaca •
•
• Tabung sentrifugeTabung sentrifuge •
• Piala gelasPiala gelas •
• Labu semprotLabu semprot •
• Pingan proselenPingan proselen
Pereaksi Pereaksi NH NH44 NO NO33 6N 6N NHNH44Cl 5 %Cl 5 % (NH (NH44))22 COCO33 CHCH33COOH 5 %COOH 5 % CH
CH33COONHCOONH44 5 % 5 % K K 22CrOCrO44 H
H22SOSO44 CaCrOCaCrO44 SrCrO
SrCrO44 Ca(CHCa(CH33COO)COO)22
Reaksi Reaksi
Larutan contoh + NH
Larutan contoh + NH44OH + NHOH + NH44ClCl ++(NH(NH44))22CO3CO3 BaCrOBaCrO44+ CaCrO+ CaCrO44+ SrCrO+ SrCrO44 BaCrO
BaCrO44+ + HCl HCl BaClBaCl22 (( kuning sindur ) + Hkuning sindur ) + H22CrOCrO44 BaCl
BaCl22 + H+ H22SOSO44 BaSOBaSO44 (( putih ) + HCl putih ) + HCl BaCl
BaCl22+ K + K 22CrOCrO44 BaCrOBaCrO44 (( kuning ) + KClkuning ) + KCl SrCrO
SrCrO44 + CH+ CH33COOHCOOH Sr(CHSr(CH33COO)COO)22 + H+ H22CrOCrO44 Sr(CH
Sr(CH33COO)COO)22 + (NH+ (NH44))22COCO33 SrCOSrCO33 + CH+ CH33COONHCOONH44 SrCO
SrCO33 + K + K 22CrOCrO44 SrCrOSrCrO44(( kuning ) + K kuning ) + K 22COCO33 CaCrO
CaCrO44 + CH+ CH33COOH Ca(CHCOOH Ca(CH33COO)COO)22 + H+ H22CrOCrO44 Ca(CH
Ca(CH33COO)COO)22 + (NH+ (NH44))22COCO33 CaCOCaCO33+ CH+ CH33COONHCOONH44 Ca(CH
Ca(CH33COO)COO)22 + (NH+ (NH44))22CC22OO44 CaCCaC22OO44 + CH+ CH33COONHCOONH44 Bagan pemisahan golongan V (Ba
• • •
• DiskusiDiskusi
•
•
Daftar Pustaka
Daftar Pustaka
••