ZIMOGRAFI
(UJI AKTIVITAS ENZIM SELULASE, AMILASE, XYLANASE, LACCASE)
DISUSUN OLEH:
SITTA NOOR FATMAWATI 24030110120019 SISKA WURI SUNDARI 24030110141017
NYKEN HERLYNA 24030110141032
RESTI PUTERI UTAMI 24030110141018
JURUSAN KIMIA
FAKULTAS SAINS DAN MATEMATIKA UNIVERSITAS DIPONEGORO
SEMARANG 2013
I. PENDAHULUAN I.1. Latar Belakang
Zimografi adalah teknik elektroforesis untuk menetapkan aktivitas enzim secara insitu. Berbeda dengan SDS-PAGE, gel pemisah zimografi mengandung substrat enzim yang akan dihidrolisis oleh enzim selama masa inkubasi. Enzim dipisahkan dalam gel denaturasi (SDS), namun dalam kondisi tidak tereduksi. Penambahan detergen Triton X-100 akan melepaskan SDS sehingga protein kembali melipat (renaturasi). Cara ini hampir sama dengan teknik silver staining, yaitu menggunakan gel poliakrilamida yang dikombinasikan dengan SDS. Perbedaannya terletak pada penambahan substrat pada gel elektroforesis. Pada pembuatan gel untuk zimogram, komposisi gel ditambahkan dengan 1% substrat bircwood xylan dengan tujuan protein yang mengandung enzim xylanase akan mendegradasi substrat xylan yang ditambahkan sehingga molekul protein yang memiliki aktivitas tampak sebagai pita bening. Metode zimografi bersifat mudah, sensitif, dan kualitatif dalam menganalisis aktivitas enzim (Leber & Balkwill 1997).
Hingga saat ini, analisis zimografi keratinase masih menggunakan gelatin sebagai substrat. Gelatin adalah protein yang diturunkan dari kolagen. Keratin, elastin, dan kolagen adalah protein fibrosa/serat yang banyak terdapat di alam. Keratin dan gelatin keduanya mengandung banyak residu glisin namun gelatin larut dalam air. Penggunaan gelatin sebagai substrat dalam teknik zimografi cukup bervariasi, pada bakteri termofilik L-23 (Lintang 2003) dan S. albidoflavus (Bressolier 1999) digunakan 2% gelatin sedangkan pada F. Pennavorans 0.1% (Friedrich & Antranikian 1996).
I.2. Tinjauan Pustaka I.2.1. Degradasi Keratin
Laju dan kesempurnaan degradasi keratin oleh mikroorganisme sangat bergantung pada jenis substratnya, dan hal ini erat berkaitan dengan kandungan sistin. Substrat yang sering digunakan untuk mempelajari aktivitas hidrolisis keratinase adalah bulu ayam (Riffel et al. 2003a, Thys et al. 2004, Toni et al. 2002, Werlang & Brandelli 2005, Zerdani et al. 2004), rambut manusia (Takami et al. 1992, Macedo et al. 2005), bulu sapi (Riffel et al. 2003b) dan wool (Ignatova et al. 1999, Huang et al. 2003).
Pada fungi keratinolitik, konsentrasi rendah glukosa (0.1%) dan sedikit suplementasi asam amino, pepton atau ekstrak kamir mungkin akan memacu pertumbuhan saat fase awal. Namun nutrisi terlarut dengan konsentrasi tinggi akan menghambat hidrolisis substrat keratin.
Degradasi keratin dalam medium cair ditandai dengan dilepaskannya produk-produk hidrolisis ke dalam medium. Produk utama adalah peptida berberat molekul satu hingga dua kilodalton, akan tetapi ditemukan juga asam-asam amino bebas dan protein berberat molekul tinggi. Indikator terbaik terjadinya keratinolisis adalah peningkatan pH medium (sedikitnya mencapai pH 8.0) yang menggambarkan penggunaan protein keratin, deaminasi, dan produksi amonia (Kunert 2000). Akumulasi produk metabolit yang mengandung sulfur juga ditemukan dalam medium cair.
I.2.2. Enzim
Enzim merupakan protein yang berfungsi sebagai biokatalis dalam sel hidup. Enzim telah banyak digunakan dalam bidang industri pangan, farmasi dan industri kimia lainnya. Dalam bidang pangan misalnya amilase, glukosa-isomerase, papain, dan bromelin, sedangkan dalam bidang kesehatan contohnya amilase, lipase, dan protease. Enzim dapat diisolasi dari hewan, tumbuhan dan mikroorganisme. Kelebihan enzim dibandingkan katalis biasa adalah : dapat meningkatkan produk beribu kali lebih tinggi; bekerja pada pH yang relatif netral dan suhu yang relatif rendah; dan bersifat spesifik dan selektif terhadap subtrat tertentu.
K1 K2
K3
Enzim + substrat Kompleks Enzim + Produk
Kesetimbangan untuk pembentuk adalah : Km = [ ][ ][ ]
Dengan Es adalah kompleks enzim substrat, E adalah enzim, S adalah substrat , dan Km adalah tetapan kesetimbangan (Azmi, 2006).
II. METODOLOGI
Gel elektroforesis dan zymogram xilanase mentah Poliakrilamida gel elektroforesis (SDS-PAGE) dilakukan pada 12,5% denaturing gel poliakrilamida dengan metode Laemmli (1970). Modifikasi adalah inkubasi sampel protein dengan buffer sampel pada 50°C selama 10 menit, bukan 100 ° C selama 2-5 menit (Blanco et al., 1997). Sampel dielektroforesis pada gel menggunakan mini protean II (BioRad) sistem, Sebuah protein berbagai penanda (Promega) digunakan untuk penentuan berat molekul. Protein diwarnai dengan 0,1% (b / v) Coomassie biru R (Fluka) di 50% (v / v) metanol, 10% (v / v) asam asetat.
Untuk analisis zymogram, sampel enzim kasar yang dielektroforesis seperti di atas pada SDS-PAGE mengandung xilan (0,1%). Setelah berjalan, gel dicuci empat kali selama 30 menit dalam 100 mM dapar fosfat (pH 7,0), dua yang pertama mencuci mengandung 25% (v / v) isopropil alkohol, untuk menghapus SDS dan protein renature dalam gel. Gel kemudian diinkubasi selama 20 menit pada suhu 37°C sebelum berendam dalam Kongo Red solusi untuk 5 menit pada suhu kamar dan mencuci dengan 1 M NaCl sampai pewarna berlebih telah dihapus dari band yang aktif. Zymogram disiapkan setelah merendam gel di asetat 0,5% larutan asam. Latar belakang berubah biru tua, dan zona yang bening diamati di daerah yang terkena aktivitas xylanase (Nakamura et al., 1993).
II.1. Analisis SDS-PAGE dan zimografi
Kombinasi antara elektroforesis gel poli-akrilamida dengan detergen SDS digunakan untuk memisahkan dan meneliti jumlah dan ukuran bobot molekul rantai protein dan rantai subunit protein. Sementara itu, elektroforesis dengan teknik zimografi juga merupakan bertujuan mendeteksi aktivitas enzim proteolitik secara langsung.
Tahapan kerja pada analisis SDS-PAGE dan zimografi meliputi: penyiapan gel pemisah dan penahan, penyiapan sampel dan pemuatan, kondisi running, pewarnaan gel, dan pelunturan warna.
II.1.1 Penyiapan gel pemisah dan penahan
Metode zimografi, sampel dilarutkan ke dalam bufer yang tidak mengandung isomer-kaptoetanol dan tidak memerlukan pemanasan. Tiap sampel dimuat ke dalam sumur gel dengan kisaran volume 10−20 μL, sedang-kan volume LMW yang digunakan sebanyak 5 μL, dengan menggunakan plasmin sebagai standar.
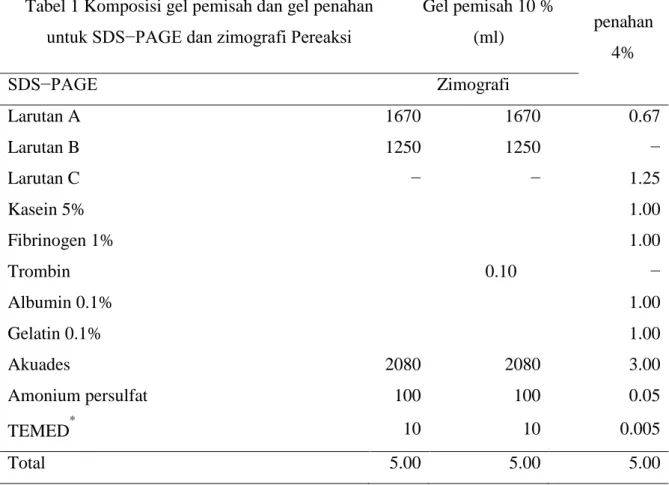
Pada zimografi, setelah elektroforesis, gel didenaturasi terlebih dahulu dalam larutan Triton X-100 2.5% (v/v) sambil digoyang selama 1 jam. Kemudian gel ditempatkan dalam bufer fosfat 50 mM pH optimum selama 30 menit. Gel diwarnai dengan larutan pewarna commassie brilliant blue R-250) selama 15 menit. Pelunturan warna gel dilakukan dengan peluntur berulang kali sampai diperoleh pita enzim proteolitik putih dengan latar gel biru. Pembuatan gel pemisah 12% dan gel penahan 4% untuk zimografi dilakukan dengan komposisi yang tertera pada Tabel 1.
Tabel 1 Komposisi gel pemisah dan gel penahan untuk SDS−PAGE dan zimografi Pereaksi
Gel pemisah 10 % (ml) Gel penahan 4% SDS−PAGE Zimografi Larutan A 1670 1670 0.67 Larutan B 1250 1250 − Larutan C − − 1.25 Kasein 5% 1.00 Fibrinogen 1% 1.00 Trombin 0.10 − Albumin 0.1% 1.00 Gelatin 0.1% 1.00 Akuades 2080 2080 3.00 Amonium persulfat 100 100 0.05 TEMED* 10 10 0.005 Total 5.00 5.00 5.00
Alat dan Bahan Alat - Kamar elektroforesis - Glass plate - Klem bingkai - Sisir penanda Bahan - Gelatin - Larutan Akrilamida - Tris - SDS 10% - Distilled water - Buffer - Triton X 100
- Trikloro asetat - Buffer Kolagenase - Larutan pewarnaan Cara kerja
- penambahan gelatin pada 1,5 M Tris pH 8,8 - penambahan akrilamida 30%
- Penambahan SDS 10% - Penambahan gliserol 50%
- Penambahan amonium per sulfat 10% - Penambahan TEMED
- Pencampuran
- Penambahan distilled water - Penambahan akrilamid 30% - Penambahan Tris 1M pH 6,8 - Penambahan SDS 10%
- Penambahan amonium per sulfat 10% - Penambahan TEMED - Pencampuran Larutan Pemisah Gelas beker Hasil Gel Penahan Gelas beker Hasil
Penuangan Gel
(1) Pembersihan glass plate (2) Pemasangan pada klem (3) Penandaan pada glass plate
(1) (2)
(3) (4) Tuangkan gel pemisah hingga batas tanda. (5) Tambahkan sedikit distilled water
(6) Biarkan selama 20-30 menit agar gel terpolimerisasi (7) Keringkan distilled water dengan kertas saring
(7)
(8) Tambahkan gel penahan di atas gel pemisah pada glass plate
(9) Pemasangan sisir penanda dalam gel penahan dan biarkan selama 20 menit
(9)
Preparasi Sampel
- Pencampuran sampel protein dengan gel loading buffer Prosedur zimografi
1. Leppaskan gel dari klem dan pasangkan pada perlengkapan gel 2. Masukan dalam kaset dan kunci
4. Masukkan buffer pada tank 5. Lepaskan sisir dengan hati-hati
6. Masukan sampel pada lubang dalam gel
8. Buka gel dan masukan dalam 50 ml triton x 100 dan diinkubasi selama 5 menit pada shaker
9. Buang larutan triton x 100 dan masukan 100 ml buffer kolagenase, shaker selama 5 menit
10. Buang buffer kolagenase dan tuangkan asam trikloroasetat pada gel inkubasi selama 30 menit pada shaker
12. Tuangkan larutan destaining dan biarkan sampai terbentuk pita bening.
1. Zimografi pada Xilanase
Xilanase merupakan kelompok enzim yang memiliki kemampuan menghidrolisis hemiselulosa dalam hal ini ialah xilan atau polimer dari xilosa dan xilooligosakarida. Xilanase dapat diklasifikasikan berdasarkan substrat yang dihidrolisis, yaitu β‐xilosidase, eksoxilanase, dan endoxilanase (Subramaniyan & Prema 2002; Richana 2002).
Pemecahan sempurna xilan memerlukan aktivitas sinergis beberapa enzim hidrolitik (hemiselulase), yaitu endo‐1,4–ß‐xilanase, ß‐xilosidase, α‐glukuronidase, α–L‐ arabinofuranosidase dan asetilesterase. Endo‐1,4‐ß‐xilanase dapat memecah kerangka dasar struktur xilan, sehingga merupakan enzim kunci dalam proses depolimerisasi xilan (Subramaniyan & Prema 2002).
Selama dekade terakhir ini, potensi bioteknologi dari aplikasi xilan dan xilanase telah menjadi perhatian utama dari para peneliti karena aplikasinya yang praktis dalam bidang industri seperti : memproduksi dan mendaur ulang kertas, meningkatkan digestibilitas makanan ternak, industri makanan dan minuman, meningkatkan kualitas roti, industri tekstil, produksi biopharmaceutika (Beq et al. 2001; Richana 2002).
Data pemurnian enzim yang diperoleh melalui elektroforesis tidak selalu menunjukkan daya katalitik enzim sebenarnya karena adanya kontaminan, isoenzim, atau enzim lain dari kelas yang sama. Kekurangan ini dapat diatasi dengan meneliti aktivitas enzim sesudah elektroforesis gel. Zimogram merupakan cara menganalisa aktivitas kitinolitik yang sederhana, sensitif, dapat dikuantisasi dan fungsional (Leber dan Balkwil, 1997). Pada dasarnya terdapat 2 model teknik zimogram. Model pertama menggunakan substrat yang terikat pada bahan penahan berupa gel, kertas saring, lembaran plastik, atau lapisan substrat
langsung. Pada model kedua, indikator diikatkan secara kuat pada gel pemisah dimana enzim subjek dibuat inaktif selama elektroforesis dan diaktifkan kembali setelah elektroforesis. Substrat yang digunakan untuk zimogram harus bersifat kromogenik,kromoforik, atau hasil reaksi enzim dengannya dapat diwarnai (Peach et al., 1993).
Zimogram adalah salah satu teknik elektroforesis yang digunakan untuk mengidentifikasi aktivitas enzim yang dipisahkan dalam gel poliakrilamida. Secara keseluruhan, prinsip teknik zimogram yang dilakukan sama, yaitu penggunaan substrat kitinase yaitu glikol kitin yang disertakan dalam gel pemisah poliakrilamid, penggunaan buffer renaturasi agar protein melipat kembali dan diberi kesempatan untuk menghidrolisis substrat pada kondisi yang tepat, inkubasi gel dalam buffer dengan pH optimum enzim. Gel divisualisasi dengan congo red dan adanya aktivitas enzim ditunjukkan oleh daerah bening dimana substrat telah didegradasi (Kleiner dan Stevenson, 1994).
Fermentasi dilakukan dengan mengambil beberapa cockborer kultur mikroorganisme pada media padat. Kultur tersebut diinokulasikan ke dalam erlenmeyer yang berisi 100 ml media cair yang mengandung 0.5 g xilan, 10.3 g sukrosa dan 1.0 g ekstrak yeast. Kultur fermentasi diinkubasikan pada suhu kamar selama 5 hari untuk isolate 234 P‐16 dan 8 hari untuk isolate 45 I‐3 dengan penggoyangan pada kecepatan 150 rpm. Hasil fermentasi dipanen pada hari ke 5 dan ke 8 karena pada hari tersebut diketahui bahwa merupakan hari dimana produksi enzim xylanase mencapai aktivitas tertingginya dari kedua isolat tersebut. Setelah waktu yang ditetapkan, kultur media di sentrifugasi untuk diambil larutan supernatannya yang merupakan ekstrak enzim kasar.
Pemekatan larutan ekstrak enzim kasar yang diperoleh dipekatkan dengan metode pengendapan menggunakan larutan aseton pada konsentrasi aseton tertentu. Untuk memperoleh konsentrasi ekstrak enzim kasar yang optimal, jumlah aseton yang ditambahkan pada 20 ml enzim ekstrak kasar isolat 45 I‐3 80 ml agar diperoleh konsentrasi aseton 80% (v/v) sedangkan untuk isolat 234 P‐16, ditambahkan aseton sebanyak 90 ml pada 10 ml ekstrak enzim kasar agar diperoleh konsentrasi aseton sebesar 90% (v/v). Campuran tersebut kemudian disimpan dalam lemari pendingin selama semalam. Setelah itu, larutan disentrifugasi pada kecepatan 10.000 rpm suhu 4 0C selama 15 menit. Endapan protein yang terbentuk diambil dan dilarutkan dalam 0,02 M bufer fosfat pH 7,0, dengan volume 1 atau 2 ml.
Larutan A dibuat dengan mencampurkan 75 g acrylamide ditambah 2 g bis‐acrylamide lalu tambahkan air hingga 250 ml. tempatkan dalam wadah gelap di suhu 4°C.
Ammonium Per Sulfate (APS) 10%
Larutan B atau Gel pemisah protein (1.4 M tris HCl pH 8.8) dibuat dengan melarutkan 45.5 g tris ke dalam 200 ml H2O dan dibuat menjadi pH 8.8 lalu ditambah dengan 1 g SDS lalu volume dibuat tepat menjadi 250 ml.
Larutan C atau gel pengumpul (1 M tris HCL pH 6.8) dibuat dengan cara melarutkan 15.1 g tris dengan 200 ml H2O lalu larutan dibuat menjadi pH 6.8 kemudian larutan ditambah dengan 1 g SDS baru ditambahkan H2)O hingga tepat menjadi 250 ml.
Buffer Reservoir (buffer elektroda) dibuat dengan melarutkan 28.8 g glysine ditambahkan dengan 6 g tris dan disesuaikan pada pH 8.3. kemudian ditambahkan 2 g SDS dan larutan ditepatkan menjadi 2 l.
Loading buffer sampel dibuat dengan mencampur 2 ml mercaptoetanol dengan 4 ml gliserol, kemudian ditambah dengan 0.3 g tris dan 2 ml bromofenol blue (0.1% b/v) dalam 20 ml H2O pH dibuat menjadi 6.8. setelah itu ditambah dengan 0.92 g SDS.
Preparasi sampel dilakukan sebelum sampel di elektroforesis. Preparasi dilakukan dengan memanaskan campuran larutan sampel dengan larutan loading buffer selama 5 menit pada suhu 100°C.
Elektroforesis dilakukan dengan menempatkan larutan sampel yang sudah dipreparasi dan juga marker ke dalam sumur SDS PAGE. Elektroforsis dilakukan selama pada kurang lebih 4 jam dengan tegangan konstan sebesar 60 volt. Migrasi diamati dengan pewarna biru bromofenol sebagai tanda.
Silver staining dilakukan dengan cara merendam gel ke dalam larutan fiksasi 50% asam asetat selama 2 jam hingga semalaman dengan penggoyangan pelan. Setelah difiksasi, gel dibilas dengan dd H2O selama 10 menit lalu dicuci dengan larutan etanol 20% selama 3 x 20 menit. Gel dibilas kembali dengan dd H2O selama 10 menit. Kemudian gel di sensitize dengan menggunakan 0.05 g/200 ml Na2S2O3 selama 1 menit. Gel kembali dibilas dengan dd H2O selama 3 x 20 menit. Kemudian gel diwarnai dengan 0.1% perak nitrat selama 20 menit, disimpan pada suhu 4°C. gel dibilas lagi dengan dd H2O selama 2 x 20 menit. Gel kemudian direndam pada larutan pengembang yang terdiri dari 5% Na2CO3 + 0.05% formalin + 0.0004% Na2S2O3. Ketika pewarnaan dengan larutan pengembang dirasa cukup, gel yang direndam diberi larutan stop solution yang berisi 6 ml asam asetat dan 440 ml dd
H2O selama 5 menit. Gel dicuci dengan dd h2O selama 5 menit. Gel di foto untuk didokumentasi dan di ukur jarak pengembangan pita protein sampel maupun marker.