BAB 2
TINJAUAN PUSTAKA 2.1 Tumbuhan Buah Jeruk Bali
2.1.1. Deskripsi Tumbuhan Buah Jeruk Bali
Jeruk Besar dalam bahas Inggris disebut pummelos, bahas Indonesi jeruk besar dan bahasa Jawa jeruk gulung. Jenis jeruk ini dapat tumbuh dengan baik didataran rendah hingga ketinggian 1.000 meter di atas permukaan laut. Jenis jeruk ini lebih menyukai daerah yang bertopografi datar (tidak bervariasi), permukaan air tanahnya dalam dan tidak tergenang air. Jenis jeruk berasal daerah kepulauan Polynesia sampai semenanjung Malaka. Berarti jenis jeruk ini berasal dari Indonesia. Setiap pohon yang besar dapat menghasilkan buah sebanyak 200 buah dalam satu musim. Waktu berbunga sama seperti jenis jeruk lain. Waktu pembentukan bunga sampai buah masak membutuhkan waktu sekitar 7-8 bulan. Jeruk besar terdiri dari berbagai macam jenis, Jeruk Pandan, Jeruk Sinyonya, Jeruk Cikoneng, Jeruk Nambangan, Jeruk Delima, Jeruk Silempang, Jeruk Oyod Gondong, Jeruk Delima Kepyar, Jeruk Nambangan-Madiun, Jeruk Bali, Jeruk Gulung, Jeruk Pandanwangi (Soelarso, 1996).
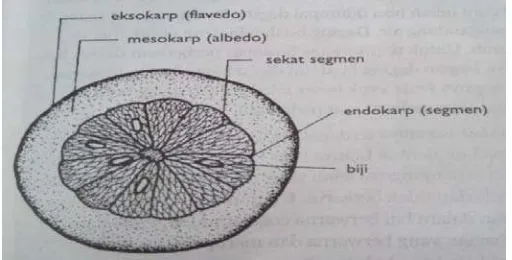
Secara umum, buah jeruk terdiri dari bagian daging buah dan kulit. Bagian daging buah yang dapat dimakan disebut dengan endokarp. Endokarp terdiri atas segmen-segmen yang disebut carpel atau locule. Di dalam segmen-segmen tersebut terdapat kantung-kantung sari buah yang berdinding tipis. Endokarp dikelilingi oleh bagian jeruk yang dinamakan kulit. Kulit buah jeruk terdiri dari flavedo dan albedo. Flavedo merupakan bagian kulit luar yang terletak di bagian bawah lapisan epidermis dan mengandung kromoplas dan kantung minyak, sedangkan kulit bagian dalam yang disebut albedo merupakan lapisan jaringan busa. Bagian tengah buah jeruk disebut dengan core atau central plasenta yang berbatasan dengan biji yang terdapat di dalam segmen (Ting dan Attaway, 1971).
jeruk ini bukan dipulau Bali, melainkan di Nambangan, Magetan (Jawa Timur). Tanaman jeruk bali tidak hanya terdapat di Nambangan. Tanaman asli Indonesia sudah menyebar di Iran, Pakistan, India, Malaysia, RRC dan Australia. Salah satu varietasnya, yaitu pomelo sudah dikembangkan di Negara-Negara subtropis dan popular dengan sebutan grapefruit. Ukuran grapefruit sedikit lebih kecil dari jeruk bali dan kegunaannya hanya untuk konsentrat. Konsentrat grapefruit yang didinginkan biasa diminum pada pagi hari sebelum masyarakat menyantap roti, kentang, daging, dan sarapan lainnya.
Jeruk Bali merupakan terna pohon dengan pertumbuhan cabang mulai dari pangkal batang. Ketinggian tajuk hanya sekedar 10 m. Batang jeruk bali berkayu keras dan liat. Daun jeruk bali berbentuk jorong dengan ujung meruncing dan bersayap pada bagian tangkainya. Warna daun hijau muda, tebal dan mengilap. Bunga berwarna putih dan beraroma sangat harum, tumbuh pada ujung ranting. Bentuk buah bervariasi mulai dari bundar agak pipih hingga bundar sempurna. Warna kulit buah bervariasi dari hijau gelap sampai hijau kekuningan setelah masak. Diameter buah rata-rata sekitar 20 cm. Biji berukuran sekitar 1 cm. Daging buah muda diurai, berwarna mulai dari putih, kekuningan merah jambu dan merah tua. Rasanya bervariasi dari masam, manis masam, manis sampai manis bercampur getir (agak pahit). Menteri pertanian RI melepas tujuh varietas jeruk bali. Ketujuh varietas tersebut adalah nambangan, nambangan merah, nambangan putih, nagetan tanpa biji, srinyonya, ades duku dan gulung (Rahardi, 2004).
Gambar 2.1. Bagian Luar Jeruk Bali 2.1.2. Sistematika Buah Jeruk Bali (C. maximaMerr.) Sistematika buah jeruk bali adalah sebagai berikut : Kingdom : Plantae
Divisi : Spermatophyta Class : Dicotyledonae Ordo : Rutales
Famili : Rutaceae Genus : Citrus
Spesies : Citrus maxima Merr. Nama Lokal : Jeruk Bali
2.1.3. Komposisi Kimia Albedo Kulit Jeruk Bali
Flavedo mengandung minyak essensial, pigmen karotenoid, dan senyawa steroid, sedangkan albedo kaya akan senyawa selulosa, hemiselulosa, lignin, pektat, dan fenolik. Komposisi dari dinding segmen, kantung sari buah, dan pusat buah tidak banyak berbeda dengan albedo. Sebagian besar gula dan asam sitrat terdapat pada sari buah disamping komponen nitrogen, lipid, senyawa fenolik, vitamin, dan senyawa anorganik (Ting dan Attaway, 1971).
Bagian dalam kulit buah jeruk bali yang berwarna putih (albedo) dapat dijadikan makanan, seperti manisan, selain itu dapat dibuat menjadi alkohol dan gula tetes serta dapat juga diekstrak kandungan pektin di dalamnya. Hasil penelitian dari Purbianti (2005) menunjukkan pektin paling banyak terdapat pada kulit jeruk bali dibandingkan dengan kulit jeruk keprok dan jeruk lemon. Jeruk bali memiliki rendemen (11,13%), kadar air (17,17%), viskositas (16,67 cps), persentase kemurnian pektin (69,69%), dan derajat keputihan (56,33).
Gambar 2.2 Penampang melintang buah jeruk bali 2.2 Klasifikasi Bahan Alam
Bahan alam didefenisikan di sini sebagai senyawa organik dengan bobot molekul antara 100 hingga 2000. Dalam arti yang lebih luas, istilah bahan alam juga dapat digunakan untuk senyawa yang dihasilkan dari alam, seperti bahan tanaman mentah, bahan makanan, resin dan eksudat tanaman atau ekstrak bahan tanaman (Heinrich, et al. 2005).
tanaman (selulosa, kitin, lignin dan pektin), sebagai cadangan makanan amilum, protein, lipoprotein) atau untuk memenuhi fungsi metabolisme penting lainnya (protein dan enzim). Senyawa kimia dari tanaman yang berbeda-beda dapat disari dengan pelarut umum, berupa senyawa kimia tanaman dengan molekul kecil. Sejumlah kelompok bahan alam dapat dibuat dari asam amino fenilalanin, terutama fenilpropana, lignin, kumarin dan flavonoid, semuanya memiliki substruktur umum yang berbasis cincin 6-karbon aromatik (unit C6) dengan rantai 3-karbon (unit C3) yang melekat pada cincin aromatik. Dengan meningkatnya jenis dan tipe senyawa yang ditentukan di dalam berbagai bahan alam, senyawa yang terdapat dalam tumbuhan adalah senyawa metabolit primer dan senyawa metabolit sekunder (Wiryowidagdo, 2008)
2.3 Senyawa Metabolit Primer dan Sekunder
Sejak zaman prasejarah manusia telah memanfaatkan ekstrak tanaman untuk mengobati dan membunuh. Pada zaman modern senyawa organik yang diisolasi dari kultur mikroorganisme, seperti halnya dari tanaman, telah banyak digunakan untuk mengobati berbagai penyakit (misalnya antibiotika penisilin dan tetrasiklin). Senyawa-senyawa organik yang berasal dari sumber-sumber alami ini menyusun suatu kelompok besar yang disebut produk-produk alami (natural products), atau yang lebih dikenal sebagai metabolit sekunder. Suatu jaring-jaring yang kompleks dari reaksi-reaksi yang dikatalisis oleh enzim kini telah diketahui, yang bermula dari pengikatan karbondioksida dalam proses fotosintesis , sampai ke senyawa-senyawa yang beragam yang disebut metabolit primer, misalnya asam amino, asetil koenzim-A, asam mevalonat, gula dan nukleotida.
semua benda hidup dan sangat erat terlibat dalam proses-proses kehidupan yang esensial. Metabolit sekunder tidaklah bersifat esensial untuk kehidupan, meski penting bagi organisme yang menghasilkannya.
Senyawa metabolit sekunder juga merupakan senyawa kimia molekul kecil dengan penyebaran terbatas. Berikut ini beberapa penggolongan senyawa metabolit sekunder; minyak atsiri, alkaloid, flavonoid, tanin, resin, glikosida, kumarin, terpenoid dan steroid. (Sirait, 2007)
2.4 Senyawa Flavonoida
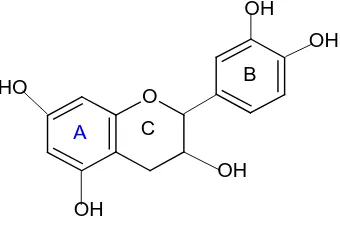
Senyawa flavonoida adalah senyawa-senyawa polifenol yang mempunyai 15 atom karbon, terdiri dari 2 cincin benzena yang dihubungkan menjadi satu oleh rantai liniear yang terdiri dari tiga atom karbon, kerangka ini dapat ditulis sebagai C6-C3-
C6. Jadi senyawa flavonoida adalah senyawa 1,3diarilpeopana, senyawa isoflvonoida
adalah senyawa 1,2 biarllpropana, sedang senyawa-senyawa neoflavonoida adalah senyawa 1,1 diarilpropana.
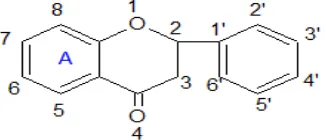
Sistem penomoran untuk turunan senyawa flavonoid diberikan di bawah
Gambar 2.3. Penomoran Flavonoid
paling rendah dan dianggap sebagai struktur induk dalam kelompok senyawa-senyawa ini (Manito, 1981).
Flavonoid merupakan kandungan khas tumbuhan hijau dengan mengecualikan alga. Flavonoid sebenarnya sebenarnya terdapat pada semua bagian tumbuhan termasuk daun, akar, kayu, kulit, tepung sari, nektar, bunga, buah dan biji. Hanya sedikit saja catatanyang melaporkan adanya flavonoid pada hewan , misalnya dalam kelenjar bau berang-berang. ‘propopolis’ (sekresi lebah) dan didalam sayap kupu-kupu ; itupun dengan anggapan bahwa flavonoid tersebut berasal dari tumbuhan yang menjadi makanan hewan tersebut dan tidak dibiosintesis di dalam tubuh mereka (Markham, 1988).
Flavonoid mengandung sistem aromatik yang terkonjugasi dan karena itu menunjukkan pita serapan kuat pada daerah spectrum UV dan spectrum tampak. Akhirnya flavonoid umumnya terdapat dalam tumbuhan, terikat pada gula sebagai glikosida dan aglikon flavonoida yang mana pun mungkin saja terdapat dalam satu tumbuhan berpembuluh, tetapi beberapa kelas lebih terbesar daripada yang lainnya: flavon dan flavonolterdapat di semesta, sedangkan isoflavon dan biflavon hanya terdapat pada beberapa suku tumbuhan (Harborne, 1996).
Senyawa flavonoida pada tumbuhan memiliki variasi konsentrasi yang ditemukan dalam jumlah yang kecil. Variasi konsentrasi atau tipe dari flavonoid yang ditemukan dalam jumlah kecil pada tumbuhan biasanya disebabkan atau dilihat berdasarkan umur dari jaringan tumbuhan tersebut, siklus kehidupan tumbuhan pertahun. Pigmentasi dari merah ke warna ungu kecoklatan dari daun-daun pada tumbuhan, menunjukkan sebagai sebagai sifat alami daun tersebut. Pada tumbuhan terjadi anabilisme dan katabolisme flavonoid. Sedikit yang mengetahui dari katabolisme polimer seperti tanin dari formasi polimer ditunjukkan seperti rute detoksifikasi isoflavonoid (Vickery, et all. 1981).
kedua cincin aromatik ini dinotasikan cincin A dan B. Pada cincin A dan B ada dijumpai atau terdapat sustituen hidroksil (OH) atau metoksi, juga gugus gula yang bentuk C-glikosida atau O-glikosida. Tapi ada juga senyawa flavonoida tanpa adanya gugus C=O yang disebut senyawa flavan (Ikan, 1969).
Dalam tubuh manusia, flavonoid dapat berguna untuk mengobati gangguan sirkulasi perifer, menurunkan tekanan darah dan meningkatkan aquaresis. Banyak juga obat-obat mengandung flavonoid yang dipasarkan di berbagai negara sebagai obat anti-inflamasi, antispasmodik, antialergi, dan antivirus (Ikan, 1969).
2.4.1 Struktur Dasar senyawa Flavonoida
Senyawa flavonoida adalah senyawa yang mengandung C15 terdiri atas dua inti fenolat yang dihubungkan dengan tiga satuan karbon yang dapat atau tidak dapat membentuk cincin ketiga. Struktur dasar flavonoida dapat digambarkan sebagai berikut (Sastrohamidjojo, 1996) :
C
C
C
B
A
Gambar 2.4. Kerangka dasar senyawa flavonoida
2.4.2 Kegunaan Flavonoida
Bagi tumbuhan untuk menarik serangga, yang membantu proses penyerbukan dan untuk menarik perhatian binatang yang membantu penyebaran biji. Bagi manusia dalam dosis kecil, flavon bekerja sebagai stimulan pada jantung, hesperidin mempengaruhi pembuluh darah kapiler. Flavon terhidroksilasi bekerja sebagai diuretik dan sebagai antioksidan pada lemak (Sirait, 2007).
dan dapat dilihat oleh banyak serangga. Senyawa ini diduga memiliki manfaat ekologi yang besar di alam berkat warnanya sebagai penarik serangga dan burung untuk membantu penyerbukan tanaman. Flavonoda tertentu juga mempengaruhi rasa makanan secara signifikan; misalnya beberapa tanaman memiliki rasa pahit dan kesat seperti flavanon naringin, pada kulit grapefruit (C. paradisi). Senyawa flavonoida diduga sangat bermanfaat dalam makanan karena, berupa senyawa fenolik, senyawa ini yang bersifat antioksidan kuat. Banyak kondisi penyakit yang diketahui bertambah parah oleh adanya radikal bebas seperti superoksida dan hidroksil. Dan flavonoida memiliki kemampuan untuk menghilangkan dan secara efektif ‘menyapu’ spesies pengoksidasi yang merusak ini. Oleh karena itu, makanan yang kaya flavonoida dianggap penting untuk mengobati penyakit-penyakit, seperti kanker dan penyakit jantung (Heinrich, et all. 2005).
2.4.3. Klasifikasi Senyawa Flavonoida 1. Flavonoida O-glikosida
Flavonoida biasanya terdapat sebagai flavonoid O-glikosida, pada senyawa tersebut satu gugus hidroksil flavonoid (atau lebih) terikat pada satu gula (atau lebih) dengan ikatan hemiasetal yang tak tahan asam. Pengaruh glikosilasi menyebabkan flavonoid menjadi kurang reaktif dan lebih mudah larut dalam air (cairan), misalnya 7-hidroksil pada flavon, isoflavon, dan dihidroflavon.
2. Flavonoida C-glikosida
Gula dapat juga teikat pada atom karbon flavonoid dan dalam hal ini gula tersebut terikat langsung pada inti benzena dengan suatu ikatan karbon-karbon yang tahan asam. Glikosida yang demikian disebut C-glikosida. Sekarang gula yang terikat pada atom C hanya ditemukan pada atom C nomor 6 dan 8 dalam inti flavonoid. Misalnya galaktosa, ramnosa, xilosa dan arabinosa.
3. Flavonoida Sulfat
hidroksi fenol atau gula. Secara teknis senyawa ini sebenarnya bisulfat karena terdapat sebagai garam. Banyak yang berupa glikosida bisulfat, bagian bisulfat terikat pada hidroksil fenol yang mana saja yang masih bebas atau pada suatu gula.
4. Biflavonoida
Biflavonoid adalah flavonoid dimer walaupun prosianidin dimer biasanya tidak dimasukkan kedalam golongan ini. Flavonoid yang biasanya terlibat ialah flavon dan flavanon yang secara biosintesis mempunyai biosintesis yang sederhana 5,7,4’ dan ikatan antar flavonoida berupa ikatan karbon – karbon atau ikatan eter. Monomer flavonoid yang digabungkan menjadi golongan biflavonoid yang satu jenis atau berbeda dan letak ikatannya berbeda-beda. Banyak sifat fisika dan kimia biflavonoid menyerupai sifat monoflavonoid pembentuknya misalnya spectrum UV-tampak, uji warna dan lain-lain. Biflavonoid jarang ditemukan sebagai glikosida dan penyebarannya terbatas, terdapat terutama pada gimnospermae.
5. Aglikon Flavonoida
Sejumlah aglikon flavonoid mempunyai atom karbon asimetrik dan dengan demikian menunjukkan keaktifan optik. Yang termasuk dalam golongan flavonoid ini ialah flavanon, dihidroflavanol, katekin, pterokarpan, rotenoid dan beberapa biflavanoid (Markham, 1988)
Menurut robinson, flavonoida dapat dikelompokkan berdasarkan keragaman pada rantai C3 yaitu flavonol, flavon, isoflavon, flavanon, dihidroflavonol, katekin,
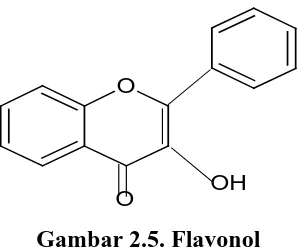
leukoantosianidin, antosianidin, khalkon dan auron (Robinson, 1995). 1. Flavonol
Larutan flavanol dalam suasana basa dioksidasi oleh udaratetapi tidak begitu cepat sehingga penggunaan basa pada pengerjaannya masih dapat dilakukan.
O
O OH
Gambar 2.5. Flavonol 2. Flavon
Flavon berbeda dengan flavanol dimana pada flavon tidak terdapat gugusan 3-hidroksi. Hal ini mempunyai serapan UV-nya, gerakan kromatografi, serta reaksi warnanya. Flavon terdapat juga sebagai glikosidanya lebih sedikit daripada jenis glikosida pada flavanol. Flavon yang paling umum dijumpai adalah apigenin dan luteolin. Luteolin merupakan zat warna yang pertama kali dipakai di Eropa. Jenis yang paling umum adalah 7-glukosida dan terdapat juga flavon yang terikat pada gula melalui ikatan karbon-karbon. Contohnya luteolin 8-C-glikosida. Flavon dianggap sebagai induk dalam nomenklatur kelompok senyawa flavonoida.
O
O
Gambar 2.6. Flavon 3. Isoflavon
karena reaksinya tidak khas dengan pereaksi warna manapun. Beberapa isoflavon (misalnya daidzein) memberikan warna biru muda cemerlang dengan sinar UV bila diuapi ammonia, tetapi kebanyakan yang lain tampak sebagai bercak lembayung yang pudar dengan amonia berubah menjadi coklat.
O
O
Gambar 2.7. Isoflavon 4. Flavanon
Flavano terdistribusi luas di alam. Flavanon terdapat di dalam kayu, daun dan bunga. Flavanon glikosida merupakan konstituen utama dari tanaman genus prenus dan buah jeruk ; dua glikosida yang paling lazim adalah neringenin dan hesperitin, terdapat dalam buah anggur dan jeruk.
O
O
Gambar 2.8. Flavanon 5. Flavanonol
O
O OH
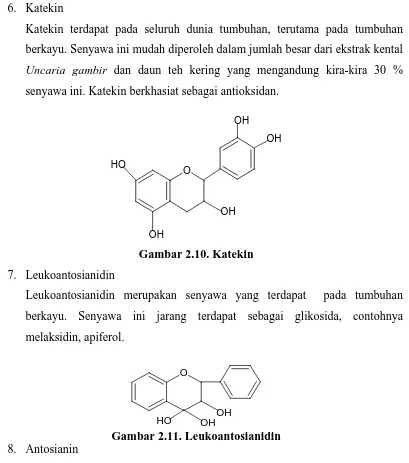
Gambar 2.9. Flavanonol 6. Katekin
Katekin terdapat pada seluruh dunia tumbuhan, terutama pada tumbuhan berkayu. Senyawa ini mudah diperoleh dalam jumlah besar dari ekstrak kental Uncaria gambir dan daun teh kering yang mengandung kira-kira 30 % senyawa ini. Katekin berkhasiat sebagai antioksidan.
O
OH
OH
OH
OH
HO
Gambar 2.10. Katekin 7. Leukoantosianidin
Leukoantosianidin merupakan senyawa yang terdapat pada tumbuhan berkayu. Senyawa ini jarang terdapat sebagai glikosida, contohnya melaksidin, apiferol.
O
HO OHOH
Gambar 2.11. Leukoantosianidin 8. Antosianin
dalam tumbuhan. Pigmen yang berwarna kuat dan larut dalam air ini adalah penyebab hampir semua warna merah jambu, merah marak, ungu, dan biru dalam daun, bunga dan buah pada tumbuhan tinggi. Secara kimia semua antosianin merupakan turunan suatu struktur aromatik tunggal yaitu sianidin, dan semuanya terbentuk dari pigmen sianidin ini dengan penambahan atau pengurangan gugus hidroksil atau dengan metilasi atau glikosilasi.
O
OH
Gambar 2.12. Antosianin 9. Kalkon
Kalkon adalh pigmen fenol kuning yang berwarna coklat kuat dengan sinar UV bila dikromatografi kertas. Aglikon kalkon dapat dibedakandari glikosidanya, karena hanya pigmen dalam bentuk glikosida yang dapat bergerak pada kromatografi kertas dalam pengembang air (Harborne, 1996).
O
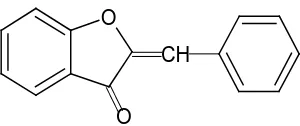
Gambar 2.13. Kalkon 10.Auron
O
O CH
Gambar 2.14.Auron
2.4.4 Sifat Kelarutan Senyawa Flavonoida
Aglikon flavonoida adalah polifenol dan karena itu mempunyai sifat kimia seperti fenol yaitu bersifat agak asam sehingga dapat larut dalam basa. Tetapi bila didiamkan dalam larutan basa dan disamping itu terdapat banyak oksigen maka akan banyak yang terurai. Karena mempunyai sejumlah gugus hidroksil yang tak tersulih atau suatu gula, flavonoid merupakan senyawa polar maka pada umumnya flavonoida larut dalam pelarut polar seperti etanol, metanol, butanol, aseton, dimetilsulfoksida, dimetilformadida, air dan lain-lain. Adanya gula yang terikat pada flavonoida cendrung menyebabkan flavonoida lebih mudah larut dalam air. Dengan demikian campuran pelarut diatas dengan air merupakan pelarut yang lebih baik untuk glikosida. Sebaliknya, aglikon yang kurang polar seperti isoflavon, flavanon, flavon serta flavanol yang termetoksilasi cendrung lebih mudah larut dalam pelarut seperti eter dan kloroform (Markham, 1988).
2.5. Tanin
Tanin terdapat luas pada tumbuhan berpembuluh, dalam Angiospermae terdapat khusus di jaringan kayu. Tanin dapat bereaksi dengan protein membentuk kopolimer mantap yang tidak larut dalam air. Dalam industri, tanin adalah senyawa yang berasal dari tumbuhan, yang mampu mengubah kulit hewan yang mentah menjadi kulit siap pakai karena kemampuannya menyambung silang protein (Harborne, 1996).
Secara kimia terdapat dua jenis utama tanin (Harborne, 1996) yaitu : 2.5.1. Tanin terkondensasi
Tanin terkondensasi terbentuk dengan cara kondensasi katekin tunggal (galokatekin) yang membentuk senyawa dimer dan oligomer yang lebih tinggi. Ikatan karbon-karbon menghubungkan satu satuan flavon dengan satuan berikutnya melalui ikatan 4-8 atau 6-8. Kebanyakan flavolan mempunyai 2-20 satuan flavon. Tanin terkondensasi disebut juga dengan proantosianidin karena bila direaksikan dengan asam panas, beberapa ikatan karbon-karbon penghubung satuan terputus dan dibebaskanlah monomer antosianidin.
O
OH
OH
OH
OH
HO
A C
B
O
Gambar 2.16. Catechal tannin 2.5.2. Tanin Terhidrolisis
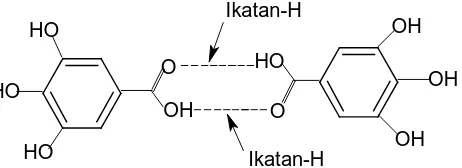
Terdiri dari dua kelas yaitu: a. Dimer asam galat
Inti molekul berupa senyawa dimer asam galat, yaitu asam heksahidroksidifenat yang berikatan dengan glukosa. Tanin terhidrolisis disebut juga elagitanin yang pada hidrolisis menghasilkan asam galat.
OH
Gambar 2.17. Dimer Asam galat
b. Depsida galoilglukosa
Gambar 2.18. Gallotannin 2.6. Bakteri
Nama bakteri berasal dari kata “bakterion” (bahasa Yunani) yang berarti tongkat atau batang. Sekarang namanya dipakai untuk menyebutkan sekelompok mikroorganisme yang bersel satu, pembiakan dengan cara pembelahan diri, serta demikian kecilnya sehingga hanya tampak dengan mikroskop (Dwidjoseputro, 1998).
Bakteri merupakan penghasil bermacam-macam zat organik dan obat-obatan antibiotik. Mikroorganisme memang peranan penting dalam menganalisis sistem enzim dan dalam mengalisis komposisi suatu makanan. Bakteri merupakan organisme yang sangat kecil (berukuran mikroskopis). Bakteri rata-rata berukuran lebar 0,5 – 1 mikron dan panjang hingga 10 mikron (1 mikron - 103 mm). Untuk melihat bakteri dengan jelas, tubuhnya perlu diisi dengan zat warna, pewarna ini disebut pengecatan bakteri (Irianto, 2006).
Ada kalanya suatu bakteri perlu diwarnai dua kali. Setelah zat warna yang pertama (ungu) terserap, maka bakteri dicuci dengan alkohol, kemudian ditumpangi dengan zat warna berlainan, yaitu dengan zat warna merah. Zat warna tambahan terhapus, sehingga yang nampak adalah zat asli (ungu). Dalam hal ini bakteri disebut Gram Positif. Jika zat warna tambahan merah yang bertahan sehingga zat warna asli tidak tampak, dalam hal ini bakteri disebut Gram Negatif (Dwijoseputro,1998).
2.6.1. Bakteri Gram positif
Bakteri Gram positif memiliki dinding sel yang tersusun atas beberapa lapisan peptidoglikan, dan strukturnya tebal dan keras. Bakteri gram positif mempunyai struktur dinding sel yang tebal (15-80 μm) dan berlapis tunggal (mono). Komponen utama penyusun dinding sel adalah peptidoglikan dan asam teikoat (Pelczar,et al. 1986 ). Selain itu, dinding selnya juga tersusun atas asam teikoat (teichonic acid) yang mengandung alkohol (gliserol atau ribitol) dan posfat. Ada 2 macam asam teikoat, yaitu asam lipoteikoat (lipoteichoic acid) yang merentang di lapisan peptidoglikan dan terikat pada membran plasma, dan asam teikoat dinding (wall teichoicacid) yang terikat pada lapisan peptidoglikan (Pratiwi, 2008).
Beberapa contoh bakteri gram positif, yaitu : 1. Bakteri Staphylococcus aureus
Sistematika Staphylococcus aureus (Dwidjoseputro, 1998). Division : Protophyta
Kelas : Schizomycetes Ordo : Eubacteriales Family : Micrococaceae Genus : Staphylococcus
Spesies : Staphylococcus aureus
Staphylococcus aureus merupakan bakteri gram positif, aerob atau anaerob fakultatif berbentuk bola atau kokus berkelompok tidak teratur, diameter 0,8 – 1,0
tumbuh cepat pada suhu 370C tetapi paling baik membentuk pigmen pada suhu 20-250C. koloni pada pembenihan padat berbentuk bulat halus, menonjol dan berkilau membentuk berbagai pigmen. Bakteri ini terdapat pada kulit, selaput lendir, bisul dan luka. Dapat menimbulkan penyakit melalui kemampuannya berkembang biak dan menyebar luas dalam jaringan (Jawetz, 2001).
Gambar 2.19. Staphylococcus aureus 2. Basillus subtilis
Berbentuk batang dan membentuk spora. Sering menimbulkan permasalahan pada industri pengalengan karena sporanya sangat tahan terhadap panas. Basillus antracis menyebabkan penyakit anthrax pada manusia dan hewan, B.subtilis (B.mesentericus) menyebabkan suatu tipe kerusakan yang disebut dengan ropiness pada roti, dan B.cereus dapat menyebabkan keracunan pangan (Gaman, 1992).
Gambar 2.20. Basillus subtilis 3.Pseudomonas aeruginosa
dan biasanya membentuk lendir. Kebanyakan Pseudomonas, kecuali P. Syringe, bersifat oksidase positif, dan akan membentuk warna biru jika ditambah senyawa dimetil-p-fenilenediamin dihidroklorida. Tidak tahan terhadap panas dan keadaan kering. Oleh karena itu, mudah dibunuh dengan proses pemanasan dan pengeringan (Fardiaz, 1992).
Gambar 2.21. Pseudomonas aeruginosa 2.6.2 Bakteri Gram negatif
Bakteri Gram negatif memiliki dinding sel yang tersusun atas satu lapisan peptidoglikan dan membran luar. Terdapat daerah periplasma, yaitu daerah yang terdapat di antara membran plasma dan membran luar. Periplasma berisi enzim degradasi konsentrasi tinggi serta protein-protein transpor. Dinding sel bakteri Gram negatif tidak mengandung teichoic acid. Membran luar tersusun atas lipopolisakarida, lipoprotein, dan posfolipid (Pratiwi, 2008).
Bakteri gram negatif mempunyai struktur dinding sel yang tipis ( 10- 15 μm) dan berlapis tiga (multi). Dinding sel meliputi peptidoglikan dan selaput luar mengandung tiga polimer yaitu lipoprotein, fosfolipida dan lipopolisakarida (LPS) (Pelczar, et al. 1986 ).
Beberapa contoh bakteri gram negatif, yaitu : 1. Escherichia coli
jumlah yang banyak menunjukkan bahwa pangan atau air telah mengalami pencemaran (Gaman, 1992).
Gambar 2.22. Escherichia coli
Berikut sistematika bakteri Escherichia coli (Dwidjoseputro, 1998): Kingdom : Prokaryota
Divisi : Bacteriophyta Kelas : Bacteria Bangsa : Eubacteriales Suku : Bacteriaceae Marga : Escherichia Jenis : Escherichia coli
Escherichia coli merupakan bakteri gram negatif, berbentuk batang dengan panjang sekitar 2 mikrometer dan diamater 0,5 mikrometer, bersifat anaerob fakultatif, biasanya dapat bergerak dan tidak membentuk spora. Bakteri ini umumnya hidup pada rentang 20-400C, optimum pada 370C.
2. Bakteri Shigella dysenteriae
Shigella dysenteriae merupakan bakteri gram negatif, fakultatif anaerobik, berbentuk batang yang tidak bergerak, tidak membentuk spora. Bakteri ini berukuran sekitar 0,5-0,7 mikrometer dan tumbuh baik pada suhu 370C. Bakteri ini dapat menyebabkan disentri basiler. Disentri adalah salah satu dari berbagai gangguan pencernaan yang ditandai dengan peradangan usus terutama kolon, disertai nyeri perut dan buang air besar yang sering mengandung darah dan lendir (Pelczar, 1986).
Gambar 2.23. Shigella dysenteriae
Berikut sistematika bakteri Shigella dysenteriae (Dwidjoseputro, 1998): Kingdom : Prokaryota
Divisio : Bacteriophyta Kelas : Bacteria Bangsa : Eubacteriales Suku : Bacteriaceae Marga : Shigella
Jenis : Shigella dysenteriae 3. Bakteri Salmonella typhi
Salmonella typhi merupakan bakteri gram negatif, bersifat motil (bergerak), bakteri
dalam nodus limfa danaliran darah. Salmonella typhi dapat menyebabkan penyakit demam tifoid(Gibson, 1996).
Gambar 2.24. Salmonella typhi
Klasifikasi dari bakteri Salmonella typhi menurut (Breed, et al. 1957) adalah: Divisi : Protophyta
Kelas : Schizomycetes Bangsa : Eubacteriales Suku : Enterobacteriaceae Marga : Salmonella
Species: Salmonella typhi
2.6.3. Klasifikasi Bakteri
Berdasarkan bentuk morfologinya, maka bakteri dapat dibagi atas tiga golongan (Dwidjoseputro, 1978), yaitu:
a. Bentuk basil
Basil adalah bakteri yang mempunyai bentuk menyerupai batang atau silinder, membelah dalam satu bidang, berpasangan ataupun berbentuk rantai pendek atau panjang. Bentuk basil dapat dibedakan atas:
Contoh: Escherichia coli, Bacillus anthracis, Salmonella typhimurium, Shigella dysenteriae.
b. Bentuk kokus
Kokus adalah bakteri yang bentuknya seperti bola-bola kecil, ada yang hidup sendiri dan ada yang berpasang-pasangan. Bentuk kokus ini dapat dibedakan atas:
- Monokokus yaitu kokus yang terlepas satu sama lain. - Diplokokus yaitu kokus yang bergandeng dua. - Tetrakokus yaitu kokus yang mengelompok empat.
- Stafilokokus yaitu kokus yang mengelompok dan merupakan suatu untaian. - Streptokokus yaitu kokus yang bergandeng-gandengan panjang berupa rantai. - Sarsina yaitu kokus yang mengelompok seperti kubus.
Contoh: Monococcus gonorhoe, Diplococcus pneumoniae, Streptococcus lactis, Staphylococcus aureus, Sarcina luten.
c. Bentuk spiral Dapat dibedakan atas:
- Spiral yaitu bentuk yang menyerupai spiral atau lilitan. - Vibrio yaitu bentuk batang yang melengkung berupa koma.
- Spirochaeta yaitu menyerupai bentuk spiral, bedanya dengan spiral dalam kemampuannya melenturkan dan melengkukkan tubuhnya sambil bergerak.
Contoh: Spirillum, Vibrio cholerae, Spirochaeta palida (Volk, 1989).
2.6.4. Perkembangbiakan Bakteri
Pertumbuhan dan perkembangbiakan bakteri dipengaruhi oleh: 1. Suhu
Setiap spesies bakteri tumbuh pada suatu kisaran suhu tertentu. Atas dasar ini maka bakteri diklasifikasikan menjadi (Dwijoseputro,1982):
a. Bakteri psikrofil (oligotermik) yaitu bakteri yang dapat hidup antara suhu 0-30
o
b. Bakteri mesofil (mesotermik), yaitu bakteri yang tumbuh pada suhu antara 5-60 oC, sedangkan suhu optimumnya antara 25-40 0C.
c. Bakteri termofil (politermik), yaitu bakteri yang tumbuh dengan baik pada suhu 50-60 oC, meskipun demikian bakteri ini juga dapat berbiak pada temperatur lebih
rendah atau lebih tinggi dari pada itu, yaitu dengan batas-batas 40-80 oC. Suhu terendah dimana bakteri dapat tumbuh disebut minimum growth temperature. Sedangkan suhu tertinggi dimana bakteri dapat tumbuh dengan baik disebut maximum growth temperature. Suhu dimana bakteri dapat tumbuh dengan sempurna diantara kedua suhu tersebut disebut suhu optimum (Tim Mikrobiologi FK Unibraw, 2003).
2. pH
Pertumbuhan bakteri pada pH optimal antara 6,5 dan 7,5. Namun, beberapa spesies dapat tumbuh dalam keadaan sangat asam atau sangat alkali. Bagi kebanyakan spesies, nilai pH minimum dan maksimum ialah antara 4 dan 9. Bila bakteri dibiakan dalam suatu medium, yang mula-mula disesuaikan adalah pHnya maka mungkin sekali pH ini berubah karena adanya senyawa asam atau basa yang dihasilkan selama pertumbuhan (Pelczar and Chan,1988).
3. Oksigen
Berdasarkan akan kebutuhan terhadap oksigen , bakteri dapat digolongkan menjadi (Tim Mikrobiologi FK Unibraw, 2003):
a. Bakteri aerob mutlak, yaitu bakteri yang untuk pertumbuhannya memerlukan adanya oksigen.
b. Bakteri anaerob fakultatif, yaitu bakteri yang dapat tumbuh, baik ada oksigen maupun tanpa adanya oksigen.
c. Bakteri anaerob aerotoleran, yaitu bakteri yang tidak mati dengan adanya oksigen.
4. Nutrisi
Sumber zat makanan (nutrisi) bagi bakteri diperoleh dari senyawa karbon, nitrogen, sulfur, fosfor, unsur logam (natrium, kalsium, magnesium, mangan, besi, tembaga dan kobalt), vitamin dan air untuk fungsi-fungsi metabolik dan pertumbuhannya (Dwijoseputro,1982).
5. Pengaruh Kebasahan dan Kekeringan
Bakteri sebenarnya adalah makhluk yang suka akan keadaan basah, bahkan dapat hidup didalam air, hanya didalam air yang tertutup mereka tidak dapat hidup subur, hal ini disebabkan karena kurangnya udara. Tanah yang basah baik untuk kehidupan bakteri. Banyak bakteri yang mati, jika terkena udara kering (Dwijoseputro,1982).
6. Tekanan Osmosa.
Medium yang paling cocok untuk kehidupan bakteri ialah medium yang isotonik terhadap isi sel bakteri (Dwijoseputro,1982).
2.6.5. Media Pertumbuhan Bakteri
Pembiakan mikroorganisme membutuhkan media yang berisi zat hara serta lingkungan pertumbuhan yang sesuai bagi mikroorganisme. Media dapat dibagi berdasarkan (Lay, 1994):
1. Konsistensinya, media dapat dibagi menjadi tiga macam, yaitu: a. Media padat
b. Media cair
c. Media semi padat
2. Sumber bahan baku yang digunakan, media dapat dibagi menjadi dua macam: a. Media sintetik, bahan baku yang digunakan merupakan bahan kimia atau
bahan yang bukan berasal dari alam. Pada media sintetik, kandungan dan isi bahan yang ditambahkan diketahui secara terperinci.
b. Media nonsintetik, menggunakan bahan yang terdapat dialam, biasanya tidak diketahui kandungan kimianya secara terperinci. Contoh: ekstrak daging, pepton, ekstrak ragi dan kaldu daging.
3. Berdasarkan fungsinya, media dapat dibagi menjadi:
a. Media selektif, yaitu media biakan yang mengandung paling sedikit satu bahan yang dapat menghambat perkembangbiakan mikroorganisme yang tidak diinginkan dan membolehkan perkembangbiakan mikroorganisme tertentu yang ingin diisolasi.
b. Media differensial, yaitu media untuk membedakan kelompok mikroorganisme tertentu yang tumbuh pada media biakan. Bila berbagai kelompok mikroorganisme tumbuh pada media differensial, maka dapat dibedakan kelompok mikroorganisme berdasarkan perubahan pada media biakan atau penampilan koloninya.
c. Media diperkaya, yaitu dengan menambahkan bahan-bahan khusus pada media untuk menumbuhkan mikroba yang khusus.
2.6.6. Metode Isolasi Biakan Bakteri a. Cara gores
Ose yang telah steril dicelupkan ke dalam suspensi mikroorganisme yang diencerkan, lalu dibuat serangkaian goresan sejajar yang tidak saling menutupi di atas permukaan agar yang telah padat.
b. Cara sebar
c. Cara tuang
Pengenceran inokulum yang berturut-turut diletakkan pada cawan petri steril dan dicampurkan dengan medium agar cair, lalu dibiarkan memadat. Koloni yang berkembang akan tertanam di dalam media tersebut (Stanier, 1982).
2.6.7. Fase Pertumbuhan Bakteri
Bila bakteri ditanam dalam perbenihan yang sesuai dan pada waktu-waktu tertentu diobservasi (dihitung jumlah bakteri yang hidup), pertumbuhan dan perkembangbiakan bakteri tersebut dapat digambarkan dengan sebuah grafik. Pertumbuhan bakteri tersebut dapat dibagi menjadi 4 fase yaitu :
1. Fase Penyesuaian Diri (Lag phase)
Fase penyesuaian merupakan periode waktu dari bakteri yang ditanam pada media perbenihan yang sesuai atau waktu yang diperlukan untuk beradaptasi terhadap lingkungan yang baru. Rentang waktu fase penyesuiaan tersebut tergantung dari fase pertumbuhan bakteri saat dipindahkan untuk diinokulasikan pada media perbenihan yang baru dan tergantung pula pada adanya bahan toksis atau bahan yang dapat menghambat pertumbuhan dan perkembangbiakan bakteri (Tim Mikrobiologi FK Unibraw, 2003). Waktu penyesuaiaan ini umumnya berlangsung selama 2 jam. Pada fase ini belum terjadi pertumbuhan dan perkembangbiakan, tetapi aktivitas metabolismenya sangat tinggi (Staf Pengajar Kedokteran UI, 1994).
2. Fase Pembelahan (Logarhytmik Phase / Exponensial Phase)
Pada fase ini bakteri berkembang biak dengan cepat, jumlah bakteri meningkat secara eksponensial. Untuk kebanyakan bakteri, fase ini berlangsung 18 – 24 jam. Pada fase ini pertumbuhan sangat ideal, pembelahan terjadi secara teratur, semua bahan dalam sel berada dalam seimbang (balanced growth) (Pratiwi, 2008).
3. Fase Stasioner (Stationary phase)
terjadi jumlah bakteri yang hidup sama dengan bakteri yang mati (Staf Pengajar Fakultas Kedokteran UI, 1994).
4. Fase Kematian (Death phase)
Pada fase ini terjadi akumulasi bahan toksik, zat hara yang diperlukan oleh bakteri berkurang sehingga bakteri akan memasuki fase kematian. Fase ini merupakan kebalikan dari fase logaritmik. Jumlah sel menurun terus sampai didapatkan jumlah sel yang konstan untuk beberapa waktu (Lay, 1992).
Keterangan : a : Lag phase b : Log phase c : Stationary phase d : Death phase
Gambar 2.25. Grafik Pertumbuhan Bakteri
2.6.8. Pengukuran Aktivitas Antibakteri
Penentuan kepekaan bakteria patogen terhadap antimikroba dapat dilakukan dengan salah satu dari tiga metode pokok yaitu dilusi, difusi dan turbidimetri. Penting sekali menggunakan metode standar untuk mengendalikan semua faktor yang mempengaruhi aktivitas antimikroba.
a. Metode Dilusi
b. Metode Difusi
Metode yang paling sering digunakan adalah metode difusi agar. Cakram kertas saring berisi sejumlah tertentu obat ditempatkan pada permukaan medium padat yang sebelumnya telah diinokulasi bakteri uji pada permukaannya. Setelah inkubasi, diameter zona hambatan sekitar cakram dipergunakan mengukur kekuatan hambatan obat terhadap organisme uji. Metode ini dipengaruhi oleh beberapa faktor fisik dan kimia, selain faktor antara obat dan organisme (misalnya sifat medium dan kemampuan difusi, ukuran molekular dan stabilitas obat). Meskipun demikian, standarisasi faktor-faktor tersebut memungkinkan melakukan uji kepekaan dengan baik (Jawetz, 2001).
c. Cara turbidimetri
Pada cara ini digunakan media cair. Pertama dilakukan penuangan media kedalam tabung reaksi, lalu ditambahkan suspensi bakteri, kemudian dilakukan pemipetan larutan uji, dilakukan inkubasi. Selanjutnya dilakukan pengukuran kekeruhan, kekeruhan yang disebabkan oleh pertumbuhan bakteri diukur dengan menggunakan instrumen yang cocok, misalnya nephelometer setelah itu dilakukan penghitungan potensi antimikroba (Depkes RI, 1995).
2.7. Skrining Fitokimia
Banyak reagen yang dapat digunakan untuk mengaetahui keberadaan dari flavonoid, meskipun beberapa juga akan bereaksi positif dengan senyawa polifenol. Reagen yang biasa digunakan adalah :
2. H2SO4(p), flavon dan flavononol akan memberikan perubahan larutan kuning
pekat. Kalkon dan auron menghasilkan larutan berwarna merah atau merahkebiru-biruan. Flavanon memberikan warna orange sampai merah.
3. NaOH 10%, menghasilkan larutan biru violet
4. FeCl3 5% telah digunakan secara luas untuk mengidentifikasi senyawa fenol,
tetapi tidak dapat digunakan untuk membedakan macam-macam golongan flavonoid. Pereaksi ini memberi warna kehijauan, warna biru dan warna hitam-biru (Robinson, 1995).
2.8. Teknik Pemisahan
Tujuan dari teknik pemisahan adalah untuk memisahkan komponen yang diinginkan dalam keadaan murni, agar tidak bercampur dengan komponen-komponen lainnya (Silverstein, et all. 1981)
2.8.1 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak larut dengan menggunakan pelarut cair. Senyawa aktif yang terdapat dalam berbagai simplisia dapat digolongkan ke dalam golongan minyak atsiri, alkaloida, flavonoida dan lain-lain. Dengan diketahuinya senyawa aktif yang dikandung simplisia akan mempermudah pemilihan pelarut dengan cara yang tepat (Depkes, 2000).
Pembagian metode ekstraksi menurut Depkes (2000) adalah: A. Cara Dingin
1. Maserasi
2. Perkolasi
Perkolasi adalah ekstraksi dengan menggunakan pelarut yang selalu baru sampai penyaringan sempurna, umumnya dilakukan pada temperatur ruangan. Proses ini terdiri dari tahapan pengembangan bahan, tahap maserasi antara, dan tahap perkolasi sebenarnya (penetesan/ penampungan ekstrak) yang terus menerus sampai ekstrak yang diinginkan habis tersari. Tahap pengembangan bahan dan maserasi antara dilakukan dengan maserasi serbuk menggunakan cairan penyari sekurang-kurangnya 3 jam, hal ini penting terutama untuk serbuk yang keras dan bahan yang mudah mengembang.
B. Cara Panas 1. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut yang relatif konstan dengan adanya pendingin balik.
2. Sokletasi
Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru, umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinue dan jumlah pelarut relatif konstan dengan adanya pendingin balik.
3. Digesti
Digesti adalah maserasi dengan pengadukan kontinue pada temperatur yang lebih tinggi dari temperatur ruangan yaitu pada temperatur 40-50oC.
2.8.2 Ekstrak